锗知识
锗离子半径

锗离子半径1. 引言离子半径是描述离子大小的重要参数之一。
锗(Ge)是一种化学元素,其离子的半径也是一个研究的重点。
本文将详细介绍锗离子半径的相关知识,包括定义、测量方法、影响因素等内容。
2. 定义离子半径是指离子周围电子云分布的范围,通常以某个特定原子核与其最外层电子轨道之间的距离来表示。
由于锗可以形成不同价态的阳离子和阴离子,因此它具有多个不同价态的离子半径。
3. 锗离子半径测量方法锗离子半径可以通过多种实验方法进行测量,下面介绍两种常用方法。
3.1 X射线衍射法X射线衍射法是一种常用于测量晶体结构的方法,也可以用于测量锗离子半径。
该方法利用X射线与晶体相互作用产生衍射现象,通过观察衍射图样来确定晶体结构和晶胞参数。
在锗化合物中引入适量的杂质,可以通过对衍射图样的分析计算出锗离子的半径。
3.2 光学法光学法是一种通过测量物体对光的散射或吸收来确定其性质的方法。
在锗离子半径测量中,可以利用光学法来测量锗化合物的晶格常数和折射率等参数,从而推导出锗离子的半径。
4. 锗离子半径影响因素锗离子半径受多种因素影响,下面介绍几个主要因素。
4.1 氧化态锗可以形成不同氧化态的离子,包括Ge2+、Ge3+和Ge4+等。
不同氧化态的离子具有不同的电荷数和电子排布方式,因此其离子半径也会有所差异。
4.2 配位数配位数是指周围配位原子与中心原子之间形成化学键的个数。
在不同配位数下,锗离子与周围原子之间的距离不同,从而导致其离子半径发生变化。
4.3 结构类型锗可以形成多种晶体结构类型,如立方晶系、正交晶系等。
不同结构类型的晶体中,锗离子的排列方式和相互作用方式不同,因此其离子半径也会有所差异。
5. 锗离子半径的应用锗离子半径在材料科学、化学工程等领域具有重要的应用价值。
5.1 材料科学锗化合物是一类重要的半导体材料,其性能与锗离子的半径密切相关。
通过控制锗离子的半径,可以调节材料的电学、热学和光学性能,从而实现对材料性能的优化。
锗知识

植物中都含有限量锗,如人参、党参、白芷、枸杞、灵芝草、芦荟和茶叶等。
具有预防和改善身体的不适感及按摩温泉效果等功效保健功效锗的药用保健功效:强化自然治愈力、改善全身体质、防止老化、预防癌症、消除肿瘤、肝病、气喘、血压调整、排除体内的毒素、自律神经失调症等等慢性病症;能吃的氧缺氧成为万病得根源,而锗被称为能吃的氧。
经研究证明锗对缺氧引起的以下病症又特殊的疗效:由于精神压力的加重,引起血液粘稠度升高,现代人由于运动量不足引起的新陈代谢不振;各种心里因素和身心衰弱引起的睡眠不足;呼吸污染的空气而引起的肺功能低下。
恢复被伤害的细胞的作用大量的吸入过量化学物质(药品或化学调料)等。
锗是起抑制放射线引起的伤害,从而减轻伤害,恢复被伤害的细胞的作用。
通过血球细胞增加供氧,使血液干净。
肝癌。
肺癌、胃癌等血管丰富部位的癌症和呼吸道疾病、哮喘和皮肤病等疾病的治疗有着特殊的疗效。
保健品、食品、药品及化妆品添加剂。
有机锗是人体需要的一种元素,它具有多种功能,它具有脱氢富集氧功能,能够使体能保持充足的氧,从而维护人体的健康。
在人体中,食物的分解是借助氧气进行的,在食物分解过程中,需要消耗大量的氧,同时生成水和二氧化碳。
如果没有充足的氧,就有可能使机体引起各种疾病。
而有机锗能把人体内的氢离子带出体外,减少了机体对氧的需求量,从而有利于健康。
锗进入人体后,可均匀地分布在各器官组织中,24小时完全排出体外,属于不会在身体中蓄积的微量元素,其毒性极低,无副作用。
人体各器官细胞在生命过程中产生废物,一部分经过分泌系统排出体外,还有一部分以自由基的形式存在于各器官中,形成病变,导致器官功能下降影响健康,有机锗能与这部分自由基结合后排出体外,增强器官生命。
10、临床研究发现,目前被人们广泛认可锗对多种疾病有着良好的治疗作用。
主要体现在:抗肿瘤、治疗老年痴呆、增强免疫功能、延缓衰老、预防及治疗动脉硬化、降低血液粘稠度、抗类风湿关节炎、调节内分泌、止痛消炎、降血压、治疗骨质疏松、调节内分泌、治疗慢性肝炎等方面。
锗——天使还是恶魔?

锗——天使还是恶魔?近年来,由于一些健康方面的研究,周期表中一种原本普普通通的化学元素“锗”被推上了风口浪尖。
推崇它的人认为锗的化合物是治疗百病的神药,将其视为人类健康的“灵丹妙药”,但是与此同时,许多滥用锗化合物而导致肾衰的人间惨剧也在发生。
所以锗到底对人体有什么影响呢?我们又该如何面对名目众多的锗保健品呢?我们需要先来了解锗元素的一些基本知识。
锗是第32号元素,在周期表中处于第4周期,第14族(原先的第IV主族)。
锗是一种典型的半导体,在早期历史上被广泛用作半导体材料制作电子元件。
锗的化学性质与硅和锡相近。
锗的第一种有机化合物——四乙基锗在1887年由德国化学家文克勒(Clemens Winkler)使用四氯化锗与二乙基锌合成。
合成四乙基锗的化学方程式如下:GeCl4+2(C2H5)Zn=2ZnCl2+Ge(C2H5)4四乙基锗是一种易燃的无色液体,在165℃沸腾。
四乙基锗是一种用于锗的气相沉积重要的化学化合物。
最早被用于保健品的锗化合物是1967年(一说1971年)由日本学者浅井一彦合成的Ge-132。
它被视为是一种有益健康的化合物,早期(二十世纪八九十年代)的大鼠实验显示出Ge-132——羧乙基锗倍半氧化物具有一定的抗癌活性,并且没有发现Ge-132有明显的急性毒性,便被用作了抗癌药物,进一步是保健品。
那么锗是否可以做保健品呢?首先,迄今为止,没有任何证据能够证明锗是人体必需的微量元素。
现代科学证明生命必需元素只有28种,它们分别是氢、硼、碳、氮、氧、氟、钠、镁、硅、磷、硫、氯、钾、钙、钒、铬、锰、铁、钴、镍、铜、锌、砷、硒、溴、钼、锡和碘。
并不是所有生物都会利用这全部28种元素,有的生物不会利用其中某几种,例如植物并不会利用钒,而有的动物不会利用硼等。
而与生命必需元素性质相似的元素可能反而是有毒的。
例如镉和锌在周期表上位置相近,但是镉有高毒性,就是因为镉和锌的相似性——镉取代了体内的锌,导致需要锌的生化反应被阻碍。
金属基本知识铜铝铅钨钼镁碲锗锑铟锡银钯铑铌锆锶铷镓

金属基本知识铜铝铅钨钼镁碲锗锑铟锡银钯铑铌锆锶铷镓镍钴锰钒铬钛硅铍锂铯锇铱硒砷钌镉汞钽锌镧铈镨钕钷钐铕钆铽镝钬铒铥镱镥钇钪铜基本知识介绍1、自然属性铜是人类最早发现的古老金属之一,早在三千多年前人类就开始使用铜。
金属铜,元素符号Cu,原子量63.54,比重8.92,熔点1083o C。
纯铜呈浅玫瑰色或淡红色,表面形成氧化铜膜后,外观呈紫铜色。
铜具有许多可贵的物理化学特性,例如其热导率和电导率都很高,化学稳定性强,抗张强度大,易熔接,具抗蚀性、可塑性、延展性。
纯铜可拉成很细的铜丝,制成很薄的铜箔。
能与锌、锡、铅、锰、钴、镍、铝、铁等金属形成合金。
铜冶炼技术的发展经历了漫长的过程,但至今铜的冶炼仍以火法冶炼为主,其产量约占世界铜总产量的85%。
1)火法冶炼一般是先将含铜百分之几或千分之几的原矿石,通过选矿提高到20-30%,作为铜精矿,在密闭鼓风炉、反射炉、电炉或闪速炉进行造锍熔炼,产出的熔锍(冰铜)接着送入转炉进行吹炼成粗铜,再在另一种反射炉内经过氧化精炼脱杂,或铸成阳极板进行电解,获得品位高达99.9%的电解铜。
该流程简短、适应性强,铜的回收率可达95%,但因矿石中的硫在造锍和吹炼两阶段作为二氧化硫废气排出,不易回收,易造成污染。
近年来出现如白银法、诺兰达法等熔池熔炼以及日本的三菱法等、火法冶炼逐渐向连续化、自动化发展。
2)现代湿法冶炼有硫酸化焙烧-浸出-电积,浸出-萃取-电积,细菌浸出等法,适于低品位复杂矿、氧化铜矿、含铜废矿石的堆浸、槽浸选用或就地浸出。
2、铜及铜产品分类①、按自然界中存在形态分类自然铜------铜含量在99%以上,但储量极少;氧化铜矿-----为数也不多硫化铜矿-----含铜量极低,一般在2--3%左右,世界上80%以上的铜是从硫化铜矿精炼出来的。
②、按生产过程分类铜精矿----冶炼之前选出的含铜量较高的矿石。
粗铜------铜精矿冶炼后的产品,含铜量在95-98%。
纯铜------火炼或电解之后含量达99%以上的铜。
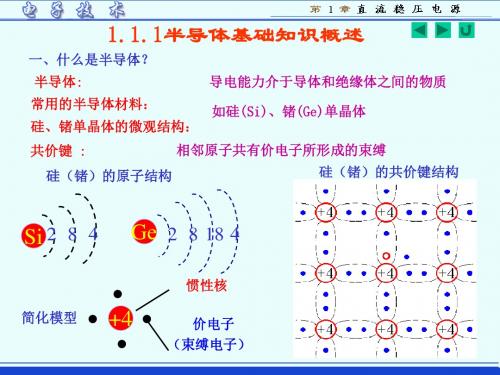
半导体基础知识
符号
1
+ W78XX +
2
_
3
_
W79XX
1 2
3
1.6.3 W78XX、W79XX系列 集成稳压器的使用方法
一、 组成输出固定电压的稳压电路
1. W78XX系列
+
1
W78XX
Co
2
+
Uo = 12V
改善负载 的暂态响 应,消除 高频噪声
注意 3 Ui 输入 Ci 电压 极性 抵消输入 长接线的 电感效, 防止自激 Ci : 0.1~1F
IR + +
R UR
IL
IZ RL
2、引起电压不 稳定的原因
UI
电源电压的波动 负载电流的变化
DZ
稳压二极管
+ UL
将微小的电压变化转 换成较大的电流变化
三端稳压器封装及电路符号
封装
塑料封装
金属封装
79LXX
W7805 1 3 2
W7905 1 3 2
78LXX
1
2
3
UI GND UO GND UI UO
空穴
负离子
电子
正离子
一、载流子的浓度差引 N型材料 起多子的扩散扩散使 交界面处形成空间电 荷区(也称耗尽层)
内电场方向
二、空间电荷区特点
基本无无载流子,仅 有不能移动的离子
三、扩散和漂移达到动态平衡
扩散电流= 漂移电流 总电流=0 利于少子的漂移
形成内电场
阻止多子扩散进行
1.2.2 PN结的单向导电性
外界条件决定半导体内部 载流子数量
三、本征半导体: 纯净的半导体
化学元素知识:锗-半导体器件和红外线技术的重要元素

化学元素知识:锗-半导体器件和红外线技术的重要元素锗是一种重要的化学元素,其在半导体器件和红外线技术中发挥着重要作用。
本文将从锗的基本性质、历史发展背景、半导体器件和红外线技术中的应用等方面,详细介绍锗的重要性和应用前景。
一、锗的基本性质锗是一个类似于硅的化学元素,其原子序数为32,位于碳族元素中间。
锗的化学代码为Ge,密度为5.323 g/cm³,熔点为938.25℃,沸点为2,830℃。
锗是一种灰色的金属,具有特殊的导电能力。
它的电导率比金属小,但比半导体大,因此,锗常用于制作半导体器件。
锗是一种丰富的元素,广泛存在于地壳中。
在自然界中,锗主要存在于锗铜矿、锗铅矿等硫化物中。
锗的化学性质与硅非常相似,也是一种不活泼的元素,不容易与其他元素发生化学反应。
二、历史发展背景锗的发现与研究一直伴随着人类的科学发展历程。
早在19世纪70年代,德国化学家Weilandt曾经从某种银矿中提取得锗。
后来,K. Winkler在1886年从一个硅铝矿物中分离出了纯的锗。
由于它的特殊电学性质,锗很快就被用于半导体器件中。
20世纪50年代,随着晶体管和集成电路的发明,半导体技术得到了快速发展。
而锗正式成为半导体器件的重要组成部分,从而促进了半导体行业的迅速崛起。
三、锗在半导体器件中的应用半导体器件是指在一定温度下,导电性介于导体和绝缘体之间的材料。
因其具有电子、光学、热学等多种性质,在现代电子技术、通信技术、计算机科学等领域得到了广泛的应用。
早期的半导体器件使用的是锗材料,此后,由于硅的晶体结构更稳定,更容易控制制备过程,硅也逐渐成为了半导体器件的主要材料。
但锗在一些特殊应用场合中还是无可替代的。
锗的光电性能优越,可以在高频率下运行,因此,锗通常用于制造微波移相器、高频变阻器和放大器等设备。
锗管是最早的半导体器件之一。
由于制造进度远远落后于晶体管,现在锗管已经较少使用了。
四、锗在红外线技术中的应用除了半导体器件,锗在红外线技术中也有着非常重要的应用。
锗的抗氧化作用

锗的抗氧化作用锗作为一种珍贵的稀有元素,自然界几乎难以找到独立的矿床,锗作为一种高新技术材料,在光纤通信,国防科技、航空航天技术、医疗保健、地质勘探、化工、催化和半导体材料等领域的应用日趋广泛,特别是在知识经济爆炸的今天,高新科学技术的研究日益深入而广泛,锗材料的应用领域也日趋拓展,用量大增。
锗”是人体所需要的一种微量元素,然而科学家在人体内却找不到“锗”的踪影。
原来,“锗”是人体所不能合成的物质,它是靠外源补充的,锗进入人体3小时后有90%会被排出体外,24小时后便会完全排出体外。
锗,就是德国化学家文克列尔辨认出的。
就是浅色得金属,半导体物质,其原子具备32个电子,电子在人体里受到电子工学促进作用而收缩,而且通过净化促进作用给细胞供氧。
经过研究证明锗晶体里的原子排列与金刚石一样,硬而且脆,锗在自然界分布很散、很广。
铜矿、铁矿、硫化矿以至岩石,泥土和泉水中都含有微量得的锗。
在地壳中的含量为一百万分之七,锗石含有大量的有机锗及名贵的玉石粉、珍珠粉、麦矾石、中药材料、镁、铁、钙、碳、钾、钠、叶绿素等45种对人体有益的矿物质。
世界上知名的锗元素研究专家日本的asashi博士刊登了为《锗和我的人生》著作领衔的许多论文。
他一生都致力于对锗的研究与对疑难病症的临床研究及化疗,终于,于1975年在世界上首次顺利地研制出锗的有机化合物,受全世界的广为高度关注并因此赢得了诺贝尔奖。
asashi博士表示:锗具备抗癌促进作用和强健促进作用;锗可以有效率转化成人体免疫系统;锗能够为人进一步增强身心健康水平,防疫疾病提供更多可信确保。
科学家指出,在人体机能如物质代谢、能量转换、抗菌能力、心血管、神经、生殖等功能中,都有锗的参与。
锗在传统的抗衰老中药如人参、灵芝、枸杞中含量很高,且认为人参的抗衰老和药理作用,与锗含量呈相关关系。
20世纪70年代以后,随着研究结果的不断明朗化,有机锗崭露头角,成为“震动世界医学界的新星”。
从此人们不再把锗看成是一种单纯的半导体材料。
半导体知识点总结高中

半导体知识点总结高中一、半导体的概念半导体是介于导体和绝缘体之间的一类物质。
在半导体中,电子的导电能力比绝缘体好,但并不及导体好。
半导体的导电机制是通过外加电场或光照来改变材料的导电性质。
二、半导体的基本性质1. 禁带宽度:半导体的能带结构是由价带和导带组成,两者之间的能带间隙称为禁带宽度。
禁带宽度决定了半导体的电学特性,一般被用来区分半导体的种类,如硅、锗等。
2. 导电机制:半导体的导电机制主要有两种,一是载流子的浓度可以通过外加电场或光照来改变,此时的导电机制称为电场效应或光照效应。
二是在高温下,少数载流子的浓度大大增加,使得半导体发生了电导,此时的导电机制称为热激发。
3. 施主和受主:半导体材料中的掺杂原子可以分为施主和受主,施主是指掺入材料中导致材料带负电性的原子,而受主是指导致带正电性的原子。
4. 电子与空穴:当半导体中的原子受到激发时,可以形成自由电子和自由空穴,这两者是载流子的基本单位。
三、半导体器件1. 二极管:二极管是一种半导体器件,它由P型区和N型区组成,具有单向导电性。
当加在二极管两端的电压大于开启电压时,二极管就开始导电了。
2. 晶体三极管:晶体三极管是一种电子器件,是由两个P型半导体和一个N型半导体层堆积而成的。
晶体三极管有放大信号、开关控制信号等功能。
四、半导体材料1. 硅(Si):硅是目前最常用的半导体材料,具有稳定性好、制备工艺成熟、价格便宜等特点。
硅半导体的电子迁移率不高,电导率较低,但是它便宜易得,并且有很好的化学稳定性。
2. 锗(Ge):在早期半导体技术中,锗是最早用作半导体材料的。
锗具有良好的电子迁移率,是一种重要的电子材料。
五、半导体的应用1. 微电子器件:微电子器件是半导体的最主要应用之一。
我们所见到的电子产品、电脑、手机等都离不开半导体器件。
2. 光电器件:半导体材料具有优异的光电性能,可以制备出各种光电器件,如光电二极管、光电晶体管等。
3. 太阳能电池:半导体材料可以转化光能为电能,利用太阳能电池板中的半导体材料可以将阳光直接转换为电能。
锗的含氧酸

锗的含氧酸全文共四篇示例,供读者参考第一篇示例:锗是一种重要的非金属元素,它在自然界中以氧化锗的形式存在。
氧化锗是锗的含氧酸,是一种重要的化合物,具有许多重要的应用价值。
在本文中,我们将重点介绍锗的含氧酸的性质、制备方法和应用领域。
锗的含氧酸具有许多独特的性质。
氧化锗具有很强的还原性,它可以与许多金属元素反应生成相应的金属氧化物。
氧化锗具有较高的热稳定性,可以在高温下稳定存在。
氧化锗还具有优异的导电性和光学性能,适用于制备电子器件和光学器件。
氧化锗的制备方法多种多样。
常见的制备方法包括化学气相沉积、物理气相沉积、溶胶-凝胶法和水热合成法。
化学气相沉积是一种较为常用的制备方法,它通过在高温下将锗源气体和氧源气体反应生成氧化锗薄膜。
溶胶-凝胶法则是一种较为简单易行的制备方法,它通过将锗源和氧源溶液混合后在常温下凝胶化形成氧化锗凝胶,经过热处理后即可得到氧化锗薄膜。
氧化锗具有广泛的应用领域。
氧化锗可以作为半导体材料用于制备光电器件,例如光伏电池、光电探测器和光导纤维等。
氧化锗还可以用作绝缘材料用于制备电容器、电阻器和绝缘膜等。
氧化锗还可以用作催化剂用于有机合成反应和废水处理等领域。
锗的含氧酸是一种重要的化合物,具有很多独特的性质和广泛的应用领域。
随着科学技术的不断发展,氧化锗的研究和应用将会更加广泛和深入,为人类社会的发展作出更大的贡献。
希望本文能够对锗的含氧酸的研究和应用提供一些参考和借鉴,促进相关领域的进一步发展。
【锗的含氧酸】。
第二篇示例:锗是一种广泛应用于电子、半导体和光电子领域的金属元素,其化合物在材料科学领域中具有重要的应用价值。
锗的含氧酸是一类重要的化合物,具有独特的性质和应用潜力。
本文将介绍关于锗的含氧酸的相关知识和应用。
让我们了解一下锗的基本性质。
锗是一种化学元素,原子序数为32,原子量为72.63。
它的化学性质类似于硅,属于周期表中的第14族元素。
锗是一种非常稳定的金属元素,具有较高的熔点和沸点,能够在高温下保持稳定性。
灵芝的八大神奇元素—有机锗

灵芝的八大神奇元素—有机锗
灵芝的八大神奇元素—有机锗
城市漫步 07-21 09:02 大
灵芝的八大神奇元素—有机锗
近年来,越来越多的国内外研究结果表明,微量元素锗在人类的生命过程中起着重要的作用,与人体健康有着密切的关系。
尤其是有机锗活性很强,具有抗肿瘤、消炎与免疫调节、抗氧化、抗衰老、降血脂等多重有益功能。
作为一种珍贵的稀有微量元素,我们该从哪里获得有机锗呢?
灵芝、人参、枸杞等药物植物富含有机锗,但灵芝对锗的富集能力较强,有机锗的含量是人参的4-6倍、枸杞的100倍。
值得注意的是,灵芝有机锗能与体内污染物金属相结合成为有机锗化合物,或将人体中许多原本排不出去的杂质中和,比如血液中的药物毒素、没代谢的脂质等杂质,最终中和成一种容易排出体外的物质。
灵芝的降压、降脂、去毒、抑制各种病症的恶化等作用就是有机锗的缘故。
此外,灵芝有机锗可诱导人体产生并激活NK细胞和巨噬细胞活性,参与免疫调节作用;可使人体血液循环畅通,增强人体对氧气的吸收能力,促进人体代谢,有清血行气、改善体质的功能。
灵芝好,好的灵芝,自然要搭配上科学的食用方法,才不至于造成很大的浪费。
最方便吸收灵芝有机锗的食用方式是什么?如果想要更好的吸收灵芝中的有机锗,建议选择将灵芝用来煲汤。
因为灵芝所含的有机锗比较容易溶解于汤里,便于人体吸收,所以说,常喝灵芝汤,不仅降脂去毒,强免疫白皮肤,还可以养护肠胃。
灵芝的好处实在是太多了,今天就给大家介绍到这里了,找正宗的灵芝产品请加微信:[lingzhishan001]学习更多的养生知识!。
神奇元素锗的历史与应用

神奇元素锗的历史与应用锗(Germanium)是一种神奇的元素,其历史和应用颇具迷人之处。
本文将向您介绍锗的发现历程以及其在不同领域的广泛应用。
一、发现历程锗是由德国化学家弗雷德里希·奥斯卡·格罗宁(Friedrich Oscar Gmelin)于1886年首次发现的。
格罗宁使用了一种称为分光光度计的仪器,他发现了一种未知元素,该元素对红外线具有非常强烈的吸收能力。
格罗宁将这个元素命名为“锗”,以纪念他的祖国:德国(Deutschland)。
二、物理和化学性质锗是一种银白色的金属元素,在常温下呈脆性。
它的原子序数为32,化学符号为Ge。
锗的原子结构类似于硅,因此两者具有类似的性质。
锗是一种半导体,它的电导率介于导电性材料和绝缘体之间。
此外,锗还具有良好的热导率和光学性质。
这些独特的性质使得锗在许多领域得到了广泛应用。
三、电子行业中的应用由于锗是一种半导体材料,它在电子行业中具有重要的应用价值。
锗晶体可以用于制造高效的太阳能电池和红外线探测器。
相比于其他材料,锗具有更高的光电转换效率和更广的光谱响应范围。
此外,锗还可以用于制造高速电子器件,例如晶体管和集成电路。
锗基电子器件在通信、计算机和电子设备制造等领域具有广泛的应用。
四、光学领域中的应用除了在电子行业中的应用,锗在光学领域中也发挥着重要作用。
由于锗对红外线有很强的吸收能力,因此它被广泛用于红外光谱仪、红外摄像机和热成像设备中。
锗晶体还可以用于制造激光器窗口和透镜,以及红外激光雷达系统。
锗的高折射率和低散射使得它成为光学元件的理想选择。
五、其他应用领域锗在医疗领域、石油开采、纺织工业和催化剂制造等领域也有着广泛的应用。
例如,锗被用作X射线透视设备中的探测器材料,以及石油开采过程中的催化剂。
此外,锗化合物还可以用于制备特殊玻璃和陶瓷材料,以及颜料和染料的生产中。
总结:锗作为一种神奇元素,具有丰富的历史和广泛的应用领域。
它在电子行业中用于制造高效的太阳能电池和晶体管,而在光学领域中被广泛用于红外光谱仪和透镜的制造。
锗的基本知识

锗的基本知识性质和用途锗具有半导体性质。
在高纯金属锗中掺入三价元素如铟、镓、硼等,得到p型锗;掺入五价元素如锑、砷、磷等,得到n 型锗。
锗的禁带宽度(300K)0.67电子伏,本征电阻率(27℃)47欧姆·厘米,电子迁移率3900±100厘米2/(伏·秒),空穴迁移率1900±5 0厘米2/(伏·秒),电子扩散系数100厘米2/秒,空穴扩散系数48.7厘米2/秒。
锗在电子工业中的用途,已逐渐被硅代替。
但由于锗的电子和空穴迁移率较硅高,在高速开关电路方面,锗比硅的性能好。
锗在红外器件、γ辐射探测器方面,有新的用途。
金属锗能通过2~15微米的红外线,又和玻璃一样易被抛光,能有效地抵制大气的腐蚀,可用以制造红外窗口、三棱镜和红外光学透镜材料。
锗酸铋用于闪烁体辐射探测器。
锗还同铌形成化合物,用作超导材料。
二氧化锗是聚合反应的催化剂。
用二氧化锗制造的玻璃有较高的折射率和色散性能,可用于广角照相机和显微镜镜头;GeO2-TiO2-P2O5类型的玻璃有良好的红外性能,在空间技术上,可用来保护超灵敏的红外探测器。
富集回收锗的制取第一步是从重有色金属冶炼过程回收锗的富集物。
以炼锌为例:在火法炼锌过程中,锌精矿首先经过氧化焙烧,然后加入还原剂和氯入钠,在烧结机上烧结焙烧,锗以氯化物或氧化物形态挥发进入烟尘。
如不采用氯化烧结措施,锗将富集于最后锌蒸馏的残留物中(见氯化冶金)。
在湿法炼锌过程中,如锌精矿含锗不高时,大部分锗在硫酸浸出渣中,小部分锗进入溶液。
在锌溶液净化过程中,由于锗的亲铁性质,氢氧化铁沉淀时吸附锗,锗进入铁渣。
锌溶液用锌粉置换镉时,残留的锗和镉同时为锌粉所置换。
如将浸出渣熔化,然后用烟化炉挥发铅、锌,则锗以一氧化锗状态挥发,富集于烟尘中。
烟化炉可用来处理含锗的氧化铅、锌矿。
将氧化矿在鼓风炉内熔炼,再用烟化炉处理炉渣挥发锗,挥发率大于90%。
现代炼锌多用湿法,在处理含锗较高的硫化锌精矿(含锗100~150克/吨)时,首先使锗富集于浸出渣中,用烟化炉处理,烟尘含锗0.1%,用酸浸出,溶液净化后,加丹宁(C76H52O46)沉淀,沉淀物中含锗3~5%;经烘干、煅烧,得到含锗15~20%的锗灰,作为提锗原料。
锗含量分析专业知识

钢铁及其合金中锗含量旳分析
元素性质
存在形式
用途
钢铁中旳作用
检测措施
元素性质
锗
原子序数:32 相对原子质量:72.64 化学符号:Ge 所属周期:第四面期 所属族数:IVA
氧化态 :Ge+2,Ge+4 锗为银灰色晶体,熔
点937.4°C,沸点 2830°C 一种稀有金属, 主要 旳半导体材料
用途
检测措施
• 锗旳测定根据含量不同分别采用下列几种 措施:质量分数低旳,一般采用原子吸收 光谱法、萃取分光光度法、蒸馏分光光度 法;
• 质量分数较高旳,采用碘酸钾滴定法,重 量法等
蒸馏分离苯芴酮-十六烷基三甲基溴 化铵光度法
1、仪器和设备 ⑴分光光度计 ⑵简易蒸馏装置
• 2、试验环节 取样 式样分解
锗地壳中旳含量约0.0007%(一百万分之七),大量旳锗 以分散状态存在于多种金属旳硅酸盐矿、硫化物矿以及多 种类型旳煤中。锗在自然界分布很散、很广,煤、铜矿、 铁矿 、某些银矿中,也成锗石产出,岩石,泥土和泉水中 都具有微量旳锗。诸多植物中都具有限量锗。
பைடு நூலகம் 钢铁中旳作用
• 锗有着良好旳半导体性质,如电子迁移率、 空穴迁移率,能将光能转化为电能,能利 用温差发电等等 在合金中加入锗可提升合 金旳导电性
半导体基本知识

4)温度升高,激发的电子空穴对数目增加,半导体的导电能力增强。 空穴的出现是半导体导电区别于导体导电的一个主要特征。
如果在本征半导体中掺入微量杂质(其他元素),形成杂质半导体,其导电 能力会显著变化。根据掺入杂质的不同,可以分为P型半导体和N型半导体。
在本征半导体硅(或锗)中掺入微量的 五价元素,如磷、砷、锑等,就形成N型半 导体。杂质原子替代了晶格中的某些硅原子, 它的四个价电子和周围四个硅原子组成共价 键,而多出的一个价电子很容易受激发脱离 原子核的束缚成为自由电子,但并不同时产 生空穴,相应的五价元素的原子因失去一个 电子而成为不能自由移动的带正电粒子—— 正离子,由于杂质原子可以提供电子,故也 称施主原子,如右图所示。
在本征半导体硅(或锗)中掺入微量的 三价元素,如硼、铝、铟等,就形成P型半导 体。杂质原子替代了晶格中的某些硅原子, 它的三个价电子和周围四个硅原子组成共价 键,而第四个共价键因缺少一个价电子出现 空位,由于空位的存在,使邻近共价键内的 电子只需很小的激发能便能填补这个空位, 相应的三价元ቤተ መጻሕፍቲ ባይዱ的原子因得到一个电子而成 为不能自由移动的带负电粒子——负离子, 由于杂质原子得到电子,故也称为受主原子, 如右图所示。
这种杂质半导体的多子是空穴,因空穴 带正(positive)电,所以称为P型半导体。P 型半导体中空穴的浓度比电子的浓度高得多。 当在其两端加电压时,主要由空穴定向移动 形成电流。
2015年高中化学竞赛辅导无机化学14.3锗分族知识点素材

§14-3 锗分族T he Germanium Subgroup一、General Properties从Ge 到Pb +2氧化态稳定性增大 从Pb 到Ge +4氧化态稳定性增大 Ge(s) + GeO 2(s)2GeO(s) ∆r G m = 47kJ ·mol -1Sn(s) + SnO 2(s)2SnO(s) ∆r G m = -67kJ ·mol -1PbO2 + 4H ++ 2e Pb 2++ 2H 2O φ = +1.45V GeO 2 + 4H ++ 2eGe 2+ + 2H 2O φ = -0.15V自然界中存在锡石(tinstone):SnO 2,方铅矿(galena):PbS铅存在于Uranium 和Thorium 矿中,这是由于铅是U 和Th 的放射性衰变的产物二、The Simple Substances 1.Allotropes : 灰锡(α锡)13.6℃白锡(β锡)脆锡锡制品长期处于低温会毁坏,这是β锡转变为α锡的缘故,这一现象叫做锡瘟(Tin disease),灰锡是粉末状,β锡低于13.6℃转变为α锡,但转变速度极慢,温度降至-48℃,转变速度最快,α锡本身就是这类反应的催化剂。
2.Properties :(1) Sn 是两性金属 Sn + 2HClSnCl 2 + H 2↑Sn + 2OH -+ 2H2O -24Sn(OH)+ H 2↑Ge 只有在H 2O 2(氧化剂)存在下,才溶于碱Ge + 2KOH 2H 2O 2K 2[Ge(OH)6] Pb 也能与碱反应:Pb + 2H 2O + 2KOH K 2[Pb(OH)4] + H 2↑(2) 与氧化性酸反应:a .Pb 与任何浓度的硝酸反应都得到Pb(NO 3)2 b .Sn 与浓HNO 3反应得到Sn (IV),与稀HN O 3反应得到Sn(II)3Sn + 8HNO 3(稀)3Sn(NO 3)2 + 2NO + 4H 2O Sn + HNO 3(浓)H 2SnO 3 + 4NO 2 + H 2O三、The Compounds1.卤化物 EHal 4 EHal 2 (1) SnCl 2a .水解性 SnCl 2 + H 2OSn(OH)Cl ↓+ H ++ Cl -在配制SnCl 2(aq)必须防止氧化(4O 2SnCl SnCl 2−→−)和水解,用盐酸酸化蒸馏水,并在SnCl 2(aq)中加入Sn 粒:SnCl 4 + Sn 2SnCl 2b .还原性SnCl 2 + 2HgCl 2SnCl 4 + Hg 2Cl 2 Hg 2Cl 2 + SnCl 2SnCl 4 + 2Hg ↓ (2) GeCl 4、SnCl 4也强烈水解 GeCl4 + 2H 2O GeO 2↓+ 4HCl SnCl 4 + 4H 2O Sn(OH)4 + 4HCl在盐酸中:SnCl 4 + 2HClH 2SnCl 6(3) PbCl 2在冷水中溶解度小,但在热水中溶解度大,在盐酸中溶解度增大因为 PbCl 2 + 2Cl --24PbCl(4) PbCl 4在低温下稳定,在常温下即分解:PbCl 4PbCl 2 + Cl 2PbF 4 m.p. = 600℃ PbCl 4 m.p. = -15℃ 2.硫化物(1) SnS :H 2S + Sn 2+SnS ↓(暗棕色) + 2H+SnS 不溶于Na 2S 溶液中,但可溶解于中等浓度的盐酸和碱金属的多硫化物溶液中SnS + 4Cl -+ 2H+-24SnCl + H 2S ↑-+22S SnS −→−+-H 23SnS SnS ↓+ H 2S ↑(2) SnS 2Sn 4++ 2H 2S SnS 2↓+ 4H+SnS 2 + S 2--23SnS (3) PbS :Pb 2+ + S 2-PbS ↓(黑色)PbS 可溶于浓HCl 和稀HNO 3、H 2O 2,不溶于Na 2S 和无氧化性的稀酸 PbS + 4HCl (浓)H 2S ↑+ H 2PbCl 43PbS +-32NO + 8H +3Pb 2++ 3S ↓+ 2NO ↑+ 4H 2O由于Pb (IV)有极强的氧化性,所以PbS 2不存在3.一些铅的化合物 (1) 氧化物PbO (黄色)密陀僧,Pb 2O 3 (PbO ·PbO 2)(黄色),Pb 3O 4 (2PbO ·PbO 2)(红色)铅丹,PbO 2(黑色)Pb 2O 3、Pb 3O 4、PbO 2都具有强氧化性5PbO 2 + 2Mn 2++ 4H +5Pb 2++-42MnO +2H 2O PbO 2 + 4HCl PbCl 2 + Cl 2↑+ 2H 2O(2) Pb(NO 3)2易水解:Pb 2++-3NO + H 2O Pb(OH)NO 3↓+ H +易分解:2Pb(NO3)22PbO + 4NO 2 + 2H 2O(3) Pb(CH 3COO)2 易溶于水,难离解,毒性大 Pb(Ac)2 + Cl 2 + 4KOH PbO 2 + 2KCl + 2KAc + 2H 2O(4) PbSO 4 可溶于浓H 2SO 4中,也可溶于NH 4Ac 或NaAc 溶液中PbSO 4 + H 2SO 4(浓)Pb(HSO 4)2−−→−O H2PbSO 4+ H 2SO 4 PbSO 4(白色)−−→−-Ac PbAc 2(可溶) +-24SO(5) PbCrO4(黄色)PbCr 2O 7(可溶)(6) 铅的有机化合物Na4Pb (钠铅合金) + 4C2H5Cl Pb(C2H5)4 + 4NaCl四乙基铅(tetraethyl lead)是汽油抗震剂(antiknock agent),其△f H m = 217.6kJ·mol 1,但在常温下尚能稳定存在。
锗抗拉强度

锗抗拉强度全文共四篇示例,供读者参考第一篇示例:锗是一种重要的半导体材料,具有很高的抗拉强度。
在工业生产中,锗被广泛应用于半导体器件、光伏电池和光纤通信等领域。
锗的抗拉强度是衡量其材料性能的重要指标之一,对于保证其在各种应用场合中的稳定性和可靠性起着至关重要的作用。
我们来了解一下锗的概况。
锗是一种化学元素,原子序数32,化学符号为Ge,原子量为72.63,属于IVB族元素。
锗是一种灰色的金属元素,是地壳中相对较为稀有的元素之一。
由于其独特的电学和光学性质,锗在半导体器件中具有重要的应用前景。
由于锗的熔点较低,因此在工业生产中常常需要采取合适的措施来提高其抗拉强度。
锗的抗拉强度是指在外力作用下,锗材料发生拉伸变形时所能承受的最大拉力。
通常情况下,我们通过材料拉伸测试来测量锗的抗拉强度。
在拉伸测试中,将标准形状和尺寸的锗试样安装在拉伸试验机上,施加逐渐增加的拉力,直至试样发生破裂为止。
根据拉伸试验得到的拉力-伸长曲线,可以计算出锗的抗拉强度。
锗的抗拉强度受多种因素的影响,其中包括晶格结构、纯度、温度等。
首先是锗的晶格结构。
在晶体中,原子的排列方式对材料的力学性能有着重要的影响。
锗通常呈现出面心立方结构或钻石结构,这种结构使得锗具有较高的抗拉强度。
锗的纯度也是影响其抗拉强度的重要因素。
杂质的存在会降低材料的力学性能,因此在工业生产中需要控制锗材料的纯度,以保证其抗拉强度。
温度也会对锗的抗拉强度产生影响。
一般来说,随着温度的升高,锗的抗拉强度会下降。
这是因为在高温下,原子的热运动会增加材料的塑性变形能力,导致材料更容易发生破裂。
在特定温度范围内,需要根据锗的应用情况和环境条件来选择合适的温度范围,以保证其抗拉强度。
在工业生产中,提高锗的抗拉强度是一个重要的研究方向。
目前,已有许多研究机构和企业致力于开发新的制备工艺和技术,以提高锗材料的抗拉强度。
采用合金化、热处理和压力加工等方法,可以有效地提高锗的抗拉强度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
立志当早,存高远
锗知识
锗为银灰色金属,密度5.35 克,熔点937.4℃,沸点2830℃。
室温下,晶态锗性脆,可塑性很小。
锗的化学性质稳定,常温下锗在空气中不被氧化,但在加热时,锗能在氧气、氯气和溴蒸气中燃烧。
锗不与水作用,不溶于盐酸和稀硫酸,硝酸和热的浓硫酸能将金属锗氧化为二氧化锗,锗还溶于王水。
锗易溶于熔融的氢氧化钠或氢氧化钾,生成锗酸钠或锗酸钾。
在过氧化氢、次氯酸钠等氧化剂存在下,锗能溶解在碱性溶液中,生成锗酸盐。
锗具有半导体性质,在高纯锗中掺入三价元素(如铟、镓、硼)、得到P 型锗半导体;掺入五价元素(如锑、砷、磷),得到N 型锗半导体。
锗通常以分散状态存在于其他矿物中,独立的矿物很少。
可从含锗的氧化铅锌矿、闪锌矿和煤灰中回收锗。
锗的提取方法是首先将锗的富集物用浓盐酸氯化,制取四氯化锗,再用盐酸溶剂萃取法除去主要的杂质砷,然后经石英塔两次精馏提纯,再经高纯盐酸洗涤,可得到高纯四氯化锗,用高纯水使四氯化锗水解,得到高纯二氧化锗。
一些杂质会进入水解母液,所以水解过程也是提纯过程。
纯二氧化锗经烘干煅烧,在还原炉的石英管内用氢气于650-680℃还原得到金属锗。
锗在电子工业中的用途已逐渐被硅代替。
但由于锗的电子和空穴迁移率较硅高,在高速开关电路方面,锗比硅的性能好。
锗主要用来生产低功率半导体二极管三极管,锗在红外器件、γ辐射探测器方面有着新的用途,金属锗能让2-15 微米的红外线通过,又和玻璃一样易被抛光,能有效地抵制大气的腐蚀,可用以制造红外窗口、三棱镜和红外光学透镜材料。
锗还与铌形成化合物,用作超导材料。
用氧化锗制造的玻璃有较高的折射率和色散性能,可用于广角照像镜头和显微镜。
