Beckmann反应-己内酰胺的制备讲解
环己酮肟液相贝克曼重排制己内酰胺研究进展_章明

等催化的重 排, 发现在 BPyBF4 ( 正 丁基吡啶氟 硼酸盐 ) 中, PCI5 催化效果最好, 80 100% , 催化转化数 5。 2. 2 在 DMF 中 P2 O5 催化重排 [ 8] 在 DMF 中 , P2 O5 能有效催化环己酮肟重排 反应 2 小 时 , 环己 酮肟 转化 率 100% , 已 内酰 胺选 择性
己内酰胺是制造聚酰胺 6 纤维、 塑料和薄 膜的重要单体 , 在我国已内酰胺产量尚不能满 足国内市场的需求。 90% 以上的己内酰胺是由 环己酮一羟胺法生产的 , 由环己酮和羟胺进行
肟化反应生成环 己酮肟 , 然后进 行液相 Beck mann 重排, 生成己内酰胺。当前的工业生产是 以浓硫酸或发烟硫酸催化, 然后用氨中和制得 己内酰胺。
1. 用化学计量试剂进行的重排 1. 1 酸
[ 1]
用酸性试剂进行的重排 这是早期发展的液相重排 , 环己酮肟在硫 、 氯磺酸 [ 2] 、 苯磺酰氯[ 3] 、 氢氟酸 [ 4] 、 多聚 用 路易斯 酸进行 的环 己酮肟 衍生 物重 排
[ 6]
磷酸[ 5] 等试剂作用下发生重排, 生成己内酰胺。 1. 2
彭家建等研究了在室温离子液 [ 1- 丁基 3- 甲基咪唑三氟乙酸盐 ( BMIm TFA) 、 1- 丁基 - 3- 甲基咪唑氟硼酸盐 ( BMImBF4 ) 和正 丁基 吡啶氟硼酸盐 ( BPyBF4 ) ] 中 , PCl5 、 P2O5 或 POCl3
2004 年 3 月
环己酮肟 液相贝克曼重排制已内酰胺研究进展
[ 10]
CF3SO3Me 能催化环已酮肟重排 , 分别在 53
反应 1 小时转化率分别为 17. 8% 、 49. 4% ,
催化转化数分别为 4. 7、 2. 6。己内酰胺选择性 均大于 98% , 催化活性物种被认为是 O- 烷基 甲酰胺盐。 Me2 NCHO+ Me3O BF4 BF4 + Me2 O 也有类似的报道 , 在 DMF 中用氯磺酸促进 肟的贝克曼重排反应, 认为是形成了具有极强
实验十一 已内酰胺的制备

实验十一已内酰胺的制备一、实验目的1. 掌握贝克曼重排制备已内酰胺的原理和方法2. 进一步熟悉重结晶等基本操作二、实验原理已内酰胺是一种重要的有机化工原料,它是生产尼龙-6纤维(即锦纶)和尼龙-6工程塑料的单体,在汽车、纺织、电子、机械等众多领域具有广泛应用。
尼龙-6工程塑料主要用于生产汽车、船舶、电子器件和日用消费品等构件;尼龙-6纤维则可制成各种纺织品;此外,已内酰胺还可用于生产L-赖氨酸、月桂氮卓酮等工业品。
已内酰胺可以通过环已烷、苯酚、甲苯等为原料来进行合成,而目前世界上80%的已内酰胺都是以环已烷为原料,通过环已酮肟发生的贝克曼重排反应来合成的。
其反应式如下:酮肟在酸性催化剂如硫酸、多聚磷酸以及能产生强酸的三氯化磷、五氯化磷、苯磺酰氯和氯化亚砜等试剂作用下,重排成酰胺的反应称为贝克曼(Beckmann)重排,反应机理如下:研究表明,酮肟首先在酸的催化作用下发生羟基的质子化,帮助羟基离去。
离去基团与迁移基团处于反式,基团的离去与基团的迁移是同步进行的,迁移基团在迁移前后构型不变。
已内酰胺常温下容易吸湿,具有微弱的胺类刺激性气味。
易溶于水、醇、醚、烷烃、氯仿和芳烃等溶剂。
受热易发生聚合反应。
纯的已内酰胺为白色晶体或结晶性粉末,mp 69~71 o C。
已内酰胺的红外光谱图三、仪器与试剂仪器:三口烧瓶,恒压滴液漏斗,布氏漏斗,分流漏斗试剂:环已酮肟2.00 g(17.7 mmol),85% 硫酸3.0 mL,20% 氨水,二氯甲烷,石油醚,无水硫酸镁,活性炭四、物理常数化合物分子量性状比重(d204)熔点(℃)沸点(℃)折光率(n)溶解性水乙醇乙醚环已酮肟113.16 白色晶体- 90 206 - 溶溶溶已内酰胺113.16 白色晶体- 69.3 270 - 互溶互溶- 五、实验步骤1.已内酰胺的合成在50 mL三口烧瓶中加入2.00 g环已酮肟,3.0 mL 85%的硫酸,摇匀。
在小火上慢慢加热[1],至有气泡产生(约120 o C),立即将火移开,反应剧烈放热,温度很快自行上升(可达160 o C),反应在几秒内即完成。
生产己内酰胺的Beckmann重排催化剂研究进展

生产己内酰胺的Beckmann重排催化剂研究进展4杭州化工2008.38(1)生产己内酰胺的Beckmann重排催化剂研究进展徐兆瑜(安徽省化工研究院,安徽合肥230041)摘要:综述了生产己内酰胺工艺路线中Beckmann重排过程所取得的新进展及近年来国内外Beck—mann重排催化剂的研究开发情况.对新的催化体系(包括分子筛,固体酸,离子液体等)的开发及其应用于Be&mann重排反应所取得的一些新的技术路线作了重点叙述.展望了离子液体和超临界流体技术在己内酰胺生产中的应用前景..'关键词:己内酰胺;环己酮肟;Beckmann重排;尼龙一6己内酰胺(CPL)有多种生产技术和原料路线(拉西法,DSM/HPO工艺,BASF—NO还原工艺Nventa-NO还原工艺,Allied异丙醇酚工艺,Capmpol工艺,东丽PNC工艺和SNIA甲苯法工艺)等2I.其中以苯为原料,通过环己酮一羟胺制备环己酮肟,再经Beckmann重排为基础的DSM/Ⅺ)0和Capropol工艺应用最为广泛,但它们存在明显的环保和成本问题[0,.多数工艺路线的最后一步是相同的,即液体环己酮肟在发烟硫酸或浓硫酸催化作用下,进行Beckmann重排反应,反应混合物再用氨中和生成CPL和硫酸铵.环己酮肟的Beckmann重排,是生产己内酰胺的重要工艺过程.目前世界己内酰胺的总产量的90%左右均采用以浓硫酸或发烟硫酸为催化剂的环己酮肟的Beckmann重排工艺.尽管该路线具有98%以上的选择性,但仍存在副产低值硫酸铵等诸多问题.基于一系列新催化剂的开发与新工艺的应用[5,6l,当前,在国内外已掀起了以简化工艺,降低或消除副产硫酸铵,减少腐蚀和环境污染,降低成本和提高经济效益为目标的新工艺和新技术开发热潮l7].其中尤以针对环己酮肟的Beckmann重排过程,进行了许多研究并取得了新的进展.1气,液相Beckmann重排中的催化剂环己酮肟的液相Beckmann重排是生产CPL中最重要的反应之一,对工业成本和产品质量起关键作用.环己酮肟在发烟硫酸中的液相重排是快速强烈反应,反应温度在70℃时的半衰期只有10s.目前工业生产过程的重排液粘度会随温度和酸肟比的下降而急剧上升,造成局部混合不均匀,从而影响产品质量,而反应温度过高又会导致副反应加剧.在重排过程中,只有通过溶剂的吸热或汽化潜热,移走反应热,使重排能在低温下进行,才有望达到低温,低酸肟比和高产品质量的目的.气相重排工艺是将环己酮汽化,在固体催化剂作用下进行复相催化反应重排成CPL,可以避免硫酸铵生成.在2O世纪7O年代,BASF等公司曾以B203为催化剂的流化床进行气相重排中试,其成果已接近工业化.气相重排一般设计为流化床工艺,液体环己酮肟溶解在有机溶剂中,再加以汽化送入流化床反应器进行Beckmann重排反应.Beckmann重排反应的关键是催化剂的选择,这也是研究的热点.目前文献报道所用的催化剂主要有以下几种案例.(1)荷兰DSM公司用固体酸作催化剂,环己酮肟的转化率达93.1%,CPL选择性为83.9%.在此基础上,用己内酰胺基硫磺磷酸作辅助催化剂,CPL吸收效率达100%L8J.(2)大连理工大学近年来一直从事固体酸应用于环己酮肟气相Beckmann重排的研究,开发了03/21"O3催化体系,取得的结果是:环己酮肟转化率和己内酰胺的选择性均达95%以上.固体酸有Al2()3,杂多酸,硅铝胶,Y型分子筛, ZSM一5,ZrO2/SO4,超强酸等.总体而言,上杭州化工2008.38(1)5述催化剂都有较好的催化活性,但都存在寿命太短的问题.Thangarij等第一个报道了采用"IS一1进行环己酮肟气相Beckmann重排的尝试,获得了满意的结果.这表明,一1催化剂用于环己酮肟重排反应,无论是环己酮肟的转化率还是己内酰胺的选择性都优于MF一1型.其它催化剂如ZSM一5和硅胶催化剂失活速度相对比较小, 100h后环己酮肟的转化率从100%降至95%,但选择性仍保持在91%以上.(3)日本住友化学公司采用由烷基化试剂和DMF组成的催化体系,CPL的选择性达99.8%C9].烷基化试剂可以是含烷基烷酸酯,芳基烷酸酯,三甲基氧铃盐和硫酸酯等基团1个以上的物质,也可以是强酸,酯等.在DMF中,P2()5能有效催化环己酮肟重排生成CPL,95℃反应2h,环己酮肟的转化率达99.8%,CPL的选择性为94.2%,催化转化数(反应的环己酮肟与催化剂摩尔之比)为13.3.据报道,在61~154℃的范围内,采用H交换度为100%的HNaY分子筛,CPI的收率随着温度升高而增大,在132"C时达到最大(73.5%),在154℃时开始下降【J. (4)荷兰DSM公司应用改性的磺化聚苯乙烯一二乙烯基苯树脂作催化剂,在二甲基亚砜溶液中催化环己酮肟重排,环己酮肟转化率为93.1%,CPI选择性为83.9%,CPI收率为78.1%…J.在此基础上,用己内亚胺基一.一磺酸作辅助催化剂,CPL收率达100%.用分子筛等固体酸催化剂进行液相重排工艺比液体酸催化剂更具优势,因为它消耗低,容易分离,可重复使用,值得深入研究.(5)日本住友化学公司与埃尼化学公司开发了从环己酮肟生产己内酰胺新工艺,生产成本比传统方法低.该工艺将FS一1催化剂,与氨进行氨氧化直接生产环己酮肟的技术与环己酮肟气相法Beckmann重排反应技术结合起来.采用流化床反应器,甲醇为辅助反应剂,环己酮(肟)/甲醇/氮气在350℃通过分子筛,环己酮肟的转化率为99.3%,环己酮肟和甲醇的空速分别为5.04 和6.76g/(g催化剂?h).己内酰胺产率为99.3%,副产物是水.以环己烷为原料,采用钛硅酸盐催化剂,约在90℃下与氨和H2()2反应,生产环己酮肟,称为肟化反应.该工艺原来由意大利埃尼化学公司开发.由于不需要羟胺装置,从而降低了费用,但H202价贵,因此只有规模化生产才显示出价格优势和经济性.该工艺可避免硫酸铵副产物生成.工艺可靠性已由日本住友化学公司在5oo0t/a装置上验证,并于2003年在日本爱媛建成6.7万t/a装置,他们准备向东南亚和中国转让该技术.(6)日本住友化学公司通过一种专有的高效Si02沸石催化剂代替硫酸,避免了硫酸铵生成.在0.1MPa和380"C条件下的流化床中进行气相Beckmann重排反应,把甲醇与环己酮肟以1:1 (质量比)混合,以提高催化剂的选择性,甲醇可循环使用,环己酮肟的转化率达到99%,己内酰胺的转化率达95%以上【I2J.反应后甲醇可回收并循环利用,副产品仅仅是水.工艺总收率为70%,与DSMPo工艺相比,原料消耗可降低6%,据测算,该工艺可使新厂投资降低3O%,目前正致力于工业化[I3].中国科学院大连物理研究所,四川大学,厦门大学等科研机构正在开展相关研究工作.2离子液体应用新动态离子液体由有机阳离子和无机侑机阴离子组成,它的熔点一般低于100"(2,蒸气压低,不挥发,使用它作为溶剂替代挥发有机物已成为绿色化学的重要研究方向之一.它可消除传统有机溶剂造成的环境污染,同时还表现出可调控的酸性等许多优点,被称为开发绿色石油化工新工艺的"新式武器"【14,I5J.离子液体用于Beckmann重排反应具有重要意义和实际价值.张伟-l6-所研究的1一正丁基一3一甲基咪唑四氟硼酸盐[bmim]BF4与甲苯组成的两相体系可证明P催化环己酮肟转化率达98.96%,CPL选择性达87.3O%.首次使用合成的一类阳离子为质子化己内酰胺,阴离子为硬脂酸根离子液体,用该离子液体作反应介质,Pa为催化剂催化环己酮肟进行13eckmann重排反应合成CPI,其转化率和选择性均达到90%以上.离子液体阴离子是从自然物质硬脂酸获得,因此还具有廉价和环境友好的特点,此项研究开拓了一个全新的I~ckmann重排研究方向.李曹龙等?发现正丁基吡啶氟硼酸盐,正戊6杭州化工2008.38(1)基吡啶氟硼酸盐,正辛基吡啶氟硼酸盐等离子液体和含磷化合物等组成的催化体系,可高效催化环己酮肟Beckmarm重排制CPL,不需要其它有机溶剂,反应条件温和.以正丁基吡啶氟硼酸盐离子液体和PCI5构成催化体系,反应温度80℃, 反应时间2h,环己酮肟转化率达100%,CPL选择性为95.68%,催化转化数为5,具有良好的开发前景.彭家健【i8】等也研究了1一丁基一3一甲基咪唑三氟乙酸盐,1一丁基一3一甲基咪唑氟硼酸盐和正基吡啶氟硼酸盐等离子液体与含磷化合物组成的催化体系.试验表明,增加催化剂用量,可以显着提高转化率,但催化转化数降低.提高反应温度,能使环己酮肟转化率迅速提高,但对CPL选择性而言须选择适宜温度[18,19】.由于不使用其它有机溶剂,使反应体积大为减少,为实现环己酮肟Beckmann重排制CPL的清洁工艺提供了一条新的思路.在二烷基眯唑盐和烷基吡啶盐离子液体及含磷化合物的催化介质中,在80℃下环己酮肟进行I3eckmann重排反应,可获得极好的转化率和选择性.而对于丙酮肟则发生13eckmann碎裂.试验表明,在离子液体[BPy]BF4中对于£一CPL几乎达到100%的转化率和99%的选择性.中国科学院兰州化学物理研究所深入地研究了室温下1一丁基一3一甲基咪唑三氟乙酸盐,1 一丁基一3一甲基咪唑三氟硼酸盐,正丁基吡啶氟硼酸盐离子液体和含磷化合物组成的体系在不需要其它有机溶剂且温和的反应条件下高效地催化环己酮肟制CPL.日本东北大学和钢铁化学公司的新工艺可低温合成CPL.他们采用超临界co2为溶剂,N一甲基咪唑盐离子液体代替硫酸作催化剂,反应温度50*(2[20,21】.该工艺不副产硫酸铵,也不需要其它有机溶剂,是一种绿色化学工艺,具有很好的发展前景.目前他们正在继续开发高反应性离子液体催化剂,并在优化反应和分离设备,提高该工艺的总体经济性,以推向工业化【22,23J.另外还有研究报道在超临界状态下进行Beckmann重排.Ikushima等在压力为22.1Mpa, 温度低于623K的过热水条件下,发现将环己酮肟溶于水,无CPI产生,但在临界点附近,环己酮肟发生了Beckmann重排反应.接近临界点时,反应速率常数明显增大,超过临界点后反应速率常数明显降低.超临界水条件下的Beckmann重排反应可避免使用有机溶剂,反应副产物少,值得深入研究.3结束语从近年的研究看,环己酮肟液相Be&mann重排生产己内酰胺与气相重排工艺相比,具有条件温和,对设备要求不高,有利于对现有装置改造利用和催化剂可重复使用等优点.也有研究表明,液相重排的进展更大,已经看到了工业化前景;离子液体催化体系反应条件温和,具有巨大的潜在开发和应用前景.参考文献:[1]王洪波,付送保,吴巍.环己酮肟化新工艺与HIK)工艺技术及经济对比分析[J].合成纤维工业,2004.27(3):4o一42.[2]石化.己内酰胺生产新工艺与传S.v-艺经济比较[J].化工技术经济,1998.16(2):10—12.[3]闵恩泽.谢文华.2003年石油4e~.v-绿色化的进展[J].石油化工,2004,33(7):597—602.[4]付送保,朱泽华.吴巍.苯法生产己内酰胺新技术[J],合成纤维工业.2004.27(2):35—38.[5]朱明乔.己内酰胺生产绿色qe~[J].合成纤维工艺,2002,25 (2):38—41.[6]SchuchardtU,CardoeoD.CyclohexaneOxidationContinues tobeaChallenge[J].AppliedCatalysisA,General,2001.211:1—17.[7]程立泉,付送保,刘郁东.丁二烯/A成气路线制己内酰胺的技术进展[J].合成纤维工业,2005,28(4):37—39.[8]向阳.环己酮肟贝克曼重排技术研究的新进展[J].合成纤维工业,1999,22(4):43.[9]Ixurni,Yusuke.ReactionacceleratorforrealTagelnentofoxime tOamideandproce~forproaud~gamidesbyrea/Iangmentof oximes[P].US,5225547,1993.[1O]王东升.环己酮肟贝克曼重排工艺[J].湖南化工,1990, (2):l4一l7.[11]章明,邓志红.环已酮肟液相贝克曼重排制制己内酰胺研究进展[J].江西化工,2004,(1):37—38.f12]彭琳.己内酰胺新工艺工业化【J].国外石油化工快报, 2002,109(6):6.[13]蒋云峰,邓蜀平,董桂燕.已内酰胺生产技术发展与市场前景[J].合成纤雏工业,1999,22(6):36—38.(下转第l8页)18杭州化工2008.38(1)良好的条件.罗立新等[?lo】研究出铁一炭内电解法废水处理装置,该装置对重金属离子c~(VI)的去除率可达100%,有机物(苯胺)的去除率在80%以上,对实验室实际废水的COD去除率达90%以上(见图2).图2动态铁屑床装置流程综上可知,吸附,膜技术和化学氧化,电化学处理工艺是当前用于老龄垃圾渗滤液难降解有机物去除的主要方法,但是其高额的费用往往难以为经济不发达地区所接受.4结束语(1)垃圾渗滤液作为一种特殊废水,由于其氨氮浓度,有机物浓度受场龄等因素影响,水质变化较大,导致处理工艺复杂,设备繁多,目前还没有十分切实有效的方法对其进行处理.因此,要开发不占地,不增加设备,运行费用极低的新颖的结构简单的工艺以及在垃圾填埋工艺中极具应用前景的垃圾渗滤液处理工艺.可根据具体情况实现多元工艺的组合,并通过小试,中试不断优化工艺参数.(2)中小城市垃圾填埋场内对渗滤液的处理,运用场内组合预处理一场外合并处理是一种较为理想的处理方案.对于条件尚不具备的地方,可以利用天然生物塘,并采用水生植物系统或将出水向填埋场回灌,利用土地吸附,土壤生物降解作用进行后续处理,不仅投资省,效果好,且运行费用也低.参考文献:[2][3][4][5][6][7][8][9][10]刘疆鹰,徐迪民等.大型垃圾填埋场渗滤水氨氮衰减规律团[J].环境科学,2001,21(3):323—327.张益,陶华.垃圾处理处置技术7Z:r-程实例[M].北京:化学工业出版社,20o3.汪群慧.固体废物处理及资源化[M].北京:化学工业出版社,20o4.陈石,王克虹等.城市生活垃圾填埋场渗滤液处理中试研究[J].给水排水,2000,26(10):5~18.KenlchiUshikoshi,TetsuoK01)ayashi,KazuyaUematsu,eta1. Leachatetreatmentbytheerseo~wnosis~stem[J].I~ali. nation,2002,150:121—129.Ⅵr0n—YoungAhn,Mo【)n—SunKang,Seong—KeunYjm,et a1.Advan—cedlandfillleachatetreatmentusinganintegrated membranePmce~s[J].Desalination,2002,149:109—114.朱凡等.铁炭微电解法削减老龄垃圾渗滤液的毒性研究[J].中国给水排水,2006,22(11):83—86.王锋,周恭明.铁一碳微电解法预处理老龄垃圾填埋场渗滤液的研究[J].环境污染治理技术与设备,2004,5(3);63—65.罗立新.铁屑内电解法废水处理装置研究[J].环境科学与技术,2003,26(2):42—43.罗立新.一种带渗滤液处理功能的垃圾填埋方法[P].CN, 1449873.2003—5—15.,(上接第6页)[14]杨雅立,王晓化,寇元等.不断壮大的离子液体家族[J]. 化学进展,2003,15(6);471—476.[15]邹汉波,董新法,林雏明.离子液体及其在绿色有机合成中的应用[J].化学世界,2005,45(2):107—110,98.[16]张伟,吴巍,张树忠等.[Bmim][BF4]离子液体中PCI5催化液相贝克曼重排[J].过程工程,2004,4(3):261—264.[17]李曹龙王洪林,刘光恒.离子液体体系中催化环己酮肟重排反应的研究[J].云南化工,2004,31(2):4—6.[18]彭家健,邓友全.离子液体体系中催化环己酮肟重排制己内酰胺[J].石油化工,2001,30(2):91,105.[19]Pengj,DengY.IonicliquidscatalyzeBcckrnannreactionun.[20][21][22][23]dersolvent—freecondition.TetrahedortLett[J].2001,42: 403—405.江镇海.离子液体催化剂低温法己内酰胺新工艺[J].合成纤雏工业,2005,28(1):43.季开慧,于世涛,刘仕伟等.离子液体在精细有机合成反应中的应用研究[J].精细石油化工进展,2007,8(9):49—54.IkushiinaY,HatakedaK,Sato,eta1.A&elerationofsyn- theticorganicreactiorksusingsuoercritialwater,noncatalytic Beckmannandpinamlrcarrangemetrks[J].jAmChins.c, 2000.122:l908~1918.王繁泓.己内酰胺对外依存度居高不下[N].中国化工报,2006~02—16,(3).。
己内酰胺生产工艺

己内酰胺生产工艺己内酰胺生产工艺比较1 己内酰胺发展历程, 1899年,德国学者S.Gabriel和T.A.Mass首次加热ε-氨基己酸获得了己内酰胺。
未工业应用。
, 1900年,O.Wallach利用贝克曼(Beckmann)重排转位反应,在硫酸中加热环己酮肟获得己内酰胺。
, 1937年,德国I.G.Farben公司P.Schlack开创了己内酰胺生产和应用的新纪元,以氨基己酸盐为催化剂,使己内酰胺开环聚合,聚合体纺得纤维的商品名为Perlon., 二次大战期间,德国建设了一些工业装置,生产聚酰胺6纤维,主要用在军事工业上。
(采用苯酚为原料加氢制的环己醇,再脱氢得环己酮,再和羟胺硫酸盐反应生成环己酮肟,转位生成己内酰胺), 二次大战后,I.G.Farben公司公开技术,各国的公司纷纷建设己内酰胺装置,到1960年,世界己内酰胺产量达到180kt。
, 50年代后期,陆续开发了多种己内酰胺生产工艺。
随着石油苯的快速发展以苯为原料,加氢制得环己烷,氧化得环己醇、环己酮的工艺成为生产己内酰胺的主要方法。
2 己内酰胺生产工艺己内酰胺生产方法可以归纳为以下4类:(1) 苯加氢制环己烷,环己烷氧化制环己酮,再与羟胺肟化生成环己酮肟,经Beckmann重排得己内酰胺。
(2) 苯酚加氢制环己酮,经肟化、重排得己内酰胺。
(3) 甲苯氧化制苯甲酸,加氢的环己烷羧酸,与亚硝酰硫酸反应生成己内酰胺。
(4) 环己烷与亚硝酰氯发生光亚硝化反应生成环己酮肟,经Beckmann重排得己内酰胺。
其具体生产工艺如下表所示:己内酰胺生产工艺生产工艺生产原理厂家优势劣势苯酚法(传统法) 苯酚加氢制得环己醇,环己醇脱氢成环德国I.G.Farben公司在副产经济价值较低的硫铵,大约己酮每生产1t己内酰胺副产4.4t硫铵。
硫酸羟胺法氨氧化制氧化氮,氨水依次吸收二氧化美国霍尼韦尔技术成熟、运转稳定,易操氨消耗大,副产硫铵多,1t己内酰环己酮羟(HSO) 氮、氧化氮得到羟胺二磺酸盐,经加热日本宇部兴产公司作;不需要贵重金属催化剂胺同时副产4.4t硫铵; 胺法(根水解即得硫酸羟胺。
Beckmann反应-己内酰胺的制备讲课教案

•2.环己酮肟重排制备己内酰 •在小烧杯加入6 mL冷水,在冷水浴冷却下小 心地慢慢加入8 mL浓硫酸,配得70%的硫酸溶 液。在另一小烧杯中加入7g干燥的环己酮肟, 用7 mL70%的硫酸溶解后,转入滴液漏斗,烧杯用1.5 mL70 %硫酸洗涤后并入滴液漏斗。在一250 mL烧杯中加入4.5 mL70%硫酸,用木夹夹住烧杯,用小火加热至130~135℃,缓 缓搅拌,保持130~135℃,边搅拌边滴加环己酮肟溶液,滴完 后继续搅拌5~10min。反应液冷却至80℃以下,再用冰盐浴冷 却至0~5℃。在冷却下,边搅拌边小心地通过滴液漏斗滴加浓 氨水(约25 mL)至pH=8。滴加过程中控制温度不超过20℃。 用少量水(不超过10 mL)溶解固体。反应液倒入分液漏斗, 用二氯甲烷萃取三次,每次10 mL。合并有机层并用等体积水 洗涤两次后,用无水Na2SO4干燥后,常压蒸馏除去二氯甲烷。 残液转移到锥形瓶中,将锥形瓶在温水浴温热下,在通风柜 中浓缩至5mL左右,放置冷却,析出白色结晶。进行重结晶。
【数据处理与结论】
•1.环己酮肟为白色固体,熔点为 80~90℃,产量为7~7.5g。 •2.已内酰胺为无色或白色晶体,熔点 69~70℃,产量为4~5g。
【注意事项】
•1.与羟胺反应时温度不宜过高。加完环己酮以后,充分摇 荡反应瓶使反应完全,若环己酮肟呈白色小球状,则表示反 应未完全,需继续振摇。 •2.配制70%硫酸溶液时是将酸倒入水中,绝不可搞错。因 放热强烈,必须水浴冷却。 •3.重排反应很激烈,并要保持温度在130~135℃,滴加过程 中必须一直加热。温度均不可太高,以免副反应增加。 •4.用氨水中和时会大量放热,故开始滴加氨水成尤其是要 放慢滴加速度。否则温度太高,将导致酰胺水解。 •5.已内酰胺也可用重结晶方法提纯:将粗产物转入分液漏 斗,每次用10mL四氯化碳萃取3次,合并萃取液,用无水硫 酸镁干燥后,滤入一干燥的锥形瓶。加入沸石后在水浴上蒸 去大部分溶剂,直到剩下8mL左右溶液为止。小心向溶液加 入石油醚(30~60℃),到恰好出现混浊为止。将锥形瓶置于 冰浴中冷却结晶,抽滤,用少量石油醚洗涤结晶。如加入石 油醚的量超过原溶液4-5倍仍未出现混浊,说明开始所剩下 的四氯化碳量太多。需加入沸石后重新蒸去大部分溶剂直到 剩下很少量的四氯化碳时,重新加入石油醚进行结晶。
Beckmann重排制己内酰胺研究进展

Beckmann重排制己内酰胺研究进展1886年Beckmann发现五氯化磷与二苯酮肪作用时,生成了苯甲酞苯胺。
他首次提出酮肘能够发生重排反应,他认为重排反应的形式是羟基和肟的烷基之一的移换,所应用的试剂仅是催化剂。
Beckmann重排反应的特点:①分子内协同的亲核同步反应:Beckmann重排是分子内协同的亲核重排反应,其中烃基的迁移与反式位置羟基的离去是同时发生的,是属于同步协同的反应;②手性分子迁移前后的构型保持不变:如果迁移基团为手性碳原子,其迁移后的手性构型保持不变;③烃基的迁移为反位迁移:烃基的迁移是立体专一的,由于迁移的基因只能从羟基背面进攻缺电子的N原子,因此,烃基的迁移为反位迁移;④紫外线照射下,Z式、E式结构互变;⑤芳基比烷基优先迁移。
Beckmann重排反应最初主要用于鉴定生成的酰胺或酰胺的水解产物,测定原来酮肟的结构,随着该反应研究的不断深入,现已广泛应用于有机合成中,合成一系列的有机原料。
该类反应的原子转化率为100%,是原子经济性反应,是绿色化学的首选反应类型之一。
Beckmann重排还可认为是一个较为普遍的反应,它不仅适用于大多数的酮肟及酮肟的衍生物,而且一些α位上有氨基、羟基、羰基或酯基存在的酮肟进行Beckmann重排时,生成的不是酰胺,而是碳碳键断裂后生成的腈、芳醛或芳酸,这样一种类型的Beckmann重排反应称为“第二类Beckmann重排”或“Beckmann 裂解”反应。
Beckmann重排反应的研究有着重要的意义:①对有机化学结构理论的阐明有着积极的作用;②用来确定酮肠和酮的结构;③代替由酸和胺反应制取酸胺的困难,特别是从酸胺再进一步制取。
现今,关于Beckmann重排反应的机理,多数认为是在催化剂(包括酸性催化剂)影响下,肟的氮氧键部分离子化形成缺电子的氮原子,同时位于经基反位的原子团发生分子内转移而形成过渡状态正离子。
重排反应的最初产物为亚胺衍生物,它迅速重排为相应的酰胺。
(整理)己内酰胺生产工艺删减版
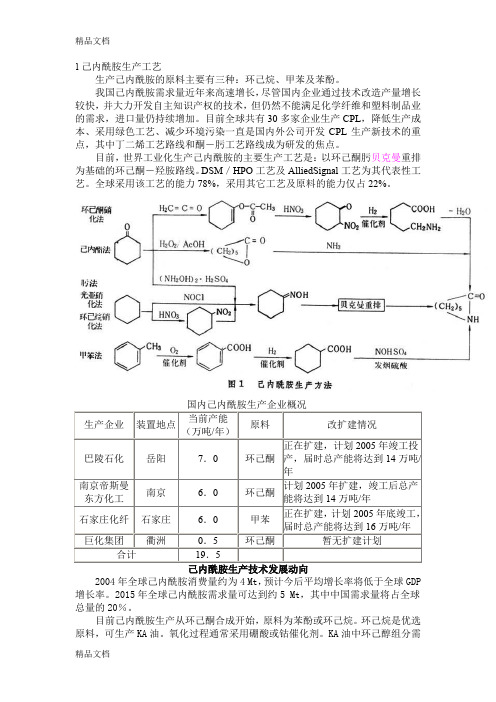
1己内酰胺生产工艺生产己内酰胺的原料主要有三种:环己烷、甲苯及苯酚。
我国己内酰胺需求量近年来高速增长,尽管国内企业通过技术改造产量增长较快,并大力开发自主知识产权的技术,但仍然不能满足化学纤维和塑料制品业的需求,进口量仍持续增加。
目前全球共有30多家企业生产CPL,降低生产成本、采用绿色工艺、减少环境污染一直是国内外公司开发CPL生产新技术的重点,其中丁二烯工艺路线和酮-肟工艺路线成为研发的焦点。
目前,世界工业化生产己内酰胺的主要生产工艺是:以环己酮肟贝克曼重排为基础的环己酮-羟胺路线。
DSM/HPO工艺及AlliedSignal工艺为其代表性工艺。
全球采用该工艺的能力78%,采用其它工艺及原料的能力仅占22%。
2004年全球己内酰胺消费量约为4 Mt,预计今后平均增长率将低于全球GDP 增长率。
2015年全球己内酰胺需求量可达到约5 Mt,其中中国需求量将占全球总量的20%。
目前己内酰胺生产从环己酮合成开始,原料为苯酚或环己烷。
环己烷是优选原料,可生产KA油。
氧化过程通常采用硼酸或钴催化剂。
KA油中环己醇组分需进一步脱氢成环己酮。
采用贵金属催化剂,将苯酚一步催化加氢生成环己酮,环己酮再与羟胺反应转化成环己酮肟。
上述工艺中包括一系列复杂的反应过程。
传统已内酰胺工艺的肟化和Beckmann重排工序通常会产生大量的硫铵。
己内酰胺工业生产还采用其他几种肟化工艺,最老的方法是20世纪40年代和50年代开发的Raschig工艺,产生的硫铵量最大。
该工艺以氨、二氧化碳和二氧化硫为原料,经过几个反应步骤后生成羟胺,再将高纯度的环己酮与氨和水解羟胺反应生成环己酮肟。
几种新工艺有助于减少工艺过程中硫铵的产生。
一些工业化工艺仍然采用羟胺作肟化剂,但在羟胺生产过程中尽可能减少硫铵生成量。
这些工艺包括由DSM 运行和转让的NO还原和HPO/改良HPO工艺。
日本住友公司的一种新工艺在其爱媛县装置上实现工业化,完全避免该工序中硫铵的生成。
己内酰胺生产工艺及技术特点

己内酰胺生产工艺及技术特点<i>己内酰胺</i>路线见图1。
(NH4)2SO4溶液中的环己酮用蒸汽气提回收后返回反应系统。
反应生成的环己酮肟经过饱和浓度的硫铵母液干燥脱水。
环己酮肟在发烟H2SO4催化作用下经两级串联贝克曼重排器制得己内酰胺,用气氨在真空条件下进行中和反应,并利用反应热蒸发部分水分,同时(NH4)2SO4结晶从母液中分离出来。
己内酰胺精制过程有萃取、蒸馏,流程较短。
图1 SNIA工艺Fig.1 SNIAtechnic该工艺可以避免羟胺制备过程中生成(NH4)2SO4,因而该工艺技术被迅速推广,BASF公司也成为目前世界上最大的己内酰胺生产商,现生产能力为1015kt a,占世界己内酰胺总生产能力的19.00%,生产装置分布在美国、德国和比利时。
工艺路线见图2。
-1在SNIA工艺制备己内酰胺中,含己内酰胺60%左右的酰胺油先经NH3 H2O苛化,然后经甲苯萃取、水萃取制成30%的己内酰胺水溶液。
己内酰胺水溶液经KMnO4氧化和过滤、三效蒸发、脱水浓缩、预蒸馏、NaOH处理和蒸馏、轻副产物蒸馏和精馏、重副产物蒸馏和精馏等精制过程,才能得到符合标准的纤维级己内酰胺成品。
1999年,中国石化石家庄化纤责任有限公司采用意大利SNIA公司甲苯法生产技术,耗资35亿-1元,建成一套生产能力为50kt a的己内酰胺生产装置,2002年与中国石化科学研究院合作开发并应用非晶态镍催化剂引入苯甲酸加氢反应系统部分取代Pd/C催化剂以及己内酰胺水溶液加氢取代KMnO4工艺技术,将生产能力扩建到70kt a。
尽管SNIA工艺为己内酰胺生产提供了新的原料路线,采用甲苯为原料,不经过环己酮肟直接生产己内酰胺,但酰胺化反应过程条件苛刻,收率较低,生成的副产物成分复杂,每生产1t己内酰胺副产3.8t(NH4)2SO4。
而且工艺精制过程存在流程长、工艺控制复杂、能耗大、产品质量不稳定、优级品率低的问题,投资大,生产设备高度专业化,难以转换用途。
己内酰胺生产工艺

己内酰胺生产工艺己内酰胺的三种工业化技巧:液相Beckmann重排法苯→环己烷→环己酮→环己酮肟→粗己内酰胺→产品羧酸酰胺化法甲苯→苯甲酸→环己烷羧酸→粗己内酰胺→产品 光亚硝化法苯→环己烷→粗己内酰胺→产品苯甲酸加氢制备亚硝基硫酸己内酰胺caprolactam(简称CPL)分子式:C6H11NO 分子量:133.16构造式:常温下轻易吸湿,有柔弱的胺类刺激气味,手触有润滑感,易溶于水、甲醇、乙醇、乙醚、石油烃、环己烯、氯仿和苯等溶剂。
受热时易产生聚合反响。
不合制程方法比较1.传统制程:本制程是由环己酮与(NH2OH)2-H2SO4和氨水反响得环己酮圬(cyclohexanone oxime)后,再经贝克曼重排反响(Beckmann rearrangement)而制成CPL。
传统法的理论产率约70%(以环己烷为基准),即每消费1公斤的环己烷可生成0.94公斤的CPL;若以苯酚为基准,理论产率达92%,即每消费1公斤苯酚可至得1.11公斤CPL。
2.BASF制程:CH3+3/2O2COOH+H2OCoCOOH+3H2Pd/C HCOOH 2NH3+3O2N2O3+3H2ON2O3+H2SO4+SO32NOHSO4Pt/RhBASF制程和传统制程的不合处在于制造(NH2OH)2-H2SO4的方法不合,本制程是由一氧化氮、硫酸、氢气经触媒感化所获得(NH2OH)2-H2SO4。
此种制程所得CPL的产率理论值约70%,平均每消费1公斤环己烷可生成0.94公斤的CPL。
3.SNIA VISCOSA制程:SNIA VISCOSA制程是是以甲苯为原料,经氧化、氢化等反响得HBA(Hexahydrobenzoic acid),再制得CPL。
此法的理论产率为72%;即每消费1公斤的甲苯可产生0.89公斤的CPL。
此外,Inventa-NO Reductin制程和BASF制程相当类似;DSM/HPO制程为传统的改进。
己内酰胺结晶纯化方法与相关技术

本技术介绍了一种己内酰胺结晶纯化方法。
将环己酮肟液相重排或液相溶剂重排或气相重排过程得到的酰胺油经过硫酸铵脱除、己内酰胺降温结晶、重结晶、晶体处理、结晶母液后处理等过程,得到高纯度的己内酰胺固体产品、尼龙切片产品、己内酰胺液态产品。
本技术采用降温结晶、蒸发蒸馏分离、萃取分离等集成技术,取代或部分取代原有工艺中苯萃取、水反萃取、离子交换、加氢等工序,降低了废水排放量,流程短,降低了能耗,可生产出品质较高的己内酰胺固体产品。
技术要求1.一种己内酰胺结晶纯化方法,其特征在于包括以下步骤:(1)脱除硫酸铵将环己酮肟液相重排或液相溶剂重排所得到的酰胺油进行蒸发,脱除低沸点物质,得到硫酸铵结晶液,将硫酸铵结晶液进行离心分离,得到副产物硫酸铵和结晶母液;(2)己内酰胺降温结晶向步骤(1)得到的结晶母液或环己酮肟经气相重排所得到的酰胺油中加入纯水,使结晶母液或酰胺油中的己内酰胺溶解到纯水中,进行膜过滤预处理除去固体杂质,然后进行降温结晶,己内酰胺晶体析出,得到己内酰胺结晶液,然后进行离心分离,得到己内酰胺晶体和一级结晶母液;(3)己内酰胺重结晶将步骤(2)得到的一级结晶母液进行蒸发,脱除水和轻相杂质,蒸发温度100~105℃,压力为常压,当蒸发器中己内酰胺的浓度>95%时,完成蒸发过程,得浓缩液,将浓缩液进行膜过滤预处理除去固体杂质,然后送入结晶罐进行降温结晶,析出己内酰胺晶体,得到己内酰胺重结晶液,经离心分离后得到己内酰胺晶体和二级结晶母液;(4)己内酰胺晶体处理将步骤(2)和步骤(3)得到的己内酰胺晶体进行干燥处理,得到纯度为大于99.98%的己内酰胺固体产品;或者,将步骤(2)和步骤(3)得到的己内酰胺晶体送入聚合装置,得到尼龙切片产品;(5)结晶母液后处理将步骤(3)得到的二级结晶母液进行蒸发脱水,脱水后的液体经蒸馏分离出气态己内酰胺,气态己内酰胺经冷凝后得到液态粗品己内酰胺回到步骤(3)中的降温结晶罐中,蒸馏后剩余的高沸点物质进行焚烧处理;或者,向步骤(3)得到的二级结晶母液中加入萃取剂苯进行苯萃取,二级结晶母液中的己内酰胺溶解到溶剂苯中,搅拌,静置分层后得到己内酰胺的苯溶液和含杂质的水溶液,再向己内酰胺的苯溶液中加入纯水进行水反萃取,搅拌,静置分层后得到己内酰胺的水溶液和含有机杂质的苯溶液,向含有机杂质的苯溶液中加入纯水进行水洗除去水溶液杂质后进行苯蒸馏,蒸出的苯经冷凝后作为萃取剂循环使用,苯蒸馏后的釜底液进行焚烧处理;己内酰胺的水溶液经蒸发脱水后进行蒸馏得到纯度大于99.98%的己内酰胺液态产品,蒸馏后的残液返回至苯萃取过程中;(6)脱除水的处理将步骤(1)蒸发出的水和轻相杂质或者步骤(3)一级结晶母液蒸发的水和轻相杂质或者步骤(5)苯萃取和水洗后得到的含杂质的水溶液经生化处理后达标排放;步骤(5)二级结晶母液蒸发的水或步骤(5)己内酰胺水溶液蒸发的水回用到己内酰胺原生产工艺中。
实验十一已内酰胺的制备

实验⼗⼀已内酰胺的制备实验⼗⼀已内酰胺的制备⼀、实验⽬的1. 掌握贝克曼重排制备已内酰胺的原理和⽅法2. 进⼀步熟悉重结晶等基本操作⼆、实验原理已内酰胺是⼀种重要的有机化⼯原料,它是⽣产尼龙-6纤维(即锦纶)和尼龙-6⼯程塑料的单体,在汽车、纺织、电⼦、机械等众多领域具有⼴泛应⽤。
尼龙-6⼯程塑料主要⽤于⽣产汽车、船舶、电⼦器件和⽇⽤消费品等构件;尼龙-6纤维则可制成各种纺织品;此外,已内酰胺还可⽤于⽣产L-赖氨酸、⽉桂氮卓酮等⼯业品。
已内酰胺可以通过环已烷、苯酚、甲苯等为原料来进⾏合成,⽽⽬前世界上80%的已内酰胺都是以环已烷为原料,通过环已酮肟发⽣的贝克曼重排反应来合成的。
其反应式如下:酮肟在酸性催化剂如硫酸、多聚磷酸以及能产⽣强酸的三氯化磷、五氯化磷、苯磺酰氯和氯化亚砜等试剂作⽤下,重排成酰胺的反应称为贝克曼(Beckmann)重排,反应机理如下:研究表明,酮肟⾸先在酸的催化作⽤下发⽣羟基的质⼦化,帮助羟基离去。
离去基团与迁移基团处于反式,基团的离去与基团的迁移是同步进⾏的,迁移基团在迁移前后构型不变。
已内酰胺常温下容易吸湿,具有微弱的胺类刺激性⽓味。
易溶于⽔、醇、醚、烷烃、氯仿和芳烃等溶剂。
受热易发⽣聚合反应。
纯的已内酰胺为⽩⾊晶体或结晶性粉末,mp 69~71 o C。
已内酰胺的红外光谱图三、仪器与试剂仪器:三⼝烧瓶,恒压滴液漏⽃,布⽒漏⽃,分流漏⽃试剂:环已酮肟2.00 g(17.7 mmol),85% 硫酸3.0 mL,20% 氨⽔,⼆氯甲烷,⽯油醚,⽆⽔硫酸镁,活性炭四、物理常数五、实验步骤1.已内酰胺的合成在50 mL三⼝烧瓶中加⼊2.00 g环已酮肟,3.0 mL 85%的硫酸,摇匀。
在⼩⽕上慢慢加热[1],⾄有⽓泡产⽣(约120 o C),⽴即将⽕移开,反应剧烈放热,温度很快⾃⾏上升(可达160 o C),反应在⼏秒内即完成。
稍冷,装上温度计和恒压滴液漏⽃,并在冰盐浴中冷却。
己内酰胺生产技术

本文摘自再生资源回收-变宝网()己内酰胺生产技术1943年,德国法本公司通过环己酮-羟胺合成(现在简称为肟法),首先实现了己内酰胺工业生产。
随着合成纤维工业的发展,先后出现了甲苯法(ANIA法),光亚硝化法(PNC法),己内酯法(UCC法)、环己烷硝化法和环己酮硝化法。
正在开发的环己酮氨化氧化法,由于生产过程中不需采用羟胺进行环己酮肟化,且流程简单,已引起人们的关注。
1.肟法首先将高纯度的环己酮与硫酸羟胺在80-110℃下进行缩合反应生成环己酮肟。
分离出来的环己酮肟以发烟硫酸为催化剂,在80-110℃经贝克曼重排转位为粗己内酰胺,粗己内酰胺通过萃取、蒸馏、结晶等工序,制得高纯度己内酰胺。
肟法的原料环己酮可由苯酚加氢得环己醇,再脱氢而得;或由环己烷空气氧化生成环己醇与环己酮,分离后的环己醇催化脱氢也生成环己酮。
2.甲苯法甲苯在钴盐催化剂作用下氧化生成苯甲酸,苯甲酸用活性炭载体上的钯催化剂进行液相加氢生成六氢苯甲酸,在发烟硫酸中,六氢苯甲酸与亚硝酰硫酸反应生成己内酰胺。
甲苯法由于甲苯资源丰富,生成成本低,具有一定的发展前途。
3.光亚硝化法环己烷在汞蒸气灯照射下与氯亚硝酰发生光化学反应,直接转化成环己酮肟盐酸盐,环己酮肟盐酸盐在发烟硫酸存在下,通过贝克曼重排转化为己内酰胺。
4.苯酚法苯酚在镍催化剂存在下加氢,制得环己醇,提纯后脱氢得粗环己酮。
环己酮提纯后与羟胺反应得到环己酮肟,再经贝克曼移位生成己内酰胺、反应产物中的硫酸用氨中和得副产物硫胺。
粗己内酰胺经一系列化学与物理处理得到纯己内酰胺。
更多己内酰胺相关资讯,请持续关注变宝网资讯中心。
本文摘自变宝网-废金属_废塑料_废纸_废品回收_再生资源B2B交易平台网站;变宝网官网网址:/newsDetail385709.html网上找客户,就上变宝网!免费会员注册,免费发布需求,让属于你的客户主动找你!。
己内酰胺生产工艺

己内酰胺的三种工业化技术:液相Beckmann 重排法苯 → 环己烷 → 环己酮 → 环己酮肟 →粗己内酰胺 → 产品羧酸酰胺化法甲苯 → 苯甲酸 → 环己烷羧酸 → 粗己内酰胺→产品光亚硝化法苯 → 环己烷 → 粗己内酰胺 → 产品苯甲酸加氢制备亚硝基硫酸己内酰胺 caprolactam (简称CPL )分子式:C 6H 11NO 分子量:133.16结构式:己内酰胺是ε-氨基己酸H 2N(CH 2)5COOH 分子内缩水而成的内酰胺,又称ε-己内酰胺,它一种重要的有机化工原料,是生产尼龙—6纤维(即锦纶)和尼龙—6工程塑料的单体,可生产尼龙塑料、纤维、及L-赖氨酸等下游产品。
它常温下为白色晶体或结晶性粉末。
熔点(CH 2)5CONH69~71℃,沸点139℃(12毫米汞柱)、122~124℃(665Pa)、130℃(1599Pa)、165~167℃(2247Pa)。
比重:1.05(70%水溶液),熔化热:121.8J/g ,蒸发热:487.2J/g 。
纯己内酰胺的凝固点为69.2℃,在760mmHg 时沸点为268.5℃,85℃下密度1010kg/m3。
在20℃水中溶解度为100g 水溶解82g 己内酰胺。
受热时起聚合反应,遇火能燃烧。
常温下容易吸湿,有微弱的胺类刺激气味,手触有润滑感,易溶于水、甲醇、乙醇、乙醚、石油烃、环己烯、氯仿和苯等溶剂。
受热时易发生聚合反应。
己内酰胺的制法主要有:①以苯酚为原料,经环己醇、环己酮、环己酮肟而制得;②以环己烷为原料,用空气氧化法或光亚硝化法转化成环己酮肟,经重排CH 3+3/2O 2COOH +H2O Co COOH +3H2Pd/C H COOH 2NH 3+3O 2N 2O 3+3H2O N 2O 3+H 2SO 4+SO 32NOHSO 4Pt/Rh而制得;③以甲苯为原料,用斯尼亚法合成。
此外,也可以糠醛或乙炔为原料合成。
在制造过程中,环己酮(cyclohexanone)是主要的关键性中间原料,此关键性原料可藉由环己烷氢化或苯酚氢化得到,这两种制程相当类似,不同点仅在于触媒的使用和操作条件的不同而已。
己内酰胺生产工艺

己内酰胺生产工艺己内酰胺生产工艺比较1 己内酰胺发展历程,1899年,德国学者S.Gabriel和T.A.Mass首次加热「氨基己酸获得了己内酰胺。
未工业应用。
,1900年,O.Wallach利用贝克曼(Beckmann)重排转位反应,在硫酸中加热环己酮肟获得己内酰胺。
, 1937 年,德国I.G.Farben 公司P.Schlack 开创了己内酰胺生产和应用的新纪元,以氨基己酸盐为催化剂,使己内酰胺开环聚合,聚合体纺得纤维的商品名为Perlon., 二次大战期间,德国建设了一些工业装置,生产聚酰胺6 纤维,主要用在军事工业上。
(采用苯酚为原料加氢制的环己醇,再脱氢得环己酮,再和羟胺硫酸盐反应生成环己酮肟,转位生成己内酰胺), 二次大战后,I.G.Farben 公司公开技术,各国的公司纷纷建设己内酰胺装置,到1960年,世界己内酰胺产量达到180kt。
, 50 年代后期,陆续开发了多种己内酰胺生产工艺。
随着石油苯的快速发展以苯为原料,加氢制得环己烷,氧化得环己醇、环己酮的工艺成为生产己内酰胺的主要方法。
2 己内酰胺生产工艺己内酰胺生产方法可以归纳为以下4 类:(1) 苯加氢制环己烷,环己烷氧化制环己酮,再与羟胺肟化生成环己酮肟,经Beckma nn重排得己内酰胺。
(2)苯酚加氢制环己酮,经肟化、重排得己内酰胺。
(3) 甲苯氧化制苯甲酸,加氢的环己烷羧酸,与亚硝酰硫酸反应生成己内酰胺。
⑷环己烷与亚硝酰氯发生光亚硝化反应生成环己酮肟,经Beckmann重排得己内酰胺。
其具体生产工艺如下表所示:己内酰胺生产工艺生产工艺生产原理厂家优势劣势苯酚法( 传统法) 苯酚加氢制得环己醇,环己醇脱氢成环德国I.G.Farben 公司在副产经济价值较低的硫铵,大约己酮每生产1t 己内酰胺副产4.4t 硫铵。
硫酸羟胺法氨氧化制氧化氮,氨水依次吸收二氧化美国霍尼韦尔技术成熟、运转稳定,易操氨消耗大,副产硫铵多,1t 己内酰环己酮羟(HSO) 氮、氧化氮得到羟胺二磺酸盐,经加热日本宇部兴产公司作; 不需要贵重金属催化剂胺同时副产4.4t 硫铵; 胺法(根水解即得硫酸羟胺。
Beckmann重排
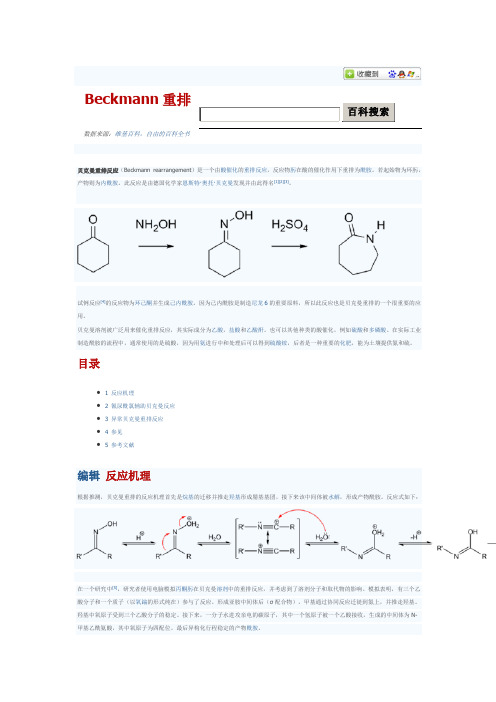
Beckmann 重排数据来源:维基百科,自由的百科全书贝克曼重排反应(Beckmann rearrangement )是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名[1][2][3]。
试例反应[4]的反应物为环己酮并生成己内酰胺。
因为己内酰胺是制造尼龙6的重要原料,所以此反应也是贝克曼重排的一个很重要的应用。
贝克曼溶剂被广泛用来催化重排反应,其实际成分为乙酸,盐酸和乙酸酐。
也可以其他种类的酸催化,例如硫酸和多磷酸。
在实际工业制造酰胺的流程中,通常使用的是硫酸,因为用氨进行中和处理后可以得到硫酸铵,后者是一种重要的化肥,能为土壤提供氮和硫。
目录∙ 1 反应机理∙ 2 氰尿酰氯辅助贝克曼反应∙ 3 异常贝克曼重排反应∙ 4 参见∙ 5 参考文献编辑 反应机理根据推测,贝克曼重排的反应机理首先是烷基的迁移并推走羟基形成腈基基团,接下来该中间体被水解,形成产物酰胺。
反应式如下:在一个研究中[5],研究者使用电脑模拟丙酮肟在贝克曼溶剂中的重排反应,并考虑到了溶剂分子和取代物的影响。
模拟表明,有三个乙酸分子和一个质子(以氧鎓的形式纯在)参与了反应。
形成亚胺中间体后(σ配合物),甲基通过协同反应迁徙到氮上,并推走羟基。
羟基中氧原子受到三个乙酸分子的稳定。
接下来,一分子水进攻亲电的碳原子,其中一个氢原子被一个乙酸接收,生成的中间体为N-甲基乙酰氨酸,其中氧原子为四配位。
最后异构化行程稳定的产物酰胺。
当计算对象是一个水合氢离子和六分子水的时候,结果相同。
但是当移动基团为苯基的时候,例如在苯乙酮肟的重排反应中,反应更倾向于生成三元π-配合物。
此配合物在对H3O+(H2O)6的研究中没有发现。
在环己酮肟的例子中,因为要释放环张力,所以有了第三种反应机理。
它是通过一步协同反应步骤直接生成质子化的己内酰胺,而没有π-配合物或σ-配合物中间体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•2.环己酮肟重排制备己内酰 •在小烧杯加入6 mL冷水,在冷水浴冷却下小 心地慢慢加入8 mL浓硫酸,配得70%的硫酸溶 液。在另一小烧杯中加入7g干燥的环己酮肟, 用7 mL70%的硫酸溶解后,转入滴液漏斗,烧杯用1.5 mL70 %硫酸洗涤后并入滴液漏斗。在一250 mL烧杯中加入4.5 mL70%硫酸,用木夹夹住烧杯,用小火加热至130~135℃,缓 缓搅拌,保持130~135℃,边搅拌边滴加环己酮肟溶液,滴完 后继续搅拌5~10min。反应液冷却至80℃以下,再用冰盐浴冷 却至0~5℃。在冷却下,边搅拌边小心地通过滴液漏斗滴加浓 氨水(约25 mL)至pH=8。滴加过程中控制温度不超过20℃。 用少量水(不超过10 mL)溶解固体。反应液倒入分液漏斗, 用二氯甲烷萃取三次,每次10 mL。合并有机层并用等体积水 洗涤两次后,用无水Na2SO4干燥后,常压蒸馏除去二氯甲烷。 残液转移到锥形瓶中,将锥形瓶在温水浴温热下,在通风柜 中浓缩至5mL左右,放置冷却,析出白色结晶。进行重结晶。
+
上面的反应式说明肟重排时,其结果是羟基与处于反位的基团对调位置。
贝克曼重排反应不仅可以用来测定酮 的结构,而且有一定的应用价值。如 环已酮肟重排得到已内酰胺,后者经 开环聚合得到尼龙-6。己内酰胺是一 种重要的有机化工原料,己内酰胺主 要用于制造尼龙—6,也用作医药原料等。
O + H2NOH OH N
【数据处理与结论】
•1.环己酮肟为白色固体,熔点为 80~90℃,产量为7~7.5g。 •2.已内酰胺为无色或白色晶体,熔点 69~70℃,产量为4~5g。
【注意事项】
•1.与羟胺反应时温度不宜过高。加完环己酮以后,充分摇 荡反应瓶使反应完全,若环己酮肟呈白色小球状,则表示反 应未完全,需继续振摇。 •2.配制70%硫酸溶液时是将酸倒入水中,绝不可搞错。因 放热强烈,必须水浴冷却。 •3.重排反应很激烈,并要保持温度在130~135℃,滴加过程 中必须一直加热。温度均不可太高,以免副反应增加。 •4.用氨水中和时会大量放热,故开始滴加氨水成尤其是要 放慢滴加速度。否则温度太高,将导致酰胺水解。 •5.已内酰胺也可用重结晶方法提纯:将粗产物转入分液漏 斗,每次用10mL四氯化碳萃取3次,合并萃取液,用无水硫 酸镁干燥后,滤入一干燥的锥形瓶。加入沸石后在水浴上蒸 去大部分溶剂,直到剩下8mL左右溶液为止。小心向溶液加 入石油醚(30~60℃),到恰好出现混浊为止。将锥形瓶置于 冰浴中冷却结晶,抽滤,用少量石油醚洗涤结晶。如加入石 油醚的量超过原溶液4-5倍仍未出现混浊,说明开始所剩下 的四氯化碳量太多。需加入沸石后重新蒸去大部分溶剂直到 剩下很少量的四氯化碳时,重新加入石油醚进行结晶。
OH N
H2SO4(浓)
N
OH 20% NH3-H2O
H N
O
【仪器与试剂】
•1.仪器:锥形瓶(250 mL)、烧杯(100 mL,250 mL)、滴液漏斗(50 mL)、温度计(300℃)、 分液漏斗(125 mL)、圆底烧瓶(100 mL)、克氏蒸 馏头(19*4)、直型冷凝管(19*2)、布氏漏 斗(60mm)、吸滤瓶(250 mL)。 •2.试剂:环己酮、羟胺盐酸盐、无水醋酸钠、 浓硫酸、浓氨水、氯仿、无水硫酸钠。
基础实验
实验二十九
Beckmann反应-己内酰胺的制备
【实验目的】
•1.由环己酮与羟胺反应合成环 己酮肟。 •2.环己酮肟在酸性条件下发生 Beckmann重排,生成己内酰胺。 •3.用减压蒸馏提纯己内酰胺粗 产品。
【实验原理】
酮与羟胺作用生成肟:
R' C R'' O + HN2OH R'' R' C NOH + H 2O
【思考题】
1在制备环己酮肟时,为什么要加入醋酸钠? 2.如果用氨水中和时,反应温度过高,将 发生什么反应? 3.某肟发生Beckmann重排后得到一化合物, 试推测该肟的结构?
O C H NHCH C 4.反式甲基乙基酮肟
3 7 3
N H 3C
OH C 2H 5
经Beckmann重排得到什么产物?
C
【实验步骤】
•1.环己酮肟的制备 •在250 mL锥形瓶,加入7g羟胺盐酸盐和10g无水醋 酸钠,用30mL水将固体溶解,小火加热此溶液至 35~40℃。分批慢慢加入7g环己酮,边加边摇动反应 瓶,很快有固体析出。加完后用橡皮塞塞住瓶口, 并不断激烈振荡瓶子5~10min。环己酮肟呈白色粉状 固体析出。冷却后,抽滤,粉状固体用少量水洗涤、 抽干后置身培养皿中干燥,或在50~60℃下烘干。
肟在酸性催化剂如硫酸、多聚磷酸、 苯磺酰氯等作用下,发生分子重排 生成酰胺的反应称为贝克曼重排反 应。反应历程如下:
R' C R'' R' C + N R'' R' C O NHR'' H2O R' + H2O C N R'' HO - H+ R' C N R'' N OH H+ R' C R'' N + OH2 - H2O R' C R'' N
