第十三章 伏安和极谱法
极谱分析法和伏安分析法优秀课件

E E O 0.059 lg A (id i) / k A
n
B (i) / kB
E O 0.059 lg ( AkB id i )
n
BkA i
E' 0.059 lg ( id i )
n
i
当i=1/2id时的电位即为半波电位
E=E’ 即电极电位与浓度无关,故可利 用半波电位进行定性分析
n 减小措施
加入大量的支持电解质
(3)极谱极大
n 现象 n 产生的原因
溪流运动
n 消除方法
加入小量极大抑制剂 (表面活性剂)
(4) 氧波与氢波
(5) 其他概念: 可逆与不可逆波 氧化波与还原波
Ø 可逆波: 电流只受扩散控制 Ø 不可逆波: 电流受扩散速度和 电极反应速度控制
Ø还原波(阴极波)(电 流为正)
Id正比于c的条件
依据公式: id =K c 可进行定量计算。
极限扩散电流 由 极谱图上量出, 用波高 直接进行计算。
(3) 应用方法
直接比较法 标准曲线法 标准加入法
cx
hx hs
cs
hX Kcs
H K (VX cX Vscs ) VX VS
cX
(VS
VS cS hX VX )H VX hX
③ 电流急剧上升阶段 这在半波电位附近
④ 极限扩散区
此时达到极限电流值, 称为极限电流。
C0 0
i C C0
δ→常数, id= kC , id 称为极限扩散电流
(3)涉及概念
极化 浓差极化及形成条件
极化电极A小,反应离子数/单位面积 大,Cs→0
C低 静止
极化电极与去极化电极
Zn2+
伏安法

伏安法与极谱法
伏安法:使用表面静止的液体或固体电极为工作电极,
测定电解过程的i-V曲线。
极谱法:使用滴汞电极或其它表面能够周期性 更新的 液体电极为工作电极,属伏安法的一种。 前提:①浓差极化 ②电极反应极快
极谱分析(特殊电解):不要搅拌,要加支持电解质,
以保证浓差极化。非电化学极化,是以电解为
③电解电流小(A级)。
返回
三个疑问??? ①.Why有上述特殊点? ②极谱波形为何是“S”? ③极谱图为何可以定量? 二.极谱过程的特殊性
目的:使甘汞电极→去极化电极(E不随外加电压而改变)
使滴汞电极→极化电极(E随外加电压而改变)
保证电解过程是浓差极化过程。
1.电极的特殊性
①参比电极-电位应保持恒定,但如何保持?
①灵敏度高 可测10-5mol/L的物质,近代极谱法可测
10-11mol/L
②准确度高 相对误差1-5%
③应用广
可直接测无机物、600多种有机物
④速度快、易自动化 缺点:使用了具有挥发性的毒物--汞
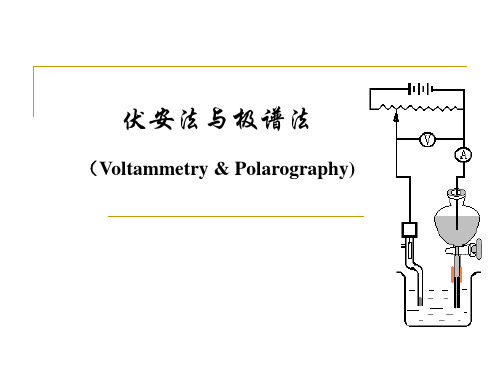
§1.极谱分析的基本原理 一.极谱的装置 极谱--特殊的电解 特殊: ①参比面积大、滴汞面积小;
②不搅拌,加大量支持电解质;
解:使用小面积的极化电极如滴汞电极或微铂电极,
溶液保持静止(不搅拌) 2.在极谱分析中所用的电极,为什么一个电极的面 积应该很小,而参比电极则应具有大面积? 解:一个电极的面积做得很小,是为了使其成为极化 电极,电极上具有较高的电流密度,以保证浓差极化。 使用大面积汞池作参比电极,是为了使其去极化,即
(vs.SCE)以前无H2↑(H2的标准电位0V);汞能与许多 金属形成汞齐,使他们的分解电压降低; ② 滴汞面积小,很快可达浓差极化; ③ 汞滴不断下落,使电极表面不断更新,重复性好;
伏安和极谱
迁移电流
电解质中阴、阳离子的静电引力或排斥力,向电极表 面移动而产生的电流
消除方法:加入大量支持电解质
三)极谱极大
定义:在极谱分析中电流随滴汞电极电位的增加迅速。
极谱极大影响半波 电位和极谱扩散电流的 测定 消除方法:可采用加入 少量表面活性物质
(四)氧波
a.为了更好地消除iR降的影响,目前多数仪 器使用三电极系统;
b. 极谱波呈S型锯齿状。
极谱分析特点∶
1.由于汞滴不断下落,电极表面不断更新。具有较高 的再现性。 2.氢在汞电极上的过电位比较高,滴汞电极电位负到 1.20V还不会有氢气析出,可在酸性溶液中测定很多物质。 3.汞是液态金属,具有均匀的表面,能与许多金属形 成汞齐,使其在滴汞电极上的析出电位变正,因而在碱 性溶液中,可测定碱金属和碱土金属离子。 4.可以进行多元素同时测定。在合适的条件下可以一 份试液中同时测定几种元素。
氧在水或溶液中的溶解度约为10-20mg.L-1,溶解氧易在
滴汞电极上还原,产生干扰 第一个波 O2+2H++2e=H2O2 酸性溶液
第二个波
H2O2 +2H++2e= 2H2O
酸性溶液
O2的两个极谱波的E1/2分别是-0.2V及-0.8V,由于氧波的 波形倾斜,延伸很长,影响许多物质的极谱测定。必须除 去溶解氧 除氧方法:1、通气法 2、亚硫酸钠法
2、特点
伏安和极谱分析法是一种特殊电解的分析方法,它是 以小面积电极作工作电极与大面积的参比电极组成电解池,
电解待测物质的稀溶液,根据所得的电流电压曲线进行分
析的方法。
是在电压连续变化的条件下的电解,研究电解过程中I~
E变化规律 电解过程中电流非常小(10-6~10-8A)。
13 伏安和极谱法

第十三章伏安和极谱法Voltammetry and Polarography什在伏安法的工作电极是电解过程中表面不能更新的固定液态或固态电极,如悬汞如悬汞、、汞膜汞膜、、玻璃碳玻璃碳、、铂电极等铂电极等;;――极谱法的工作电极是表面能周期性更新的液态电极,即滴汞电极即滴汞电极。
(。
(。
(有的书把两者统有的书把两者统称为极谱法称为极谱法))极谱1922年,捷克学者海洛夫斯基(Heyrovsky Heyrovsky))首先提出极谱分析法首先提出极谱分析法,,开创了这一电分析化学的分支创了这一电分析化学的分支;;1925年,海洛夫斯基与日本学者志方益三研制出第一台手工操作式的极谱仪研制出第一台手工操作式的极谱仪,,画出第一张极谱图画出第一张极谱图;;年,海洛夫斯基因发明和发展了极谱分析法而获得诺贝尔化学奖;2020世纪世纪世纪,,六、七十年代以来七十年代以来,,理论研究及应用得到迅速发展研究及应用得到迅速发展,,各种新技术、新方法不断出现新方法不断出现。
伏两大类:•控制电位极谱法――――如直流极谱法如直流极谱法如直流极谱法,,单扫描极谱法扫描极谱法,,脉冲极谱法脉冲极谱法,,方波极谱法,催化极谱法催化极谱法,,溶出伏安法等溶出伏安法等。
•控制电流极谱法――――如计时极谱法如计时极谱法如计时极谱法,,交流示波极谱法等(本课程介绍控制电位极谱法,且主要是直流极谱法)1、直流极谱法的测量浓度范围为10-2~10-5mol ·L -1,即灵敏度一般即灵敏度一般,,采用其他新技术新技术,,可以获得较高的灵敏度可以获得较高的灵敏度,,脉冲极谱法检测限可达10-9mol ·L -1;2、准确度高准确度高,,重现性好重现性好,,相对误差一般在2%以内以内;;3、试液可以连续反复使用;5、应用比较广应用比较广,,仪器较为简单仪器较为简单、、便宜便宜,,凡能在电极上起氧化凡能在电极上起氧化――还原反应的有机或无机物均可采用无机物均可采用,,有的物质虽不能在电极上反应上反应,,但也可以间接测定但也可以间接测定。
《极谱与伏安分析法》课件

感谢您的观看
THANKS
压曲线。
根据电流-电压曲线计算 被测物质的浓度或含量
。
对实验结果进行误差分 析和可靠性评估。
03
伏安分析法基础
伏安分析法的原理
1
伏安分析法是一种电化学分析方法,通过测量电 流随电位变化的关系来研究电极反应过程。
2
伏安分析法的基本原理是电位控制下的电流测量 ,通过改变电极电位来观察电流的变化,从而获 取有关电极反应的信息。
阶梯伏安法
将电极电位分成多个阶梯,并在每 个阶梯上保持恒定电位,测量相应 的电流响应,从而研究电极反应过 程。
伏安分析法的实验操作
组装实验装置
将电极、导线、电解池等仪器 组装在一起,确保连接牢固、 导电良好。
实验操作
设定合适的电位范围和扫描速 率,开始进行伏安实验,记录 电流随电位变化的曲线。
准备实验仪器和试剂
详细描述
极谱与伏安分析法在生物医学领域的应用研究涉及药物代谢、疾病诊断、生物分子检测等多个方面。 通过电化学手段对生物体内的物质进行检测,能够为药物研发、疾病诊断和治疗提供有力支持。
06
结论
总结极谱与伏安分析法的知识要点
极谱分析法
是一种电化学分析方法,通过在电解过 程中测量电流-电压曲线来研究物质的 电化学性质。
采用脉冲电压进行电解,提高了灵敏度和分辨率,适用于痕量
物质的分析。
交流极谱法
03
通过测量电解过程中的交流电流来分析物质,能够消除背景电
流的干扰,提高准确性。
极谱分析法的实验操作
实验前准备
实验操作
数据处理
结果分析
选择适当的电极和电解 液,准备好实验仪器和
试剂。
将电极浸入电解液中, 施加电压并记录电流-电
极谱与伏安分析法

交流极谱分析过程与极谱图
(1) 在图中 A 点,直流电压叠加 交流电压仍达不到被测物质的析出 电位。无交流电解电流产生; (2)当直流电压达到被测物质的析 出电位后,叠加交流电压将产生交 流电解电流; (3)在曲线的 B 点(半波电位)交流 电流的振幅最大;
(4)在图中 C 点,叠加交流电压不 能使扩散电流产生变化. 交流极谱产生峰型信号
05:16:40
三、方波极谱分析
square-wave polarography
1. 原理
充电电流限制了交流极谱灵 敏度的提高。将叠加的交流正弦 波改为方波,使用特殊的时间开 关,利用充电电流随时间很快衰 减的特性,在方波出现的后期, 记录交流极化电流信号。峰电流:
i p Kn AD V0 c
05:16:40
2.交流极谱的峰电流方程式与特点
对可逆反应: Ox + ne Red
n2 F 2 ip AD1/ 2 1/ 2 V0 c 4 RT
交流电压的角频率;
V0 交流电压的振幅;
特点: (1) 灵敏度比直流极谱稍高; (2) 分辨率比直流极谱高,峰电 位差40 mV可分辨。 (3) 氧的干扰小。
05:16:40
dE /dt -E 曲线
交流示波极谱滴定法测定 Zn2+
开始时,溶液中Zn2+发生电解反应, dE /dt -E 曲线上对 称出现切口, 滴加EDTA标准溶液,生成Zn-EDYA配合物,浓 度减小,切口变小,切口消失时,到达滴定终点。 可进行多种金属离子的连续滴定。以Zn2+为指示离子采
(3) 电容电流的补偿
扫描电压 和电极面积变 化,导致产生 电容电流 ( 10-7 A,相 当于10-5mol的 物质产生的电 流)。
伏安和极谱分析法

电极上的电压,并记录电流的
变化——绘制i-U曲线。如左
图所示。例如:当以100-200 mV/min的速度对盛0.5mol/L CdCl2溶液施加电压时,记录 电压U对电流i的变化曲线。
-:未达分解电压U分,随外加电压U外的增加,只有一微小电流通过电
解池——残余电流ir
②-③:继续施加电压,达到Cd2+的分解电压后,滴汞表面的Cd2+便开始还 原,随即形成Cd(Hg),产生电解电流
因此只要测量波高就可求出C 1)、平行线法 通过极谱法的残余电流 部分和极限电流部分作两条 平行线,两线间的垂直距离h, 即为波高:
2)、三切线法 通过残余电流、极限电流和扩 散电流部分分别作三条切线:相交 于O和P点,过O点与P点作二条与横 坐标平行的平行线,两线间的垂直 距离为波高:此法方便,适用于不 同的波形,故应用广泛。
④-⑤:外加电压继续增加,C0趋近于0, (C-C0)趋近于C时,这时电流不再增加,达 到一个极限值──极限电流il,极谱波出现 一个平台,极限电流与残余电流之差称为 极限扩散电流id,也叫波高。 即: id =il-ir (极谱定量分析的基础) 并知: id = KC E1/2: 半波电位:扩散电流为极限扩散电流一 半时对应的电位 (极谱定性的依据).
伏安和极谱分析法
直流极谱法概述及极谱图
极谱定量分析基础 实验技术
新的极谱和伏安分析法
应用
一、什么是伏安和极谱分析法
伏安和极谱分析法是根据测量特殊形式电解过程中的电流― 电位(电势)或电流―时间曲线来进行分析的方法。是电分析化 学的一个重要分支。 1)采用一大一小的电极:大面积的去极化电极——参比电极;小 面积的极化电极; 2)电解是在静置、不搅拌的情况下进行。
伏安法和极谱法word版

第17章 伏安法和极谱法伏安分析法(voltammetry )是一种特殊形式的电解方法。
它以小面积的工作电极与参比电极组成电解池,电解被分析物质的稀溶液,根据所得到的电流-电压曲线(伏安图)来进行分析。
伏安分析法不同于近乎零电流下的电位分析法,也不同于溶液组成发生较大改变的电解分析法,由于其工作电极表面积小,虽有电流通过,但溶液组成基本不变。
它的实际应用相当广泛,凡能在电极上被还原或被氧化的无机和有机物质,一般都可用伏安法测定。
在基础理论研究方面,伏安法常用来研究化学反应机理及动力学过程,测定络合物的组成及化学平衡常数,研究吸附现象等。
在伏安分析法中,极化现象比较明显,所以得到的伏安图(voltammogram )又被称为极化曲线。
当用滴汞电极或其他液态电极作工作电极,其电极表面作周期性的更新时,伏安分析法又称为极谱法(polarography ),它是最早发现和最先开始使用的伏安法。
但近年来,由于循环伏安法的广泛使用,以及对汞蒸汽有毒的担心和汞电极在较正电位下容易氧化等因素的影响,使得滴汞电极的使用越来越少。
§17-1 物质的传递与扩散控制过程一、 物质的传递溶液中物质的传递(又称传质)有三种途径:对流、电迁移和扩散。
由于液体或气体的流动所造成的物质传递的现象称为对流传质;电迁移是在溶液内部有电场存在的情况下引起的带有电荷粒子i 的移动;扩散则是由于物质的浓度分布不均匀而引起的该物质自高浓度向低浓度方向的传递。
物质的传递速度可以用流量来表示,流量(Ⅱi)即单位时间内通过单位横截面积的物质的量。
若只考虑一维方向,即x 方向上,粒子i 的传质流量为:Ⅱi =c v i x ±i i x c u E 0- D .(dx dci ) (17-1)式中v x 是x 方向上对流的速度,c i 是粒子i 的浓度,E x 是电场强度,u i 0是离子淌度(“+”适用于带正电荷的离子,“-”适用于带负电荷的离子),D .为该粒子的扩散系数,负号表示扩散是从高浓度向低浓度方向进行的。
第13章极谱法与伏安法

定义: 定义: 伏安法和极谱法是一种特殊的电解方法。以小面积、 伏安法和极谱法是一种特殊的电解方法。以小面积、易极化的电 极作工作电极,以大面积、不易极化的电极为参比电极组成电解池, 极作工作电极,以大面积、不易极化的电极为参比电极组成电解池, 电解被分析物质的稀溶液,由所测得的电流- 电解被分析物质的稀溶液,由所测得的电流-电压特性曲线来进行定 性和定量分析的方法。当以滴汞作工作电极时的伏安法, 性和定量分析的方法。当以滴汞作工作电极时的伏安法,称为极谱法 ,它是伏安法的特例。 它是伏安法的特例。 伏安法-电位分析-电解分析区别 伏安法-电位分析-电解分析区别: 电位分析 电解分析区别:
极谱分析的特殊之处: 极谱分析的特殊之处: 1)采用一大一小的电极:大面积的去极化电极——参比电极;小面 )采用一大一小的电极:大面积的去极化电极 参比电极; 参比电极 积的极化电极; 积的极化电极; 2)电解是在静置、不搅拌的情况下进行。 )电解是在静置、不搅拌的情况下进行。 极谱分析的特点: 极谱分析的特点: 滴汞和周围的溶液始终保持新鲜──保证同一外加电压下的电流的重 滴汞和周围的溶液始终保持新鲜 保证同一外加电压下的电流的重 现和前后电解不相互影响。 现和前后电解不相互影响。 汞电极对氢的超电位比较大──可在酸性介质中进行分析 对SCE,其 汞电极对氢的超电位比较大 可在酸性介质中进行分析(对 可在酸性介质中进行分析 , 电位可负至-1.2V)。 。 电位可负至 滴汞作阳极时,因汞会被氧化,故其电位不能超过+ 滴汞作阳极时,因汞会被氧化,故其电位不能超过+0.4V。即该方法不 。 适于阴离子的测定。 适于阴离子的测定。 汞易纯化,但有毒,易堵塞毛细管。 汞易纯化,但有毒,易堵塞毛细管。
13.1 极谱分析与极谱图 一、极谱分析基本装置
仪器分析伏安与极谱课件

传质——前转化——电化学反应——后转化——新 相的生成
26
可逆波:电流只受扩散控制
不可逆波:电流受扩散速度和 电极反应速度控制
波形区别:由于反应慢,电极 上需有足够大电位变化时,才 有明显电流通过,因而不可逆 波形倾斜;
Note:当电极电位更负时,有明显电流通过,形成浓 差极化,不可逆波CD段亦可用作定量分析。
由于,Hx+s与Vs成线性关系。如图所示,延长直 线交于横坐标(负值),则
34
二、实验技术
1.除氧方法(见前述)
2.底液的选择
除残余电流ir可通过作图法扣除外,其它干扰电流 还需在测量液中加入适当试剂。
支持电解质:HCl、H2SO4,NaAc-Hac,NH3NH4Cl,NaOH,KCl(消除迁移电流)
蒸馏法:将汞洗净,放入真空蒸馏器进行减压蒸 馏,可得高纯度汞。
电解法:可得高纯度汞。
37
b)防止汞中毒
通风良好、对撒落的汞应及时清理(用刷子或汞 镊仔细收集并放于水中,防止与空气接触;对不 能清理的要撒上硫磺粉或用三氯化铁清洗)。
经典直流极谱局限性: 1)经典极谱法既费汞又费时间; 2)分辨率差; 3)灵敏度低; 4)iR降:使用两电极体系,当溶液iR降增加时,会
(1)单次标准加入
合并两式,消去K,可得Cx
32
(2)取两个同体积V的容量,分别加入同样量的试 样Vx(Cx),而其一容量瓶再加入Vs(Cs),分别 测两瓶溶液的波高Hx,Hx+s,则得
与单次加入法同,只是体积都定容到V
33
(3)系列标准加入 取一系列体积相同为V的容量瓶(4~5个),分别
加入同样量的试液Vx(Cx),再分别加入不同量 的标准溶液Vs(Cs),分别测其波高Hx+s,作 Hx+s~Vs曲线。
伏安与极谱分析法

1/2 id nFAD O
cb 3 πt 7
2 1 3 6 2
A 8.4910 m t (cm )
3
整个滴下时间(t从0到 )通过的电量为 0 it dt 除以滴下时间,则为单位时间内通过的电量, 即为平均极限扩散电流id:
id
1
0
it dt
1/ 2 2 / 3 1/ 6 m
15.3.4 定量分析方法
15.3.4.1 定量分析方法 1. id的测量 三切线法
2. 定量分析方法 (1)标准曲线法
(2)标准加入法
h kcx
Vx c x Vs cs H k V V x s
csVs h cx H (Vx Vs ) hVx
NH2 NH
+ 2H+ + 2e
对-氨基苯酚的循环伏安图
O + H3O+ NH O O
+ + NH4
O + 2H+ + 2e O
OH
3
4
OH
Mn+ + ne- + Hg = M(Hg)
假定电极反应是可逆的,迁移电流已经消除, 则滴汞电极电位为: RT ca θ de ln nF cs
式中cs为金属离子在电极表面的浓度,ca 为 金属在汞齐中的浓度
根据扩散电流方程式可得: id = Ksc0 未达到极限扩散电流以前,扩散电流为: i = Ks(c0 - cs) 式中c0为金属离子在本体溶液中的浓度 由上两式得: i id 1 2 Ks 607nDs / 2qm/ 3t1/ 6 cs Ks 另外,还原产物的浓度也应与通过的电流成正比
第十三章-极谱与伏安分析法学习资料

3. 极谱波方程式
极谱波方程式: 描述极谱波上电流与电位之间关系。 简单金属离子的极谱波方程式: (可逆;受扩散控制;生成汞齐)
Mn+ +ne +Hg = M(Hg)(汞齐)
EEOn RF T l naH agcM a ocM o
(1)
ca 滴汞电极表面上形成的汞齐浓度; cM可还原离子
cM o
id i KM
( 4 ) (5)
2020/7/2
根据法拉第电解定律:还原产物的浓度(汞齐)与通过电 解池的电流成正比,析出的金属从表面向汞滴中心扩散,则:
iK a(ca o 0 )K a ca o;
c a o i/K a
(6 )
将(6)和(5)代入(2)
EEO n RF T lnM accaM oo
电压由0.2 V逐渐增加到0.7 V 左右,绘制电流-电压曲线。
图中①~②段,仅有微小的电 流流过,这时的电流称为“残余电 流”或背景电流。当外加电压到达 Pb2+的析出电位时,Pb2+开始在滴 汞电极上迅速反应。
由于溶液静止,电极附近的铅离子在 电极表面迅速反应,此时,产生浓度梯度 (厚度约0.05mm的扩散层),电极反应受 浓度扩散控制。在④处,达到扩散平衡。
第十三章-极谱与伏安分析法
极化电极与去极化电极
如果一支电极通过无限小的电流, 便引起电极电位发生很大变化,这样的 电极称之为极化电极,如滴汞电极,反 之电极电位不随电流变化的电极叫做理 想的去极化电极,如甘汞电极或大面积 汞层。
2020/7/2
极谱分析过程和极谱波-Pb2+(10-3mol/L)
在滴汞电极表面的浓度;a, M活度系数;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
所施加的电压值不是足够负,情况 如何?
1.
扩散层厚度不变
i=k
o (c
i
s -c
)/δ i
i=k
o (c
i
s -c
)/δ i
当阶跃到E3 及更负的电 位时,电极表面的O的浓度 很小,几乎为零,这种情 况叫达到了完全浓差极化。
如果电极的电位值是由E0逐渐变负至 E3,图中电流上升呈“S”状,并达 到一个稳定值,电流达到了极限值, 称为极限扩散电流id,它与物质的 浓度成正比, 电流为极限扩散电流一半时的电极电 位称为半波电位(E 1/2),可作为 定性分析的依据反应时,反 应粒子不断在电极上消耗而反应产物不 断生成。 因此,如果这些粒子处在液相 中,则在电极表面附近的液层中会出现 这些粒子的浓度变化,从而破坏了液相 中的浓度平衡状态,称为出现了浓差极 化现象。
一般说来,在电极反应的开始阶
段,由于反应粒子浓度变化的幅度还
但是,在电极表面附近 的薄层液体中,液流速度却 一般很小,因而起主要作用 的是扩散及电迁过程。
如果溶液中除参加电极反应的粒 子外,还存在大量不参加电极反应的 “惰性电解质”,则粒子的电迁速度 将大大减小.在这种情况下,可以认 为电极表面附近薄层液体中仅存在扩 散传质过程.这就是伏安和极谱需要 的研究条件。
差极化而引起,所以i~E 曲线也叫
极化曲线,极谱法也由此而得名;
• *要产生完全浓差极化,必要的条 件是: • (1)工作电极的表面积要足够小, 这样电流密度才会大,CS才易于趋 于零; • (2)被测物质浓度要稀,才易于 使CS →0; • (3)溶液要静止,才能在电极周 围建立稳定的扩散层。
极谱扩散电流
• 极限扩散电流部分:DE段 当V外进一步增大,使 E负到一定值, 由于Cd2+在DME上的迅速反应,Cd2+向DME 表面的扩散跟不上电极反应的速度,电极 反应可以进行到如此完全的程度,以致于 滴汞表面的溶液中,Cd2+的浓度趋于零。 这时,在每一瞬间,有多少Cd2+扩散到电 极表面,就同样有多少Cd2+被还原。这种 情况称为完全浓差极化,电解电流到达最 大值,称为极限电流,
极谱的形成
以测定1×10-3 mol· -1的Cd2+ L (含有0.1 mol· -1的KNO3)为例 L
说明极谱波的形成。
2.极谱波的形成
极谱波可分成三个部分:
• 残余电流部分:AB段
i残=ic+if
当外加电压未达到Cd2+的分解电压,亦 即施加在电极上的电位未达到Cd2+ 的析 出电位时,回路上仍有微小的电流通过, 此电流称为残余电流 , 包含有两部分: 一是滴汞电极的充电电流(这是主要 的),二是可能共存杂质还原的法拉弟 电流。
4、由于极谱电解电流很小,分析结束后 浓度几乎不变,试液可以连续反复使用; 5、应用比较广,仪器较为简单、便宜, 凡能在电极上起氧化―还原反应的有机或 无机物均可采用,有的物质虽不能在电极 上反应,但也可以间接测定。
一、物质的传递
1.液相中粒子的运动方式
(1)扩散(Diffusion) 当溶液中粒子存在浓度梯度时,这种 粒子从高浓度向低浓度的移动过程.由于 电极反应造成的这种现象,成为“浓差极 化”.显然,这是溶质相对溶剂的运动
2. 扩散层厚度变化
i=k
o (c
i
s -c
)/δ i
一般在静止电极上快速扫描时 所得到的极化曲线都呈峰形。
普通(直流)极谱法的基本原理
1.基本装置和电路
• 可分为三个基本部分 • 外加电压装置:提供可变的外加 直流电压(分压器) • 电流测量装置:包括分流器,灵 敏电流计 • 电解池:极谱法装置的特点明显 反映在电极上
及毛细管(内径约0.05mm),滴入
电解池中,储汞瓶高度一定,汞滴
以一定的速度(3-5秒/滴)均匀滴
下。
• 滴汞电极的特点 是一个完全的极化电极。由于汞滴很小 (半径0.5-1mm),表面积很小,所以电 流密度很大,当外加电压使其电位负到一 定值时,汞滴表面溶液中的离子完全被还 原,浓度趋于零,电流完全为离子的扩散 所决定
二、扩散控制过程
O+e- =R
如果电子交换速率较快,只有传质过程是最 慢的,则电流密度(j,即通过单位面积的电 流):
j=nFΠi=nFυxci±nFExuOici-nFDi(dci/dx)
如果在溶液中加入大量的支持电解质 KCl,可以消除迁移电流,在紧靠近 电极表面的一层溶液的内部,对流 作用可以忽略不计,
第十三章 伏安和极谱法
Voltammetry and Polarography
什么是伏安和极谱分析法 伏安和极谱分析法是根据测量特 殊形式电解过程中的电流―电位 (电势)或电流―时间曲线来进行 分析的方法。是电分析化学的一个 重要分支。
在含义上,伏安法和极谱法是相同的,而两者 的不同在于工作电极: ――伏安法的工作电极是电解过程中表面不能 更新的固定液态或固态电极,如悬汞、汞膜、
极谱分析法的特点
1、直流极谱法的测量浓度范围为10-2~ 10-5mol·-1,即灵敏度一般,采用其他 L 新技术,可以获得较高的灵敏度,脉冲 极谱法检测限可达10-9 mol·-1; L
2、准确度高,重现性好,相对误差一般
在2%以内;
3、选择合适的极谱底液时,可不经分离 而同时测定几种物质,具有一定的选择性;
ji=-n F D i(dci/dx)
在电极表面附近,如果浓度Ci随x的分布如图 所示:
i=A j =A nFDi (coi-csi)/δ
Coi,csi分别是溶液本体中和电极表面上粒
子的浓度, δ为扩散层厚度, A为电极 的表面积。
这种主要因为扩散传质而形成的 电流称为扩散电流,由扩散取决定 作用的过程称为扩散控制过程。
• 参比电极――是去极化电极,其电 极电位不随外加电压的变化而变化, 通常用饱和甘汞电极(SCE),接于 电解池外边,用盐桥与电解池连接。
• 去极化电极的必要条件:电极表面 积要大,通过的电流(密度)要小, 可逆性要好。
• 工作电极――是一个表面积很小的 极化电极,极谱中采用滴汞电极 (DME)。储汞瓶中的汞沿着乳胶管
• 若脉冲电压时间足够长,t远大于 t3 时,电流应该一直向零衰减,然而在 扩散层δ3之外的溶液本体中,由于 自然对流或强制对流等作用的影响, 阻止了扩散层的进一步变厚,所以电 流不可能衰减到零。如果有稳定不变 的扩散层形成,电流也将维持不变。
二、扩散控制伏安图
上述电压是阶跃到一个足够负的 电位值,因而电极表面的物质很快 就衰减到一个接近于零的值。如果
• 电流上升部分:BD段 V外增大――到达Cd2+的析出电位 ――Cd2+在滴汞电极还原,产生电解电 流,即为B点,电极反应为: 滴汞电极反应: Cd2++2e+Hg==Cd(Hg) 甘汞电极反应: 2Hg-2e+2Cl-==Hg2Cl2
此时,由于Cd2+迅速被还原,且溶液 是静止的,所以汞滴表面溶液的Cd2+浓度 CS小于溶液本体中Cd2+的平衡浓度C0, 产生了浓差极化,在汞滴周围形成了一层 扩散层δ ,则浓度梯度为(co-cs)/δ , Cd2+从溶液的本体上向汞滴表面扩散。电 解电流受到Cd2+的扩散速度所制约,这样 的电解电流称为扩散电流i (扣除残余电 流 后的电解电流)
Πi =υ xci±ExuOici-Di(dci/dx)
Π 总=Π 对+Π 电+Π 扩
=0C D(dC/dX)+VxC±ExU
Π-流量,(mol/cm2); D-扩散系数(cm2/s); Vx-流速(cm/s); Ex-x方向的电场强度(伏/cm) C-浓度(mol/L); U0-淌度(cm2/s.v)
玻璃碳、铂电极等;
――极谱法的工作电极是表面能周期性更新
的液态电极,即滴汞电极。(有的书把两者统
称为极谱法)
极谱法的发展概况及分类
1922年,捷克学者海洛夫斯基 (Heyrovsky)首先提出极谱分析法,开 创了这一电分析化学的分支; 1925年,海洛夫斯基与日本学者志方 益三研制出第一台手工操作式的极谱仪, 画出第一张极谱图;
扩散电流方程式指的是(极限)扩散电流 与在滴汞电极上进行电极反应的物质浓度 之间的关系式。
思考:式中常数K应等于什么?与哪些 因素有关?
在极谱分析中,在每一滴汞的生
1959年,海洛夫斯基因发明和发展
了极谱分析法而获得诺贝尔化学奖;
20世纪,六、七十年代以来,理论 研究及应用得到迅速发展,各种新技术、 新方法不断出现。
伏安和极谱分析法按其电解过程可以 分为两大类:
• 控制电位极谱法――如直流极谱法,单 扫描极谱法,脉冲极谱法,方波极谱法, 催化极谱法,溶出伏安法等。 • 控制电流极谱法――如计时极谱法,交 流示波极谱法等 (本课程介绍控制电位极谱法,且主要是 直流极谱法)
特殊情况下,电极表面离子的 s 很小, 浓度c i i= A nFDi coi/δ=K coi
扩散电流理论 一、计时电流法(在工作电极上施加如图所示的 电压,记录 i--t曲线,为计时电流曲线)
•电流随时间变化曲线
δ=(πDt)1/2
电流随时间变化的关系式为
1/2 i=(nF AD i o c i)/( 1/2t1/2) π
2.对流(convection) 所谓的对流,即粒子随着流动的液体 而移动.显然,这是溶液中的溶质和溶剂 同时移动.有两种形式:a.自然对流和b. 强制对流. 3.电迁(migrition) 在电场作用下,荷正电粒子向负极移 动,荷负电粒子向正极移动.
在电解池中,上述三种传质过程 总是同时发生的。然而,在一定条件 下起主要作用的往往只有其中的一种 或两种.例如,即使不搅拌溶液,在 离电极表面较远处液流速度的数值往 往比电极附近的大几个数量级,因而 扩散和电迁传质作用可以忽略不计。
