仪器分析 电化学分析习题及参考答案
仪器分析习题答案(人卫版)

仪器分析习题答案(人卫版)第一章仪器分析的基本理论和方法1.1 仪器分析的定义和分类仪器分析是利用物理、化学等科学原理和方法,通过仪器设备对物质进行性质和组成的定量或定性测定的过程。
仪器分析可以分为以下几类:•电化学分析——利用电化学原理和方法进行分析•光谱分析——利用光谱理论和方法进行分析•色谱分析——利用色谱理论和方法进行分析•质谱分析——利用质谱理论和方法进行分析1.2 仪器分析的基本过程仪器分析的基本过程包括样品采集与处理、测量仪器的选择与校准、测量方法的选择与优化、数据处理与分析等步骤。
样品采集与处理样品采集与处理是仪器分析的第一步。
在采集样品时,应注意样品的代表性和可获得性。
在处理样品时,可以用溶解、提取、分离等方法将样品中的目标物质分离出来,提高测量的准确性和灵敏度。
测量仪器的选择与校准根据要测定的目标物质的性质和测量要求,选择适合的测量仪器。
选择后,需要进行仪器的校准,确保测量结果的准确性和可靠性。
测量方法的选择与优化根据要测定的目标物质的特点和测量要求,选择适合的测量方法,如光谱法、电化学法等。
在选择后,通过优化测量条件,提高测量的准确性和灵敏度。
数据处理与分析在测量完成后,需要对获得的数据进行处理和分析。
常见的方法包括数据的平均处理、标准差分析、拟合曲线的绘制等。
通过数据处理与分析,得出最终的测量结果和结论。
1.3 仪器分析的应用领域仪器分析广泛应用于各个领域,包括环境监测、食品安全、药物分析、生物分析等。
在环境监测中,仪器分析可以对环境中的污染物进行定量测定,帮助评估环境质量和制定环境保护措施。
在食品安全中,仪器分析可以对食品中的有害物质进行检测,确保食品的安全性和质量。
在药物分析中,仪器分析可以对药物中的有效成分进行测定,帮助药物的研发和质量控制。
在生物分析中,仪器分析可以对生物样品中的成分进行定量测定,帮助研究生物过程和疾病诊断。
第二章电化学分析2.1 电化学分析的基本概念电化学分析是利用电化学原理和方法进行分析的一类方法。
仪器分析电位分析篇试题及答案

5.离子选择性电极虽然有多种,但基本结构是由、、和内参比电极三部分组成。
5. 内参比溶液,敏感膜电位分析法一、计算题1.在 -0.96V(vs SCE)时,硝基苯在汞阴极上发生如下反应:C 6H5NO2+ 4H++ 4e-= C6H5NHOH + H2O把 210mg含有硝基苯的有机试样溶解在 100mL甲醇中,电解 30min后反应完成。
从电子库仑计上测得电量为 26.7C,计算试样中硝基苯的质量分数为多少?2.将氯离子选择性电极和饱和甘汞电极接成如下电池:SCE||Cl-(X mol/L)│ ISE试推导标准加入法测定氯离子的计算公式。
3.氟离子选择电极的内参比电极为Ag-AgCl,EθA g/AgCl=0.2223V。
内参比溶液为0.10mol/LNaCl和1.0×10-3mol/LNaF,计算它在1.0×-5mol/LF-,pH=7的试液中,25o C时测量的电位值。
4.由Cl-浓度为 1mol/L的甘汞电极和氢电极组成一电对,浸入 100mL HCl试液中。
已知摩尔甘汞电极作阴极,电极电位为 0.28V,E q (H+/ H2)= 0.00V,氢气分压为 101325Pa。
A r(H) = 1.008,A r(Cl) = 35.4该电池电动势为0.40V。
(1)用电池组成符号表示电池的组成形式(2)计算试液含有多少克 HCl5.Ca2+选择电极为负极与另一参比电极组成电池,测得0.010mol/L的Ca2+溶液的电动势为0.250V,同样情况下,测得未知钙离子溶液电动势为0.271V。
两种溶液的离子强度相同,计算求未知Ca2+溶液的浓度。
6.流动载体钾电极与饱和甘汞电极组成测量电池,以醋酸锂为盐桥,在1.0×10-2mol/L氯化钠溶液中测得电池电动势为60.0mV(钾电极为负极),在1.0×10-2 mol/L氯化钾溶液中测得电池电动势为90.8mV(钾电极为正极),钾电极的响应斜率为 55.0mV/pK。
仪器分析练习题及答案

1。
简述仪器分析法的特点。
答:1.仪器分析法灵敏度高。
2.仪器分析法多数选择性较好.3.仪器分析法分析速度较快,利于批量样品分析。
4.易于使分析工作自动化。
5.相对误差较大。
6.设备复杂、价格昂贵,对仪器工作环境要求较高。
第二章电分析导论1.计算[Cu2+]= 0.0001 mol/L时,铜电极的电极电位(EθCu2+ /Cu=0.337V)2。
已知电极反应Ag++ e—=Ag的EθAg+,Ag为0.799V,电极反应Ag2C2O4+ 2e—=Ag + C2O42-的标准电极电位EθAg2C2O4,Ag为0。
490V,求Ag2C2O4的溶度积常数。
3。
已知电极反应Zn2++ 2e—=Zn的EθZn2+,Zn=-0.763V,Zn(CN)42-的稳定常数为5×1016。
求电极反应Zn(CN)42—+ 2e—=Zn + 4 CN—的标准电极电位EθZn(CN)2—,Zn.4答案:1。
计算[Cu2+] = 0。
0001 mol/L时,铜电极的电极电位(EθCu2+ /Cu=0。
337V)解:电极反应为:Cu2++ 2e—=Cu按照能斯特方程,铜电极的电位为:E Cu2+ /Cu = EθCu2+ /Cu +RT/nF ln[αCu2+ /αCu]金属的活度为常数,作为1,在非精度的情况下,可以认为αCu2+=[Cu2+]。
则求得(25℃时)E Cu2+ /Cu = EθCu2+ /Cu +RT/nF ln[Cu2+]=0。
344+(0.059/2)•lg0.0001=0.226V2。
已知电极反应Ag++ e-=Ag的EθAg+,Ag为0。
799V,电极反应Ag2C2O4+ 2e—=Ag + C2O42-的标准电极电位EθAg2C2O4,Ag为0.490V,求Ag2C2O4的溶度积常数.解:根据能斯特方程:EθAg2C2O4,Ag= E Ag+,Ag=EθAg+,Ag + 0.059lg[Ag+]= EθAg+,Ag + 0.059lg(Ksp/[C2O42-])1/2已知EθAg2C2O4,Ag为0.490V,EθAg+ ,Ag为0。
仪器分析电化学分析习题及参考答案

电化学分析习题及参考答案一、 填空题1、原电池的写法,习惯上把原电池的写法,习惯上把 极写在左边,极写在左边,极写在左边, 极写在右边,故下列电池中极写在右边,故下列电池中Zn Zn︳︳ZnSO 4︳CuSO 4︳Cu 极为正极,极为正极, 极为负极。
极为负极。
极为负极。
2、当加以外电源时,当加以外电源时,反映可以向相反的方向进行的原电池叫反映可以向相反的方向进行的原电池叫反映可以向相反的方向进行的原电池叫 ,,反之称为反之称为 ,,铅蓄电池和干电池中,干电池为电池中,干电池为 。
3、在电位滴定中,几种确定终点方法之间的关系是:在E-V 图上的图上的 就是一次微商曲线上的就是一次微商曲线上的就是一次微商曲线上的 也就也就是二次微商的是二次微商的 点。
点。
点。
4、极谱定性分析的依据是、极谱定性分析的依据是 ,定量分析的依据是,定量分析的依据是,定量分析的依据是 。
5、电解分析通常包括、电解分析通常包括 法和法和法和 法两类,均可采用法两类,均可采用法两类,均可采用 和和 电解过程进行电解。
电解过程进行电解。
电解过程进行电解。
6、在电极反应中,增加还原态的浓度,该电对的电极电位值该电对的电极电位值 ,,表明电对中还原态的表明电对中还原态的 增增强。
反之增加氧化态的浓度,电对的电极电位值强。
反之增加氧化态的浓度,电对的电极电位值 ,表明此电对的,表明此电对的,表明此电对的 增强。
增强。
增强。
7、电导分析的理论依据是、电导分析的理论依据是 。
利用滴定反应进行时,溶液电导的变化来确定滴定终点的方法。
利用滴定反应进行时,溶液电导的变化来确定滴定终点的方法叫 法,它包括法,它包括法,它包括 和和8、极谱分析的基本原理是极谱分析的基本原理是 。
在极谱分析中使用在极谱分析中使用 电极作参比电极,电极作参比电极,这是由于它不出现浓度差极化现象,故通常把它叫做极化现象,故通常把它叫做 。
9、电解过程中电极的电极电位与它电解过程中电极的电极电位与它 发生偏离的现象称为极化。
仪器分析习题 Y3习题の电化学分析法导论-电位分析法-电解与库伦分析法

选择题1.下列参量中,不属于电分析化学方法所测量的是()A电动势B电流C电容D电量2.下列方法中不属于电化学分析方法的是()A电位分析法B伏安法C库仑分析法D电子能谱3.区分原电池正极和负极的根据是()A电极电位B电极材料C电极反应D离子浓度4.区分电解池阴极和阳极的根据是()A电极电位B电极材料C电极反应D离子浓度5.衡量电极的极化程度的参数是()A标准电极电位B条件电极电位C过电位D电池的电动势6.浓差极化是由于在电解过程中电极表面附近溶液的浓度与主体溶液的浓度差别引起的,它的大小与哪些因素有关()A电极电位B溶液电阻C搅拌程度D电流密度7.对于极化的结果,下列说法正确的有()A阴极电位变负B阴极电位变正C阳极电位变正D阳极电位变负8.下列不是作为一个参比电极的条件的是()A电位的稳定性B固体电极C重现性好D可逆性好9.甘汞电极是常用参比电极,它的电极电位主要取决于()A温度B氯离子的活度C主体溶液的浓度DKCl的浓度10.电位分析中所用的离子选择电极属于()A极化电极B去极化电极C指示电极D理想电极1~5:C、D、C、A、C;6~10:C、AC、B、B、C ****************************************************************** 11.下列哪项不是玻璃电极的组成部分?()AAg-AgCl电极B一定浓度的HCl溶液CKCl溶液D玻璃膜12.pH玻璃电极膜电位的产生是由于()A离子透过玻璃膜B电子的得失C离子得到电子D溶液中H+和硅胶层中的H+发生交换13.璃电极IUPAC分类法中应属于()A单晶膜电极B非晶体膜电极C多晶膜电极D硬质电极14.晶体膜电极的选择性取决于()A被测离子与共存离子的迁移速度B被测离子与共存离子的电荷数C共存离子在电极上参与响应的敏感程度D共存离子与晶体膜离子形成微溶性盐的溶解度或络合物的稳定性15.测定溶液PH值时,所用的指示电极是:()A氢电极B铂电极C氢醌电极D玻璃电极16.测定溶液PH时,一般所用的内参比电极是:()A饱和甘汞电极B银-氯化银电极C玻璃电极D铂电极17.玻璃电极在使用前,需在去离子水中浸泡24小时以上,其目的是:()A清除不对称电位B清除液接电位C清洗电极D使不对称电位处于稳定18.晶体膜离子选择电极的灵敏度取决于()A响应离子在溶液中的迁移速度B膜物质在水中的溶解度C响应离子的活度系数D晶体膜的厚度19.氟离子选择电极测定溶液中F-离子的含量时,主要的干扰离子是()ACl-BBr-COH-DNO3-20.实验测定溶液pH值时,都是用标准缓冲溶液来校正电极,其目的是消除何种的影响。
仪器分析复习题(电化学).docx

仪器分析复习题(电化学)一、问答题1、单扫描极谱法和循环伏安法在原理上有何异同点?1、答:循环伏安法和单扫描极谱法都是利用产生的伏——安曲线进行分析的一种方法,测量池均为电解池,循环伏安法和单扫描极谱法一般都采用的是三电极系统。
循环伏安法以固体电极为工作电极,如玻碳电极,悬汞电极,汞膜电极等,单扫描极谱法以滴汞电极为工作电极,它们一般都以饱和甘汞电极为参比电极,鸽电极为对电极。
单扫描极谱法在分析中采用锯齿波形加压的方法,在每一滴汞上,前5秒静止富集,后2秒加极化电压,在一滴汞上测得一个峰形伏——安曲线,获得一个数据,分辨率(△EM30〜50mV)和灵敏度(1 X 10_7mol/L)相对较高,分析时间短,峰电流ip二k z C;峰电位为4)pc=4)1/2 -1.11RT/nFo循环伏安法在分析中施加的是三角波电压,它同时可以得到阳极波(或阳极支) 和阴极波(或阴极支〉,它们的峰电位分别为:4>pa= 01/2 +1.11RT/nF和4>pc二-1.11RT/nF;峰电流为土ip二kC;循环伏安法更多的用于电极反应机理的研究和氧化还原波可逆性的判断。
它们的工作电都是极化电极,具有小的电极表面积和大的电流密度。
2、产生浓差极化的条件是什么?2、答:当电流通过电极与溶液界面时,如果电极电位对其平衡值发生了偏差,这种现象称为极化现象。
当电解进行时,由于电极表面附近的一部分金属离子在电极上发生反应、沉积,而溶液中的金属离子又来不及扩散到电极表面附近,因而造成电极表面附近的金属离子浓度远低于整体浓度,电极电位又取决于电极表面附近的金属离子浓度,所以电解时的电极电位就不等于它的平衡电位,两者之间存在偏差,这种现象称为浓差极化。
3、什么是pA(pH)的实用定义3、答:在电位分析法中,离子选择性电极的定量基础是能斯特方程式,既:E ISE=K±RT/nF In a ; +表示阳离子,一表示阴离子;常数项K包括内参比电极电位,膜内相间电位,不对称电位,测量时还有外参比电极电位,液接电位等,这些变量是无法准确测量的,因此,不能用测的得E ISE去直接计算活度a值,而必须与标准溶液比较才能消除K 的影响,得到准确的分析结果,为此,pH值通常定义为与试液(pHx)和标准溶液(pHs)之间电动势差(ZkE)有关的函数关系如:pHx = pHs+ (Ex — Es)F/RTIn10 ;同样适用于其它离子选择性电极的测量,如:pAx = pAs±Z(Ex~Es)F/RTIn10;被称为pA(pH)的实用定义。
仪器分析练习题(二)

第四章电位分析法单项选择题1.不属于电化学分析法的是()。
A.电位分析法;B.极谱分析法;C.电子能谱法;D.库仑滴定。
2.在电位法中作为指示电极,其电位应与待测离子的浓度()A.成正比;B.符合扩散电流公式的关系;C.的对数成正比;D.符合能斯特公式的关系。
3.区分电解池阴极和阳极的根据是()A.电极电位;B.电极材料;C.电极反应;D.离子浓度。
4.测定溶液的pH值时,所用的指示电极是()A.氢电极;B.玻璃电极;C.氢醌电极;D.铂电极。
5.测定溶液的pH值时,需要不断搅拌溶液,这是为了()A.减少浓差极化;B.加快响应速度;C.使电极表面保持干净;D.降低电极内阻。
6.pH电极在使用前,需在去离子水中浸泡24小时以上,其目的是()A.清除不对称电位;B.清除液接电位;C.清洗电极;D.使不对称电位处于稳定。
7.氟离子选择性电极测定溶液中F- 离子的含量时,主要干扰离子是()A.Cl-;B.Br-;C.OH-;D.NO3-。
8.pH电极膜电位的产生是由于()A.溶液中氢离子和玻璃膜水化层中的氢离子的交换作用;B.电子的得失;C.氢离子得到电子;D.氢离子透过半透膜。
9.膜电位产生的原因是()A.电子得失;B.离子的交换和扩散;C.吸附作用;D.电离作用。
10.下列关于pH电极的叙述中,不正确的是()A.未经充分浸泡的电极对H+不敏感;B.测定pH<1的溶液时测的pH值偏小;C.经充分浸泡的电极,不对称电位趋向稳定;D.pH电极不易中毒。
11.用离子选择性电极测定离子活度时,常用选择性常数来描述电极的选择性,因此选择性常数的作用是()A.一个真实的常数;B.计算电极的响应斜率;C.估计电极的检测限;D.估计干扰离子给测定带来的误差。
12.pH电极属于()A.晶体膜电极;B.非晶体膜电极;C.气敏电极;D.液膜电极。
13.测定溶液中的F-1浓度,如果溶液中存在大量柠檬酸根离子,会使测定结果()。
资料:第四章 电化学分析法 习题及答案

第四章 电化学分析法 题库及答案1. 电化学分析方法与其他种类的仪器分析方法相比,都有什么特?答:设备简单、操作方便、应用广泛、灵敏度与准确度高、重现性好等。
2. 电化学分析过程中一定有电流流过电极吗?哪些分析法需要有电流流过电极?哪些需无电流流过?答:不一定;电解分析法,伏安分析法,库仑分析法;电位分析法。
3. 参比电极的电极电位为什么是恒定的?在电位分析法中的作用是什么?答:参比电极的电位取决于电极内离子的活度,其浓度保持恒定,故其电极电位恒定。
在电位分析法中,保持一支电极的电位恒定,另一支电极电位随待测离子浓度的变化而变化,这样使两极之间的电位差的变化反应溶液中离子活度的大小。
4. 离子选择性电极有哪些类型?分别举一个例子说明其作用原理。
答:晶体膜电极:如F 电极,F -在晶体膜表面进行交换,溶液中F -活度较高,则溶液中的F -进入晶体,反之,晶体膜内的F-进入溶液。
玻璃膜电极:用水浸泡玻璃膜时,玻璃膜表面的Na+与水中的H+交换,形成一层水化硅胶层。
在水化层,溶液中的H+经水化层扩散至干玻璃层,干玻璃层的阳离子向外扩散以补偿外表面溶出的离子,离子的相对移动产生扩散电位。
液膜电极,如钙电极,将与响应离子有作用的载体溶解在不与水混溶的有机溶剂,组成一种液体离子交换剂,然后掺入一种微孔物质制成敏感膜,载体离子可以在液膜-试样、液膜-内填充溶液两个相界面间来回迁移,起到传递待测离子的作用,由于待测离子在水相与有机相中活度有差异,从而产生相间电位。
敏化电极:如气敏电极,其原理是某些气体渗过透气膜而溶解在水溶液中,然后释放出的H+改变水溶液的pH ,使pH 玻璃膜电极产生响应。
5. 当用直接电位法测量溶液的pH 值时,表达式pH K E 0592.0'+=中,K ’ 项包括哪些常数?答:参比电极、内参比电极、不对称电位及液接电位等常数。
6. 用pH 玻璃膜电极和饱和甘汞电极测定溶液的pH 。
第七章电化学临床分析技术和相关仪器习题参考答案

第七章电化学临床分析技术和相关仪器习题参考答案一、名词解释1. 电化学分析法:利用溶液电化学性质将被测物质的浓度转变成电学参数而进行检测的方法。
2. 离子选择性电极:用特殊敏感膜制成的、对溶液中特定离子具有选择性响应的电极。
3. 电解质分析仪:通常采用离子选择性电极(ISE)测定生物样品中离子浓度的仪器。
4. 血气分析仪:利用电极对人全血中的酸碱度(pH)、二氧化碳分压(PCO2)和氧分压(PO2)进行测定的仪器。
5. 定标或校准:确定电极系统工作曲线的过程。
6. 气路系统:提供PCO2和PO2两种电极定标时所用的两种气体系统。
7. 压缩气瓶供气方式:由两个压缩气瓶供气,一个含有5%的二氧化碳和20%的氧;另一个含10%的二氧化碳,不含氧。
经减压阀后输出的气体。
8. 气体混合器供气方式:用气体混合器将空气压缩机产生的压缩空气和气瓶送来的纯二氧化碳气体进行配比、混合,最后产生定标气的方式。
9. 基流:当PO2的值为零时,电路中存在的微小电流值。
10. PO2电极:PO2电极是一种气敏电极,电流的大小与血液样品中PO2值相关。
11. PCO2电极:又称为“Severinghaus”电极,主要由玻璃电极、参比电极以及CO2渗透膜组成的,电位值随血液PCO2的大小变化而改变。
二、选择题【A型题】1. D2. A3. C4.B5. D6. A7. C8. B9. B10. C 11. C12. E13. A14. B15. E 16. D17. A18. A19. D20. C21. E22. B23. A24. E25. D26. E27. C28. E29. D30. A31. B32. D33. B34. C35. E36. D37. A38. E39. D40. C【X型题】1. ABCE2. ABDE3. AC4. CD5. AB6. AD7. BC8. ABCD9. ABCE 10. ABCD11. ACDE 12. BCDE 13. ABC 14. ABCD 15. ABCD16. ABCD 17. BCDE 18. BCD 19. BCDE 20. ABC21. AC 22. CE 23. AB 24. CE 25. AB26. ABCD 27. ABCD 28. CD 29. ABCD 30. ABDE31. ABDE 32. BCD 33. ABDE 34. CD 35. AB36. CE 37. ACDE 38. ACDE 39. ABCD 40. ABDE41. ACDE 42. ACD 43. BCD三、简答题1.什么是电化学分析法?它利用哪些电化学特性进行检测?答:电化学分析法是利用溶液电化学性质将被测物质的浓度转变成电学参数而进行检测的方法。
仪器分析练习题06附答案

仪器分析练习题06附答案⼀、选择题1. 液接电位的产⽣是由于() A. 两种溶液接触之前带电荷B. 两种溶液中离⼦迁移速率不同所导致C. 电极电位对溶液作⽤的结果D. 溶液表⾯张⼒不同所致2. 正确的饱和⽢汞电极半电池的组成为() A. Hg ?Hg 2Cl 2(1 mol ?L -1)?KCl (饱和) B. Hg ?Hg 2Cl 2(固体)?KCl (饱和) C. Hg ?Hg 2Cl 2(固体)?HCl (1mol ?L -1)D. Hg ?HgCl 2(固体)?KCl (饱和)3. ⽢汞参⽐电极的电极电位随KCl 溶液浓度的增加⽽产⽣什么变化() A. 增加B. 减⼩C. 不变D. 两者⽆直接关系4. ⽤AgCl 晶体膜离⼦选择电极测定Cl -时,若以饱和⽢汞电极作为参⽐电极,应选⽤的盐桥为() A. KNO 3B. KClC. KBrD. KI5. 离⼦选择电极产⽣膜电位,是由于() A. 扩散电位的形成B. Donan 电位的形成C. 扩散电位和Donan 电位的形成D. 氧化还原反应6. 离⼦选择电极中通常采⽤的内参⽐电极是() A. Ag 电极B. Ag/AgCl 电极C. 饱和⽢汞电极D. AgCl 电极7. ⽤Ag 离⼦选择性电极测定含有Ag 离⼦的氨性溶液,能引起电极响应的是() A. +AgB. ()+3NH AgC. ()+23NH AgD. 三种离⼦的总和8. pH 电极的膜电位产⽣是由于测定时,溶液中的() A. H +穿过了玻璃膜B. 电⼦穿过了玻璃膜C. Na +与⽔化玻璃膜上的H +交换作⽤D. H +与⽔化玻璃膜上的H +交换作⽤9. pH 电极在使⽤之前需要在去离⼦⽔中浸泡24 h ,其主要⽬的是() A. 彻底清除电极表⾯的杂质离⼦ B. 形成⽔化层,使不对称电位稳定 C. 消除液接电位D. 消除不对称电位10. pH 玻璃电极产⽣的不对称电位来源于() A. 内外玻璃膜表⾯特性不同 B. 内外溶液中H +浓度不同 C. 内外溶液的H +活度系数不同D. 内外参⽐电极不⼀样11. 在实际测定溶液 pH 时都⽤标准缓冲溶液来校正电极,其⽬的是消除() A. 不对称电位B. 液接电位C. 不对称电位和液接电位D. 温度影响12. 晶体膜离⼦选择性电极的检出限主要取决于()A.响应离⼦在溶液中的迁移速度 B. 膜物质在⽔中的溶解度C. 响应离⼦的活度系数D. 晶体膜的厚度13. 晶体膜电极的选择性取主要决于()A. 被测离⼦与共存离⼦的迁移速度B. 被测离⼦与共存离⼦的电荷数C. 共存离⼦在电极上参与响应的敏感程度D. 共存离⼦与晶体膜中的晶格离⼦形成微溶盐的溶解度或络合物的稳定性14. 活动载体膜电极的敏感膜为()A. 固态的⽆机化合物B. 晶体膜C. 固态的有机化合物D. 液态的有机化合物15. 活动载体膜离⼦选择性电极的检出限主要取决于()A. 响应离⼦在溶液中的迁移速度B. 膜电阻C. 膜的厚度D. 响应离⼦与载体的缔合物或络合物在⽔中的溶解度16.⼆氧化碳⽓敏电极是以0.01 mol L-1碳酸氢钠作为中介溶液,指⽰电极可以选择()A. SCEB. pH玻璃电极C. 中性载体膜钠电极D. 铂电极17.关于离⼦选择性电极的响应时间,不正确的说法是()A. 浓试样⽐稀试样长B. 光滑的电极表⾯与较薄的膜相会缩短响应时间C. 共存离⼦对响应时间有影响D. ⼀定范围内升⾼温度会缩短响应时间18.离⼦选择性电极在使⽤时,每次测量前都要将其电位值清洗⾄⼀定的值,即固定电极的预处理条件,这样做的⽬的是()A. 避免存贮效应(迟滞效应或记忆效应)B. 清洗电极C. 消除电位不稳定性D. 提⾼灵敏度19. ⽤离⼦选择性电极进⾏测定时,需要⽤磁⼒搅拌器搅拌溶液,这是因为()A. 减⼩浓差极化B. 加快响应速度C. 使电极表⾯保持⼲净D. 降低电池内阻20. 离⼦选择性电极的选择性系数可⽤于()A. 估计电极的检出限B. 估计共存离⼦的⼲扰程度C. 校正⽅法误差D. 估计电极的线性响应范围21. 电位分析法主要⽤于低价离⼦测定的主要原因是()A. 相对⾼价离⼦,低价离⼦电极易制作B. ⾼价离⼦电极未研制出来C. 能斯特⽅程对⾼价离⼦不适⽤D. 测定⾼价离⼦的灵敏度低、准确度差22. ⽤玻璃电极测定溶液pH 值时,通常采⽤的定量分析⽅法为() A. 校正曲线法B. 直接⽐较法C. ⼀次加⼊标准法D. 内标法23. ⽤离⼦选择电极标准加⼊法进⾏定量分析时,对加⼊标准溶液的要求为() A. 加⼊体积⼤,溶液浓度⾼ B. 加⼊体积⼩,溶液浓度低 C. 加⼊体积⼤,溶液浓度低D. 加⼊体积⼩,溶液浓度⾼24. 对于电位滴定法,下⾯哪种说法是错误的()A. 在酸碱滴定中,常⽤pH 玻璃电极为指⽰电极,饱和⽢汞电极为参⽐电极B. 弱酸、弱碱以及多元酸(碱)不能⽤电位滴定法测定C. 电位滴定法具有灵敏度⾼、准确度⾼、应⽤范围⼴等特点D. 在酸碱滴定中,应⽤电位法指⽰滴定终点⽐⽤指⽰剂法指⽰终点的灵敏度⾼得多 25. 下列说法错误的是()A. 电位滴定是通过测量滴定过程中电池电动势的变化来确定滴定终点B. 滴定终点位于滴定曲线斜率最⼩处C. 电位滴定中,在化学计量点附近应该每加⼊0.1~0.2 mL 滴定剂就测量⼀次电动势D. 除⾮要研究整个滴定过程,⼀般电位滴定只需准确测量和记录化学计量点前后1~2 mL 的电动势变化即可26. 在极谱分析中,⽤来进⾏定性、定量分析的极谱图是() A. 电流对浓度B. 电流对电压C. 电流对体积D. 电压对浓度27. 经典直流极谱波出现平台是由于() A. 电化学极化使电流上不去B. 浓差极化使电流受扩散控制C. 离⼦还原后,电极周围的电场发⽣了变化D. 汞滴落下,将电荷带⾛了 28. 经典直流极谱法中极限扩散电流与汞⾼的关系为()A. 2/1d h i ∝B. h i d ∝C. 2d h i ∝D. 3/1d h i ∝29. 在经典极谱分析中,⼀般不搅拌溶液,这是为了() A. 消除迁移电流 B. 减少充电电流的影响 C. 加速达到平衡D. 有利于形成浓差极化30. 在加⼊⽀持电解质后、极⼤抑制剂和除氧剂后,极谱分析中的极限电流是指() A. 残余电流和扩散电流 B. 残余电流、扩散电流和迁移电流 C. 扩散电流和迁移电流D. 残余电流和迁移电流31. 极谱法中极限扩散电流是()A. 电极表⾯附近还原(或氧化)离⼦浓度趋近于0时所得到的扩散电流B. 电极表⾯附近还原(或氧化)离⼦浓度等于0时所得到的扩散电流C. 电极表⾯附近还原(或氧化)离⼦浓度最⼤时所得到的扩散电流D. 较长时间电解所得到扩散电流32. 极谱波的半波电位是()A. 扩散电流为极限扩散电流⼀半时的电极电位B. 从极谱起始电位到终⽌电位⼀半处的电极电位C. 极限电流⼀半时的电极电位D. 参与电极反应物质的析出电位33. 下⾯的哪种说法是正确的()A. 极谱半波电位相同的,都是同⼀种物质B. 半波电位是极谱定量分析的依据C. 极谱半波电位随被测离⼦浓度的变化⽽变化D. 当溶液的组成⼀定时,同⼀物质的半波电位相同34. 极谱法测定时,溶液可多次测量且数值基本不变是因为()A. 电极很⼩,电解电流很⼩B. 加⼊浓度较⼤的惰性⽀持电解质C. 外加电压不很⾼,被测离⼦电解很少D. 被测离⼦还原形成汞齐⼜回到了溶液中35.哪种⽅法不适合消除氧波()A. 在中性或碱性底液中加⼊亚硫酸钠B. 在微酸性或碱性底液中加⼊抗坏⾎酸C. 在碱性底液中通⼊CO2D. 在溶液中通⼊N2等惰性⽓体36.在极谱分析中,通常在试液中加⼊⼀定量的明胶,⽬的是消除()A. 极谱极⼤B. 迁移电流C. 充电电流D. 残余电流37. 严重限制经典极谱分析检测下限的因素是()A. 电解电流B. 扩散电流C. 极限电流D. 电容电流38. 影响阳离⼦半波电位负移的主要因素是()A. 改变温度B. 改变酸度C. 加⼊配位剂D. 形成汞齐39. 脉冲极谱法和⽅波极谱法的根本区别是()A. 脉冲极谱所施加的极化电压是等幅的B. 脉冲极谱所施加的极化电压是不等幅的C. 脉冲极谱是在直流极化电压上叠加⽅波电压D. 脉冲极谱是在直流极化电压上叠加频率较低⽅波电压,即⼀滴汞上只加⼀个⽅波电压40. 对于不可逆极谱波() A. 不发⽣完全的浓差极化现象 B. 极限扩散电流等于零C. 表现出明显的过电位D. 极限扩散电流不与浓度成正⽐41. 不可逆极谱波在未达到极限扩散电流区域时,控制电流⼤⼩的因素是() A. 电极反应速度B. 扩散速度C. 电极反应与扩散速度D. ⽀持电解质迁移速度42. 伏安法经常使⽤三电极系统,即⼯作电极、参⽐电极与铂丝辅助电极,这是因为: A. 确保⼯作电极电位完全受外加电压的控制 B. 保证参⽐电极的电位始终为零 C. 增强极化电压的稳定性D. 提⾼⽅法的灵敏度43. 单扫极谱和循环伏安法中,关于峰电流i p 和扫描速率v 的关系,下列说法正确的是() A. 对不可逆电极过程,2p v i ∝ B.对可逆电极过程,2p v i ∝ C. 对不可逆电极过程,2/1p v i ∝D. 对可逆电极过程,2/1p v i ∝44. ⽅波极谱是在直流极化电压上叠加⼀个⼩振幅的⽅波电压并在其后期进⾏电流测量,其检出限降低的主要原因是()A. 增加了电解电流的值B. 减少了电容电流的值C. 提⾼了测量电流中电解电流对电容电流的⽐值D. 仪器对测量电流进⾏了⾼倍率放⼤45. 脉冲极谱法能⽤于那些电极反应较慢(不可逆反应)物质的微量分析因为() A. 采⽤脉冲⽅式加电压B. 采⽤了较短的脉冲持续时间C. 采⽤了较长的脉冲持续时间D. 采⽤了在滴汞⽣长后期施加电压⽅式46. 下列的哪种说法是错误的()A. 溶出伏安法具有较⾼的灵敏度,是由于将⼤体积试液中的被测物质富集到微⼩体积的电极上,使浓度增⼤,快速溶出时,电流将⼤⼤增加B. 阴极溶出伏安法中,富集过程是电氧化,溶出过程是电还原;⽽阳极溶出伏安法中,富集过程是电还原,溶出过程是电氧化C. 富集过程中,电极反应物常以汞齐或难溶化合物的形式被富集D. 溶出都是极化电压以⼀定速度(⼀般⼤于20 mV/s )由正电位向负电位⽅向线性变化 47. 在溶出伏安的富集(即预电解)过程中,需要搅拌试液或者旋转电极,其⽬的是() A. 加快电极表⾯的反应 B. 加速达到电极平衡 C. 获得稳定的溶出电流D. 提⾼富集效率48. 在阳极溶出伏安法中,使⽤下列哪种⼯作电极是不合适的: A. 滴汞电极B. 汞膜电极C. 悬汞电极D. 碳电极49. 溶出伏安法时使⽤悬汞电极,适合于测定() A. 与汞⽣成汞齐的⾦属离⼦ B. 不与汞⽣成汞齐的⾦属离⼦ C. 变价的⾦属离⼦D. 形成可溶性汞盐的⾦属离⼦50. 下列哪种伏安法的检出限最低() A. 脉冲伏安法B. 经典直流极谱法C. 溶出伏安法D. ⽅波极谱法51. 若溶液中含有下列浓度的离⼦,以Pt 电极电解时,⾸先在阴极上析出的是() A. 0.01 mol ?L -1的Ag +(θ+?Ag Ag = 0.80 V ) B. 2 mol ?L -1 Cu 2+(θ+?Cu/Cu 2= 0.34 V ) C. 1 mol ?L -1的Pb 2+(θ+Pb/Pb 2= -0.13 V ) D. 0.1 mol ?L -1 Zn 2+(θ+?Zn /Zn 2= -0.76 V ) 52. ⽤银电极电解1 mol ?L -1 Br -、1 mol ?L -1 SCN -、0.001 mol ?L -1 Cl -、0.001 mol ?L -1 IO 3-和0.001 mol ?L -1 CrO 42-的混合溶液,已知?θ(AgBr/Ag) = +0.071V 、?θ(AgSCN/Ag) = +0.09V ,? θ(AgCl/Ag) =+0.222V ,? θ(AgIO 3/Ag) = +0.361V ,? θ(Ag 2CrO 4/Ag) = +0.446V ,在银电极上最先析出的为() A. AgBrB. AgSCNC. AgClD. AgIO 353. 电解时,由于超电位存在,要使阳离⼦在阴极上析出,其阴极电位要⽐可逆电极电位() A. 更正 B. 更负 C. 两者相等 D.⽆规律 54. 下列不是恒电流电解分析法特点的是()A. 电解速度快B. 选择性差C. 需要的分析时间长D. 电解过程中外加电压不断变化55. 在控制电位电解过程中为了保持⼯作电极电位恒定,必须保持()A. 不断改变外加电压B. 外加电压不变C. 辅助电极电位不变D. 电解电流恒定 56. 法拉第定律和下列哪些因素有关()A. 温度和压⼒B. 电化学物质浓度C. 电极材料或溶剂性质D. 电⼦转移数 57. 下列不是库仑滴定法特点是() A. 需要标准物进⾏滴定剂的校准B. 可⽤使⽤不稳定的滴定剂C. ⽅法灵敏度和准确度⾼D. 容易实现⾃动滴定 58. 控制电位库仑分析的先决条件是()A. 100%电流效率B. 100%滴定效率C. 控制电极电位D. 控制电流密度59. ⾼沸点有机溶剂中微量⽔分的测定,最适采⽤的⽅法是()A. 直接电位法B. 电位滴定法C. 电导分析法D. 库仑分析法60. 由库仑法⽣成的Br 2来滴定Tl +,反应如下:Tl ++ Br 2─→ Tl 3++ 2Br -。
仪器分析伏安法习题答案

仪器分析伏安法习题答案仪器分析伏安法习题答案伏安法是一种常用的电化学分析方法,广泛应用于化学、材料、生物等领域。
通过测量电流与电势之间的关系,可以得到样品的电化学性质和化学反应动力学参数。
在学习和应用伏安法时,经常会遇到一些习题,下面将给出一些常见的习题以及详细的解答,希望对大家的学习有所帮助。
1. 一个溶液中含有两种可逆氧化还原对,分别是Fe3+/Fe2+和Cu2+/Cu+,它们的标准电极电势分别为0.77 V和0.34 V。
当电位为0.5 V时,哪个氧化还原对发生反应?解答:根据伏安法的基本原理,当电位大于标准电极电势时,还原反应发生;当电位小于标准电极电势时,氧化反应发生。
所以当电位为0.5 V时,Fe3+/Fe2+发生还原反应。
2. 一个溶液中含有两种可逆氧化还原对,分别是Ag+/Ag和Cu2+/Cu,它们的标准电极电势分别为0.80 V和0.34 V。
如果在电位为0.6 V时,Ag+的浓度为0.1 mol/L,Cu2+的浓度为0.01 mol/L,求Cu的浓度。
解答:根据伏安法的浓度极限公式,可以得到Ag+的浓度与Cu2+的浓度的比值为:[Ag+] / [Cu2+] = exp[(EAg+/Ag - ECu2+/Cu) / 0.0592]代入已知数据,可得:[Ag+] / [Cu2+] = exp[(0.80 - 0.34) / 0.0592] = exp[0.76]由于[Ag+] = 0.1 mol/L,代入上式可得:0.1 / [Cu2+] = exp[0.76]解得[Cu2+] ≈ 0.013 mol/L,即Cu的浓度约为0.013 mol/L。
3. 在电化学分析中,常用的工作电极有哪些?它们的特点和适用范围分别是什么?解答:常用的工作电极包括玻碳电极、金电极、银电极等。
它们的特点和适用范围如下:- 玻碳电极:具有良好的电导性和化学稳定性,适用于大多数溶液中的电化学反应。
- 金电极:具有较高的电导性和化学稳定性,适用于高浓度酸性溶液中的电化学反应。
仪器分析练习题06参考答案
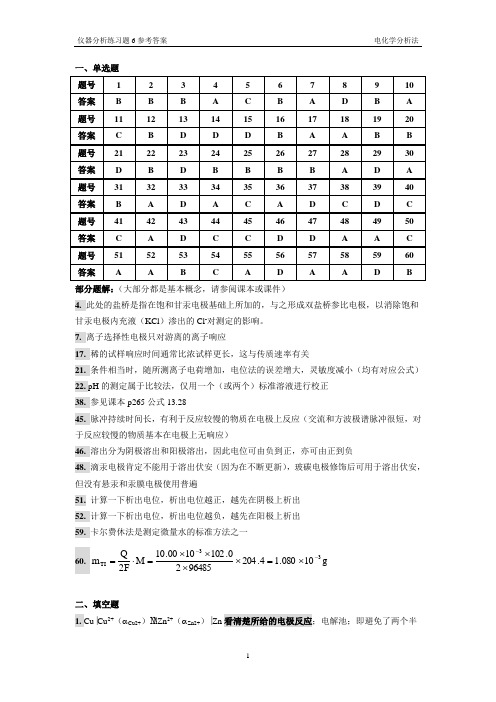
一、单选题部分题解:(大部分都是基本概念,请参阅课本或课件)4. 此处的盐桥是指在饱和甘汞电极基础上所加的,与之形成双盐桥参比电极,以消除饱和甘汞电极内充液(KCl )渗出的Cl -对测定的影响。
7. 离子选择性电极只对游离的离子响应17. 稀的试样响应时间通常比浓试样更长,这与传质速率有关21. 条件相当时,随所测离子电荷增加,电位法的误差增大,灵敏度减小(均有对应公式) 22. pH 的测定属于比较法,仅用一个(或两个)标准溶液进行校正 38. 参见课本p265公式13.2845. 脉冲持续时间长,有利于反应较慢的物质在电极上反应(交流和方波极谱脉冲很短,对于反应较慢的物质基本在电极上无响应)46. 溶出分为阴极溶出和阳极溶出,因此电位可由负到正,亦可由正到负48. 滴汞电极肯定不能用于溶出伏安(因为在不断更新),玻碳电极修饰后可用于溶出伏安,但没有悬汞和汞膜电极使用普遍51. 计算一下析出电位,析出电位越正,越先在阴极上析出 52. 计算一下析出电位,析出电位越负,越先在阳极上析出 59. 卡尔费休法是测定微量水的标准方法之一 60. g 10080.14.2049648520.1021000.10M F 2Q m 33TI --⨯=⨯⨯⨯⨯=⋅=二、填空题1. Cu ⎥Cu 2+(αCu2+) Zn 2+(αZn2+)⎥Zn 看清楚所给的电极反应;电解池;即避免了两个半电池中电解质溶液的接触,又将液接电位降低到最小限度;正、负离子的迁移速率大致相等且可达到较高浓度并不与半电池中溶液发生化学反应 2. 极化;浓差极化;电化学极化3. 电势在一定范围内变化时,电流不变;电流在一定范围内变化时,电势不变;滴汞电极;饱和甘汞电极4. 参比电极;AgCl/Ag 和Hg 2Cl 2/Hg5. 正6. 大于,小于7. 待测液玻璃膜pH FRT303.2K -=ϕ(写成25︒C 时的表达式待测液玻璃膜pH 059.0K -=ϕ也可以,以后同)8. 形成较多空的F -点阵,降低晶体膜的电阻(增大导电性);NaF+NaCl ;调节总离子强度;掩蔽干扰的阳离子;5-7;pH 过低,会形成HF 或HF 2-,降低F -的活度,pH 过高,OH -会与晶体膜作用释放F - 9. Br -;-α-=ϕBr lg FRT303.2K 玻璃膜 10. 5.75注意电池连接方式,题中SCE 为正极,pH 电极为负极,因此电池的电动势为:059.0E E pH pH pH 059.0K E pH 059.0K E sx s x x x ss -+=⇒+=+=11. 0.66V先计算一下Ag +和Br -哪个过量,然后在计算电极电位,题目中Ag +过量,因此电极电势:[]V 66.025202505.02010.0lg 059.076.0Ag lg 059.0Ag/Ag Ag /Ag =+⨯-⨯+=+ϕ=ϕ+θ++12. 12.9%;0.059 mol ⋅L -19.12%100108.215.00016.0%E 41/2=⨯⨯⨯=-[]14L mol 059.00016.0%2108.2Na --+⋅=⨯⨯≤13. 1011 ΩΩ=⇒⨯+=1110R %100R R R %E 电位计电位计膜电极膜电极14. 2%%2%1005.019.3%E =⨯⨯⨯=15. Al 电极(F –离子选择性电极亦可);玻璃膜(pH )电极;Ag 电极;Pt 电极16. 不可逆波;可逆波;动力波;吸附波17. d ;h ;既消除了电容电流的影响,又使毛细管噪音降到极低 18. 4.57 μA根据Ilkovic 方程可知,当其他条件确定时有6/13/2t m k i ⋅⋅=,结合m ∝h (汞高)和t ∝1/h ⇒2/1hk i ⋅=⇒2121h /h i /i =;由t ∝1/h ⇒h 1/h 2=t 2/t 1(h 变化时m 和t 均发生变化,因此也有h 1/h 2=m 1/m 2,这一点要明确,但题目中前后的t 已经给出,所以由t 的比值来求h 的比值很方便)⇒1221t /t i /i =,带入数据即可。
仪器分析习题答案-电化学分析部分

仪器分析部分作业题参考答案第一章绪论1-21、主要区别:(1)化学分析是利用物质的化学性质进行分析;仪器分析是利用物质的物理或物理化学性质进行分析;(2)化学分析不需要特殊的仪器设备;仪器分析需要特殊的仪器设备;(3)化学分析只能用于组分的定量或定性分析;仪器分析还能用于组分的结构分析;(3)化学分析灵敏度低、选择性差,但测量准确度高,适合于常量组分分析;仪器分析灵敏度高、选择性好,但测量准确度稍差,适合于微量、痕量及超痕量组分的分析。
2、共同点:都是进行组分测量的手段,是分析化学的组成部分。
1-5分析仪器与仪器分析的区别:分析仪器是实现仪器分析的一种技术设备,是一种装置;仪器分析是利用仪器设备进行组分分析的一种技术手段。
分析仪器与仪器分析的联系:仪器分析需要分析仪器才能达到量测的目的,分析仪器是仪器分析的工具。
仪器分析与分析仪器的发展相互促进。
1-7因为仪器分析直接测量的是物质的各种物理信号而不是其浓度或质量数,而信号与浓度或质量数之间只有在一定的范围内才某种确定的关系,且这种关系还受仪器、方法及样品基体等的影响。
因此要进行组分的定量分析,并消除仪器、方法及样品基体等对测量的影响,必须首先建立特定测量条件下信号与浓度或质量数之间的关系,即进行定量分析校正。
第二章光谱分析法导论2-1光谱仪的一般组成包括:光源、单色器、样品引入系统、检测器、信号处理与输出装置。
各部件的主要作用为:光源:提供能量使待测组分产生吸收包括激发到高能态;单色器:将复合光分解为单色光并采集特定波长的光入射样品或检测器;样品引入系统:将样品以合适的方式引入光路中并可以充当样品容器的作用;检测器:将光信号转化为可量化输出的信号。
信号处理与输出装置:对信号进行放大、转化、数学处理、滤除噪音,然后以合适的方式输出。
2-2:单色器的组成包括:入射狭缝、透镜、单色元件、聚焦透镜、出射狭缝。
各部件的主要作用为:入射狭缝:采集来自光源或样品池的复合光;透镜:将入射狭缝采集的复合光分解为平行光;单色元件:将复合光色散为单色光(即将光按波长排列)聚焦透镜:将单色元件色散后的具有相同波长的光在单色器的出口曲面上成像;出射狭缝:采集色散后具有特定波长的光入射样品或检测器2-3棱镜的分光原理是光的折射。
完整版)仪器分析试题及答案

完整版)仪器分析试题及答案1、仪器分析法是指利用专门的仪器,通过测量物质某些物理、化学特性的物理量来进行分析的方法。
2、电化学分析法包括电位分析法和电解分析法,其中电位分析法利用电极电位与被测物质活度的关系来测定溶液中待测组分的含量。
3、电化学分析法中的参比电极是用来提供电位标准的电极,其电位值应该是已知且恒定的。
4、荧光光谱法、紫外-可见吸收光谱法和原子吸收法属于光学分析法,而电位法属于电化学分析法,库仑分析法属于物理分析法。
5、玻璃器皿的洗涤方法应该根据污染程度选择不同的洗涤液,洗涤干净的标志是表面应该有一层薄薄的水膜。
6、分析天平的使用方法包括水平调节、预热、开启显示器、称量和关闭显示器等步骤,使用时需要注意保持天平平稳和正确读数。
7、参比电极在电位分析法中起着至关重要的作用,其电位值应该是已知且恒定的,以确保测量结果的准确性。
4、在电位分析法中,指示电极是一种电极,它的电位会随着待测离子活(浓)度的变化而变化,并能指示出待测离子活(浓)度。
5、pH的实用定义公式为pHx=pHs+(Ex-Es)×0.0592.6、荧光光谱法不属于电化学分析法。
7、在电位分析法中,作为指示电极,其电极电位应与被测离子的活度的对数成正比。
8、饱和甘汞电极的外玻璃管中装的是纯水。
9、pH玻璃电极膜电位的产生是由于氢离子穿透玻璃膜而使膜内外氢离子产生浓度差。
10、pH=9.18不是直接电位法中常用的pH标准缓冲溶液。
11、实验室常用的pH=6.86(25℃)的标准缓冲溶液是0.1 mol/L乙酸钠+0.1 mol/L乙酸。
12、pH复合电极的参比电极是银电极。
13、使用pH复合电极前需要进行活化,一般活化时间为30分钟。
14、使用pH复合电极前应用纯水进行活化。
15、如果已知待测水样的pH大约为5左右,定位溶液最好选pH7和pH9.16、如果已知待测水样的pH大约为8左右,定位溶液最好选pH2和pH7.17、使用离子选择性电极进行测量时,需要用磁力搅拌器搅拌溶液,以加快响应速度。
电化学分析与测试仪器考核试卷

D.测试环境温度变化
20.以下哪些是电化学合成过程中可能使用的催化剂?()
A.铂
B.钯
C.铱
D.铁
(以下为答题纸):
考生姓名:________________
答题日期:________________
得分:_________________
判卷人:_________________
4.电化学传感器的设计中,选择性总是优于灵敏度。()
5.电解质的离子种类和浓度不会影响电化学测试结果。()
6.在电化学电池中,阳极发生氧化反应,阴极发生还原反应。()
7.电化学工作站可以直接测量电极的电容值。()
8.电化学腐蚀主要是指金属在电解质溶液中的阳极溶解过程。()
9.电化学合成通常需要使用催化剂来提高反应速率。()
4.请解释电化学活性物质在电极表面的沉积与溶解过程,以及这些过程对电化学性能的影响。
标准答案
一、单项选择题
1. C
2. A
3. C
4. B
5. D
6. C
7. D
8. A
9. D
10. C
11. D
12. B
13. C
14. D
15. C
16. D
17. A
18. A
19. C
20. B
二、多选题
1. ABC
3.敏感元件、转换元件、信号处理部分
4.电荷转移电阻
5.电化学效率
6.添加电解质
7.数据处理
8. I、E
9.沉积
10.氧化、还原
四、判断题
1. ×
2. ×
3. √
4. ×
5. ×
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电化学分析习题及参考答案
一、填空题
1、原电池的写法,习惯上把极写在左边,极写在右边,故下列电池中Zn︳ZnSO4︳CuSO4︳Cu 极为正极,极为负极。
2、当加以外电源时,反映可以向相反的方向进行的原电池叫,反之称为,铅蓄电池和干
电池中,干电池为。
3、在电位滴定中,几种确定终点方法之间的关系是:在E-V图上的就是一次微商曲线上的也就
是二次微商的点。
4、极谱定性分析的依据是,定量分析的依据是。
5、电解分析通常包括法和法两类,均可采用和电解过程进行电解。
6、在电极反应中,增加还原态的浓度,该电对的电极电位值,表明电对中还原态的增
强。
反之增加氧化态的浓度,电对的电极电位值,表明此电对的增强。
7、电导分析的理论依据是。
利用滴定反应进行时,溶液电导的变化来确定滴定终点的方法
叫法,它包括和
8、极谱分析的基本原理是。
在极谱分析中使用电极作参比电极,这是由于它不出现浓度差
极化现象,故通常把它叫做。
9、电解过程中电极的电极电位与它发生偏离的现象称为极化。
根据产生极化的原因不同,主要有
极化和极化两种。
10 、离子选择性电极的电极斜率的理论值为。
25℃时一价正离子的电极斜率是;二
价正离子是。
11、某钠电极,其选择性系数K Na+,H+约为30。
如用此电极测定PNa等于3的钠离子溶液,并要求测定误差小
于3%,则试液的PH值应大于________。
12、用离子选择性电极测定浓度为1.0´10-4mol/L某一价离子i,某二价的干扰离子j的浓度为4.0´
10-4mol/L,则测定的相对误差为。
( 已知K ij=10-3)
13、玻璃电极在使用前,需在蒸馏水中浸泡24h以上,目的是,饱和甘汞电极使用温度不得超
过℃,这是因为温度较高时。
二、选择题
1、进行电解分析时,要使电解能持续进行,外加电压应()。
A 保持不变
B 大于分解电压
C 小于分解电压 D等于分解电压 E 等于反电动势
2、用NaOH直接滴定法测定H3BO3含量能准确测定的方法是()
A电位滴定法 B酸碱中和法 C电导滴定法 D库伦分析法 E色谱法
3、已知在c(HCl)=1mol/L的HCl溶液中:ΦCr2O72-/Cr3+=1.00V,ΦFe3+/Fe2+=0.68V。
若以K2CrO7滴定Fe2+时,
选择下列指示剂中的哪一种最适合。
()
A二苯胺(Φ=0.76V); B二甲基邻二氮菲—Fe3+(Φ=0.97V);
C次甲基蓝(Φ=0.53V); D中性红(Φ=0.24V); E以上都行
4、电位滴定法用于氧化还原滴定时指示电极应选用()。
A玻璃电极 B甘汞电极 C银电极 D铂电极 E复合甘汞电极
5、在电位法中离子选择性电极的电位应与待测离子的浓度()
A.成正比
B.的对数成正比
C.符合扩散电流公式的关系
D.符合能斯特方程式
6、离子选择性电极的选择系数可用于()。
A.估计共存离子的干扰程度
B.估计电极的检测限
C.估计电极的线性响应范围
D.估计电极的线性响应范围
7、用酸度计测定溶液的PH值时,一般选用______为指示电极。
A. 标准氢电极;
B.饱和甘汞电极;
C.玻璃电极。
8、用玻璃电极测量溶液pH值时,采用的定量方法为()
A. 校正曲线法
B. 直接比较法
C. 一次加入法
D. 增量法
9、用电位法测定溶液的pH值时,电极系统由玻璃电极与饱和甘汞电极组成,其中玻璃电极是作为测量溶
液中氢离子活度(浓度)的______。
A.金属电极,
B.参比电极,
C.指示电极,
D.电解电极。
10、总离子强度调节缓冲剂的最根本的作用是_____。
A. 调节pH值,
B. 稳定离子强度,
C. 消除干扰离子,
D. 稳定选择性系数
三、计算题
1.用电位滴定法测定硫酸含量,称取试样1.1969g,与小烧杯中,在电位滴定计上用c(NaOH)=0.5001mol/L 的氢氧化钠溶液滴定,记录终点时滴定体积与相应的电位值如下:
滴定体积/mL 电位值/mV 滴定体积/mL 电位值/mV
23.70 183 24.00 316
23.80 194 24.10 340
23.90 233 24.20 351
已知滴定管在终点附近的体积校正值为-0.03mL,溶液的温度校正值为-0.4mL/L,请计算试样中硫酸含量的质量分数(硫酸的相对分子质量为98.08).
2、用电位的定法测定碳酸钠中NaCl含量,称取2.1116g试样,加HNO3中和至溴酚篮变黄,以c(AgNO3)=0.05003mol/L的硝酸银标准溶液的滴定结果如下表:
加入AgNO3溶液/mL 相应的电位值/mV 加入AgNO3溶液/mL 相应的电位值/mV
3.40 411 3.70 471
3.50 420 3.80 488
3.60 442 3.90 496
根据上表数值,计算样品中NaCl含量的质量分数。
如果标准要求wNaCl≤0.50%,而标准未注明极限值的判定方法,请判断该产品是否合格?应如何报出分析结果?
3、用pH玻璃电极测定pH=5.0的溶液,其电极电位为43.5 mV,测定另一未知溶液时,其电极电位为14.5mV,若该电极的响应斜率为58.0 mV/pH,试求未知溶液的pH值。
4、、以0.05mol/kg KHP标准缓冲溶液(pH 4.004)为下述电池的电解质溶液,测得其电池电动势为0.209V,
玻璃电极 | KHP(0.05mol/kg)|| S.C.E.
当分别以三种待测溶液代替KHP溶液后,测得其电池电动势分别为:(1)0.312V,(2)0.088V,(3)-0.017V,计算每种待测溶液的pH值。
四、简答题
1、在用离子选择性电极测定离子浓度时,加入TISAB的作用是什么?
2、何谓指示电极及参比电极?举例说明其作用。
参考答案
1、负,正,Cu,Zn 2.可逆电池,不可逆电池,不可逆电池
3.拐点,的最高点,等于零 4.半波电位,极限扩散电流
5.电重量,汞阴极电解分离,恒电流,恒电位 6、下降,还原能力,上升,氧化能力
7.欧姆定律,电导滴定,普通电导滴定法,高频电导滴定法
8、解大面积饱和甘汞电极去极化电极9、未电解时体系的平衡电位,浓差,电化学10、 2.303RT/nF。
59.2mv; 29.6mv11、 6 12、20%。
13、恒定不对称电位,80,电位值不稳定。
二、选择题 1、B2、C 3 B 4 D 5 D 6 A 7 B 8 B 9 C 10 B
三、、计算题: 1、解:做E-V曲线确定滴定终点
在曲线的两个拐电处作两条切线,然后再两条切线中间做一条平行线,平行线与曲线的交点即为滴定终点。
得:
Vep=23.95ml
2、解:做E-V曲线确定滴定终点
在曲线的两个拐电处作两条切线,然后再两条切线中间做一条平行线,平行线与曲线的交点即为滴定终点。
得:
Vep=3.65ml
3、解:PH=5.0+(14.5-43.5)/58.0=4.5
四、简答题
1、在用离子选择性电极测定离子浓度时,加入TISAB的作用是:
(1)恒定离子强度
(2)缓冲PH
(3)掩蔽干扰
2、指示电极:电极电位随被测电活性物质活度变化的电极。
参比电极:与被测物质无关、电位已知且稳定,提供测量电位参考的电极。
