基础化学(李保山)D10z分子结构
基础化学第二版课后习题答案

基础化学第二版课后习题答案【篇一:基础化学第二版习题答案chap5】1.何谓沉淀溶解平衡?同物质的量的bacl2和h2so4混合溶液中,含有哪些离子?这些离子浓度之间存在着哪些关系?答:难溶电解质溶解和沉淀速度相等,固体的量和溶液中分子或离子的量不再改变的状态,称为沉淀溶解平衡。
ba2+、cl-、so4、h+、oh-2?2.活度积、溶度积、离子积之间有何区别与联系?答:活度积、溶度积指平衡状态下的活度积或浓度积,对给定的难溶电解质其活度积只与温度有关,溶度积不但与温度有关,还和溶液离子强度有关,对于ma型难溶电解质:?ksp(ma)。
离子积指任意状态下的浓度积,其值是任意的。
?(m?)??(a?)3.无副反应时,沉淀的溶度积与溶解度有何关系?溶度积小的物质,它的溶解度是否一定小?举例说明。
答:s?mmnn不同类型难溶电解质的溶解度不能根据溶度积数值大小直接判断。
溶度积小的物质,它的溶解度是不一定小,如ag2cro4与agcl。
4.除了沉淀物质本性以外,影响沉淀溶解度的主要因素有哪些?答:除了沉淀物质本性以外,影响沉淀溶解度的主要因素还有:同离子效应、盐效应、酸碱效应、配位效应等。
5.判断下列操作中可能发生的反应和现象并予以解释。
(1)将少量caco3固体放入稀hcl中。
(2)将少量mg(oh)2放入nh4cl溶液中。
答:(1)caco3固体溶解,有无色无味气体产生。
caco3(s)ca2+ + co32-+2h+h 2co 3→co2 +h 2o(2)mg(oh)2固体溶解,有无色刺激性气体产生。
的氨水,有肉色沉淀生成。
原因是饱和h2s水溶液提供的s2-很少,此时mg(oh)2(s)mg2+ + 2oh-+2nh4+(4)黑色固体变成白色固体。
so42- +h2o(5)白色沉淀变成黄色沉淀。
agcl(白)+ i-(6)浅兰色沉淀消失,生成深兰色溶液。
cu(oh)2 + 4nh3pb2++so42-→pbso4↓(白)agi(黄)+cl-[cu(nh3)4](oh)2答:(1)(2)减小(同离子效应);(3)增大(盐效应);(4)增大(配位效应)。
人民卫生出版社第7版《基础化学》第九章

第一节 氢原子的结构
五. 要点 • 电子具有波粒二象性,电子波是概率波。 • 电子等微观粒子遵守测不准原理。原子中电子 运动状态体现为在核外空间出现的概率。 • 电子的运动状态用波函数ψ描述。波函数ψ2表 示电子的概率密度。 • 每一ψ对应一确定的能量值,称为定态。电子 的能量具有量子化的特征,是不连续的。基态 时能量最小,比基态能量高的是激发态。
第二节 量子数和原子轨道
一. 量子数 量子数组合和原子轨道数
轨道角动 主量子 量量子数 数n l 1 0 0 磁量子 数m 0 0 波函数ψ ψ1s ψ2s 同层轨 道数 (n2) 1 容纳电 子数 (2n2) 2
2 1
0 ±1
ψ2p ψ2p ψ2p
z x
4
y
8
第二节 量子数和原子轨道
一. 量子数 量子数组合和原子轨道数
一. 量子数 1. 主量子数(principal quantum number) • 符号 n,可以取任意正整数值,即 n = 1,2,3,… • 它是决定电子能量的主要因素。氢原子只有一 个电子,能量只由n决定
多电子原子存在静电排斥,能量还取决于 l。
RH En 2 n
第二节 量子数和原子轨道
第二节 量子数和原子轨道
一. 量子数 2. 轨道角动量量子数(orbital angular momentum quantum number) • 符号 l ,它只能取小于 n 的正整数和零 l = 0、1、2、3 … (n – 1),共可取n个值 • 它决定原子轨道的形状(n 种)。
第二节 量子数和原子轨道
第一节 氢原子的结构
一.氢光谱和氢原子的玻尔模型 4. Bohr 的氢原子模型
• Bohr运用量子化观点,成功地解释了氢原子的 稳定性和不连续光谱。但未能冲破经典物理学 的束缚,不能解释多电子原子光谱,甚至不能 说明氢原子光谱的精细结构。Bohr理论属于旧 量子论。电子等微观粒子的运动不遵守经典物 理学规律,必须用量子力学方法来描述。
基础化学李保山第二版8 氧化还原反应习题答案教学内容

8 氧化还原反应习题解答(p222-226)1. 用氧化值法配平下列各氧化还原方程式。
(1)3Cu 2S +22HNO 3 = 6Cu(NO 3)2 +3H 2SO 4 +10NO+8H 2O (2)NH 4NO 2 = N 2 + 2H 2O(3)(NH 4)Cr 2O 7 = N 2 + Cr 2O 3 +4H 2O(4)3As 2S 3 + 28HNO 3+4 H 2O = 6 H 3AsO 4 + 9H 2SO 4 +28 NO (5)K 2Cr 2O 7 + 3H 2S +4 H 2SO 4 = Cr 2(SO 4)3 + 3S + 7H 2O + K 2SO 4 (6)2Na 2S 2O 3 + I 2 = Na 2S 4O 6 + 2NaI (7)2 MnO 4-+3 Mn 2+ +2 H 2O =5 MnO 2 +4 H +(8)4[Co(NH 3)6]2+ + O 2 +2H 2O = 4 [Co(NH 3)6]3+ + 4OH -2. 用离子-电子法配平下列方程式。
(1-11)为酸性介质,(12-14)为碱性介质 (1) Cr 2O 72-+ 3H 2O 2 + 8H + = 2 Cr 3+ + 3O 2 +7 H 2O (2) 2 MnO 4-+5 SO 32-+6 H + = 2Mn 2+ + 5 SO 42-+3 H 2O (3) ClO 3-+ 6I - + 6H + = Cl - +3 I 2 + 3H 2O(4) 5NaBiO 3(s) + 2Mn 2+ +14 H + = 5Na + +5 Bi 3+ + 2 MnO 4-+7 H 2O (5) H 2S +2 Fe 3+ = S +2Fe 2+ + 2H +(6) 3P 4(s)+20HNO 3(浓)+8 H 2O =12H 3PO 4+20NO(7) 2FeS 2+30HNO 3→Fe 2(SO 4)3+30NO 2+H 2SO 4+14H 2O (8) 7PbO 2+2MnBr 2+14HNO 3→7Pb(NO 3)2+2Br 2+2HMnO 4+6H 2O (9) 28HNO 3+3As 2S 3+4H 2O →9H 2SO 4+6H 3AsO 4+28NO (10) As 2S 5+10NO 3-+10H +→2H 3AsO 4+10NO 2+5S+2H 2O (11) 2Bi 3++3S 2O 32-+3H 2O →Bi 2S 3+3SO 42-+6H + (12) Cl 2 + 2OH -== Cl - + ClO -+ H 2O(13) 2[Cr(OH)4]- + 3H 2O 2 + 2OH -== 2 CrO 42-+8H 2O (14) SO 32-+ Cl 2 +2OH -==2 Cl - + SO 42-+ H 2O3. (1)逆向进行(2) )(0=θ/Sn n θ+24V E E 15.=++S)(=θ/MgMg θ-V E E 37.22-=+)(2.370.15=-θ-θ+θV E E E 52.2=+=∴正向进行(3) )1.09(==θ/Br Br θ+-2V E E)(77.0==θ/Fe e F θ-+2+3V EE)(32.0=0.77-1.09=-=θ-θ+θV E E E∴正向进行 (4) )(=θ/Pbθ+2V E E 13.0-=+Pb )(=θn/Z n θ-2V E E 76.0-=+Z )(0-0.13=-θ-θ+θV E E E 63.076.=+=∴正向进行4.(1)V n n E 55.1100.1)0.1(10.0lg 50592.051.1)M /O M (4824=⨯⨯+=-+-(2)V E 67.110.00.1lg 10592.072.1)Ce /Ce (34=+=++(3)VcK E E HAc 17.01075.110.0lg 0592.000.0lg 10592.0)/H H ()HAc/H (522-=⨯⨯+=+=-+θθ(4)Vc K g E E Cl sp 341.0100.1108.1lg 0592.0799.0lg 10592.0/Ag)A ()AgCl/Ag (210+=⨯⨯+=+=--+-θθ(5)Vc c c c c c E E 40.018.058.0)100.1(0.10.1lg 40592.058.0)/)(/()/(lg 40592.0)O /S SO ()O /S SO (6226OH O S 2SO 232232322323223-=+-=⨯⨯+-=+=--------θθθθ(6)Vc c p p E E O 564.0)100.1(100/0.10lg 40592.0401.0)/(/lg 40592.0)/OH O ()/OH O (434OH 222=⨯+=+=----θθθ5. 解答:(1)2Ag +(0.10 mol·L -1) + Cu(s) ==2Ag(s) + Cu 2+(0.010 mol·L -1) 电池符号: (-) Cu|Cu 2+(0.010 mol·L -1)||Ag +(0.10 mol·L -1)|Ag (+) 电极反应: (+) Ag ++e = Ag(s) (-) Cu-2e = Cu 2+ 电动势∶V c c g E A g E Ag 740.010.0lg 0592.0799.0lg 10592.0/Ag)A ()g /A (+=+=+=+++θθV c c C Cu E C Cu E Cu 278.0010.0lg 20592.0337.0lg 20592.0)u /()u /(222+=+=+=+++θθV C Cu E A g E E 462.0278.0740.0)u /()g /A (2=-=-=++(2)MnO 2(s)+ 2Cl -(12 mol·L -1) + 4H +(12 mol·L -1) = Mn 2+(1.0 mol·L -1) + Cl 2(100kPa) + 2H 2O(l) 电池符号:(-) Pt, Cl 2(100kPa)|Cl -(12.0 mol·L -1)||Mn 2+(1.0mol·L -1),H +(12.0 mol·L -1)|MnO 2(s),Pt(+) 电极反应:(+) MnO 2+ 4H ++2e== Mn 2++ 2H 2O\ (-) 2Cl —2e== Cl 2电动势∶Vc c c c E E Mn 36.10.112lg 20592.023.1/)/(lg 20592.0)/Mn MnO ()/Mn MnO (44H 22222+=+=+=++++θθθVc c p p E E Cl 30.1121lg 20592.036.1)/(lg 20592.0)/Cl Cl ()/Cl Cl (22Cl 222+=+=+=--θθθV E 06.030.136.1=-=(3)H 3AsO 3(0.10 mol·L -1)+ I 2(s) + H 2O(l) = H 3AsO 4(1.0 mol·L -1) + 2I -(0.010 mol·L -1) +2H +(0.10 mol·L -1) 电池符号:(-) Pt|H 3AsO 4 (1.0 mol·L -1), H +(0.10 mol·L -1), H 3AsO 3(0.10 mol·L -1)||I -(0.010mol·L -1)|I 2(s), Pt (+)电极反应: (+) I 2+2e =2I -(-) H 3AsO 3+ H 2O-2e = H 3AsO 4+2H +电动势∶34332H AsO H34333433H AsO 2(/)(/)0.0592(H AsO /H AsO )(H AsO /H AsO )lg 2/0.0592 1.0(0.10) 0.559lg 0.52920.10c c c c E E c c Vθθθθ+=+⨯=+=+22222I 0.059210.05921(I /I )(I /I )lg 0.536lg 0.6542(/)2(1.010)E E V c c θθ----=+=+=⨯E = 0.654-0.529=0.125V(4)Cr 2O 72-(1.0 mol·L -1) + 6Fe 2+(0.10 mol·L -1) +14H +(1.0 mol·L -1) = 2Cr 3+(0.10 mol·L -1) + 6Fe 3+(1.0 mol·L -1) + 7H 2O(l) 电池符号:(-)Pt|Fe 3+(1.0 mol·L -1), Fe 2+(0.10 mol·L -1)||Cr 2O 72-(1.0mol·L -1), Cr 3+(0.10mol·L -1), H +(1.0 mol·L -1)|Pt (+)电极反应:(+) Cr 2O 72-+14H ++6e = 2Cr 3++ 7H 2O(-) Fe 2+-e = Fe 3+电动势∶227314Cr O H232327272Cr (/)(/)0.0592(Cr O /Cr )(Cr O /Cr )lg6(/)c c c c E E c c θθθθ-++-+-+=+1420.0592(1.0)(1.0)1.33lg 1.356(0.10)V =+=323232Fe Fe /0.0592 1.0(Fe /Fe )(Fe /Fe )lg 0.7710.0592lg 0.8301/0.10c c E E Vc c θθθ++++++=+=+=+E =1.35-0.830=0.52V6. 解答:(1) E =E (+)-E (-)θθθc c c c E E E /lg 20592.0440.0/lg 20592.0)/Fe Fe ()/Fe Fe ()(22Fe Fe 22+++-=+==+++V c c E E E 822.0100.1lg 20592.0763.0/lg 20592.0)/Zn Zn ()/Zn Zn ()(2Zn 222-=⨯+-=+==--+++θθ0.293= -0.440+(0.0592/2)lg c (Fe2+)+0.822 c (Fe2+)=1.0×10-3(mol·L -1) (2)(-)Ag ∣Ag +(y mol·L -1)‖Ag +(1.0×10-1 mol·L -1)∣Ag (+) E =0.0592V ,求负极Ag +的浓度。
人民卫生出版社第7版《基础化学》习题第十章

共价键与分子间力首页难题解析学生自测题学生自测答案章后习题解答难题解析[TOP]例10-1试用杂化轨道理论说明乙烯分子的形成及其构型。
分析根据杂化轨道理论,形成乙烯分子时,C原子的价层电子要杂化。
共价键形成时,σ键在成键两原子间能单独存在,且只存在一个; 键在成键两原子间不能单独存在,但可存在多个。
乙烯分子中C原子的4个价电子分别与其它原子形成三个σ键,C、C原子间的双键中有一个是π键。
三个σ键决定分子构型,因此C原子有三个原子轨道参与杂化,形成三个等性杂化轨道。
解乙烯分子C2H4中有2个C原子和4个H原子,每个基态C原子的价层电子组态为2s2 2p2,在形成乙烯分子的过程中,1个2s电子被激发到2p空轨道上,然后1个2s轨道和2个2p轨道杂化形成3个等同的sp2杂化轨道,彼此间夹角为120º。
每个C原子的2个sp2杂化轨道各与1个H原子的1s轨道重叠形成2个C—H σ键;2个C原子间各以1个sp2杂化轨道互相重叠,形成1个σ键。
由于2个C 原子的这6个sp2杂化轨道处于同一平面,未参与杂化的2p z轨道则垂直于该平面,“肩并肩” 重叠形成1个π键,构成C=C双键。
乙烯分子中6个原子在一个平面上,分子呈平面构型。
例10-2 利用价层电子对互斥理论预测-I的空间构型。
3分析先确定中心原子的价电子对数,中心原子提供7个电子,配位提供1个电子,加上负离子的电荷数,得价层电子数的总和再除以2。
然后根据价层电子对构型和孤对电子决定-I的空间构型。
3解-I中有3个I原子,我们可将其中1个I作为中心原子,其余2个作为配位体。
中心原子I有73个价电子,2个配位I原子各提供1个电子,-I离子的负电荷数为1,所以中心原子的价电子对数为3(7+2+1)/2=5 。
价层电子对构型为三角双锥,因配位原子数为2,说明价层电子对中有2对成键电子对和3对孤对电子,以3对孤对电子处在三角双锥的三角形平面上排斥能最小,所以-I为直线型。
基础化学(李保山)D4z热力学

敞开系统
封闭系统
隔离系统 9
1.2 状态和状态函数
状态 由一系列表征体系性质的物理量所确定下来的 体系的一种存在形式,称为体系的状态。
状态函数 确定体系状态的物理量,称为状态函数。
例如某理想气体体系 n = 2 mol, p = 1.013 10 5 Pa, V = 44.8 dm 3 , T = 273 K 这就是一种状态。是由 n、p、V、T 所确定下来的 体系的一种存在形式 。 因而 n、p、V、T 都是体系的状态函数。
虽然体系的内能尚不能求得,但是体系的状态一定 时,内能是一个固定值。因此,热力学能 U 是体系的 状态函数。
体系的状态发生变化,始终态确定,则内能变化量 U 是一定值, U = U终 - U始 。
28
§2 热力学第一定律和热化学
2.1 热力学第一定律 2.2 焓变和热化学方程式 2.3 Hess定律
过程着重于始态和终态;而途径着重于具体方式。
13
该过程可以经由许多不同的途径来完成。 下面给出其中两种途径:
0.5 10 5 Pa 4 dm3
1 10 5 Pa 2 dm3
始态
途径 I
途径 II 4 10 5 Pa
0.5 dm3
2 10 5 Pa 1 dm3
终态
状态函数的改变量,取决于始态和终态,不管途径如何不同。
1.热 ( Q )
系统与环境之间由于存在温差而传递
的能量。 热不是状态函数。
规定 系统吸热: Q >0 系统放热: Q <0
如:
Q = 30 J, 表示体系吸热 30 J, Q = - 40 J,表示体系放热 40 J 。 体系吸热为正,放热为负。
18
2. 体积功
基础化学第二版李保山8 氧化还原反应习题解答-学生

第八章氧化还原反应习题 (p222-226) 参考答案1.解答:(1)3Cu2S +22HNO3 ==6Cu(NO3)2 +3H2SO4 +10NO↑+8H2O(2)NH4NO2 == N2↑+ 2H2O(3)(NH4)2Cr2O7 == N2↑+ Cr2O3 +4H2O(4)3As2S3 + 28HNO3+4 H2O ==6 H3AsO4 + 9H2SO4 +28 NO↑(5)K2Cr2O7 + 3H2S +4 H2SO4 == Cr2(SO4)3 + 3S↓ + 7H2O + K2SO4(6)2Na2S2O3 + I2 == Na2S4O6 + 2NaI(7)2 MnO4-+3 Mn2+ +2 H2O ==5 MnO2↓ +4 H+(8)4[Co(NH3)6]2+ + O2 +2H2O ==4 [Co(NH3)6]3+ + 4OH-2.解答:(1)Cr2O72- + 3H2O2 + 8H+ ==2 Cr3+ + 3O2↑ +7 H2O(2)2 MnO4- +5 SO32- +6 H+ == 2Mn2+ + 5 SO42- +3 H2O(3)ClO3- + 6I- + 6H+ == Cl- +3 I2 + 3H2O(4)5NaBiO3(s) + 2Mn2+ +14 H+ == 5Na+ +5 Bi3+ + 2 MnO4- +7 H2O(5)H2S +2 Fe3+ ==S +2Fe2+ + 2H+(6) 3P4(s)+20HNO3(浓)+8 H2O ===12H3PO4+20NO↑(7) 2FeS2+30HNO3==Fe2(SO4)3+30NO2↑+H2SO4+14H2O(8) 7PbO2+2MnBr2+14HNO3==7Pb(NO3)2+2Br2+2HMnO4+6 H2O(9) 28HNO3+3As2S3+4H2O==9H2SO4+6H3AsO4+28NO↑(10) As2S5+10NO3-+10H+==2H3AsO4+10NO2↑+5S↓+2 H2O(11) 2Bi3++3S2O32-+3H2O==Bi2S3↓+3SO42-+6H+(12)Cl2 + 2OH-== Cl- + ClO-+ H2O(13)2[Cr(OH)4]—+ 3H2O2 + 2OH—== 2 CrO42- +8H2O(14)SO32- + Cl2 +2OH-==2 Cl—+ SO42-+ H2O3.解答:(1)逆向;(2)正向;(3)正向;(4)正向4.解答:(1)1.55V;(2)1.67V;(3)-0.17V;(4 ) 0.34V;(5)-0.40V;(6)0.56V5.解答:(1)所以电极反应:(+) Ag++e==Ag(-) Cu2+ +2e== Cu电池符号:(-) Cu|Cu2+(0.010mol·L-1)||Ag+(0.10 mol·L-1)|Ag (+)电动势∶E=0.46V(2)电极反应:(+) MnO2+ 4H++2e== Mn2++ 2H2O(-) Cl2+2e ==2C l-电池符号:(-) Pt, Cl2(100kPa)|Cl-(12.0 mol·L-1)||Mn2+(1.0 mol·L-1),H+(12.0mol·L-1)|MnO2(s),Pt (+)电动势∶E =0.06V(3)反应正向进行,电极反应为:(+) I 2+2e==2I -(-) H 3AsO 4+2H ++2e ===H 3AsO 3+ H 2O 电池符号:(-) Pt|H 3AsO 4 (1.0 mol·L -1) ,H +(0.10 mol·L -1), H 3AsO 3(0.10 mol·L -1)||I -(0.010 mol·L -1)|I 2(s),Pt (+)电动势∶E =0.13V(4)反应正向进行,电极反应:(+) Cr 2O 72-+14H ++6e= 2Cr 3++ 7H 2O (-) Fe 3++e ==Fe 2+ 电池符号:(-)Pt|Fe 3+(1.0 mol·L -1), Fe 2+(0.10 mol·L -1)||Cr 2O 72-(1.0mol·L -1),Cr 3+(0.10 mol·L -1),H +(1.0 mol·L -1)|Pt (+)电动势∶E =0.52V6.解答:(1)x =1.2×10-3 mol·L -1;(2)y = 0.010 mol·L -1;(3) x min =1.42 mol·L -17.解答: E θ(Ag +/Ag)= +0.79932V8.解答: =7.1×10θPbI sp,K -99.解答:E θ(Ag 3PO 4/Ag)==0.49V 10.解答:E Ag 2S/Ag =-0.20V11.解答: (HCN)=6.22×10θK -1012.解答: E θ(H 3PO 4/H 2)= - 0.13V 13.解答:(1)电极反应式为:(+) Ag ++e == Ag(-) Zn 2+ +2e == Zn原电池符号: (-)Zn|Zn 2+(0.30 mol·L -1)||Ag +(0.10 mol·L -1)|Ag (+) (2)该原电池的电动势E =1.52V (3) 52θ100.5×=K (4)127L mol 106.2]Ag [−−+⋅×=14.解答:K θ=3.8×10515.解答:Ag +先被还原;c (Ag +)=5.3×10-9mol .L -116.解答:V 1.1)/Cr O Cr (3-272=+E17.解答:(1)逆向进行(2)(-)Pt|Cr 3+(1 mol·L -1),Cr 2O 72-(1 mol·L -1),H +(1 mol·L -1)||Cl -(1mol·L -1)|Cl 2(p θ), Pt (+) 电极反应式:+)3Cl 2+6e = 6Cl --)Cr 2O 72-+14H ++6e=2Cr 3++3Cl 2+7H 2O(3) 逆向进行;V E 44.0=18.解答:]S [lg 20592.0]Cu lg[20592.02θsp,CuS θ)/Cu Cu (2θ)/Cu Cu ()/Cu Cu (222−++=+=+++K E EE126.0V 702.0783.0103.6lg 20592.0337.0θ/PbPb 362−=<−=×+=+−E V 所以可以正常放电。
《基础化学》习题答案第3版

《基础化学》习题答案(第3版)第一章 习题答案1.答:能量单位J 、质量单位μg 、长度单位nm 、温度单位℃、属于SI 单位;其他不是。
2.答:SI 基本单位:m 、kg 、s 、A 、K 、mol 、cd 。
3.答:一切属于国际单位制的单位都是我国的法定计量单位。
根据我国的实际情况,在法定计量单位中还明确规定采用了若干可与国际单位制并用的非国际单位制单位。
第二章习题答案1. 解: 根据)()O H ()O H ()O H (222蔗糖n n n x +=0292mol .0mol 342g g0.10)( mol 56.5mol 18.0g g 100)O H (1-1-2=⋅==⋅=蔗糖n n995.00.0292molmol 56.5mol56.5)O H (2=+=xkPa33.20.995kPa 34.2)O H ()O H (2*2=⨯==x p p2.解:)B ()O H ()()O H (999.00.1molmol 08mol08)O H ()O H ()O H ()O H (899.00.1molmol 04mol04)O H ()O H ()O H ()(999.00.1molmol 80mol80)()()()O H (999.00.1mol mol 80mol80)O H ()O H ()O H (*2**2*22*22*2*22*23***2*2*22*21答案为苯苯苯苯苯∴>=+⋅===+⋅===+⋅===+⋅==p p p p x p p p p x p p p p x p p p p x p p3.解:与人体血浆等渗。
11os f 11os f B f B f f 11-1-1-os L mmol 310L mol 31.0C58.0K58.0L mol 31.0mol kg K 86.1L mol 31.0L00.1mol 147g g33.03mol 74.6g g 30.02mol 58.5g g 50.82-----⋅=⋅=︒-==⋅⨯⋅⋅=≈≈=∆⋅=⋅⨯+⋅⨯+⋅⨯=c T c K c iK b iK T c4.解:K 85.1molkg K 512.00.510Kmol kg K 86.1mol g 1.28mol kg 0281.00.510K 250g g 00.7mol kg K 512.011b b f B f f 111b A B b B =⋅⋅⋅⋅⋅=∆⋅=⋅=∆⋅=⋅=⨯⨯⋅⋅=∆⋅⋅=-----K T K b K T T m m K MT f = -1.85℃ 5. 解:压略高于人体眼液的渗透kPa869K 310K mol L kPa 314.8L mol 337.0L mmol 337L mol 337.0mL10001.000LmL 1000mol 61.8g g 00.17mol 161.5g g 00.52111-os 1-1-1-1-os =⨯⋅⋅⋅⨯⋅==⋅=⋅=⨯⋅+⋅⨯=--RT c Πc6. 解:11A fB f B 11A b B b B mol kg 61.1100g0.220K g0.19mol kg K 86.1mol kg 62.1100g 0.0600K g 0.19mol kg .512K 0----⋅=⨯⨯⋅⋅=∆=⋅=⨯⨯⋅⋅=∆=m T m K M m T m K M用两种方法计算该物质的相对分子质量基本相同。
基础化学李保山第二版9原子结构习题答案

9 原子结构习题解答(p262-265)思考题:1. 1862年,尚古多提出了元素的性质就是原子量的变化论点,创造了一个元素螺旋图,初步提出了元素的周期性。
1864年,迈尔提出了六元素表,为元素周期表提供了雏形。
1865年,纽兰兹将元素按原子量次序排列发现了八音律。
1869年,人们已经发现了63种元素,门捷列夫按原子量的大小和元素的化学性质之间的关系列成一张表,这便是他的第一张元素周期表。
经过继续努力,1871年他发表了关于周期律的新的论文。
文中他修正了1869年发表的元素周期表。
在前表中,性质类似的各族是横排,周期是竖排;而在新表中,族是竖排,周期是横排,这样各族元素化学性质的周期性变化就更为清晰。
同时他将那些当时性质尚不够明确的元素集中在表格的右边,形成了各族元素的副族。
在前表中,为尚未发现的元素留下4个空格,而新表中则留下了6个空格。
元素周期律,使人类认识到化学元素性质发生变化是由量变到质变的过程,把原来认为各种元素之间彼此孤立、互不相关的观点彻底打破了,使化学研究从只限于对无数个别的零星事实作无规律的罗列中摆脱出来,从而奠定了现代化学的基础。
2. 根据电子排布顺序得出,第八周期排布为:8s、5g、6f、7d、8p,s轨道2个电子、p轨道6个电子、d轨道10个电子、f轨道14个电子、g轨道18个电子,总共有50个电子,也就是八周期元素共有50个元素。
3. 在多电子体系中,由于其他电子对某一电子的排斥作用而抵消了一部分核电荷,从而引起有效核电荷的降低,削弱了核电荷对该电子的吸引,这种作用称为屏蔽作用或屏蔽效应。
在原子核附近出现的概率较大的电子,可更多地避免其余电子的屏蔽,受到核的较强的吸引而更靠近核,这种进入原子内部空间的作用叫做钻穿效应。
与屏蔽效应相反,外层电子有钻穿效应。
外层角量子数小的能级上的电子,如4s电子能钻到近核内层空间运动,这样它受到其他电子的屏蔽作用就小,受核引力就强,因而电子能量降低,造成E(4s) <E(3d) 。
基础化学(2007年人民卫生出版社出版的图书)

无机化学
基础化学之无机化学
1、课程性质
《无机化学》教学大纲是以综合性大学化学专业部颁无机化学教学大纲为基础,结合我校实际情况制定的。 根据面向21世纪的培养目标,加强素质教育,培养学生的综合能力的精神,依据国家教委颁发的化学专业课程的 知识点,加强基础,删除陈旧的内容,为后续课程提供必要的基础理论和基本化学知识,与后续课程协调分工, 减少重复,减少学时,努力提高教学质量。
基础化学基础教材可作为化学近源专业类的基础化学课程或普通化学课程的教材,也适用于化学远源专业的 学生(如机、电等)以及对化学感兴趣的学生自学。
课程特点
1、本课程具有直观性和系统性强的特点,通过讲授和实践教学环节,要求学生掌握其基本理论、基本知识和 基本技能,注意和提高学生分析问题、解决问题的能力和实际动手操作能力,同时注重基本理论知识的巩固,为 相关专业课程奠定坚实的基础。
本课程是学生进大学后的第一门化学课,它的任务是为学习后续的《分析化学》、《有机化学》、《物理化 学》等课程提供必需基本理论知识,同时掌握无机化学常见元素单质、化合物的性质,以及无机化学常见反应类 型和反应规律。教学中既要注意与中学内容相衔接,又力求以近代化学学科基础理论为起点。课程课堂教学时数 为90学时,分上下两学期进行。
2、教学方法:课堂讲授为主,自学和多媒体教学为辅。
普通化学
基础化学之普通化学
基础化学
1、课程性质
普通化学是一门关于物质及其变化规律的基础课。它简明地反映了近代化学学科的一般原理,是化学与工程 技术间的桥梁,是培养全面发展的现代技术人员的知识结构和能力的重要组成部分。
基础化学李保山第二版-化学热力学基础习题标准答案

基础化学李保山第二版-化学热力学基础习题答案————————————————————————————————作者:————————————————————————————————日期:2884 化学热力学基础习题解答(p87-89)思考题1.解:(1) ⨯ 原因见(3)(2) ⨯ 原因见(3)(3) √ 确切地说,应为:恒压过程中,系统的焓变等于恒压反应热。
(4) ⨯ H 是状态函数,任何过程都有∆H ,不是只有恒压过程才有∆H 。
(5) ⨯ 原因见(7) (6) ⨯ 原因见(7)(7) √ 应为:在某温度和标准压力下,最稳定的纯态单质的标准生成焓等于零。
(8) ⨯ 由于CaCO 3的生成焓为负值,但不是由于它的分解是吸热的。
(9) ⨯ 热化学方程式的系数影响反应的焓变值。
2.解:(1)、(2)、(5)单质的标准生成焓不等于零。
3.解:(1) 不同,因为二反应方程式中各物质前的系数不同; (2) 不同,因为二反应中Br 2的状态不同。
4.解:书写热化学方程式应注意:(1) 注明各物质前的计量系数−表明物质的量。
(2) 标明物质所处的状态(l 、g 、s)和晶形;对于溶液中的反应,还要注明物种的浓度,以aq 代表水溶液。
(3) 注明温度。
(4) 标明反应热(焓变)。
5. 解:(1) ∆S > 0 ; (2) ∆S > 0 ; (3) ∆S > 0 ; (4) ∆S < 0 ; (5) ∆S < 0 ; (6) ∆S < 0 6. 解:(1) ∆S < 0 ; (2) ∆S > 0 ; (3) ∆S > 0 ; (4) ∆S < 0 ; (5) ∆S > 0习题1.解:(1) ∆U = Q + W = 100 – 540 = - 440 J(2) ∆U = Q + W = – 100 + 635 = 535 J2.解:(1) W = – p 外∆V = – 100( 0.040 – 0.015 ) = - 2.5 kJ(2) 中间平衡态时,气体的体积为V = 33025.010200298314.80.2m p nRT =⨯⨯⨯= W = – p 外,1∆V 1 + (– p 外,2∆V 2) = - 200(0.025-0.015) - 100(0.040-0.025) = - 3.5 kJ3.解:此过程为: )()(22l O H g O H =解法1:恒压过程:∆H = Q = - 2.26 ⨯ 450 = -1017 kJ∆U = ∆H – (∆n)RT = -1017 – ( 0 - 18450)⨯ 8.314 ⨯ (100 + 273.15) ⨯ 10-3 = -939.4 kJW = ∆U – Q = -939.4 – (-1017) = 77.6 kJ9 9解法2:33311m 76480Pa 103101mol Kg 100218K 15373K mol J 3148Kg 450 0218450../....V RT .pV nRT pV =⨯⋅⨯⋅⋅⋅⋅=⇒=⇒=--- 所以77.5KJ 7648.0103.101W 33=⨯⨯=m PaKJ 1017g 450KJ/g 26.2-=⨯-=Q由于为恒压过程,KJ 1017Q -==∆p H-939.5KJ 77.5KJ KJ 1017U =+-=+=∆W Q4.解:方程式 (1) – (2) 得2N 2(g) + 2O 2(g) = 4NO(g) ∆H θ = 360 kJ ⋅mol -1所以11904360),(--⋅=⋅=mol kJ mol kJ g NO H m f θ∆5.解:反应)()(2)(42g CH g H s C =+可由 (1) + 2 ⨯ (2) – (3) 得到,所以123123935228588900753.(.)(.).r m r r r H H H H kJ mol θθθθ-∆=∆+⨯∆-∆==-+⨯---=-⋅6.解:① N 2H 4(l)生成反应为:N 2(g) + 2H 2(g) → N 2H 4(l)由反应[(2) ⨯ 3 + (3) – (1) – (4)]/4 得 N 2(g) + 2H 2(g) → N 2H 4(l)② N 2H 4(l)的)]4()1()3()2(3[41θθθθθm r m r m r m r m f H H H H H ∆-∆-∆+∆=∆16.50)]8.285()5.1011()143()3.317(3[41-⋅=-----+-⨯=mol kJ7.解:由反应(1) – 2 ⨯ (2) – 2 ⨯ (3)得N 2H 4 (l) + 2H 2O 2 (l) → N 2 + 4H 2O(l) 故此反应的12.818)5.51(25.14922.622)3(2)2(2)1(-⋅-=-⨯-⨯--=∆⨯-∆⨯-∆=∆mol kJ H H H H m r m r m r m r θθθθ8.解:(1) 反应NH 3(g) + HCl(g) = NH 4Cl(s) 的4313144461923176 (,)(,)(,).(.)(.)r m f m r m f mH H NH Cl s H NH g H HCl g kJ mol θθθθ-∆=∆-∆-∆=-----=-⋅故2.0mol HCl (g)与2.0mol NH 3 (g)反应生成NH 4Cl (s)放出的热量为2 ⨯ 176 kJ = 352 kJ ;(2) 由于HCl (g) → HCl (aq)12.73-⋅-=∆mol kJ H m r θ1010NH 3 (g) → NH 3 (aq)12.35-⋅-=∆mol kJ H m r θNH 3 (aq) + HCl (aq) = NH4Cl (aq) 1602.r mH kJ mol θ-∆=-⋅ 故1.0mol HCl (g)和1.0mol NH 3 (g)同时溶解于水中NH 3 (g) + HCl (g) = NH4Cl (aq) (i) 的热效应为7323526021686.(.)(.).r mH kJ mol θ-∆=-+-+-=-⋅(3) (i)过程的热效应),(),(),(34g HCl H g NH H aq Cl NH H H m f m r m f mr θθθθ∆-∆-∆=∆ 4)3.92()1.46(),(=----∆=aq Cl NH H m f θ可求出),(4aq Cl NH H m f θ∆=-307.0 kJ ⋅mol -1(4) 用反应NH 3(g) + HCl(g) = NH 4Cl(aq)减去NH 3(g) + HCl(g) = NH 4Cl(s)得 NH 4Cl(s) = NH 4Cl(aq)此过程的热效应为14.7)176(6.168-⋅=--=∆mol kJ H m r -θ,所以NH 4Cl (s)溶解是吸热过程。
基础化学(李保山)D6z-酸碱

能够准确反映整个平衡体系当中质子转移 的严格的数学关系时称为质子条件式 步骤: 1. 选择溶液中大量存在且参加质子转移的物 质为零水准(参考水平). 2. 失去质子变为零水准的物质总浓度等于得 到质子变为零水准的物质总浓度
例:写出Na2CO3溶液的质子条件式
解
得质子产物 HCO3
3
酸碱的相对强弱
酸越强,给出质子的能力越强,它的
共轭碱接受质子的能力越弱,共轭碱
就越弱;酸越弱,它的共轭碱就越强。
酸性 HClO4> H2SO4 > H3PO4>HAc >
H2CO3 > H2O
碱性 ClO4- < HSO4- < H2PO4- < Ac- < HCO3- < OH-
弱酸、弱碱的解离平衡常数
酸碱反应的实质:酸碱反应的实质是形
成配位键的反应;碱提供电子对,酸以
空轨道接受电子对形成配位键。 H+ + :OH– HOH AlCl3 + Cl – AlCl4 – Cu2+ + 4:NH3 Cu2+4(NH3)
Lewis的电子理论有关酸、碱的划分 凡金属阳离子及缺电子的分子都是酸; 凡与金属离子结合的阴离子或中性分子 都是碱。
HAc
HCN
Kaθ 1.810-5
5.810-10
K 越大,表明酸碱越强
水: K w
弱酸:K a 弱碱: K b
pKw
pKa
pKb
§3
酸碱溶液中pH值的计算
3.1 酸碱溶液pH值计算 3.2 溶液中酸碱各种存在形式的平衡浓度的计算
3.1 酸碱溶液pH值计算
基础化学(第二版)

复习指导
3
英汉词汇对照
4 化学史话发现
DNA分子结构 的科学家
5
习题
1
13.1配合物的 基础知识
13.2配合物的 2
空间构型和异 构现象
3
13.3配合物的 价键理论
4
13.4配合物的 晶体场理论
5
13.5配位平衡
13.6配合物在 1
生物医药方面 的应用
2
复习指导
3
英汉词汇对照
4
化学史话维尔 纳与配位学说
11.1微观粒子的基 本特征
11.2单电子原子的 结构
11.3多电子原子的 结构
11.4元素周期律
1
11.5元素和人 体健康
2
复习指导
3
英汉词汇对照
4 化学史话德布
罗意与波粒二 象性
5
习题
12.1共价键理论 12.2杂化轨道理论
12.3价层电子对互 斥理论
12.4分子轨道理论
1
12.5分子间作 用力
2.2溶液的蒸气压下 降
2.3溶液的沸点升高
2.4溶液的凝固点降 低
1
2.5溶液的渗 透压
2
复习指导
3
英汉词汇对照
4 化学史话张孝
骞与血容量研 究
5
习题
1
3.1强电解质 溶液理论
2
3.2酸碱理论
3 3.3弱电解质
溶液的解离平 衡
4
3.4酸碱溶液 pH值的计算
5 3.5难溶强电
解质的沉淀与 溶解平衡
5
习题
01
14.1晶体 结构概述
02
14.2原子 晶体与分子 晶体
03
基础化学(第3版)课件:第六章 胶体和乳状液

2021年6月24日星期四
第五章 胶体和乳状液
32
【例5-1】利用 AgNO3 溶液和KI 溶液制备AgI 溶胶 的反应为
AgNO3 + KI → AgI + KNO3
若将24.0 mL 0.0200mol·L-1 的KI溶液和200 mL 0.050 0 mol·L-1AgNO3 溶液混合,制备AgI 溶胶,写出该溶胶的 胶团结构式,并判断其在电场中的电泳方向。
胶核 (colloidal nucleus)与吸 附层合称为胶粒 (colloidal particle),把胶粒与 扩散 层 合称为 胶团 (colloidal micell),溶胶就是指所有胶团和胶团间液构成 的整体。
2021年6月24日星期四
第五章 胶体和乳状液
31
【例】金溶胶的胶团结构式为
(2)KI过量时,AgI胶核吸附过量的I-离子而带 负电荷,其胶团结构式为
[(AgI)m·nI-·(n-x)Ag+]x-·x Ag+
2021年6月24日星期四
第五章 胶体和乳状液
35
2.胶核表面分子的离解
例如,硅胶的胶核是由许许多多xSiO2.yH2O分子组 成的,其表面的 H2SiO3 分 子可以离解成SiO32-和H+。
2021年6月24日星期四
第五章 胶体和乳状液
27
三、胶团结构
(一)胶粒带电的原因与胶团的结构 1.胶核界面的选择性吸附
FeCl3+3H2O→Fe(OH)3+3HCl Fe(OH)3+HCl→FeOCl+2H2O
基础化学第二版李保山12 主族元素及其化合物概述-学生用

12 主族元素及其化合物概述习题 (p400-4702) 参考解答1.解答:大量的NH 4+干扰鉴定。
大量的NH 4+应在鉴定前加碱煮沸以除去。
2.解答:(1) [CrO 42-]=2.0×10-3mol .L -1; (2) [Ba 2+]min =1.2×10-10/2.0×10-3=6.0×10-8 mol .L -13.解答: A—BaCO 3;B—BaO ;C—CaCO 3;D—BaCl 2;E—BaSO 4;4.解答:白色固体为KCl 和MgSO 4的混合物。
5.解答:A—Na ;B—NaOH ;C—HCl ;D—NaCl ;E—AgCl ;F—NaO 2;G—Na 2O 2;H—H 2O 2;I—O 26.解答:(1) 2I -+Cl 2=I 2+2Cl -I 2+6H 2O+5Cl 2=2IO 3-+10Cl -+12H +2Br -+Cl 2=Br 2+2Cl -(2) 不一定。
电动势大,反应速度不一定快。
7.解答:(1) 3HClO 2HCl+HClO ⎯⎯→⎯加热3(2) HClO 3加热的反应有:3HClO 3⎯⎯→⎯加热HClO 4+2ClO 2+H 2O|----------------→Cl 2+2O 28HClO 3⎯⎯→⎯加热4HClO 4+3O 2+2Cl 2+2H 2O26HClO 3⎯⎯→⎯加热10HClO 4+15O 2+8Cl 2+8H 2O(3) KClO 3加热的反应有:2KClO 3⎯⎯→⎯加热2KCl+3O 2 (cat.)4KClO 3⎯⎯→⎯加热3KClO 4+KCl(4) NH 4Cl NH ⎯⎯→⎯加热3+HCl(5) (NH 4)2CO 3⎯⎯→⎯加热2NH 3+CO 2+H 2O(6) NH 4NO 2加热的反应有:NH 4NO 2⎯⎯→⎯加热N 2+2H 2O2NH 4NO 2⎯⎯→⎯加热2NH 2+2HNO 2(7) NH 4NO 3加热的反应有:2NH 4NO 3⎯⎯→⎯低温 NH 3+HNO 32NH 4NO 3⎯⎯→⎯加热N 2O+2H 2O (100~300℃)2NH 4NO 3⎯⎯→⎯加热2N 2+O 2+4H 2O (突然加热至高温)2NH 4NO 3⎯⎯→⎯加热N 2+2NO+4H 2O (加热) 3NH 4NO 3⎯⎯→⎯加热2N 2+N 2O 3+6H 2O (加热) 4NH 4NO 3⎯⎯→⎯加热3N 2+2NO 2+8H 2O (加热)5NH 4NO 3⎯⎯→⎯加热4N 2+2HNO 3+9H 2O (加热)(8) (NH 4)2SO 4⎯⎯→⎯加热NH 3+NH 4HSO 4(9) (NH 4)2Cr 2O 7⎯⎯→⎯加热Cr 2O 3+N 2+4H 2O8.解答:CaCO 3、CaC 2O 4可溶于HAcCaCO3+2HAc=Ca(Ac)2+CO2↑+H2OCaC2O4+2HAc=H2C2O4+Ca(Ac)2CaCO3可溶于稀强酸:CaCO3+2H+=Ca2++CO2↑+H2OBaSO4不溶于酸9.解答:(1) 2Ag++S2O32-= Ag2S2O3↓(白色)Ag2S2O3+H2O = +H2SO4+Ag2S↓(黑色)(2) 2Ag++S2O32-= Ag2S2O3↓(白色)Ag2S2O3+2S2O32-= [Ag2(S2O3)3]4-10.解答:Na2O:与H2O作用呈碱性。
人卫八版基础化学知识点
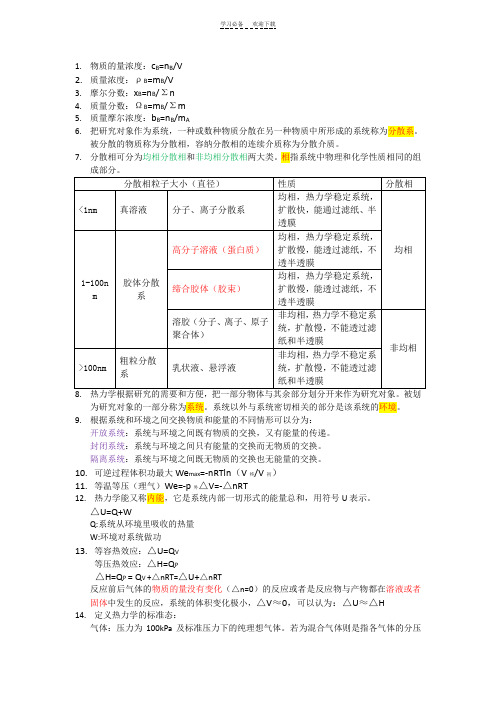
1.物质的量浓度:c B=n B/V2.质量浓度:ρB=m B/V3.摩尔分数:x B=n B/Σn4.质量分数:ΩB=m B/Σm5.质量摩尔浓度:b B=n B/m A6.把研究对象作为系统,一种或数种物质分散在另一种物质中所形成的系统称为分散系。
被分散的物质称为分散相,容纳分散相的连续介质称为分散介质。
7.分散相可分为均相分散相和非均相分散相两大类。
相指系统中物理和化学性质相同的组成部分。
8.热力学根据研究的需要和方便,把一部分物体与其余部分划分开来作为研究对象。
被划为研究对象的一部分称为系统。
系统以外与系统密切相关的部分是该系统的环境。
9.根据系统和环境之间交换物质和能量的不同情形可以分为:开放系统:系统与环境之间既有物质的交换,又有能量的传递。
封闭系统:系统与环境之间只有能量的交换而无物质的交换。
隔离系统:系统与环境之间既无物质的交换也无能量的交换。
10.可逆过程体积功最大We max=-nRTln(V终/V初)11.等温等压(理气)We=-p外△V=-△nRT12.热力学能又称内能,它是系统内部一切形式的能量总和,用符号U表示。
△U=Q+WQ:系统从环境里吸收的热量W:环境对系统做功13.等容热效应:△U=Q V等压热效应:△H=Q P△H=Q P = Q V +△nRT=△U+△nRT反应前后气体的物质的量没有变化(△n=0)的反应或者是反应物与产物都在溶液或者固体中发生的反应,系统的体积变化极小,△V≈0,可以认为:△U≈△H14.定义热力学的标准态:气体:压力为100kPa及标准压力下的纯理想气体。
若为混合气体则是指各气体的分压为标准压力且均为理想气体的性质。
纯液体(或纯固体):标准压力下的纯溶液(或纯固体)溶液:溶液由溶质和溶剂构成,溶质的标准态是指在标准压力溶质浓度(严格应为活度)为1mol/L或质量摩尔浓度为1mol/kg且具有理想溶液性质的溶质;溶剂的标准态则是指标准压力下的纯溶剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4
2
注:① 卤素原子作中心原子时,提供所有的7个 价电子,作配位原子时只提供1个价电子;
② 氧族元素的原子作中心原子时,提供所有
的6个价电子,作配位原子时不提供价电子; ③ 惰性气体元素的原子作中心原子时,最外 层电子均看作价层电子
sp sp sp 杂化轨道类型 不等性 sp 3 参加杂化的轨道 s+p s+(2)p s+(3)p s+(3)p 杂化轨道数 2 3 4 4 成键轨道夹角 1800 1200 1090 28' 900 1090 28' 分子空间构型
2
3
实例
中心原子
BeCl 2 BF3 CH 4 NH3 H 2O HgCl 2 BCl 3 SiCl 4 PH3 H 2S Be(ⅡA) B(ⅢA) C,Si N,P O,S Hg(ⅡB) (ⅣA) (ⅤA) (ⅥA)
LP=0
BF3
CH 4
LP=0
LP=0 LP=0 LP=0
PCl5
SF 6
②LP≠0 分子的空间构型≠电子对的空间构型 使价层电子对斥力最小 VP 3 LP
电子对的 空间构型 分子的 空间构型
1 1
2
4
6
1 2
VP=5
LP=1
LP=2
F F
四变 面形 体 字 形 T
: Cl :
F o 90 LP-LP( ) 0 o 90 LP-BP( ) 4
键能力增强。
1. sp3杂化 CH4的空间构型 为正四面体
C:2s22p2
2s
2p
2p
2s
激发
2p
2s
3
sp 杂化
sp3
CH 4的形成
2.sp2杂化
F
BF3的空间构型 为平面三角形
F
B
F
B: 2s22p1
2s
2p
BF3的形成
2p
2p1
激发
2s
2p
sp2
2S2
sp2杂化
3. sp杂化 Be:2s2
永久偶极:极性分子的固有偶极
诱导偶极:在外电场作用下产生的偶极
瞬时偶极:在某一瞬间,由于分子的正、负
电荷中心不重合而产生的偶极
2.分子间力的本质和类型 定义: 分子间的相互作用称为分子间 力, 又叫范德华力。 ( 1) 色散力 非极性分子在某一瞬间总会有一个偶极 存在,这种偶极叫做瞬时偶极。靠近的两 分子间由于同极相斥异极相吸,瞬时偶极 间总是处于异极相邻的状态。我们把瞬时 偶极间产生的分子间力叫做色散力.
2s
2p
H Be H
BH2的空间构型为直线形
2s
2p
激发
2s
2p
sp
sp杂化
Be采用sp杂化 生成BeH2
两个sp杂化轨道
2 杂化类型与分子空间构型的关系
① sp杂化轨道
1个ns 轨道与1个 np 轨道杂化形成2个sp杂化轨道:
px -
s
+ x +
1800 sp sp
+
-
- +
x
BeCl2的成键过程:铍原子杂化
形成条件:成键原子一方有孤对电子,
另一方有空轨道。 例:
NH 4
H
BF4
F F
H N H
FBF
2
C O
2s 2p
2
CO
H
CO的价键结构式: (与N2为等电子分子)
2s 2p
2
4
. . .C
.. O. ..
2s
C: O:
••
2p
: O —— C :
• •
O == C
H2S 中: S 的 3px, 3py H 的 1s
例:计算 NH4+、IF2–的价层电子对 的数目。
VP (NH4+) = (5 + 4×1 – 1) / 2 = 4 VP (IF2–) = [7 + 2×1 – (–1)] / 2 = 5
(2) 确定电子对的空间排布方式
VP=2 直线形 : A
:
:
A
VP=3
VP=4
平面三角形
:
: : :
:
正四面体
是极性分子,还与分子的空间构型有关系
如:CH4 CCl4 无极性,
CHCl3
有极性
分子偶极矩的测定,可得到分子结 构的参考资料。 CO2:C-O 键有极性,但分子无极 性,得CO2为线性分子。 BF3分子无极性,为平面结构, 而NH3分子有极性,为三角锥结构
分子的偶极矩μ(×10-30 C· m) D=3.33×10
分子是否有极性,关键要看分子中电荷
重心是否重合。
正、负电荷中重心重合者 偶极 分子没有极性,非极性分子
不存在
正、负电荷重心不重合者
存在 偶极
分子有极性,极性分子
对于双原子分子:键有极性、分子就有极性 (键的极性与分子的极性一致,而且键越强、 分子的极性也越强)。 HF>HCl>HBr>HI 对于多原子分子:极性键多原子分子不一定
分子式 H2 N2 CO2 CS2 CH4 CO CHCl3 H2S 偶极矩 0 0 0 0 0 0.40 3.50 3.67 分子式 SO2 H2O NH3 HCN HF HCl HBr HI
-30C· m
偶极矩 5.33 6.17 4.90 9.85 6.37 3.57 2.67 1.40
分子 偶极矩
第十章
§1
§2
化学键及分子结构
共价键
杂化轨道理论
§3
§4
价层电子对互斥理论
分子间力和氢键
§5
离子极化
本章作业:
P324~325习题:2,6, 7, 8
1 共价键
1. 化学键
分子或晶体中相邻原子间
强烈的相互作用
共价键 分类 金属键 离子键
2
价键理论(valence band, VB法)
2.1 键的形成与特点
2s 2p 铍原子基态 2s 2p 激发态 sp 2p 杂化状态
BeCl2 的成键过程:
4.不等性sp3杂化
NH 3
HNH 10718'
2p
2s
sp 杂化
3
sp
3
H 2O
HOH 104 30
'
2p 2s
sp 杂化
3
sp
3
104o30’
小结:杂化轨道的类型与分子的空间构型
2.2 键型
2.1 键的形成与特点 价键(Valence Bond, VB)理论基本观点: 两原子间通过共用电子对相连形成分子。 是基于电子定域于两原子之间的成键理论。 共价键的形成与本质:
(1)成键两原子靠近时, 键合双方各提供自旋 方向相反的未成对电子。
(2)键合双方原子轨道应尽可能最大程度地 重叠。(对称性相同, 能量相近的轨道发生重叠)
3.键角:
在分子中两个相邻化学键之间的夹 角称为键角.
4.2 分子间力和氢键
指分子和分子之间弱的相互作用力 1.分子的极性: 分子极性的量度 —— 偶极矩μ μ = q ·d q:正(负)电荷重心(电荷集中点)的电量 d:正(负)电荷重心的距离 偶极矩是一个矢量,其方向是从正极到
负极。电子的电荷等于1.6×10-19C,两个中 心的距离和分子的直径有相同的数量级,即 10-10m,故偶极矩大小的数量级为10-30C· m。
1
2
四方锥
平面正方形
IF5
ICl4–
中心原子的价层电子对的空间构型
与其杂化轨道之间的对应关系
VP 2 sp 3 sp2 平面三 角形 4 sp3 5 sp3d 6 sp3d2 正八面 体
A的杂 化类型
价层电 子对空 间构型
直线形
正四面 三角双 体 锥
可以看出, 杂化轨道理论是从原子轨道的杂化 来探讨分子的几何构型; 价层电子对互斥理论 则是从价层电子对的互斥作用来探讨分子的几 何构型, 二者角度不同, 而所得的结果大致相同
: : F Cl F F 1
: Cl F : 0
6
F
F
3
中心原子的价层电子对中有孤对电子存在
VP 3 4 LP = VP - n 1 1 2 1 5 2 3 6 分子或离子 的几何构型 V形 三角锥 V形 变形四面体 T形 直线形 实例 SO2 NH3 H2O TeCl4 ClF3 XeF2、I3–
思考题:
解释NO2-, I3-, [AlF6]3-, BrF3 , BrF5等 离子或分子的空间构型。
价层电子对互斥理论的局限性
• 只适用于中心原子为主族元素或 d0、d5、d10的过渡元素的原子 • 只适用于孤立的分子或离子,不
适用于固体的空间结构
4 分子间力和氢键
4.1 键参数 4.2 分子间力 4.3 氢键
诱导偶极而产生的分子间相互作用。
+ _ + _ + _
分子离得较远
分子靠近时
决定诱导作用强弱的因素: • 极性分子的偶极矩: μ愈大,诱导作用愈强。 • 非极性分子的极化率: α愈大,诱导作用愈强。
(3) 取向力
当极性分子相互于固有偶极的取向而引起的分子间 的力叫做取向力。
共价键的本质:
原子相互接近时,由于原子
轨道的重叠,原子间通过共用自
旋方向相反的电子对使体系能量
降低,由此形成共价键。
