第十五章芳杂环化合物
合集下载
芳香杂环化合物

CH3
CH3
R'=(CH3)2CHCH2CH2(CH2CHCH2CH2)CH2C=C CH2
伊沙匹隆
OR
S
H3C
N
CH3 HO
H3C
OH
H3C CH3
CH3
O OH O
Epothilone A(R=H) ;B(R=CH3)
1993年被发现的一种高效抗癌物质
第一节 分类和命名
一 分类
杂环
单杂环
稠杂环
N
1
嘧啶
pyrimidine
3.若有多个不同杂原子时,则按O、S、 NH、N的先后顺序编号
43
5 1 N2 N H
4 N3
5
2
S
1
吡唑 pyrazole
噻唑 thiazole
4.有些有特定名称的稠杂环母体的编号 是固定的
5 6
7 8
4 3
2
N
1
67
1N 5 N
2
98
N4
3
N
H
喹啉
quinoline
5 氧化和还原
和苯环相比,不易被氧化,优先被还原
吡啶N-氧化物
在过氧化物条件下生成
亲电取代反应比较容易,也能进行亲核取代
反应,并且取代反应都发生在a位或γ位。
? 衍生物
二 喹啉和异喹啉
喹啉
异喹啉
奎宁(金鸡钠碱),是最早,也是最重 要的抗疟药物,至今仍广泛用于临床。
化学性质
1 亲电取代 主要发生在C-5与C-8
N O
异噁唑
isoxazole
六元环
4
5
3
6N 2
1
吡啶
十五章杂环化合物

N原子 sp2杂化
p sp2
H
H
H
O
H 呋喃
H
H
H
S
H 噻吩
p电子数 = 4n+2规则
H
H
H
NH
H 吡咯
• 五个原子含有六个π电子,富电子芳杂环, • 芳香稳定性不如苯环 • 亲电取代反应比苯
3.化学反应
比苯容易发生亲电取代反应 主要进入 α-位 活性:吡咯 > 呋喃 > 噻吩 >> 苯
1)卤代反应:
环状封闭的大π键,π电子数为6,符合4n+2规则 吡啶具有一定的芳香性
2.吡啶的 化学性质 (1)碱性 与质子酸成盐
+ HCl N
吡啶与路易斯酸作用,形成盐
N Cl 或 H 吡啶盐酸盐
HCl N
+ SO3 N
+ CrO3 N
N
( SO 3 )
N-磺酸吡啶
N
(一种温和的非质子性磺化试剂)
SO3
Cl2
O
-40℃
Br2 , 室温
S
AcOH
O Cl + Cl O Cl
S Br
78%
II
I2 , KI 或 HgO
N
IN I
H
H
2)硝化反应:
OO CH3COCCH3
+ HNO3
-5℃以下
O CH3CONO2 + CH3COOH
CH3COO-NO2+
O
-5~ -30℃
CH3COO-NO2+
S
Ac2O , -10℃
O CHO
Ag(NH3)2+
CH3COONa (CH3CO)2O
p sp2
H
H
H
O
H 呋喃
H
H
H
S
H 噻吩
p电子数 = 4n+2规则
H
H
H
NH
H 吡咯
• 五个原子含有六个π电子,富电子芳杂环, • 芳香稳定性不如苯环 • 亲电取代反应比苯
3.化学反应
比苯容易发生亲电取代反应 主要进入 α-位 活性:吡咯 > 呋喃 > 噻吩 >> 苯
1)卤代反应:
环状封闭的大π键,π电子数为6,符合4n+2规则 吡啶具有一定的芳香性
2.吡啶的 化学性质 (1)碱性 与质子酸成盐
+ HCl N
吡啶与路易斯酸作用,形成盐
N Cl 或 H 吡啶盐酸盐
HCl N
+ SO3 N
+ CrO3 N
N
( SO 3 )
N-磺酸吡啶
N
(一种温和的非质子性磺化试剂)
SO3
Cl2
O
-40℃
Br2 , 室温
S
AcOH
O Cl + Cl O Cl
S Br
78%
II
I2 , KI 或 HgO
N
IN I
H
H
2)硝化反应:
OO CH3COCCH3
+ HNO3
-5℃以下
O CH3CONO2 + CH3COOH
CH3COO-NO2+
O
-5~ -30℃
CH3COO-NO2+
S
Ac2O , -10℃
O CHO
Ag(NH3)2+
CH3COONa (CH3CO)2O
有机化学第十五章 杂环化合物[精]
![有机化学第十五章 杂环化合物[精]](https://img.taocdn.com/s3/m/be37535b011ca300a6c3903c.png)
正常 CC CC CN CN
1.54 1.34 1.47 1.28
1、组成吡啶环上的5个C原子和1个N原子,均为SP2杂化,共同 平面。环上的π 电子数为6,符合4n+2规则,故其具有芳香性,即 可以发生取代反应。
2、由于吡啶环上有一个N原子代替了苯环中的一个CH,因此和 苯环相比,必然产生下列差异:
NH NH2
NH2
N
N
NH
N
N
H
H
.OH N
4、稳定性:不易氧化、易还原
A、原苯环中的一个H原子被N原子的一对孤电子对所取代,因 此,吡啶应具有一定的碱性,同时又由于N原子的电负性大于C 原子,使环上的电子云向N原子偏移,又增大了N原子的碱性;
B、由于电子云向N原子方向偏移,吡啶分子中应有偶极:
+0.18
偶 极 矩 : 2.2D
C、电子云分布不均匀:
0.932
+0.05
N -0.58
+0.15
1.000
1.166
1.000
N 1.064
0.866
1.000 1.000
与苯环相比,N原子上的电子云密度增大,α 、γ 位电子云密 度降低,β 位变化不大。
由分析可知:N原子具有碱性, β 位克发生亲电取代,α 、γ 可以发生亲核取代。总体上讲由于N原子的电负性较大,使环上的 电子云向N原子方向偏移,从而降低了环上的电子云密度,故其亲 电取代困难,而在一定条件下可发生亲核取代,即类似于硝基苯:
2
66
N2 6
2
N 1 嘧啶
N 1 哒嗪
N 1 吡嗪
5
4
5
4
5
4
6 稠杂环
第十五章杂环化合物

唑的化学性质
y 碱性
>
>
>
>
1,3-唑 > 1,2-唑
唑的化学性质
y 亲电取代活性
苯 > 唑 > 吡啶
>
>
>
>
N
O
常见的五元杂环化合物
y 含单个杂原子的五元杂环
吡咯
呋喃 噻吩
吲哚
y 含多个杂原子的五元杂环
咪唑
噁唑
噻唑
N
N
吡唑 O 异噁唑 S 异噻唑
嘌呤
嘌呤
6
7
1
5
8 2
49
3
9H-嘌呤
7H-嘌呤
吡咯等的化学性质:亲电取代
y 傅克酰化:使用温和催化剂
吡咯等的化学性质:还原
H2/Ni
O
O
呋喃的双烯加成
呋喃芳香性较差,可体现共轭二烯的性质 吡咯、噻吩一般条件下不发生此类反应
吲哚的化学性质
C6H5CO2NO2
N H
O
O 0oC
NO2 N H
亲电取代反应性与呋喃类似 注意取代主要发生于3-位
Br2, 300oC
Br 39%
N
吡啶的化学性质:亲电取代
CH3
CH3
H3C
N
H2SO4 / HNO3 CH3 100oC, 5h H3C
N
NO2 CH3
93%
吡啶的化学性质:亲核取代
Cl
OMe
NaOMe/MeOH
N
N
吡啶的化学性质:亲核取代
(Chichibabin反应)
吡啶的化学性质:还原
常见的五元杂环化合物
第十五章 杂环化合物

R-C-H + CH2N2
O R-C-CH3 + N2
O
O
R'
+ R-C-CH2R' + N2
R
3
主要内容
第一节 第二节 第三节 第四节
杂环化合物的分类及命名 杂环化合物结构与芳香性 六元杂环化合物 五元杂环化合物
O
HH
NH
S CH3
NH2 O
N
CH3
COONa
氨苄青霉素钠 (amoxicillin)
0.140
4
3
0.139
N2
0.147 单
0.134 0.128 双
无芳香性
O
2H-吡喃 (无芳香性)
芳香性
N
N
嘧啶
N
喹啉
4n+2? 休克尔规则 4H-吡喃
(无芳香性)
O
N
异喹啉
二、五元杂环化合物
43
2
Z
Z = O、NH、S
ZC
C2 C3
呋喃 0.136(0.143) 0.1361
吡咯 0.1370(0.147) 0.1383
3
6
N2
N
1
6
2
N
1
6
2
N
1
哒嗪(pyridazine) 嘧啶(pyrimidine) 吡嗪(pyrazine)
六元杂环苯并环系
5 6
7 8
4 3
N2 1
喹啉
(quinoline)
5 6
7 8
4 3
N2 1
异喹啉
(isoquinoline)
54
O
6
O R-C-CH3 + N2
O
O
R'
+ R-C-CH2R' + N2
R
3
主要内容
第一节 第二节 第三节 第四节
杂环化合物的分类及命名 杂环化合物结构与芳香性 六元杂环化合物 五元杂环化合物
O
HH
NH
S CH3
NH2 O
N
CH3
COONa
氨苄青霉素钠 (amoxicillin)
0.140
4
3
0.139
N2
0.147 单
0.134 0.128 双
无芳香性
O
2H-吡喃 (无芳香性)
芳香性
N
N
嘧啶
N
喹啉
4n+2? 休克尔规则 4H-吡喃
(无芳香性)
O
N
异喹啉
二、五元杂环化合物
43
2
Z
Z = O、NH、S
ZC
C2 C3
呋喃 0.136(0.143) 0.1361
吡咯 0.1370(0.147) 0.1383
3
6
N2
N
1
6
2
N
1
6
2
N
1
哒嗪(pyridazine) 嘧啶(pyrimidine) 吡嗪(pyrazine)
六元杂环苯并环系
5 6
7 8
4 3
N2 1
喹啉
(quinoline)
5 6
7 8
4 3
N2 1
异喹啉
(isoquinoline)
54
O
6
第十五章+杂环化合物
号时,把连有氢原子的杂原子编号为 , 号时,把连有氢原子的杂原子编号为1,并使其余 杂原子的位次尽可能小 。
CH3
4
N3
N 2 1
4 –甲基咪唑 甲基咪唑
(3)如果环上有多个不同杂原子时,按氧、硫、 )如果环上有多个不同杂原子时,按氧、
氮的顺序编号
H 3 C
4
N
3
H 3 C
5
S
1
2
4,5–二甲基噻唑 二甲基噻唑
+
H2 O
吡啶的硝化反应需在浓酸和高温下才能进行, 吡啶的硝化反应需在浓酸和高温下才能进行,硝基 主要进β-位 主要进 位。
(3)磺化反应 )
+
O N
+ SO 3
C2H4Cl2 室温三天 O SO 3H
+
N
+
N H
N
+
SO3Biblioteka -C2H4Cl2100 ℃
N H
SO3H
+
N
吡咯,呋喃对酸很敏感,强酸能使它们开环聚合, 吡咯 呋喃对酸很敏感,强酸能使它们开环聚合,常用温和的非质子 呋喃对酸很敏感 磺化试剂:吡啶与SO 的加成物。 磺化试剂:吡啶与 3的加成物。
4
N3
4 5
N3 S1
2
O
S
N H
5
N1
2
呋喃 噻吩 吡咯 (furan) (thiophene) (pyrrole)
咪唑 (imidazole)
H
噻唑 (thiazole)
4 5
N3 N1
2
O
吡喃 (pyran)
6
N
吡啶 (pyridine)
有机化学:第十五章 杂环化合物

5 6
7
4 3
2
81
OH 8-羟基喹啉
NH2
1 65
7
2 49 8 3
6-氨基嘌呤
O
4 5
3 CO2H
CH3 1 6 5 N
N 7 CH3
6
12
Br 7
2
O
3
N4 N
8
9
CH3
6-溴吲哚-3-羧酸 1,3,7-三甲基嘌呤-2,6-二酮
标氢:当杂环上含有饱和原子时,往往存在互变异构
体,命名时用“位置编号” +“H” (大写斜体)写在词 首加以区别,并给饱和原子尽可能低的编号。
度的碱性,可成盐。
2.吡啶的水溶性
吡啶氮原子上的一对未共用电子能与水 形成氢键,吡啶能与水互溶,但吡啶环上引 入羟基或氨基后,化合物的水溶性却明显降 低,且引入的羟基或氨基数目愈多,水溶性 愈差,主要原因是溶质分子间缔合(分子间 氢键等),抑制了与水分子间的缔合。
3. 碱性:
吡啶环N原子的一对孤电子对处于sp2杂化轨道上, 它并不参与环上的共轭体系,因此可能和质子结合或 给出电子,呈现弱碱性。吡啶中氮原子上的未共用电 子对处于sp2杂化轨道中,s成分较大,受N的束缚力较 强,给出电子倾向较小,与 H+ 的结合力较弱,所以碱 性较弱。
· ·
·
· ·
N
·
··
叔胺 N
pKb: ~ 4
8.8
N
NH2
H
9.37
~ 14
碱性:叔胺 > 吡啶 > 苯胺 > 吡咯
+ HCl N
· Cl N+ H 吡啶盐酸盐
4.化学反应
⑴
通过氮原子上的未共用电子对,吡啶可以
第15章 杂环化合物

54
6
3
7
N2
81
异喹啉
isoquinoline
[命名] 音译名
(Imidazole)
H N
( Thiophene)
O
S
S
H
H
N
NN
N
N
吡咯 呋喃
(Pyrrole)(Furan)
噻吩 噻唑 咪唑 吡唑
( Thiazole)
(Pyrazole)
N N
N
吡啶Pyridine
喹啉Quinoline
异喹啉Isoquinoline
CH3COONO2
O
- 5~30oC
O NO2
(35%)
CH3COONO2
N H
OH-,5oC,Ac2O
N NO2 + H (83%)
NO2
N H
(7%)
当呋喃或吡咯环上连有吸电子基团时,环的稳定性
增 加,可用一般方法硝化。
O2N
N H
CCH3 O
HNO3 H2SO4
O2N
N H
CCH3 + O
N H
吡啶N
P
N
SP2
N 吡咯N
P
H
SP2
C
呋喃O(噻吩S)
P
P
SP2
SP2
“多π”芳杂环———六个电子由五个原子分配,每个碳 原子的电子云密度比苯环高,故亲电取代比苯容易。
H
O
S
N
2.33 10-30C.m 1.70 10-30C.m 6.03 10-30C.m
N原子
给电子共轭>> 吸电子诱导。
吡啶N:吸电子诱导+吸电子共轭
第十五章 芳杂环化合物.

4
1 7
8
1
8
1
异喹啉 NH2
1
6
5 6
3 2
5 6
3 2
CO2H
5
7
2
3
4 9
8
Br 茚
6-溴吲哚 -3-羧酸
6-氨基 嘌呤
第二节 五元杂环化合物
一、呋喃、噻吩、吡咯
1. 结构
O 呋喃
S 噻吩 吡咯
所有成环原子都以sp2杂化轨道重叠形成σ键;碳原子 未参加杂化的 p 轨道有 1 个电子,杂原子则有 2 个 p 电子, p 轨道互相平行重叠形成 6电子环状共轭大π键。 与苯环的6 原子共6π电子比,呋喃、噻吩、吡咯为5原子共用6个π电子, 故环上π电子密度比苯环大,属于“富π芳杂环”。
1 2
4 5
N3 S 噻唑
1 2
8
DC.sjtu
3. 有特定名称的稠杂环母环的编号,大都按照稠芳环 规则编号,但个别的另有编号顺序(如嘌呤)。
6 7 5 4 3 2 6 7 5 4 3 2 6 7 5 4 3 2
8
1
萘
4 1 7
OH 8-羟基喹啉
咪唑 Imidazole
吡唑 5 pyrozole
噁唑 DC.sjtu oxazole
六 2 元 6 1 杂 吡啶 环 pyridine
5
3
5
3
5 6
3 2
5 6
3 2
6
1
2
1
1
嘧啶 pyrimidine
哒嗪 pyridazine
吡喃 pyran
稠杂环
6 7
5
4
3 2
6 7
5
1 7
8
1
8
1
异喹啉 NH2
1
6
5 6
3 2
5 6
3 2
CO2H
5
7
2
3
4 9
8
Br 茚
6-溴吲哚 -3-羧酸
6-氨基 嘌呤
第二节 五元杂环化合物
一、呋喃、噻吩、吡咯
1. 结构
O 呋喃
S 噻吩 吡咯
所有成环原子都以sp2杂化轨道重叠形成σ键;碳原子 未参加杂化的 p 轨道有 1 个电子,杂原子则有 2 个 p 电子, p 轨道互相平行重叠形成 6电子环状共轭大π键。 与苯环的6 原子共6π电子比,呋喃、噻吩、吡咯为5原子共用6个π电子, 故环上π电子密度比苯环大,属于“富π芳杂环”。
1 2
4 5
N3 S 噻唑
1 2
8
DC.sjtu
3. 有特定名称的稠杂环母环的编号,大都按照稠芳环 规则编号,但个别的另有编号顺序(如嘌呤)。
6 7 5 4 3 2 6 7 5 4 3 2 6 7 5 4 3 2
8
1
萘
4 1 7
OH 8-羟基喹啉
咪唑 Imidazole
吡唑 5 pyrozole
噁唑 DC.sjtu oxazole
六 2 元 6 1 杂 吡啶 环 pyridine
5
3
5
3
5 6
3 2
5 6
3 2
6
1
2
1
1
嘧啶 pyrimidine
哒嗪 pyridazine
吡喃 pyran
稠杂环
6 7
5
4
3 2
6 7
5
第十五章-杂环化合物

• 吡咯和噻酚发生正常亲电取代反应
AcONO2
N
Ac2O, oC
H
AcONO2
S
Ac2O-AcOH, 0oC
N
NO2 +
H
83%
S
NO2 +
60%
NO2
N H 17%
NO2
S 10%
• 呋喃发生加成反应(共轭烯烃性质)
AcONO2
O
5 ~ 30oC
AcO O NO2
加成
碱或 HOAc
消除
O NO2
10-羟基喜树碱 (抗癌药) HO O
SS
H2O
SS
TTF
HgOH
NaO
O
O
Br 红汞
Br CO2Na
Br
NaO
O
O
Br
曙红 (红墨水)
Br CO2Na
杂环化合物的类型
芳香杂环
N
O
S
重点内容
N
N
H
H
N
N
N
N
N
N
N H
N
普通杂环
O
环醚,内酯,内 O
O
酰胺,环状酸酐
N OO OO O H
§15.1 杂环化合物的分类、命名
AE
位取代
E+
A
E A
E H
H+
A
中间体只有二个主要共振式, 中间体较不稳定
E A
对亲电取代反应活性的解释
i. 由五员杂环的结构分析 杂原子起给电子基的作用,环上的电荷密度比苯环大
ii. 由中间体的稳定性分析
E+
A
AcONO2
N
Ac2O, oC
H
AcONO2
S
Ac2O-AcOH, 0oC
N
NO2 +
H
83%
S
NO2 +
60%
NO2
N H 17%
NO2
S 10%
• 呋喃发生加成反应(共轭烯烃性质)
AcONO2
O
5 ~ 30oC
AcO O NO2
加成
碱或 HOAc
消除
O NO2
10-羟基喜树碱 (抗癌药) HO O
SS
H2O
SS
TTF
HgOH
NaO
O
O
Br 红汞
Br CO2Na
Br
NaO
O
O
Br
曙红 (红墨水)
Br CO2Na
杂环化合物的类型
芳香杂环
N
O
S
重点内容
N
N
H
H
N
N
N
N
N
N
N H
N
普通杂环
O
环醚,内酯,内 O
O
酰胺,环状酸酐
N OO OO O H
§15.1 杂环化合物的分类、命名
AE
位取代
E+
A
E A
E H
H+
A
中间体只有二个主要共振式, 中间体较不稳定
E A
对亲电取代反应活性的解释
i. 由五员杂环的结构分析 杂原子起给电子基的作用,环上的电荷密度比苯环大
ii. 由中间体的稳定性分析
E+
A
有机化学第15章

(抗癌药) HO O
SS
H2O
SS
TTF
HgOH
NaO
O
O
Br 红汞
Br CO2Na
Br
NaO
O
O
Br 曙红 (红墨水)
Br CO2Na
杂环化合物的类型
芳香杂环
N
O
S
N H
N H
H
NN
N
N
N
N
N
N
普通杂环
O
O
O
N
OO O
O
H
环醚,内酰胺,环状酸酐,内酯等
OO
§15.1 杂环化合物的分类、命名
杂环分类:
+
S
(Hale Waihona Puke 量) 反应快H2SO4 r. t.
S SO3H 溶解于硫酸中
(3)五员芳杂环的Friedel-Crafts反应
(CH3CO)2O
N H
(CH3CO)2O
O
BF3
(CH3CO)2O
S
SnCl4
COCH3 N H
2-乙酰基吡咯
COCH3 O
2-乙酰基呋喃
COCH3 S
2-乙酰基噻吩
2)五员芳杂环的加成反应
H3C 4
3
N
5
2
N1
H
4-甲基咪唑
10
3. 含两个不同的杂原子:按O, S, N顺
3
N
4 序编号
2 S 5 CH3 5-甲基噻唑
1
4. 特殊编号
5 6
4 3
7
2
N
8
1
喹啉
Quinoline
5 6
第15章 杂环化合物

(β) (α)
4 5 3
O
1
2
(β) (α)
(β) 4 (α ) 5
3
S
1
2
(β) (α)
(β) (α)
4 5
3
N H
2
(β) (α)
1
furan(呋喃)
thiophene(噻吩)
pyrrole(吡咯)
(β) (α ) 6
5
4 (γ) 3 2
N
1
(β) (α )
4 5
N3 N H
2 1
4 5
N3 S
9
8
7
6
5 δ
4
3
2
1
0
吡啶的 1H NMR谱
从它们核磁共振图谱上的化学位移可知,呋喃、吡咯、噻吩 和吡啶上的π电子产生很强的磁各向异性效应。它们的质子都 是位于与外加磁场方向一致的去屏蔽区。它们环上质子的化 学位移与苯环上的质子相当。
15.4 五元杂环化合物的性质 15.4.1 呋喃的性质
呋喃是一种无色液体,在酸性条件下不稳定,容易发生 开环等反应。所以呋喃的硝化反应和磺化反应要在特殊条件 下进行。呋喃蒸汽遇到被盐酸浸过的松木片时呈深绿色,利 用此反应可检验呋喃的存在。 (1)呋喃的取代反应 (A)卤代反应 呋喃进行卤代反应比苯活泼,它的氯代反应在常温下进 行时会生成二氯代物,即使在低温下进行,也难避免二氯代 物的生成。溴代反应通常也要加溶剂稀释,以降低反应活性, 防止反应剧烈而使呋喃环破坏。
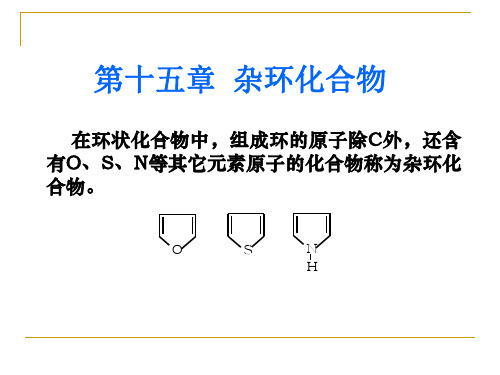
构成环状化合物的原子,除了碳原子以外,还包含有 其它原子的化合物叫杂环化合物,这些其它原子被称为 杂原子,最常见的杂原子是O、S、N等。例如,下列化 合物都是杂环化合物:
O O N H S O N H O
4 5 3
O
1
2
(β) (α)
(β) 4 (α ) 5
3
S
1
2
(β) (α)
(β) (α)
4 5
3
N H
2
(β) (α)
1
furan(呋喃)
thiophene(噻吩)
pyrrole(吡咯)
(β) (α ) 6
5
4 (γ) 3 2
N
1
(β) (α )
4 5
N3 N H
2 1
4 5
N3 S
9
8
7
6
5 δ
4
3
2
1
0
吡啶的 1H NMR谱
从它们核磁共振图谱上的化学位移可知,呋喃、吡咯、噻吩 和吡啶上的π电子产生很强的磁各向异性效应。它们的质子都 是位于与外加磁场方向一致的去屏蔽区。它们环上质子的化 学位移与苯环上的质子相当。
15.4 五元杂环化合物的性质 15.4.1 呋喃的性质
呋喃是一种无色液体,在酸性条件下不稳定,容易发生 开环等反应。所以呋喃的硝化反应和磺化反应要在特殊条件 下进行。呋喃蒸汽遇到被盐酸浸过的松木片时呈深绿色,利 用此反应可检验呋喃的存在。 (1)呋喃的取代反应 (A)卤代反应 呋喃进行卤代反应比苯活泼,它的氯代反应在常温下进 行时会生成二氯代物,即使在低温下进行,也难避免二氯代 物的生成。溴代反应通常也要加溶剂稀释,以降低反应活性, 防止反应剧烈而使呋喃环破坏。
构成环状化合物的原子,除了碳原子以外,还包含有 其它原子的化合物叫杂环化合物,这些其它原子被称为 杂原子,最常见的杂原子是O、S、N等。例如,下列化 合物都是杂环化合物:
O O N H S O N H O
第十五章杂环化合物hr

CHO
O
2-甲酰基呋喃 (α-呋喃甲醛)
COOH
N
3-吡啶甲酸 β-吡啶甲酸
CONHNH2
N
N
NH2
CH2CHCOOH
N H
4-吡啶甲酰肼
3-(5-咪唑基)-2-氨基丙酸
γ-吡啶甲酰肼
(组氨酸)
(异烟肼,抗结核药第十)五章杂环化合物hr
(2)稠杂环类化合物编号的基本原则:
从稠碳原子相邻的第一个原子开始编号, 同时使杂原子编号尽可能小。稠碳原子一般不 参与编号。
2、吡啶的化学性质
(1)吡啶的碱性:
特点:N上存在一对未成键的孤电子对,有 给电子能力,呈现一定的碱性。
(哌啶)
NH3
N
N
H
pKa : 11.2 9.24 5.19
NH2 4.62
∴ 碱性: 脂肪胺 > 氨 > 吡啶 > 苯胺
说明:吡啶环上的取代基对吡啶碱性强弱的 影响与取代第苯十五胺章杂类环化似合物。hr
O
O
+
N
OH -
小蘗碱 (黄连素) (抗菌、消炎药)
OCH3 (含异啉环)
OCH 第十五章杂环化合物3hr
一、杂环化合物的分类和命名
(一)杂环化合物的分类
五元环 1、按环的大小分类:
六元环
2、按环中杂原子数目分类:
含1个杂原子的杂环 含2个或多个杂原子的杂环
3、按分子中所含的环数目分类:
第十五章杂环化合物hr
单杂环 稠杂环
(二)杂环化合物的命名 (复杂)
1、母核的命名 (音译法)
——有特定名称杂环化合物的命名 五元单杂环类:
N H
吡咯
O
呋喃
第十五章 杂环

第十五章 杂环化合物—五元环性质
O B r2 O 0℃ 8 0% O C l2 - 4 0℃ O C H3 C O O N O 2 O Cl Br
+
Cl O Δ or Py O N O2 Cl
H - 5 ℃ - 3 0℃ C H C O O 2
-
H O N O2 H Cl
N
+
S O3 O S O3 -
O
S O3 H
( C H3 C O )2 O 0℃ B F3 E t2 O O C O C H3
第十五章 杂环化合物—五元环性质
Br 2 Cl 2 CH 3 COOH r, t 50 ℃ 36% S CH 3 COONO 2 S 95%H 2 SO 4 ( CH 3 CO) 2 O H 3 PO 4 25 ℃ S S -10 ℃ S 78% S Br + Cl Cl Cl + Cl Cl S 14% NO 2 + 70% S 67-76% S Cl 13% Cl NO 2 5%
第十五章 杂环化合物—概述 2、理论意义: 杂环化学中贯穿了大量的电子理论,是验证 电子学说和其它有关理论的园地 3、研究现状: (1)教学方面:作为选修课。 (2)研究方面: 杂环化学的研究目前主要集中在其生理活性 及其药用价值。此外,在非生物领域的应 用研究也取得很大进展,如:胶片的敏化 剂、橡胶工业的抗氧剂、硫化促进剂等, 多性能催化作用以及一些特殊性能的研究 都取得很大进展。
第十五章 杂环化合物—五元环性质 §15.3五元杂环化合物 一、呋喃、噻吩、吡咯的结构 成键特性:
第十五章 杂环化合物—五元环性质
分子 苯 噻吩
S
吡咯
N H
呋喃
O
第十五章 杂环化合物

+ H2SO4 S S SO3H
+ H2O
溶于酸
应用于除去石油和粗苯中的噻吩
6、吡咯的弱酸性
+ KOH N N K + H2O
吡咯钾
参与共轭
H
四氢吡咯的碱性明显大于吡咯,存在于脯氨酸中,P520
1) CO2
2-吡咯甲酸
N Na
类似苯酚钠
2) H3O+
N H
COOH
N H
+
N2Cl
pH=7-9
N H
N
N H
e. 重要衍生物 (P359)维生素PP和NAD+ , 维生素B6
COOH N
(2) 嘧啶
6 N N
CH N 尿嘧啶(Uracil) CH N OH
1
N 2 N 3
5
7 N 8
嘧啶
NH 2 N
4
N 9
嘌呤
OH N OH N CH 3 胸腺嘧啶
胞嘧啶(cytosine) N
烯醇式可重排为酮式
2-甲基-5-硝基吲哚(P352)
CH 2COOH N H 3-吲哚乙酸是植物生长调节剂
(P352 照书讲)
CH2CHCOOH CH2CH2NH2 N H 色胺
N H
NH2 色氨酸
是哺乳动物脑组织中与 中枢神经有关的物质。
HO CH 2CH 2NH 2 N H
5-羟色胺
吲哚环存在于1000多各生物碱天然产物中。
1. 咪唑
(1) 结构P521 弱酸
H N
H N
N原子sp2杂化
N N H 咪唑 imidazole
..
sp2
碱性
H H 分子间可能成氢键 m.p. 90℃
第十五杂环化合物ppt文档

★ 五元及六元稠杂环
4 5
6 7
3
2
N 1 H
吲哚 indole
4 5
3 2
6
O 1
7
苯并呋喃
benzofuran
4 5
3 2
6
S1
7
苯并噻吩
benzothiophene
4 5
6 7
N 3
2
N H 1
苯并咪唑 benzoimidazole
54
6
3
7 8
N 12
喹啉 quinoline
54
6
3
7
N 2
PhCO 5 4
6 7
3
N
12
N H
NH2
S O 3H
I
N
OH
2-氨基-5-苯甲酰基苯并咪唑
7-碘-8-羟基喹啉-5-磺酸
2-amino-5-benzoylbenzimidazole 7-iodo-8-hydroxuquinoline-5-sulfonic acid
O
PhCO
1
N
65
N7CH3
3
O 2 N4
N H
S
NH2
单环杂环
NN
N
N
O
N
N
三聚氰胺 H2N-C≡N (氰胺)
H2N N NH2
N
二环O 杂环 芳稠杂环(苯环N与杂环稠合) H
N
多环杂环 稠杂环(杂环与杂环稠合)
6. 根据多环的连接方式分类
稠(环)杂环 桥(环)杂环
丁公藤碱
螺(环)杂环
巨杂环
氮穴类化合物
杂环多面体
卟吩环系
第十五章 芳杂环化合物

N-H
因其性质与相应的脂肪族化合物较相似,因此并入 脂肪族化合物中讨论,而不列为杂环化合物。
2
第二页D,C本.课s件j共tu有50页
本章讨论的杂环化合物主要指环系较稳定,包括杂原子
在内的环是平面型,环内有4n+2个π电子处于环闭共轭体系 中,统称为芳(香)杂环化合物。
4
N S
第四页D,C本.课s件j共tu有50页
二、命名
命名原则:译音+“口”旁
4
3(b)
5 1 2(a)
O
4
3
5 12
S
4
3
512
4
N3
512
S
呋喃
五 元 furan
噻吩
吡咯 噻唑
thiophene pirrole thiazole
杂
3
4
环 2 15
4
3
5 12
4
N3
512
O
咪唑 Imidazole
卟吩
血红素
24
第二十四页D,C本.课s件j共tu有50页
第三节 六元杂环化合物
六元杂环化合物包括环中有1个杂原子的六元杂 环(如吡啶等);环中有多个杂原子的六元杂环(如嘧啶 等);以及稠杂环(如喹啉、嘌呤等)。
一、吡啶(C5H5N)
吡啶存在于煤焦油、骨焦油中,其衍生物广泛存在 于自然界。工业上主要从煤焦油的轻油部分提取吡啶。
(69%~76%)
25℃
S SO3H
噻吩-2-磺酸
16
第十六页D,C本.课s件jt共u有50页
溴代: Br2 (或I2)
Br
乙醇(稀释)/0℃ Br
Br
因其性质与相应的脂肪族化合物较相似,因此并入 脂肪族化合物中讨论,而不列为杂环化合物。
2
第二页D,C本.课s件j共tu有50页
本章讨论的杂环化合物主要指环系较稳定,包括杂原子
在内的环是平面型,环内有4n+2个π电子处于环闭共轭体系 中,统称为芳(香)杂环化合物。
4
N S
第四页D,C本.课s件j共tu有50页
二、命名
命名原则:译音+“口”旁
4
3(b)
5 1 2(a)
O
4
3
5 12
S
4
3
512
4
N3
512
S
呋喃
五 元 furan
噻吩
吡咯 噻唑
thiophene pirrole thiazole
杂
3
4
环 2 15
4
3
5 12
4
N3
512
O
咪唑 Imidazole
卟吩
血红素
24
第二十四页D,C本.课s件j共tu有50页
第三节 六元杂环化合物
六元杂环化合物包括环中有1个杂原子的六元杂 环(如吡啶等);环中有多个杂原子的六元杂环(如嘧啶 等);以及稠杂环(如喹啉、嘌呤等)。
一、吡啶(C5H5N)
吡啶存在于煤焦油、骨焦油中,其衍生物广泛存在 于自然界。工业上主要从煤焦油的轻油部分提取吡啶。
(69%~76%)
25℃
S SO3H
噻吩-2-磺酸
16
第十六页D,C本.课s件jt共u有50页
溴代: Br2 (或I2)
Br
乙醇(稀释)/0℃ Br
Br
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7
4 3
2
81
萘
5 6
7
4
5
36
27
4 3
2
81
OH 8-羟基喹啉
81
异喹啉
4 5
4 35
3 CO2H
6
12 6
12
7
Br 7
茚
6-溴吲哚 -3-羧酸
NH2
1 65
7
2 49 8
3
6-氨基 嘌呤
第二节 五元杂环化合物
一、呋喃、噻吩、吡咯
1. 结构
O 呋喃
S 噻吩
吡咯
所有成环原子都以sp2杂化轨道重叠形成σ键;碳原子 未参加杂化的p轨道有1个电子,杂原子则有2个p电子,p 轨道互相平行重叠形成6电子环状共轭大π键。 与苯环的6 原子共6π电子比,呋喃、噻吩、吡咯为5原子共用6个π电子, 故环上π电子密度比苯环大,属于“富π芳杂环”。
S
吡啶
呋喃
噻吩 吡咯
哌啶
四氢呋喃
其它不具芳香性的杂环化合物,统称为非芳 香杂环化合物或杂脂环化合物。
3
DC.sjtu
第一节 分类和命名
一、分类
五元杂环:
O 单杂环
六元杂环:
杂环
苯稠杂环:
稠杂环
杂稠杂环:
4
N S
DC.sjtu
二、命名
4
3
4
Cl 5 1 2SH 5
3 12
CH3
5 6
1
3 2
C2H5
2-巯基-5-氯咪唑 1-甲基吡唑
2-乙基嘧啶
4
N3
51 2
S
噻唑
4
N3
51 2
O
噁唑
8
DC.sjtu
3. 有特定名称的稠杂环母环的编号,大都按照稠芳环 规则编号,但个别的另有编号顺序(如嘌呤)。
5 6
芳香性 (环的稳定性):苯 > 噻吩 > 吡咯 > 呋喃
13
DC.sjtu
2. 化学性质
为富电子芳杂环,亲电取代比苯容易。吡咯的活泼度与 苯胺或苯酚相当,噻吩是三者中活性最差的,然而噻吩的亲 电取代反应活性仍比苯大得多。如在室温及乙酸溶液中,噻 吩与Br2发生取代反应的速度为苯的109倍。
25℃
S SO3H
噻吩-2-磺酸
16
DC.sjtu
溴代: Br2 (或I2) Br 乙醇(稀释)/0℃ Br
Br
产物均为
Br 四卤吡咯
吡咯
硝化: CH3CO2NO2 乙酸酐/5℃
二噁烷(稀释)/0℃
O Br (80%)
O 呋喃
氯代:Cl2 -40℃
O Cl Cl O Cl
产率变迁不定
硝化:CH3CO2NO2 (硝基乙酰酯) -5~-30℃
O NO2 (35%)
2-硝基呋喃
磺化:吡啶.SO3
ClCH2CH2Cl/室温
15
O SO3H (41%)
10
DC.sjtu
呋喃 环中的杂 原子O (噻吩中为 S) 的 1 个 sp2 杂 化 轨道上有 一对未共 用电子对。
环状离域的大π 键, 5个原子共用 6个电子,为 富π电子体系。
S
11
sp2
DC.sjtu
吡咯环 N 的1个sp2杂 化轨道上有1个电子 与 H 的1s电子配对 形成N—H σ 键。
第十五章 芳杂环化合物
掌握杂环化合物的命名; 掌握五元杂环、六元杂环
和稠杂环的结构和性质
1
DC.sjtu
杂环化合物(Heterocyclic Compouds)
“杂环”就是组成环的原子除C外,还含有其它元素的原 子,这些非碳原子统称为杂原子。原则上二价以上的元素都可 以成为杂原子,但最常见的是O、S和N。
呋喃-2-磺酸
DC.sjtu
溴代:Br2 乙酸/室温
S Br (78%)
S 噻吩
氯代:Cl2 50℃
S Cl Cl S Cl
30%
14%
+ 13%加成产物
硝化:CH3CO2NO2 乙酸酐/- 10℃
S NO2
70%
NO2
S
5%
磺化: 95%H2SO4
(69%~76%)
12
DC.sjtu
杂环中的π电子云分布不象苯环那样均匀,环 的稳定性因而不如苯。O的电负性(3.5)较大,故呋 喃环π电子共轭程度较弱,芳香性最小。S的电负性 (2.5)在三者中为最小,且S为第三周期元素,原子半 径较大,原子核对共轭π电子的吸引力较小,故噻吩 环π电子共轭程度较大,芳香性在三者中是最大的。 N的电负性(3.0)在O、S之间,故吡咯的芳香性介于 呋喃与噻吩之间。
前面学过的内酯、内酰胺、环氧化合物、环状酸酐等:
N-H
因其性质与相应的脂肪族化合物较相似,因此并 入脂肪族化合物中讨论,而不列为杂环化合物。
2
DC.sjtu
本章讨论的杂环化合物主要指环系较稳定,包 括杂原子在内的环是平面型,环内有4n+2个π电子处于 环闭共轭体系中,统称为芳(香)杂环化合物。
purine
杂环的编号规则:
1. 单杂环的编号从杂原子开始。
4
3(b)
4(g)
5
3(b)
5 1 2(a)
O
呋喃
6 1 2(a)
吡啶
O
Br CHO
呋喃-2-甲醛 α-呋喃甲醛
3-溴吡啶 β-溴吡啶
7
4
3(b)
5 1 2(a)
吡咯
N CH3
1-甲基吡咯
DC.sjtu
2. 有多个杂原子时,按O、S、N-R、NH、N 顺序编号.
噁唑 oxazoleDC.sjtu
六5
3
元6
2
杂
1
环 吡啶
pyridine
5
3
6
2
1
嘧啶 pyrimidine
5
3
6
2
1
哒嗪 pyridazine
5
3
6
2
1
吡喃 pyran
稠杂环
5 6 7
8
4
5
36
27
1
8
4
4
35
26
1
7
6 15Hale Waihona Puke 3 1 22 49 83
喹啉
异喹啉
吲哚
嘌呤
quinoline
isoquinoline indole
命名原则:译音+“口”旁
4
3(b)
4
3
4
5 1 2(a)
5 12
5
O
S
3 12
4
N3
512
S
呋喃 五 元 furan
杂
3
4
环2 1 5
噻吩
吡咯
thiophene pirrole
4
3
5 12
噻唑 thiazole
4
N3
512
O
咪唑 Imidazole
吡唑 pyroz5 ole
亲电取代活性:呋喃、吡咯 > 噻吩 > 苯
亲电取代反应主要在2-位发生;若2、5两个 位置已有基团存在,则亲电取代在β位发生。
-0.06 -0.10 +0.32
这些杂环进行亲电取代反应时, 须用缓和的试剂在温和的条件下进行。
14
DC.sjtu
(1) 亲电取代 溴代:Br2
4 3
2
81
萘
5 6
7
4
5
36
27
4 3
2
81
OH 8-羟基喹啉
81
异喹啉
4 5
4 35
3 CO2H
6
12 6
12
7
Br 7
茚
6-溴吲哚 -3-羧酸
NH2
1 65
7
2 49 8
3
6-氨基 嘌呤
第二节 五元杂环化合物
一、呋喃、噻吩、吡咯
1. 结构
O 呋喃
S 噻吩
吡咯
所有成环原子都以sp2杂化轨道重叠形成σ键;碳原子 未参加杂化的p轨道有1个电子,杂原子则有2个p电子,p 轨道互相平行重叠形成6电子环状共轭大π键。 与苯环的6 原子共6π电子比,呋喃、噻吩、吡咯为5原子共用6个π电子, 故环上π电子密度比苯环大,属于“富π芳杂环”。
S
吡啶
呋喃
噻吩 吡咯
哌啶
四氢呋喃
其它不具芳香性的杂环化合物,统称为非芳 香杂环化合物或杂脂环化合物。
3
DC.sjtu
第一节 分类和命名
一、分类
五元杂环:
O 单杂环
六元杂环:
杂环
苯稠杂环:
稠杂环
杂稠杂环:
4
N S
DC.sjtu
二、命名
4
3
4
Cl 5 1 2SH 5
3 12
CH3
5 6
1
3 2
C2H5
2-巯基-5-氯咪唑 1-甲基吡唑
2-乙基嘧啶
4
N3
51 2
S
噻唑
4
N3
51 2
O
噁唑
8
DC.sjtu
3. 有特定名称的稠杂环母环的编号,大都按照稠芳环 规则编号,但个别的另有编号顺序(如嘌呤)。
5 6
芳香性 (环的稳定性):苯 > 噻吩 > 吡咯 > 呋喃
13
DC.sjtu
2. 化学性质
为富电子芳杂环,亲电取代比苯容易。吡咯的活泼度与 苯胺或苯酚相当,噻吩是三者中活性最差的,然而噻吩的亲 电取代反应活性仍比苯大得多。如在室温及乙酸溶液中,噻 吩与Br2发生取代反应的速度为苯的109倍。
25℃
S SO3H
噻吩-2-磺酸
16
DC.sjtu
溴代: Br2 (或I2) Br 乙醇(稀释)/0℃ Br
Br
产物均为
Br 四卤吡咯
吡咯
硝化: CH3CO2NO2 乙酸酐/5℃
二噁烷(稀释)/0℃
O Br (80%)
O 呋喃
氯代:Cl2 -40℃
O Cl Cl O Cl
产率变迁不定
硝化:CH3CO2NO2 (硝基乙酰酯) -5~-30℃
O NO2 (35%)
2-硝基呋喃
磺化:吡啶.SO3
ClCH2CH2Cl/室温
15
O SO3H (41%)
10
DC.sjtu
呋喃 环中的杂 原子O (噻吩中为 S) 的 1 个 sp2 杂 化 轨道上有 一对未共 用电子对。
环状离域的大π 键, 5个原子共用 6个电子,为 富π电子体系。
S
11
sp2
DC.sjtu
吡咯环 N 的1个sp2杂 化轨道上有1个电子 与 H 的1s电子配对 形成N—H σ 键。
第十五章 芳杂环化合物
掌握杂环化合物的命名; 掌握五元杂环、六元杂环
和稠杂环的结构和性质
1
DC.sjtu
杂环化合物(Heterocyclic Compouds)
“杂环”就是组成环的原子除C外,还含有其它元素的原 子,这些非碳原子统称为杂原子。原则上二价以上的元素都可 以成为杂原子,但最常见的是O、S和N。
呋喃-2-磺酸
DC.sjtu
溴代:Br2 乙酸/室温
S Br (78%)
S 噻吩
氯代:Cl2 50℃
S Cl Cl S Cl
30%
14%
+ 13%加成产物
硝化:CH3CO2NO2 乙酸酐/- 10℃
S NO2
70%
NO2
S
5%
磺化: 95%H2SO4
(69%~76%)
12
DC.sjtu
杂环中的π电子云分布不象苯环那样均匀,环 的稳定性因而不如苯。O的电负性(3.5)较大,故呋 喃环π电子共轭程度较弱,芳香性最小。S的电负性 (2.5)在三者中为最小,且S为第三周期元素,原子半 径较大,原子核对共轭π电子的吸引力较小,故噻吩 环π电子共轭程度较大,芳香性在三者中是最大的。 N的电负性(3.0)在O、S之间,故吡咯的芳香性介于 呋喃与噻吩之间。
前面学过的内酯、内酰胺、环氧化合物、环状酸酐等:
N-H
因其性质与相应的脂肪族化合物较相似,因此并 入脂肪族化合物中讨论,而不列为杂环化合物。
2
DC.sjtu
本章讨论的杂环化合物主要指环系较稳定,包 括杂原子在内的环是平面型,环内有4n+2个π电子处于 环闭共轭体系中,统称为芳(香)杂环化合物。
purine
杂环的编号规则:
1. 单杂环的编号从杂原子开始。
4
3(b)
4(g)
5
3(b)
5 1 2(a)
O
呋喃
6 1 2(a)
吡啶
O
Br CHO
呋喃-2-甲醛 α-呋喃甲醛
3-溴吡啶 β-溴吡啶
7
4
3(b)
5 1 2(a)
吡咯
N CH3
1-甲基吡咯
DC.sjtu
2. 有多个杂原子时,按O、S、N-R、NH、N 顺序编号.
噁唑 oxazoleDC.sjtu
六5
3
元6
2
杂
1
环 吡啶
pyridine
5
3
6
2
1
嘧啶 pyrimidine
5
3
6
2
1
哒嗪 pyridazine
5
3
6
2
1
吡喃 pyran
稠杂环
5 6 7
8
4
5
36
27
1
8
4
4
35
26
1
7
6 15Hale Waihona Puke 3 1 22 49 83
喹啉
异喹啉
吲哚
嘌呤
quinoline
isoquinoline indole
命名原则:译音+“口”旁
4
3(b)
4
3
4
5 1 2(a)
5 12
5
O
S
3 12
4
N3
512
S
呋喃 五 元 furan
杂
3
4
环2 1 5
噻吩
吡咯
thiophene pirrole
4
3
5 12
噻唑 thiazole
4
N3
512
O
咪唑 Imidazole
吡唑 pyroz5 ole
亲电取代活性:呋喃、吡咯 > 噻吩 > 苯
亲电取代反应主要在2-位发生;若2、5两个 位置已有基团存在,则亲电取代在β位发生。
-0.06 -0.10 +0.32
这些杂环进行亲电取代反应时, 须用缓和的试剂在温和的条件下进行。
14
DC.sjtu
(1) 亲电取代 溴代:Br2
