微生物限度检验原始记录
微生物限度、控制菌检查记录

产品名称
批号
数量
供货单位
取样量
检验日期
温度
湿度
报告日期
检验依据
供试液制备
取供试品(g),加pH7.0无菌氯化钠蛋白胨缓冲液至ml,混匀,作为1:10的供试液;细菌检查:吸取本品1ml至5个平皿,每个平皿0.2ml;霉菌和酵母菌检查:吸取本品1ml至平皿
平皿号
细菌
培养基/批号
营养琼脂培养基/
供试品
阳性对照
阴性对照
结果
□检出□未检出(规定:)
备注
结论
本品按进行检验,结果。
检验人
复核人
2天
3天
3天
4天
4天
5天
5天
5
1天
1天
2天
2天
3天
3天
4天
4天
5天
5天
每组菌落总数
平均数
平均数
结果
(规定:)
结果
(规定:)
备注
结论
本品经按进行检验,结果。
检验人
复核人
控制菌检查记录
检验编号:
产品名称
批号
数量
供货单位
取样量
检验日期
温度
湿度
报告日期
检验依据
一、大肠埃希菌检查
供试品制备:取供试品(g/ml/cm2),加PH7.0无菌氯化钠蛋白胨缓冲液至ml,混匀,作为的供试液。
培养基信息:①营养肉汤培养基配制批号:②四硫磺酸钠亮绿培养基配制批号:
③胆盐硫乳琼脂培养基配制批号:④EMB配制批号:
培养温度:培养时间:培养箱编号:
营养肉汤预增菌(18~24h)
四硫磺酸钠亮绿增菌(18~24h)
微生物限度检验记录表
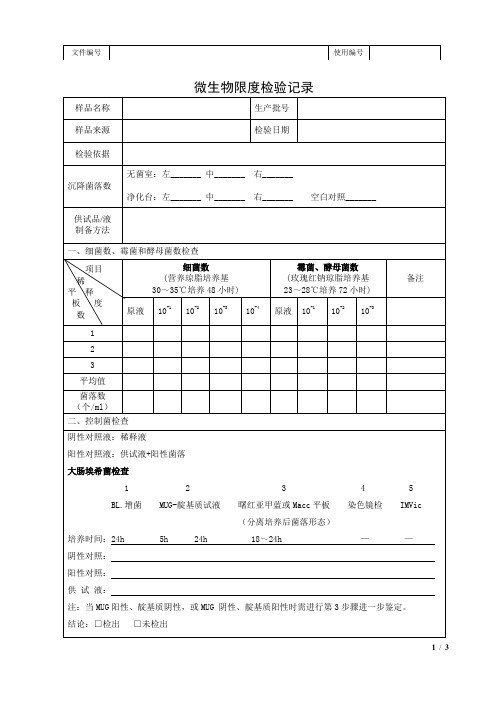
霉菌、酵母菌数
(玫瑰红钠琼脂培养基
23~28℃培养72小时)
备注
原液
10-1
10-2
10-3
10-4
原液
10-1
10-2
10-3
1
2
3
平均值
菌落数
(个/ml)
二、控制菌检查
阴性对照液:稀释液
阳性对照液:供试液+阳性菌落
大肠埃希菌检查
1 2 3 4 5
BL.增菌MUG-靛基质试液曙红亚甲蓝或Macc平板染色镜检IMVic
文件编号
使用编号
微生物限度检验记录
样品名称
生产批号
样品来源
检验日期
检验依据
沉降菌落数
无菌室:左_______中_______右_______
净化台:左_______中_______右_______空白对照_______
供试品/液
制备方法
一、细菌数、霉菌和酵母菌数检查
项目
基
结论:□检出□未检出
结果分析
结论
□(均)符合规定□(均)不符合规定
检验:审核:复核:日期:
阴性对照:
阳性对照:
供试品:
注:当第2步发现有菌落生长且形态与金黄色葡萄球菌疑似时需挑选2~3个菌落,分别接种于营养琼脂培养基斜面上,培养18~24小时,再进行第3步骤进一步鉴定。
结论:□检出□未检出
铜绿假单胞菌检查
1 2 3 4 5
BL增菌溴化十六烷基三甲铵平板革兰氏染色镜检氧化酶试验绿脓菌素试验
培养时间:24h24h———
阴性对照:
阳性对照:
供试品:
注:当第2步发现有菌落生长且形态与铜绿假单胞菌疑似时需挑选2~3个菌落,分别接种于营养琼脂培养基斜面上,培养18~24小时,再进行第3步骤进一步鉴定。
微生物限度检验原始记录(国标)
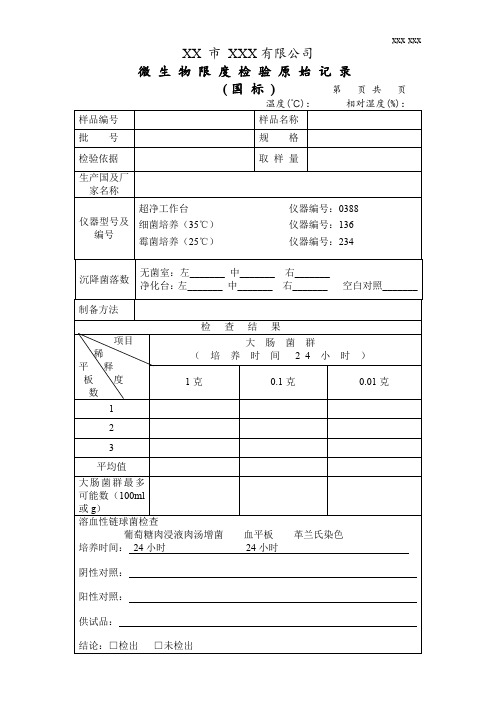
无菌室:左_______ 中_______ 右_______ 净化台:左_______ 中_______ 右_______
Hale Waihona Puke 空白对照_______制备方法
项目 稀 平释 板度 数
1
检查结果
大肠菌群 ( 培 养 时 间 24 小 时 )
1克
0.1 克
0.01 克
2
3
平均值
大肠菌群最多 可能数(100ml 或 g) 溶血性链球菌检查
活螨: □检出 □未检出
其他检验方法:
结 论□
检验者: 日 期:
(均)符合规定 □
校对者: 日 期:
(均)不符合规定
审核者: 日 期:
样品编号 批号
XX 市 XXX 有限公司
xxx-xxx
微生物限度检验原始记录
(国 标 )
第 页共 页
温度(℃):
相对湿度(%):
样品名称
规格
检验依据
生产国及厂 家名称
仪器型号及 编号
超净工作台 细菌培养(35℃) 霉菌培养(25℃)
取样量
仪器编号:0388 仪器编号:136 仪器编号:234
沉降菌落数
葡萄糖肉浸液肉汤增菌 培养时间: 24 小时
血平板 革兰氏染色 24 小时
阴性对照:
阳性对照:
供试品:
结论:□检出 □未检出
xxx-xxx
志贺氏菌检查 25 克+GN225ML 增菌 EMB 或 SS 平板 三糖铁琼脂斜面
培养时间:_______________________________________________________ 阴性对照: 阳性对照: 供试品: 结论:□检出 □未检出
微生物限度检查原始记录

室温:℃湿度:%
供试液制备:
生产工具用无菌脱脂棉球蘸无菌生理盐水溶液,反复刷洗设备表面10 cm2,然后将带菌脱脂棉放入100 mL无菌生理盐水中,进行充分洗涤,即制成1:10含菌样液。
细菌总数:常规法30~35℃培养3天
大肠菌群检查:常规法30~35℃培养
结果判定:
本品按照《中国药典》2010年版二部附录XI J检验,结论为:□合格□不合格
复核人:检验人:
室温:℃湿度:%
供试液制备:
用无菌镊子取无菌脱脂棉签蘸无菌生理盐水溶液,反复刷洗人员手部和衣服表面10 cm2,然后将带菌脱脂棉放入100 mL无菌生理盐水中,进行充分洗涤,即制成含菌样液。
细菌总数:常规法30~35℃培养3天
大肠菌群检查:常规法30~35 ℃培养
结果判定:
本品按照《中国药典》2010年版二部附录XI J检验,结论为:□合格□不合格复核人:检验人:。
纯化水检验原始记录
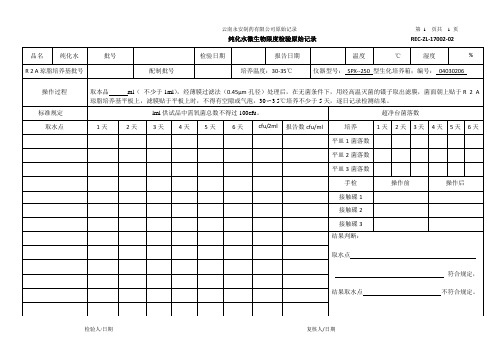
云南永安制药有限公司原始记录第1 页共 1 页
纯化水微生物限度检验原始记录REC-ZL-17002-02
品名纯化水批号检验日期报告日期温度℃湿度% R 2 A琼脂培养基批号配制批号培养温度:30-35℃仪器型号:SPX--250 型生化培养箱;编号:04030206
操作过程取本品ml(不少于1ml),经薄膜过滤法(0.45μm孔径)处理后,在无菌条件下,用经高温灭菌的镊子取出滤膜,菌面朝上贴于R 2 A 琼脂培养基平板上,滤膜贴于平板上时,不得有空隙或气泡,30〜3 5℃培养不少于5天,逐日记录检测结果。
标准规定lml供试品中需氧菌总数不得过100cfu。
超净台菌落数取水点1天2天3天4天5天6天cfu/2ml 报告数cfu/ml 培养1天2天3天4天5天6天
平皿1菌落数
平皿2菌落数
平皿3菌落数
手检操作前操作后
接触碟1
接触碟2
接触碟3
结果判断:
取水点
符合规定,
结果取水点不符合规定。
检验人/日期复核人/日期。
微生物限度检验原始记录

10-3
阴性对照
1
1
1
2
2
2
平均
平均
平均
结 果: cfu/g
2.霉菌、酵母菌检查:玫瑰红钠琼脂培养基批号: 培养温度: ℃ 培养箱:SPX-150B-Z生化培养箱
24小时观察结果
48小时观察结果
72小时观察结果
碟号
10-1
10-2
阴性对照
碟号
10-1
10-2
阴性对照
碟号
10-1
10-2
阴性对照
常规法 加pH7.0无菌氯化钠-蛋白胨缓冲液: ml □保温振摇法 □研钵法
1.细菌检查: 营养琼脂培养基批号: 培养温度: ℃ 培养箱:SPX-150B-Z生化培养箱
24小时观察结果
48小时观察结果
72小时观察结果
碟号
碟号
10-1
10-2
10-3
阴性对照
碟号
10-1
EMB或MacC平板
TSI斜面
生化反应
血清凝集
结果:
结果:
5.大肠菌群: 6.活螨
0.1g或0.1ml
0.01g或0.01ml
0.001g或0.001ml
活螨检查
直接法□ 集螨法□ 漂浮法□ 分离法□
结果: (个∕g或ml)
结果:
检验人: 复核人:
微生物限度检验原始记录
文件标题
微生物限度检验记录
第1页
共1页
项目
部 门/职 务
姓 名
日 期
起 草
质量控制部
审 核
质量控制部
审 核
质量保证部
批 准
质量副总经理
颁发部门
压缩空气系统微生物检测记录
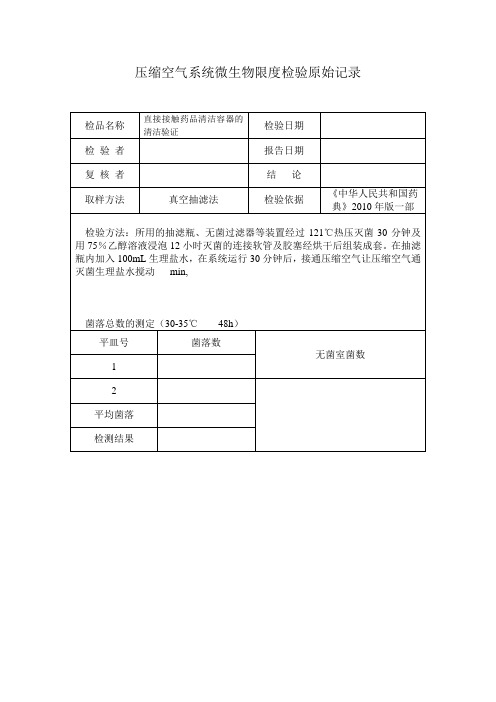
平皿号
菌落数
无菌室菌数
1
2
平均菌落
检测结果
压缩空气系统微生物限度检验原始记录
检品名称
直接接触药品清洁容器的清洁验证
检验日期
检验者
报告日期
复核者
结论
取样方法
真空抽滤法
检验ห้องสมุดไป่ตู้据
《中华人民共和国药典》2010年版一部
检验方法:所用的抽滤瓶、无菌过滤器等装置经过121℃热压灭菌30分钟及用75%乙醇溶液浸泡12小时灭菌的连接软管及胶塞经烘干后组装成套。在抽滤瓶内加入100mL生理盐水,在系统运行30分钟后,接通压缩空气让压缩空气通灭菌生理盐水搅动min,
微生物限度检验记录

微生物限度检查记录
检验人/日期:复核人/日期:
微生物限度检查记录
【大肠埃希菌】标准规定:(g/ml/cm2)不得检出
检验人/日期:复核人/日期:
微生物限度检查记录
【耐胆盐革兰阴性菌】标准规定:(g/ml/cm2)
检验人/日期:复核人/日期:
微生物限度检查记录
【沙门菌】标准规定:不得检出/10g
检验人/日期:复核人/日期:
微生物限度检查记录
【铜绿假单胞菌】标准规定:不得检出
检验人/日期:复核人/日期:
微生物限度检查记录
【金黄色葡萄球菌】标准规定:不得检出
检验人/日期:复核人/日期:
微生物限度检查记录
【白色念珠菌】标准规定:不得检出
检验人/日期:复核人/日期:
微生物限度检查记录
【梭菌】标准规定:不得检出
检验人/日期:复核人/日期:温馨提示:最好仔细阅读后才下载使用,万分感谢!。
微生物限度检查记录(2010年版)
3、大肠埃希菌测定:取1:10供试液10ml加入100ml胆盐乳糖增菌培养基中,35℃培养48小时。取上述培养物0.2ml,接种至含5mlMUG培养基的试管内,培养5-24小时,在366nm紫外灯下观察。
一、细菌数检查(30~35℃)
供试品
阴性对照
阳性对照
结果
□检出□未检出沙门菌(规定:不得检出/10ml)
结论
本品经按《中国药典》2010年版“微生物限度检查法”进行检验,结果。
审核者:检验者:
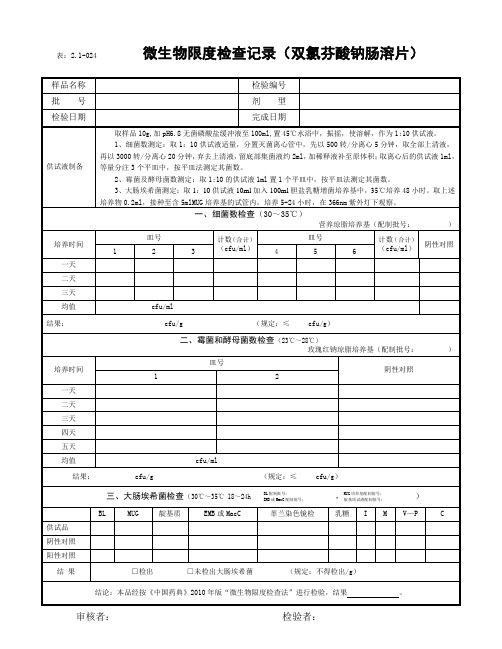
表:2.1-024微生物限度检查记录(内包材)
样品名称
检验编号
批号
检验日期
完成日期
供试液制备
1、口服液体药用复合硬片:取本品100㎝2,剪碎,加pH7.0无菌氯化钠-蛋白胨缓冲液100ml,浸泡,振摇,作为1:10的供试液。
结论:本品经按《中国药典》2010年版“微生物限度检查法”进行检验,结果。
审核者:检验者:
表:2.1-024微生物限度检查记录(脑心舒口服液)
样品名称
检验编号
批号
剂型
检验日期
完成日期
供试液制备
取供试品ml,加PH7.0无菌氯化钠蛋白胨缓冲液至ml,用适宜的方法混匀,作为
1:10的供试液。
一、细菌数检查(30~35℃)
阴性对照
原液
10-1
10-2
阴性对照
皿1
皿2
皿1
皿2
皿1
皿2
皿1
皿2
皿1
皿2
皿1
皿2
一天
二天
三天
四天
五天
均值
微生物限度检查记录
阳性对照
检验人
结果
复核人:复核日期:
二、大肠菌群检查(30~35℃)
培养基编号:RDF- MKK-
平皿号:
培养基类别
乳糖胆盐发酵
培养基
麦康凯琼脂
培养基
操作日期培养Leabharlann 编号供试液10-1
供试液
10-2
供试液
10-3
阴性对照
阳性对照
检验人
结果
复核人:复核日期:
24
1
2
48
1
2
72
1
2
96
120
结果
报告值
Cfu/
培养基编号:MGH-
检验人:复核人:
检验日期:复核日期:
控制菌检查记录
检品名称:批号:
检验依据:
一、大肠埃希菌检查(30~35℃)
培养基编号:DRZ- MUG-
DJZ-平皿号:
培养基类别
胆盐乳糖
培养基
MUG
培养基
靛基质
试液
备注
操作日期
培养基编号
供试品
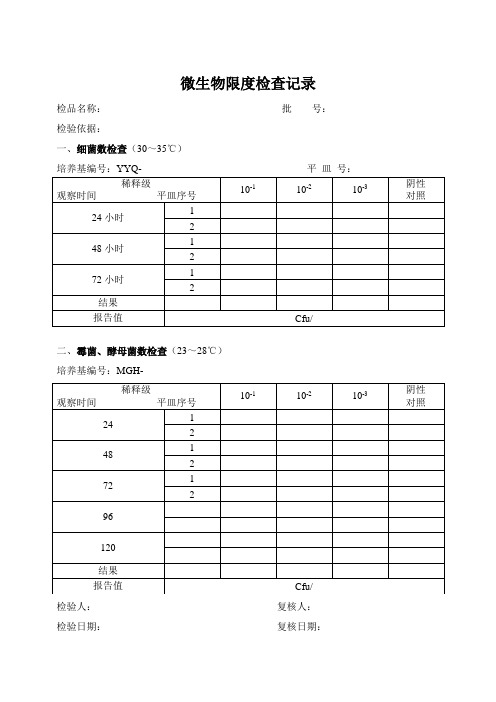
微生物限度检查记录
检品名称:批号:
检验依据:
一、细菌数检查(30~35℃)
培养基编号:YYQ-平皿号:
稀释级
观察时间平皿序号
10-1
10-2
10-3
阴性
对照
24小时
1
2
48小时
1
2
72小时
1
2
结果
报告值
Cfu/
二、霉菌、酵母菌数检查(23~28℃)
稀释级
观察时间平皿序号
10-1
10-2
10-3
阴性
对照
微生物限度检查方法学验证原始记录

微生物限度检查方法验证原始记录(平皿法)
验证类别:□初次验证□周期性再验证
样品来源:□研发中试产品□研发试生产产品□正式生产产品
验证药品名称:规格:
验证起止时间:年月日~年月日
一、计数方法验证
1、实验条件
样品名称:批号:
培养基:营养肉汤培养基批号:配制日期:营养琼脂培养基批号:配制日期:
改良马丁液体培养基批号:配制日期:
改良马丁琼脂培养基批号:配制日期:
玫瑰红钠琼脂培养基批号:配制日期:
胆盐乳糖培养基批号:配制日期:
MUG培养基批号:配制日期:
蛋白胨批号:配制日期:
稀释剂:0.9%无菌氯化钠-蛋白胨缓冲液配制日期:
培养箱:□设备型号:SPX-150 培养温度:30~35℃
□设备型号:LRH-150B 培养温度:23~28℃
2、环境测试
测试时间:年月日操作人:复核人:沉降菌菌落数:无菌室:左中右
净化台:左中右空白对照
3、菌种
大肠埃希菌(Escherichia coli)〔CMCC(B)44102〕编号:
金黄色葡萄球菌(Staphylococcus aureus) 〔CMCC(B) 26 003〕编号:
枯草芽孢杆菌(Bacillus subtilis) 〔CMCC(B)63501〕编号:
白色念珠菌(Candida albicans)〔CMCC(F) 98 001〕编号:
黑曲霉(Aspergillus niger) 〔CMCC(F)98 003 编号:
(1)微生物生长检查记录(1)
样品名称:样品批号:
样品名称:样品批号:
时间:年月日计数人:复核人:
样品名称:样品批号:
(2)回收率记录
统计时间:统计人:复核人:。
微生物限度检查记录版
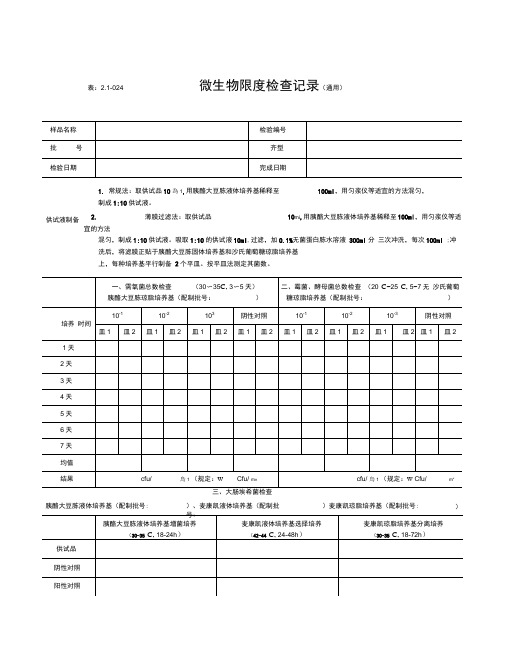
表:2.1-024微生物限度检查记录(通用)1. 常规法:取供试品10為1,用胰酪大豆胨液体培养基稀释至 100ml ,用匀浆仪等适宜的方法混匀,制成1:10供试液。
2. 薄膜过滤法:取供试品10mi ,用胰酪大豆胨液体培养基稀释至 100ml ,用匀浆仪等适宜的方法混匀,制成1:10供试液。
吸取1:10的供试液10ml ,过滤,加0.1%无菌蛋白胨水溶液 300ml 分 三次冲洗,每次100ml ;冲洗后,将滤膜正贴于胰酪大豆胨固体培养基和沙氏葡萄糖琼脂培养基 上,每种培养基平行制备 2个平皿。
按平皿法测定其菌数。
胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批)麦康凯琼脂培养基(配制批号: )供试液制备微生物限度检查记录、需氧菌总数检查30〜353〜5)、霉菌、酵母菌总数检查20C〜25C,5〜7天)三糖铁琼脂斜面穿刺接种 (18〜24h )三、控制菌检查 (30-35 C )检验者:表:2.1-024号:结论本品经按《中国药典》2015年版“非无菌产品微生物限度检查法”进行检验,结果审核者:微生物限度检查记录(丸剂)供试液制备供试液。
胰酪大豆胨增菌 (18〜24h )RV 沙门选择培养木糖赖氨酸脱氧胆酸分离培养(18〜48h )胰酪大豆胨液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)四、沙门菌检查 (30 °C 〜35C ) 胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:五、耐胆盐革兰阴性菌检杳胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:审核者:检验者: 表:2.1-024阴性对照阳性对照三、大肠埃希菌检查)、麦康凯液体培养基(配制批结果□检出大肠埃希菌□未检出大肠埃希菌(规定:不得检出/g)四、沙门菌检查(30°C〜35C)胰酪大豆东液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:、表: 2.1-024 微生物限度检查记录(蛇胆川贝液)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)审核者:检验者:表:2.1-024 微生物限度检查记录(30〜353〜5天)、霉菌、酵母菌总数检查20C〜25C, 5〜7天)1、 口服液体药用聚酯瓶:取数个试瓶,加入1/2标示容量的氯化钠注射液,将盖旋紧,振摇1分钟,即得供试液。
28微生物限度检测原始记录
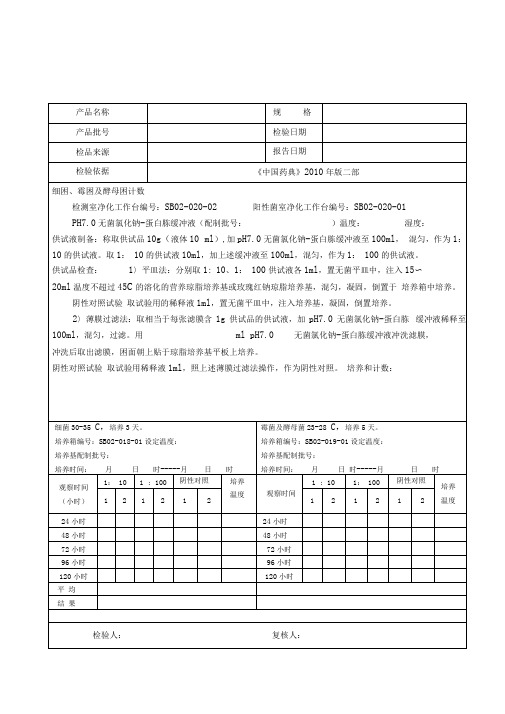
规 格 检验日期结论:活螨检验:供试品 用直接检查法, 活螨结论:产品名称 产品批号产品名称产品批号 控制菌检查 阳性对照菌 取沙门菌 新鲜营养肉汤(配制批号:)培养物1ml, 9ml0.9%无菌NaCI 溶液10倍递增稀释取供试品10g 直接接种至300ml 的营养肉汤(配制批号: )中,混匀,培养18〜24小时。
取上述培养物1ml ,接种于10ml 四硫磺酸钠亮绿培养基(配制批号:)中,培养18〜24小时后,分别划线接种于胆盐硫乳琼脂培养基 (或沙门、志贺菌属琼脂培养基) 和麦康凯琼脂培养基(配制批号:)(或曙红亚甲蓝琼脂培养基)的平板上,培养18〜24小时(必要时可延长至 40-48小时)。
若平板上生长的菌落与下表所列的菌落形态特征相符或疑似,用接种针挑选 2-3个菌落分别于三糖铁琼脂培养基高层斜面上进行斜面和高层穿刺接种,培养18〜24小时。
阳性对照试验 阳性对照试验方法同供试品的检查,对照菌加菌量为 10-100cfu 。
阴性对照试验 取稀释液10ml 照控制菌检查法检查。
结论:规 格 检验日期检测室净化工作台编号:SB02-020-02 阳性菌室净化工作台编号:SB02-020-01供试液制备:取本品用开孔面积为20cm2的消毒过的金属模板压在内层面上,将无菌棉签用0. 9%无菌氯化钠溶液,稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置100cmt每支棉签抹完后立即剪断(或烧断),投入盛有30ml 0.9 %无菌氯化钠溶液的锥型瓶(或大试管)中。
全部擦抹棉签投入瓶中后,将瓶迅速摇晃1分钟,即得供试液。
供试品检查:平皿法:分别取100cm:30 ml、100cm:300 ml供试液各1ml,置无菌平皿中,注入15〜20ml温度不超过45C的溶化的营养琼脂培养基或玫瑰红钠琼脂培养基,混匀,凝固,倒置于培养箱中培养。
阴性对照试验取试验用的稀释液1ml,置无菌平皿中,注入培养基,凝固,倒置培养。
10.1微生物限度检查记录

二、细菌、霉菌检查:
细菌
30~35℃72小时
原液
10-1
10-2
10-3
阴性对照
1
2
1
2
1
2
1
2
1
2
24小时
48小时
72小时
平均菌落数
霉菌及酵母菌
23~28℃120小时
原液
10-1
10-2
10-3
阴性对照
1
2
1
2
1
2
1
2
1
2
48小时
72小时
96小时
120小时
平均菌落数
三、大肠埃希菌:
增
菌
培
养
培养基:胆盐乳糖培养基
培养温度:℃
培养时间:小时
供试品
阴性对照
阳性对照
结果
BL
□未检出大肠埃希菌
□检出大肠埃希菌
MUG
靛基质
分
离
EMB或MacC
革兰氏染色、镜检
生
化
反
应
I
M
V-P
C
乳糖发酵
活满检查
用肉眼观察:
四、微生物室菌落数
1.、2.、3.。
结论:本品按《中国药典》2010年版二部附录ⅪJ微生物限度检查法检验,结果:。
微生物限度检查记录
检品名称
批号
规格
取样日期
检验日期
报告日期
消毒时间
送检部门
温度
附录ⅪJ微生物限度检查法检验。
标准规定
细菌数≤1000cfu/g霉菌数≤100cfu/g,大肠埃希菌不得检出。
微生物限度方法验证原始记录

样品名称:主要成分(处方):样品来源:样品规格:批号:样品前处理方法:取 g(ml)加(乳化剂) g(ml),加pH7.0无菌氯化钠-蛋白胨缓冲液(pH6.8无菌磷酸盐缓冲液) ml验证用菌种:枯草芽孢杆菌CMCC(B)63501、金黄色葡萄球菌CMCC(B)26003、大肠埃希菌 CMCC(B)44102、白色念珠菌 CMCC(F)98001、黑曲霉 CMCC(F)98003。
菌液制备:大肠埃希菌肉汤培养物1ml,加9ml生理盐水,10倍稀释至,备用。
金黄色葡萄球菌肉汤培养物1ml,加9ml生理盐水,10倍稀释至,备用。
枯草芽孢杆菌肉汤培养物1ml,加9ml生理盐水,10倍稀释至,备用。
白色念珠菌改良马丁培养物1ml,加9ml生理盐水,10倍稀释至,备用。
黑曲霉菌斜面的新鲜培养物接种至改良马丁琼脂斜面培养基上,25.5±2.5℃培养5~7d,使大量的孢子成熟。
取经25℃培养7d的黑曲霉真菌斜面培养物,加入生理盐水 ml洗下孢子,吸出转移至空试管作为原液,稀释至,备用。
菌液计数:分别取上述5种细菌菌液适量加入培养皿,每种菌液做平行2皿。
大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌注入营养琼脂培养基约15~20ml,30~35℃培养;白色念珠菌注入改良马丁琼脂培养基、黑曲霉注入玫瑰红钠琼脂培养基约15~20ml,23~28℃培养。
表1 细菌数计数结果表2 霉菌数计数结果回收率测定:(常规法)(1)试验组:分别取供试液1 ml和各试验菌液同时加入平皿中,立即倾注营养琼脂培养基(白色念珠菌用改良马丁琼脂培养基,黑曲霉用玫瑰红钠琼脂培养基),待凝固后,置规定温度培养24~72小时观察结果。
(2)供试品对照组:除不加菌液外,其他同试验组。
(3)稀释剂对照组:除不加供试液,余下同试验组。
回收率测定结果结果:(1)枯草芽孢杆菌回收率 70%金黄色葡萄球菌回收率 70%大肠埃希菌回收率 70%常规法□适合□不适合该品种细菌计数方法(2)白色念珠菌回收率 70%黑曲霉菌回收率 70%常规法□适合□不适合该品种霉菌及酵母菌计数方法回收率测定:(培养基稀释法) ml/皿(1)试验组:分别取供试液 1 ml,分置个平皿,每皿加入试验菌液,立即倾注营养琼脂培养基(白色念珠菌用改良马丁琼脂培养基,黑曲霉用玫瑰红钠琼脂培养基),待凝固后,置规定温度培养24~72小时观察结果。
微生物限度测定原始记录表(平皿倾注法)
主要 仪器 设备
名称 高压蒸汽灭菌器
生物安全柜 生物安全柜 电热恒温培养箱
型号 LDZF-75KB-Ⅱ BHC/1300Ⅱ-A/B3
BHC-090A DH-420A
编号
1016A1-001
1014A1-001 1019A1-001
1001A1-001
主要培养基 及试剂
培养基名称 胰酪大豆琼脂
批号
生产厂家
计算 公式
菌落总数(CFU/ml 或 g 或 cm2)=平均菌落数(CFU)×稀释倍数
不同稀释度培养结果
菌落总数
序号
1 2 3
样品编号
-0001 -0002 空白
1:1
平
平
平 CFU/mL CFU/g CFU/cm2
1
2
3
均
1
2
3
均
1
2
3
均
27 24 / 26 / / / / / / / /
26
/
/
检验 步骤
取_______1mL_________的供试液于无菌平皿中,另取 1ml 于另一无菌平皿做平行接种,取 1ml 加到 9ml 稀释液中作 1:10 稀释,混匀后取 2ml 分别加到两个无菌平皿内,每皿 1ml,倾注熔化并冷却至_50.0___℃培养基于平皿中,立即旋摇平皿使其混匀,同时倾注培养基于空白平皿内 作为空白对照,待培养基凝固后,倒置平皿于__33.0____℃的培养箱内培养___5___d 后计数。
表格编号:
×××有限公司
微生物限度检查测 定 原 始 记 录 表
委托单编号:
样品名称:
收样日期:__2023_年_____月____日 测定日期:_2023_年____月____~____月____日
微生物检验原始记录(大肠菌群)

编号:
报告类别:
微生物
共页
项目:
大肠菌群coliforms
检验地点:
样品名称:
样品编号:
样品状态:
符合检验要求; 其他
环境条件:
实验依据及步骤
GB4789.3-2016
样品稀释
固体和半固体样品:称取25g样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌均质容器内均质,或放入盛有225ml稀释液的无菌均质袋中拍击式均质器拍打,制成为1:10样品匀液。依次进行10倍递增稀释。
M:微生物指标的最高安全限量值
2.例:n=5,c=2,m=1cfu/g,M=10cfu/g,即从一批产品中采集5个样品,
若5个样品的检测结果均小于或等于m值(≤1cfu/g),则这种情况是允许的;
若≤2个样品的结果(X)位于m值和M值之间(1cfu/g≤X≤10cfu/g),则这种情况也是允许的;
若有3个及以上样品的检验结果位于m和M之间,则这种情况是不允许的;
MPN检索表
(CFU/ml)
n=5 c=2 m=1
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
数据分析与结果
一、菌落计数
根据证实为大肠菌群的阳性管数,查MPN检索表,报告大肠菌群的最可能数。
二、缓冲液
1.磷酸盐缓冲液
磷酸二氢钾 34.0g 蒸馏水500ml (稀释液需要1000ml)
贮存液:将34.0g磷酸二氢钾溶于500ml蒸馏水中,用大约175ml的1mol/l氢氧化钠溶液调节ph至7.2,用蒸馏水稀释至1000ml后贮存冰箱。
28微生物限度检测原始记录
检验人:复核人:
微生物限度检测原始记录
文件编号R07-028-Ⅱ
产品名称
规格
产品批号
检验日期
试验方法
培养箱编号
培养温度
培养
时间
结果
供试品
培养
温度
观察时间
1:10
1:100
阴性对照
培养
温度
1
2
1
2
1
2
1
2
1
2
1
2
24小时
24小时
48小时
48小时
72小时
72小时
96小时
96小时
120小时
120小时
平均
结果
检验人:复核人:
微生物限度检测原始记录
文件编号R07-028-Ⅱ
产品名称
规格
产品批号
检验日期
控制菌检查:大肠埃希菌
大肠埃希菌批号:营养肉汤培养基配制批号:
阳性对照试验阳性对照试验方法同供试品的检查,对照菌加菌量为10-100cfu。
阴性对照试验取稀释液10ml照控制菌检查法检查。
试验方法
培养箱编号
培养温度
培养时间
结果
供试品
阳性对照
阴性对照
营养肉汤
编号:SB02-018-01
TTB
编号:SB02-018-01
DHL
编号:SB02-018-01
MacC
编号:SB02-018-01
细菌30-35℃,培养3天。
微生物限度检查记录

取样点
稀释度
碟号1
碟号2
平均
菌落数
总菌落数
报告
菌落数
空白
培养基
名称
标准规定
结论
供试液
玫
瑰
红
钠
培
养
基
不
得
过
25个/25cm2
阴性对照
供试液
阴性对照
供试液
阴性对照
供试液
阴性对照
供试液
阴性对照
供试液
阴性对照
检验人复核人
微生物检查记录(验证)(附页)
表-ZL00124
大肠杆菌检查培养温度(36℃±1℃)始温℃末温℃
细菌菌落数测定培养温度(30℃~35℃)始温℃末温℃
培养时间月日时分至月日时分
取样点
稀释度
碟号1
碟号2
平均
菌落数
总菌落数
报告
菌落数
空白
培养基
名称
标准规定
结论
供试液
营
养
琼
脂
培
养
基
不
得
过
100个
/25cm2
阴性对照
供试液
阴性对照
供试液
阴性对照
供试液
阴性对照
供试液
阴性对照
供试液
阴性对照
表-ZL00123霉菌菌落数测定培养温度(25℃~28℃)始温℃末温℃
取样点
BL
MUG
I
EMB
(Macc)
革兰氏染色
Lac
IMViC
结果
标准
规定
结论
供试液
不
得
检
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
微生物限度检验记录
第 1 页
共 1 页
项 目
部 门/职 务
姓 名
日 期
起 草
质量控制部
审 核
质量控制部
审 核
质量保证部
批 准
质量副总经理
颁发部门
GMP办公室
等 级
生效日期
分发部门
质量控制部
微生物限度检验记录
品名批号
检验日期年月日报告日期年月日
检验依据室温℃相对湿度%
供试品制备:供试品取样量g或ml紫外灯消毒时间:
EMB或MacC平板
TSI斜面
生化反应
血清凝集
结果:
结果:
5.大肠菌群: 6.活螨
0.1g或0.1ml
0.01g或0.01ml
0.001g或0.001ml
活螨检查
直接法□ 集螨法□ 漂浮法□ 分离法□
结果: (个∕g或ml)
结果:
检验人:复核人:
10-2
10-3
阴性对照
1
1
1
2
2
2
平均
平均
平均
结 果: cfu/g
2.霉菌、酵母菌检查:玫瑰红钠琼脂培养基批号: 培养温度: ℃ 培养箱:SPX-150B-Z生化培养箱
24小时观察结果
48小时观察结果
72小时观察结果
碟号
10-1
10-2
阴性对照
碟号
10-1
10-2
阴性对照
碟号
10-1
10-2
阴性对照
1
1
1
2
2
2
平均
平均
平均
96小时观察结果
120小时观察结果
结 果: cfu/g
碟号
10-1
10-2
阴性对照
碟号
10-1
10-2
阴性对照
1
1
2
2
平均
平均
3.大肠埃希菌 4.沙门菌
大肠埃希菌检查
供试品
阳性对照
阴性对照
沙门氏菌检查
供试品
阳性对照
阴性对照
MUG-
EMB或MacC平板
染色镜检
乳糖发酵
生化反应
SS或DHL平板
常规法 加pH7.0无菌氯化钠-蛋白胨缓冲液: ml □保温振摇法 □研钵法
1.细菌检查: 营养琼脂培养基批号: 培养温度: ℃ 培养箱:SPX-150B-Z生化培养箱
24小时观察结
10-2
10-3
阴性对照
碟号
10-1
10-2
10-3
阴性对照
碟号
10-1
