蛋白质的性质实验 ppt课件
合集下载
《蛋白质的性质实验》PPT课件

Pr+ 醋酸铅或硫酸铜 沉淀
4、生物碱试剂:
Pr+ 鞣酸或苦味酸 沉淀
观察加水
2021/4/24
23
实验注意事项
(1).在操作过程中试管不能冲向他人以防止烫伤。 (2).操作强酸时要注意,吸管使用要规范。 (3).双缩脲反应铜离子不能多加,否则与氢氧化
钠形成蓝色的氢氧化铜,干扰试验结果。 (4).实验报告各部分内容都要包括,实验结果如
实验一 蛋白质的性质实验
王伟 中国海洋大学医药学院
2021/4/24
1
实验目的
1. 加深理解所学有关的蛋白质性质的理论 知识
2. 掌握氨基酸和蛋白质常用的定性、定量 分析的方法及原理
2021/4/24
2
实验原理
一、蛋白质呈色反应 二、蛋白质沉淀反应
2021/4/24
3
一、蛋白质呈色反应
❖ 蛋白质的呈色反应是指蛋白质所含的某些氨基酸及 其特殊结构,在一定条件下可与某些试剂发生了生 成有色物质的反应。不同蛋白质分子所含的氨基酸 残基不完全相同,因此所发生的成色反应也不完全 一样。
2021/4/24
6
(二)双缩脲反应
❖ 当尿素经加热至180℃左右时,两分子尿素脱去一分 子氨,进而缩合成一分子双缩脲。其在碱性条件下 双缩脲与铜离子结合成红紫色络合物,此反应称为 双缩脲反应。
❖ 蛋白质在碱性溶液中与硫酸铜作用呈现紫红色,此 类似反应也称蛋白质的双缩脲反应。凡分子中含有 两个以上肽键的化合物都呈此反应,故所有蛋白质 都能与双缩脲试剂发生反应。
OH + HNO3
HO
HO
NO2 + NaOH
O
2021/4/24
NO2 + H2O
实验1 蛋白质性质一精选课件

精
10
4. 重金属沉淀蛋白质
取 1支试管,加入约 1ml 卵清蛋白质液,加入2% 硝 酸银溶液1 滴,观察沉淀的生成。
5. 有机酸沉淀蛋白质
取 1 支试管,加入卵清蛋白质液约 0.5ml, 然后滴加10% 三氯乙酸溶液数滴,观察沉淀的生成。
精
11
【注意事项】
1. 酒精灯加热试管时,试管口勿对人。 2. 浓硝酸滴加时小心,勿伤人及桌面。 3. 试剂用完及时盖上盖,防止挥发。 4. 观察现象时,随加随摇,及时记录。 5. 药品放回原处,清点自己物品。
蛋白质分子由于形成水化层和双电层而成为稳定 的胶体颗粒。
蛋白质
(pH > pI )
+
H2O
+
H2O
+
H2O
+
H2O
在一定的物理化学因素影响 下,蛋白质颗粒失去电荷、脱水, 甚至变性而丧失稳定因素,即以 固态形式从溶液中析出,这种作 用称为蛋白质的沉淀反应。
精
5
1. 可逆沉淀反应
在发生沉淀反应时,蛋白质虽已沉淀析出,但 其分子内部结构并未发生显著变化,基本上保持原 有的性质。沉淀因素除去后,蛋白质沉淀可再溶于 原来的溶剂中。这种沉淀反应称为可逆沉淀反应。
此反应称为双缩脲反应。
蛋白质或二肽以上的多肽分子中,含有多个与双缩脲结构
相似的肽键,因此也有双缩脲反应,可用此法鉴定蛋白质的定
性和定量。
精
3
2. 茚三酮反应
水合茚三酮
还原茚三酮
此反应用于
定性、定量 注意: 脯氨酸、 鉴定氨基酸。 羟脯氨酸与茚三
酮反应生成黄色
紫色物质
物质。
精
4
蛋白质的性质645.ppt
OH OH OH OH OH
葡萄糖分子中含有(hán yǒu)醛基,能够发生银 镜反响、与新制氢氧化铜悬浊液反响。
第十六页,共二十八页。
1.葡萄糖的特征(tèzhēng) 反响
葡萄糖与新制Cu(OH)2悬浊液反响 实验(shíyàn)步骤:在一试管中参加8-10滴10 %的NaOH溶液,滴加5%的CuSO4溶液约4滴, 再参加4滴10%的葡萄糖溶液,加热.
2、蛋白质溶液 无机轻金属盐 析出蛋白质(盐析)
加水
①强酸强碱②重金属盐③加热
3、蛋白质溶液
变性凝结
④一些有机物如:醛、醇⑤紫外线
4、蛋白质的颜色反响,多数蛋白质分子含有带苯 坏的氨基酸,所以(suǒyǐ)遇浓硝酸有黄色反响。
5、灼烧(zhuó s烧hāo焦) 羽毛味
第七页,共二十八页。
蛋白质的主要(zhǔyào)应用:
2、医院里用高温蒸煮来消毒。
3、在伤口处涂抹酒精溶液来消毒杀菌。
病毒和细菌的主要成分是蛋白质,酒精和高温蒸煮都能使构成细菌生命根底 的蛋白质变性从而失活,到达杀菌的目的。
第九页,共二十八页。
[知识(zhī shi)应用]
4、生物学中用福尔马林溶液保存生物标本。
甲醛溶液可以使蛋白质变性,有防腐的性质,可以保存动物尸体。
第三页,共二十八页。
蛋白质的性质:
盐析 2、
(yán xī)
盐析一般是指在溶液(róngyè)中参加无机盐类而使 某种物质溶解度降低而析出的过程。在乙酸的酯化反 响中参加饱和碳酸钠溶液,降低乙酸乙酯溶解度,使 其分层现象更明显的过程。 一般向蛋白质溶液中参 加某些无机盐溶液后,都可以使蛋白质凝聚而从溶液 中析出。盐析的过程可复原。
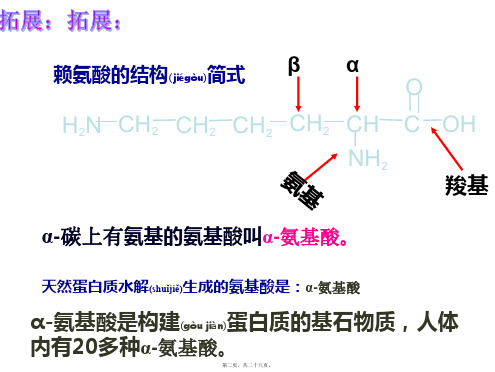
赖氨酸的结构( 简式 jiégòu)
蛋白质的理化性质PPT课件

第三章蛋白质的理化性质
蛋白质的理化性质
一、两性性质及等电点 二、胶体性质 三、变性与复性作用 四、蛋白质的沉淀作用 五、蛋白质的颜色反应 六、蛋白质的紫外吸收性质
一、蛋白质的两性解离与等电点
蛋白质分子中氨基酸残基的侧链上存在游离的 氨基和羧基,因此蛋白质与氨基酸一样具有两 性解离性质,具有特定的等电点(pI)。 溶液pH=pI时,蛋白质所带正负电荷相等; pH>pI时,蛋白质带净负电荷; pH<pI时,蛋白质带净正电荷。
2.沉淀种类:可逆与不可逆
3.沉淀方法:
沉淀后蛋白质仍能保持生物活性的沉淀方 法
沉淀后蛋白质失去生物活性的沉淀方法
四、蛋白质的沉淀作用
2.沉淀种类:可逆与不可逆 3.沉淀方法:
沉淀后蛋白质仍能保持生物活性的沉淀方 法
(1)盐析-中性盐沉淀法 (2)有机溶剂沉淀法 (3)酸沉淀法
蛋白质仍能保持生物活性的沉淀方法
等电点时特点:
(1)净电荷为零 (2)一定离子强度的缓冲液:等离子点特征常数 (3)多数蛋白质在水中等电点偏酸(较低) 碱性AA/酸性AA 胃蛋白酶 0.2 等电点 1.0
血红蛋白
细胞色素C 菊糖酶
1.7
2.9 0.34
6.7
10.7 8.2
(4)导电性、溶解度、黏度及渗透压都最小。
蛋白质分子在一定pH的溶液中可带净的负电 荷或正电荷,故可在电场中发生移动。 不同蛋白质分子所带电荷量不同,且分子大 小也不同,故在电场中的移动速度也不同,
蛋白质仍能保持生物活性的沉淀方法
(1)盐析—中性盐沉淀
常用的中性盐:硫酸铵、氯化钠、硫酸钠等。
盐析时,pH在蛋白质的等电点处效果最好。
盐析沉淀蛋白质通常不会引起蛋白质的变性。 优点 盐析应用举例
蛋白质的理化性质
一、两性性质及等电点 二、胶体性质 三、变性与复性作用 四、蛋白质的沉淀作用 五、蛋白质的颜色反应 六、蛋白质的紫外吸收性质
一、蛋白质的两性解离与等电点
蛋白质分子中氨基酸残基的侧链上存在游离的 氨基和羧基,因此蛋白质与氨基酸一样具有两 性解离性质,具有特定的等电点(pI)。 溶液pH=pI时,蛋白质所带正负电荷相等; pH>pI时,蛋白质带净负电荷; pH<pI时,蛋白质带净正电荷。
2.沉淀种类:可逆与不可逆
3.沉淀方法:
沉淀后蛋白质仍能保持生物活性的沉淀方 法
沉淀后蛋白质失去生物活性的沉淀方法
四、蛋白质的沉淀作用
2.沉淀种类:可逆与不可逆 3.沉淀方法:
沉淀后蛋白质仍能保持生物活性的沉淀方 法
(1)盐析-中性盐沉淀法 (2)有机溶剂沉淀法 (3)酸沉淀法
蛋白质仍能保持生物活性的沉淀方法
等电点时特点:
(1)净电荷为零 (2)一定离子强度的缓冲液:等离子点特征常数 (3)多数蛋白质在水中等电点偏酸(较低) 碱性AA/酸性AA 胃蛋白酶 0.2 等电点 1.0
血红蛋白
细胞色素C 菊糖酶
1.7
2.9 0.34
6.7
10.7 8.2
(4)导电性、溶解度、黏度及渗透压都最小。
蛋白质分子在一定pH的溶液中可带净的负电 荷或正电荷,故可在电场中发生移动。 不同蛋白质分子所带电荷量不同,且分子大 小也不同,故在电场中的移动速度也不同,
蛋白质仍能保持生物活性的沉淀方法
(1)盐析—中性盐沉淀
常用的中性盐:硫酸铵、氯化钠、硫酸钠等。
盐析时,pH在蛋白质的等电点处效果最好。
盐析沉淀蛋白质通常不会引起蛋白质的变性。 优点 盐析应用举例
《蛋白质的性质》PPT课件

化学性质3:水解 (结构中含有肽键)
水解原理:
H
OH
O
|
||
|
||
H—N—CH2—C——N—CH2—C—OH
HO H
注意:不同的蛋白质水解最终生成各种氨基酸,
但只有天然蛋白质水解均生成α-氨基酸
2021/4/24
18
性质4:具有两性
多肽链端的-NH2显碱性、-COOH显酸性(天然 蛋白质是α-氨基酸缩聚的产物,分子中还存在残留的 氨基和羧基,因此跟氨基酸相似,蛋白质也具有两 性)
2、二级结构:多肽链卷曲盘旋和折叠所形成的空间 结构(螺旋结构)。(氢键)
3、三级结构:是在二级结构的基础上,多肽链进一 步盘曲折叠形成三维结构。(球状结构,为亚基)
4、四级结构:亚基的立体排布、亚基间相互作用与 布局。(聚合体结构,氢键和二硫键)
2021/4/24
8
COOH
H N 20212/4/24
多肽
这样由于可以结合无数的 氨基酸分子,所以蛋白 2质021分/4/2子4 很大。
蛋白质
HO NCH2C
2
1、蛋白质主要存在哪里?
• 主要的存在于生物体内,肌肉,发,皮肤, 角蹄,酶,激素,抗体,病毒;在植物中 也很丰富,比如大豆,花生,谷物。
• 是生命的基础,没有蛋白质就没有生命。
2、组成蛋白质的主要元素有哪些?
化效率越高
D、任何结构的蛋白质遇到浓HNO3都
会变成黄色 2021/4/24
29
神奇的蛋白质——酶
❖ 酶具有高度的专一性 一种酶只催化一种反应。
❖ 高效率 催化效率是化学催化剂的1010~ 1014倍
❖ 条件温和,不需加热 人体体温37摄氏度和血液PH约为7时
《蛋白质性质试验》PPT课件

实验 蛋白质的部分性质
第一部分、蛋白质的颜色反应
一、试验原理
❖ 蛋白质分子中某种或某些集团可与显色剂作用,产生颜色。 不同的蛋白质由于所含的氨基酸不完全相同,颜色反应亦不完全 相同。颜色反应不是蛋白质的专一反应,一些非蛋白物质也可产 生同样的颜色反应,因此不能根据颜色反应的结果来决定被测物 是否为蛋白质。另外,颜色反应也可作为一些常用蛋白质定量测 定的依据。
精选PPT
9
(二)有机溶剂沉淀蛋白质
原理:某些有机溶剂(如乙醇、甲醇、丙醇等),因引 起蛋白质脱去水化层以及降低介电常数而增加带电质 点间的相互作用,致使蛋白质颗粒容易凝聚而沉淀。
操作:取一试管加蛋白液1ml,,加入晶体氯化钠少许, 待溶解后再加95%乙醇3ml,摇匀,观察现象。
精选PPT
10
(三)重金属盐与某些有机酸沉淀蛋白质
原理:植物体内具有显著生理作用的含氮碱性化合物成为生物碱。 能沉淀生物碱或与其产生颜色反应的物质称为生物碱试剂,如 鞣酸等。当溶液PH小于等电点时,蛋白质颗粒带正电荷,容易 与生物碱试剂的负离子发生反应而沉淀。
操作:
1、取少量尿素晶体放在干燥的试管中,微火加热使其熔化
成液体, 此时有氨气放出,可用湿润的试纸检验,至
液体重新结晶出现白色固体时, 停止加热,冷却。然后
加10%NaOH溶液1ml,摇匀,再加2-4滴1% 液,混匀,观察有无紫色出现。
CuSO4溶
2、取蛋白液1ml,加10%NaOH溶液1ml,摇匀,再加24滴1% CuSO4溶液,混匀,观察有无紫色出现。
精选PPT
7
二、实验仪器
1、移液管 2、吸管 3、试管 4、电炉
三、实验试剂
1、卵清蛋白液:鸡蛋清用蒸馏水稀释10-20倍,3-4层纱布过滤,滤液 放在冰箱里冷藏备用。
第一部分、蛋白质的颜色反应
一、试验原理
❖ 蛋白质分子中某种或某些集团可与显色剂作用,产生颜色。 不同的蛋白质由于所含的氨基酸不完全相同,颜色反应亦不完全 相同。颜色反应不是蛋白质的专一反应,一些非蛋白物质也可产 生同样的颜色反应,因此不能根据颜色反应的结果来决定被测物 是否为蛋白质。另外,颜色反应也可作为一些常用蛋白质定量测 定的依据。
精选PPT
9
(二)有机溶剂沉淀蛋白质
原理:某些有机溶剂(如乙醇、甲醇、丙醇等),因引 起蛋白质脱去水化层以及降低介电常数而增加带电质 点间的相互作用,致使蛋白质颗粒容易凝聚而沉淀。
操作:取一试管加蛋白液1ml,,加入晶体氯化钠少许, 待溶解后再加95%乙醇3ml,摇匀,观察现象。
精选PPT
10
(三)重金属盐与某些有机酸沉淀蛋白质
原理:植物体内具有显著生理作用的含氮碱性化合物成为生物碱。 能沉淀生物碱或与其产生颜色反应的物质称为生物碱试剂,如 鞣酸等。当溶液PH小于等电点时,蛋白质颗粒带正电荷,容易 与生物碱试剂的负离子发生反应而沉淀。
操作:
1、取少量尿素晶体放在干燥的试管中,微火加热使其熔化
成液体, 此时有氨气放出,可用湿润的试纸检验,至
液体重新结晶出现白色固体时, 停止加热,冷却。然后
加10%NaOH溶液1ml,摇匀,再加2-4滴1% 液,混匀,观察有无紫色出现。
CuSO4溶
2、取蛋白液1ml,加10%NaOH溶液1ml,摇匀,再加24滴1% CuSO4溶液,混匀,观察有无紫色出现。
精选PPT
7
二、实验仪器
1、移液管 2、吸管 3、试管 4、电炉
三、实验试剂
1、卵清蛋白液:鸡蛋清用蒸馏水稀释10-20倍,3-4层纱布过滤,滤液 放在冰箱里冷藏备用。
蛋白质的理化性质课件参考.ppt

精选课件
4
练习
• 下列哪种蛋白质在pH5.0的溶液 中带负电荷?
• A.pI为5.5的蛋白质 B.pI为4.0的蛋白质 C.pI为7.0的蛋白质 D.pI为5.0的蛋白质
精选课件
5
体内大多数蛋白质的等电点在pH5.0 左右,
因而在生理条件下以阴离子形式存在 。
精选课件
6
3.电泳
定义: 带电粒子在电场中向电性相反的电极移动的现象。
若蛋白质变性程度较轻,去除变性因素,有些
可恢复其天然构象和生物活性,称为蛋白质的复性。
精选课件
25
核糖核酸酶的变性与复性示意图
8M尿素或 β-巯基乙醇
透析
精选课件
26
(五)、变性与复性
过核 程糖
核 酸 酶 的 变 性
精选课件
27
蛋白质沉淀
概念 蛋白质从溶液中析出的现象称为沉淀。
方法 盐析法、有机溶剂的沉淀、重金属盐沉淀、
蛋白质在带电场中泳动的速度和方向与其所 带电荷的性质、数量及分子的大小、形状有关。
带电荷多,分子小的泳动速度较快;反之则泳动 较慢,从而达到分离蛋白质的目的。
血清蛋白醋酸纤维素薄膜电泳可将血清蛋白
分为清蛋白、α1球蛋白、α2球蛋白、β球蛋白
、γ球蛋白。
精选课件
7
精选课件
8
A:染色后显示的蛋白质区带 B:光密度扫描定量分析
精选课件
9
精选课件
10
精选课件
11
正常
肝硬化
精选课件
12
精选课件
13
二、蛋白质的胶体性 质
1.蛋白质有胶体性质
蛋白质是生物大分子,分子量在1万~10万 kD(千道尔顿)之间,分子直径在胶体颗粒 的范围(1—100nm)
蛋白质的理化性质ppt课件

44
蛋白质的热变性与凝固作用
2、蛋白质的凝固作用
天然蛋白质变性后,变性蛋 白质分子互相凝集或相互穿插 缠绕在一起的现象成为蛋白质 的凝固(coagulation) 。
凝固作用分两个阶段: 首先是变性; 其次失去规律性的肽链聚集缠绕在一起而凝固或结絮;
45
淀,加热后变成红色 31
六、蛋白质的颜色反应
7. 乙醛酸反应—色氨酸的特有反应
在蛋白质溶液中加入HCOCOOH,将 浓硫酸沿管壁缓慢加入,不使相混, 在液面交界处,即有紫色环形成
色氨酸的反应(吲哚环的反应) 鉴定蛋白质中是否含有色氨酸 明胶中不含色氨酸
32
六、蛋白质的颜色反应
8. 坂口反应—精氨酸特有的反应
19
蛋白质仍能保持生物活性的沉淀方法
(1)盐析—中性盐沉淀 What’s salt precipitation of protein? 盐溶作用 盐析作用
20
蛋白质仍能保持生物活性的沉淀方法
(1)盐析—中性盐沉淀
What’s salt precipitation of protein? 定义:在蛋白质溶液中加入大量中性盐,以
沉淀原理:
① 脱水作用——破坏水化膜; ② 使水的介电常数降低,蛋白质溶解度降低。
24
蛋白质仍能保持生物活性的沉淀方法
(2)有机溶剂沉淀法 处理条件: ① 低温操作;
② 沉淀完全后尽快分离;
(3)酸沉淀法 机制:破坏电荷,等电点沉淀。
25
四、蛋白质的沉淀作用
3.沉淀方法:
沉淀后蛋白质仍能保持生物活性的沉淀方法 沉淀后蛋白质失去生物活性的沉淀方法
同性电荷蛋白质分子互相排斥。
7
蛋白质颗粒的表面电荷和水化膜
蛋白质的热变性与凝固作用
2、蛋白质的凝固作用
天然蛋白质变性后,变性蛋 白质分子互相凝集或相互穿插 缠绕在一起的现象成为蛋白质 的凝固(coagulation) 。
凝固作用分两个阶段: 首先是变性; 其次失去规律性的肽链聚集缠绕在一起而凝固或结絮;
45
淀,加热后变成红色 31
六、蛋白质的颜色反应
7. 乙醛酸反应—色氨酸的特有反应
在蛋白质溶液中加入HCOCOOH,将 浓硫酸沿管壁缓慢加入,不使相混, 在液面交界处,即有紫色环形成
色氨酸的反应(吲哚环的反应) 鉴定蛋白质中是否含有色氨酸 明胶中不含色氨酸
32
六、蛋白质的颜色反应
8. 坂口反应—精氨酸特有的反应
19
蛋白质仍能保持生物活性的沉淀方法
(1)盐析—中性盐沉淀 What’s salt precipitation of protein? 盐溶作用 盐析作用
20
蛋白质仍能保持生物活性的沉淀方法
(1)盐析—中性盐沉淀
What’s salt precipitation of protein? 定义:在蛋白质溶液中加入大量中性盐,以
沉淀原理:
① 脱水作用——破坏水化膜; ② 使水的介电常数降低,蛋白质溶解度降低。
24
蛋白质仍能保持生物活性的沉淀方法
(2)有机溶剂沉淀法 处理条件: ① 低温操作;
② 沉淀完全后尽快分离;
(3)酸沉淀法 机制:破坏电荷,等电点沉淀。
25
四、蛋白质的沉淀作用
3.沉淀方法:
沉淀后蛋白质仍能保持生物活性的沉淀方法 沉淀后蛋白质失去生物活性的沉淀方法
同性电荷蛋白质分子互相排斥。
7
蛋白质颗粒的表面电荷和水化膜
化学人教版(2019)选择性必修3 4.2.2蛋白质的性质课件(共24张ppt)

虾含Cu蛋白
蛋白质的结构
➢ 蛋白质的一级结构:各种氨基酸单体的排列顺序,它是蛋白质高级结构的 基础,对蛋白质的性质和功能起着决定性作用;
蛋白质的结构
➢ 蛋白质的二级结构:肽链中的氧原子与氢原子之间存在氢键,会使肽链盘 绕或折叠成特定的空间结构;
蛋白质的结构
➢ 蛋白质的三级结构:肽链在二级结构基础上进一步盘曲折叠;
官能团 氨基 羧基 酰胺基
性质 碱性 酸性 水解反应
➢ 小结:(1) 蛋白质也是一种两性分子; (2) 在酸、碱或酶的作用下,蛋白质也可以发生水解反应!
蛋白质的性质
蛋白质的水解
蛋白质在酸、碱或酶的作用下,逐步水解成相对分子质量较小的多肽,最 终水解得到氨基酸。
蛋白质
水解 合成
多肽
水解 合成
氨基酸
【例2】蛋白质的水解:下图表示蛋白质分子结构的一部分,请指出蛋白质发 生水解时可能断裂的化学键。
(C3H7O2N)、天冬氨酸(C4H7O4N)和赖氨酸(C6H14O2N2)。1个该多肽分子完
全水解后,得到天冬氨酸分子的个数为 a-3d 。
蛋白质的性质
蛋白质的显色反应
【实验4-5】 ➢ 实验操作:向盛有2 mL鸡蛋清溶液的试管中加入5滴浓硝酸,加热; ➢ 实验现象:开始有白色沉淀,加热后沉淀变黄色; ➢ 原因:硝酸与蛋白质中的苯环发生硝化反应,生成了黄色物质; ➢ 应用:检验含苯环蛋白质的存在;
蛋白质的结构
➢ 蛋白质的四级结构:多个具有特定三级结构的多肽键通过非共价键相互作 用(如氢键等)排列组装;
蛋白质的结构
【例1】蛋白质的多级结构:蛋白质的
A
与肽键的形成有关。
A. 一级结构
B. 二级结构
《蛋白质的性质》课件

蛋白质的功能
1 催化作用
蛋白质可以作为酶催化化 学反应,加速生物体内的 代谢过程。
2 结构支撑
蛋白质可以为细胞和组织 提供结构支撑,维持生物 体的形态和稳定性。
3 传递信息
一些蛋白质可以作为信号 分子,在细胞间传递信号, 调控生物体的生理功能。
蛋白质的分类
依据结构
纤维性蛋白质、球形蛋白质、 结构转变蛋白质等
蛋白质的合成和降解
1
合成
蛋白质的合成发生在细胞内的核糖体中,通过翻译作用将mRNA编码的信息转化 为蛋白质。
2
降解
蛋白质的降解发生在溶酶体和蛋白酶体中,通过降解酶的作用将蛋白质分解为氨 基酸。
蛋白质的重要性和应用
维持生命活动
蛋白质参与细胞结构、功能调节和代谢等方面, 对生命活动至关重要。
食品工业
依据来源
动物蛋白质、植物蛋白质、微 生物蛋白质等
依据功能
运动蛋白质、酶类蛋白质、激 素蛋白质等
蛋白质的结构
一级结构
蛋白质的一级结构是指氨基酸的 线性排列顺序。
二级叠结 构。
三级结构
蛋白质的三级结构是指氨基酸残 基间的空间排列中的折叠和转向。
蛋白质在食品工业中用于增强口感、改善营养、 增加储存稳定性等。
药物研发
蛋白质作为药物靶标,与药物相互作用,参与新 药研发和治疗疾病。
环境保护
蛋白质在环境中具有重要功能,如水处理、废物 降解和污染物去除等。
《蛋白质的性质》PPT课 件
蛋白质是生命中不可或缺的基本分子,它们承担着许多重要的生物学功能。 了解蛋白质的性质对于深入理解生命过程至关重要。
蛋白质的定义
什么是蛋白质?
蛋白质是由氨基酸构成的生物大分子,是细胞中的基本组成部分,也被称为生命的“建筑块”。
蛋白质的结构和性质(课件PPT)

Байду номын сангаас
(6)颜色反应
浓硝酸
科学视野 我国现代取得的成就
1965年我国科技工 作者成功合成了具有 生物活性的——结晶 牛胰岛素。这是科学 史上的一大成就,可 以说是科学史上又一 “丰碑”。在认识生 命现象揭开生命奥秘 的伟大历程中,做出 了重要贡献。
这是我国第一头克隆羊
我是阳阳
我
的妈妈
叫
阳 阳 我是由妈妈的耳朵
蛋白质的结构和性质
世 界 第 一 只 克 隆 羊 : 多 利
蛋白质是形成生命和进行生命 活动不可缺少的基础物质。
蛋白质更是现代生命科学研 究的重点和关键。
在奶和奶的制品中
在 豆 类 、 薯 类 、 小 麦 和 谷 类 中
2、蛋白质的结构
一级结构
蛋白质分子中各种氨基酸的连接方式和排列顺序
肽键是蛋白质一级结构的基本结构键。
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
(6)颜色反应
浓硝酸
科学视野 我国现代取得的成就
1965年我国科技工 作者成功合成了具有 生物活性的——结晶 牛胰岛素。这是科学 史上的一大成就,可 以说是科学史上又一 “丰碑”。在认识生 命现象揭开生命奥秘 的伟大历程中,做出 了重要贡献。
这是我国第一头克隆羊
我是阳阳
我
的妈妈
叫
阳 阳 我是由妈妈的耳朵
蛋白质的结构和性质
世 界 第 一 只 克 隆 羊 : 多 利
蛋白质是形成生命和进行生命 活动不可缺少的基础物质。
蛋白质更是现代生命科学研 究的重点和关键。
在奶和奶的制品中
在 豆 类 、 薯 类 、 小 麦 和 谷 类 中
2、蛋白质的结构
一级结构
蛋白质分子中各种氨基酸的连接方式和排列顺序
肽键是蛋白质一级结构的基本结构键。
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
蛋白质理化性质通用课件

在离心前加入密度梯度介 质,使蛋白ห้องสมุดไป่ตู้在离心过程 中沉降到相应密度的界面 上而分离。
超速离心法
利用极高的离心力使蛋白 质颗粒沉降,可同时实现 分离和纯化。
电泳法
纸电泳法
利用滤纸作为支持物进行 电泳,适用于小分子蛋白 质的分离。
凝胶电泳法
利用凝胶作为支持物进行 电泳,根据蛋白质的电荷 和分子量实现分离。
三级结构
三级结构是指整条多肽链的空 间构象,由二级结构通过肽链 间的相互作用形成。
主要的相互作用包括疏水键、 氢键、离子键和范德华力等。
三级结构决定了蛋白质的生物 学活性和功能,对蛋白质的结 构稳定性和热稳定性具有重要 影响。
四级结构
四级结构是指蛋白质复合物的结构, 由两条或两条以上具有三级结构的肽 链通过相互作用形成。
激素等。
按来源分类
动物蛋白
主要来源于肉、蛋、奶等动物产 品,如鱼肉蛋白、乳清蛋白等。
植物蛋白
主要来源于豆类、坚果、谷物等 植物产品,如大豆蛋白、小麦蛋 白等。
按结构分类
单体蛋白
由一条多肽链组成的蛋白质,如肌红 蛋白、血红蛋白等。
复合蛋白
由多个亚基组成的蛋白质,如一些酶 、蛋白质复合物等。
04
CATALOGUE
03
CATALOGUE
蛋白质的分类
按功能分类
01
02
03
04
结构蛋白
主要参与细胞和组织的结构组 成,如胶原蛋白、角蛋白等。
催化蛋白
具有生物催化作用的蛋白质, 如各种酶。
运输蛋白
负责运输各种分子和离子的蛋 白质,如血红蛋白、铁传递蛋
白等。
激素蛋白
具有调节生物体代谢和生理功 能的蛋白质,如胰岛素、生长
超速离心法
利用极高的离心力使蛋白 质颗粒沉降,可同时实现 分离和纯化。
电泳法
纸电泳法
利用滤纸作为支持物进行 电泳,适用于小分子蛋白 质的分离。
凝胶电泳法
利用凝胶作为支持物进行 电泳,根据蛋白质的电荷 和分子量实现分离。
三级结构
三级结构是指整条多肽链的空 间构象,由二级结构通过肽链 间的相互作用形成。
主要的相互作用包括疏水键、 氢键、离子键和范德华力等。
三级结构决定了蛋白质的生物 学活性和功能,对蛋白质的结 构稳定性和热稳定性具有重要 影响。
四级结构
四级结构是指蛋白质复合物的结构, 由两条或两条以上具有三级结构的肽 链通过相互作用形成。
激素等。
按来源分类
动物蛋白
主要来源于肉、蛋、奶等动物产 品,如鱼肉蛋白、乳清蛋白等。
植物蛋白
主要来源于豆类、坚果、谷物等 植物产品,如大豆蛋白、小麦蛋 白等。
按结构分类
单体蛋白
由一条多肽链组成的蛋白质,如肌红 蛋白、血红蛋白等。
复合蛋白
由多个亚基组成的蛋白质,如一些酶 、蛋白质复合物等。
04
CATALOGUE
03
CATALOGUE
蛋白质的分类
按功能分类
01
02
03
04
结构蛋白
主要参与细胞和组织的结构组 成,如胶原蛋白、角蛋白等。
催化蛋白
具有生物催化作用的蛋白质, 如各种酶。
运输蛋白
负责运输各种分子和离子的蛋 白质,如血红蛋白、铁传递蛋
白等。
激素蛋白
具有调节生物体代谢和生理功 能的蛋白质,如胰岛素、生长
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 不同蛋白质分子所含的氨基酸残基不完全相同,
因此所发生的成色反应也不完全一样。
• 呈色反应并不是蛋白质的专一反应。因此,不能
仅仅根据呈色反应的结果为阳性就来判断被测物 质一定是蛋白质,至少要用2种以上的方法来鉴 别。
蛋白质的性质实验
(一)双缩脲反应
【实验原理】
• 当尿素经加热至180℃左右时,两分子尿素
蛋白质的性质பைடு நூலகம்验
【实验流程】
• 取试管2支,分别加入蛋白质样液及0.1%
甘氨酸溶液1ml,然后各加入茚三酮溶液 0.5ml,混匀后于沸水浴中加热数分钟,观 察颜色变化如图所示:
蛋白质的性质实验
(三)黄色反应
• 【实验原理】
在蛋白质分子中,具有芳香环的氨基酸(如 酪氨酸,色氨酸等)残基上的苯环经硝酸作 用可生成黄色的硝基化合物,在碱性条件 下生成物可转变为桔黄色的硝醌衍生物,反 应为:
其结构与双缩脲分子中的亚酰胺键相同。
因此,在碱性条件下与铜离子也能呈现出
类似于双缩脲的呈色反应。其反应过程如
下:
OO
H 2 N
H 2 N
C O+ CO
H 2 N
H 2 N
1 8 0 0 C
H 2 N N C C H 2 N +H N 3H
蛋白质的性质实验
【试剂】
1. 蛋白质溶液(鸡蛋清用蒸馏水稀释10倍, 2. 通过2-3层纱布滤去不溶物)
蛋白质的性质实验
【试剂】
1.蛋白质溶液(鸡蛋清:水=1:20) 2.考马斯亮蓝染液
蛋白质的性质实验
OH+ HNO3
HO
NO2 + H2O
HO
NO2 + 蛋N白aO质H的性质实验 O
OH N
OH
多数蛋白质分子含有带苯环的氨基酸, 所以都会发生黄色反应。苯丙氨酸不易硝 化,需加少量浓硫酸后才能够发生黄色反 应。
蛋白质的性质实验
【试剂】
1.蛋白质样液(与双缩脲反应相同) 2.浓硝酸 3. 20%NaOH 4. 0.1%石炭酸溶液
2. 0.1%的甘氨酸溶液 3. 0.01%精氨酸溶液 4. 10%NaOH溶液 5. 1%CuSO4溶液 6. 尿素结晶
蛋白质的性质实验
【实验流程】
双缩脲的制备
少许尿素结晶于干燥试管中 微火加热 尿素熔解至
硬化
停止加热 看到有白色气体 冷却
加10%氢氧化钠
溶液约1ml
震荡 加入1%硫酸铜溶液2滴 震荡 观察颜色的变化
如图所示
蛋白质的性质实验
注意:
• (1)尿素结晶不要取多,约火柴头大小。 • (2)在操作过程中试管不能冲向他人以防止
烫伤。
• (3)控制加热的时间既不能过长也不能过短。 • (4)加热时火不能太大,防止碳化。 • (5)铜离子不能多加,否则与氢氧化钠形成
蓝色的氢氧化铜,干扰试验结果。
蛋白质的性质实验
脱去一分子氨,进而缩合成一分子双缩脲。
其在碱性条件下双缩脲与铜离子结合成红
紫色络合物,此反应称为双缩脲反应。其
反应过程如下:
OO
H 2 N
H 2 N
CO+ CO
H 2 N
H 2 N
1 8 00 C
H 2 NN C C H 2 N +H N3H
蛋白质的性质实验
• 多肽及蛋白质分子结构中均含有许多肽键,
蛋白质的性质实验
【实验流程】
1. 取0.1%石炭酸溶液约1ml放在试 管内,加浓硝酸5滴(注意不要弄 到手上),水浴加热,观察结果如 右图所示:
2. 取洁净试管1支,加蛋白质样液 1ml和浓硝酸5滴,出现沉淀,加热, 不必至沸腾,沸腾比较危险,则沉 淀变成黄色,待试管冷却后,向两 管各加20%NaOH溶液使成碱性, 观察颜色变化如图所示:
蛋白质的性质实验
实验一 蛋白质的性质实验
蛋白质及氨基酸的呈色反应
蛋白质的性质实验
【实验目的】
1.加深理解所学有关的蛋白质性质的理论知 识
2.掌握氨基酸和蛋白质常用的定性、定量分 析的方法及原理
蛋白质的性质实验
一、蛋白质呈色反应
• 蛋白质的呈色反应是指蛋白质所含的某些氨基酸
及其特殊结构,在一定条件下可与某些试剂发生 了生成有色物质的反应。
(二)茚三酮反应
• 【实验原理】
在弱酸条件下(pH5-7),蛋白质或氨基酸 与茚三酮共热,可生成蓝紫色缩合物。此 反应为一切蛋白质和α—氨基酸所共有(亚氨 基酸如脯氨酸和羟脯氨酸产生黄色化合物), 含有氨基的其他化合物亦可发生此反应。
蛋白质的性质实验
【试剂】
1.蛋白质样液(与双缩脲反应相同) 2. 0.1%的甘氨酸溶液 3. 0.2%茚三酮溶液
蛋白质的性质实验
(四)考马斯亮蓝反应
• 【实验原理】
考马斯亮蓝具有红色和蓝色两种色调。在酸性溶 液中,其以游离态存在呈棕红色;当它与蛋白质 通过疏水作用结合后变成为蓝色。它染色灵敏度 高,比氨基黑高3倍。反应速度快,约在2分钟左 右时间达到平衡,在室一小时内稳定。在 0.01~1.0mg蛋白质范围内,蛋白质浓度与 A595nm值成正比。所以常用来测定蛋白质含量。
因此所发生的成色反应也不完全一样。
• 呈色反应并不是蛋白质的专一反应。因此,不能
仅仅根据呈色反应的结果为阳性就来判断被测物 质一定是蛋白质,至少要用2种以上的方法来鉴 别。
蛋白质的性质实验
(一)双缩脲反应
【实验原理】
• 当尿素经加热至180℃左右时,两分子尿素
蛋白质的性质பைடு நூலகம்验
【实验流程】
• 取试管2支,分别加入蛋白质样液及0.1%
甘氨酸溶液1ml,然后各加入茚三酮溶液 0.5ml,混匀后于沸水浴中加热数分钟,观 察颜色变化如图所示:
蛋白质的性质实验
(三)黄色反应
• 【实验原理】
在蛋白质分子中,具有芳香环的氨基酸(如 酪氨酸,色氨酸等)残基上的苯环经硝酸作 用可生成黄色的硝基化合物,在碱性条件 下生成物可转变为桔黄色的硝醌衍生物,反 应为:
其结构与双缩脲分子中的亚酰胺键相同。
因此,在碱性条件下与铜离子也能呈现出
类似于双缩脲的呈色反应。其反应过程如
下:
OO
H 2 N
H 2 N
C O+ CO
H 2 N
H 2 N
1 8 0 0 C
H 2 N N C C H 2 N +H N 3H
蛋白质的性质实验
【试剂】
1. 蛋白质溶液(鸡蛋清用蒸馏水稀释10倍, 2. 通过2-3层纱布滤去不溶物)
蛋白质的性质实验
【试剂】
1.蛋白质溶液(鸡蛋清:水=1:20) 2.考马斯亮蓝染液
蛋白质的性质实验
OH+ HNO3
HO
NO2 + H2O
HO
NO2 + 蛋N白aO质H的性质实验 O
OH N
OH
多数蛋白质分子含有带苯环的氨基酸, 所以都会发生黄色反应。苯丙氨酸不易硝 化,需加少量浓硫酸后才能够发生黄色反 应。
蛋白质的性质实验
【试剂】
1.蛋白质样液(与双缩脲反应相同) 2.浓硝酸 3. 20%NaOH 4. 0.1%石炭酸溶液
2. 0.1%的甘氨酸溶液 3. 0.01%精氨酸溶液 4. 10%NaOH溶液 5. 1%CuSO4溶液 6. 尿素结晶
蛋白质的性质实验
【实验流程】
双缩脲的制备
少许尿素结晶于干燥试管中 微火加热 尿素熔解至
硬化
停止加热 看到有白色气体 冷却
加10%氢氧化钠
溶液约1ml
震荡 加入1%硫酸铜溶液2滴 震荡 观察颜色的变化
如图所示
蛋白质的性质实验
注意:
• (1)尿素结晶不要取多,约火柴头大小。 • (2)在操作过程中试管不能冲向他人以防止
烫伤。
• (3)控制加热的时间既不能过长也不能过短。 • (4)加热时火不能太大,防止碳化。 • (5)铜离子不能多加,否则与氢氧化钠形成
蓝色的氢氧化铜,干扰试验结果。
蛋白质的性质实验
脱去一分子氨,进而缩合成一分子双缩脲。
其在碱性条件下双缩脲与铜离子结合成红
紫色络合物,此反应称为双缩脲反应。其
反应过程如下:
OO
H 2 N
H 2 N
CO+ CO
H 2 N
H 2 N
1 8 00 C
H 2 NN C C H 2 N +H N3H
蛋白质的性质实验
• 多肽及蛋白质分子结构中均含有许多肽键,
蛋白质的性质实验
【实验流程】
1. 取0.1%石炭酸溶液约1ml放在试 管内,加浓硝酸5滴(注意不要弄 到手上),水浴加热,观察结果如 右图所示:
2. 取洁净试管1支,加蛋白质样液 1ml和浓硝酸5滴,出现沉淀,加热, 不必至沸腾,沸腾比较危险,则沉 淀变成黄色,待试管冷却后,向两 管各加20%NaOH溶液使成碱性, 观察颜色变化如图所示:
蛋白质的性质实验
实验一 蛋白质的性质实验
蛋白质及氨基酸的呈色反应
蛋白质的性质实验
【实验目的】
1.加深理解所学有关的蛋白质性质的理论知 识
2.掌握氨基酸和蛋白质常用的定性、定量分 析的方法及原理
蛋白质的性质实验
一、蛋白质呈色反应
• 蛋白质的呈色反应是指蛋白质所含的某些氨基酸
及其特殊结构,在一定条件下可与某些试剂发生 了生成有色物质的反应。
(二)茚三酮反应
• 【实验原理】
在弱酸条件下(pH5-7),蛋白质或氨基酸 与茚三酮共热,可生成蓝紫色缩合物。此 反应为一切蛋白质和α—氨基酸所共有(亚氨 基酸如脯氨酸和羟脯氨酸产生黄色化合物), 含有氨基的其他化合物亦可发生此反应。
蛋白质的性质实验
【试剂】
1.蛋白质样液(与双缩脲反应相同) 2. 0.1%的甘氨酸溶液 3. 0.2%茚三酮溶液
蛋白质的性质实验
(四)考马斯亮蓝反应
• 【实验原理】
考马斯亮蓝具有红色和蓝色两种色调。在酸性溶 液中,其以游离态存在呈棕红色;当它与蛋白质 通过疏水作用结合后变成为蓝色。它染色灵敏度 高,比氨基黑高3倍。反应速度快,约在2分钟左 右时间达到平衡,在室一小时内稳定。在 0.01~1.0mg蛋白质范围内,蛋白质浓度与 A595nm值成正比。所以常用来测定蛋白质含量。
