金属相图Pb-Sn体系
金属相图

实验五 金属相图1. 摘要最早研究Pb-Sn 熔点与组成关系是在19世纪20年代,在这类体系中所发现的 最低共熔组成被误认为是PbSn 3的化合物。
直至在Gibbs 推导出相律(1973~1976年间),继1886年Lechatelier Heney L 发现能够正确测量高温的铂-铂铑热电偶以后,奠定了热分析方法的基础。
现在,一般采用自动平衡记录仪或者电位差计测量温差电势,通过测定不同金属组成的合金熔融液的步冷曲线(简单热分析方法)绘制简单低共熔体系相图。
相律:关键词:低共熔点 三相线 相区 固熔体 2. 仪器与试剂暗丝管加热电炉 1只 调压变压器 1只 硬质玻璃样品管 6只 镍铬-镍硅热电偶(铠装) 2支 单笔自动平衡记录仪(或UJ-25型电位差计) 1台 冰水浴 铅(C.P ) 锡(C.P ) 铋(C.P )(1)配制钝铅、纯锡以及含锡分别为20%、40%、61.9%、80%的样品管(各 管总量100克)(23.预习提问(1)什么叫步冷曲线,纯物和混合物的步冷曲线有何不同?(2)测定步冷曲线时应自何时开始记录数据或走纸为适宜?如何防止发生过冷现象?如有过冷发生,则相应相变点温度如何推求?(3)如何由步冷曲线绘制相图?出现固熔体的步冷曲线有何特征?(4)试述热电偶温度计的简单工作原理。
如何进行校正?(5)试述自动平衡记录仪的简单原理、使用及接线?4.操作5.数据和图象(1)文献数据最低共熔点:组成:61.9% 温度:456.9K(据H.穆拉契编著,原重工业部专家工作室译《有色冶金手册》P111)要求:所测最低共熔温度在455~459K,低共熔组成在61~63%(2)步冷曲线与金属相图(3)表格表2.5.1 体系步冷转折温度6..点评(2)器材选配与操作技能由于立式冷却保温电炉不能人为地控制样品与冷却电炉的温差,使得高温段如纯 铅的平台难以测准,甚至拐点不明显,所以在实验的改进是利用自动控温回转管式电炉(RJK 系列管式电阻炉和DRZ -4型电炉温度控制器,见装置图2.5.1),可以获得在较短时间内成功绘制较佳相图的效果。
pb—sn共晶相图相及组织组成物的量化分析

pb—sn共晶相图相及组织组成物的量化分析
晶相图是用于表示材料的相组成的一种绘图工具,主要由相名称、相比例和占总比例组成。
最常用的是Sn-Pb共晶相图。
Sn-Pb共晶相图大致由三个相组成:Sn、Pb和熔盐,代表其中的Sn和Pb的比例来自于其原子比例。
Sn-Pb共晶相图是分析熔锡锡-铅熔接设备成分的重要图表,反映了熔锡锡-铅共晶样品的组成情况。
Sn-Pb共晶相图量化分析首先要按相的位置绘制出各相的成份比例曲线,并利
用相的分割线来确定具体的成份比例。
其次,确定样品里每个元素的含量,以及由此引出的Sn和Pb的比例。
此外,要根据Sn-Pb图里按色彩分布画出熔盐晶体结构,并使用微观组织分析软件来进行微量元素的量化分析。
Sn-Pb共晶相图的量化分析主要针对热收缩材料行业使用的锡-铅熔合工艺的
熔锡锡-铅合金的分析,其精确性对熔锡锡-铅合金的制备性能有着重要意义。
此外,Sn-Pb共晶相图也可以用于传输率和电气特性测试,以及弱电性塑料仪表管材料测试。
二元合金相图

二元合金相图一、实验目的1.用热分析法测绘Pb—Sn二元金属相图。
2.了解热分析法的测量技术。
二、实验原理相图是多相(二相或二相相以上)体系处于相平衡状态时体系的某物理性质(如温度)对体系的某一自变量(如组成)作图所得的图形,途中能反映出相平衡情况(相的数目及性质等),故称为相图。
二元或多元体系的想吐常以组成为自变量,其物理性质则大多去温度。
由于相图能反映出多相平衡体系在不同自变量条件下的相平衡情况,因此,研究多相体系的性质,以及多相体系相平衡情况的演变,都要用到相图。
热分析法所观察的物理性质是被研究体系的温度。
将体系加热熔融成一均匀液相,然后让体系缓慢冷却,并每隔一定时间度体系温度一次,以所得历次温度值对时间作图,得一曲线,通常称为步冷曲线或冷却曲线。
从相图的定义可知,用热分析法测绘相图的要点如下:(1)、被测体系必须时时处于或非常接近于相平衡状态。
因此,体系冷却时,冷却速度必须足够慢,以保证上述条件近与实现。
若体系中的几个相都是固相,这条件通常非常难以实现(因固相与固相间相互转化时的相变热较小),此时测绘相图,常用其他方法(如差热分析法)。
(2)、测定时被测体系的组成值必须与原来配制样品时的组成值一致。
如果测定过程中样品各处不均匀,或样品发生氧化变质,这一要求就不能实现。
(3)、测得的温度值必须能真正反映体系在所测时间时的温度值。
因此,测温仪器的热容必须足够小,它与被测体系的热传导必须足够良好,测温探头必须深入到被测体系足够深处。
本实验测定铅、锡二元金属体系的相图,用SWKY数字控温仪,通过KWL-08可控升降温电炉来控制体系的加热和冷却速度。
三、仪器和药品1.仪器SWKY型数字控温仪一台;KWL-08型可控升降温电炉一台;样品管一只。
2.药品铅;锡。
四、实验步骤1、连接SWKY数字控温仪与KWL-08可控升降温电炉。
将KWL-08可控升降温电炉冷风量调节逆时针旋转到底,加热量调节顺时针旋转到底,接通电源,“内控”、“外控”开关置于“外控”,电源开关“开”、“关”置于“开”。
铝铜绿硅相图pb-snbi-cd

铝合金的时效举例Al-Cu合金
Al-Cu合金相图(共晶温度是548℃)
含4%Cu的Al-Cu合金,加热到550并保温一段时间后, 在水中快冷时, θ相(CuAl2)来不及析出, 合金获得过饱和的α固溶体组织, 其强度为σb=250MPa
若在室温下放置, 随着时间的延续, 强度将逐渐提高, 经4~5天后, σb可达400MPa。
含4%Cu的Al-Cu合金的自然时效曲线
(4)时效规律
(1) 时效温度越高, 强度峰值越低, 强化效果越小;
(2) 时效温度越高, 时效速度越快, 强度峰值出现所需时间越短;
(3)低温使固溶处理获得的过饱和固溶体保持相对的稳定性, 抑制时效的进行。
577是共晶温度
Al-Si合金相图。
金相实验报告——Pb-Sn二元相图测定及其组织分析

西安交通大学实验报告
课程:金相技术与材料组织显示分析实验日期:年月日专业班级:组别交报告日期:年月日姓名:学号: 报告退发:(订正、重做)同组者:教师审批签字:
实验名称:Pb-Sn二元相图测定及其组织分析
实验目的:
1.掌握用热分析法测定材料的临界点的方法;
2.学习根据临界点建立二元合金相图;
3. 自制二元合金金相样品,并分析组织;
实验概述:
相图中临界点测定方法有很多种,有热分析法、热膨胀法、电阻测定法、显微分析法、磁性测定法等等。
把熔化的合金自高温缓慢冷却,在冷却过程中每隔相等的时间进行测量,记录一次温度,由此得到某一成分下合金的冷却曲线。
金属或合金无相变发生时,温度随时间均匀的降低,一旦发生了某种转变,水平台阶或者转折点的温度就是相变开始或终了的温度。
利用热分析法测定Pb-Sn合金转变点,是通过一定数量不同合金成分步冷曲线综合得到的。
简述热分析法测定二元相图的方法:
测定一系列不同Pb-Sn合金成分下的由液体缓慢冷却至完全凝固的数据,作步冷曲线,找出转折点或者平台,即对应转变开始或者完成所对应的温度,由此,综合这一系列的温度和其所对应的成分即可作出平衡态下的相图。
实验结果分析:
合金成分是亚共晶状态,在由液态缓慢冷却时,先析出初生α相,由于合金成分离共晶点很近,初生α相的量非常少,故沿晶界非连续分布,到达共晶点温度时,剩余液相按共晶成分恒温析出至完全,最后冷却到室温,组织没有发生变化。
Pb-Sn二元相图测定及其组织分析报告

实验10 二组分合金相图班级:材料(硕)01 组长:丁斌组员:越凡门明达王光王晓宇瑛康何林温雅欣多雪俊杰实验日期:2013年5月221.1实验目的1.2①掌握用热分析法测定材料的临界点的方法;②学习根据临界点建立二元合金相图;③自制二元合金金相样品,并分析组织。
热分析法(冷却曲线法)热分析法(冷却曲线法)是绘制凝聚体系相图时常用的方法。
它是利用金属及合金在加热或冷却过程中发生相变时,潜热的释出或吸收及热容的突变,使得温度-时间关系图上出现平台或拐点,从而得到金属或合金的相转变温度。
由热分析法制相图,先做冷却曲线,然后根据冷却曲线作图。
通常的做法是先将金属或合金全部熔化。
然后让其在一定的环境中自行冷却,通过记录仪记录下温度随时间变化的曲线(步冷曲线)。
以合金样品为例,当熔融的体系均匀冷却时(1所示),如果系统不发生相变,则系统温度随时间变化是均匀的,冷却速率较快(如图中ab线段);若冷却过程中发生了相变,由于在相变过程中伴随着放热效应,所以系统的温度随时间变化的速率发生改变,系统冷却速率减慢,冷却曲线上出现转折(如图中b点)。
当熔液继续冷却到某一点时(如图中c点),此时熔液系统以低共熔混合物的固体析出。
在低共熔混合物全部凝固以前,系统温度保持不变,因此步冷曲线出现水平线段(如图中cd线段);当熔液完全凝固后,温度才迅速下降(如图中de线段)。
由此可知,对组成一定的二组分低共熔混合物系统,可根据它的冷却曲线得出有固体析出的温度和低共熔点温度。
根据一系列组成不同系统的步冷曲线的各转折点,即可画出二组分系统的相图(温度-组成图)。
不同组成熔液的冷却曲线对应的相图2所示。
测定一系列不同Pb-Sn合金成分下的由液体缓慢冷却至完全凝固的数据,作冷却曲线,找出转折点或者平台,即对应转变开始或者完成所对应的温度,由此,综合这一系列的温度和其所对应的成分即可作出平衡态下的相图。
图1 图2实验结果:金相组织分析:何林温雅欣多雪俊杰组:成分组织相理论相对量相实际相对量90%Pb-10%Sn α+βⅡα90% 87.1% β10% 12.9%最终为ɑ固溶体,其冷却到固溶度线以下,将析出二次β,通常呈粒状或小条状分布于晶界与晶。
金属相图PbSn体系课件

随着相关学科的不断发展,pbsn体系的理论研究将更加深入和完善,同时实验验证和技术优化也将不断 推进,为相关领域的研究和应用提供更可靠的技术支持。
பைடு நூலகம்
金属相图与pbsn体系的结合发展前景
金属相图与pbsn体系的结合将为材料科学和环保领域的发展提供新的思路和方法
实例三
钴与氮的反应:钴的氮化 物相图揭示了钴与氮在不 同温度和压力下的相互作 用和可能的合成路径。
04
pbsn体系在金属相图中的应用
pbsn体系在金属相图中的作用
1 2 3
描述金属材料的相变过程
pbsn体系能够详细描述金属材料在加热或冷却 过程中的相变行为,包括固-液相变、固-固相变 等。
预测材料的物理性质
pbsn体系的未来发展趋势
pbsn体系在环保领域的应用将更加广泛
随着环保意识的不断提高,pbsn体系在污水处理、废气治理等方面的应用将更加重要,为环保事业的发展提供有力 支持。
pbsn体系在生物医学领域的应用将更加深入
随着生物医学技术的不断发展,pbsn体系在药物传递、组织工程等方面的应用将更加广泛和深入,为生物医学领域 的研究提供新的思路和方法。
金属相图和pbsn体系分别在材料科学和环保领域具有广泛的应用前景,两者的结合将为相关领域的研究和应用 提供更全面和深入的支持。
金属相图与pbsn体系的结合将促进多学科交叉融合
金属相图涉及到物理、化学和材料科学等多个学科领域,而pbsn体系涉及到环境科学、化学和生物医学等多个 学科领域,两者的结合将促进多学科交叉融合,推动相关领域的发展和创新。
动力学分析
金属相图也能提供反应的动力学信 息,如反应速率常数、活化能等, 有助于优化反应条件。
铋一铅一锡三元系相图

实验五三元合金的显微组织(Microstructure of Ternary Alloys)实验学时:1 实验类型:综合前修课程名称:《材料科学导论》适用专业:材料科学与工程一、实验目的1.熟悉铋一铅一锡三元系相图和典型合金的显微组织。
2.了解三元合金的显微组织与其三元相图的关系。
二、概述三元相图可以帮助我们分析三元合金的平衡凝固过程及凝固后的显微组织。
对于铸锭和铸件,如果凝固时的冷却速率较小(如砂模铸造),也可借助相图分析其凝固过程和凝固后的显微组织。
下图为铋一铅一锡三元相图的液相面投影图的示意。
图中Bi、Pb、Sn分别代表纯组元铋、铅、锡;(Bi)、(Pb)、(Sn)分别代表以铋、铅、锡为溶剂的固溶体;(β)代表以Bi--Pb二元系中的β相为溶剂的固溶体。
为帮助了解铋一铅一锡三元相图,下面给出该三元相图各边的二元相图简图。
图中(Bi)、(Pb)、(Sn)分别代表各二元系中以铋、铅、锡为溶剂的固溶体。
由上图可知,各二元系在液态时均为无限互溶,但在固态则为有限溶解,在铅一铋二元系中还出现了中间相β。
在锡一铋二元系中,有一个共晶转变L→(Sn)+(Bi),转变温度为138.5℃。
在铅一铋二元系中有一个包晶转变和一个共晶转变,包晶转变温度为184℃,反应式为L+(Pb)→β;共晶转变温度为125℃,反应式为L→β+(Bi)。
在铅一锡二元系中,有一个共晶转变L→(Pb)+(Sn),转变温度为188℃。
各二元系中的三相平衡都要进入三元系,成为三元系中的三相平衡。
根据相律,三元系中三相平衡的自由度数等于1,因而是在一个温度范围内进行的。
当降至某一定温度时,这些三相平衡将参与四相反应。
由液相面投影图可知,在铋一铅一锡三元系中存在两个四相平衡,一是在P点发生的四相包共晶反应,反应式为L+(Pb)→β+(Sn);另一个是在E点发生的四相共晶反应,反应式为L→(Bi)+β+(Sn)。
根据相律,三元系中四相平衡的自由度数等于零,因而是一个恒温转变。
金属相图Pb-Sn体系.ppt

本实验采用热分析法绘制相图,其基本原理:
先将体系加热至熔融成一均匀液相,然后让 体系缓慢冷却,①体系内不发生相变,则温 度--时间曲线均匀改变;②体系内发生相变, 则温度--时间曲线上会出现转折点或水平段。 根据各样品的温度--时间曲线上的转折点或 水平段,就可绘制相图。
实验目的
1.用热分析法测绘Pb-Sn二元金属相图,并 掌握应用步冷曲线数据绘制二元体系相图 的基本方法; 2.了解步冷曲线及相图中各曲线所代表的 物理意义; 3.学习自动平衡记录仪的使用方法。
实验原理
相是指体系内部物理性质和化学性质完全 均匀的一部分。
相平衡是指多相体系中组分在各相中的量 不随时间而改变。
曲线③表示其组成恰为最低共 熔混合物的步冷曲线,其形状与纯 物质相似,但它的水平段是三相平 衡。
即 L=A(s)+B(s)
分析2:
相图由一个单相区和三个两相区组成: 即 ①溶液相区;
②纯A(s)和溶液共存的两相区; ③纯B(s)和溶液共存的两相区; ④纯A(s)和纯B(s)共存的两相区; 水平线段表示:A(s)、B(s)和溶液共 存的三相线;水平线段以下表示纯A(s)和 纯B(s)共存的两相区;o为低共熔点。
实验数据记录
实验日期:
;室温: ℃;气压:
KPa
锡的百 0% 分含量 (纯铅)
20%
40%
61.9%
80% 100%
(低共熔物)
(纯锡)
转折点
(t℃)
水平段
(t℃)
数据处理
1.温度换算( ℃ 2.作出Pb-Sn相图; 3.与文献值比较。
相图分析

图1-7过共晶合金组织
(二)包晶相图分析
图2-1 Pt-Ag合金相图
一、认识包晶相图
Pt-Ag、Ag-Sn、Sn-Sb合金具有包晶相图。
Pt-Ag合金相图中存在三种相:
Pt与Ag形成的液溶体L相;
Ag溶于Pt中的有限固溶体α相;
Pt溶于Ag中的有限固溶体β相。
e点为包晶点, e点成分的合金冷却到e点所对应的温度(包晶温度)时发生包晶反应L+α →β。发生包晶反应时三相共存,它们的成分确定,反应在恒温下平衡地进行。水平线ced为包晶反应线。
cf为Ag在α中的溶解度线, eg为Pt在β中的溶解度线。
1.合金I的结晶过程
合金冷却到1点温度以下时结晶出α固溶体, α相成分沿ac线变化, L相成分沿ad线变化。合金刚冷到2点温度而尚未发生包晶反应前,由c点成分的α相与d点成分的L相组成。此两相在e点温度时发生包晶反应,L相包围α相而形成β。反应结束后, L相与α相正好全部反应耗尽,形成e点成分的β固溶体。温度继续下降,从β中析出αⅡ。最后室温组织为β+αⅡ。其组成相和组织组成物的成分和质量分数可根据杠杆定律来确定。
图1-3合金II的平衡结晶过程
图1-4共晶合金组织的形态
3.合金Ⅲ的结晶过程
图1-5合金Ⅲ平衡结晶过程
合金Ⅲ是亚共晶合金,合金冷却到1点温度后,由匀晶反应生成α固溶体,叫初生α固溶体。从1点到2点温度的冷却过程中,按照杠杆定律,初生α的成分沿ac线变化,液相成分沿ad线变化;初生α逐渐增多,液相逐渐减少。当刚冷却到2点温度时,合金由c点成分的初生α相和d点成分的液相组成。然后液相进行共晶反应,但初生α相不变化。经一定时间到2点共晶反应结束时,合金转变为α+(α+β)。从共晶温度继续往下冷却,初生α中不断析出,成分由c点降至f点;共晶体形态、成分和总量保持不变。合金的室温组织为初生α+ βⅡ+ (α+β) ,合金的组成相为α和β ,它们的质量分数为:
实验六、二组分合金相图

二组分合金相图一、实验目的1.用热分析法(步冷曲线法)测绘Pb—Sn二组分金属相图。
2.了解固液相图的特点,进一步学习和巩固相律等有关知识。
3.掌握金属相图(步冷曲线)测定仪的基本原理及方法。
二、实验原理1、二组分固-液相图人们常用图形来表示体系的存在状态与组成、温度、压力等因素的关系。
以体系所含物质的组成为自变量,温度为应变量所得到的T-x图是常见的一种相图。
二组分相图已经得到广泛的研究和应用。
固-液相图多应用于冶金、化工等部门。
二组分体系的自由度与相的数目有以下关系:自由度= 组分数–相数+ 2 (1)由于一般的相变均在常压下进行,所以压力P一定,因此以上的关系式变为:自由度= 组分数–相数+ 1 (2)又因为一般物质其固、液两相的摩尔体积相差不大,所以固-液相图受外界压力的影响颇小。
这是它与气-液平衡体系的最大差别。
图1以邻-、对-硝基氯苯为例表示有最低共熔点相图的构成情况:高温区为均匀的液相,下面是三个两相共存区,至于两个互不相溶的固相A、B和液相L三相平衡共存现象则是固-液相图所特有的。
从式(2)可知,压力既已确定,在这三相共存的水平线上,自由度等于零。
3、较为简单的二组分金属相图主要有三种;(1)是液相完全互溶,凝固后,固相也能完全互溶成固熔体的系统,最典型的为Cu—Ni系统;(2)是液相完全互溶而固相完全不互溶的系统,最典型是Bi—Cd系统;(3)是液相完全互溶,而固相是部分互溶的系统,如Pb—Sn系统,本实验研究的系统就是这一种。
在低共熔温度下,Pb在固相Sn中最大溶解度为(质量百分数)。
2、热分析法(步冷曲线法)是绘制相图的基本方法之一。
热分析法是相图绘制工作中常用的一种实验方法。
按一定比例配成均匀的液相体系,让它缓慢冷却。
以体系温度对时间作图,则为步冷曲线。
曲线的转折点表征了某一温度下发生相变的信息。
由体系的组成和相变点的温度作为T-x图上的一个点,众多实验点的合理连接就成了相图上的一些相线,并构成若干相区。
铋一铅一锡三元系相图

实验五三元合金的显微组织(Microstructure of Ternary Alloys)实验学时:1 实验类型:综合前修课程名称:《材料科学导论》适用专业:材料科学与工程一、实验目的1.熟悉铋一铅一锡三元系相图和典型合金的显微组织。
2.了解三元合金的显微组织与其三元相图的关系。
二、概述三元相图可以帮助我们分析三元合金的平衡凝固过程及凝固后的显微组织。
对于铸锭和铸件,如果凝固时的冷却速率较小(如砂模铸造),也可借助相图分析其凝固过程和凝固后的显微组织。
下图为铋一铅一锡三元相图的液相面投影图的示意。
图中Bi、Pb、Sn分别代表纯组元铋、铅、锡;(Bi)、(Pb)、(Sn)分别代表以铋、铅、锡为溶剂的固溶体;(β)代表以Bi--Pb二元系中的β相为溶剂的固溶体。
为帮助了解铋一铅一锡三元相图,下面给出该三元相图各边的二元相图简图。
图中(Bi)、(Pb)、(Sn)分别代表各二元系中以铋、铅、锡为溶剂的固溶体。
由上图可知,各二元系在液态时均为无限互溶,但在固态则为有限溶解,在铅一铋二元系中还出现了中间相β。
在锡一铋二元系中,有一个共晶转变L→(Sn)+(Bi),转变温度为138.5℃。
在铅一铋二元系中有一个包晶转变和一个共晶转变,包晶转变温度为184℃,反应式为L+(Pb)→β;共晶转变温度为125℃,反应式为L→β+(Bi)。
在铅一锡二元系中,有一个共晶转变L→(Pb)+(Sn),转变温度为188℃。
各二元系中的三相平衡都要进入三元系,成为三元系中的三相平衡。
根据相律,三元系中三相平衡的自由度数等于1,因而是在一个温度范围内进行的。
当降至某一定温度时,这些三相平衡将参与四相反应。
由液相面投影图可知,在铋一铅一锡三元系中存在两个四相平衡,一是在P点发生的四相包共晶反应,反应式为L+(Pb)→β+(Sn);另一个是在E点发生的四相共晶反应,反应式为L→(Bi)+β+(Sn)。
根据相律,三元系中四相平衡的自由度数等于零,因而是一个恒温转变。
金属相图的绘制

实验一金属相图的绘制一、实验目的:1.学会用热分析法测绘Pb-Sn二组分金属相图。
2.掌握热分析法的测量技术。
二、实验原理:相图是用以研究多相体系的状态随浓度、温度、压力等变量的改变而发生变化的图形。
对于二组分体系, 体系的自由度最多等于3, 即体系的状态可以由温度、压力和组成所决定。
若将压力确定, 则体系的自由度为2, 此时的体系状态可以由温度及组成确定, 此时的相图即温度—组成图。
热分析法是绘制相图最常用的基本方法之一。
其基本原理是, 当体系缓慢而均匀地冷却时, 如果体系内不发生相变化, 则温度将随时间而均匀地改变, 当体系内有相的变化发生时, 由于相变潜热的出现, 所以, 温度—时间图上就会出现转折点(表示温度随时间的变化率发生了变化)或水平段(温度不随时间而变化)。
通常的做法是先将体系全部熔化, 然后让其在一定的环境中自行冷却, 并每隔一定的时间记录一次温度, 以温度为纵坐标, 时间为横坐标, 绘制步冷曲线。
如图, 当体系均匀冷却时, 如果体系不发生相变, 则体系的温度随时间的变化是均匀的, 冷却也较快(如图中ab线段)。
若在冷却过程中发生了相变化, 由于在相变过程中伴随有热效应, 所以体系随时间的变化速度将发生改变, 体系的冷却速度减慢, 步冷曲线出现转折点(如图中b点)。
当熔液继续冷却到某一点时(如图中c点), 由于此时熔液的组成已达到最低共熔混合物的组成, 故有最低共熔混合物析出, 在最低共熔混合物完全凝固以前, 体系温度保持不变, 因此步冷曲线出现平台(如图中cd段)。
当熔液完全凝固后, 温度才迅速下降(如图中de段)。
由此可知, 对组成一定的二组分低共熔混合物体系来说, 可以根据它的步冷曲线, 判断有固体析出时的温度和最低共熔点的温度, 如果作出一系列组成不同的体系的步冷曲线, 从中找出对应各转折点, 即能画出二组分体系的温度——组成图。
三、仪器与试剂:金属相图专用加热装置JX-3D型金属相图控制器(含热电偶)计算机及其它附件锡铅四、实验步骤:1.检查各接口连接是否正确, 然后接通电源开关。
Sn金属相图的绘制

锡的百 分含量
0%
20%
锡(g) 0 20
铅(g) 100 80
40% 61.9% 80% 100%
40 61.9 80 100 60 38.1 20 0
何时停止加热?
纯Pb、纯Sn、含锡61.9%(低共熔物) 含锡20%、含锡40%、含锡80%六个样品, 则应该加热到高处理论值约50℃左右后 停止加热。
相平衡是指多相体系中组分在各相中的量 不随时间而改变。
研究多相体系的状态如何随组成、温度、 压力等变量的改变而发生变化,并用图形 来表示体系状态的变化,这种图就叫相图。
本实验采用热分析法绘制相图,其基本原理:
先将体系加热至熔融成一均匀液相,然后让 体系缓慢冷却,①体系内不发生相变,则温 度--时间曲线均匀改变;②体系内发生相变, 则温度--时间曲线上会出现转折点或水平段。 根据各样品的温度--时间曲线上的转折点或 水平段,就可绘制相图。
0(A)
B% 100(B)
(b)二元组分凝聚系统相图
④纯A(s)和纯B(s)共存的两相区;
水平线段表示:A(s)、B(s)和溶液共存 的三相线;水平线段以下表示纯A(s)和纯 B(s)共存的两相区;o为低共熔点。
药品仪器
仪器:差热分析仪JCF—A型一台。 镊子 2把
试剂:α—氧化铝(A,R) 铅(A,R) 锡(A,R)装
177。C
239。C 337。C
。
230 C
。
246 C
20%的Sn
。
237 C
337。C
324。C
40%的Sn
。
158 C
。
240 C
80%的Sn
198。C
枝晶偏析:在晶体析出时,由于扩
SnPb相图PbSn.ppt

实验原理
相是指体系内部物理性质和化 学性质完全均匀的一部分。
相平衡是指多相体系中组分在 各相中的量不随时间而改变。
研究多相体系的状态如何随组 成、温度、压力等变量的改变而发 生变化,并用图形来表示体系状态 的变化,这种图就叫相图。
本实验采用热分析法绘制相图,其
基本原理:先将体系加热至熔融成一均 匀液相,然后让体系缓慢冷却,①体系 内不发生相变,则温度--时间曲线均匀 改变;②体系内发生相变,则温度--时 间曲线上会出现转折点或水平段。根据 各样品的温度--时间曲线上的转折点或 水平段,就可绘制相图。
曲线③表示其组成恰为最低共 熔混合物的步冷曲线,其形状与纯 物质相似,但它的水平段是三相平 衡。
即 L=A(s)+B(s)
分析2:
相图由一个单相区和三个两相区组成: 即 ①溶液相区;
②纯A(s)和溶液共存的两相区;
③纯B(s)和溶液共存的两相区;
④纯A(s)和纯B(s)共存的两相区;
水平线段表示:A(s)、B(s)和溶液共 存的三相线;水平线段以下表示纯A(s)和 纯B(s)共存的两相区;O为低共熔点。
含锡20%、含锡30%、含锡80%三个 样品,出现了转折点,并在作完水平线 段后又继续降温,表明样品已完全凝固, 即可停止测量。
实验数据记录
实验日期:
;室温: ℃;气压:
KPa
锡的百 分含量
0% (纯铅)
20%
30%
61.9%
80% 100%
(低共熔物)
(纯锡)
转折点
(t℃)
水平段
(t℃)
数据处理
药品仪器
1. EA/J2P00双笔自动平衡记录仪; 2. 电炉; 3. 镍铬—镍硅热电偶; 4. 大、小坩埚; 5. 保温瓶; 6. 坩埚钳; 7. 冰块、石墨; 8. 锡粒(AR),铅粒(AR); 9. 等等。
共晶、包晶、共析
在2点,具有E点成分的剩余液体发生共晶反应: L ⇄( + ) ,转变为共晶组织,共晶体的重量与转变 前的液相重量相等, 即QE =QL C 2 100%, Q 2 E 100%
CE CE
反应结束后,在共晶温度下、 两相的相对重量百 分比为:
2D C2 Q 100%, Q 100% CD CD
温度继续下降,将从一次
和共晶 中析出Ⅱ,从
共晶 中析出Ⅱ。其室温
组织为Ⅰ+ (+) + Ⅱ。
亚共晶合金的 结晶过程
④ 过共晶合金结晶过程 与亚共晶合金相似,不同的 是一次相为 , 二次相为Ⅱ 室温组织为Ⅰ+(+)+Ⅱ。
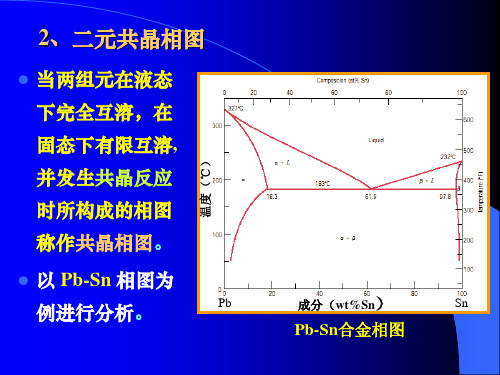
2、二元共晶相图
当两组元在液态
下完全互溶,在
固态下有限互溶, 并发生共晶反应 时所构成的相图 称作共晶相图。
以 Pb-Sn 相图为 例进行分析。
Pb 成分(wt%Sn) Sn
Pb-Sn合金相图
⑴ 相图分析
① 相:相图中有L、、 三种相, 是溶质Sn在 Pb中的固溶体, 是溶 质Pb在Sn中的固溶体。
.2
温度降到3点以下, 固溶体被Sn过饱和,由于晶格 不稳,开始析出(相变过程也称析出)新相— 相。 由已有固相析出的新固相称二次相或次生相。 形成二次相的过程称二次析出, 是固态相变的一种。
H
由 析出的二次 用Ⅱ 表示。 随温度下降, 和 相的成分分别沿CF线和DG线变 化, Ⅱ的重量增加。 室温下Ⅱ的相对重量百分比为:QⅡ
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
混合物步冷曲线如②、④所示,如②起 始温度下降很快(如a/b/段),冷却到b/点时, 开始有固体A析出,这时体系呈两相,因为 液相的成分不断改变,所以其平衡温度也不 断改变。由于凝固热的不断放出,其温度下 降较慢,曲线的斜率较小(b/c/段)。到了低 共熔点c/后,体系出现三相平衡L=A(s)+B (s),温度不再改变,步冷曲线又出现水平 段,直到液相完全凝固后,温度又开始下降。
金属相图(Pb-Sn体系)
一、实验目的 三、药品仪器 五、实验记录 二、实验原理 四、实验步骤 六、数据处理
七、结果分析与讨论 八、注意事项 九、思考题
Department of Chemistry
实验目的
⑴用热分析法测绘Pb-Sn二元金属相图, 并掌握应用步冷曲线数据绘制二元体系 相图的基本方法; ⑵了解步冷曲线及相图中各曲线所代表 的物理意义; ⑶学习并掌握热电偶的使用及校正和自 动平衡记录仪的使用方法。
纯Pb、纯Sn、含锡61.9%三个样品,在 作完水平线段后又继续降温,表明样品已 完全凝固,即可停止测量。 含锡20%、含锡30%、含锡80%三个样 品,出现了转折点,并在作完水平线段后 又继续降温,表明样品已完全凝固,即可 停止测量。
Department of Chemistry
实验数据记录
实验日期: ;室温: ℃;气压: kPa
锡的百 分含量
0% (纯铅)
20%
61.9% 30% 80% (低共熔物)
100% (纯锡)
转折点 (t℃) 水平段 (t℃)
Department of Chemistry
数据处理
1.温度换算(℃ K); 2.作出Pb-Sn相图; 3.与文献值比较。
Department of Chemistry
T/K
Department of Chemistry
药品仪器
1. 2. 3. 4. 5. 6. 金属相图实验炉 ; 镍铬—镍硅热电偶; 邻苯二甲酸酐(AR); 石墨; 锡粉(AR),铅粉(AR); 等等。
Department of Chemistry
实验步骤
准备样品 (按比例) 取出样品、放 入新样品测试 加石墨覆盖 加热 观察降温情况 及时停止实验 观察升温情况 及时停止加热 温度到最 高点搅拌
Department of Chemistry
曲线③表示其组成恰为最低共熔 混合物的步冷曲线,其形状与纯物质 相似,但它的水平段是三相平衡。 即 L=A(s)+B(s)
Department of Chemistry
分析2:
相图由一个单相区和三个两相区组 成:即 ①溶液相区; ②纯A(s)和溶液共存的两相区; ③纯B(s)和溶液共存的两相区; ④纯A(s)和纯B(s)共存的两相区; 水平线段表示:A(s)、B(s)和溶液共 存的三相线;水平线段以下表示纯A(s)和 纯B(s)共存的两相区;O为低共熔点。
A
b/
B
A
L
L+A(s) L+B(s) O A(s)+B(s)
c/
时间
(a)步冷曲线
0(A)
B%
100(B)
(b)二元组分凝聚系统相图
热分析法绘制相图
Department of Chemistry
分析1:
纯物质的步冷曲线如①、⑤ 所示,如①从高温冷却,开始降温 很快,ab线的斜率决定于体系的散 热程度,冷到A的熔点时,固体A 开始析出,体系出现两相平衡(液 相和固相A),此时温度维持不变, 步冷曲线出现水平段,直到其中液 相全部消失,温度才下降。
Department of Chemistry
何时停止加热?
纯Pb、纯Sn、含锡61.9%(低共 熔物)三个样品,如果出现转折点, 则停止加热。 含锡20%、含锡30%、含锡80%三个 样品,如果出现转折点,再升高50 ℃ 后,则停止加热。
Department of Chemistry
何时停止实验?
Department of Chemistry
实验原理
相是指体系内部物理性质和化 学性质完全均匀的一部分。 相平衡是指多相体系中组分 在各相中的量不随时间而改变。 研究多相体系的状态如何随 组成、温度、压力等变量的改变而 发生变化,并用图形来表示体系状 态的变化,这种图就叫相图。
Department of Chemistry
本实验采用热分析法绘制相图, 其基本原理:先将体系加热至熔融成一 均匀液相,然后让体系缓慢冷却,①体 系内不发生相变,则温度--时间曲线均 匀改变;②体系内发生相变,则温度-时间曲线上会出现转折点或水平段。根 据各样品的温度--时间曲线上的转折点 或水平段,就可绘制相图。
Department of Chemistry
Department of Chemistry
准备样品:
按以下比例配制
锡的百 分பைடு நூலகம்量
0%
20%
30%
61.9%
80%
100%
锡(g) 铅(g)
0 100
20 80
30 70
61.9 38.1
80 20
100 0
Department of Chemistry
样品加热:
在样品表面覆盖少许石墨,插 好热电偶,插上电炉插头,开始加热。
温度--时间曲线,即步冷曲线
Department of Chemistry
转折点:
表示温度随时间的变化率 发生了变化。
Department of Chemistry
水平段:
表示在水平段内,温度 不随时间而变化。
Department of Chemistry
③④ 温 ①a② a/ 度 b
⑤
B
温 度
600K
L(单相区)
L+Pb(s) 454K Pb(s)+Sn(s) L+Sn(s)
505K
0(Pb)
61.9%
100%(Sn)
Pb—Sn 金属相图
Department of Chemistry
文献值:
Pb-Sn体系的熔点对照表:
锡%
0
20
40
60
80
100
熔点温度℃
最低共熔点温度℃
327 276 240 190 200 232
181 181 181 181
最低共熔混合物组成: 含Sn63%
Department of Chemistry
两种金属的 任何一种都能微 T/K 溶于另一种金属 600K 中,是一个部分 互溶的低共熔体 L(单相区) 系,它用一般的 505K 热分析法只能得 L+Pb(s) α 到一个相当于简 L+Sn(s) 454K β 单的二元低共熔 Pb(s)+Sn(s) 点相图(如本实 验Pb-Sn体系), 0(Pb) 61.9% 100%(Sn) 测不出来固态晶 形转变点。 真实的Pb—Sn 金属相图
