各类有机物的一般通式及分子式的通式归纳如下
高中化学各类有机物的通式

高中化学各类有机物的通式各类有机物的通式、及主要化学性质烷烃CnH2n+2 仅含C—C键与卤素等发生取代反应、热分解、不与高锰酸钾、溴水、强酸强碱反应烯烃CnH2n 含C==C键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应、加聚反应炔烃CnH2n-2 含C≡C键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应苯(芳香烃)CnH2n-6与卤素等发生取代反应、与氢气等发生加成反应(甲苯、乙苯等苯的同系物可以与高锰酸钾发生氧化反应)卤代烃:CnH2n+1X 醇:CnH2n+1OH或CnH2n+2O 苯酚:遇到FeCl3溶液显紫色醛:CnH2nO 羧酸:CnH2nO2 酯:CnH2nO2 有机反应类型:取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
加成反应:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合的反应。
聚合反应:一种单体通过不饱和键相互加成而形成高分子化合物的反应。
加聚反应:一种或多种单体通过不饱和键相互加成而形成高分子化合物的反应。
消去反应:从一个分子脱去一个小分子(如水.卤化氢),因而生成不饱和化合物的反应。
氧化反应:有机物得氧或去氢的反应。
还原反应:有机物加氢或去氧的反应。
酯化反应:醇和酸起作用生成酯和水的反应。
水解反应:化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、糖等)CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
有机化学物 化学式

有机化学物化学式:甲烷:CH4甲烷氧化反应:CH4 + 2O2——点燃——CO2 +2H2O甲烷取代反应:CH4+Cl2----光---CH3Cl+HCl (无色气体)CH3Cl+Cl2----光----CH2Cl2+HCl (难溶于水的无色液体)CH2Cl2+Cl2----光----CHCl3+HCl (氯仿,有机溶剂)CHCl3+Cl2----光----CCl4+HCl (四氯化碳,有机溶剂)烷烃通式:CnH2n+2烷烃CnH2n+2燃烧通式:CnH2n+2---点燃---nCO2+(n+1)H2O 乙烯:C2H4乙烯氧化:CH2=CH2+3 O2---点燃--- 2CO2+H2O乙烯的加成反应:和氢气反应:C2H4+H2=C2H6和氯气反应:C2H4+Cl2=CH2ClCH2Cl和氯化氢反应:C2H4+HCl=CH2ClCH3和水反应:C2H4+H2O=CH3CH2OH使溴的四氯化碳溶液褪色:CH2=CH2 + Br2 → CH2Br-CH2Br烯烃通式:CnH2n烃CnH2n完全燃烧通式:CnHm+(n+m/4)O2---点燃---nCO2+(m/2)H2O苯:C6H6苯燃烧:2C6H6+15O2---点燃---12CO2+6H2O(在空气中剧烈燃烧,燃烧时产生橙黄色火焰,并有大量黑烟)乙醇:C2H6O或C2H5OH(-OH 羟基)乙醇燃烧:C2H60+3O2---点燃---2CO2+2H2O乙醇跟金属钠反应:2CH3CH2OH+2Na----2CH3CH2Na+H2↑乙醇在铜或银做催化剂的条件下,可以与空气中的氧气氧化为乙醛:铜或银2CH3CH2OH+O2-----------------2CH3CHO+2H2O加热乙醇还可以与酸性高锰酸钾溶液或重铬酸钾(K2Gr2O7)溶液反应被直接氧化成乙酸。
乙酸:分子式(C2H4O2,结构简式为CH3COOH,乙酸的官能团为:(—COOH)羧基。
有机物总结
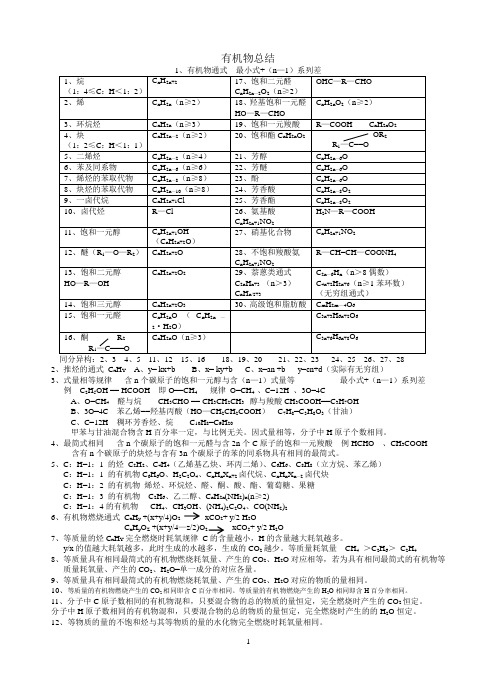
有机物总结2、推烃的通式C x H Y A、y= kx+b B、x= ky+b C、x=an +b y=cn+d(实际有无穷组)3、式量相等规律含n个碳原子的饱和一元醇与含(n—1)式量等最小式+(n—1)系列差例C2H5OH == HCOOH 即O==CH4 规律O=CH4 、C=12H 、3O=4CA、O=CH4醛与烷CH3CHO == CH3CH2CH3 醇与羧酸CH3COOH==C3H7OHB、3O=4C 苯乙烯==羟基丙酸(HO—CH2CH2COOH)C7H8=C3H8O3(甘油)C、C=12H 稠环芳香烃、烷C10H8=C9H20甲苯与甘油混合物含H百分率一定,与比例无关。
因式量相等,分子中H原子个数相同。
4、最简式相同含n个碳原子的饱和一元醛与含2n个C原子的饱和一元羧酸例HCHO 、CH3COOH含有n个碳原子的炔烃与含有3n个碳原子的苯的同系物具有相同的最简式。
5、C:H=1:1 的烃C2H2、C4H4(乙烯基乙炔、环丙二烯)、C6H6、C8H8(立方烷、苯乙烯)C:H=1:1 的有机物C6H6O、H2C2O4、C n H n X n+2卤代烷、C n H n X n—2卤代炔C:H=1:2 的有机物烯烃、环烷烃、醛、酮、酸、酯、葡萄糖、果糖C:H=1:3 的有机物C2H6、乙二醇、C n H2n(NH2)n(n≥2)C:H=1:4的有机物CH4、CH3OH、(NH4)2C2O4、CO(NH2)26、有机物燃烧通式C x H y +(x+y/4)O2 xCO2+ y/2 H2OC x H y O Z +(x+y/4—z/2)O2 xCO2+ y/2 H2O7、等质量的烃C x H Y完全燃烧时耗氧规律C的含量越小,H的含量越大耗氧越多。
y/x的值越大耗氧越多,此时生成的水越多,生成的CO2越少。
等质量耗氧量CH4>C2H6>C2H48、等质量具有相同最简式的有机物燃烧耗氧量、产生的CO2、H2O对应相等,若为具有相同最简式的有机物等质量耗氧量、产生的CO2、H2O=单一成分的对应各量。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸170℃2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
高中化学有机物的官能团、反应类型及燃烧通式

高中化学有机物的官能团、反应类型及燃烧通式1.碳碳双键:CC 2.碳碳叁键:C C3.卤(氟、氯、溴、碘)原子:—X 4.(醇、酚)羟基:—OH5.醛基:—CHO 6.羧基:—COOH 7.酯类的基团:二十六、各类有机物的通式、及主要化学性质烷烃C n H 2n+2 仅含C —C 键与卤素等发生取代反应、热分解、不与高锰酸钾、溴水、强酸强碱反应烯烃C n H 2n 含C==C 键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应、加聚反应炔烃C n H 2n-2含C ≡C 键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应苯(芳香烃)C n H 2n-6与卤素等发生取代反应、与氢气等发生加成反应(甲苯、乙苯等苯的同系物可以与高锰酸钾发生氧化反应)卤代烃:C n H 2n+1X 醇:C n H 2n+1OH 或C n H 2n+2O 苯酚:遇到FeCl 3溶液显紫色醛:C n H 2n O羧酸:C n H 2n O 2酯:C n H 2n O 2二十七、有机反应类型:取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
加成反应:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合的反应。
聚合反应:一种单体通过不饱和键相互加成而形成高分子化合物的O O C反应。
加聚反应:一种或多种单体通过不饱和键相互加成而形成高分子化合物的反应。
消去反应:从一个分子脱去一个小分子(如水.卤化氢),因而生成不饱和化合物的反应。
氧化反应:有机物得氧或去氢的反应。
还原反应:有机物加氢或去氧的反应。
酯化反应:醇和酸起作用生成酯和水的反应。
水解反应:化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、糖等)二十八、有机物燃烧通式烃: C x H y +(x +4y )O 2x CO 2+2y H 2O 烃的含氧衍生物: C x H y O z +(x +4y-2z )O 2x CO 2+2yH 2O。
高中有机化学方程式总结

高中有机化学方程式总结一、烃1. 烷烃—通式:C n H 2n-2(1)氧化反应①甲烷的燃烧:CH 4+2O 2CO 2+2H 2O②甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2CCl 4+HCl (3)分解反应CH 4C+2H 22. 烯烃—通式:C n H 2n 乙烯的制取:CH 3CH 2OHH 2C=CH 2↑+H 2O(1)氧化反应①乙烯的燃烧:H 2C=CH 2+3O 22CO 2+2H 2O②乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2CH 3CH 3与氯化氢加成:H 2C=CH 2+HClCH 3CH 2Cl与水加成:H 2C=CH 2+H 2OCH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH 2 n3. 炔烃—通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HCCH ↑+Ca(OH)2(1)氧化反应①乙炔的燃烧:HC CH+5O 24CO 2+2H 2O②乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HCCH+Br 2HC=CH Br CHBr=CHBr+Br2CHBr 2—CHBr 2 与氢气加成:HC CH+H 2H 2C=CH 2与氯化氢加成:HC CH+HClCH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:nCH 2=CHCln乙炔加聚,得到聚乙炔:n HC CH n点燃光光光光浓硫酸170℃点燃催化剂△催化剂加热加压催化剂CH 2-CH 2图1 乙烯的制取点燃图2 乙炔的制取催化剂△催化剂△BrCH 2—CH催化剂Cl催化剂CH=CH催化剂△高温溴的CCl 4可用于鉴别烯烃和烷烃,也可用于除去烷烃中混有的烯烃。
常见有机物化学式

常见有机物化学式有机化学是关于碳基化合物的化学科学,常见有机物可以通过化学式来表示其分子结构。
下面将介绍几种常见有机物及其化学式。
1. 甲烷(CH4)甲烷是最简单的有机化合物,也是天然气的主要成分之一。
其化学式为CH4,由一个碳原子与四个氢原子组成。
甲烷是一种无色、无味的气体,主要用作燃料和化工原料。
2. 乙醇(C2H5OH)乙醇是一种常见的醇类有机物,也称为酒精。
其化学式为C2H5OH,由两个碳原子、六个氢原子和一个氧原子组成。
乙醇是一种透明、无色的液体,在医药、化妆品和溶剂等方面有广泛的应用。
3. 甲醛(CH2O)甲醛是一种有机化合物,也是最简单的醛类化合物。
其化学式为CH2O,由一个碳原子、两个氢原子和一个氧原子组成。
甲醛是一种无色气体或液体,在工业中常用作防腐剂、消毒剂和纺织品整理剂。
4. 乙酸(CH3COOH)乙酸是一种酸性有机化合物,常见的有机酸之一。
其化学式为CH3COOH,由两个碳原子、四个氢原子和两个氧原子组成。
乙酸呈无色液体,在制药、化妆品和食品行业有广泛的应用。
5. 苯(C6H6)苯是一种芳香烃类有机化合物,由六个碳原子和六个氢原子组成。
其化学式为C6H6,苯是一种无色、有刺激性气味的液体,广泛用于制造塑料、橡胶和染料等工业领域。
6. 丙酮(C3H6O)丙酮是一种酮类有机化合物,其化学式为C3H6O,由三个碳原子、六个氢原子和一个氧原子组成。
丙酮是一种无色液体,在溶剂、化妆品和药物制剂等方面有广泛的应用。
7. 乙烯(C2H4)乙烯是一种烯烃类有机化合物,也称为乙烯烃。
其化学式为C2H4,由两个碳原子和四个氢原子组成。
乙烯是一种无色气体,是合成塑料和橡胶的重要原料。
以上是几种常见的有机物及其化学式,我们可以通过化学式来了解有机物的分子结构和化学性质。
有机化学在医药、化工、农业等领域有广泛的应用,对人类的生活产生了巨大影响。
高中有机化学的知识点归纳

高中有机化学的知识点归纳高中有机化学必备的知识点归纳高中的有机化学由于其种类繁多、结构复杂、与生产生活联系紧密,使之成为高中化学的难点,同时也是考试的热门考点。
下面是店铺为大家整理的高中化学重要的知识点,希望对大家有用!高中有机化学的知识点归纳篇1有机物的结构与性质1、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A)官能团:无;通式:CnH2n+2;代表物:CH4B)结构特点:键角为109°28′,空间正四面体分子。
烷烃分子中的每个C原子的四个价键也都如此。
C)化学性质:(2)烯烃:A)官能团:;通式:CnH2n(n≥2);代表物:H2C=CH2B)结构特点:键角为120°。
双键碳原子与其所连接的四个原子共平面。
C)化学性质:(3)炔烃:A)官能团:—C≡C—;通式:CnH2n—2(n≥2);代表物:HC≡CHB)结构特点:碳碳叁键与单键间的键角为180°。
两个叁键碳原子与其所连接的两个原子在同一条直线上。
C)化学性质:(略)(4)苯及苯的同系物:A)通式:CnH2n—6(n≥6);代表物:B)结构特点:苯分子中键角为120°,平面正六边形结构,6个C 原子和6个H原子共平面。
C)化学性质:①取代反应(与液溴、HNO3、H2SO4等)(5)醇类:A)官能团:—OH(醇羟基);代表物:CH3CH2OH、HOCH2CH2OHB)结构特点:羟基取代链烃分子(或脂环烃分子、苯环侧链上)的氢原子而得到的产物。
结构与相应的烃类似。
C)化学性质:(与官能团直接相连的碳原子称为α碳原子,与α碳原子相邻的碳原子称为β碳原子,依次类推。
与α碳原子、β碳原子、……相连的氢原子分别称为α氢原子、β氢原子、……)④酯化反应(跟羧酸或含氧无机酸)(6)醛酮B)结构特点:醛基或羰基碳原子伸出的各键所成键角为120°,该碳原子跟其相连接的各原子在同一平面上。
普通化学公式集(超全)(二)

普通化学公式集(超全)(二)引言概述:本文是关于普通化学公式集的第二部分,为读者提供了超全的普通化学公式集。
化学公式是化学中最为基础且重要的概念之一,通过公式能够表达化学物质的组成和结构。
本文将详细介绍普通化学公式,包括有机化合物、无机化合物和一些常见的离子,以及它们的命名规则和常见的反应类型。
正文:一、有机化合物的公式1. 烃类化合物a. 烷烃的一般分子式为CnH(2n+2),如甲烷的分子式为CH4;b. 烯烃的一般分子式为CnH2n,如乙烯的分子式为C2H4;c. 炔烃的一般分子式为CnH2n-2,如乙炔的分子式为C2H2。
2. 醇和酚的公式a. 醇的一般分子式为CnH2n+1OH,如乙醇的分子式为C2H5OH;b. 酚的一般分子式为C6H5OH。
3. 醛和酮的公式a. 醛的一般分子式为RCHO,如乙醛的分子式为CH3CHO;b. 酮的一般分子式为RCOR',如丙酮的分子式为(CH3)2CO。
4. 羧酸和酯的公式a. 羧酸的一般分子式为RCOOH,如乙酸的分子式为CH3COOH;b. 酯的一般分子式为RCOOR',如乙酸乙酯的分子式为CH3COOC2H5。
5. 脂肪族化合物的公式a. 脂肪酸的一般分子式为CnH2n+1COOH,如油酸的分子式为C18H30O2;b. 甘油的分子式为C3H8O3。
二、无机化合物的公式1. 水和氧化物的公式a. 水的分子式为H2O;b. 硫化物的一般分子式为M2S,如硫化钠的分子式为Na2S。
2. 盐类和氧化物的公式a. 盐的一般分子式为MCl,如氯化钠的分子式为NaCl;b. 氧化物的一般分子式为MO,如氧化钠的分子式为Na2O。
3. 硫酸盐和亚硫酸盐的公式a. 硫酸盐的一般分子式为M2SO4,如硫酸钠的分子式为Na2SO4;b. 亚硫酸盐的一般分子式为M2SO3,如亚硫酸钠的分子式为Na2SO3。
4. 硬水的成分和公式a. 以钙离子和镁离子为主要成分,分别由Ca2+和Mg2+表示。
各类有机物的一般通式及分子式的通式归纳如下
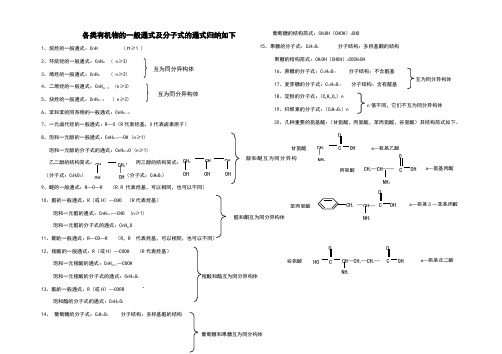
各类有机物的一般通式及分子式的通式归纳如下1、烷烃的一般通式:CnH ( ≥1 )2、环烷烃的一般通式:CnH 2n ( n ≥3)3、烯烃的一般通式:CnH 2n ( n≥2)4、二烯烃的一般通式:CnH 2n -2 (n ≥3)5、炔烃的一般通式:CnH 2n -2 ( n ≥2)6、苯和苯的同系物的一般通式:CnH 2n -67、一元卤代烃的一般通式:R —X (R 代表烃基,X 代表卤素原子) 8、饱和一元醇的一般通式:CnH 2n+1—OH (n ≥1) 饱和一元醇的分子式的通式:CnH 2n+2O (n ≥1)乙二醇的结构简式: , 丙三醇的结构简式: (分子式:C 2H 6O 2) (分子式:C 3H 8O 3)9、醚的一般通式:R —O —R (R,R 代表烃基,可以相同,也可以不同) 10、醛的一般通式:R (或H )—CHO (R 代表烃基)饱和一元醛的通式:CnH 2n+1—CHO (n ≥1) 饱和一元醛的分子式的通式:CnH 2n O11、酮的一般通式:R —CO —R (R ,R代表烃基,可以相同,也可以不同) 12、羧酸的一般通式:R (或H )—COOH (R代表烃基)饱和一元羧酸的通式:CnH 2n+1—COOH 饱和一元羧酸的分子式的通式:CnH 2n O 2 13、酯的一般通式:R (或H )—COOR饱和酯的分子式的通式:CnH 2n O 214、 葡萄糖的分子式:C 6H 12O 6 分子结构:多羟基醛的结构葡萄糖的结构简式:CH 2OH (CHOH )4CHO15、果糖的分子式:C 6H 12O 6 分子结构:多羟基酮的结构果糖的结构简式:CH 2OH (CHOH )3COCH 2OH16、蔗糖的分子式:C 12H 22O 11分子结构:不含醛基 17、麦芽糖的分子式:C 12H 22O 11 分子结构:含有醛基18、淀粉的分子式:(C 6H 10O 5)n 19、纤维素的分子式:(C 6H 10O 5)n20、几种重要的氨基酸:(甘氨酸,丙氨酸,苯丙氨酸,谷氨酸)其结构简式如下。
有机物化学方程式

+HO—SO3H +H2O
(苯磺酸)
(3)加成反应
(环己烷)
苯还可以和氯气在紫外光照射下发生加成反应,生成C6H6Cl6(剧毒农药)。
5.甲苯
(1)氧化反应
甲苯的燃烧:C7H8+9O27CO2+4H2O
甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
(2)取代反应
甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),
烷烃通式:CnH2n+2
(1)氧化反应
甲烷的燃烧:CH4+2O2CO2+2H2O
甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应
一氯甲烷:CH4+Cl2CH3Cl+HCl
二氯甲烷:CH3Cl+Cl2CH2Cl2+HCl
三氯甲烷:CH2Cl2+Cl2CHCl3+HCl(CHCl3又叫氯仿)
四氯化碳:CHCl3+Cl2CCl4+HCl
是一种淡黄色晶体,不溶于水。它是一种烈性炸药,广泛用于国防、开矿等。
注意:甲苯在光照条件下发生侧链的取代,而在催化剂条件下发生苯环上的取代。
(3)加成反应
(甲基环己烷)
6.溴乙烷
纯净的溴乙烷是无色液体,沸点38.4℃,密度比水大。
(1)取代反应
溴乙烷的水解:C2H5—Br+NaOHC2H5—OH+NaBr
苯酚是无色晶体,露置在空气中会因氧化显粉红色。苯酚具有特殊的气味,熔点
43℃,水中溶解度不大,易溶于有机溶剂。苯酚有毒,是一种重要的化工原料。
(1)苯酚的酸性
(苯酚钠)
2
烷烃结构通式

烷烃结构通式
烷烃是一类碳氢化合物,其分子由碳和氢原子组成,且没有双键或环状结构。
烷烃的通式可以表示为CₙH₂ₙ₊₂,其中n 表示烷烃分子中碳原子的数量。
例如,甲烷(一种最简单的烷烃)的通式为CH₄,乙烷的通式为C₂H₆,丙烷的通式为C₃H₈,依此类推。
以下是一些常见的烷烃的通式示例:
-丁烷:C₄H₁₀
-戊烷:C₅H₁₂
-己烷:C₆H₁₄
-庚烷:C₇H₁₆
-辛烷:C₈H₁₈
通式表示了烷烃分子中碳原子和氢原子的相对数量关系,因此可以根据通式推断烷烃的化学式。
需要注意的是,烷烃可以存在不同的同分异构体,它们具有相同的通式但分子结构不同。
各类有机物的一般通式及分子式的通式归纳如下
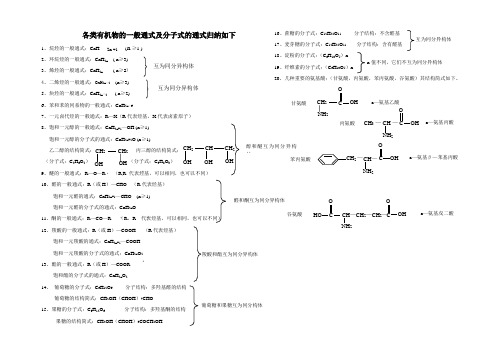
1、烷烃的一般通式:CnH(≥1 )
2、环烷烃的一般通式:CnH2n( n≥3)
3、烯烃的一般通式:CnH2n( n≥2)
4、二烯烃的一般通式:CnH2n-2(n≥3)
5、炔烃的一般通式:CnH2n-2( n≥2)
6、苯和苯的同系物的一般通式:CnH2n-6
10、醛的一般通式:R(或H)—CHO(R代表烃基)
饱和一元醛的通式:CnH2n+1—CHO (n≥1)
饱和一元醛的分子式的通式:CnH2nO
11、酮的一般通式:R—CO—R(R,R代表烃基,可以相同,也可以不同)
12、羧酸的一般通式:R(或H)—COOH(R代表烃基)
饱和一元羧酸的通式:CnH2n+1—COOH
7、一元卤代烃的一般通式:R—X(R代表烃基,X代表卤素原子)
8、饱和一元醇的一般通式:CnH2n+1—OH (n≥1)
饱和一元醇的分子式的通式:CnH2n+2O (n≥1)
乙二醇的结构简式:,丙三醇的结ห้องสมุดไป่ตู้简式:
(分子式:C2H6O2)(分子式:C3H8O3)
9、醚的一般通式:R—O—R(R,R代表烃基,可以相同,也可以不同)
饱和一元羧酸的分子式的通式:CnH2nO2
13、酯的一般通式:R(或H)—COOR
饱和酯的分子式的通式:CnH2nO2
14、葡萄糖的分子式:C6H12O6分子结构:多羟基醛的结构
葡萄糖的结构简式:CH2OH(CHOH)4CHO
15、果糖的分子式:C6H12O6分子结构:多羟基酮的结构
果糖的结构简式:CH2OH(CHOH)3COCH2OH
16、蔗糖的分子式:C12H22O11分子结构:不含醛基
有机化学知识点归纳(全)

催化剂加热、加压有机化学知识点归纳一、有机物的结构与性质1、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
烷烃分子中的每个C 原子的四个价键也都如此。
C) 物理性质:1.常温下,它们的状态由气态、液态到固态,且无论是气体还是液体,均为无色。
一般地,C1~C4气态,C5~C16液态,C17以上固态。
2.它们的熔沸点由低到高。
3.烷烃的密度由小到大,但都小于1g/cm^3,即都小于水的密度。
4.烷烃都不溶于水,易溶于有机溶剂 D) 化学性质:①取代反应(与卤素单质、在光照条件下) , ,……。
②燃烧 ③热裂解C 16H 34 C 8H 18 + C 8H 16④烃类燃烧通式:O H 2CO O )4(H C 222y x y x t x +++−−−−→−点燃⑤烃的含氧衍生物燃烧通式: O H 2CO O )24(O H C 222y x z y x z y x +-++−−−−→−点燃E) 实验室制法:甲烷:3423CH COONa NaOH CH Na CO +→↑+注:1.醋酸钠:碱石灰=1:3 2.固固加热 3.无水(不能用NaAc 晶体) 4.CaO :吸水、稀释NaOH 、不是催化剂CH 4 + Cl 2CH 3Cl + HCl 光CH 3Cl + Cl 2CH 2Cl 2 + HCl 光CH 4 + 2O 2CO 2 + 2H 2O 点燃CH 4C + 2H 2高温 隔绝空气原子:—X原子团(基):—OH 、—CHO (醛基)、—COOH (羧基)、C 6H 5— 等化学键: 、—C ≡C — C=C 官能团CaO△催化剂(2)烯烃:A)官能团:;通式:C n H 2n (n ≥2);代表物:H 2C=CH 2 B) 结构特点:键角为120°。
有机物的结构简式

78
二苯甲烷
C12H12
、CH2C6H52
79
萘
C10H8
80
—甲萘
C11H10
81
—甲萘
C11H10
82
1,6—二甲萘
C12H12
83
1,5—二甲萘
C12H12
84
—乙萘
C12H12
85
—乙萘
C12H12
86
蒽
C14H10
87
菲
C14H10
88
并四苯
C18H12
89
10
2—甲基戊烷
异己烷
C6H14
11
3—甲基戊烷
C6H14
12
2 ,3—二甲基丁烷
C6H14
13
2 ,2—二甲基丁烷
C6H14
14
正庚烷
C7H16
CH3—CH2—CH2—CH2—CH2—CH2—CH3、
CH3CH2CH2CH2CH2CH2CH3、CH3CH25CH3
15
2—甲基己烷
异庚烷
C7H16
16
200
乙酸甲酯
C3H6O2
、CH3COOCH3
201
乙酸乙酯
C4H8O2
、
CH3COOC2H5、CH3COOCH2CH3
202
甲酸正丙酯
C4H8O2
HCOOC3H7、HCOOCH2CH2CH3
203
甲酸异丙酯
C4H8O2
、 、HCOOCHCH32
204
甲酸新戊酯、
甲酸2,2—二甲基丙酯
C6H12O2
35
顺对二甲基环己烷
有机物记忆宝典

《有机物记忆宝典》物理性质:1.常温常压下为气态的有机物:1~4个碳原子的烃,一氯甲烷、新戊烷、甲醛。
2.易溶于水:碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸);难溶于水:液态烃(如苯、汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、醚、酯(乙酸乙酯);微溶与水:苯酚在常温微溶与水,但高于65℃任意比互溶。
3.不溶于水的有机物有:烃、卤代烃、酯、淀粉、纤维素4.密度比水小的液体有机物有:所有烃、大多数酯、一氯烷烃。
5.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。
通式:1.常见有机物的通式:烷烃:C n H2n+2;烯烃与环烷烃:C n H2n;炔烃与二烯烃:CnH2n-2;苯的同系物:C n H2n-6;饱和一元卤代烃:C n H2n+1X;饱和一元醇:C n H2n+2O或C n H2n+1OH;苯酚及同系物:CnH2n-6O或CnH2n-7OH;醛:CnH2n O或C n H2n+1CHO;酸:C n H2n O2或C n H2n+1COOH;酯:CnH2n O2或C n H2n+1COOC m H2m+12.最简式为CH的有机物:乙炔、苯、苯乙烯(—CH=CH2);最简式为CH2O的有机物:甲醛、乙酸(CH3COOH)、甲酸甲酯(HCOOCH3)、葡萄糖(C6H12O6)、果糖(C6H12O6)。
同分异构体:1.碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和一元醇和醚、饱和一元醛和酮、饱和一元羧酸和酯、芳香醇和酚、硝基化合物和氨基酸。
2.无同分异构体的有机物是:烷烃:CH4、C2H6、C3H8;烯烃:C2H4;炔烃:C2H2;氯代烃:CH3Cl、CH2Cl2、CHCl3、CCl4、C2H5Cl;醇:CH4O;醛:CH2O、C2H4O;酸:CH2O2。
化学性质:1.常见的官能团及名称:—X(卤原子:氯原子等)、—OH(羟基)、—CHO(醛基)、—COOH(羧基)、—COO—(酯基)、—CO—(羰基)、—O—(醚键)、 C=C (碳碳双键)、—C≡C—(碳碳叁键)、—NH2(氨基)、—NH—CO—(肽键)、—NO2(硝基)2.能被氧化的物质有:含有碳碳双键或碳碳叁键的不饱和化合物(KMnO4)、苯的同系物、醇、醛、酚。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
各类有机物的一般通式及分子式的通式归纳如下
1、烷烃的一般通式:CnH ( ≥1 )
2、环烷烃的一般通式:CnH 2n ( n ≥3)
3、烯烃的一般通式:CnH 2n ( n≥2)
4、二烯烃的一般通式:CnH 2n -2 (n ≥3)
5、炔烃的一般通式:CnH 2n -2 ( n ≥2)
6、苯和苯的同系物的一般通式:CnH 2n -6
7、一元卤代烃的一般通式:R —X (R 代表烃基,X 代表卤素原子) 8、饱和一元醇的一般通式:CnH 2n+1—OH (n ≥1) 饱和一元醇的分子式的通式:CnH 2n+2O (n ≥1)
乙二醇的结构简式: , 丙三醇的结构简式: (分子式:C 2H 6O 2) (分子式:C 3H 8O 3)
9、醚的一般通式:R —O —R (R,R 代表烃基,可以相同,也可以不同) 10、醛的一般通式:R (或H )—CHO (R 代表烃基)
饱和一元醛的通式:CnH 2n+1—CHO (n ≥1) 饱和一元醛的分子式的通式:CnH 2n O
11、酮的一般通式:R —CO —R (R ,R
代表烃基,可以相同,也可以不同) 12、羧酸的一般通式:R (或H )—
COOH (R
代表烃基)
饱和一元羧酸的通式:CnH 2n+1—COOH 饱和一元羧酸的分子式的通式:CnH 2n O 2 13、酯的一般通式:R (或H )—COOR
饱和酯的分子式的通式:CnH 2n O 2
14、 葡萄糖的分子式:C 6H 12O 6 分子结构:多羟基醛的结构
葡萄糖的结构简式:CH 2OH (CHOH )4CHO
15、果糖的分子式:C 6H 12O 6 分子结构:多羟基酮的结构
果糖的结构简式:CH 2OH (CHOH )3COCH 2OH
16、蔗糖的分子式:C 12H 22O 11
分子结构:不含醛基 17、麦芽糖的分子式:C 12H 22O 11 分子结构:含有醛基
18、淀粉的分子式:(C 6H 10O 5)n 19、纤维素的分子式:(C 6H 10O 5)n
20、几种重要的氨基酸:(甘氨酸,丙氨酸,苯丙氨酸,谷氨酸)其结构简式如下。
2n +1
n 互为同分异构体
互为同分异构体
, , , CH 2 CH 2 OH OH
CH 2
CH CH 2 OH
OH
OH
, , ,
醛和酮互为同分异构体
醇和醚互为同分异构
羧酸和酯互为同分异构体
葡萄糖和果糖互为同分构体
互为同分异构体
n 值不同,它们不互为同分异构体
甘氨酸
CH 2 NH 2
a —氨基乙酸
C OH
O
丙氨酸
a —氨基丙酸
C
OH O NH 2 CH 3—CH —— 苯丙氨酸
a —氨基β—苯基丙酸
C
OH
O
CH — NH 2
2—谷氨酸
a —氨基戊二酸
C OH
O
C
HO
O CH —CH 2—CH 2— NH 2。
