溶液沸点升高和凝固点下降有许多重要的应用
稀溶液的依数性及应用1303230018 罗健

稀溶液的依数性及其应用姓名:罗健学号:1303230018班级:新能源材料与器件摘要在物理化学学习中,稀溶液的依数性及其应用是不可缺少的部分。
本文对稀溶液的依数性进行了较全面的论述, 并阐述了稀溶液的依数性的应用。
在一定的温度和压力下,将某一难挥发性非电解质溶于溶剂中组成稀溶液时,相对纯溶剂而言,就会产生稀溶液的蒸气压降低、凝固点降低、沸点升高、渗透压等现象。
它们数值的大小,只与溶液中所含溶质粒子的浓度有关,而与溶质本身的性质无关,所以称它们为稀溶液的依数性。
我们讨论稀溶液的依数性一般从溶液的蒸气压下降、溶液的沸点升高和凝固点下降以及溶液的渗透压三个方面考虑。
关键词:稀溶液的依数性蒸汽压熔沸点渗透压一、相关现象1沸点升高沸点是指液体(纯液体或溶液)的蒸气压与外界压力相等时的温度。
如果未指明外界压力,可认为外界压力为101.325 kPa。
对于难挥发溶质的溶液,由于蒸气压下降,要使溶液蒸气压达到外界压力,就得使其温度超过纯溶剂的沸点,所以这类溶液的沸点总是比纯溶剂的沸点高,这种现象称为溶液的沸点升高,溶液浓度越大,沸点升高越多。
2凝固点下降凝固点是物质的液相和固相建立平衡的温度。
达到凝固点时,液、固两相的蒸气压必定相等,否则两相不能共存。
纯水的凝固点为273.16 K(0.009 9℃),这时水和冰的蒸气压均为610.6 Pa(4.58 mm Hg)。
溶液凝固点是指从溶液中开始析出溶剂晶体时的温度。
这时体系是由溶液(液相)溶剂(固相)和溶剂(气相)所组成。
对于水溶液,溶剂固相即纯冰。
由于溶液蒸气压下降,当273.16 K时,冰的蒸气压仍为610.6 Pa,而溶液蒸气压必然低于610.6 Pa,这样,溶液和冰就不能共存,只有在273.15 K以下的某个温度时,溶液蒸气压才能和冰的蒸气压相等,这时的温度才是溶液的凝固点,所以溶液的凝固点总是比纯溶剂的低,这种现象称为凝固点下降。
溶液浓度越大,蒸气压下降越多,凝固点下降也越多。
溶液沸点升高和凝固点降低与溶质的本性无关

因此,溶液沸点升高和凝固点降低与溶质
的本性无关,只与其浓度有关。
应用: 计算溶液的沸点
计算溶液的凝固点
计算溶质的的摩尔质量(MA)
如果是以水作为溶剂的话,溶液的沸点就等于100+△Tb, 凝固点就等于0-△Tf 。
问:植物为什么表现出一定的抗旱性和耐寒性? 细胞液是溶液,溶液的蒸汽压下降(抗旱性)溶液的
溶液的渗透压:
•
一定温度下,为阻止渗透作用的进行,必须向溶液施加的
最小压力。这个压力就是渗透压,用П表示。
1886年,Vant Hoff(范特霍夫)提出:稀溶液 的渗透压与溶液的物质的量浓度和热力学温度成正 比,与溶质的本性无关。
c=b
蒸气压下降、沸点上升、凝固点降低和渗透压 都是难挥发非电解质稀溶液的通性;它们只与 溶剂的本性、溶液的浓度有关,与溶质的本性 无关。
凝固点降低(耐寒,不致冻冰冻坏)
冬天在汽车的水箱里加入甘油或乙二醇,可防止水箱结 冰。
2、渗透压-依数性之四
这种现象,称为渗透现象 【渗透】溶剂分子透过半透膜从纯溶剂进入溶液,
或从稀溶液进入浓溶液的现象
2019/11/23
4
度不同
浓度不太高的溶液,定性分析依数性时, 一般认为:
A 同类物质的浓度越大,影响越大。
B 同一浓度的不同物质 强电解质 >弱电解质>非电解质
生产、生活和实际工作中溶液依数性及其应用

生产、生活和实际工作中溶液依数性及其应用稀溶液依数性是指只依赖溶液中溶质分子的数量,而与溶质分子本性无关的性质。
依数性包括溶液中溶剂蒸气压下降,凝固点降低,沸点升高和渗透压等。
稀溶液依数性可以解释很多自然现象和生活规律,在生产、生活和实际中有着广泛的应用。
现就四种依数性的应用分别举例说明。
一、蒸气压下降由Raout定律,P A = P A* X A,则△P= P A*- P A= P A*(1-X A)= P A*X B ,△P表示溶液的蒸汽压下降 ,即一定温度下稀溶液的△P与溶液中溶质的物质的量分数成正比。
CaCl2、NaOH、P2O5等易潮解的固态物质,常用作干燥剂。
因其易吸收空气中的水分在其表面形成溶液,该溶液蒸气压较空气中水蒸气的分压小,使空气中的水蒸气不断凝结进入溶液而达到消除空气中水蒸气的目的。
二、凝固点降低溶质的加入使固态纯溶剂从溶液中析出的温度T f比纯溶剂的凝固点T f*低。
应用热力学原理,推导出凝固点降低值△T f与溶液组成的定量关系式为△T f=k f m B , k f为凝固点降低常数。
冰雪天的道路上通过泼洒工业食盐可以加速除冰融雪,从而使道路畅通。
在冰雪中撒食盐,食盐溶解在水中后形成稀溶液,由于稀溶液凝固点要低,依据相平衡条件,随着白天温度稍稍回升,就可以使平衡向稀溶液方向移动,冰雪就会加速溶解变成液体,从而达到除冰融雪的目的。
同样基于凝固点降低的原理,在冬季,汽车的散热器里通常加入丙三醇、建筑工地上经常给水泥浆料中添加工业盐等,都是通过降低凝固点来预防冻伤。
[3]冬天吃冻梨前,将冻梨放入凉水中浸泡。
一段时间后,冻梨内部解冻了,表面却结了一层薄冰。
是利用梨汁含有糖分,其凝固点低于水的冰点,凉水温度比冻梨温度高,使冻梨解冻;冻梨解冻时要吸热,且解冻后的温度仍低于水的冰点,故冻梨内部解冻了而表面却结了一层薄冰。
[4]三、沸点升高当溶剂中加入不挥发溶质时,溶剂的蒸气压下降,使溶液沸点升高。
51.2溶液的沸点升高凝固点降低

$
一、溶液的沸点升高
蒸 气 压
溶液的沸点:溶液刚开始沸腾时的温度。 溶液的沸点升高的原因:溶液的蒸气压下降
$
实验表明:溶液的沸点升高与溶液的蒸气压下降成正比。
△ Tb= Tb- Tb0 = K'△p= K'KbB= KbbB
bB ---质量摩尔浓度 Kb---溶剂的沸点升高常数,只与溶剂本性有关。单
$
Thank you!
$
1.Kf>Kb值,则△Tf>△Tb,采用凝固点下降法的相对误差较小;
2.凝固点下降法是在较低的温度下进行的,不易引起生物样品
的变性和破坏。
4.溶液的凝固点降低应用实例
$
a. 冬天防止汽车的水箱炸裂-加入乙二醇或甘油 b. 积雪路面防滑-撒盐 c.在临床骨科中使用盐水冰袋冷敷
$
小结:
难挥发非电解质稀溶液依数性:
目录
$
★1.溶液的沸点升高 ★2.溶液的凝固点降低
$
引言
难挥发非电解质溶液蒸气压下降导致的结果之一: 溶液沸点的升高
纯溶剂中溶入少量难挥发非电解质后,发 现溶液的沸点总是高于纯溶剂的沸点,这 种现象叫溶液的沸点升高。为什么出现溶 液的沸点升高的现象?
$
液体的沸点(boiling point) Tb
$ 表2 几种常用溶剂的凝固点及凝固点降低常数
溶剂 水 苯 乙酸 乙醚 萘
四氯化碳
Tf/℃ 0.0 5.5 17 -116.2 80.5 -22.9
Kf/ (K·kg·mol-1) 1.86 4.9 3.9 1.8 6.8 32
$
例1 乙二醇(C2H6O2)是一种难溶非电解质,可作为汽车水箱抗 冻剂。试计算质量分数为0.25的乙二醇水溶液的凝固点。
基础化学教学课件:4.3.2 沸点升高和凝固点降低

防止水箱中的水
结冰
夏天
防止水箱开锅
溶液的沸点升高和凝固点
降低的原理及应用
谢
谢
• 水不断的汽化成水蒸气;
• 锅内气压增大,锅内水的沸点升高。
食物容易煮熟
溶液的凝固点
溶液的凝固点降低
凝固点:在一定外压下物质的液固两相平衡共存时的温度。
蒸气压相等
水的凝固点
温度/℃
-60
-40
-20
水的蒸气压/Pa
冰的蒸气压/Pa
1.08
12.84
103.26
0
20
40
60
100
611
2388
纯固体、纯溶剂和溶液的蒸气压曲线图
蒸气压P/Pa
溶液的凝固点降低
A
P*
P
B
Tf
∗
温度T/K
图2-4稀溶液凝固点降低示意图
溶液的凝固点降低
凝固点降低值与溶液的蒸汽压成正比,而蒸汽压又与溶液的质量摩尔浓度成正比。
根据拉乌尔定律得:溶液的凝固点降低与其质量摩尔浓度成正比关系。
ΔTf = Tf*-Tf = Kf bB
7376
19916
101325
611
溶液的凝固点降低
• 纯溶剂中加入非电解质溶质;
• 凝固时仅是溶剂析出;
• 需要进一步降低温度;
• 溶剂不断析出至溶液达到饱和;
• 最终全部凝结成固体。
共晶混合物
结论:溶液的凝固点比溶剂低。
蒸气压P/Pa
溶液的凝固点降低
A
P*
P
B
Tf
∗
温度T/K
图2-4稀溶液凝固点降低示意图
mol-1
溶液的凝固点与沸点

溶液的凝固点与沸点溶液是由溶质溶解在溶剂中形成的一种混合物。
在溶液中,溶质和溶剂之间的相互作用会对溶液的性质产生影响,其中包括凝固点和沸点。
溶液的凝固点和沸点是溶液中溶质和溶剂之间相互作用的结果,对于研究溶液的物理性质和应用具有重要意义。
一、溶液的凝固点降低当溶质溶解在溶剂中时,溶质与溶剂的相互作用会导致溶液的凝固点降低。
根据郎之万特脱退尔方程,溶液的凝固点降低与溶质的摩尔浓度成正比。
即溶质浓度越高,溶液的凝固点降低效应越明显。
溶液的凝固点降低可以通过冰点测定法进行实验测量。
在实验中,我们会发现在溶质溶解度较高的情况下,溶液的凝固点更低。
这是因为溶质分子与溶剂分子之间的相互作用会影响溶液的凝固行为,使其凝固成固体的能力降低。
凝固点降低的现象在现实生活中也有广泛应用。
例如,在冬季的寒冷地区,人们会在路面上撒一些盐来降低冰的凝固点,以防止路面结冰。
这是因为盐在溶液中能够与冰结晶相互作用,削弱冰的结构,从而降低了冰的凝固点,使道路保持结冰消融状态。
二、溶液的沸点升高与溶液的凝固点降低相反,溶液的沸点会因溶质的存在而升高。
溶质与溶剂之间的相互作用增加,导致溶液的沸点升高。
根据郎之万特脱退尔方程,溶液的沸点升高与溶质的摩尔浓度成正比。
即溶质浓度越高,溶液的沸点升高效应越明显。
实验中,我们可以通过沸点测定法来测量溶液的沸点升高。
我们会发现,在有溶质存在的情况下,溶液的沸点比纯溶剂的沸点要高出一定的温度。
这是由于溶质分子与溶剂分子之间的相互作用会阻碍溶剂分子的蒸发过程,从而提高溶液的沸点。
沸点升高也有实际应用。
例如,在烹饪中加入食盐也能够提高水的沸点。
由于沸点升高,水的煮沸温度也随之升高,从而可以更快地煮熟食物。
此外,汽车发动机冷却液中也含有防冻剂,它们能够使冷却液的沸点升高,从而提高汽车的发动机运行温度范围。
总结:溶液中溶质和溶剂之间的相互作用会影响溶液的凝固点和沸点。
溶液的凝固点会因溶质的存在而降低,而沸点则会因溶质的存在而升高。
4.凝固点下降、沸点上升

nB WA
T f K f mB
Kf M A R T
* 2 f
(2)
(3)
fus H m
Kf:溶剂凝固点降低常数(cryoscopic constant); 单位: K.kg.mol-1 . Kf的值只与溶剂的性质有关,与溶质的性质无关.
溶剂沸点升高
用与上节相类似的方法,可得:
故 :
H ln x A T RT 2 p
H xA 1 d ln x A T * RT 2 d T H 1 1 ln x A * R T T
xA T
对于稀溶液: xA→1; xB→0 lnx =ln(1 - x ) ≈ - x A B B H T
Tb
R T
* 2 b
b H m
xB
(4) (5)
Tb K b mB
Kb M A R T
* 2 b
vap H m
(6)
•沸点升高常数(ebullioscopic constant)Kb与凝固点降低常数一
样,也只与溶剂的性质有关,与溶质的性质无关.
• 一般在相同的浓度下,沸点升高的幅度小于凝 固点降低的幅度.
• 几种物质的数据如下:
•
水
苯
萘 6.9 5.8
HAc 3.90 3.07
• Kf/K.kg.mol-1 1.86 5.12 • Kb/K.kg.mol-1 0.51 2.53
ln x A R T
*
2
有:
xB
fus H m T f RTT
*
fus H m T f R T
4.2.2 稀溶液的沸点升高和凝固点降低

稀溶液的沸点和凝固点
蒸气压
纯溶剂
固相 凝固点降低
稀溶液 沸点升高
温度
稀溶液的沸点和凝固点
拉乌尔定律
溶液的沸点升高值 凝固点下降值
ΔTbp = Kb∙bB ΔTfp = Kf∙bB
Kb:溶剂的摩尔沸点升高常数 Kf :溶剂的摩尔凝固点下降常数 bB:溶液的质量摩尔浓度
稀溶液的沸点和凝固点
拉乌尔定律
溶液的沸点升高值 凝固点下降值
ΔTbp = Kb∙bB ΔTfp难挥发非电解质的稀溶液
ΔTbp和ΔTfp与溶质的浓度有关,与溶质的本性无关
Kb和Kf与溶剂的本性有关
由于同一溶剂的Kf大于Kb,因此相同浓度溶液的凝 固点降低较沸点升高更明显
实际应用
ΔTbp = Kb∙bB = 2.1 oC ΔTfp = Kf∙bB = 7.5 oC
Tbp= 100 + 2.1 = 102.1 oC Tfp= 0 − 7.5 = −7.5 oC
实际应用
溶液的质量摩尔浓度溶液的沸点升高值拉乌尔定律稀溶液的沸点和凝固点溶液的沸点升高值fp的计算仅适用于难挥发非电解质的稀溶液fp与溶质的浓度有关与溶质的本性无关因此相同浓度溶液的凝固点降低较沸点升高更明显实际应用例题
4.2.2 稀溶液的沸点升高 和凝固点降低
沸点 (boiling point)
蒸气压 / mmHg
800 34.6 oC 760
乙醚
600
78.3 oC
乙醇
100 oC
水
400
200
0 20 40 60 80 100 温度 / oC
沸点:液体的蒸气压与外界压力相等时的温度
凝固点 (freezing point)
溶液的蒸气压、凝固点、沸点和渗透压
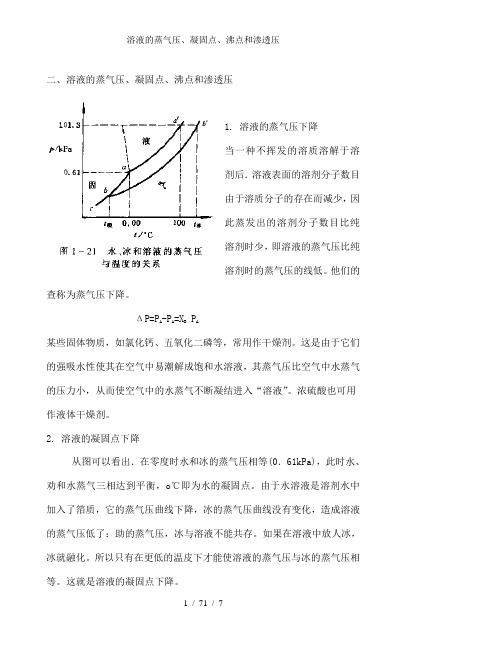
二、溶液的蒸气压、凝固点、沸点和渗透压1. 溶液的蒸气压下降当一种不挥发的溶质溶解于溶剂后.溶液表面的溶剂分子数目由于溶质分子的存在而减少,因此蒸发出的溶剂分子数目比纯溶剂时少,即溶液的蒸气压比纯溶剂时的蒸气压的线低。
他们的查称为蒸气压下降。
ΔP=PA -PA=XBPA某些固体物质,如氯化钙、五氧化二磷等,常用作干燥剂。
这是由于它们的强吸水性使其在空气中易潮解成饱和水溶液,其蒸气压比空气中水蒸气的压力小,从而使空气中的水蒸气不断凝结进入“溶液”。
浓硫酸也可用作液体干燥剂。
2. 溶液的凝固点下降从图可以看出.在零度时水和冰的蒸气压相等(0.61kPa),此时水、劝和水蒸气三相达到平衡,o℃即为水的凝固点。
由于水溶液是溶剂水中加入了箔质,它的蒸气压曲线下降,冰的蒸气压曲线没有变化,造成溶液的蒸气压低了:助的蒸气压,冰与溶液不能共存。
如果在溶液中放人冰,冰就融化。
所以只有在更低的温皮下才能使溶液的蒸气压与冰的蒸气压相等。
这就是溶液的凝固点下降。
Δt凝=k凝m溶液凝固点下降应用很广。
在汽车、坦克的水箱(散热器)中常加人防冻剂乙二酵、酒精、甘油等,其中以乙二醇为优,因为它具有高沸点、高化学稳定性以及从木溶液中结出时形成淤泥状而不是块状冰特点;在水泥砂浆中加入食盐或氯化钙,能防止冬季产生冰冻现象。
在制冷过程中,用无机盐水溶液作裁冷剂或用冰—无机盐水溶液(共晶冰)作蓄冷剂.使其更适用于低温制冷装置。
3. 溶液的沸点上升图中aa’,ac’,bb’线分别表示水、冰和溶液的蒸气压与温度的关系。
当液体的蒸气压等于外界压力时,液体就沸腾,这时的温度称为沸点。
纯水在100℃时的蒸气压等于101.3kPa(等于外界压力),故水的沸点是100℃。
水中加入难挥发的溶质后,由于溶液的蒸气压曲线下降,只有在更高的温度下才能使它的蒸气压达到101.3kPa而汤踢。
这就是沸点上升的原因。
实验证明,难挥发物质溶液的拂点总是高于纯溶剂的沸点。
溶液的凝固点降低与沸点升高

溶液的凝固点降低与沸点升高溶液是由溶剂和溶质组成的一种混合物,其中溶质以分子或离子形式溶解在溶剂中。
当溶质与溶剂相互作用时,会引起溶液的物理性质发生变化,其中包括凝固点的降低和沸点的升高。
一、溶液的凝固点降低溶液的凝固点降低是指相较于纯溶剂,溶质的溶解使得溶液的凝固点下降的现象。
这个现象可以通过物理化学的分类来解释,具体包括:1. 性质相同的溶质对溶液凝固点的影响;2. 性质不同的溶质对溶液凝固点的影响。
1. 性质相同的溶质对溶液凝固点的影响溶剂的凝固点降低与溶液中溶质的数量有关。
根据拉尔斯-亨利斯定律的描述,当溶液中溶质的摩尔浓度增加时,溶液的凝固点降低的程度也会增加。
这可以通过以下公式表示:ΔT = K × m其中,ΔT表示溶液的凝固点降低,K为一个与溶剂溶质相互作用有关的常数,m为溶质的摩尔浓度。
从公式可以看出,溶液的凝固点降低是与溶质浓度呈正相关的。
2. 性质不同的溶质对溶液凝固点的影响在性质不同的溶质中,非电解质和电解质对溶液凝固点的影响不同。
对于非电解质,其分子间力较为弱,溶质分子溶解后不会解离产生离子,因此对溶液凝固点的影响较小。
当非电解质溶质浓度增加时,溶液的凝固点降低程度较小。
而对于电解质溶质,由于其容易解离产生离子,与溶剂中的溶剂分子发生离子间的相互作用,从而增加了溶剂的有效浓度,导致溶液的凝固点降低的程度较大。
这是因为电解质的解离增加了溶质颗粒的数量,扩大了溶液中颗粒之间的作用力。
二、溶液的沸点升高溶液的沸点升高是指相较于纯溶剂,溶质的溶解使得溶液的沸点升高的现象。
溶液的沸点升高与溶质的种类和摩尔浓度有关。
根据拉尔斯-亨利斯定律,溶液的沸点升高可以通过以下公式表示:ΔT = K × m其中,ΔT表示溶液的沸点升高,K为一个与溶剂溶质相互作用有关的常数,m为溶质的摩尔浓度。
与溶液的凝固点降低类似,溶液的沸点升高也与溶液中溶质的浓度呈正相关。
总结:溶液的凝固点降低和沸点升高是溶质溶解在溶剂中的常见现象。
对稀溶液凝固点降低的理解

对稀溶液凝固点降低的理解这种现象只会出现在易挥发溶剂中添加少量难挥发溶质所形成的稀溶液。
稀溶液的界定范围一般是指溶质浓度低到可以忽略溶质粒子间的相互作用力。
如果从微观方向形象一些解释的话,可以理解为:溶液中多了其他东西,使得溶液分子不容易跑出来,难以沸腾,且难以变为固体。
这属于稀溶液的依数性问题,之所以称之为依数性,是由于指定了溶剂的种类和数量后,这些性质只取决于所含溶质分子的数目,而与溶质的本性无关。
解释这个问题首先要理解什么情况下溶液会沸腾,什么情况下会凝固。
一、蒸发要了解沸腾首先要理解蒸发。
蒸发是指液体表面中的粒子从液体中逃出去后变成了气态粒子(即粒子间相互作用力可忽略不计的自由粒子)。
而在这个过程中,气态的粒子还会跑回到液体中。
当跑出去与跑回来的分子数目达到动态平衡时,这时液体表面的蒸气压我们称之为饱和蒸气压。
这个饱和蒸气压与温度有关。
温度越高,分子运动越剧烈,液体粒子逃离周围其他粒子的束缚的趋势越大,从而需要更大的外界压力才能把分子压回液体实现动态的平衡。
从而饱和蒸气压更大。
蒸发示意图二、沸腾在正常情况下,液体的饱和蒸气压低于大气压力,大气压力足以维持粒子逃离与回归的动态平衡。
而沸腾时,液体的饱和蒸气压与大气压相等,这就导致了大气的力量不足以按住液体分子,使得液体内部也会发生由液体变成气体的状况。
液体内部与外部同时剧烈蒸发,气泡不断生成使得液体不断翻滚,出现沸腾现象。
沸腾示意图三、沸点升高我们来分析一下溶液中加入了溶质以后会出现什么情况。
加入溶质后,溶质粒子会混合在溶液粒子之间。
这导致了单位面积上溶液粒子数目变少了。
从而出现了在蒸发的时候,溶液中分子跑出去的也就变少了,达到动态平衡时的蒸气压也就小了。
相同温度之下的蒸气压小了,不足以支持液体内部的分子顶着大气压力变成气体粒子,就不会沸腾。
所以温度要在更高一些的情况下才可以沸腾。
也就出现了沸点升高现象。
溶液中溶质越多,溶剂粒子变为气态的可能性越小,沸腾所需温度越高。
凝固点降低法测物质分子量

实验二 凝固点降低法测定物质的相对分子质量一.实验目的1. 用凝固点降低法测定萘的相对摩尔质量;2. 掌握溶液凝固点测定技术;3. 通过实验加深对稀溶液依数性质的理解。
二.实验原理1. 稀溶液的依数性 (1)、溶液的蒸气压下降:Δp = poxB ≈ poMAbB = KbB (2)、溶液的沸点升高:ΔTb = kbbB (3)、溶液的凝固点降低:ΔTf = kfbB(4)、溶液的渗透压力:Π = cBRT利用溶液的沸点升高和凝固点降低都可以测定溶质的相对分子质量,但通常都用凝固点降低法。
原因:Kf > Kb , Tb > Tf2. 凝固点降低原理含非挥发性溶质的二组分稀溶液(当溶剂与溶质不生成固溶体时)的凝固点将低于纯溶剂的凝固点。
这是稀溶液的依数性质之一,当指定了溶剂的种类和数量后,凝固点降低值取决于所含溶质分子的数目,即溶剂的凝固点降低值与溶液的浓度成正比: m K T T T f =-=0这就是稀溶液的凝固点降低公式。
式中:T0为溶剂的凝固点;T 为溶液的凝固点;Kf 为质量摩尔凝固点降低常数,简称为凝固点降低常数;m 为溶质的质量摩尔浓度。
上式又可整理为:GT gKM f∙=1000式中:M 为溶质的摩尔质量(单位为g ·mol-1);g 和W 分别表示溶质和溶剂的质量(单位为g )。
3. 实验测量原理如已知溶剂的凝固点值,则可通过实验求出ΔT 值,利用(2)式求溶质的相对分子质量。
需要注意,如溶质在溶液中发生解离或缔合等情况,则不能简单地应用公式(2)加以计算。
浓度稍高时,已不是稀溶液,致使测得的相对分子质量随浓度的不同而变化。
为了获得比较准确的分子量数据,常用外推法,即以(2)式中所求得的相对分子质量为纵坐标,以溶液浓度为横坐标作图,外推至浓度为零而求得较准确的相对分子质量数值。
通常测凝固点的方法是将已知浓度的溶液(或溶剂)逐步冷却,记录一定时刻体系的温度,并绘出冷却曲线。
溶液的沸点升高及凝固点降低公式的简便推导

溶液的沸点升高及凝固点降低公式的简便推导当溶液中添加其他分子时,溶液的沸点会升高,而凝固点会降低。
这是因为溶液中的分子可以与溶液中的固体分子结合,这会使溶液的粘度增加,从而使溶液的沸点升高,而凝固点则降低。
这种现象可以用公式来表示:ΔTb = Kb · m · (i - 1)ΔTf = Kf · m · (i - 1)其中,ΔTb表示溶液的沸点升高量,ΔTf表示溶液的凝固点降低量,Kb和Kf分别表示溶液的沸点升高常数和凝固点降低常数,m表示溶质的质量浓度,i表示溶质的分子量比较系数。
公式的推导过程如下:首先,我们考虑沸点升高的原因。
溶液的沸点升高是因为加入的分子会增加溶液的粘度,使得溶液更难沸腾。
这种现象可以用动能平衡公式来表示:ΔHvap = ΔU + Δ(PV)其中,ΔHvap表示溶质汽化所需的热量,ΔU表示溶质固体和液体之间的热力学变化量,Δ(PV)表示溶质汽化时所发生的动能变化量。
根据柯尔定律,Δ(PV)与Δ(PV)与溶液的粘度成反比。
因此,当溶液的粘度增加时,Δ(PV)会减小,这会使ΔHvap增加。
因此,溶液的沸点会升高。
类似地,溶液的凝固点降低是因为加入的分子会增加溶液的粘度,使得溶液更难凝固。
这种现象可以用动能平衡公式来表示:ΔHfus = ΔU + Δ(PV)其中,ΔHfus表示溶质凝固所需的热量,ΔU表示溶质固体和液体之间的热力学变化量,Δ(PV)表示溶质凝固时所发生的动能变化量。
根据柯尔定律,Δ(PV)与溶液的粘度成反比。
因此,当溶液的粘度增加时,Δ(PV)会减小,这会使ΔHfus减小。
因此,溶液的凝固点会降低。
最后,我们将上述结论用公式表示出来:ΔTb = Kb · m · (i - 1)ΔTf = Kf · m · (i - 1)其中,ΔTb表示溶液的沸点升高量,ΔTf表示溶液的凝固点降低量,Kb和Kf分别表示溶液的沸点升高常数和凝固点降低常数,m表示溶质的质量浓度,i表示溶质的分子量比较系数。
溶液的凝固点和沸点

溶液的凝固点和沸点溶液是由溶质溶解在溶剂中形成的均相混合物。
当溶质溶解到溶剂中时,它会改变溶剂的一些物理性质,如凝固点和沸点。
凝固点是指溶液在降低温度时开始凝固的温度,而沸点是指溶液在增加温度时开始沸腾的温度。
本文将探讨溶液中凝固点和沸点的影响因素以及其在化学和生活中的应用。
一、溶液中凝固点的影响因素溶液的凝固点可以通过添加溶质来降低,这是因为溶质与溶剂之间的相互作用力会干扰溶剂分子之间的相互作用力。
以下是凝固点的主要影响因素:1. 溶质的种类和数量:不同的溶质有不同的影响程度。
通常情况下,溶质的数量越多,凝固点的下降越多。
2. 溶剂的性质:不同的溶剂具有不同的凝固点降低能力。
一般来说,极性溶剂(如水)的凝固点降低较大,而非极性溶剂(如石油醚)的凝固点降低较小。
3. 溶剂与溶质之间的相互作用力:当溶质和溶剂之间的相互作用力较强时,凝固点的下降会更明显。
二、溶液中沸点的影响因素溶液的沸点可以通过添加溶质来升高,这是因为溶质与溶剂之间的相互作用力会干扰溶剂分子之间的相互作用力。
以下是沸点的主要影响因素:1. 溶质的种类和数量:不同的溶质对沸点的升高影响程度不同。
通常情况下,溶质的数量越多,沸点的升高越大。
2. 溶剂的性质:不同的溶剂具有不同的沸点升高能力。
一般来说,非极性溶剂(如石油醚)的沸点升高较大,而极性溶剂(如水)的沸点升高较小。
3. 溶剂与溶质之间的相互作用力:当溶质和溶剂之间的相互作用力较强时,沸点的升高会更明显。
三、溶液凝固点和沸点的应用1. 冰融化道路的应用:在寒冷的冬季,道路上的冰会造成交通事故。
为了防止结冰,可以向道路上喷洒抗冰剂,如盐类溶液。
这些盐会降低冰的凝固点,使冰变为溶解在水中的盐溶液,从而防止道路上的结冰。
2. 铜锅炖汤:在炖制汤的过程中,人们经常使用铜锅。
这是因为铜可以通过提高溶液的沸点来加快蔬菜和肉类的煮熟速度,从而减少烹饪时间。
3. 化学实验中的制冷剂:在化学实验中,研究人员经常需要在低温下进行实验。
从熵的角度理解凝固点降低值大于沸点升高值

从熵的角度理解凝固点降低值大于沸点升高值热力学熵(S)是物理学中的一个重要概念,可以用来衡量一个
物质过程的自然运动状态。
它可以用来理解物质从一个状态到另一个状态的变化过程,例如从气态到液态和从液态到固态。
它可以用来说明为什么凝固点的降低值大于沸点的升高值。
首先,我们来解释一下为什么凝固点的降低值大于沸点的升高值。
当物质从气态变为液态或从液态变为固态时,它的热力学熵是减小的。
热力学熵的下降表明物质的分子运动是一种秩序化的过程,但它也意味着物质的热能(Q)必须同时释放,因此凝固点的降低值就大于沸
点的升高值。
其次,我们来看看热力学熵如何影响凝固点降低值大于沸点升高值的结果。
热力学熵的变化是由热量的变化而引起的,因此凝固点的温度会低于沸点的温度,这就是为什么凝固点的降低值大于沸点的升高值的原因。
最后,我们来讨论凝固点降低值大于沸点升高值的实际应用。
凝固点降低值大于沸点升高值可以用来生产高品质的冰淇淋、冰镇饮料和其他冷冻食品。
冰淇淋中含有果汁成分,果汁成分的凝固点比水的凝固点低,这就是为什么凝固点降低值大于沸点升高值的原因。
此外,它也可以用来生产冰镇饮料以及一些特定的制冷技术应用,这些技术应用也受到凝固点降低值大于沸点升高值的影响。
总之,从熵的角度理解凝固点降低值大于沸点升高值有助于我们理解物质从一个状态到另一个状态的变化过程,并可以应用于一些实
际技术应用领域。
同时,只有当物质的热力学熵减小时,物质的热能才会释放出来,这就是为什么凝固点的降低值大于沸点的升高值的原因。
1. 5 溶液沸点升高和凝固点降低

凝固点低于纯水。
1. 6. 2 计算公式 1. 沸点升高公式 用 Tb 表示沸点升高值,
Tb = Tb - T0,b
Tb = Tb - T0,b 式中 T0,b 纯溶剂的沸点, Tb 溶液的沸点。
Tb 直接受 p 影响,
事实上 Tb p
Tb p 而 p = k•m, 故 Tb m 比例系数用 kb 表示,则有
B′点低于 273 K,是溶液的冰点。 有冰析出,溶液浓度增加,冰点更低, 温度继续下降
T/K
A
A′
( 2)
A ′′
273
C B B′ C′ D D′ B ′′ D ′′ C ′′ E ′′
E′
t/min
故 B′C′段上,尽管冰与溶液 共存,但温度并不恒定。
T/K
A
A′
( 2)
A ′′
273
373
T1
T/K
此时若溶液和冰共存,冰要熔化,
或者说溶液此时尚未达到凝固点
p/Pa
1.013 10 5 A B l3 B′ T2 273 373
l1
l2 A′
l1 水 l2 水溶液 l3 冰
611
T1
T/K
⑧ 降温到 T2 < 273 K 时,
冰线和溶液线相交于 B′点。
p/Pa
1.013 10 5 611 B′ T2 273 B l3
所以葡萄糖的相对分子质量为 179。 和葡萄糖的实际数据 180 很相近。
若利用凝固点法测分子量,结 果将更准确。
因为 kf 比 kb 要大,温度差会
更明显一些。 就测定方法本身来讲,凝固点
的测定比沸点的测定精确度要高。
生产、生活和实际工作中溶液依数性及其应用

生产、生活和实际工作中溶液依数性及其应用稀溶液依数性是指只依赖溶液中溶质分子的数量,而与溶质分子本性无关的性质。
依数性包括溶液中溶剂蒸气压下降,凝固点降低,沸点升高和渗透压等。
稀溶液依数性可以解释很多自然现象和生活规律,在生产、生活和实际中有着广泛的应用。
现就四种依数性的应用分别举例说明。
一、蒸气压下降由Raout定律,P A = P A* X A,则△P= P A*- P A= P A*(1-X A)= P A*X B ,△P表示溶液的蒸汽压下降 ,即一定温度下稀溶液的△P与溶液中溶质的物质的量分数成正比。
CaCl2、NaOH、P2O5等易潮解的固态物质,常用作干燥剂。
因其易吸收空气中的水分在其表面形成溶液,该溶液蒸气压较空气中水蒸气的分压小,使空气中的水蒸气不断凝结进入溶液而达到消除空气中水蒸气的目的。
二、凝固点降低溶质的加入使固态纯溶剂从溶液中析出的温度T f比纯溶剂的凝固点T f*低。
应用热力学原理,推导出凝固点降低值△T f与溶液组成的定量关系式为△T f=k f m B , k f为凝固点降低常数。
冰雪天的道路上通过泼洒工业食盐可以加速除冰融雪,从而使道路畅通。
在冰雪中撒食盐,食盐溶解在水中后形成稀溶液,由于稀溶液凝固点要低,依据相平衡条件,随着白天温度稍稍回升,就可以使平衡向稀溶液方向移动,冰雪就会加速溶解变成液体,从而达到除冰融雪的目的。
同样基于凝固点降低的原理,在冬季,汽车的散热器里通常加入丙三醇、建筑工地上经常给水泥浆料中添加工业盐等,都是通过降低凝固点来预防冻伤。
[3]冬天吃冻梨前,将冻梨放入凉水中浸泡。
一段时间后,冻梨内部解冻了,表面却结了一层薄冰。
是利用梨汁含有糖分,其凝固点低于水的冰点,凉水温度比冻梨温度高,使冻梨解冻;冻梨解冻时要吸热,且解冻后的温度仍低于水的冰点,故冻梨内部解冻了而表面却结了一层薄冰。
[4]三、沸点升高当溶剂中加入不挥发溶质时,溶剂的蒸气压下降,使溶液沸点升高。
溶液沸点升高和凝固点降低与溶质的本性无关

在食品工业中,利用溶液凝固点 降低原理进行食品的冷冻和保鲜。 通过将食品浸泡在低温溶液中或 者喷淋低温溶液,可以使食品迅 速降温并保持在低温状态,延长 食品的保质期。
在化学工业中,利用溶液凝固点 降低原理进行化学反应的冷却和 分离。通过将反应混合物冷却到 低温状态,可以实现化学反应的 快速进行和产物的分离纯化。
溶液的沸点升高和凝固点降低是由于溶质分子或离子 在溶剂分子中的存在,改变了溶剂分子间的相互作用
力,从而影响了溶液的蒸气压和凝固点。
输标02入题
当溶质分子或离子在溶剂分子中占据一定空间位置时, 它们会阻碍溶剂分子间的接近,从而使得溶液的蒸气 压下降,导致溶液的沸点升高。
01
03
溶液沸点升高和凝固点降低的原理是建立在分子间的 相互作用和热力学定律的基础上的,是溶液物理性质
沸点升高是溶液的一种物理性质,与 溶质的种类、数量以及溶液的浓度等 因素有关。
溶液凝固点降低的定义
溶液的凝固点降低是指溶液的凝固点相对于纯溶剂的凝固点而言的,由于溶质的加入,使得溶液的凝固点比纯溶剂的凝固点 要低。
凝固点降低是溶液的一种物理性质,与溶质的种类、数量以及溶液的浓度等因素有关。
溶液沸点升高和凝固点降低的原理
溶液沸点升高和凝固点降低的本质是 溶质分子与溶剂分子之间的相互作用, 导致溶液的蒸气压下降。这种相互作 用与溶质的本性无关,因此溶液沸点 升高和凝固点降低与溶质的本性无关。
VS
溶质的本性对溶液沸点升高和凝固点 降低的影响主要体现在溶质的浓度上。 相同条件下,溶质浓度越高,溶液的 蒸气压下降越多,溶液的沸点升高和 凝固点降低越明显。
03
溶液沸点升高和凝固点 降低的实际应用
溶液沸点升高在工业上的应用
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液沸点升高和凝固点下降有许多重要的应用。
例如钢铁工件进行氧化热处理就是应用沸点升高原理。
用每升含550~650 g NaOH和100~150 g NaNO2的处理液,其沸点高达410~420 K。
利用凝固点下降原理,将食盐和冰(或雪)混合,可以使温度降低到251 K。
氯化钙与冰(或雪)混合,可以使温度降低到218 K。
体系温度降低的原因是:当食盐或氯化钙与冰(或雪)接触时,在食盐或氯化钙的表面形成极浓的盐溶液,而这些浓盐溶液的蒸气压比冰(或雪)的蒸气压低得多,冰(或雪)则以升华或熔化的形式进入盐溶液。
进行上述过程都要吸收大量的热,从而使体系的温度降低。
利用这一原理,可以自制冷冻剂。
冬天在室外施工,建筑工人在砂浆中加入食盐或氯化钙;汽车驾驶员在散热水箱中加入乙二醇等等,也是利用这一原理,防止砂浆和散热水箱结冰。
有些晶体能自发吸收空气中的水蒸气,在它们的固体表面逐渐形成饱和溶液,它的水蒸气压若是低于空气中的水蒸气压,则平衡向着潮解的方向进行,水分子向物质表面移动。
这种现象叫做潮解。
无水氯化钙、氯化镁和固体氢氧化钠在空气中很容易潮解。
有些无水晶体潮解后在表面形成饱和溶液,还变成水合物。
如无水氯化钙潮解后变成Ca Cl2•6H2O;有些只在表面形成饱和溶液,如氢氧化钠固体。
由于化合物饱和溶液的蒸气压低于同温下空气中的水蒸气的分压,因而使该物质不断吸收水分而潮解。
溶液的水蒸气压跟溶液的浓度有关(当然还跟电解质的电离度有关),只有饱和溶液的浓度足够大,才能保证它的水蒸气压足够小(小于空气中的水蒸气压),因此,能够发生潮解的都是那些溶解度特别大的物质。
纯净的氯化钠晶体不潮解。
同时,潮解的发生还与空气的相对湿度有关。
容易潮解的物质有CaCl2、MgCl2、FeCl3 、AICl3、NaOH等无机盐、碱。
易潮解的物质常用作干燥剂,以吸收液体或气体的水分。
易潮解的物质必须在密闭条件下保存;易潮解的药物(特别是原料药)更要在防潮条件下贮存,以防霉烂变质。
潮解是属于物理变化。
