溶液沸点升高和凝固点降低与溶质的本性无关
生产、生活和实际工作中溶液依数性及其应用

生产、生活和实际工作中溶液依数性及其应用稀溶液依数性是指只依赖溶液中溶质分子的数量,而与溶质分子本性无关的性质。
依数性包括溶液中溶剂蒸气压下降,凝固点降低,沸点升高和渗透压等。
稀溶液依数性可以解释很多自然现象和生活规律,在生产、生活和实际中有着广泛的应用。
现就四种依数性的应用分别举例说明。
一、蒸气压下降由Raout定律,P A = P A* X A,则△P= P A*- P A= P A*(1-X A)= P A*X B ,△P表示溶液的蒸汽压下降 ,即一定温度下稀溶液的△P与溶液中溶质的物质的量分数成正比。
CaCl2、NaOH、P2O5等易潮解的固态物质,常用作干燥剂。
因其易吸收空气中的水分在其表面形成溶液,该溶液蒸气压较空气中水蒸气的分压小,使空气中的水蒸气不断凝结进入溶液而达到消除空气中水蒸气的目的。
二、凝固点降低溶质的加入使固态纯溶剂从溶液中析出的温度T f比纯溶剂的凝固点T f*低。
应用热力学原理,推导出凝固点降低值△T f与溶液组成的定量关系式为△T f=k f m B , k f为凝固点降低常数。
冰雪天的道路上通过泼洒工业食盐可以加速除冰融雪,从而使道路畅通。
在冰雪中撒食盐,食盐溶解在水中后形成稀溶液,由于稀溶液凝固点要低,依据相平衡条件,随着白天温度稍稍回升,就可以使平衡向稀溶液方向移动,冰雪就会加速溶解变成液体,从而达到除冰融雪的目的。
同样基于凝固点降低的原理,在冬季,汽车的散热器里通常加入丙三醇、建筑工地上经常给水泥浆料中添加工业盐等,都是通过降低凝固点来预防冻伤。
[3]冬天吃冻梨前,将冻梨放入凉水中浸泡。
一段时间后,冻梨内部解冻了,表面却结了一层薄冰。
是利用梨汁含有糖分,其凝固点低于水的冰点,凉水温度比冻梨温度高,使冻梨解冻;冻梨解冻时要吸热,且解冻后的温度仍低于水的冰点,故冻梨内部解冻了而表面却结了一层薄冰。
[4]三、沸点升高当溶剂中加入不挥发溶质时,溶剂的蒸气压下降,使溶液沸点升高。
无机化学1-电大解析

《无机化学》(药)单项练习-判断题1.强碱滴定一元弱碱的条件为c K b≥10-10。
错2.缓冲溶液之所以具有缓冲作用,是由于外加少量酸碱时,质子在共轭酸碱之间发生转移以维持质子浓度基本不变而造成的。
对3.盐效应使弱电解质的解离度略有增大。
对4.稀溶液的依数性是说溶液的某些性质与溶质的粒子数的多少有关,与溶质本性无关。
对5.同离子效应的实质是由于离子浓度的变化,引起了电离平衡的移动,而使弱电解质的解离度增大。
错6.难挥发非电解质稀溶液的沸点升高与溶液的质量摩尔浓度成正比,而与溶质的本性有关。
错7.体系的状态一定,状态函数是值一定,状态函数的变化只决定于体系的始态和终态,而与变化的途径无关。
对8.在化学反应中,△H的符号与Q值相同,△H>0,为吸热反应,表示体系从环境吸热,△H<0,为放热反应,表示体系放热给环境。
对9.浓度影响化学反应速率,浓度可以改变单位体积内活化分子的总数。
对10.HAc与Ac―为共轭酸碱对。
对11溶剂分子通过半透膜进入溶液的过程称之为渗透或渗透现象。
对12.恒温下,增加反应物浓度,活化能增加。
错14.共价键是成键原子得失电子后形成的正负离子靠静电引力结合在一起而形成的,其特征是无方向性、无饱和性错15.分子的几何构型不仅取决于中心原子采取的杂化轨道类型,还取决于分子的键型是否相同。
对16.在弱电解质溶液中加入与该弱电解质有共同离子的强电解质而使解离平衡向左移动,从而降低弱电解质解离度的现象,称为同离子效应。
对17.强酸滴定一元弱酸的条件为c K a≥10-8。
对18.难挥发非电解质稀溶液的凝固点降低和溶液的质量摩尔浓度成正比,而与溶质的本性有关。
错19.难挥发非电解质稀溶液的沸点升高与溶液的质量摩尔浓度成正比,而与溶质的本性无关。
对20.温度能影响化学反应速率,温度可以改变单位体积内活化分子的总数。
错21.催化剂能影响化学反应速率,是通过改变反应的途径而改变了反应的活化能。
基础化学第二章习题加答案解析

第二章 稀薄溶液的依数性 首 页 难题解析 学生自测题 学生自测答案 章后习题答案 难题解析 [TOP]例2-1 已知异戊烷C 5H 12的摩尔质量M (C 5H 12) = 72.15 g·mol -1,在20.3℃的蒸气压为77.31 kPa 。
现将一难挥发性非电解质0.0697g 溶于0.891g 异戊烷中,测得该溶液的蒸气压降低了2.32 kPa 。
(1)试求出异戊烷为溶剂时Raoult 定律中的常数K ;(2)求加入的溶质的摩尔质量。
分析 Raoult 定律中的常数K = p 0M A ,注意p 0是溶剂异戊烷的蒸气压。
解 (1) AA B AB B A B B M m n n n n n n x =≈+= B B A 0A A B 0B 0ΔKb b M p M m n p x p p ==== K = p 0M A 对于异戊烷有 K = p 0M A = 77.31 kPa×72.15 g·mol -1=5578 kPa·g·mol -1 = 5.578 kPa·kg·mol -1(2)A B B B Δm M m K Kb p == 11A B B mol g 188kg 10000.891kPa 32.2g 0697.0mol kg kPa 578.5Δ--⋅=⨯⋅⋅=⋅=m p m K M 例2-2 一种体液的凝固点是-0.50℃,求其沸点及此溶液在0℃时的渗透压力(已知水的K f =1.86 K·kg·mol -1,K b =0.512K·kg·mol -1)。
分析 稀薄溶液的四个依数性是通过溶液的质量摩尔浓度相互关连的,即 RTK T K T K p b ∏≈===f f b b B ΔΔΔ 因此,只要知道四个依数性中的任一个,即可通过b B 计算其他的三个依数性。
《基础化学》稀溶液的依数性

Kf称为质量摩尔凝固点降低常数,它只与 溶剂的本性有关。单位为: K ·kg ·mol-1.
注意:溶液的凝固点并不固定。
析出的是什么?上图
返回
沸点升高与凝固点降低的应用
T b K b bB
T f K f bB
T
K
bB
K
nB mA
K
mB MB mA
M
一、溶液的蒸气压下降 二、溶液的沸点升高与凝固点降低 三、溶液的渗透压力 (医学紧密相关)
第一节 蒸汽压下降
一、蒸气压
我们将与液相处与平衡时气相所具有的压强称为 该温度下的饱和蒸气压, 简称蒸气压 (vapor pressure), 常用符号 p 表示, 单位 Pa (帕)或 kPa (千帕)。
若半透膜两侧分别为稀溶液和浓溶液?
把这种溶剂分子自发地透过半透膜由纯溶剂 进入溶液或由稀溶液进入浓溶液的现象称为 渗透现象。
渗透现象产生的条件
图
(1)有半透膜的存在
(2)半透膜两侧单位体积内溶剂分子数不等
渗透的方向
由单位体积内溶剂分子数目多的一侧向单位 体积内溶剂分子数目少的一侧渗透。
由溶剂分子高浓度一侧向溶剂分子低浓度一 侧渗透。
返回
渗透平衡
单位时间内从膜两侧透过的溶剂分子数 相等,渗透作用达到平衡,称为渗透平衡。
平衡时溶剂分子的无规则热运动,扩散 仍在进行,只不过两个方向的速度相等。
动态平衡。
返回
渗透压力
在纯溶剂与溶液之间,为了使渗透现象不发生,必 须在溶液上施加一额外的压力,由此产生的压强正 好可以维持渗透平衡状态,这一额外压强在数值上 等于该溶液的渗透压力。
在一定温度下,难挥发性非电解质稀溶液 的蒸气压等于纯溶剂的蒸气压乘以溶液中溶 剂的摩尔分数。
稀溶液依数性在生活中的应用

稀溶液依数性在生活中的应用摘要稀溶液依数性是指稀溶液中依赖溶质数量的物理性质,与溶质本性无关。
这些性质包括蒸汽压下降、沸点升高、凝固点降低和渗透压。
通过阐述稀溶液依数性定义,分析依数性在人们生活与生产实践中的应用实例,有利于提高学生运用基本理论解决实际问题的能力。
关键词蒸汽压下降;沸点升高;凝固点降低;渗透压;应用实例前言稀溶液依数性描述了稀溶液性质比起所对应纯溶剂性质的一些特殊变化,是多组分系统中化学势随组分数而表现出来的自身变化规律。
在讨论稀溶液依数性时,要牢牢把握形成稀溶液的溶剂和溶质本性是不能发生改变的,即溶质分子在形成溶液后不能形成聚合物或水解物。
稀溶液依数性非常贴近人们的生产和生活实践,可以解释我们身边的很多自然现象和生活规律。
本文阐述稀溶液依数性的基本理论,汲取人们日常生活和生产中的一些实例,验证了依数性的基本原理,有助于我们学习过程中加深理解并提高分析解决实际问题的能力。
1.渗透压下降在一定温度下,将纯水放入一密闭容器中,当纯水的蒸发速率与凝结速率相等,气相和液相达到平衡时,水蒸气的密度不再改变,这时蒸气所具有的压力称该温度下的饱和为蒸气压力,简称蒸汽压力。
而稀溶液的蒸气压比纯溶剂饱和蒸气压低,这种现象叫蒸气压下降。
由Raoult定律可知,稀溶液的蒸气压下降值只与溶液中溶质的数量有关而与溶质的种类无关。
2.沸点升高2.1基本理论沸点是液体的饱和蒸气压等于外压时的平衡温度。
当外压为101.325KPa 时的沸点称为正常沸点。
在一定外压条件下,当溶液中含有不挥发性溶质时,溶液的沸点比纯溶剂的沸点高,这一现象称为溶液的沸点升高。
2.2应用实例在钢铁冶炼工业中,通过观测钢水的沸点来确定其它组分的含量在钢铁工业生产中,技术人员为了配比一定比率的固溶体需要不断的取样测定,不仅重复劳动、工作量大,而且高温作业采样会有很大的潜在危险,于是技术员通过观测安装在熔炉中温度测量仪测定每一个状态时的沸点,就可以确定即时合金中的其他金属的含量,对合金生产起到关键的调控作用。
第二章 稀溶液的依数性

17.1g nB 0.0500 mol 1 342g mol
100g nA 5.66mol 1 18.0g mol
5.56mol xA 0.991 5.56mol 0.0500 mol
p p xA 2.34k Pa 0.991
0
2.32k Pa
二、溶液的蒸气压下降
四、渗透压在医学上的意义
衡量溶液渗透压的大小:
Π~c Π ~ ic
(一) 渗透浓度:
渗透活性物质(溶质粒子包括分子、离子)的总浓度, 符号为c os,单位为mol· L-1 或mmol· L-1 。 非电解质溶液: c os=
二、Van’t Hoff 定律*
解: 首先计算该溶液的浓度:
cRT
1.33 4 1 c 5.37 10 mol L RT 8.31 298 Hb的摩尔质量:
35.0 4 1 M 6.52 10 g mol 4 5.37 10
二、Van’t Hoff 定律*
渗透(现象): 溶剂分子透过半透膜从纯溶剂进入溶液中的过程。 渗透现象产生的条件: (1)半透膜的存在 (2)半透膜两侧单位体积内溶剂的个数不等 稀 浓
非电解质溶液 :稀溶液和浓溶液之间也会产生渗透现象
一、渗透现象和渗透压
渗透方向:
溶剂净转移的方向
( 1 )溶剂分子总是从纯溶剂通过半透膜向溶 液渗透;(2)从浓度小的溶液向浓度大的溶液(非 电解质溶液)渗透 溶剂分子从单位体积内溶剂分子数目多的一侧 向溶剂分子数目少的一侧运动。
二、溶液的蒸气压下降
显然:溶液中难挥发的溶质浓度越大,Δ p下降越多
二、溶液的蒸气压下降
Raoult*(拉乌尔)定律:p = p0· xA xA为溶剂的摩尔分数。 在温度一定下,难挥发性非电解质稀溶液的蒸气压 等于纯溶剂的蒸气压与溶剂摩尔分数的乘积。 由于xA<1,所以p<p0 xA+xB=1 xB为溶质的摩尔分数。 xA = 1- xB p= p0(1- xB) △p= p0-p = p0xB 适用条件:1难挥发性2非电解质的3稀薄溶液*。
《稀溶液的依数性》习题解答

习 题1. 什么叫稀溶液的依数性?难挥发性非电解质稀溶液的四种依数性之间有什么联系? 答 溶液的蒸气压下降、沸点升高、凝固点降低和渗透压力等性质只与溶质、溶剂微粒数的比值有关,而与溶质的本性无关,因为这类性质的变化规律只适用于稀溶液,所以统称为稀溶液的依数性。
难挥发性非电解质稀溶液的四种依数性之间关系密切,知道一种依数性则可以求出另一种依数性:b f B b f T T p Πb K K K RT∆∆∆==== 2.已知293.15K 时水的饱和蒸气压为2.338kPa ,若将5.00g 尿素[CO (NH 2)2]溶于100g 水中,试问该溶液的蒸气压为多少?解 尿素的摩尔质量M = 60g ·mol -1,溶液中H 2O 的摩尔分数为()-12-1-1100g18g mol H O 0.9855.00g 100g 60g mol 18g mol x ⋅==+⋅⋅ 尿素溶液的蒸气压为p = p 0 x (H 2O) = 2.338 kPa ×0.985= 2.303 kPa3. 将19.0g 某生物碱溶于100g 水中,测得此溶液的凝固点降低值△T f 为0.220K ,试求该生物碱的相对分子质量。
解 水的K f =1.86K ·kg ·mol -1,则-13-119.0g []=1.86K kg mol 1. 6110g mol 0.220K 0.100kgM ⋅⋅⨯=⨯⋅⨯生物碱 由计算结果可知,该生物碱的相对分子质量为1.61×103。
4. 什么叫渗透?渗透压力的定义是什么?渗透现象产生的条件是什么?答 溶剂分子通过半透膜进入溶液的自发过程称为渗透作用,简称渗透。
渗透压力:为维持只允许溶剂分子通过的半透膜所隔开的溶液与溶剂之间的渗透平衡而需要在溶液液面上施加的超额压力等于渗透压力。
产生渗透现象的条件:(1)必须有半透膜存在;(2)半透膜两侧相同体积的液体中溶剂分子数目不相等。
溶液的依数性

溶液的依数性溶液的依数性是说溶液的某些性质与溶质的粒子数的多少有关系,与溶质本性无关。
依数性分别用拉乌尔定律、沸点升高、凝固点降低和渗透压公式定量描述。
溶液的依数性所谓“依数性”顾名思义是依赖于数量的性质。
稀溶液中溶剂的蒸气压下降、凝固点降低、沸点升高及渗透压等的数值均与稀溶液中所含溶质的数量有关,这些性质都称为稀溶液的依数性。
1.蒸气压下降对二组分稀溶液,溶剂的蒸气压下降已如式(2-67)所述Δp=p*A-pA=p*AxB即Δp的数值正比溶质的数量—溶质的摩尔分数xB,比例系数即为纯A的饱和蒸气压p*A。
2.凝固点(析出固态纯溶剂时)降低稀溶液当冷却到凝固点时析出的可能是纯溶剂,也可能是溶剂和溶质一起析出。
当只析出纯溶剂时,即与固态纯溶剂成平衡的稀溶液的凝固点Tf比相同压力下纯溶剂的凝固点T*f 低,实验结果表明,凝固点降低的数值与稀溶液中所含溶质的数量成正比,比例系数kf叫凝固点下降系数它与溶剂性质有关而与溶质性质无关。
详细推导3.沸点升高沸点是液体或溶液的蒸气压p等于外压pex时的温度。
若溶质不挥发,则溶液的蒸气压等于溶剂的蒸气压p=pA,对稀溶液pA=p*AxA,pA<p*A,所以在p—T图上稀溶液的蒸气压曲线在纯溶剂蒸气压曲线之下,由图可知,在外压pex时,溶液的沸点Tb必大于纯溶剂羝液的沸点Tb必大于纯溶剂的沸点T*b,即沸点升高。
实验结果表明,含不挥发性溶质的稀溶液的沸点升高亦可用热力学方法推出,kb叫沸点升高系数。
它与溶剂的性质有关,而与溶质性质无关。
4.渗透压若在U形管中用一种半透膜把某一稀溶液和溶剂隔开,这种膜允许溶剂但不允许溶质透过。
实验结果表明,大量溶剂将透过膜进入溶液,使溶液的液面不断上升,直到两液面达到相当大的高度差时才能达到平衡。
要使两液面不发生高度差,可在溶液液面上施加额外的压力,假定在一定温度下,当溶液的液面上施加压力为∏时,两液面可持久保持同样水平,即达到渗透平衡,这个∏值叫溶液的渗透压。
稀溶液的依数性

稀溶液的依数性:当溶质溶解在溶剂中形成溶液后,溶液的蒸气压下降,沸点升高,凝固点降低及产生渗透压等性质,只与溶质中粒子的数目有关,而与溶质的本性无关。
由于这类性质的变化,只适用于稀溶液,故称之为稀溶液的依数性。
人工降雨:①根据开尔文公式RTlnPr/P0=2rVm/R’,最初生成的雨滴半径很小,所以其蒸气压很高,此时对平面液体过饱和度达4的水蒸气,对极小的水滴仍未达饱和,所以这个新的液构很难凝聚出来。
②而空气中的灰尘常会作为凝聚中心促使雨滴形成,若在这种水蒸气过饱和度已超过4的云层中,用火箭或撒入干冰提供凝聚中心,使凝聚水滴的曲率半径增大。
由laplace方程,Ps=2Y/R’,其相应的饱和蒸气压变小,蒸汽会还原凝结成冰。
暴沸:①通常在液态有机物中,溶解的空气很少,在蒸馏过程中,液体中形成的蒸汽泡内壁是一个凹液面。
②根据开尔文公式RTlnPr/P0=2rVm/R’可知,凹面上的R’越小,小蒸汽泡内的蒸气压就越低,所以在相同温度下,小蒸汽泡的蒸气压比平面液体的P0低很多;此时液体内部产生气泡所承受的压力P’1=P大气+P平面+Ps,所以当T超过正常沸点时,液体内部的小蒸汽泡无法形成,溶液无法沸腾。
③继续加热,直至小气泡开始形成,气泡一旦形成后便不断变大。
由laplace公式,Ps=2Y/R’,随着R’增大,Ps下降,而P静在气泡上升阶段中不断下降,此时Ti>T正常,故此很容易产生暴沸现象。
盐碱地农作物枯死:①农作物的生长需要水分,然而盐碱地中盐碱浓度大,此时化学势UA 较低,农作物的中心浓度较盐碱地低,其化学式势UB>UA。
②由UB>UA,土地中的渗透压>农作物中的渗透压,农作物中的水分通过细胞壁渗透到土壤中,导致细胞枯萎。
分解电压:电解质在电极上分解生成电解产物所需施加的最小电压。
析出电压:当外加电压等于分解电压时两极的电极电位,是开始析出物质时所必须的最小析出电位。
电极极化的意义:电极上有电流通过时,就会有净反应发生,表明电极失去了原有的平衡状态,电极电位将偏离平衡电位。
第3章溶液与离子平衡习题

第3章溶液与离子平衡习题一、思考题1. 稀溶液有哪些依数性?产生这些依数性的根本原因是什么?答案:1)当溶质溶解在溶剂中形成溶液后,溶液的蒸气压下降、沸点升高、凝固点降低及产生渗透压等性质,只与溶液中溶质粒子的数目有关,而与溶质的本性无关。
由于这类性质的变化,只适用于稀溶液,故称为稀溶液的依数性。
2)根据拉乌尔定律,对于二组分稀溶液可以看出,加入非挥发性溶质B 以后,溶剂A 的蒸气压会下降,这是造成凝固点下降,沸点升高和渗透压的根本原因。
2. 说明稀溶液定律的适用条件。
答案:难挥发的非电解质稀溶液适用。
3. 将下列水溶液按照其凝固点的高低顺序排列:1 mol ·kg -1 NaCl ,1 mol ·kg -1 H 2SO 4,1 mol ·kg -1 C 6H 12O 6,0.1 mol ·kg -1 CH 3COOH ,0.1 mol ·kg -1NaCl ,0.1 mol ·kg -1 C 6H 12O 6,0.1 mo l ·kg -1 CaCl 2。
答案:溶液凝固点下降的程度与单位体积内溶质的微粒数有关,微粒数越多,凝固点下降值越大。
4. 在冬天抢修土建工程时,常用掺盐水泥沙浆,为什么?答案:降低水凝的凝固点。
5. 说明CaCl 2可用来作干燥剂的原理。
答案:CaCl 2是一种苏松的多孔性物质,吸收大气中的水蒸气后,降低了水蒸气的饱和蒸气压使得水蒸气易于液化。
6. 人体输液时,所用的盐水和葡萄糖溶液浓度是否可以任意改变?为什么?答案:不可以任意改变。
医疗上所用的盐水和葡萄糖溶液是等渗溶液,不能采用低渗溶液也不能采用高渗溶液,否则,会出现医疗上称之的质壁分裂或溶血现象。
7. 什么是溶液的渗透现象?渗透压产生的条件是什么?如何用渗透现象解释盐碱地难以生长农作物?答案:渗透现象是指溶液中的溶剂分子通过半透膜扩散的现象。
条件:必须有渗透膜且膜两边溶液的浓度不同。
考研农学门类联考《315化学》2021年考研真题库

考研农学门类联考《315化学》2021年考研真题库第1部分无机及分析化学第1章溶液和胶体一、选择题1饮用水中残留的质量浓度不得超出2×10-6g·mol-1,与此相当的的质量摩尔浓度约为()。
A.B.C.D.【答案】B查看答案【解析】因溶液极稀,密度2已知水的凝固点下降常数,若的AB 水溶液的凝固点是-0.0186℃,则AB分子的离解度为()。
A.100%B.99%C.1.0%D.0.0%【答案】D查看答案【解析】由凝固点下降公式得,b=0.0186℃/1.86K·kg·mol -1=0.01mol·kg-1。
由此可见AB并没有在水中解离。
3果糖、葡萄糖(Ⅱ)、蔗糖(Ⅲ)三种水溶液,溶质的质量分数均为0.01,则三溶液渗透压大小的关系是()。
A.B.C.D.【答案】B查看答案【解析】由公式可知,渗透压与溶液中溶质的物质的量浓度有关。
溶液中溶质的质量相等,相同质量分数的溶质的分子量越大,则渗透压越小。
果糖与葡萄糖的分子量相等,而蔗糖的分子量最高,所以渗透压最小,因此答案选B。
4将0℃的冰放进0℃的盐水中,则()。
A.冰-水平衡B.水会结冰C.冰会融化D.与加入冰的量有关,因而无法判断将发生何种变化【答案】C查看答案【解析】将0℃的冰放进0℃的盐水中,虽然温度还是0℃,但是盐水中溶质的质量摩尔浓度降低了,盐水的凝固点下降了,冰在盐水中的溶解和凝固过程不再平衡,冰会融化。
5蔗糖、葡萄糖各10g,分别溶入100g水中,成为A、B两溶液。
用半透膜将两溶液隔开,则()。
A.A中水渗入BB.B中水渗入AC.没有渗透现象D.以上情况都可能【答案】A查看答案【解析】由于蔗糖的相对分子量大于葡萄糖的相对分子量,所以相同质量的蔗糖和葡萄糖,n(葡萄糖)>n(蔗糖),又c=n/V,所以c(葡萄糖)>c(蔗糖)。
根据公式可知,葡萄糖一侧的渗透压高于蔗糖一侧的渗透压,因此,A中水渗入B中。
多组分溶液热力学复习题
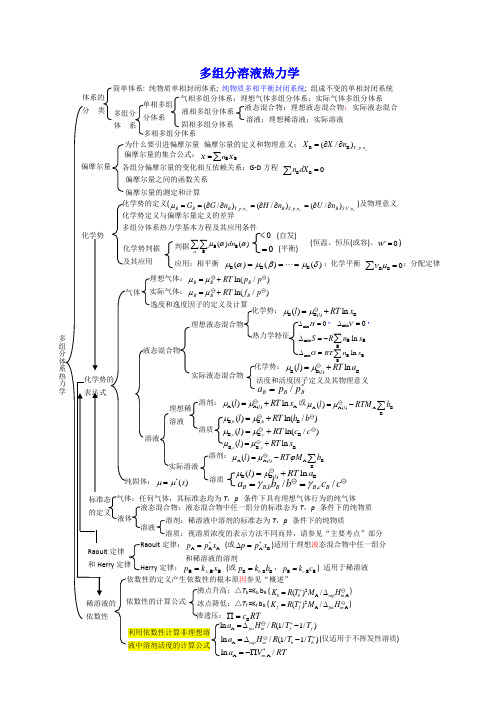
多组分溶液热力学; 组成不变的单相封闭系统液态混合物:理想液态混合物;实际液态混合溶液:理想稀溶液;实际溶液因参见“概述”B c RT ∏=T b =K b b B (2A ,A ()/b b vap m K R T M H *=∆)T f =K f b B (2A,A()/fffusm K R T M H *=∆)A /(1/1/)fus m f f a H R T T *=∆-A ,A /m a V RT*=-∏ A /(1/1/)vap m b b a H R T T *=∆-(仅适用于不挥发性溶质)Raoult 定律:p p x *= (或AB p p x *∆=)适用于理想液态混合物中任一组分(或B ,B B b p k b =,B ,B B c p k c =) 适用于稀溶液B B ,,(/)CT p n X X n =∂∂B B XG-D 方程 BB0n dX=∑化学势多组分体系热力学基本方程及其应用条件 ,,,,,,)(/)(/)C C CB T p n B S p n B S V n H n U n =∂∂=∂∂)及物理意义化学势判据B B B ()()()μαμβμδ==⋅⋅⋅=;化学平衡BB 0νμ=∑;分配定律B )()dn α(恒温、恒压(或容)、0W '=)0= (平衡)0 (自发)ln(/)B f pln(/)B p pA A()A ()ln l l RT x μ=+或A A()ABB()l l RTM bμμ=-∑B,B,B ()ln(/)c c l RT c c μ=+B,B,B ()ln x x l RT x μ=+B,B,B ()ln(/)b b l RT b b μ=+A A()A BB()l l RT M bμμϕ=-∑B B()B ()ln l l RT a μμ=+,,//B B b B B c B a b b c cγγ==化学势:B B()B ()ln l l RT a μμ=+ 活度和活度因子定义及其物理意义/B B B a p p *=化学势:B B()B ()ln l l RT x μμ=+热力学特征 mixB B B ln S R n x ∆=-∑mix 0H ∆=,mix 0V ∆=,mix B BBln G RT n x ∆=∑标准态 液体 液态混合物:液态混合物中任一组分的标准态为T ,p 条件下的纯物质溶剂:稀溶液中溶剂的标准态为T ,p 条件下的纯物质溶质:视溶质浓度的表示方法不同而异,请参见“主要考点”部分气体:任何气体,其标准态均为T ,p 条件下具有理想气体行为的纯气体一、选择题1. A,B,C 三种物质组成的溶液,物质 C 的偏摩尔量为 (a)()A BC ,,,T p n n n μ∂∂ (b)()A BC ,,,T p n n G n ∂∂(c)()A B A ,,,T v nn A n ∂∂ (d)()A BC ,,,T s nn H n ∂∂(答案) b (什么叫偏摩尔量(P 165-166)偏摩尔量具有哪些性质和特点。
溶液的沸点升高及凝固点降低公式的简便推导

溶液的沸点升高及凝固点降低公式的简便推导当溶液中添加其他分子时,溶液的沸点会升高,而凝固点会降低。
这是因为溶液中的分子可以与溶液中的固体分子结合,这会使溶液的粘度增加,从而使溶液的沸点升高,而凝固点则降低。
这种现象可以用公式来表示:ΔTb = Kb · m · (i - 1)ΔTf = Kf · m · (i - 1)其中,ΔTb表示溶液的沸点升高量,ΔTf表示溶液的凝固点降低量,Kb和Kf分别表示溶液的沸点升高常数和凝固点降低常数,m表示溶质的质量浓度,i表示溶质的分子量比较系数。
公式的推导过程如下:首先,我们考虑沸点升高的原因。
溶液的沸点升高是因为加入的分子会增加溶液的粘度,使得溶液更难沸腾。
这种现象可以用动能平衡公式来表示:ΔHvap = ΔU + Δ(PV)其中,ΔHvap表示溶质汽化所需的热量,ΔU表示溶质固体和液体之间的热力学变化量,Δ(PV)表示溶质汽化时所发生的动能变化量。
根据柯尔定律,Δ(PV)与Δ(PV)与溶液的粘度成反比。
因此,当溶液的粘度增加时,Δ(PV)会减小,这会使ΔHvap增加。
因此,溶液的沸点会升高。
类似地,溶液的凝固点降低是因为加入的分子会增加溶液的粘度,使得溶液更难凝固。
这种现象可以用动能平衡公式来表示:ΔHfus = ΔU + Δ(PV)其中,ΔHfus表示溶质凝固所需的热量,ΔU表示溶质固体和液体之间的热力学变化量,Δ(PV)表示溶质凝固时所发生的动能变化量。
根据柯尔定律,Δ(PV)与溶液的粘度成反比。
因此,当溶液的粘度增加时,Δ(PV)会减小,这会使ΔHfus减小。
因此,溶液的凝固点会降低。
最后,我们将上述结论用公式表示出来:ΔTb = Kb · m · (i - 1)ΔTf = Kf · m · (i - 1)其中,ΔTb表示溶液的沸点升高量,ΔTf表示溶液的凝固点降低量,Kb和Kf分别表示溶液的沸点升高常数和凝固点降低常数,m表示溶质的质量浓度,i表示溶质的分子量比较系数。
《无极及分析化学》(第三版)第一章 课后习题答案详解

第1章思考题与习题参考答案一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C 3H8O3)溶液D. 尿素((NH2)2 CO)溶液解:选D。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液C. HAc溶液D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
由于纯化的Fe(OH)3溶胶具有这种聚结稳定性,从而可以存放数年而不聚沉。
多组分化学平衡习题

有下列方程组
解得:x=4.53×104 y=7.73×104 =4.53×104Pa =7.73×104Pa
(2)对溶液I:
(3)溶液I混合过程的△mixG为:
(4)溶液Ⅲ的组成为: nA=3mol nB=1十2十3=6mol
2.在293.15K时。乙醚的蒸气压为58.95kPa.若在100g乙醚中 溶人某非挥发性有机物质10g,乙醚的蒸气压降低到56.79kPa, 试求该有机化合物的摩尔质量。
3. 如果在水中加入少量的乙醇,则四个依数性将发生怎 样的变化,为什么有这样的变化?如果加 NaCl、CaCl2 则又怎样?
答:水中加入乙醇后,溶液蒸气压上升,沸点下降。 冰点仍是下降,渗透压仍存在。这是由于乙醇是挥发性 的,并且挥发性又很大。但乙醇水溶液凝固时,析出的 固态仍是纯冰。如果溶入 NaCl,由于每个分子完全电 离成二个粒子,则蒸气压降低,沸点升高,所呈依述性 数值加倍,如溶入 CaCl2,则近似增加三倍。
8.海中的水生生物有的可能有数百公尺长,而陆地 上植物的生长高度有一定限度,试解释其原因。
解:陆地上生长的植物靠渗透压将水分运送至植物 的顶部,因细胞中的溶度浓度有一定限度,因而限 制了植物的生长高度。海中的植物可从其周围的海 水中吸收水分和营养,所以能长得很长。
选择题
1. 在373.15K和101325Pa•下水的化学势与水蒸气
3. 影响沸点升高常数和凝固点降低常数值的主要因素是 (A) 溶剂本性 (B) 温度和压力
(C)溶质本性 (D) 温度和溶剂本性 答案:A。由沸点升高常数
可以看出。 4. 在等质量的水、苯、氯仿和四氯化碳中分别溶入100g
非挥发性物质B,已知它们的沸点升高常数依次是0.52,
2.6, 3.85, 5.02,溶液沸点升高最多的是 (A) 氯仿 (B) 苯 (C) 水 (D)四氯化碳
无机化学03非电解质稀溶液的依数性

Ⅱ
7
渗透压在医学上的意义
9.0 g.L-1 NaCl 等渗溶液
5.0 g.L-1 NaCl 低渗溶液
15 g.L-1 NaCl 高渗溶液
Ⅲ
8
渗透压在医学上的意义
晶体渗透压和胶体渗透压
生物体液的渗 透压
(769.8kPa)
无机盐、葡萄
晶体渗透压(766kPa) 糖、氨基酸等 (由晶体物质产生) 小分子物质(1L
血浆含7.5g)
胶体渗透压(3.8kPa) 蛋白质、多糖
(由胶体物质产生)
、脂质等高分 子物质(1L血浆
含70g)
9
细胞
自由通过 水分子
细胞内液 细胞外液
晶体物质 胶体物质
晶体渗透压起决定作用!
4
例:计算18.7 g·L-1乳酸钠(M=112)溶液的渗透 浓度。并判断该溶液属于临床上的等渗、高渗还是 低渗溶液?
解:c = 18.7÷112×1000×2 = 334 mmol·L-1 334 mmol·L-1接近320 mmol·L-1,又因为
乳酸钠溶液的实际粒子活度略小于2,所以该溶液 仍然属于临床上的等渗溶液。
无机化学03非电解质稀溶液 的依数性
2
第三章 非电解质稀溶液的依数性
溶液的依数性
蒸气压下降 沸点升高 凝固点降低 渗透压
依数性的应用
3
什么是非电解质稀溶液?
溶液? 非电解质溶液? 稀溶液?
4
溶液的依数性
依数性
非电解质稀溶液的某些性质的大小只决定于溶 质的浓度而与溶质的本性无关,即只依赖于溶质粒 子的数目,称为依数性。包括溶液的蒸气压下降, 沸点升高,凝固点降低和渗透压。
根据公式
,则:
4.2.2 稀溶液的沸点升高和凝固点降低

稀溶液的沸点和凝固点
蒸气压
纯溶剂
固相 凝固点降低
稀溶液 沸点升高
温度
稀溶液的沸点和凝固点
拉乌尔定律
溶液的沸点升高值 凝固点下降值
ΔTbp = Kb∙bB ΔTfp = Kf∙bB
Kb:溶剂的摩尔沸点升高常数 Kf :溶剂的摩尔凝固点下降常数 bB:溶液的质量摩尔浓度
稀溶液的沸点和凝固点
拉乌尔定律
溶液的沸点升高值 凝固点下降值
ΔTbp = Kb∙bB ΔTfp难挥发非电解质的稀溶液
ΔTbp和ΔTfp与溶质的浓度有关,与溶质的本性无关
Kb和Kf与溶剂的本性有关
由于同一溶剂的Kf大于Kb,因此相同浓度溶液的凝 固点降低较沸点升高更明显
实际应用
ΔTbp = Kb∙bB = 2.1 oC ΔTfp = Kf∙bB = 7.5 oC
Tbp= 100 + 2.1 = 102.1 oC Tfp= 0 − 7.5 = −7.5 oC
实际应用
溶液的质量摩尔浓度溶液的沸点升高值拉乌尔定律稀溶液的沸点和凝固点溶液的沸点升高值fp的计算仅适用于难挥发非电解质的稀溶液fp与溶质的浓度有关与溶质的本性无关因此相同浓度溶液的凝固点降低较沸点升高更明显实际应用例题
4.2.2 稀溶液的沸点升高 和凝固点降低
沸点 (boiling point)
蒸气压 / mmHg
800 34.6 oC 760
乙醚
600
78.3 oC
乙醇
100 oC
水
400
200
0 20 40 60 80 100 温度 / oC
沸点:液体的蒸气压与外界压力相等时的温度
凝固点 (freezing point)
5实验一凝固点降低法测分子量

实验一凝固点降低法测定溶质的摩尔质量一、目的要求1.根据稀溶液的依数性质,利用凝固点降低法测定非电解质溶质摩尔质量。
2.掌握SWC-Ⅱ型精密数字温度温差测量仪的使用方法。
二、实验原理将一不挥发、非电解质溶于某溶剂时,溶液上方溶剂的蒸气压会比纯溶剂的蒸气压低,导致溶液的沸点升高,凝固点降低,并导致产生渗透压。
对于稀溶液,这些物理量的变化仅仅与溶液中溶质的质点的数目有关,而与溶质的本性无关,故称这些性质为稀溶液的“依数性”。
在纯溶剂中加入不挥发非电解质后,形成二组分溶液。
设纯溶剂的凝固点为Tf*,溶液的凝固点为Tf。
如果溶液很稀,溶液凝固时可认为是固态纯溶剂的化学势1S(T,p)和溶液中的溶剂的化学势1L(T,p,x1)相等,即:上式改写为::式中,Gm-液态纯溶剂凝固为固态纯溶剂时的摩尔吉布斯能变化。
对上式求微分,根据吉布斯-亥姆霍兹公式可得:式中,fusHm-纯溶剂的摩尔熔化焓。
对上式积分,得:由于Tf*和Tf相差不大,可将fusHm看着常量设:Tf= Tf*Tf,Tf*Tf (Tf*)2,稀溶液时(x2很小),将对数项展开:则:(1-1)式中,Tf*-纯溶剂的凝固点,K;Tf-溶液的凝固点;ΔTf-溶液的凝固点降低值;nA-溶剂的物质的量,mol; nB-溶质物质的量;ΔfusHm-溶剂摩尔熔化焓,J/mol。
上式可改写成:(1-2)MA-溶质的摩尔质量,kg/mol;mB-溶液的质量摩尔浓度,mol/kg;Kf-溶剂的凝固点降低常数,Kmol-1kg,它是溶剂的特征常数,其数值只与溶剂的性质有关。
根据质量摩尔浓度的定义,由式(1-2)可得:,因此:(1-3)式中,WB-溶质的质量,kg;WA-溶剂的质量;MB-溶质的摩尔质量,kg/mol。
由式(1-3)可知,已知溶剂的Kf后,只要测得ΔTf即可计算MB。
一些常见溶剂的凝固点和凝固点降低常数列在表1-1中,其他溶剂的凝固点降低常数可在有关化学手册中查找。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
因此,溶液沸点升高和凝固点降低与溶质
的本性无关,只与其浓度有关。
应用: 计算溶液的沸点
计算溶液的凝固点
计算溶质的的摩尔质量(MA)
如果是以水作为溶剂的话,溶液的沸点就等于100+△Tb, 凝固点就等于0-△Tf 。
问:植物为什么表现出一定的抗旱性和耐寒性? 细胞液是溶液,溶液的蒸汽压下降(抗旱性)溶液的
溶液的渗透压:
•
一定温度下,为阻止渗透作用的进行,必须向溶液施加的
最小压力。这个压力就是渗透压,用П表示。
1886年,Vant Hoff(范特霍夫)提出:稀溶液 的渗透压与溶液的物质的量浓度和热力学温度成正 比,与溶质的本性无关。
c=b
蒸气压下降、沸点上升、凝固点降低和渗透压 都是难挥发非电解质稀溶液的通性;它们只与 溶剂的本性、溶液的浓度有关,与溶质的本性 无关。
凝固点降低(耐寒,不致冻冰冻坏)
冬天在汽车的水箱里加入甘油或乙二醇,可防止水箱结 冰。
2、渗透压-依数性之四
这种现象,称为渗透现象 【渗透】溶剂分子透过半透膜从纯溶剂进入溶液,
或从稀溶液进入浓溶液的现象
2019/11/23
4
度不同
浓度不太高的溶液,定性分析依数性时, 一般认为:
A 同类物质的浓度越大,影响越大。
B 同一浓度的不同物质 强电解质 >弱电解质>非电解质
