二组分液液平衡系统相图ppt课件
合集下载
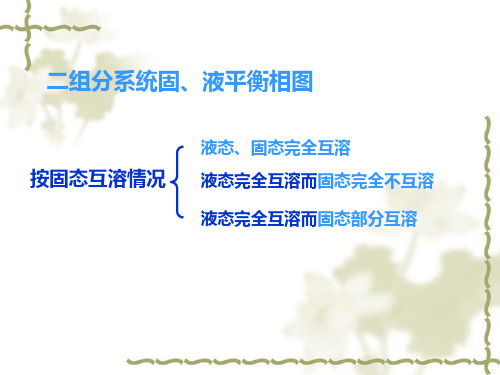
3.4 二组分系统固液平衡相图
t/℃
80
l(A+B)
•t
* B
液相线(凝固
60
点降低曲线)
• 40 t
* A
s(A)+l(A+B)
l (A+B)+sB
固相线
20 C
•E s(A)+s(B)
共晶线
D
(温度、三个相的
0.0 0.2 0.4 0.6 0.8 1.0 组成都不变)
邻硝基氯苯(A) xB
对硝基氯苯(B)
E点:液相能存在的
l+s s(A+B)
p/102kPa
t=60℃ l(A+B)
lg g(A+B)
d-香芹(A) wB
l-香芹(B)
图a 最高熔点液固相图
H2O(A)
yB
C2H5OH(B)
图b 最高恒沸点气液相图
2 液态完全互溶而固态完全不互溶
t/℃ 80
60
• 40 t
* A
20
C
•E
•t
* B
t/℃
•t
* A
p=101 325Pa
出的t-xB图,列表回答系统在5C,30C,50C时的
相数、相的聚集态及成分、各相的物质的量、系统所 在相区的条件自由度数。
解:
系统 相数
温度
t / C
5
2
相的聚集态 及成分
s (A), s (B)
30 2 s (B), l (A+B)
50 1
l (A+B)
各相的物量
ns(A) = 2 mol ns(B) = 8 mol
t
* B
l (A+B)
二组分液态部分互溶和完全不互溶系统液-气平衡相图精品PPT课件

液相组成 w[(NH4)2SO4] 0
0.167 0.286 0.375 0.384 0.411 0.422 0.438 0.458 0.479 0.498 0.518
固相
冰 冰
冰 冰
冰+(NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4
3.固态部分互溶的二组分凝聚系统相图
(1) 系统有一低共熔点
在相图上有三个单相区: AEB线以上,熔化物(L) AJF以左, 固溶体(1) BCG以右,固溶体 (2) 有三个两相区: AEJ区, L +(1) BEC区, L + (2) FJECG区,(1)+ (2)
AE,BE是液相组成线;AJ,BC是固溶体组成线;JEC线 为三相共存线,即(1)、(2)和组成为E的熔液三相共存,E点 为(1)、(2)的低共熔点。
8杠杆规则及其应用bbbb??????????mmmm???得bbbb??????mm????aobb??b?b??m?m?得杠杆规则bbbb?????mm?????设m为质量为质量分数1
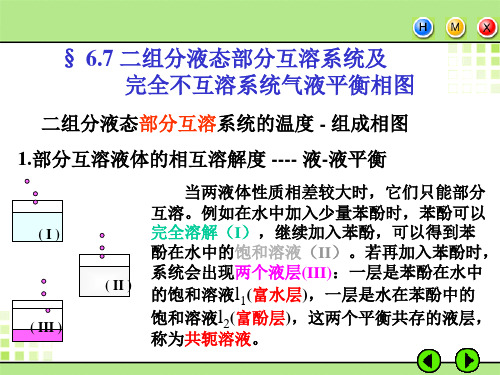
§6.4 二组分液态部分互溶和完全不互 溶系统液-气平衡相图
1. 液体的相互溶解度
彼此互相饱和的两溶液,称为共轭溶液 6.7p.2影二响组不分大液,态通部常分是互T溶-x图系—统—的溶气解一度液曲平线衡相图
MN:三相平衡线
§6.5 绘制二组分凝聚系统相图的方法
1.热分析法(适用于熔点高的二元合金相图绘制)
原理:当系统缓而均匀地冷却时,若系统内无相 的变化,则温度将随时间而均匀地改变,即在T-t 曲线上呈一条直线,若系统内有相变化,则因放 出相变热,使系统温度变化不均匀,在T-t 图上 有转折或水平线段,由此判断系统是否有相变化。
4.3 二组分气-液平衡体系

五、完全不互溶双液体系--水蒸气蒸馏
如果两种液体在性质上差别很大,它们间 的相互溶解度很小,这样的体系可看作完全 不互溶的双液系。在这种体系中任一液体的 蒸气压与同温度单独存在时完全一样,并与 两种液体存在的量无关。溶液的总蒸气压等 于两纯组分饱和蒸气压之和。
即:
p p p
* A
* B
不管其相对数量如何,体系的总蒸气压P 大于任一纯组分的蒸气压,因此体系的沸点 必然低于任一液体的沸点。
(三)理想液态混合物的 p-x -y图
若将P=P*A+(P*B-P*A)xB 代入PyB=P*BxB 可得
Px yB * PA ( P P ) xB
* B B * * B A
(xA= 1-xB)
(yA =1-yB)
据此可以分别求得气相和液相的组成。 气相线总是在液相线的下面(见图)
这是 p-x 图的一种,把液相组成 x 和气相组成 y 画在 同一张图上即得 p-x-y 图
(一)产生正负偏差不大的体系
pB p B xA 如图所示,是对拉乌 yB p p 尔定律发生正偏差的情
* B
况,虚线为理论值,实 线为实验值。真实的蒸 气压大于理论计算值。 当正负偏差较小时,溶液 的总蒸气压介于两个纯组 分蒸气压之间。
如:CCl4-环己烷,CCl4-苯
一般偏差体系: p T一定
,
PB= P*BxB)
pA p xA yA p p
A B
pB p xB yB p p
y A p .x A y B p .xB
y A p .x A 若纯液体 B比纯液体A易挥发, y B p .xB 亦即p *> p *,则:
B A
第6章 二组分液态部分互溶系统及完全不互溶系统气液平衡相图
不变,但三相的数量却在改变,状态 L1 和 L2的两个液相量按
线段长度 GL2与 L1G的比例蒸发 t g
p=101.325kPa
成状态 G 的气相。
Q
d
因系统点 b 位于 G 点左侧 L1G线段上,在产生气相之前 L1 和 L2两液相的质量之比为线段 bL2和 L1b长度之比:
m( L1) bL2 m( L2 ) bL1
或 Δm(α) [wB (γ ) wB (α)] Δm( β ) [wB ( β ) wB (γ )]
及 Δm(α) Δm( β) Δm(γ) 0
Δm(α) wB ( β ) wB (γ ) Δm(γ ) wB ( β ) wB (α)
Δm( β ) wB (α) wB (γ ) Δm(γ ) wB ( β ) wB (α)
又为另一液层的饱和蒸汽压。即气相与两个液
L2
相均平衡,而这两个液相相互平衡。
根据这三相组成的关系,可将部分互溶系统气-液平衡的温 度 - 组成图分为两类:
3.部分互溶系统的温度 - 组成图
(1)气相组成介于两液相组成之间的系统
t
P
92
L1 0M A
p=101.325kPa
Q
G L2
wB/%
N 100 B
当系统由a 升温到L2´时,两个
共轭液相的相点分别沿 L1 L1´ 和 L2 L2´ 变化,两液相的质量 也不断变化,富水层减少,富酚层逐渐增加。在 L2´富水层状 态为L1´ ,然后富水层消失,只剩一个富酚层。此为第一种类 型。
t
p=const. be
C
LL11’´
L2’´ l
第二种类型为系统点在ce 线 左侧,升温过程中相变化的分析 与上类似,只是升到 MC 线时是 富酚层消失,只剩下富水层。
6-2二组分系统理想液态混合物的气—液平衡相图

二组分系统液态互溶情况:
(a)完全互溶
(b)完全不互溶 (c)部分互溶
液态完全互溶系统 p-x、t-x图
理想系统 真实系统
一般正偏差 最大正偏差
一般负偏差 最大负偏差
液态部分互溶系统 t-x图
气相组成介于两液相之间 气相组成位于两液相同侧
液态完全不互溶系统 t-x图
完全互溶系统:理想液态混合物系统气-液平衡相图
1. 压力—组成图
A、B形成理想液态混合物:均符合拉乌尔定律
A组分分压: pA pA* xA pA* 1 xB
B组分分压: pB pB* xB
pA,pB,p和xB均成
气相总压: p pA pB
直线关系
pA* 1 xB pB* xB
pA* pB* pA* xB
液相线:气相总压 p 与液相组成 xB 之间的关系曲线
nL
解: (1) 先确定系统点的总组成
xM
nB nA nB
6 46
0.6
利用
nG (xM yB ) nL (xB xM ) 即 nG (0.6 0.2) nL (0.7 0.6) (1)
nG nL n总 =4+6=10mol (2)
解得
nG =2mol
nL =8mol
(2) 气相中: 甲苯 nB nG yB 2 0.2 0.4mol 苯 nA nG yA 2 0.8 1.6mol
(4)最大负偏差系统
p实际 p理想
且在某一组成范围内比 难挥发组分的饱和蒸气 压还小,实际蒸气总压 出现最小值
液相线
氯仿(A)—丙酮(B)系统
加上气相线:
一般正偏差系统
一般负偏差系统
最大正偏差系统
液相线 气相线
(a)完全互溶
(b)完全不互溶 (c)部分互溶
液态完全互溶系统 p-x、t-x图
理想系统 真实系统
一般正偏差 最大正偏差
一般负偏差 最大负偏差
液态部分互溶系统 t-x图
气相组成介于两液相之间 气相组成位于两液相同侧
液态完全不互溶系统 t-x图
完全互溶系统:理想液态混合物系统气-液平衡相图
1. 压力—组成图
A、B形成理想液态混合物:均符合拉乌尔定律
A组分分压: pA pA* xA pA* 1 xB
B组分分压: pB pB* xB
pA,pB,p和xB均成
气相总压: p pA pB
直线关系
pA* 1 xB pB* xB
pA* pB* pA* xB
液相线:气相总压 p 与液相组成 xB 之间的关系曲线
nL
解: (1) 先确定系统点的总组成
xM
nB nA nB
6 46
0.6
利用
nG (xM yB ) nL (xB xM ) 即 nG (0.6 0.2) nL (0.7 0.6) (1)
nG nL n总 =4+6=10mol (2)
解得
nG =2mol
nL =8mol
(2) 气相中: 甲苯 nB nG yB 2 0.2 0.4mol 苯 nA nG yA 2 0.8 1.6mol
(4)最大负偏差系统
p实际 p理想
且在某一组成范围内比 难挥发组分的饱和蒸气 压还小,实际蒸气总压 出现最小值
液相线
氯仿(A)—丙酮(B)系统
加上气相线:
一般正偏差系统
一般负偏差系统
最大正偏差系统
液相线 气相线
物理化学课件二组分相图相图解读

2
压力-组成图(p~ xB图)
设组分A和B形成理想液态混合物(见图). 气-液平衡时蒸气总压p与液相组成xB的关系: 在温度T下两相平衡时, 由拉乌尔定律
* * xB pA pA xA , pB pB
T一定
g p y A yB pA pB xA xB l
•理想液态混合物的 气 - 液平衡
A和B均满足 pB = p*B xB
t 一定 p
p
l (A+B) M
* B
nGxG + nLxL = (nG + nL) xM 得
L 总 nG n n B B B
L
G
nL xG xM MG 推导 nG xM xL LM
B 既是系统点又是相点
A
xL xM xG nL nM nG
xB
7
• 实际混合物中苯(B)和甲苯(A)双液系的性质接近理想 混合物, 在79.7 ℃下实测 压力-组成 数据如下:
液相组成 xB 0 0.1161 0.2271 0.3383 0.4532 0.5451 0.6344 0.7327 0.8243 0.9189 0.9565 1.000
8
相点
系统点
液相线
• 点, 线, 区的含义 及各状态下自由 度数; • 会读系统总组成 g p 与相组成 ; yA yB pA pB 气相线 xA xB 相点 l
T一定
结线 •理想液态混合物的 气 - 液平衡
蒸气压组成相图 A和B均满足 pB = p*B xB
9
2. 温度-组成图(T~ xB图)
在恒压下表示二组分系统气-液平衡时的温度和
组成的关系. 根据实验数据可以作出T~x图(包括气相线和液 相线). 例如:苯~甲苯的T~x图如下:
物理化学课件二组分相图相图

* A A
气相线(p~y图) 将气相线与液相线画在同一张图上得:
6
系统点
p
相点
t 一定
l (A+B) M
L
G
• 系统点: 表示系统总状态 p (总组成)的点(例如M点); 结线 • 相点:表示各个相的状态的 点( 只有一个相时,系统点 就是相点) (例如L、G点).
* B
* pA
g (A+B)
• 结线: 两个平衡相点的连 结线。 相点
0.18 l A+B)
气相线
g(A+B)
0.12
0.06 g (A+B) 0.2 0.4 xB 0.6 0.8 1.0 B
p
* A
0.0 A
•H2O(A) - C3H6O (B)系统的压力-组成图
20
具有最大正偏差系统的压力-组成图 液相线和气相线在最高点处相切
1. 0 60 50
t =35 ℃
l L G
* f AB < f AA * f AB < f BB
•若纯组分有缔合作用, 在形成混合物后发生离解, 因分子数 增多而产生正偏差.
•混合时常有吸热及体积增大现象. 关于负偏差: •若两组分分子间的吸引力大于各纯组分分子间吸引力, 形成 混合物后, 分子就较难逸出液面而产生负偏差. * * f AB > f AA f AB > f BB
•若形成混合物后分子发生缔合, 因分子数减少而产生负偏差.
•混合时常有放热及体积缩小现象.
19
②. 压力-组成图
一般正偏差和一般负偏 差系统的压力-组成图 与理想系统的主要 差别是液相线不是直 线. 如: 统. 水和丙酮系
3.2 二组分系统气液平衡相图

LG
定温连结线
80
t
* B
xl,B
l(A+B)
60
0.0
0.0 0.2 0.4 0.6 0.8 1.0
C6H5CH3(A)
xB
C6H6 (B)
图3-10 C6H5CH3(A) - C6H6 (B)系统的 沸点-组成图
15
0.0 t/℃
120
t
* A
100
80
60
yB 0.2 0.4 0.6 0.8 1.0
p/102kPa
(2) 蒸气压‐组成曲线有极值
0.0 0.2 1. 0
t=60℃ 0.8
0.6
0.4
pA*
0.2
xB 0.4 0.6
l(A+B) lg
0.8 1.0 xB=0.92
蒸气压有极大值,
yB=xB,气相线与液相 线相切
左半支:yB > xB pB* 右半支:yB < xB
g(A+B)
0.0 0.0 0.2
若pB* > p > pA*, 则 yB > xB, yA < xA. 可知:
饱和蒸气压不同的两种液体形成理想液态混合物成气液平衡时, 两相的组成并不相同, 易挥发组分在气相中的相 对含量大于它在液相中的相对含量.
气-液平衡时蒸气总压p与气相组成yB的关系: 结合式 p = pA* + (pB* - pA* ) xB 和式 yB = pB*xB /p 可得
• 从相图分析恒温降压变化过程.
• 与纯物质在恒温下有一定的饱和蒸气压不同, 由于液相在 气化过程中组成不断变化(剩余难挥发性组分愈来愈多), 使得其平衡蒸气压不断下降, 因而存在相变压力区间. 5
二组分固态互溶系统液固平衡相图(共9张PPT)

• 11.2 三组分系统图解表示法
(1)等边三角形表示法
F=C-P+2=5-P
当Fmin=0 时,Pmax=5,最多可以 有五相共存
当 Pmin=1时, Fmax=4,这四个
变量是T、P和组成x1和x2
★ 等边三角形的三个顶点分别代 表纯组分A、B、C
★ 三条边则代表A-B、B-C、C-A 三个两组分系统
• 11.1 三组分系统相律分析
• 11.2 三组分系统图解表示法 • 11.3 三组分系统一对液体部分互溶的恒温液-液相图
★ 水与醋酸、氯仿与醋酸以任意 比例互溶,水与氯仿部分互溶。 ★ 共轭溶液:氯仿层、水层 ★ d→C过程分析:
连结线---实线、非平行线 会溶点---不是最高点、不止一
个
10 ★
生d→成C化过合程物分的析二:1组-分--凝l 聚系统相2图---α
3---β
2 三组分系统图解表示法
(1)等边三角形表4示-法--α+l 5---β+l 6--- α+β
F=C-P+2=5-P
111三三组组分分系系统统相液律-液分S平析1衡S相2-图-- α+β+l
2 三组分系统图解表示法
F=C-P+2=5-P 11 三组分系统液-液平衡相图 11 三组分系统液-液平衡相图
M g 2 S i(s) 1 1 0 2 C M g 2 S i(l) NaCl2H2O(s) 0 .15 CmNaCl(s)(m1)l
§6.11 三组分系统液-液平衡相图
• 11.1 三组分系统相律分析
§6.9 二组分固态互溶系统液固平衡相图
• 9.1 固态完全互溶系统
• 当Fmin=0 时9,.Pm2ax固=5,态最多部可以分有五互相溶共存系统
(1)等边三角形表示法
F=C-P+2=5-P
当Fmin=0 时,Pmax=5,最多可以 有五相共存
当 Pmin=1时, Fmax=4,这四个
变量是T、P和组成x1和x2
★ 等边三角形的三个顶点分别代 表纯组分A、B、C
★ 三条边则代表A-B、B-C、C-A 三个两组分系统
• 11.1 三组分系统相律分析
• 11.2 三组分系统图解表示法 • 11.3 三组分系统一对液体部分互溶的恒温液-液相图
★ 水与醋酸、氯仿与醋酸以任意 比例互溶,水与氯仿部分互溶。 ★ 共轭溶液:氯仿层、水层 ★ d→C过程分析:
连结线---实线、非平行线 会溶点---不是最高点、不止一
个
10 ★
生d→成C化过合程物分的析二:1组-分--凝l 聚系统相2图---α
3---β
2 三组分系统图解表示法
(1)等边三角形表4示-法--α+l 5---β+l 6--- α+β
F=C-P+2=5-P
111三三组组分分系系统统相液律-液分S平析1衡S相2-图-- α+β+l
2 三组分系统图解表示法
F=C-P+2=5-P 11 三组分系统液-液平衡相图 11 三组分系统液-液平衡相图
M g 2 S i(s) 1 1 0 2 C M g 2 S i(l) NaCl2H2O(s) 0 .15 CmNaCl(s)(m1)l
§6.11 三组分系统液-液平衡相图
• 11.1 三组分系统相律分析
§6.9 二组分固态互溶系统液固平衡相图
• 9.1 固态完全互溶系统
• 当Fmin=0 时9,.Pm2ax固=5,态最多部可以分有五互相溶共存系统
物理化学课件二组分体系相图

假定 H vap m的值与温度无关,积分得:
lnp2 vapHm(11)
p1
R T1 T2
这公式可用来计算不同温度下的蒸气压或摩尔蒸发热。
6.2.2 Clapeyron方程
三条两相平衡线的斜率均可由Clausius-Clapeyron 方程或Clapeyron方程求得。
f * * = ( 3 - 1 ) - 1 + 0 = 1 ( X B )
d ) T = 4 5 0 ℃ , P = 1 5 0 P θ , 有 催 化 剂 , 发 生 反 应
投 料 比 : N 2 ∶ H 2 = 1 ∶ 3 R ’ = 1 f * * = ( 3 - 1 - 1 ) - 1 + 0 = 0
注意:
a ) 独 立 的 浓 度 限 制 条 件 ( 初 始 条 件 或 分 解 )
说明:不同物质在同一相中的浓度限制条件 R’=0 C a C O 3 ( s ) → C a O ( s ) + C O 2 ( g )
b ) 独 立 的 化 学 反 应 数 “ R ” 表 示
化 学 平 衡 时 , 平 衡 常 数 限 制 浓 度
d dT PV Sii,,m m
Si,m Vi ,m
Si,m Vi,m
相变摩尔熵 相变摩尔体积
Si,m
Hi,m T
得:
dP H i,m
Clapeyron equation 适用于纯物质两相
dT
TVi , m
平衡
6.2.2 Clapeyron方程
在一定温度和压力下,任何纯物质达到两相平 衡时,蒸气压随温度的变化率可用下式表示:
§ 6.1.1 基本概念
相(phase) 体系内部物理和化学性质完全均
二组分液液平衡系统相图讲义

W醇 7.81% W醇100.0
W醇8.4( 7g)
水-正丁醇溶解度图
二组分液液平衡系统相图
(2)当正丁醇的加入量为 25.0g时,系统的总组成为:
W 醇 %2.5 02.1 500.002% 0
此时系统的物系点为d,在液液两相平衡共存区内,共轭两 液相的相点为a和b,它们的组 成是水层中W醇%=7.81%;醇层 中W醇% =79.9%,由杠杆规则:
不断加入,l1 相会减少,l2 相的量
会增加。当总组成为 X 时 :
• 当体系的总组成为 X2 时,l1 相恰好消失。
• 如果继续加酚至组成为 b 时,则体系中只有一个水在酚 中的不饱和溶液相了。
二组分液液平衡系统相图
2.若某温度时有一组成为 d 的溶液,其状态点在ACB曲 线的外面,故此时只有一 个液相存在。
An
A"
T1
两相
313 D
C
E
0 0 .2 0 .4 0 .6 0 .8 1 .0
H 2 O 质量分数
C6H5NH2
H 2O -C 6H 5N H 2 的 溶 解 度 图
帽形区内两相共存
二组分液液平衡系统相图
一、部分互溶液体的相互溶解度 2.具有最低临界溶解温度
水-三乙基胺的溶解
度图如图所示。
343
二组分液液平衡系统相图
一、部分互溶液体的相互溶解度
1.具有最高临界溶解温度
D点:苯胺在水中的饱和溶解度 E点:水在苯胺中的饱和溶解度
温度升高,互溶程度增加
B点:水与苯胺完全互溶
T B 是最高临界溶解温度
DB线是苯胺在水中的溶解度曲线 EB线是水在苯胺中的溶解度曲线
T/K
453
W醇8.4( 7g)
水-正丁醇溶解度图
二组分液液平衡系统相图
(2)当正丁醇的加入量为 25.0g时,系统的总组成为:
W 醇 %2.5 02.1 500.002% 0
此时系统的物系点为d,在液液两相平衡共存区内,共轭两 液相的相点为a和b,它们的组 成是水层中W醇%=7.81%;醇层 中W醇% =79.9%,由杠杆规则:
不断加入,l1 相会减少,l2 相的量
会增加。当总组成为 X 时 :
• 当体系的总组成为 X2 时,l1 相恰好消失。
• 如果继续加酚至组成为 b 时,则体系中只有一个水在酚 中的不饱和溶液相了。
二组分液液平衡系统相图
2.若某温度时有一组成为 d 的溶液,其状态点在ACB曲 线的外面,故此时只有一 个液相存在。
An
A"
T1
两相
313 D
C
E
0 0 .2 0 .4 0 .6 0 .8 1 .0
H 2 O 质量分数
C6H5NH2
H 2O -C 6H 5N H 2 的 溶 解 度 图
帽形区内两相共存
二组分液液平衡系统相图
一、部分互溶液体的相互溶解度 2.具有最低临界溶解温度
水-三乙基胺的溶解
度图如图所示。
343
二组分液液平衡系统相图
一、部分互溶液体的相互溶解度
1.具有最高临界溶解温度
D点:苯胺在水中的饱和溶解度 E点:水在苯胺中的饱和溶解度
温度升高,互溶程度增加
B点:水与苯胺完全互溶
T B 是最高临界溶解温度
DB线是苯胺在水中的溶解度曲线 EB线是水在苯胺中的溶解度曲线
T/K
453
二组分理想液态混合物的气液平衡相图(共6张PPT)

的含量
• 6.2 精馏操作过程分析
精馏是多次蒸馏过程
x1>x2>x3 ---→纯A y1< y2/<y3 / --→纯B • 6.3 精馏操作的条件
蒸气总压介于两纯组分饱和蒸气压之 间
液相线—泡点,泡点线
(2)对比T-x图与p-x图
① p-x图中液相区在上,气相区在
下; T-x图则相反
② p-x图中液相线为直线,气相线
为曲线;T-x图中液相线和气相
线都为曲线
(3)a→b系统加热过程状态变化分析
易挥发组分在气相中的含量大于液相中的 含量
§6.5 二组分真实液态混合物的气-液平 衡相图
§6.4 二组分理想液态混合物的气-液
平衡相图
复习
• 4.1 二组分系统相律分析
温度-组成图:恒定压力下研究T、
• 4.2 压力-组成图
x、y之间关系
• 4.3 温度-组成图
气相线:表示液相蒸气总压与蒸气组 成关系的曲线
(1)气相线、液相线
液相线:表示液相蒸气总压与液相组
气相线—露点,露点线
成关系的曲线
一般正、负偏差的蒸气压-组成图中蒸气
总压仍然介于两纯组分饱和蒸气压之间,
而另一种情况则不然
§6.5 二组分真实液态混合物的气液平衡相图
• 5.1 真实液态混合物与理想
液态混合物的差别
• 5.2 蒸气压-组成图
• 5.3 压力-组成图
§6.5 二组分真实液态混合物的气-液 液态混合物的差别 • 5.2 蒸气压-组成图
• 5.3 压力-组成图
• 5.4 温度-组成图
恒沸点:沸腾时温度不变
特点—该点气相组成始终等于液相 组成
相律解释—C=S-R-R/=2-0-1=1,F=12+1=0
• 6.2 精馏操作过程分析
精馏是多次蒸馏过程
x1>x2>x3 ---→纯A y1< y2/<y3 / --→纯B • 6.3 精馏操作的条件
蒸气总压介于两纯组分饱和蒸气压之 间
液相线—泡点,泡点线
(2)对比T-x图与p-x图
① p-x图中液相区在上,气相区在
下; T-x图则相反
② p-x图中液相线为直线,气相线
为曲线;T-x图中液相线和气相
线都为曲线
(3)a→b系统加热过程状态变化分析
易挥发组分在气相中的含量大于液相中的 含量
§6.5 二组分真实液态混合物的气-液平 衡相图
§6.4 二组分理想液态混合物的气-液
平衡相图
复习
• 4.1 二组分系统相律分析
温度-组成图:恒定压力下研究T、
• 4.2 压力-组成图
x、y之间关系
• 4.3 温度-组成图
气相线:表示液相蒸气总压与蒸气组 成关系的曲线
(1)气相线、液相线
液相线:表示液相蒸气总压与液相组
气相线—露点,露点线
成关系的曲线
一般正、负偏差的蒸气压-组成图中蒸气
总压仍然介于两纯组分饱和蒸气压之间,
而另一种情况则不然
§6.5 二组分真实液态混合物的气液平衡相图
• 5.1 真实液态混合物与理想
液态混合物的差别
• 5.2 蒸气压-组成图
• 5.3 压力-组成图
§6.5 二组分真实液态混合物的气-液 液态混合物的差别 • 5.2 蒸气压-组成图
• 5.3 压力-组成图
• 5.4 温度-组成图
恒沸点:沸腾时温度不变
特点—该点气相组成始终等于液相 组成
相律解释—C=S-R-R/=2-0-1=1,F=12+1=0
双组份理想溶液的气液平衡相图(课堂PPT)

示混合液的沸点和与液相平衡的汽相组成y之间的关 系,此曲线称为饱和蒸气线。
2.图中红色线为气相线t-y(露点线):它表
示混合液的沸点和平衡液相组成x之间的关系,此曲 线称为饱和液体线。
两组分溶液的气液平衡相图
1、温度-组成图(t-x-y图)
三个区域:
液相区:蓝线以下区域 过热蒸气区:红线以上区域 气液共存区:红线和蓝线包围的区域
yxAA51
yA3 yA2
yA1
x(y)
1.0
当温度达到该溶液的露点TB,溶液全部 气化成为组成为 yA5= xf 的气相,最后 一滴液相的组成为 xA5。
2020/6/22
11
2020/6/22
12
2020/6/22
13
两组分溶液的气液平衡相图
2、气液平衡相图(y-x图)
在一定外压下,以y为纵坐标,以x为横坐标 ,建立气-液相平衡图,即y-x图,图中曲线 代表气液相平衡时的气相组成y与液相组成x 之间的关系。
差异越大,物系越易分离。
两组分溶液的气液平衡相图
1、温度-组成图(t-x-y图)
两条线 三个区域 两相区特点
2、气液平衡相图(y-x图)
相平衡曲线 相平衡曲线的特点
2020/6/22
17
2020/6/22
18
2020/6/22
19
化工单元操作
2020/6/22
谢谢观看
东明县职业中专
20
化学单元操作
2020/6/22
两组分溶液的气液平衡相图
东明县职业中专
1
两组分溶液的气液平衡相图
Contents
目录
1 温度-组成图(t-x-y图) 2 气液平衡相图(y-x图)
2.图中红色线为气相线t-y(露点线):它表
示混合液的沸点和平衡液相组成x之间的关系,此曲 线称为饱和液体线。
两组分溶液的气液平衡相图
1、温度-组成图(t-x-y图)
三个区域:
液相区:蓝线以下区域 过热蒸气区:红线以上区域 气液共存区:红线和蓝线包围的区域
yxAA51
yA3 yA2
yA1
x(y)
1.0
当温度达到该溶液的露点TB,溶液全部 气化成为组成为 yA5= xf 的气相,最后 一滴液相的组成为 xA5。
2020/6/22
11
2020/6/22
12
2020/6/22
13
两组分溶液的气液平衡相图
2、气液平衡相图(y-x图)
在一定外压下,以y为纵坐标,以x为横坐标 ,建立气-液相平衡图,即y-x图,图中曲线 代表气液相平衡时的气相组成y与液相组成x 之间的关系。
差异越大,物系越易分离。
两组分溶液的气液平衡相图
1、温度-组成图(t-x-y图)
两条线 三个区域 两相区特点
2、气液平衡相图(y-x图)
相平衡曲线 相平衡曲线的特点
2020/6/22
17
2020/6/22
18
2020/6/22
19
化工单元操作
2020/6/22
谢谢观看
东明县职业中专
20
化学单元操作
2020/6/22
两组分溶液的气液平衡相图
东明县职业中专
1
两组分溶液的气液平衡相图
Contents
目录
1 温度-组成图(t-x-y图) 2 气液平衡相图(y-x图)
4.4 两组分气液液相图
上部会溶点 上部会溶温度
系线(联结线)
CK 线 , C’K 线 : 溶解度随 温度的变化曲线称为 溶 解度曲线(雾点线)。
H2O(A)--i-C4H9OH(B)的液液平衡相图
返回章首
具有下部会溶点的 液液平衡相图
具有上部会溶点和下部 会溶点的液液平衡相图
水(A)--三乙胺(B)的液液相图
水(A)--烟碱(B)的液液相图
温度对溶解度影响的原因:Smix 0; 组分间存在氢键。
返回章首
2.气液液平衡 部分互溶系统的气液液平衡相图(类型1)
二元系的气液液相图
不同压力的二元系气液液相图
(2异丁醇(B)的气液液平衡相图
返回章首
wO
w L1
w
V
水(A)--异丁醇(B)的气液液平衡相图
D D O L D H V 11 2 W W WLL w w w w wO O D O D L H V 2 W W W w O w wLL11 W w
返回章首
部分互溶系统的精馏
wO
w L1
w
V
水(A)--异丁醇(B)的气液液平衡相图
两塔流程分离醇与水
返回章首
部分互溶系统的气液液 平衡相图(类型2)
完全不互溶系统的 二元气液液相图
H2O(A)--SO2(B)气液液相图
完全不互溶系统的二元气液液相图
返回章首
温度降至c点,开始凝结出纯B。 温度继续下降,纯 B 液体的量
4-4 两组分系统的气液液平衡相图
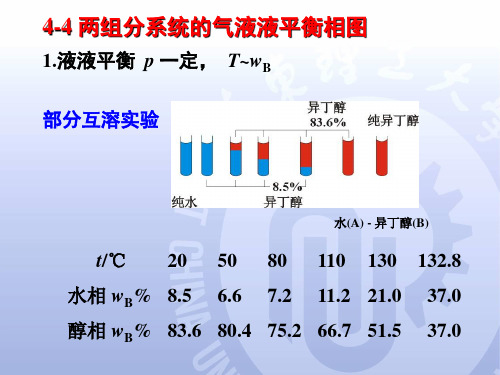
1.液液平衡 p 一定, T~wB 部分互溶实验
水(A) - 异丁醇(B)
t/℃
20
50
6.6
80
7.2
110
系线(联结线)
CK 线 , C’K 线 : 溶解度随 温度的变化曲线称为 溶 解度曲线(雾点线)。
H2O(A)--i-C4H9OH(B)的液液平衡相图
返回章首
具有下部会溶点的 液液平衡相图
具有上部会溶点和下部 会溶点的液液平衡相图
水(A)--三乙胺(B)的液液相图
水(A)--烟碱(B)的液液相图
温度对溶解度影响的原因:Smix 0; 组分间存在氢键。
返回章首
2.气液液平衡 部分互溶系统的气液液平衡相图(类型1)
二元系的气液液相图
不同压力的二元系气液液相图
(2异丁醇(B)的气液液平衡相图
返回章首
wO
w L1
w
V
水(A)--异丁醇(B)的气液液平衡相图
D D O L D H V 11 2 W W WLL w w w w wO O D O D L H V 2 W W W w O w wLL11 W w
返回章首
部分互溶系统的精馏
wO
w L1
w
V
水(A)--异丁醇(B)的气液液平衡相图
两塔流程分离醇与水
返回章首
部分互溶系统的气液液 平衡相图(类型2)
完全不互溶系统的 二元气液液相图
H2O(A)--SO2(B)气液液相图
完全不互溶系统的二元气液液相图
返回章首
温度降至c点,开始凝结出纯B。 温度继续下降,纯 B 液体的量
4-4 两组分系统的气液液平衡相图
1.液液平衡 p 一定, T~wB 部分互溶实验
水(A) - 异丁醇(B)
t/℃
20
50
6.6
80
7.2
110
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
p 影响不大,通常是T-x图——溶解度曲线
7
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
例如
在通常温度下将少量的酚加入水中时,开始酚是 完全溶解的。
如果继续往水里加酚,在浓度超过一定数值以后, 就不再溶解。
这时溶液中出现两个液层,这两个液层是部分互 溶的饱和溶液,即:
8
一、部分互溶液体的相互溶解度
• l2 的组成向 B 方向移动。
中国科学技术大学化
1
一、部分互溶液体的相互溶解度
如果升温,苯酚在水中的溶解度沿AC 线向上变化,水在苯酚中的溶解度沿 BC线向上变化,彼此的溶解度都增加。 如继续升温,则两层的组成逐渐接近, 最后汇集到C点,此时两层的浓度一样 而成单相溶液; 以C点以上,溶液成单相,自由度
• 连接 l1 和 l2 的线就是“结线”。
• 当体系的总组成(物系点)落在结线上时,体系两相共存。 • 且这两相的互比量(质量比)应遵守杠杆规则。
中国科学技术大学化
1
一、部分互溶液体的相互溶解度 •比如体系的总组成为 X 时,共轭溶液的组成分 别 为 X1 和 X2 , 而 这 两 个 相的互比量为:
中国科学技术大学化
1
2.若某温度时有一组成为 d 的溶液,其状态点在ACB曲 线的外面,故此时只有一 个液相存在。
• 如果将此溶液冷却,则当温度降 低到 50C时,体系的状态点正
好落在ACB曲线的 l1 上,此时体 系即将出现另一液相 l 2;
温度继续降低,共轭溶液的组成会随之变改:
• l1 的组成向 A 方向移动;
F K 1 2 11 2
表示在此温度以上,水与苯酚可以任意比例混溶而不分层,则C 点称为临界点,C点所对应的温度称为“最高临界溶解温度” 。
从上述图中可以看出:AC线相当于苯酚在水中的溶解度曲 线,BC线相当于水在苯酚的溶解度曲线
7.5%
71.2% 7.5%
71.2% 7.5%
71.2% 7.5%
10
一、部分互溶液体的相互溶解度
部分互溶液体的温度-组成图 • 根据相律,在温度和压力一定的情
况下,共轭溶液的组成是确定的。 因为这时自由度: f= C + 0 = 22 + 0 = 0 • 而在压力一定的条件下,共轭溶液 的组成将随温度的不同而改变,因 为这时,自由度:
71.2%<wB<100%
水的酚溶液
62.0%<wB<100% 50.0%<wB<100%
9
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
共轭溶液: T一定时,部分互溶的溶液浓度超过
一定范围,体系分层形成两个液相,当溶解达到 平衡时,这对彼此互相饱和的两个溶液。
◦ ① 酚在水中的饱和溶液; ◦ ② 水在酚中的饱和溶液。
中国科学技术大学化
1
如果继续往此体系中加酚,则两个 液相的组成仍然为 X1 和 X2,但这 两个液相的互比量变化。随着酚的
不断加入,l1 相会减少,l2 相的量
会增加。当总组成为 X 时 :
• 当体系的总组成为 X2 时,l1 相恰好消失。
• 如果继续加酚至组成为 b 时,则体系中只有一个水在酚 中的不饱和溶液相了。
【教学重点】 1. 部分互溶双液系统的相图
【教学难点】 1.水蒸气蒸馏原理
3
第四节 二组分气-液平衡系统相图
一、 拉乌尔定律及理想溶液 二、 气相组成与液相组成 三、 非理想溶液对理想溶液的偏差 四、 蒸馏与精馏原理
4
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度 当两种液体的性质差别较大时,可发生部分互 溶的现象,即在某温度范围内,两种液体的相互 溶解度都不大, 只有当一种液体的量很少,另一 种液体的量相对较多时,才能形成均匀的一相, 而在其它配比下,系统将分层而呈两个液相平衡 共存。此时将这两液相称为共轭溶液。
例如水(A)-苯酚(B): 在23.9℃及标准压力下,往水中逐渐加苯酚。
7.5%
0
7.5%
23.9 ℃ 0<wB<7.5%
酚的水溶液
50 ℃ 0<wB<11.5%
65 ℃ 0<wB<18.5%
71.2% 7.5%
71.2% 7.5%
71.2% 7.5%
7.5%<wB<71.2%
共轭溶液
11.5%<wB<62.0% 18.5%<wB<50.0%
5
Hale Waihona Puke 第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度 二、部分互溶液体的蒸馏 三、不互溶的液-液系统—水蒸气蒸馏
6
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
当两种液体性质上有明显的不同,体系的行 为比之理想溶液有很大的偏差时,会发生“部分互 溶”的现象,即一液体在另一液体中只有有限的溶 解度。
Wl1 l1X Wl2 l2X
或 :Wl 1 Xl2 Wl 2 Xl1
14
讨论
1. 在 50C 时,组成为 a 的溶液是酚在水中的不 饱和溶液。
• 如果在恒温度下往此溶液中加酚, 则体系的状态点(物系点) 将沿 a b 线向右移动;
当体系的总组成恰好落在ACB曲线上(即l1)时,体系中即 将出现组成为 X2 的另一液相 l2。
实用物理化学
1
目录图第表二章 相平衡
1 相律和相平衡的基本概念 2 单组分系统相平衡相图 3 二组分固-液平衡系统相图 4 气-液平衡系统相图 35 二组分液-液平衡系统相图 6 三组分平衡系统相图(自学)
2
第五节 二组分液-液平衡系统相图
【知识与能力目标】 1、理解部分互溶双液体系的相图 2、掌握水蒸气消耗系数及其物理意义
液相存在; • 自由度: f * = C +1 = 2 2 +1 = 1
(曲线ACB)
中国科学技术大学化
1
一、部分互溶液体的相互溶解度
在 50C 时,这两个相互 平衡的液相(即共轭溶液)
为l1 和 l2 ,其组成分别
为 X1 和 X2。
– X1 是酚在水中的饱和溶液组成;
– X2 是水在酚中的饱和溶液的组成。
f= C + 1 = 22 + 1 = 1 右图中即为水-酚体系在恒压下的温度-组成图。
11
一、部分互溶液体的相互溶解度
• 图中ACB曲线以外的区域是单 相区,只有一个液相,自由度: f = C +1 = 2 1 + 1 = 2
(黄色阴影面)
• 在ACB曲线以内的区域是两相区, • 在此区域内有两个相互平衡的
7
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
例如
在通常温度下将少量的酚加入水中时,开始酚是 完全溶解的。
如果继续往水里加酚,在浓度超过一定数值以后, 就不再溶解。
这时溶液中出现两个液层,这两个液层是部分互 溶的饱和溶液,即:
8
一、部分互溶液体的相互溶解度
• l2 的组成向 B 方向移动。
中国科学技术大学化
1
一、部分互溶液体的相互溶解度
如果升温,苯酚在水中的溶解度沿AC 线向上变化,水在苯酚中的溶解度沿 BC线向上变化,彼此的溶解度都增加。 如继续升温,则两层的组成逐渐接近, 最后汇集到C点,此时两层的浓度一样 而成单相溶液; 以C点以上,溶液成单相,自由度
• 连接 l1 和 l2 的线就是“结线”。
• 当体系的总组成(物系点)落在结线上时,体系两相共存。 • 且这两相的互比量(质量比)应遵守杠杆规则。
中国科学技术大学化
1
一、部分互溶液体的相互溶解度 •比如体系的总组成为 X 时,共轭溶液的组成分 别 为 X1 和 X2 , 而 这 两 个 相的互比量为:
中国科学技术大学化
1
2.若某温度时有一组成为 d 的溶液,其状态点在ACB曲 线的外面,故此时只有一 个液相存在。
• 如果将此溶液冷却,则当温度降 低到 50C时,体系的状态点正
好落在ACB曲线的 l1 上,此时体 系即将出现另一液相 l 2;
温度继续降低,共轭溶液的组成会随之变改:
• l1 的组成向 A 方向移动;
F K 1 2 11 2
表示在此温度以上,水与苯酚可以任意比例混溶而不分层,则C 点称为临界点,C点所对应的温度称为“最高临界溶解温度” 。
从上述图中可以看出:AC线相当于苯酚在水中的溶解度曲 线,BC线相当于水在苯酚的溶解度曲线
7.5%
71.2% 7.5%
71.2% 7.5%
71.2% 7.5%
10
一、部分互溶液体的相互溶解度
部分互溶液体的温度-组成图 • 根据相律,在温度和压力一定的情
况下,共轭溶液的组成是确定的。 因为这时自由度: f= C + 0 = 22 + 0 = 0 • 而在压力一定的条件下,共轭溶液 的组成将随温度的不同而改变,因 为这时,自由度:
71.2%<wB<100%
水的酚溶液
62.0%<wB<100% 50.0%<wB<100%
9
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
共轭溶液: T一定时,部分互溶的溶液浓度超过
一定范围,体系分层形成两个液相,当溶解达到 平衡时,这对彼此互相饱和的两个溶液。
◦ ① 酚在水中的饱和溶液; ◦ ② 水在酚中的饱和溶液。
中国科学技术大学化
1
如果继续往此体系中加酚,则两个 液相的组成仍然为 X1 和 X2,但这 两个液相的互比量变化。随着酚的
不断加入,l1 相会减少,l2 相的量
会增加。当总组成为 X 时 :
• 当体系的总组成为 X2 时,l1 相恰好消失。
• 如果继续加酚至组成为 b 时,则体系中只有一个水在酚 中的不饱和溶液相了。
【教学重点】 1. 部分互溶双液系统的相图
【教学难点】 1.水蒸气蒸馏原理
3
第四节 二组分气-液平衡系统相图
一、 拉乌尔定律及理想溶液 二、 气相组成与液相组成 三、 非理想溶液对理想溶液的偏差 四、 蒸馏与精馏原理
4
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度 当两种液体的性质差别较大时,可发生部分互 溶的现象,即在某温度范围内,两种液体的相互 溶解度都不大, 只有当一种液体的量很少,另一 种液体的量相对较多时,才能形成均匀的一相, 而在其它配比下,系统将分层而呈两个液相平衡 共存。此时将这两液相称为共轭溶液。
例如水(A)-苯酚(B): 在23.9℃及标准压力下,往水中逐渐加苯酚。
7.5%
0
7.5%
23.9 ℃ 0<wB<7.5%
酚的水溶液
50 ℃ 0<wB<11.5%
65 ℃ 0<wB<18.5%
71.2% 7.5%
71.2% 7.5%
71.2% 7.5%
7.5%<wB<71.2%
共轭溶液
11.5%<wB<62.0% 18.5%<wB<50.0%
5
Hale Waihona Puke 第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度 二、部分互溶液体的蒸馏 三、不互溶的液-液系统—水蒸气蒸馏
6
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
当两种液体性质上有明显的不同,体系的行 为比之理想溶液有很大的偏差时,会发生“部分互 溶”的现象,即一液体在另一液体中只有有限的溶 解度。
Wl1 l1X Wl2 l2X
或 :Wl 1 Xl2 Wl 2 Xl1
14
讨论
1. 在 50C 时,组成为 a 的溶液是酚在水中的不 饱和溶液。
• 如果在恒温度下往此溶液中加酚, 则体系的状态点(物系点) 将沿 a b 线向右移动;
当体系的总组成恰好落在ACB曲线上(即l1)时,体系中即 将出现组成为 X2 的另一液相 l2。
实用物理化学
1
目录图第表二章 相平衡
1 相律和相平衡的基本概念 2 单组分系统相平衡相图 3 二组分固-液平衡系统相图 4 气-液平衡系统相图 35 二组分液-液平衡系统相图 6 三组分平衡系统相图(自学)
2
第五节 二组分液-液平衡系统相图
【知识与能力目标】 1、理解部分互溶双液体系的相图 2、掌握水蒸气消耗系数及其物理意义
液相存在; • 自由度: f * = C +1 = 2 2 +1 = 1
(曲线ACB)
中国科学技术大学化
1
一、部分互溶液体的相互溶解度
在 50C 时,这两个相互 平衡的液相(即共轭溶液)
为l1 和 l2 ,其组成分别
为 X1 和 X2。
– X1 是酚在水中的饱和溶液组成;
– X2 是水在酚中的饱和溶液的组成。
f= C + 1 = 22 + 1 = 1 右图中即为水-酚体系在恒压下的温度-组成图。
11
一、部分互溶液体的相互溶解度
• 图中ACB曲线以外的区域是单 相区,只有一个液相,自由度: f = C +1 = 2 1 + 1 = 2
(黄色阴影面)
• 在ACB曲线以内的区域是两相区, • 在此区域内有两个相互平衡的
