水溶液中的酸碱平衡.
第五章水溶液中酸碱平衡和配位平衡-1

例2 纯苯的凝固点为5.40℃,0.322g萘溶于80g苯,配 制成的溶液的凝固点为5.24℃。已知苯的K凝值为5.12, 求萘的摩尔质量。
i c R T
Tb K b m i Tf K f m i
强电解质溶液浓度越低,越接近于“全部电离”?
强电解质溶液中的离子氛
溶解机理
离子氛
总结
稀溶液的依数性
• 只与溶液浓度有关,与溶质种类无关; 只与溶液浓度有关 与溶质种类无关; • 根本原因是溶液比纯溶剂蒸气压下降;
•桑拿为什么பைடு நூலகம்(缺氧)? 为什么夏天的雨天叫桑拿天?
• 凝固--温度降低,液体分子平均动能下降,分子间
滑动停止,失去流动性形成固体;发生凝固的温度 为该物质的凝固点;
• 熔化--温度升高,固体变成了液体;对应的温度为 该物质的熔点。 • 物质熔点的高低主要取决于物质内部微粒之间的 相互作用力--范德华力、氢键; • 升华--直接由固态变为气态的过程; • 凝华--气态分子也会撞击固体的表面并在其表面停
第5章 水溶液中的酸碱和配位平衡
上海交通大学化学化工学院 大学化学教研室
学习目标
• 了解水的结构和性质; • 掌握水的相图、稀溶液的依数性: 掌握水的相图 稀溶液的依数性 蒸汽压下降(水的饱和
蒸气压、相对湿度)、沸点升高、凝固点下降、渗透压
• 熟悉各种酸碱理论对于酸 熟悉各种酸碱理论对于酸、碱的定义及弱电解质解离 碱的定义及弱电解质解离 平衡的计算,能够用合适的公式计算各种体系的pH值; • 掌握缓冲溶液的组成、原理和计算; 掌握缓冲溶液的组成 原 和计算 • 熟练掌握各种体系下沉淀的生成、溶解及沉淀平衡的 移动; • 掌握配位化合物结构,简单认识配位平衡;
水溶液中的化学平衡及其影响因素

水溶液中的化学平衡及其影响因素水溶液中的化学平衡是指在溶液中各种化学物质之间的反应达到动态平衡的状态。
这种平衡状态是由溶质和溶剂之间的化学反应引起的,它涉及到溶解度、酸碱度和氧化还原等方面的因素。
本文将探讨水溶液中的化学平衡及其影响因素。
一、溶解度和溶解度积溶解度是指在一定温度下,溶质在溶剂中能够溶解的最大量。
溶解度受到温度、压力和溶质浓度的影响。
通常情况下,溶解度随着温度的升高而增加,但对于某些溶质来说,溶解度随温度的升高而减小。
压力对溶解度的影响较小,只有在气体溶解度较高的情况下才会有明显的影响。
溶质浓度对溶解度的影响较小,一般情况下不会引起明显的变化。
溶解度积是指在饱和溶液中,溶质的浓度与其离解产物的浓度的乘积。
溶解度积可以用来描述溶质在溶液中的溶解程度。
当溶解度积大于离子积时,会发生沉淀反应。
溶解度积受到温度的影响,一般情况下随温度的升高而增大。
二、酸碱度和酸碱平衡酸碱度是指溶液中酸碱物质的浓度。
酸碱度可以通过pH值来表示,pH值越低,溶液越酸;pH值越高,溶液越碱。
溶液中的酸碱度受到酸碱物质的浓度和性质的影响。
浓度越高,酸碱度越强;性质越强酸或强碱,酸碱度越大。
酸碱平衡是指溶液中酸碱物质之间的反应达到动态平衡的状态。
酸碱平衡的影响因素包括酸碱物质的浓度、温度和溶液中其他物质的存在。
当酸碱物质的浓度发生变化时,酸碱平衡也会发生改变。
温度对酸碱平衡的影响较大,一般情况下,温度升高会促进酸碱反应的进行。
三、氧化还原反应和氧化还原平衡氧化还原反应是指物质之间电子的转移反应。
在氧化还原反应中,氧化剂接受电子,而还原剂失去电子。
氧化还原反应的平衡受到氧化剂和还原剂之间的浓度、温度和pH值的影响。
浓度越高,氧化还原反应越容易进行;温度越高,氧化还原反应的速率越快;pH值的变化也会影响氧化还原反应的进行。
氧化还原平衡是指在溶液中氧化剂和还原剂之间的反应达到动态平衡的状态。
氧化还原平衡的影响因素包括氧化剂和还原剂的浓度、温度和pH值,以及溶液中其他物质的存在。
水溶液平衡知识点总结

水溶液平衡知识点总结一、酸碱平衡1. 酸碱的定义酸碱是化学中常见的概念。
根据布朗斯特德酸碱理论,酸是能够给出质子(H+)的物质,而碱是能够接受质子的物质。
根据路易斯酸碱理论,酸是能够接受电子对的物质,而碱是能够给出电子对的物质。
2. 酸碱中的pH值在水溶液中,pH值是描述酸碱性的指标。
pH值的定义是负对数形式的氢离子浓度,通常在0到14的范围内。
pH值小于7表示溶液是酸性的,而pH值大于7表示溶液是碱性的。
pH值等于7表示溶液是中性的。
3. 酸碱中的离子平衡在水溶液中,酸碱反应会导致离子的生成和消耗。
例如,强酸会把水分子中的质子释放出来,形成氢离子(H+),而碱会接受氢离子并形成氢氧根离子(OH-)。
酸碱中的离子平衡是描述溶液酸碱性质的重要概念。
4. 酸碱中的平衡常数酸碱中的平衡常数(Ka和Kb)是描述酸碱反应强弱的指标。
Ka是酸的解离常数,描述酸在水溶液中的解离程度。
Kb是碱的电离常数,描述碱在水溶液中的电离程度。
平衡常数越大,表示酸碱反应越倾向于向右进行。
二、络合平衡1.络合物的定义络合物是指由中心金属离子和一个或多个配体(通常是有机分子)形成的化合物。
络合物在生物体内发挥着重要的作用,比如血红蛋白中的铁离子和配体之间就形成了络合物。
2.络合物的平衡在络合反应中,络合物通常会形成动态平衡。
络合反应的平衡常数(Kf)描述了络合物的形成程度和平衡状态。
Kf越大,表示络合物的形成程度越高。
3.络合物的溶解度平衡络合物的溶解度平衡是描述络合物在水溶液中的溶解程度和稳定性的概念。
络合物的溶解度和离解程度会受到络合平衡和酸碱平衡的影响。
三、溶解度平衡1.溶解度的定义溶解度是描述固体在溶液中溶解的程度。
通常用溶解度积(Ksp)来表示。
Ksp是固体溶解度的平衡常数,描述了固体溶解在水溶液中的程度和平衡状态。
Ksp越大,表示固体溶解程度越高。
2.共沉淀与共沉淀平衡在溶解度平衡中,当两种离子在溶液中的产生共沉淀时,称为共沉淀反应。
酸碱滴定法

分析化学课件
水溶液中... 酸碱指示剂 酸碱滴定... 滴定终点... 应用与示例 非水溶液… 小 结
例 写出NaH2PO4液的质子条件式。
例:醋酸水溶液 按HAc: c = [HAc]+[Ac-] 按总H: c = [HAc] + [H+] – [OH-] [H+] 包括醋酸离解所得氢和水分子离解所得,水分子离解 的氢应从总氢中除去。 思考题: H3PO4 溶液, Na2HPO4 溶液
分析化学课件
水溶液中... 酸碱指示剂 酸碱滴定... 滴定终点... 应用与示例 非水溶液… 小 结
选好零水准,将所有得到质子后的产物写在等式的一端,所 有失去质子后的产物写在另一端,就得到质子条件式。 注意: 质子条件式中不出现零水准物质。
分析化学课件
水溶液中... 酸碱指示剂 酸碱滴定... 滴定终点... 应用与示例 非水溶液… 小 结
处理多元酸碱,对得失质子数多于1个的产物要加上得失质子的 数目作为平衡浓度前的系数。 例 H2CO3 质子条件式:
动 画
草酸分布系数与 溶液pH关系
分析化学课件
水溶液中... 酸碱指示剂 酸碱滴定... 滴定终点... 应用与示例 非水溶液… 小 结
1.3 质子条件式的计算 处于平衡状态的酸碱溶液中存在三种平衡: 电荷平衡、质量平衡、质子等衡。
1.3.1 电荷平衡 整个溶液电中性,故溶液中带正电荷的质点数应等于 带负电荷的质点数。
例 计算pH=5.00时,HAc和Ac-的分布系数。
水溶液中酸碱平衡和配位平衡

K K sp, AgCl
sp, AgI
C Ag
C C Cl
I
CCl CI
K
sp
(AgCl)
K
sp
(AgI)
2.1106
沉淀转化旳应用--永久硬度旳消除
CCa2 • CSO42 Q K sp
Q’<Ksp,溶解
+
Na2CO3 CO32 2Na
CCa2 • CCO32 Q K sp
K sp , Fe(OH)3
2.64 1039
K sp , Mg(OH)2
5.611012
Fe(OH)3开始沉淀
[OH ] 3
K sp , Fe(OH)3 [Fe3 ]
3
2.64 1039 0.1
2.981013 mol dm3
Fe(OH)3沉淀完全
[OH ] 3
K sp , Fe(OH)3 [Fe3 ]
1.42x1017 3.76x108, 0.01
pH=14+pOH=14+lg3.76x10-8=6.58,
阐明中性溶液会形成Pb(OH)2沉淀,所以配制Pb(NO3)2 溶液应加入少许酸。
• (2)要求溶液Pb2+浓度不大于10-10 mol dm-3,则处
理1 dm-3含0.01mol 少克NaOH?
乙二胺
氨基乙酸根 草酸根
乙二胺四乙酸根
单齿(基)配体和多基配体 • 单齿(基)配体:一种配体中有 一种原子与中心离子 形成配位键 • 多基配体:一种配体中有两个以上原子与中心离子 形成配位键,如乙二胺:
5.3.3溶度积规则——判断沉淀旳生成和溶解
Q CAm n • CBn m
K sp o [ Am ]n •[B n ]m
分析溶液中的酸碱反应与平衡

氧化还原反应:氧化还原反应的发 生会改变溶液中的氧化还原状态, 从而影响酸碱平衡
PART FIVE
酸碱滴定法:利用酸碱反应进行物质含量的测定 酸碱指示剂:利用酸碱反应指示溶液的酸碱性 离子选择电极:利用酸碱反应测量离子浓度 酸碱平衡与反应速率:酸碱平衡对化学反应速率的影响
酸碱中和反应 在化工生产中 的应用,如硫 酸生产、合成
当前研究重点:探索酸碱反应过程中的热力学性质,以及酸碱反应在生物和环境领域的应用
定义:利用量子力 学原理研究酸碱反 应的模型
目的:深入理解酸 碱反应的本质和机 理
发展历程:从早期 的经典酸碱理论到 现代的量子化学模 型的演变
应用领域:在化学 、生物学、医学等 领域有广泛的应用
汇报人:
酸度:表示溶液中氢离子浓度的负对数,常用pH值表示 酸碱度:表示溶液中氢离子和氢氧根离子浓度的比值,常用pOH值表示 酸碱指示剂:用于指示溶液的酸碱性,常用的有酚酞、甲基橙等 酸碱滴定法:通过滴定实验测定溶液的酸碱度,常用的有盐酸滴定法、氢氧化钠滴定法等
酸碱平衡的移 动方向取决于 反应物的浓度 和温度等因素
PART THREE
酸碱平衡是指在溶液中,酸和碱之间相互作用,使得溶液的pH值保持相对稳定的状态。
酸碱平衡是化学反应中的一种重要平衡,对于许多化学反应的进行和物质的稳定性都有重要 影响。
酸碱平衡的原理是建立在酸碱质子理论的基础上的,该理论认为酸和碱是通过质子转移来相 互作用的。
在酸碱平衡中,酸和碱的浓度会发生变化,以保持溶液的pH值稳定。这种变化是通过化学反 应来实现的。
,a click to unlimited possibilities
汇报人:
CONTENTS
PART ONE
化学平衡中的酸碱平衡和自动电离

化学平衡中的酸碱平衡和自动电离在化学反应中,酸碱平衡和自动电离是两个重要的概念。
酸碱平衡指的是酸和碱在水溶液中的相互转化过程,而自动电离则是指某些物质在溶液中自发地失去或得到电子的过程。
这两个概念在化学平衡中起着至关重要的作用。
酸碱平衡是指酸和碱在水溶液中的相互转化过程。
酸是能够释放出H+离子的物质,而碱则是能够释放出OH-离子的物质。
在水溶液中,酸和碱会发生中和反应,生成盐和水。
这个过程可以用化学方程式表示为:酸 + 碱→ 盐 + 水。
酸碱平衡的重要性在于它可以调节溶液的pH值,从而影响溶液中其他化学物质的性质和反应。
自动电离是指某些物质在溶液中自发地失去或得到电子的过程。
这些物质被称为电解质,它们能够在溶液中形成离子。
其中最常见的例子就是水的自动电离,即水分子自发地失去一个质子(H+离子)和一个氢离子(OH-离子),形成氢离子和氢氧根离子。
这个过程可以用化学方程式表示为:H2O ↔ H+ + OH-。
自动电离的程度可以用离子产生的浓度来衡量,通常用pH值来表示。
酸碱平衡和自动电离之间存在着密切的关系。
在水溶液中,酸和碱的反应会影响水的自动电离程度,从而改变溶液的pH值。
例如,当酸和碱的浓度相等时,溶液的pH值为中性,即pH=7。
当酸的浓度大于碱的浓度时,溶液呈酸性,pH值小于7;当碱的浓度大于酸的浓度时,溶液呈碱性,pH值大于7。
这种pH值的变化会对溶液中其他化学物质的性质和反应产生重要影响。
除了酸碱平衡和自动电离外,化学平衡中还存在其他重要的概念和现象。
例如,酸碱指示剂是一种能够根据溶液的pH值变化而改变颜色的物质。
常用的酸碱指示剂有酚酞、溴酚蓝等。
当溶液的pH值发生变化时,酸碱指示剂会发生颜色的变化,从而可以用来判断溶液的酸碱性。
此外,还有酸碱滴定、酸碱中和等重要的概念和实验方法。
总之,酸碱平衡和自动电离是化学平衡中的重要概念。
它们在溶液的pH调节、化学物质的性质和反应等方面起着至关重要的作用。
化学水溶液的三大平衡

化学水溶液的三大平衡哎呀,今天咱们聊聊化学水溶液的三大平衡,真的是个有趣的话题。
听起来有点高深,不过别担心,我会用简单的方式给大家讲明白。
水溶液,顾名思义,就是在水里溶解的东西。
想想你喝的饮料,不就是水加上各种好东西吗?不过呢,水溶液可不是随随便便的,它里面有一些神奇的平衡,像是一场华丽的舞会,每个角色都得找到自己的位置。
咱们先来聊聊酸碱平衡吧。
这可真是个老生常谈的话题,但它真的很重要!酸和碱就像是水溶液中的“好朋友”,一个是咸咸的酸,一个是甜甜的碱。
你知道吗?它们在水里碰撞的时候,能产生一些奇妙的反应。
比如,咱们的胃里就有盐酸,帮助消化,可是如果太酸了,人可就受不了啦,像是火烧心一样。
想想看,如果我们喝了太多酸的东西,比如可乐,胃就会抗议,跟你说:“别再给我酸的了,我要休息!”而碱则是反过来的,它可以中和酸,让一切变得平衡,嘿,这就是酸碱平衡的魅力所在!说到这里,不禁让我想起那句老话:“和气生财”,保持好酸碱平衡,身体才会倍儿棒。
我们得聊聊离子平衡。
听起来是不是有点复杂?其实没那么可怕!离子就像是水溶液里的小精灵,个个忙得不可开交。
水中有钠离子、钾离子、钙离子等等,都是咱们身体的“好帮手”。
这些离子可不是随便来的,它们需要通过食物、饮水等途径进入我们的身体。
比方说,钠离子帮助调节体液,保证你不干渴,像是个勤勤恳恳的水管工;而钾离子则让你的心脏跳动得稳稳的,像个稳重的交响乐指挥。
可要是离子不平衡,那可就麻烦了,像是乐团里有人跑调,整个演出就糟了。
如果你运动过度,出汗太多,钠离子和钾离子都可能变得不足,结果就可能让你感到无力,甚至出现抽筋。
嘿,记得多喝水,补充电解质,保持离子平衡哦!就像那句俗话:“多一分热情,多一分幸福”。
咱们得说说渗透压平衡。
听着好像很高大上,其实就是水分子在水溶液里像是在跳舞一样,四处流动。
水分子总是想着往浓度低的地方移动,想要把整个舞池的气氛搞得平衡一些。
想象一下,盛夏的日子,大家都在海边玩水,水面平静如镜,大家都开心极了。
普通化学第七章酸碱平衡

HI > HBr > HCl > HF
H2Te > H2Se > H2S > H2O 普通化学
22
酸碱平衡
c) 含氧酸根的稳定性
由共轭酸的概念可知,酸根越稳定,它结合 H+重新 生成共轭酸的趋势就越小,酸的强度就越大。酸根的负 电荷分布得越好,酸根的稳定性就越高。如: 酸强度顺序: HOCl < HClO2
21
酸碱平衡
b) 键的强度
提供质子的能力还决定于 HX 键的强度, HX 键 越弱,H+越容易解离出来。HX键的强弱又决定于X的 半径,X的半径越大,HX键就越弱。如:
HF HCl HBr HI HO HS 键能(kJ· mol-1): 酸强度顺序: 565 431 366 299 463 338
N O 3.44 F 3.98 P 2.19 S 2.58 Cl 3.16
电负性:
3.04
同周期酸强度变化顺序:
NH3 < H2O < HF NH3 < PH3 H2O < H2S PH3 < H2S < HCl HF < HCl
但是对同族而言,酸强度变化顺序:
说明除电负性之外,还有其它影响因素。 普通化学
C M OH C [OH ] 2
-
2 M OH
4K w
普通化学
15
酸碱平衡
§4 酸碱在水溶液中的相对强度
酸或碱的强度是指它们给出质子或接受质子的能力 大小,这种能力越大,则酸或碱的强度越强。
酸或碱的强度不仅仅决定于酸碱本身给出质子或接 受质子的能力,同时也决定于溶剂接受或给出质子的能 力。因此,酸碱强度的比较必须选定同一种溶剂,最常 用的溶剂是水。 强酸和强碱在水溶液中完全电离,但只是少数;大 多数是弱酸和弱碱,它们只能在水溶液中部分电离,并 建立电离平衡。换句话说,酸碱平衡研酸碱平衡
第四章 酸碱滴定法

共轭酸碱对
氨在水中的离解: NH3(碱1)+ H+ 半反应1 H2O(酸2) 半反应2 NH3(碱1) + H2O (酸2)
共轭酸碱对
2016/11/22
NH4+(酸1) OH-(碱2)+ H+ OH- (碱2) + NH4+ (酸1)
NH4CL的水解 (相当于NH4+弱酸的离解)
NH4+ + H2O
KW [ H ] Ca [H ]
2016/11/22
解一元二次方程,得一元强酸精度计算式为
H
Ca Ca 4 K w 2
2
当Ca≥20[OH-]时,[OH-] 项可忽略,室温为10-7mol/l,则有 [H+] = [A-] = Ca
pH=-lg[H+]=-lgCa
K a [ HA] KW
②若Caka<20Kw, Ca/Ka ≥500
则有[HA]=Ca-[H+] ≈Ca
则[H+]=
Ca K a K
此为考虑水的离解时计算一元弱酸H+浓度
的近似公式(应用较少)。
2016/11/22
③ CaKa>20Kw, Ca/Ka ≥500 时
[HA]= Ca-[H+]≈Ca
共轭酸碱对
H3O+ + NH3
NaAc的水解(相当于Ac-弱碱的离解)
Ac- + H2O
共轭酸碱对
OH- + HAc
醋酸与氨在水溶液中的中和反应 HAc + NH3
共轭酸碱对
四大平衡

最简式
例 3%的甲酸的密度= 1.0049 g/ cm3,其pH = 1.97, 问稀释多少倍后,甲酸溶液的电离度增大为稀释前的 10倍? 分析:由甲酸的密度和溶质质量分数可求出甲酸的 物质的量的浓度;由pH值可求出[H+],再由物质的 量浓度和[H+],就可求出甲酸稀释前的电离度α1。 稀释后的电离度为10α1,但浓度变化不影响电离常 数,则可由稀释前后不同浓度数值所表达的电离常 数,求出稀释前后浓度的比值,即为所要稀释的倍 数。 117.8
1-1-6 酸碱平衡
一元弱酸
起始浓度 平衡浓度 c c-[H3O+]
Ki 与α 都能说明弱电解质的解离程度; 但α 与c有关,Ki 与c无关。
A(aq) + H3O+(aq) 0 [A] = [H3O+] 0 [H3O+] (忽略水的电离)
HA(aq) + H2O(l)
或:
c(1-α)
cα
Ka
2
cα
( c )
2
若(c)/Ki ≧500, 1-α≈1
[H3O+]2 Ka= ————— ≈ [H3O+]2 c-[H3O+]
c (1 )
c
2
1
c
2
[H 3O ]
[ H 3O ]
Ka
K a 4K ac 2
近似式 (c/Ka>500)
K a c c
H2O + NH3 = NH4+ + OHHAc + H2O = H3O+ + AcAl(H2O)63+ + H2O = H3O+ + Al(H2O)5(OH) 2+
溶液中的酸碱平衡和离子平衡的选择性

溶液中的酸碱平衡和离子平衡的选择性溶液中的酸碱平衡和离子平衡是化学反应中关键的概念,它们对于溶液的性质和化学过程的发生起到了至关重要的作用。
在许多实验和应用中,我们需要选择性地调节酸碱和离子的平衡以满足特定需求。
本文将重点讨论溶液中的酸碱平衡和离子平衡的选择性,并探讨其在不同领域中的应用。
酸碱平衡是指溶液中酸和碱的浓度的关系及其对溶液性质的影响。
在溶液中,酸和碱可通过离子化过程释放出氢离子(H+)和氢氧根离子(OH-)。
酸性溶液中H+离子浓度高于OH-离子浓度,而碱性溶液中OH-离子浓度高于H+离子浓度。
同时,pH值作为衡量溶液酸碱性强弱的指标,pH值低于7表示酸性溶液,高于7表示碱性溶液,等于7表示中性溶液。
溶液中酸碱平衡的选择性可通过调节酸碱浓度、添加中和剂或控制酸碱反应的速率来实现。
例如,在水处理过程中,需要将酸性水变为中性或碱性,可以通过添加碱性物质如氢氧化钠(NaOH)来中和溶液中的酸。
同样地,如果需要调节溶液中的碱性,可以添加酸性物质如盐酸(HCl)来中和溶液。
此外,通过控制酸碱反应的速率,也可以选择性地平衡溶液中的酸碱浓度。
加热或冷却溶液,改变溶液的温度可以影响酸碱反应的速率,从而调节溶液的酸碱平衡。
离子平衡是指溶液中各种离子的浓度关系及其对溶液行为的影响。
离子平衡在许多领域中都具有重要的应用价值。
例如,土壤中的离子平衡对于植物的生长和发育至关重要。
营养元素的浓度和比例直接影响着土壤的离子平衡,进而影响着植物的根系吸收和利用养分的能力。
通过调节土壤pH值、施加化肥和调节灌溉水质等措施,可以选择性地平衡土壤中的离子浓度,提高植物的产量和品质。
在医药领域中,控制溶液中离子平衡也是极为重要的。
药物的吸收和释放往往与离子的存在和浓度有关。
通过调节溶液的pH值,可以促进或阻碍药物的溶解和吸收。
此外,通过选择特定的配方和添加剂,在制药过程中也可以实现对溶液中离子平衡的选择性控制,以增强药物的稳定性和疗效。
水溶液中酸碱平衡

2
NH
4
Ca
Ca
2
2NH 3
H2
酸?
NH 3(g) HCl (g) NH 4Cl(s)
碱?
酸?
例2:水溶液中 HSO4- 酸?碱? Na2CO3 碱?
②.碱被限制为氢氧化物:
过去认为:NH4+半径143pm, K+半径139pm, NH4OH应为强碱,但实际上氨水是弱碱,而且 从未分离出NH4OH。
K
θ a
数值的大小体现出弱酸的相对强弱
p284
一元弱酸溶液中 H+浓度的近似计算式:
cH
K
θ a
c HA
解离度 :
α
K
θ a
c HA
一元弱碱 BOH
解离常数通常用
K
θ b
表示
BOH ⇌ B OH
cOH
K
θ b
cBOH
α
K
θ b
c BOH
例:0.010mol•dm-3NH3(aq)在298K的解离度 为4.2%,求其 K bθ。
溶液酸性 溶液中性 溶液碱性
pH标度
为了方便指示水溶液的酸碱性,丹麦科学家
S.P.L.Sörensen在1909年提出pH标度。
定义:
pH lg[cH /cθ ]
简写为: 或:
pH lg[c H ] pH lg[H ]
例:某水溶液中[H+]=3.0×10-10 mol·dm-3,求其 pH值。
(Lewis酸碱电子理论 )
① 酸碱定义 凡是可给出电子对的分子、离子或原子团
化学平衡与溶液中的酸碱反应的酸碱平衡

化学平衡与溶液中的酸碱反应的酸碱平衡化学平衡是指当化学反应达到一种动态平衡状态时,反应物转化为生成物的速率与生成物转化为反应物的速率相等。
而溶液中的酸碱反应是指当酸或碱与水发生反应时,产生了具有酸性或碱性的物质。
在溶液中,酸碱反应的酸碱平衡是酸性物质和碱性物质的转化过程。
本文将详细介绍化学平衡及溶液中的酸碱反应的酸碱平衡的相关知识。
一、化学平衡化学平衡是指在一定条件下,反应物与生成物浓度保持不变的状态。
当一个化学反应达到平衡时,反应物与生成物的浓度比例将保持不变。
化学平衡的表达式可以通过化学方程式表示。
例如,对于一种简单的平衡反应:反应物A + 反应物B --> 生成物C在化学平衡时,反应物A和B的浓度与生成物C的浓度保持不变。
当反应物A或B的浓度发生改变时,平衡将会发生位移,以恢复平衡状态。
这个位移过程包括两个方向:正向反应和逆向反应。
正向反应是从反应物向生成物转化的过程,而逆向反应是从生成物向反应物转化的过程。
化学平衡的关键概念是平衡常数。
平衡常数是指在平衡状态下,系统各组分的浓度的乘积与各组分的浓度最低次幂之比的数学表达式。
平衡常数的大小决定正向反应和逆向反应的强弱程度。
当平衡常数大于1时,正向反应较为强势;当平衡常数小于1时,逆向反应较为强势。
平衡常数值越大,反应系统更倾向于生成产物。
二、溶液中的酸碱反应在溶液中,酸和碱之间会发生酸碱反应。
酸溶液含有H+离子(也称为质子),而碱溶液含有OH-离子(也称为氢氧根离子)。
当酸溶液和碱溶液混合时,H+离子与OH-离子结合,生成水分子(H2O)。
酸碱反应的一般表达式如下:酸 + 碱 --> 盐 + 水其中,盐是由酸中的阳离子和碱中的阴离子组成。
例如,盐可以是氯化钠(NaCl)等。
酸碱反应的强度可以通过酸碱值(pH值)来表示。
pH值是对溶液酸碱性的度量,其取值范围为0到14。
pH值为7时,表示溶液为中性;pH值小于7时,溶液为酸性;pH值大于7时,溶液为碱性。
化学管理--水溶液中的四大平衡
c0
0
0
c0-cHAc
cH+
cAc-
KaccH 0ccA Hc
c2 H
c0cH
cHKa
Ka24Kac0 2
KaΘ是酸式电离平衡常数
根据电离度的定义式,也可将KaΘ表示如下:
HAc === H+ + Ac-
t = 0 时 c0
0
0
平衡时 c0(1-α)
c0α
c0α
Ka
2 1
c0
1
K
a
c0
cH c0
[
cIn c
[
c HIn c
]
]
cIn (紫红色) cHIn(无色)
Ka cH
c
酸碱指示剂的变色范围 肉眼能观察到颜色变化的pH值范围
[HIn]:[In-] = 1中间颜色,此点称为理论变色点 [HIn]:[In-] ≥ 10 无色(酸色) [HIn]:[In-] ≤ 10 紫红色(碱色)
酸碱指示剂的变色范围:
pOHpKb
lgc0,(碱) c(盐)
例题:缓冲溶液的组成是1.00mol·L-3的NH3·H2O和 1.00mol·L-3的NH4Cl,求: 1)缓冲溶液的pH值; 2 ) 将 1.0cm31.00mol·L-3NaOH 溶 液 加 入 到 50.0cm3 该缓冲溶液中引起的pH值变化; 3)将同量的NaOH加入到50.0Cm3纯水中引起的pH 值变化。
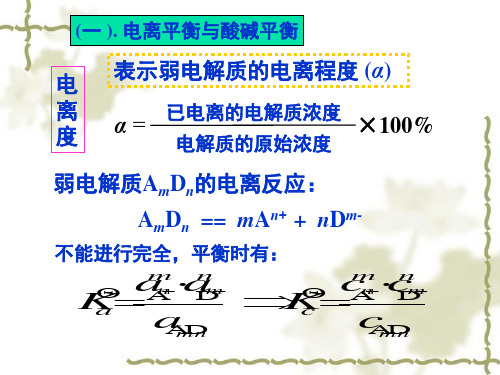
(一 ). 电离平衡与酸碱平衡
电 表示弱电解质的电离程度 (α)
离 度
α = 已电离的电解质浓度 ×100%
电解质的原始浓度
弱电解质AmDn的电离反应:
AmDn == mAn+ + nDm-
第四章 酸碱滴定法

KHIn与温度有关;
如18℃时,甲基橙的变色范围为3.1~4.4,而 100℃时则为2.5~3.7。 滴定宜在室温下进行
返回
不同的溶剂中KHIn值不同; 例如甲基橙在水溶液中pKHIn=3.4,而在甲 醇中pKHIn=3.8。 溶剂中中性电解质的存在增加了溶液的离 子强度,使指示剂的表观离解常数改变, 将影响指示剂的变色范围。 同时某些盐类具有吸收不同波长光的性质, 也会改变指示剂颜色的深度和色调。 返回
第四章 酸碱滴定法
酸碱滴定法(中和滴定法): 以酸碱反应(水溶液中的质子转移反 应)为基础的定量分析法. (非水滴定单独讲解)
本章重点: (1)酸碱平衡理论 (2)各类酸碱溶液的pH值计算方法 (3)指示剂的选择和各类酸碱滴定曲线
第一节 水溶液中的酸碱平衡
一、酸碱的质子理论
凡能给出质子(H+)的物质是酸,能接收 质子的物质是碱。
子条件式中的[OH-]项可忽略,则有:
[H+]=[A-]=Ca
2.一元弱酸
[H+]=[A-]+[OH-]
K a [HA] K w [H ] [H ] [H ]
[H ]2 K a [HA] K w
C a [H ] [HA] Ca δ 0 [H ] K a
NaHCO3溶液 参考物质:HCO3-,H2O
H2CO3 H3O
+
+H +H
+ + HCO3
-H
+ + 2CO3 -
H2O
-H
OH
质子条件式: [H2CO3]+[H3O+]=[CO32-]+[OH-]
(二)一元酸碱溶液的pH计算
分析化学酸碱滴定法(新)

13
(四)混合指示剂 混合指示剂是把两种或两种以上试剂混合,利用它们颜 色的互补性,使终点颜色变化更鲜明,变色范围更窄。
一定型体的平衡浓度占分析浓度的比值为该种型体的 分布系数(δ)。型体Ai的分布系数为
Ai
Ai
C
显然, 1 A A A 1 2 n
2
(二)弱酸(弱碱)各型体的分布系数 一元弱酸HA
HA
C HA A
HA
[ Ac ] C 0 . 1000 0 . 64 0 . 064 mol / L A c
5
(三)水溶液中酸碱平衡的处理方法 1、质量平衡(物料平衡) 在一个化学平衡体系中,某一组分的分析浓度等于该组 分各种存在型体的平衡浓度之和,称为质量平衡 C mol/L Na 2CO3溶液的质量平衡式:
强酸强碱准确滴定的条件:
C 10 mol /L
一般而言,人们观察指示剂颜色的变化约有0.2~ 0.5pH单位的误差,称之为观测终点的不确定性,用 △pH来表示,一般按△pH=±0.2来考虑,作为使用 指示剂目测终点的分辨极限值。
(三)影响指示剂变色范围的因素
11
1. 指示剂的用量 对于双色指示剂如甲基橙,用量多少对变色范围 (PH3.1~4.4)和终点(PH5)影响不大,但对色调变化有影响。 用量太多或太少都使色调变化不鲜明。 对于单色指示剂如酚酞,用量多少对色调变化影响不 大,但影响变色范围和终点。例如,在50~100ml溶液中 加入0.1%酚酞指示剂2~3滴,变色范围约8.0~10.0, pH=9时出现红色;在同样条件下加入10~15滴,则变色 范围约7.0~9.0,在pH=8时出现红色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注意:多元酸、碱的离解常数的Ka、
Kb对应关系
H3PO4
H2PO4 - + H+
Ka1
Kb3
H2PO4-
HPO42- + H+
Ka2
Kb2
HPO42-
PO43- + H+
Ka3
Kb1
多 元 酸 碱 在 水 中 逐 级 离 解 , 强 度
概念和关系式:
( a )“共轭酸碱对” :因一个质子的得失 而互相转变的每一对酸碱。
( b)“酸碱半反应” :各个共轭酸碱对的 质子得失反应。
例如:弱酸、弱碱的离解以及盐类的水解等等。
醋酸在水中的离解:
半反应1 HAc(酸1)
Ac- (碱1) + H+
半反应2 H+ + H2O(碱2)
H3O+(酸2)
HAc(酸1) + H2O (碱2)
H3O+(酸2) + Ac- (碱1)
共轭酸碱对
氨在水中的离解:
半反应1 半反应2
NH3(碱1)+ H+ H2O(酸2)
NH4+(酸1) OH-(碱2)+ H+
NH3(碱1) + H2O (酸2)
OH- (碱2) + NH4+ (酸1)
共轭酸碱对
(c)水的质子自递反应及其常数 水溶液中
0.064mol / L
2.3 多元酸溶液
H2C2O4
HC2O4-+ H+
HC2O4-
C2O42- + H+
(3—4a~c) C H2C2O4 HC2O4 C2O42
2
H பைடு நூலகம்C2O4
H 2C2O4 C
H 2 H 2 Ka1 H Ka1 Ka2
注意变换的离解常数:
1.3 酸碱离解平衡的几点结论
①酸碱的强弱取决于给出质子或接受质 子能力的强弱。
②共轭酸碱中,如果酸越容易给出电子 ,酸性越强其共轭碱的碱性就越弱。
如: HClO4 ,HCl……
③酸碱的离解常数Ka,Kb大小可以定量 证明其强弱。
Ka↑,给质子能力↑强,酸的强度↑
Kb↑,得质子能力↑强,碱的强度↑
H2O + H2O
H3O+ + OH –
水的离子积
(3—1)
pH pOH 14
(d)弱酸弱碱的离解常数 Ka,Kb
HA + H2O
H3O+ + A-
(酸的离解常数)
Ka
H3O A
HA
H A
HA
A-+ H2O
OH- + HA
(碱的离解常数)
OH HA Kb A
[某种型体的平衡浓度] [分析浓度]
( ) HOAc
HOAc
1
C
( ) OAc
OAc
0
C
(4)分布曲线 分布系数δ与溶液pH值间的关系曲线
称为分布曲线。
2.2一元酸的分布曲线
例:HA总浓度为C,[HA]和[A-]代表它们
的平衡浓度,δ1和δ0分别代表HA和A-的 分布系数。
酸的浓度:(又称酸的分析浓度)它是指单 位体积溶液中所含某种酸的物质的量(mol), 即总酸度,它包括未离解的酸的浓度。用“C” 表示。
(2)平衡浓度
在酸碱平衡体系中,通常存在于多种酸 碱组分(或称存在形式),这些组分的浓 度称为平衡浓度。
(3)分布系数
某一种存在形式的平衡浓度占总浓度的
分数,用δ表示之。
1
HC2O4
HC2O4 C
Ka1 H H 2 Ka1 H Ka1 Ka2
0
C2O42
C2O42 C
Ka1 Ka2 H 2 Ka1 H Ka1 Ka2
第三章 酸碱滴定法
水溶液中的酸碱平衡 酸碱指示剂 酸碱滴定法的基本原理 应用与示例
1. 酸碱平衡的理论基础
1.1酸碱电离理论
酸——能电离出H+的物质 碱——能电离出OH-的物质 局限性:不能解释不含OH-的碱性物质
1.2酸碱质子理论
酸——凡能给出质子的物质
碱——凡能接受质子的物质
特点:
1)具有共轭性
0 1 2 1
讨论
Ka[一H+定]时有,关δ0 ,δ1和δ2与
•
pH 主
<
pKa1,H2C2O4为
• pH = pKa1,
[H2C2O4] = [HC2O4-]
如:HA
A- + H+
2)具有相对性
如: HCO3-既为酸,也为碱 (两性) 3)具有广泛性
如:H2O 中性分子,既可为酸,也可为碱
举例
áË HAC H2CO3 HCO3NH4+ H6Y2+ NH3OH+ (CH2)6N4H+
Ë AcHCO3CO32-
NH3 H5Y+
NH2OH
(CH2)6N4
ËË× + H+ + H+ + H+ + H+ + H+ + H+ + H+
逐级递减
K K K
a1
a2
a3
K K K
b1
b2
b3
K K K K K K
a1
b3
a2
b2
a3
b1
K 1.0 1014 W
2. 溶液中弱酸、弱碱组分的分布情况—分 布曲线
2.1基本概念
(1)酸的浓度和酸度 酸度:是指溶液中H+的浓度,正确地说是 指H+ 的活度,常用pH值表示。
0
(3—3b)
讨论
Ka一定时,δHA和δA-与pH有关 pH↓,δHA↑,δA-↓
• pH < pKa,HAc为主 • pH = pKa,[HAc] = [Ac-] • pH > pKa时,Ac-为主
例:计算pH=5.0时,HOAc溶液(0.1000mol/L)
中HOAc和OAc-的分布系数及平衡浓度
HA
A- + H+
C HA A
∴
1
HA
C
HA HA A
1
1
A HA
1
1 K
H
a
H H K
a
(3—3a)
0
A
C
A HA A
H
K a
K
a
1
1
解:
[H ]
HOAc K [H ]
a
1.0 105
1.78105 1.0 105
0.36
1 0.36 0.64 OAc
[HOAc] C 0.1000 0.36 HOAc
0.036mol / L
[OAc ] C 0.1000 0.64 OAc
