生化多项校准品产品技术要求baiding
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求baiding

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:本试剂用于体外定量测定人血清中肌酐的含量。
1.1 包装规格
产品组成:
2.1 外观
2.1.1 试剂1为淡黄色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为淡粉色透明液体,无混浊,无未溶解物。
2.1.3 校准品为无色透明液体, 无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度
A≤0.080(光径1.0cm,548nm±20nm 波长)。
2.4 分析灵敏度
测定100μmol/L样本,吸光度变化在0.010~0.030范围内。
2.5 线性区间
2.5.1 [5.6,1500]μmol/L(37℃)。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.5.2 [5.6,50]μmol/L范围内,线性绝对偏差应不超过±5μmol/L;(50,1500]μmol/L范围内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
变异系数CV≤5%。
2.6.2 批间差
批间相对极差≤8%。
2.7 准确度
相对偏差在±10%范围内(测试国际参考物质SRM 909c (NIST))。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应应符合2.1、2.3、2.4、2.5、2.6.1、和2.7要求。
糖化白蛋白测定试剂盒(过氧化物酶法)产品技术要求baiding

糖化白蛋白测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人血清中糖化白蛋白和白蛋白测量浓度的比值(%)。
1.1 规格GA校准品(选配):1×1mL,ALB校准品(选配):1×1mL;质控品(选配):水平1:1×1mL,水平2:1×1mL。
1.2 组成:签。
2.1 外观2.1.1 GA试剂1:淡黄色液体。
2.1.2 GA试剂2:淡黄色至淡红色液体。
2.1.3 ALB试剂:黄绿色液体。
2.1.4 GA校准品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.5 ALB校准品:无色至淡黄色液体。
2.1.6质控品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.7包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度2.3.1糖化白蛋白试剂空白吸光度≤0.3。
2.3.2白蛋白试剂空白吸光度≤0.5。
2.4 分析灵敏度2.4.1糖化白蛋白样本浓度为1.4g/dL时,吸光度差值应≥0.01。
2.4.2白蛋白样本浓度为4.0g/dL时,吸光度差值应≥0.02。
2.5 线性区间在[10.0,69.0] %的范围内,线性相关系数r≥0.990。
测试浓度在[10.0,30.0] %时,绝对偏差应不超过±3%;测试浓度在[30.0,69.0]%时,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度与已上市产品进行对比试验,在[10.0,69.0] %的范围内,线性相关系数r≥0.975。
测试浓度在[10.0,30.0] %时,绝对偏差应不超过±3%;测试浓度在[30.0,69.0]%时,相对偏差应不超过±10%。
葡萄糖测定试剂盒(葡萄糖氧化酶法)产品技术要求baiding

葡萄糖测定试剂盒(葡萄糖氧化酶法)
适用范围:本试剂用于体外定量测定人血清中的葡萄糖含量。
1.1型号规格
产品组成
2.1 外观
2.1.1 试剂为淡粉红色透明液体,无混浊,无未溶解物。
2.1.2 校准品为无色透明液体,无混浊,无未溶解物。
2.1.3 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度
A≤0.15(光径1.0cm,500nm±20nm波长)。
2.4 分析灵敏度
测定1mmol/L 被测物,吸光度变化在0.05~0.08范围内。
2.5 线性区间
2.5.1 [0.1,28]mmol/L([1.8,500] mmol/L)。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.5.2[0.1,1]mmol/L范围内,线性绝对偏差应不超过±0.1mmol/L;(1,28]mmol/L范围内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
变异系数CV≤5.0%。
2.6.2 批间差
批间相对极差≤6.0%。
2.7 准确度
相对偏差在±10%范围内(测试国家标准物质GBW(E)090544/GBW(E)090545 /GBW(E)090546)。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.1、2.3、2.4、2.5、2.6.1、和2.7要求。
高密度脂蛋白胆固醇测定试剂盒(直接法-过氧化氢酶清除法)产品技术要求baiding

高密度脂蛋白胆固醇测定试剂盒(直接法-过氧化氢酶清除法)适用范围:本试剂用于体外定量测定人血清中高密度脂蛋白胆固醇的含量。
1.1 包装规格产品组成:2.1 外观2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为淡黄褐色透明液体,无混浊,无未溶解物。
2.1.3 校准品为无色或浅黄色冻干粉,溶解后为无色或黄色液体,无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 含水量校准品冻干粉含水量≤3%。
2.4 试剂空白吸光度A≤0.080(光径1.0cm,600nm±20nm 波长)。
2.5 分析灵敏度测定1.0mmol/L样本,吸光度变化在0.04~0.08范围内。
2.6 线性区间2.6.1 [0.20,2.50]mmol/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.6.2 [0.2,0.8] mmol/L范围内,线性绝对偏差应不超过±0.08 mmol /L;(0.8,2.5] mmol /L范围内,线性相对偏差应不超过±10%。
2.7 精密度2.7.1 重复性变异系数CV≤4.0%。
2.7.2 批内瓶间差试剂盒内校准品瓶间差CV≤4%。
2.7.3 批间差批间差≤6.0%。
2.8 准确度相对偏差在±10%范围内(测试国际参考物质SRM 1951b(NIST))。
2.9 稳定性2.9.1 校准品冻干粉复溶后在2℃~8℃避光保存稳定7天,测定结果应符合2.8要求。
2.9.2 原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.1、2.4、2.5、2.6、2.7.1和2.8要求。
生化多项质控品产品技术要求

生化多项质控品
结构组成:
本质控品是以人血清为基质,并添加了特定项目的生物源性物质和化学成分,具体内容见下
预期用途:,用于以下生化项目的室内质量控制:肌酸激酶MB同工酶、腺苷脱氨酶、天门冬氨酸氨基转移酶线粒体同工酶、5'-核苷酸酶、甘氨酰脯氨酸二肽氨基肽酶、前白蛋白、糖化血红蛋白、N-乙酰-β-D-氨基葡萄糖苷酶、血管紧张素转化酶、同型半胱氨酸、超氧化物歧化酶。
2.1 外观和性状
2.1.1 外包装完整无破损;中文包装标签应清晰、准确、牢固。
2.1.2 本质控品应为红色冻干粉;复溶后应为红色液体,无浑浊,无未溶解物。
2.2 可接受区间/值
各项目在其测量系统上的测定结果应在可接受区间内。
2.3 均匀性
2.3.1 瓶内均匀性
)应不大于10%。
各项目的瓶内均匀性变异系数(CV
瓶内
2.3.2 瓶间均匀性
)应不大于10%。
各项目的瓶间均匀性变异系数(CV
瓶间
2.4 稳定性
2.4.1 复溶稳定性
复溶后的质控品密封保存于2 ℃~8 ℃、避光环境中,可稳定3天;复溶后的质控品密封保存于不高于-18℃、避光环境中,可稳定10天。
在稳定期内赋值结果的变化趋势不显著。
2.4.2 效期稳定性
质控品保存于2 ℃~8 ℃,有效期为24个月。
在有效期内赋值结果的变化趋势不显著。
尿酸测定试剂盒(尿酸酶法)产品技术要求baiding

尿酸测定试剂盒(尿酸酶法)适用范围:本试剂用于体外定量测定人血清中尿酸的含量。
1.产品规格及其划分说明试剂1:2×40ml,试剂2:2×20ml,校准品:1×2ml试剂1:1×60ml,试剂2:1×30ml,校准品:1×2ml试剂1:2×60ml,试剂2:2×30ml,校准品:1×2ml试剂1:8×60ml,试剂2:4×60ml,校准品:1×2ml试剂1:2×80ml,试剂2:2×40ml,校准品:1×2ml试剂1:4×80ml,试剂2:4×40ml,校准品:1×2ml试剂1:2×40ml,试剂2:2×18.5ml(2×200tests),校准品:1×2ml 试剂1:24×4.4ml,试剂2:12×4.4ml(400tests),校准品:1×2ml 产品组成:试剂成份浓度试剂1 过氧化物酶(POD)4-氨基安替比林抗坏血酸氧化酶≥1.8KU/L0.3mmol/L≥0.8KU/L试剂2UricaseToos ≥0.6KU/L 1.4mmol/L校准品(单水平)尿酸水溶液297.5μmol/L2.1 外观2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为无色透明液体,无混浊,无未溶解物。
2.1.3 校准品为无色透明液体,无混浊,无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度A≤0.30(光径1.0cm,480nm~560nm波长)。
2.4 分析灵敏度测定50μmol/L样本,吸光度变化在0.02~0.04范围内。
2.5 线性区间2.5.1 [6,1190]μmol/L ([0.1,20]mg/dl)。
生化多项校准品产品技术要求zhongshengbeikong

生化多项校准品适用范围:本产品与本公司生化项目试剂盒配套使用,用于临床检验实验室中以下21个生化项目定量检测的系统校准,具体项目为:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰基转移酶(GGT)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、α-淀粉酶(AMY)、葡萄糖(Glu)、尿素(Urea)、尿酸(UA)、肌酐(Cre)、总胆红素(T.Bili)、直接胆红素(D.Bili)、无机磷(IP)、钙(Ca)、铁(Iron)、镁(Mg)、胆固醇(CHO)、甘油三酯(TG)、总蛋白(TP)、白蛋白(Alb)。
1.1规格冻干粉型(复溶体积):1mL×3(1个浓度);1mL×10(1个浓度);3mL×3(1个浓度);3mL×10(1个浓度)。
1.2主要组成成分本产品以人血清为基质,并添加了特定项目的生物源性物质和25mmol/L氯化钠。
表1 校准品的主要成分及生物源性2.1 外观本校准品应为浅黄色冻干粉,复溶后应为浅黄色或浅褐色透明溶液,无混浊,无未溶解物。
2.2 准确度2.3瓶间差变异系数(CV)应≤5%。
2.4 含水量含水量应≤5%。
2.5稳定性2.5.1效期稳定性原包装校准品在2℃~8℃条件下避光贮存,有效期为18个月。
在有效期满后3个月内,校准品性能应符合2.1、2.2、2.3要求。
2.5.2复溶稳定性复溶后校准品在15℃~25℃密封避光保存,在稳定期满后2小时内,校准品性能应符合2.1、2.2、2.3要求。
复溶后校准品在2℃~8℃密封避光保存,在稳定期满后2小时内,校准品性能应符合2.1、2.2、2.3要求。
复溶后校准品在-25℃~-15℃密封避光保存,在稳定期满后8小时内,校准品性能应符合2.1、2.2、2.3要求。
2.6溯源性校准品溯源性应符合GB/T 21415-2008的要求,并提供相关溯源过程、测定值不确定度等内容,本校准品溯源情况详见附录A。
多项生化校准品产品技术要求senmeixikema
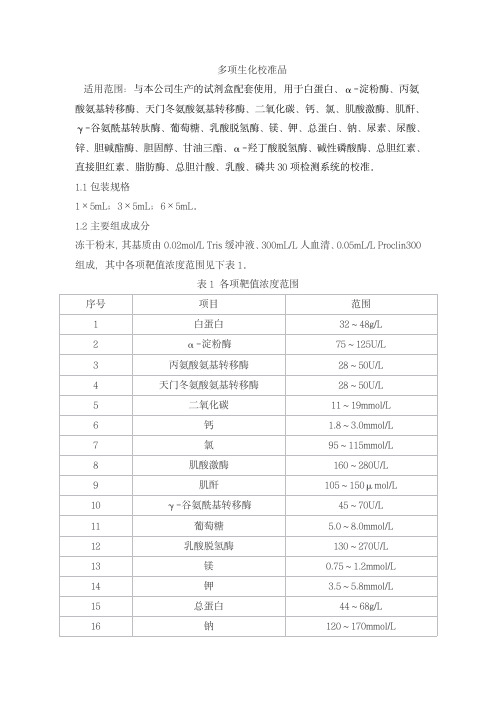
多项生化校准品适用范围:与本公司生产的试剂盒配套使用,用于白蛋白、α-淀粉酶、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、二氧化碳、钙、氯、肌酸激酶、肌酐、γ-谷氨酰基转肽酶、葡萄糖、乳酸脱氢酶、镁、钾、总蛋白、钠、尿素、尿酸、锌、胆碱酯酶、胆固醇、甘油三酯、α-羟丁酸脱氢酶、碱性磷酸酶、总胆红素、直接胆红素、脂肪酶、总胆汁酸、乳酸、磷共30项检测系统的校准。
1.1包装规格1×5mL;3×5mL;6×5mL。
1.2主要组成成分冻干粉末,其基质由0.02mol/L Tris缓冲液、300mL/L人血清、0.05mL/L Proclin300组成,其中各项靶值浓度范围见下表1。
表1各项靶值浓度范围校准品靶值批特异,详见说明书。
2.1外观和性状2.1.1各组分应齐全、完整、无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2开封前应为白色或淡黄色冻干粉。
2.1.3复溶后应为浅黄色溶液,无浑浊,无未溶解物。
2.2准确度见表2:表2准确度要求2.3重复性变异系数(CV)应不超过10%。
2.4批内瓶间差变异系数(CV)应不超过10%。
2.5量值溯源根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源情况见表3:表3溯源情况2.6稳定性2.6.1复溶稳定性复溶后的校准品在2℃~8℃条件下密闭避光保存,其中:1)二氧化碳可稳定6小时;2)胆红素可稳定6小时;3)其余项目可稳定1天。
各项目检测结果应符合2.2、2.3之规定。
复溶后的校准品在-20℃条件下密闭保存,可以稳定15天,应符合2.2、2.3之规定。
2.6.2效期稳定性该产品在2℃~8℃条件下密闭贮存有效期为24个月,取效期末的产品进行检测,应符合2.2、2.3之规定。
多项生化类质控品产品技术要求lideman

多项生化类质控品适用范围:与本公司生产的试剂盒配合使用,用于总酸性磷酸酶、丙氨酸氨基转移酶/谷丙转氨酶、天门冬氨酸氨基转移酶/谷草转氨酶、白蛋白、碱性磷酸酶、α-淀粉酶、胰腺淀粉酶、载脂蛋白A1、载脂蛋白B、钙离子、氯离子、补体C3、补体C4、二氧化碳、肌酸磷酸激酶、肌酐、胆碱脂酶、直接胆红素、铁离子、葡萄糖、谷氨酰基转移酶、α-羟基丁酸脱氢酶、高密度脂蛋白胆固醇、免疫球蛋白A 、免疫球蛋白G 、免疫球蛋白M 、钾离子、脂肪酶、低密度脂蛋白胆固醇、乳酸脱氢酶、镁离子、钠离子、磷、前白蛋白、磷脂、尿酸、不饱和铁结合力、尿素/尿素氮、甘油三酯、总胆红素、总胆固醇、总蛋白、总胆汁酸、转铁蛋白、铜离子、乳酸、亮氨酸氨基肽酶、乳酸脱氢酶同工酶1、锌离子、血管紧张素转化酶共50个项目的室内质量控制。
1.1规格冻干品,复溶体积:1×5mL;5×5mL;10×5mL;20×5mL1.2 组成本质控品为冻干品,在人血清基质中添加表1中的物质。
表1质控品组成1 电压测量:误差不超过±10%2 时间间隔:误差不超过±5%3 时间常数:0.1s误差不超过±40%4 幅频特性:1Hz~30Hz 偏差不超过+5%~-30%5 功率谱幅度:偏差不超过±10%6 功率谱频率:误差不超过±5%7 噪声电平:不大于2μV(峰-峰值)8 共模抑制比:不小于100dB9 耐极化电压:加±300mV的直流极化电压,偏差不超过±5%10 输入阻抗:≥20MΩ。
11 信号采集:可采集记录8、16、19个通道脑电信号。
12 事件标记:在采集过程中可进行事件标记,标记数不少于20次。
13 定位检索功能可选择采集过程中所做的任一标记处开始显示和处理数据。
14蓝牙传输距离:无障碍传输距离不小于8m。
15蓝牙传输速率:每通道200字节,16通道3200字节16 压缩谱阵图绘制功能可以在屏幕上绘制任意两通道脑电信号的压缩谱阵图。
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)产品技术要求baiding

低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)适用范围:用于体外定量测定人血清中低密度脂蛋白胆固醇的含量。
1.1 包装规格试剂1:3×40mL,试剂2:1×40mL试剂1:1×60mL,试剂2:1×20mL试剂1:2×60mL,试剂2:2×20mL试剂1:9×60mL,试剂2:3×60mL试剂1:3×80mL,试剂2:1×80mL试剂1:6×80mL,试剂2:2×80mL试剂1:1×540mL,试剂2:1×180mL试剂1:2×52mL,试剂2:2×17mL(2×200tests)试剂1:24×4.5mL,试剂2:12×3.2mL(400tests)校准品(单水平冻干粉,选配):1×1mL产品组成:试剂成份实验浓度试剂1 胆固醇酯酶胆固醇氧化酶过氧化氢酶4-氨基安替比林表面活性剂1≥0.8KU/L≥0.5KU/L≥400IU/L0.5mmol/L适量试剂2 TOOS过氧化物酶表面活性剂23mmol/L≥10KU/L适量校准品(单水平冻干粉,选配)人血清基质低密度脂蛋白胆固醇靶值范围2.5mmol/L-3.5mmol/L,靶值批特异,详见瓶标签2.1 外观2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为淡黄褐色透明液体,无混浊,无未溶解物。
2.1.3 校准品为无色或浅黄色冻干粉,溶解后为无色或黄色液体,无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 含水量校准品冻干粉含水量≤3%。
2.4 试剂空白吸光度A≤0.05(光径1.0cm,600nm±20nm波长)。
2.5 分析灵敏度测定1.0mmol/L样本,吸光度变化在0.04~0.08范围内。
多项生化校准品产品技术要求beiaotaikang
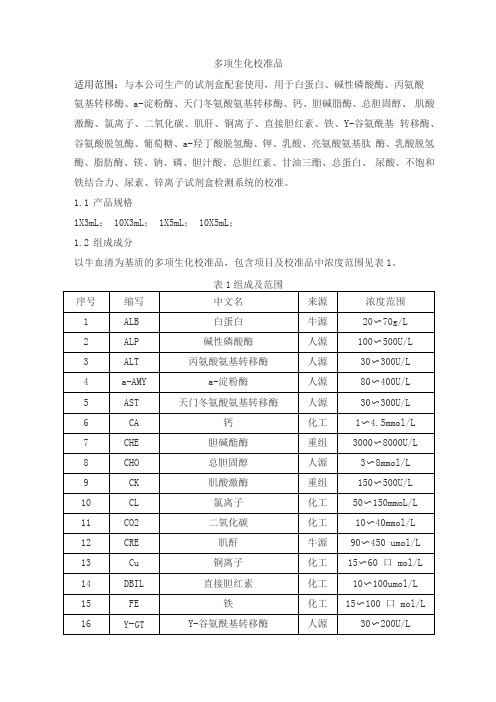
多项生化校准品适用范围:与本公司生产的试剂盒配套使用,用于白蛋白、碱性磷酸酶、丙氨酸氨基转移酶、a-淀粉酶、天门冬氨酸氨基转移酶、钙、胆碱脂酶、总胆固醇、肌酸激酶、氯离子、二氧化碳、肌肝、铜离子、直接胆红素、铁、Y-谷氨酰基转移酶、谷氨酸脱氢酶、葡萄糖、a-羟丁酸脱氢酶、钾、乳酸、亮氨酸氨基肽酶、乳酸脱氢酶、脂肪酶、镁、钠、磷、胆汁酸、总胆红素、甘油三酯、总蛋白、尿酸、不饱和铁结合力、尿素、锌离子试剂盒检测系统的校准。
1.1产品规格1X3mL; 10X3mL; 1X5mL; 10X5mL;1.2组成成分以牛血清为基质的多项生化校准品,包含项目及校准品中浓度范围见表1。
2.1外观冻干品,溶解后为浅黄色或黄色透明液体。
2.2准确度各项目的准确度偏差要求见表2.表2准确度偏差2.3重复性各项目的重复性变异系数要求见表3表3重复性变异系数2.4批内瓶间差各项目批内瓶间差应W5%。
2.5校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,本校准品所含项目中有国家或国际约定参考方法或物质的溯源至选定的参考方法或物质(工作校准品以上的校准等级);无国家或国际约定的参考方法和物质的溯源至工作校准品,工作校准品经与已知有证厂家产品比对测量赋值,具体各测定项目的溯源方法或物质,详见附录A。
O2.6稳定性2.6.1效期稳定性校准品原包装在(2〜8)℃避光保存,有效期为24个月,取失效期的校准品检测其准确度,应符合2.2的要求。
2.6.2复溶稳定性校准品复溶后,在(2〜8)℃下避光密封保存,有效期为2天,取失效期的校准品检测其准确度,应符合2.2的要求;在-20℃下避光密封保存,有效期为14 天,避免重复冻融,取失效期的校准品检测其准确度,应符合2.2的要求。
直接胆红素测定试剂盒(钒酸盐氧化法)产品技术要求baiding

直接胆红素测定试剂盒(钒酸盐氧化法)适用范围:本试剂用于体外定量测定人血清中直接胆红素的含量。
1.产品型号/规格产品组成:2.1 外观2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为浅黄色透明液体,无混浊,无未溶解物。
2.1.3 校准品为浅黄色冻干粉,溶解后为黄色液体,无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 含水量校准品冻干粉含水量≤3%。
2.4 试剂空白吸光度A≤0.080(光径1.0cm,546nm±20nm 波长)。
2.5 分析灵敏度测定20μmol/L样本,吸光度变化在0.02~0.04范围内。
2.6 线性区间2.6.1 [1,342]μmol/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.6.2 [1,10]μmol/L范围内,线性绝对偏差应不超过±1μmol/L;(10,342]μmol/L范围内,线性相对偏差应不超过±10%。
2.7 精密度2.7.1 重复性变异系数CV≤5.0%。
2.7.2 批内瓶间差试剂盒内校准品瓶间差CV≤5.0%。
2.7.3 批间差批间相对极差≤6.0%。
2.8 准确度回收率在(100±10)%范围内。
2.9 稳定性2.9.1 校准品冻干粉复溶后在2℃~8℃避光保存稳定4天,测定结果应符合2.8要求。
2.9.2 原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.1、2.4、2.5、2.6、2.7.1、和2.8要求。
N-乙酰-β-D-氨基葡萄糖苷酶测定试剂盒(MPT底物法)产品技术要求baiding

N-乙酰-β-D-氨基葡萄糖苷酶测定试剂盒(MPT底物法)适用范围:用于体外定量测定人尿液中的N-乙酰-β-D-氨基葡萄糖苷酶的活性。
1.1规格校准品(选配):1×1mL;质控品(选配):1×1mL。
1.2组成:注:校准品靶值、质控品质控范围详见包装标签。
2.1 外观2.1.1试剂1:无色至淡黄色液体,无浑浊,无不溶物。
2.1.2试剂2:无色至淡黄色液体。
2.1.3校准品:无色至淡黄色液体。
2.1.4质控品:无色至淡黄色液体。
2.1.5包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度试剂空白吸光度≤0.5;2.4 分析灵敏度样本浓度为100 U/L时,△A≥0.01 。
2.5 线性区间在[1,200] U/L范围内,线性相关系数r≥0.990;测试浓度在[1,30] U/L时,绝对偏差不超过±3 U/L,测试浓度在(30,200] U/L时,相对偏差不超过±10%。
2.6 精密度2.6.1 批內精密度用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度回收率在85%-115%范围内。
2.8 质控品赋值有效性测试结果在质控范围内。
2.9 瓶内均匀性校准品和质控品瓶内均匀性(CV)应不大于10%。
2.10 量值溯源校准品量值溯源至公司内部工作校准品并,与北京九强生物技术股份有限公司生产的N-乙酰-β-D-氨基葡萄糖苷酶测定试剂盒(MPT底物法)比对验证。
2.11 稳定性2.11.1校准品开瓶稳定性校准品开瓶后2℃~8℃避光保存可稳定3天。
稳定期过后4小时内进行测试,测试结果与靶值的相对偏差不超过±10%。
2.11.2质控品开瓶稳定性质控品开瓶后2℃~8℃避光保存可稳定3天。
糖化血红蛋白测定试剂盒(免疫比浊法)产品技术要求baiding

糖化血红蛋白测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血液中糖化血红蛋白的含量。
1.1规格校准品(选配):1mL×5。
1.2主要组成成分校准品靶值批特异,详见瓶标签。
2.1 外观2.1.1 试剂1为白色或微黄色胶乳液体,无混浊,无未溶解物。
2.1.2 试剂2为无色透明液体,无混浊,无未溶解物。
2.1.3 校准品应为无色至淡红色粉末。
2.1.4 标签内容清晰,字迹不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度A≤1.5(波长660nm,光径1cm)。
2.4 分析灵敏度测定3%的糖化血红蛋白样本,吸光度变化在0.012~0.120范围内。
2.5 线性2.5.1 [1,13]%。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.9900。
2.5.2 [1,4]%范围内,绝对偏差应不超过(0.6%);(4,13]%范围内,线性相对偏差应不超过±15%。
2.6 精密度2.6.1 批内精密度用高、中、低3个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2 批内瓶间差校准品批内瓶间差CV≤10%。
2.6.3 批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度相对偏差在±10%范围内(测试国家参考物质GBW09181、GBW09182、GBW09183)。
2.8 溯源性根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源至国家参考物质(GBW09181、GBW09182、 GBW09183)。
2.9 稳定性2.9.1 校准品复溶后2℃~8℃避光保存7天,应符合2.7要求。
2.9.2 原装试剂盒2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.3、2.4、2.5、2.6.1和2.7要求。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求baiding

小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人血清中小而密低密度脂蛋白胆固醇的含量。
1.1 规格校准品(选配):1×1mL;质控品(选配):水平1:1×1mL,水平2:1×1mL。
1.2 组成注:校准品靶值、质控品质控范围详见包装标签。
2.1 外观2.1.1试剂1:无色到淡褐色液体,无可见不溶物。
2.1.2试剂2:淡黄色到黄色液体。
2.1.3校准品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.4质控品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.5包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度试剂空白吸光度≤0.05。
2.4 分析灵敏度样本浓度为50mg/dL时,吸光度差值应≥0.02。
2.5 线性区间在[8,100] mg/dL的范围内,线性相关系数r≥0.990。
测试浓度在[8,30] mg/dL 时;绝对偏差应不超过±3mg/dL;测试浓度在(30,100] mg/dL时,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度与已上市产品进行对比试验,在[8,100] mg/dL的范围内,线性相关系数r≥0.975。
测试浓度在[8,30] mg/dL时,绝对偏差应不超过±3mg/dL;测试浓度在(30,100] mg/dL时,相对偏差应不超过±10%。
2.8 质控品赋值有效性测试结果在质控范围内。
2.9 校准品/质控品瓶内重复性校准品/质控品瓶内重复性(CV)应不大于10%。
2.10 校准品/质控品批内瓶间差校准品/质控品批内瓶间差(CV)应不大于10%。
多项生化校准品产品技术要求广州市番禺区华鑫科技

多项生化校准品
2.性能指标
2.1外观
校准品复溶前为淡黄色冻干粉,复溶后为淡黄色或黄色液体,无沉淀,无悬浮物和絮状物。
2.2水分含量
含水量应≤1%。
2.3量值溯源
按照GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,本校准品中有国家标准物质的项目溯源至国家标准物质,无国家标准物质的项目通过与已上市公司产品比对进行赋值。
2.4赋值结果及其不确定度的表示方式
赋值结果±扩展不确定度
2.5正确度
2.5.1有参考物质
检测相应项目时,当该项目为有证参考物质,量值传递的正确度应符合
|E n|≤1。
项目包括:谷草转氨酶、谷丙转氨酶、碱性磷酸酶、γ-谷氨酰基转移酶、总蛋白、白蛋白、尿素氮、尿酸、肌酐、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、葡萄糖、肌酸激酶、乳酸脱氢酶、α-淀粉酶、钙、总胆红素。
2.5.2无参考物质
检测相应项目时,当该项目为无证参考物质,检测相应工作校准品,量值传递的正确度应符合|E n|≤1。
项目包括:直接胆红素、总胆汁酸、α-羟丁酸脱氢酶、胰淀粉酶、胆碱酯酶、亮氨酸氨基转肽酶、谷氨酸脱氢酶、乳酸、脂肪酶。
2.6均匀性
2.6.1瓶内均匀性
瓶内均匀性CV 应≤10%。
2.6.2瓶间均匀性
瓶间均匀性CV 应≤10%。
1。
铜测定试剂盒(PAESA显色剂法)产品技术要求baiding

铜测定试剂盒(PAESA显色剂法)适用范围:用于体外定量测定人血清中铜的含量。
1.1 规格校准品(选配):1×1mL。
1.2 组成:注:校准品靶值详见包装标签。
2.1 外观2.1.1试剂1:无色液体,无浑浊,无不溶物。
2.1.2试剂2:红色液体。
2.1.3校准品:无色至淡黄色液体。
2.1.4包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度试剂空白吸光度≤0.8。
2.4 分析灵敏度样本浓度为30μmol/L时,吸光度差值应≥0.02。
2.5 线性在[10,79] μmol/L的范围内,线性相关系数r≥0.990。
测试浓度在[10,30] μmol/L 时,绝对偏差应不超过±3.0μmol/L;测试浓度在(30,79] μmol/L时,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于5%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度用国家标准物质 GBW09152,对试剂盒进行测试,准确性偏差应不超过±10%。
2.8 校准品瓶内重复性校准品瓶内重复性(CV)应不大于10%。
2.9 溯源性根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准品溯源至国家标准物质GBW09152。
2.10 稳定性2.10.1校准品开瓶稳定性校准品开瓶后2℃~8℃密封避光保存可稳定3天。
稳定期过后4小时内进行测试,测试结果与初测值的相对偏差应不超过±10%。
2.10.2效期稳定性原包装试剂盒在2℃~8℃密封避光保存条件下有效期为12个月。
有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1、2.7和2.8的要求。
白蛋白测定试剂盒(溴甲酚绿法)产品技术要求baiding

白蛋白测定试剂盒(溴甲酚绿法)
适用范围:本试剂用于体外定量测定人血清中白蛋白的含量。
1.1产品型号/规格
产品组成:
2.1 外观
2.1.1 试剂为棕黄色液体,无混浊,无未溶解物。
2.1.2 校准品为浅黄色液体,无混浊,无未溶解物。
2.1.3 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度
A≤0.250(光径1.0cm,630nm±20nm 波长)。
2.4 分析灵敏度
测定5g/L样本,吸光度变化在0.04~0.07范围内。
2.5 线性区间
2.5.1 [2,60]g/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.5.2 [2,10]g/L范围内,线性绝对偏差应不超过±1g/L,(10,60]g/L范围内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
变异系数CV≤2.0%。
2.6.2 批间差
批间相对极差≤5.0%。
2.7 准确度
相对偏差在±6%范围内(测试国家标准物质GBW(E)090619)。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.1、2.3、2.4、2.5、2.6.1、和2.7要求。
中性粒细胞明胶酶相关脂质运载蛋白校准品产品技术要求baiding

中性粒细胞明胶酶相关脂质运载蛋白校准品适用范围:与本公司生产的中性粒细胞明胶酶相关脂质运载蛋白测定试剂盒(免疫比浊法)配套使用,用于检测系统的校准。
1.1 型号0.5ml×6(液体,6水平)。
产品组成磷酸盐缓冲液,浓度:20mmol/L;BSA,浓度:1g/L;水平1: 重组人中性粒细胞明胶酶相关脂质运载蛋白,目标浓度:0mg/L;水平2: 重组人中性粒细胞明胶酶相关脂质运载蛋白,目标浓度:150mg/L;水平3: 重组人中性粒细胞明胶酶相关脂质运载蛋白,目标浓度:600mg/L;水平4: 重组人中性粒细胞明胶酶相关脂质运载蛋白,目标浓度:1500mg/L;水平5: 重组人中性粒细胞明胶酶相关脂质运载蛋白,目标浓度:3000mg/L;水平6: 重组人中性粒细胞明胶酶相关脂质运载蛋白,目标浓度:5000mg/L。
2.1 外观2.1.1 试剂为液体,无色至淡黄色,无可见不溶物。
2.1.2 包装外观应整洁,标签字迹清晰,不易脱落。
2.2 装量净含量不少于标示值。
2.3 量值溯源量值溯源到柏定公司内部工作校准品,并与北京九强生物技术股份有限公司生产的中性粒细胞明胶酶相关脂质运载蛋白测定试剂盒(胶乳增强免疫比浊法)比对验证。
2.4 准确度与已上市产品进行对比试验,相关系数r≥0.975,[50,500]μg/L区间内,绝对偏差应介于±50μg/L之间;(500,5000]μg/L区间内,相对偏差应介于±10%之间。
2.5 批内重复性CV≤5%。
2.6 稳定性2.6.1 开瓶稳定性产品首次开封后2℃~8℃避光保存可稳定3天,稳定期过后4小时内进行测试(水平1除外),计算测试结果与复溶后初测值的绝对偏差或者相对偏差。
水平2的绝对偏差应不超过±50μg /mL;水平3、水平4、水平5和水平6的相对偏差应不超过±10%。
2.6.2 效期稳定性原装产品在2℃~8℃避光保存可稳定12个月。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生化多项校准品
适用范围:与本公司生产的试剂盒配套使用,用于丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、γ-谷氨酰基转移酶、碱性磷酸酶、肌酸激酶、乳酸脱氢酶、α-羟丁酸脱氢酶、胆碱酯酶、α-淀粉酶、5’-核苷酸酶、乳酸脱氢酶同工酶1、线粒体天门冬氨酸氨基转移酶、亮氨酸氨基肽酶、胰淀粉酶、脂肪酶、谷氨酸脱氢酶、乳酸、不饱和铁结合力、白蛋白、总蛋白、甘油三酯、胆固醇、总胆汁酸、尿素、尿酸、肌酐、总胆红素、直接胆红素、葡萄糖、铁、钙、镁、磷共33个项目检测系统的校准。
1.1 包装规格
1×3mL;5×3mL;10×3mL;20×3mL;1×5mL;5×5mL;10×5mL;20×5mL。
1.2 主要组成成分
冻干粉,单水平。
人血清基质(20%)中添加生物活性物质及化学添加物,稳定剂20g/L。
目标浓度见下表:
校准品靶值批特异,详见靶值单。
2.1 外观
2.1.1 试剂为冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.2 包装外观应整洁,标签字迹清晰,不易脱落。
2.2 水分含量
水分含量不超过3%。
2.3 赋值结果及不确定度的表示方式
赋值结果及不确定度的表达方式应符合(赋值结果,扩展不确定度)。
2.4 量值溯源
根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源情况见下表:
2.5 正确度
2.5.1 量值溯源至国家标准物质的项目使用校准品校准后测试国家标准物质,量值传递的正确度En绝对值≤1。
2.5.2 量值溯源至公司内部工作校准品的的项目测试工作校准品,量值传递的正确度En绝对值≤1。
2.6 均匀性
2.6.1 瓶内均匀性
赋值结果的瓶内均匀性(CV)见下表:
2.6.2 瓶间均匀性
赋值结果的瓶间均匀性(CV)不大于8%。
2.7 稳定性
2.7.1 效期稳定性
2℃~8℃避光保存可稳定12个月。
稳定期内赋值结果的变化趋势不显著。
2.7.2 复溶稳定性
复溶后置2℃~8℃避光密封保存,总胆红素、直接胆红素保存24小时,其它项目保存3天。
稳定期内赋值结果的变化趋势不显著。
