酮体质控品产品技术要求乐普
血糖、血酮体测试仪产品技术要求yicheng

血糖、血酮体测试仪适用范围:本产品与我公司生产注册的配套血糖试条及血酮体试条配合使用,主要用于医学临床常规血糖测试、血酮体测试和糖尿病人血糖自我测试、血酮体自我测试。
在监测血糖的同时,不定期监测血酮体,预防酮症酸中毒的现象。
1.1 产品型号1.2 结构组成测试仪主要由外壳、液晶显示屏、电路板组成。
测试系统主要由测试仪、血糖试条(选配、有注册证)、血酮体试条(选配、有注册证)、采血针(选配、外购有产品注册证厂家的产品)和采血笔(选配、外购有产品注册证厂家的产品)组成。
2.1 性能2.1.1 血糖测量2.1.1.1 测量精度:误差不超过±0.3mmol/L。
2.1.1.2 测量范围:1.7mmol/L~27.8mmol/L。
2.1.1.3 每例测定时间:≤30S 。
2.1.1.4 重复性:精密度应符合表1的要求。
表1 血糖测试系统重复性2.1.1.5 准确度:测试仪和血糖试条测量结果偏差的95%应符合表2的要求。
表2 血糖测试系统准确度2.1.2 血酮体测量2.1.2.1 测量精度:误差不超过±0.1mmol/L。
2.1.2.2 测量范围:0.3mmol/L~6.0mmol/L。
2.1.2.3 每例测定时间: 30S±1S。
2.1.2.4 重复性:精密度应符合表3的要求。
表3 血酮体测试系统重复性2.1.2.5 准确度:测试仪和TBS-I型血酮体试条对D-3-羟丁酸的回收率为80%~120%。
2.2 外观2.2.1 仪器的外观应整洁,文字和标示应清晰。
2.2.2 仪器上的塑料件应无起泡、开裂和变形。
2.3 其它功能2.3.1 血糖区可自动存储256次测试结果值,可查询并计算7、14、28天存储测试结果平均值。
2.3.2 血酮体区可自动存储10次测试结果值。
2.4 附件采血笔、采血针的要求:应选用医疗器械注册证在有效期内的采血笔、采血针。
2.5 环境试验环境试验应符合GB/T 14710—2009的要求,见附录A。
孕酮测定试剂盒(化学发光免疫分析法)产品技术要求新产业生物

医疗器械产品技术要求编号:孕酮测定试剂盒(化学发光免疫分析法)2性能指标2.1外观试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰、准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物;磁性微球悬浮液应可均匀分布,无肉眼可观察到的团聚颗粒,无异物,无块状沉淀。
2.2装量100测试/盒和50测试/盒规格各组分应不少于声称的额定装量(见表1)。
表1100测试/盒和50测试/盒两种规格各组分额定装量变异系数(CV)应≤5%。
2.4批间差批间变异系数(CV)应≤10%。
2.5准确度回收率应在(85%~115%)范围内。
2.6线性区间在[0.200,80.000]ng/mL浓度范围内,线性相关系数(r)应>0.9900。
2.7空白限空白限应≤0.025 ng/mL。
2.8检出限检出限应≤0.100 ng/mL。
2.9特异性1)添加皮质酮于孕酮样本中,获得待测样本中孕酮目标浓度为20.100ng/mL(允许相对偏差为±15%),皮质酮的浓度为10.000 ng/mL,测定结果的均值应在目标浓度平均值(M)±2倍标准差(SD)范围内。
2)添加17α-羟孕酮于孕酮样本中,获得待测样本中孕酮目标浓度为20.100 ng/mL(允许相对偏差为±15%),17α-羟孕酮的浓度为10.000 ng/mL,测定结果的均值应在目标浓度平均值(M)±2倍标准差(SD)范围内。
2.10产品校准品准确度相对偏差应在±10%范围内。
2.11产品校准品均匀性)应≤5%。
产品校准品均匀性(CV瓶间2.12质控品预期结果质控品1每次测定结果应在[0.700,1.300]ng/mL范围内,质控品2每次测定结果应在[14.000,26.000]ng/mL范围内。
2.13质控品均匀性质控品均匀性(CV)应≤5%。
瓶间。
孕酮(P)测定试剂盒(量子点荧光免疫层析法)产品技术要求蓝十字生物

孕酮(P)测定试剂盒(量子点荧光免疫层析法)适用范围:用于体外定量测定人血清、血浆、全血中孕酮(P)的含量。
1.1 包装规格10人份/盒,20人份/盒,25人份/盒,30人份/盒,40人份/盒,50人份/盒。
1.2 主要组成成分2.1 物理性状2.1.1外观试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
2.1.2 膜条宽度产品的膜条宽度应≥2.5 mm。
2.1.3 液体移行速度液体移行速度应不低于10 mm/min。
2.1.4 净含量试剂盒中稀释液净含量的相对偏差应不超过±15%。
2.2 检出限应不高于0.3 ng/mL。
2.3 准确度用孕酮有证参考物质(BCR-348R)作为样本进行测定,其测量结果的相对偏差应不超过±15%。
2.4 线性在线性区间 [0.8,50] ng/mL内,线性相关系数r应不小于0.990。
2.5 重复性在线性范围内,选择(2±0.2)ng/mL和(25±2.5)ng/mL浓度水平的样本,各重复检测10次,其变异系数(CV)应不大于15%。
2.6 批间差用三个批号的试剂盒分别选择(2±0.2)ng/mL和(25±2.5)ng/mL浓度水平的样本,各重复检测10次,所得结果的批间变异系数(CV)应不大于15%。
2.7 溯源性按照GB/T 2145-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》标准提供所用试剂盒内校准信息的来源、赋值过程以及测量不确定度等内容要求,校准信息溯源至国际标准参考物质(编号:BCR-348R)。
2.8 效期稳定性4℃~30℃保存,有效期为24个月。
取到期后3个月内的试剂盒进行测定,测定结果应符合2.2~2.5、2.9项的要求。
2.9 特异性分别添加潜在干扰物于含有孕酮的样本中,获得待测样本中孕酮目标浓度为20 ng/mL(允许相对偏差为±15 %),潜在干扰物浓度分别为10 ng/mL的皮质酮和10 ng/ml的17α-羟孕酮。
酮体检测试纸(β-羟丁酸脱氢酶法)产品技术要求乐普

酮体检测试纸(β-羟丁酸脱氢酶法)适用范围:本产品用于体外定量检测人新鲜指尖毛细血管全血样本中酮体(β-羟丁酸)的含量。
1.1产品型号/规格产品型号:KT S1100、KT S 1101包装规格:1人份/袋;10人份/盒;25人份/盒;50人份/盒。
1.2组成每盒由酮体检测试纸和CODE码(内含校准曲线)组成。
酮体检测试纸主要由测试电极、试剂、保护盖膜、PET基板组成。
其中试剂主要包含:β-羟丁酸脱氢酶(约0.2%)、辅酶NAD(约2.5%)、铁氰化钾(约48.2%),其他非反应物质(约49.1%)。
2.1物理性状2.1.1外观酮体检测试纸应整洁完整、无毛刺、无破损、无污染;正面的加样区洁净无污点。
2.1.2尺寸酮体检测试纸的尺寸:长(30±0.5)mm×宽(6±0.5)mm×厚(0.75±0.2)mm。
2.2线性酮体检测试纸在[0.2,8.0] mmol/L的范围内,线性相关系数r值≥0.975。
2.3重复性当酮体浓度在[0.2,2.0) mmol/L时,检测结果的标准差SD≤0.2mmol/L;当酮体浓度在[2.0,8.0] mmol/L时,检测结果的变异系数CV≤10%。
2.4批间差批间差≤15%。
2.5准确度当酮体浓度在[0.2,2.0) mmol/L时,检测结果的绝对偏差不超过±0.4 mmol/L;当酮体浓度在[2.0,8.0] mmol/L时,检测结果的相对偏差不超过±20%。
2.6稳定性将酮体检测试纸置于10℃~30℃的环境中24个月,效期后3个月内取样分别检测2.1、2.2、2.3、2.5项,结果符合各项的要求。
五元素(铜锌钙镁铁)质控液产品技术要求普析

五元素(铜锌钙镁铁)质控液
适用范围:与本公司的原子吸收光谱仪配套,用于临床机构体外测量人全血中铜、锌、钙、镁、铁元素含量时的质量控制。
1.1 产品规格:50mL×2瓶/盒(1号、2号)。
1.2 产品组成成分:铜、锌、钙、镁、铁、硝酸镧(0.0025%)、曲拉通(0.025%)、硝酸(0.5%)、牛血清(小于1%)、去离子水(大于95%)。
每套校准液由1号、2号两瓶不同浓度的溶液组成,具体浓度见表1。
表1质控液浓度表
2.1. 外观
a)质控液应澄清,无异物和絮状物;
b)质控液容器表面应光滑,无毛刺等缺陷;标签应字迹清晰。
2.2. 装量
各瓶溶液的装量应不少于50mL。
2.3. 赋值有效性
测量误差应不超过标称浓度±10%。
2.4. 均一性
变异系数CV≤10%。
2.5. 批间差
相对极差R≤10%。
2.6. 效期稳定性
质控液在0℃~30℃贮存条件下有效期为6个月,在过有效期后一个月内,质控液应符合2.1、2.3和2.4的要求。
临床化学校准血清产品技术要求乐普(北京)诊断技术

临床化学校准血清适用范围:与本公司生产的试剂盒配套使用,用于α-羟丁酸脱氢酶、白蛋白、碱性磷酸酶、丙氨酸氨基转移酶、α-淀粉酶、天门冬氨酸氨基转移酶、二氧化碳、总胆汁酸、直接胆红素、总胆红素、钙、胆固醇、胆碱酯酶、肌酸激酶、肌酐、谷氨酰氨基转移酶、葡萄糖、铁、乳酸脱氢酶、镁、无机磷、总蛋白、甘油三酯、尿素、尿酸、锌共26项检测系统的校准。
1.1 包装规格1×5mL;2×5mL;5×5mL;20×5mL。
1.2 主要组成成分冻干粉,单水平,人血清基质、防腐剂(0.1%)、冻干保护剂(2%)和稳定剂(0.1mol/L)。
具体项目及靶值范围见表1:表1 主要组成成分校准品靶值批特异,详见靶值单。
2.1 性状浅黄色至黄色冻干粉,复溶后为浅黄色至黄色透明液体。
2.2 水分含量采用烘干法进行测定,水分含量不超过3%。
2.3 量值溯源根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》中有关规定提供校准品的来源,赋值过程及测量不确定度等内容,具体项目及溯源信息见表2:表2 溯源信息2.4 赋值结果及其不确定度的表示方式赋值结果±扩展不确定度2.5 正确度使用该校准品校准后测量各项目的有证参考物质或制造商溯源文件声称的参考│≤1。
具体项目及参考物质信息见表3:物质,量值传递的正确度应符合│En表3 参考物质信息2.6 均匀性2.6.1 瓶内均匀性赋值结果的瓶内均匀性(变异系数)应不大于10%。
2.6.2 瓶间均匀性赋值结果的瓶间均匀性(变异系数)应不大于10%。
2.7 稳定性2.7.1 复溶稳定性本品复溶后,2~8℃可保持7天。
-20℃冰冻保持可稳定28天。
在稳定期内赋值结果的变化趋势不显著。
2.7.2 效期稳定性在2℃~8℃条件下贮存24个月,稳定期内赋值结果的变化趋势不显著。
乐普(北京)免疫球蛋白五项校准品产品技术要求

免疫球蛋白五项校准品
结构组成:
液体剂型,单水平,人血清基质、防腐剂(0.1%)和稳定剂(0.1mol/L),具体项目及靶值范围见表1:
表1 主要组成成分
预期用途:与本公司生产的试剂盒配套使用,用于免疫球蛋白A、免疫球蛋白G、免疫球蛋白M、补体C3、补体C4共5项检测系统的校准。
2.1 性状
浅黄色或无色透明液体。
2.2 装量
装量应不少于标示值。
2.3 量值溯源
根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》中有关规定提供校准品的来源,赋值过程及测量不确定度等内容,溯源至国际参考物质ERM-DA470k/IFCC。
2.4 赋值结果及其不确定度
赋值结果±扩展不确定度
2.5 正确度
使用该校准品校准后测量各项目的国际参考物质ERM-DA470k/IFCC,量值传递的│≤1。
正确度应符合│E
n
2.6 均匀性
2.6.1 瓶内均匀性
赋值结果的瓶内均匀性(变异系数)应不大于10%。
2.6.2 瓶间均匀性
赋值结果的瓶间均匀性(变异系数)应不大于10%。
2.7 稳定性
2.7.1 首次开封后稳定性
本品首次开封后,在2℃~8℃条件保存15天,在稳定期内赋值结果的变化趋势不显著。
2.7.2 效期稳定性
在2℃~8℃条件下贮存12个月,稳定期内赋值结果的变化趋势不显著。
酮体含量检测试剂盒(血清、血浆、尿液等)说明书__ 紫外分光光度法UPLC-MS-6025

酮体含量检测试剂盒(血清、血浆、尿液等)说明书紫外分光光度法货号:UPLC-MS-6025规格:50T/48S产品内容:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件试剂一A液液体55mL×1瓶4℃保存试剂一B液液体55mL×1瓶4℃保存试剂二A液粉剂×2支-20℃保存试剂二B液粉剂×2支-20℃保存试剂三粉剂×3支-20℃保存标准品1粉剂×1支4℃保存标准品2粉剂×1支-20℃保存溶液的配制:1、试剂二A液:临用前取一支加入1.2mL蒸馏水,充分溶解。
用不完的试剂分装后-20℃可保存3周。
避免反复冻融;2、试剂二B液:临用前取一支加入600μL蒸馏水,充分溶解。
用不完的试剂分装后-20℃可保存3周。
避免反复冻融;3、试剂三:临用前取一支加入400μL蒸馏水,充分溶解。
用不完的试剂分装后-20℃保存,可以保存3周。
避免反复冻融;4、标准品1:8mg3-羟基丁酸钠。
临用前加入0.98mL蒸馏水,充分溶解,即8mg/mL3-羟基丁酸钠标准溶液,4℃可以保存4周。
临用前根据试验所需量用蒸馏水稀释成0.2mg/mL标准溶液待用,即为标准溶液1;5、标准品2:8mg乙酰乙酸锂。
临用前加入0.95mL蒸馏水,充分溶解,即8mg/mL乙酰乙酸锂标准溶液,-20℃可以保存4周。
临用前根据试验所需量用蒸馏水稀释成0.05mg/mL标准溶液待用,即标准溶液2;6、BOH工作液配制:临用前根据试验所需量将试剂一A液、试剂二A液、试剂三按照850μL:40μL:10μL(共900μL,1T的量)的比例配成工作液,充分混匀,置于37℃保温15min(此步骤不可省略),现用现配,工作液在4h内用完;7、AcAc工作液配制:临用前根据试验所需量将试剂一B液、试剂二B液、试剂三按照870μL:20μL:10μL(共900μL,1T的量)的比例配成工作液,充分混匀,置于37℃保温15min(此步骤不可省略),现用现配,工作液在4h内用完。
丙酮酸测定试剂盒(乳酸脱氢酶法)产品技术要求jiuqiang

丙酮酸测定试剂盒(乳酸脱氢酶法)适用范围:用于体外定量测定人体血清中丙酮酸(PYR)的含量,临床主要用于糖尿病引起的酮症酸中毒的辅助诊断。
1.1包装规格包装规格见表1表1 包装规格1.2主要组成成分主要组成成分见表2。
表2 主要组成成分注:不同批号的校准品、质控品赋值有差异,具体赋值详见靶值单。
2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A340nm下测定空白吸光度应≥0.5000。
2.4 准确度回收试验:在临床样本中加入一定体积的校准品溶液,进行测定,回收率在90%~110%之间。
2.5 分析灵敏度样品浓度为200 µmol/L时,其吸光度变化在0.0400~0.1200之间。
2.6 线性区间在[30,1000]µmol/L区间内,线性相关系数r≥0.990,在[30,150]µmol/L区间内绝对偏差应不超过±15µm ol/L,在(150,1000]µmol/L区间内相对偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性对高、低不同浓度的同一血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
2.9 校准品溯源性按GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供所有产品校准的来源、赋值过程以及测量不确定度,试剂盒校准品溯源至Sigma公司。
检验科尿分析酮体SOP文件

11.2 认真审核每一个测定结果,审核者对发出报告结果的准确性和可靠性负
责,并在报告单的审核者处签名。
12 有关引用程序与文件
12.1 优利特200B分析仪仪器标准操作规程。。
12.2 临检检验室内质控标准操作程序。
12.3 检验结果审核程序。
8 检验结果的报告及范围
8.1 结果的报告
8.1.1 结果经审核确认准确无误后发出报告。
8.1.2 报告单上标明结果的计量单位、参考区间、报告日期、时间、操作者和审核者签名,并有与申请单相同的医学信息。
8.1.3 如收到标本的质量可能对测定结果有影响的也在报告单上指出。
9 参考范围及医学决定水平:阴性
检验科管理文件
项目SOP文件 LJ-URIT200B-8 版本:2014-09 生效日期:2014-09
尿分析酮体 共 3 页第1页
1 检验申请
单独检验项目申请:尿析测定(酮体)临床医生根据需要提出检验申请。
2 标本采集与处理
2标本采集与要求
2.1收集尿液的容器和尿量: 收集尿液标本的容器多种多样,留取标本最基本的要求是使用清洁、干燥、方便的容器。无论采用何种容器,都必须满足下列要求:门诊病人凭检验申请2.1.2单在检验科领取领取一次性尿杯。根据检验单要求留取尿样,交由检验科小便检验工作人员。
(1)当月所有测定项目质控数据汇总表。
(2)所有测定项目该月的失控情况汇总表。
5.1.6室内质控数据的周期性评价
每个月的月末,都要对当月室内质控数据的平均数、标准差、变异系数及累积平均数、标准差、变异系数进行评价,查看与以往各月的平均数之间、标准差之间、变异系数之间是否有明显不同。如果发现有显著性的变异,就要对质控图的均值、标准差进行修改,并要对质控方法重新进行设计。
孕酮(P)测定试剂盒(化学发光免疫分析法) 产品技术要求--性能指标

孕酮测定试剂盒(化学发光免疫分析法)1.性能指标2.1 试剂性能指标2.1.1外观和物理检查试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
其中:酶标记物应为清澈均匀的液体,无沉淀,无絮状物;磁微粒应无板结,液体内无絮状物,无异物;2.1.2装量试剂盒各组分装量应不少于标示量。
2.1.3 检出限检出限应不高于0.48nmol/L;空白限应不高于0.32nmol/L。
2.1.4 准确度相对偏差应在±10%范围内。
2.1.5 线性范围在[0.48,127] nmol/L,相关系数r应不小于0.99002.1.6 重复性使用同一批试剂盒测试浓度[2,14]nmol/L和[46,85]nmol/L的样品,其测试结果的变异系数(CV)应不大于8.0 %。
2.1.7 批间差用三批试剂盒测试浓度[2,14]nmol/L和[46,85]nmol/L的样品,其测试结果的变异系数(CV)应不大于15.0 %。
2.1.8 质控品测定值测试试剂盒内高低值质控品,其测定结果应均在质控品靶值范围内。
2.1.9 特异性分别添加潜在干扰物于含有孕酮的样本中,获得待测样本中孕酮目标浓度为64nmol/L(允许相对偏差为±15%),干扰物浓度如下,各个样本测量结果的均值应在M±2SD范围内。
(M为目标浓度平均值,SD为标准差)干扰物配制浓度分别为11-去氧皮质酮600ng/mL、孕烯醇酮200ng/ mL、皮质酮1000ng/mL、17a-羟基孕酮50ng/ mL、17β-雌二醇10ng/ mL、雌酮为0.1ug/mL、雌三醇10ng/ mL、醛甾酮50ng/ mL、丹那挫100 ng/ mL、11-脱氧皮质醇100 ng/ mL、强的松龙200ng/ mL、皮质醇为1ug/mL、睾酮为1μg/mL、克罗米酚为25μg/mL、保泰松为25μg/mL2.2校准品性能指标2.2.1外观和性状校准品应为澄清液体,无肉眼可见杂质。
五元素(铜锌钙镁铁)质控液产品技术要求puxi
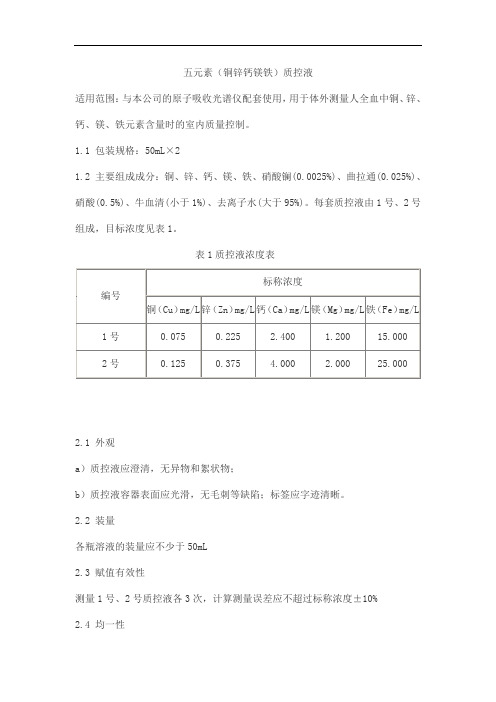
五元素(铜锌钙镁铁)质控液
适用范围:与本公司的原子吸收光谱仪配套使用,用于体外测量人全血中铜、锌、钙、镁、铁元素含量时的室内质量控制。
1.1 包装规格:50mL×2
1.2 主要组成成分:铜、锌、钙、镁、铁、硝酸镧(0.0025%)、曲拉通(0.025%)、硝酸(0.5%)、牛血清(小于1%)、去离子水(大于95%)。
每套质控液由1号、2号组成,目标浓度见表1。
表1质控液浓度表
2.1 外观
a)质控液应澄清,无异物和絮状物;
b)质控液容器表面应光滑,无毛刺等缺陷;标签应字迹清晰。
2.2 装量
各瓶溶液的装量应不少于50mL
2.3 赋值有效性
测量1号、2号质控液各3次,计算测量误差应不超过标称浓度±10%
2.4 均一性
测量2号质控液10次,要求变异系数CV≤10%
2.5 批间差
测量3个不同批次的2号质控液各3次,要求相对极差R≤10%
2.6 效期稳定性
质控液在0℃~30℃贮存条件下有效期为6个月,在过有效期后一个月内,质控液应符合2.1、2.3和2.4的要求。
醛固酮校准品产品技术要求mairui

1 性能指标
2.1外观和性状
2.1.1颜色性状
校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为塑料管,盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、校准卡应完整、清晰牢固。
塑料外盖与塑料管身配合后应无渗漏;塑料外盖应无明显划痕、崩缺。
2.2装量
校准品C0、C1 和C2 容量应不少于 1.0 mL。
2.3溯源性
2.3.1校准信息卡
校准品应可提供一份校准卡,包含校准品有效期和校准品各浓度水平的信息。
2.3.2赋值准确性
经校准品校准的迈瑞全自动化学发光免疫分析仪检测具有溯源性的两个浓度水平的正确度控制品,结果的偏倚应在±10.0% 范围内。
2.4均一性
2.4.1瓶内均一性
校准品瓶内均一性C0以标准偏差SD为指标,满足SD≤14.5pg/mL;C1和C2以变异系数CV为指标,满足CV≤10.0%。
2.4.2瓶间均一性
校准品瓶间均一性C0以标准偏差SD为指标,满足SD≤14.5pg/mL;C1和C2以变异系数CV为指标,满足CV≤10.0%。
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I 型和HIV-II
型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
血糖血酮体测试仪产品技术要求yicheng

血糖血酮体测试仪适用范围:本产品与怡成公司生产注册的5D血糖试条、TBS-I型血酮体试条配合使用。
主要用于医学临床常规末梢全血及静脉全血葡萄糖浓度的监测和糖尿病人血糖浓度的自我监测;在监测血糖的同时,监测血酮体。
1.1 产品型号5DT-4型。
1.2 产品组成主要由测试仪、血糖试条(选配、在产有注册证)、血酮体试条(选配、在产有注册证)、采血针(选配、外购有产品注册证厂家的产品)和采血笔(选配、外购有产品注册证厂家的产品)组成。
2.1 性能2.1.1 测试仪2.1.1.1 血糖测试2.1.1.1.1 测试精度:误差不超过±0.3mmol/L。
2.1.1.1.2 测试范围: 1.1mmol/L~33.3mmol/L 。
2.1.1.1.3 每例测定时间: 5S±0.5S。
2.1.1.2 血酮体测试2.1.1.2.1 测试精度:误差不超过±0.1mmol/L。
2.1.1.2.2 测试范围:0.3mmol/L~6.0mmol/L。
2.1.1.2.3 每例测定时间: 30S±1S。
2.1.2 测试系统2.1.2.1 血糖测试2.1.2.1.1 重复性:精密度应符合表1的要求。
表1 血糖测试系统重复性要求测试范围精密度<5.5mmol/L(<100mg/dL)SD<0.42mmol/L(<7.7mg/dL)≥5.5mmol/L(≥100mg/dL)CV<7.5%2.1.2.1.2 准确度血糖仪和血糖试条的系统准确度应符合下列要求:测量结果偏差的95%应符合表2的要求。
表2 血糖测试系统准确度要求测试范围允许偏差≤4.2mmol/L (≤75mg/dL)不超过±0.83mmol/L(±15mg/dL)>4.2mmol/L (>75mg/dL)不超过±20%2.1.2.2 血酮体测试2.1.2.2.1 重复性:精密度应符合表3的要求。
酮体质控液产品技术要求北京怡成生物电子

酮体质控液
适用范围:与怡成公司生产的酮体测试系统配套使用,用于酮体测试系统的质量控制。
1.1 包装规格
水平1:2.5mL/瓶、5mL/瓶
水平2:2.5mL/瓶、5mL/瓶
1.2 主要组成成分
水平1: D-3-羟丁酸0.38%,磷酸二氢钾0.68%,磷酸氢二钾
1.17%, Proclin 300 0.0344%
浓度范围:0.50mmol/L~0.70mmol/L。
质控范围:每批定值,批特异。
水平2: D-3-羟丁酸1.26%,磷酸二氢钾0.68%,磷酸氢二钾
1.17%, Proclin 300 0.0344%
浓度范围:1.80mmol/L~2.20mmol/L。
质控范围:每批定值,批特异。
2.1 外观:瓶盖密闭性好,无渗漏,溶液无色,澄清无杂质。
2.2 装量:实际装量应不小于标称体积。
2.3 赋值有效性:对酮体质控液进行20次测试,95%的结果落在规定的质控范围之内。
2.4 均一性:
2.4.1 瓶内精密度:
2.4.2 瓶间精密度:
2.5 稳定性:2℃~30℃保存,生产日期起有效期12个月。
酮体质控液有效期到期后一个月内的产品,应符合2.1、2.3、2.4的要求。
心肌标志物质控品产品技术要求北京乐普医疗科技
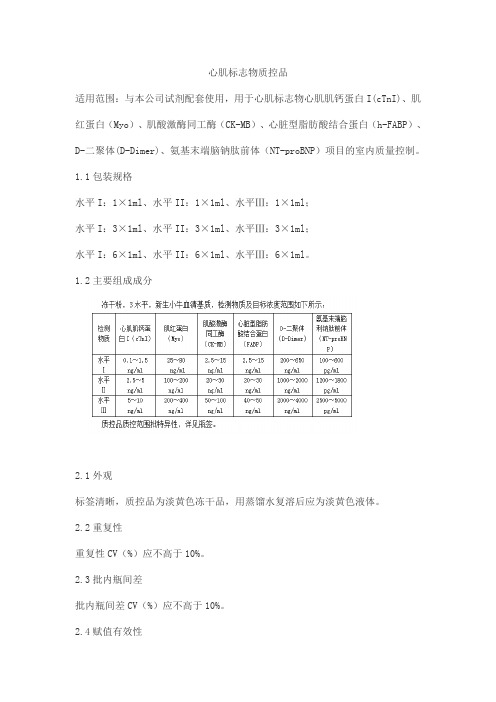
心肌标志物质控品
适用范围:与本公司试剂配套使用,用于心肌标志物心肌肌钙蛋白I(cTnI)、肌红蛋白(Myo)、肌酸激酶同工酶(CK-MB)、心脏型脂肪酸结合蛋白(h-FABP)、D-二聚体(D-Dimer)、氨基末端脑钠肽前体(NT-proBNP)项目的室内质量控制。
1.1包装规格
水平I:1×1ml、水平II:1×1ml、水平Ⅲ:1×1ml;
水平I:3×1ml、水平II:3×1ml、水平Ⅲ:3×1ml;
水平I:6×1ml、水平II:6×1ml、水平Ⅲ:6×1ml。
1.2主要组成成分
2.1外观
标签清晰,质控品为淡黄色冻干品,用蒸馏水复溶后应为淡黄色液体。
2.2重复性
重复性CV(%)应不高于10%。
2.3批内瓶间差
批内瓶间差CV(%)应不高于10%。
2.4赋值有效性
检测结果应在质控范围内。
2.5稳定性
2.5.1复溶稳定性
质控品复溶后在2℃~16℃条件下4h后,产品性能应符合2.1、2.2、2.4规定的要求。
2.5.2效期稳定性
质控品在2℃~8℃的环境中放置18个月后,产品性能应符合2.1、2.2、2.4规定的要求。
血糖、酮体、尿酸检测仪产品技术要求yuepu

血糖、酮体、尿酸检测仪适用范围:血糖、酮体、尿酸检测仪与本公司生产的配套血糖试纸、酮体检测试纸、尿酸检测试纸联合使用,用于体外检测人新鲜指尖毛细血管全血中葡萄糖、酮体、尿酸的浓度,与配套血糖试纸(葡萄糖脱氢酶法)联合使用还可以检测静脉全血中葡萄糖的浓度。
1.1型号血糖、酮体、尿酸检测仪型号为“Poctor M3100”、“Poctor M3101”其中“Poctor”为“P博士”缩写,“M3100”、“M3101”为产品系列号。
1.2产品组成血糖、酮体、尿酸检测仪由主机组成,主机由电路板、功能按钮、显示屏、电池、试纸插入口、外壳组成。
1.3 差异说明2.性能指标2.1 外观a) 仪器外观应清洁,无划痕、无毛刺等缺陷;b) 面板上图形、符号和文字应该准确、清晰、均匀;c) 紧固件连接应该牢固可靠,不得有松动现象。
2.2 检测仪仪器系统测量重复性:血糖系统重复测试结果的精密度符合表1.1的要求。
表1.1 血糖系统测量重复性酮体系统重复测试结果的精密度符合表1.2的要求。
表1.2 酮体系统测量重复性尿酸系统重复测试结果的精密度符合表1.3的要求。
表1.3 尿酸系统测量重复性2.3检测仪系统准确度血糖系统测量结果偏差的95%应符合表2.1的要求。
表2.1 准确度要求酮体系统测量结果应符合表2.2 的要求。
表2.2 准确度要求尿酸系统测量结果应符合表2.3的要求表2.3 准确度要求2.4 检测仪测量质控品血糖测量质控品精密度:变异系数(CV)应在10%以内。
酮体测量质控品精密度:变异系数(CV)应在10%以内。
尿酸测量质控品精密度:变异系数(CV)应在10%以内。
2.5 测量范围血糖测量范围为1.1~33.3 mmol/L。
酮体测量范围为0.2~8.0 mmol/L。
尿酸测量范围为200 ~1200 umol/L。
2.6 测量时间血糖测量时间小于10s。
酮体测量时间小于15s。
尿酸测量时间小于25s。
2.7 环境试验环境试验应符合GB/T 14710-2009中气候环境为Ⅱ组,机械环境为II组中适用条款的要求,具体内容见附录A。
酮体检测条说明书

酮体检测条说明书酮体检测条说明书【产品名称】..............................1【包装规格】..............................1【预期用途】..............................1【检验原理】..............................2【主要组成成份】..........................2【储存条件及有效期】......................3【适用仪器】..............................3【样本要求】..............................3【检验方法】..............................4【参考值(参考范围)】......................5【检验结果的解释】........................5【检验方法的局限性】......................6【产品性能指标】..........................6【注意事项】..............................8【参考文献】..............................8【生产企业】..............................9【医疗器械注册证书编号】..................9【产品标准编号】..........................9【说明书批准及修改日期】 (9)【产品名称】通用名称:酮体检测条英文名称:PTS PANELS Ketone Test Strips 【包装规格】25人份/盒;6人份/盒【预期用途】PTS 公司生产的酮体检测条应用于定量检测 指尖全血中的酮体(β-羟基丁酸)。
本系统可用于 家用(自我测试)系统或专业应用系统。
血酮体测试仪产品技术要求yicheng

血酮体测试仪适用范围:本产品与我公司生产的TBS-I型血酮体试条配合使用,适用于体外检测人体毛细血管全血中的酮体的浓度。
1.1 产品型号T-1型。
1.2 产品结构血酮体测试仪结构含外壳、液晶显示屏和电路板。
2.1 性能2.1.1 测试仪2.1.1.1 测试精度:误差不超过±0.1mmol/L。
2.1.1.2 测试范围:0.3mmol/L~6.0mmol/L。
2.1.1.3 每例测定时间: 30S±1S。
2.1.2 测试系统2.1.2.1 重复性:精密度应符合表1的要求。
表1 重复性要求2.1.2.2 准确度:测试仪和TBS-I型血酮体试条对D-3-羟丁酸的回收率为80%~120%。
2.2 外观2.2.1 仪器的外观应整洁,文字和标示应清晰;2.2.2 仪器上的塑料件应无起泡、开裂和变形。
2.3 其它功能可自动存储1次测试结果值。
2.4 环境试验环境试验应符合GB/T 14710—2009中气候环境实验Ⅱ组,机械环境试验Ⅱ组的要求,见附录A。
2.5 电气安全试验瞬态过压设施类别为I类,额定污染等级为2级。
应符合GB 4793.1-2007《测量、控制和实验室用电气设备的安全要求第1部分:通用要求》、YY 0648-2008《测量、控制和实验室用电气设备的安全要求第2-101部分:体外诊断(IVD)医用设备的专用要求》以及GB 4793.9-2013《测量、控制和实验室用电气设备的安全要求第9部分:实验室用分析和其他目的自动和半自动设备的特殊要求》中适用条款的要求。
2.6 电磁兼容试验工科医设备的1组B类设备。
应符合GB/T 18268.1-2010 《测量、控制和实验室用的电设备电磁兼容性要求第1部分:通用要求》和GB/T 18268.26-2010 《测量、控制和实验室用的电设备电磁兼容性要求第26部分:特殊要求体外诊断(IVD)医疗设备》的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酮体质控品
适用范围:本产品与本公司生产的酮体检测试纸及血糖、酮体、尿酸检测仪配套使用,用于酮体检测项目的质量控制。
1.1规格
规格1:质控水平I 1×1mL 质控水平II 1×1mL
规格2:质控水平I 3×1mL 质控水平II 3×1mL
规格3:质控水平I 6×1mL 质控水平II 6×1mL
1.2组成
表1产品主要组成成分
质控水平I的靶值范围:0.8±0.1mmol/L;
质控水平II的靶值范围:2.4±0.3mmol/L。
批特异性:每批质控品的质控范围具有特异性,详情参见瓶签。
2.1外观
标签清晰,质控品为红色液体。
2.2重复性
批内重复性CV(%)应不高于10%。
2.3瓶间差
批内瓶间差CV(%)应不高于10%。
2.4赋值有效性
赋值有效性检测结果应在质控范围内。
2.5稳定性
将酮体质控品置于10℃~30℃的环境中保存18个月,效期后3个月内取样分别检测2.1、2.2、2.4项,结果应符合各项目的要求。
