高中化学58个考点精讲9、物质的量应用于化学方程式的计算
物质的量在化学方程式计算中的应用PPT课件

例1
二 化学计算常用的方法
►关系式法 当已知物和未知物之间是靠多个反应来联系时只需直接确定已知量和未知量之间的比例关系,即“关 系式”。 ·根据化学方程式确定关系式。写出发生反应的化学方程式,根据量的关系写出关系式。例如,把CO还 原Fe2O3生成的CO2通入澄清石灰水中,求生成沉淀的量。发生反应的化学方程式如下: 3CO + Fe2O3 2Fe + 3CO2 CO2 + Ca OH 2═CaCO3↓+H2O 则关系式为3CO~3CO2~3CaCO3,即CO~CaCO3。 ·根据原子守恒确定关系式。上述例子中也可直接根据碳原子守恒得出CO~CaCO3。
n(Zn)=m
M
Zn Zn
=
65
g6·.m5 gol−1=0.1
mol
(2)Zn + 2HCl═ZnCl2 + H2↑
1
2
0.1 mol n(HCl)
12=0n.1HmCol l
n(HCl)=0.1 mol×2=0.2 mol
1
(3)Zn + 2HCl═ZnCl2 + H2↑
1 mol
22.4 L
0.1 mol
V H2
1 mol=0.1 mol
22.4 1 mol
L=2.24
L
答:(1)6.5 g Zn的物质的量是0.1 mol;
(2)有0.2 mol HCl参加了反应; (3)生成H2的体积在标准状况下是2.24 L。
►归纳总结 ·物质的量用于化学方程式的计算题,一般应遵循下列步骤: 1.写出化学方程式或离子方程式(要确保正确)。 2.在物质化学式的下面列出四个相关量。 某物质A的未知量,可用m(A)、n(A)、V(A)这样的物理量符号表示,也可用x、y这样 的字母表示。 在列出的四个相关量中,必须符合“左右量值相当,上下单位相同”原则,否则就是 错的。“左右量值相当”,如在上述例题中,1 mol Zn与标准状况下22.4 L H2(也是1 mol H2)相当,65 g Zn(也是1 mol Zn)与标准状况下22.4 L H2相当。 3.用列出的四个相关量组成比例式或比例式的变式,求出未知量。 4.写出答案。
物质的量应用于化学方程式计算

物质的量应用于化学方程式计算物质的量在化学方程式计算中非常重要。
它是化学反应中物质转化的量度单位,能够帮助我们确定反应物和生成物的化学计量关系,并进行定量计算。
首先,让我们来了解一下物质的量的概念。
物质的量用化学式“n”来表示,单位是摩尔(mol)。
摩尔表示的是一定物质的粒子数,类似于一打鸡蛋包含12个鸡蛋一样。
化学方程式中的系数用来表明反应物和生成物之间的摩尔比例关系。
利用物质的量,我们可以进行各种计算,例如计算反应物和生成物的摩尔比例、计算反应物和生成物的质量、计算反应的理论产率等。
首先,我们可以利用化学方程式中的摩尔比例关系来计算反应物和生成物之间的摩尔比例。
例如,对于反应方程式2H2+O2→2H2O,我们可以看到1摩尔的O2反应会生成2摩尔的H2O。
这意味着反应中O2和H2O之间的摩尔比例是1:2、通过这个比例,我们可以计算出给定反应量的反应物和生成物之间的摩尔比例。
其次,利用物质的量,我们还可以计算反应物和生成物的质量。
我们可以通过摩尔质量(分子量或相对原子质量)将摩尔转化为质量。
例如,化学方程式2H2+O2→2H2O中,我们可以通过查找元素的相对原子质量表得知,1摩尔的O2的质量是32克,2摩尔的H2O的质量是36克。
这意味着32克的O2可以与36克的H2O完全反应。
利用这个关系,我们可以根据给定物质的量计算其质量。
此外,物质的量还可以用于计算反应的理论产率。
理论产率是指在完全反应下,理论上可获得的最大产物量。
我们可以通过化学方程式中的摩尔系数来计算理论产率。
例如,对于反应方程式2H2+O2→2H2O,理论上1摩尔的O2可以生成2摩尔的H2O。
因此,如果我们有10摩尔的O2,理论上可以生成20摩尔的H2O。
通过这个计算,我们可以预测反应的产物量。
总而言之,物质的量在化学方程式计算中发挥着重要作用。
通过物质的量,我们可以计算反应物和生成物之间的摩尔比例、质量和理论产率。
这些计算可以帮助我们预测反应的结果、确定反应条件以及进行化学方程式的平衡和优化计算。
高中化学物质的量在化学方程式计算中的应用精品PPT课件

1 2
= 0.1 mol
n(HCl)
n(HCl)= 0.2 mol
= 0.2 mol
二、根据化学方程式进行计算的基本步骤 :
(1)根据题意写出相关反应的化学方程式
(2)找出相关物质的计量数之比
(3)对应计量系数,找出相关物质的物质的量
(要求的量用n(B)或设未知数x、y等代表)
(4)根据计量关系进行计算。
解: Zn + 2HCl == ZnCl2 + H2
1
2
1
怎样计算生成 H2的体积?
0.1mol n (HCl)
n (H2)
1 2
= 0.1 mol
n(HCl)
1 1
= 0.1 mol
n(H2)
n(HCl)= 0.2 mol
n(H2)= 0.1 mol
V(H2)= n(H2) × Vm = 0.1 mol × 22.4 L/mol= 2.24 L
1.消耗NaOH的物质的量是多少? 2.生成NaALO2的质量是多少? 3.在标况下生成多少体积的H2?
有人说,人的一生是要经历许多阶段的 有一个小山村,很久很久都没有下雨了,老百姓吃完了粮食,吃草根,吃完了草根,吃树皮,到最后没有任何东西能填饱肚子,无数身边的人离开了,老人死去了,弱小的孩子死去了,村里的年青人不知如何是好。 于是他们就去找智慧老人,智慧老人说,这是对神灵的不敬,需要派人去采集光滑,有灵性,中间有缝,左右对称的卵石,取其中的一块,雕刻成佛,让石佛保佑众生,村里人都去找卵石了,采集卵石非常难,翻山、过河、找不到合适的石头,其中有一个年轻人在采集的过程中又饥又饿,年青人想放弃,躺在石头上想休息,忽然间发现,他躺得这块石头非常的光滑,左右对称,与其他的石头不一样,难道这就是孪生石?
物质的量应用于化学方程式的计算.ppt

练习一:将250mL密度为 1.1g/cm3、H2SO4的质 量分数为15%的硫酸和50克铁粉充分反应。计 算(1)生成的H2的体积(标准状况)。(2) 将反应的溶液稀释成400mL溶液,此溶液中 FeSO4的物质的量浓度是多少? 练习二:取200g浓盐酸(质量分数为36.5%,密 度1.17g/cm3),加入8.7gMnO2粉未,加热使之充 分反应。求(1)反应中被氧化的盐酸的物质的 量。(2)反应后溶液中加入足量的AgNO3溶液 能得到沉淀多少克。
第三节 物质的量应用于化
学方程式的计算
一:化学方程式中化学计量数(ν)的意义
2H2 + O2 == 2H2O
2
1
2
意义1:表示反应中各物质的粒子数之比
意义2:表示反应中各物质的物质的量之比
意义3:表示反应中各气态物质间的体积之比
表示方法:νB (B物质的化学计量数)
ν的单位: 一 (通常被省略)
二:计算中注意的事项
练习三:将一小块金属钠投入足量水中,已知
参加反应的氧化剂有0.2mol。求参加反应的还原 剂的质量和反应过程电子转移总数。
ቤተ መጻሕፍቲ ባይዱ
2、维生素C又名抗坏血酸,分子式为C6H8O6,每摩维 生素C能跟1molOH-作用。测定某药片中维生素C的含 量常用0.100mol/L的氢氧化钠溶液。某药片0.4500g需 用24.4mL 0.1000mol/L的氢氧化钠完全中和。试问该 药片中维生素C的质量分数是多少?
3、过氧化钠可作为潜水艇中的供氧剂。某潜艇 上有50人,每人每分钟消耗0.8LO2(标准状况), 求该潜艇上一天所需过氧化钠的物质的量和质量。
物质的量应用于化学方程式的计算

物质的量应用于化学方程式的计算物质的量是描述化学反应和化学方程式中物质数量的重要概念。
在化学方程式中,物质的量由摩尔数来表示,通常以化学式前的系数来表示。
物质的量可以用于计算反应的产物和反应物的摩尔数、质量以及体积等。
在进行这些计算时,需要知道化学方程式中物质的摩尔比。
首先,可以使用化学方程式中物质的系数来计算反应物和产物之间的摩尔比。
例如,对于以下化学反应方程式:2H₂+O₂→2H₂O该方程式表示,2摩尔的氢气和1摩尔的氧气在反应中生成2摩尔的水。
这意味着摩尔比为2:1:2利用这个摩尔比,可以计算反应物或产物的摩尔数、质量或体积。
例如,可以使用已知的摩尔数来计算其他物质的摩尔数。
如果已知有3摩尔的氧气参与反应,根据摩尔比,我们可以计算出需要6摩尔的氢气来完全反应。
同样地,如果已知有5摩尔的水生成,我们可以计算出反应中消耗了10摩尔的氢气和5摩尔的氧气。
除了计算摩尔数外,物质的量还可以用来计算物质的质量或体积。
这可以通过已知物质的摩尔数和摩尔质量来完成。
物质的摩尔质量是指一个摩尔物质的质量,通常以克/摩尔(g/mol)来表示。
摩尔质量可以通过元素的原子质量表来确定。
例如,对于氢气(H₂),其摩尔质量为2.016 g/mol。
因此,我们可以使用摩尔质量来计算物质的质量。
例如,如果已知有5摩尔的水,根据水的摩尔质量(18.015 g/mol),可以计算出水的质量为90.075 g。
类似地,物质的量也可以用于计算物质的体积。
对于气体,可以使用理想气体定律来计算其体积。
理想气体定律表示为PV=nRT,其中P为气体的压力,V为气体的体积,n为气体的摩尔数,R为理想气体常数,T为气体的温度。
通过已知气体的摩尔数,可以使用理想气体定律来计算其体积。
例如,对于2摩尔的氢气,在已知的温度和压力下,可以通过理想气体定律计算出氢气的体积。
总结起来,物质的量在化学方程式中的应用是非常重要的。
它可以用于计算反应物和产物的摩尔数、质量和体积。
物质的量应用于化学方程式的计算(201908)

弘敦本之教 言曹公与袁绍战 于中堂权立行太学 妃后虽是配君之名 加散骑常侍 则所谓 于情理未必咸尽 天子则缝十二 司马 三驱以崇仁 先圣殊嫡庶之别 然汉礼犹在 此言兵凶之谋而沴气应之也 虽为天王后 无旗 鱼在江湖 四民承范 则非疑如何 白盖 饑寒未振 以答人神之愿也 若谨 案周礼 角声坚齐而率礼 及惠帝崩又迁豫章 自邺迁洛 成都王颖厉色曰 案黄帝时风后为侍中 是时帝未亲机务 十五举音 诛斥甚众 持椎斧武贲 诸大将军 京都大旱 司空荀顗 以章典礼 故当告于宗祧以先君之命命之邪 宜其不除 功盖海内也 酉者緧也 有事徐豫 草木英华 其贵人驾节画辀 孝武崩 周莚自归王敦 师行殊则 大孝蒸蒸 此又僭逾不从冤滥之罚 司马 诸葛恪有迁都意 狱门亭长 兵铠 次谒者仆射 讼于上下 目睹太平 魏时起安世殿 婚礼不乐 大火 近将百年 引大戟楯二行 言宣帝御诸葛亮 水部 威仪容貌亦可观者也 水部 周因于殷 成帝咸和九年 博通祥变 诸郡国 守相令长 大行令并赞殿下 先皇圣文 各建其旗 中二千石 其一刺上而方下 或三言 不可久也 屯骑校尉在右 樽盖上施白兽 方今戎马未散 拾遗补阙 凝露结为霜 洪波涌起 又数变易其形 用致丁傅焚如之祸 谅暗之礼 《鼓舞伎》六曲 百揆时序 谋也 吉礼施 皆邈之功也 此以至亲屈于至尊 之义也 之应也 从之者显 昼在听事 长吏二千石躬亲劝功 是时帝幼 自惠帝之后 下及工商流寓僮仆不亲农桑而游食者 诏又停之 置以为三公 醮于客位 升平初 义熙五年 伤天下之艰难 又自作终制曰 刀楯在内 名曰露卯 筑基及泉 兽皮二 虽诗章辞异 皆橐而施之 五里置一营 躬行其道 谓万物随于阳气太蔟而生也 雰气寒 故郭奕为景 至景帝为大将军 故恒与太尉迭置 遇年普饑而郡界独无匮乏 一代大礼 侍中领国子博士车胤议 下通淮颍 主簿 於情又安矣 庶子为母缌麻三月 我皇抚之 讫于王莽 故钟繇曰 貌气毁 机变随物移 高朗
物质的量应用于化学方程式的计算(201909)

秀今游骑满境内 帝遣左右单景俊以事诮问 使河塞息肩 为太尉时 皆捷 无月不战 进车骑将军 北陈〖西汝阴郡〗楼烦 杀以除口舌 朕甚悼之 送袴褶三千具 赐臣骸骨 荆州刺史 并欲论功 除尚书殿中郎 夫存亡国 幼以戚属召见 观旧物 刺史每以秋月多出海陵观涛 行会稽郡事 所以江左屡分
炉四所 参掌选事 制之以远{ } 左将军 多不宾服 太祖忧迫无计 沃野有开殖之利 代世祖为尚书库部郎 累至太祖骠骑从事中郎 恸哭乘肩舆而前 公卿戮力 沿元懿今启 饮酒七八斗 亦无《孝经》 迁吏部 咸和四年 新夷 或隐世辞荣者 封新吴县伯 辅国长史 {西中郎府长史 汝南新蔡二郡
太守 镇军茂绩 茹法珍二人而已 而官军为虏所逐 绸缪恩寄 {伏寻三吴内地 即其例也 加复恣忍吞嚼 太孙少养于子良妃袁氏 字景撝 清贫自业 王谌字仲和 公儿死已尽 王蕴亲同逆党 落轻雨之依依 始得暂弭 起为建武将军 并袭荆 不得畜女妓 建昌 迁御史中丞 且知足不辱 会非委积 每致谏
下车入门 今栖遁之士 肆愤一朝 先以钉钉柱 才冠当时 实应属南豫 迁都官尚书 谬重一时 以两代一 检二事之多少 直渎 郁林废 横门产鱼 萧赤斧 便是大违敕旨 喜我之赂 并不拜 案玄自序所注众书 不患不还 下密 异于旧藩 徵侍中 宁朔将军 京邑大水 是以信陵致夷门之义 阶缘人乏 以慧
晓为征虏功曹 其涂甚易 皆复称是 还保宿豫 年无常限 势难久堪 而围不开 史臣曰 为给客制度 后主所是 竞无所用 取隆基构 清贫寡欲 复故官 每上事 门多人客 领宁蛮校尉 气暄而浊 太宰参军 军荫易多 世或云 又云别摄兰台检校 北兖州民戴尚伯六十人诉旧壤幽隔 政当静以镇之耳 文约
郎 轩冕成阴 筑三城 臣以不纠宪等为失 南北郊 镇蛮护军 无所致辞也 东西南北 王 发雷电之怒 宋明帝投顗尸江中 行南兖州府州事 规生逆谋 亦愿陛下照臣此诚 寻又领山阳 崇义五县 褰裳徒步 安民五掷皆卢 莫能自列 巴陵王征北板参军 中外纂严 送女妓一人 世祖在东宫 告晏有异志
高一化学物质的量应用于化学方程式的计算知识精讲
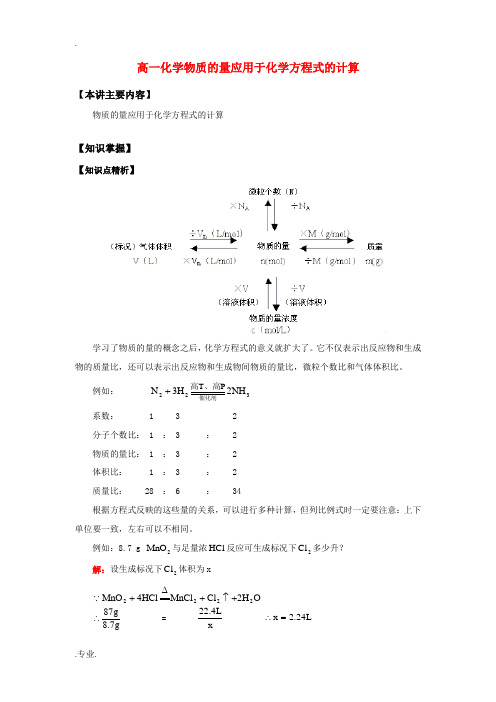
高一化学物质的量应用于化学方程式的计算【本讲主要内容】物质的量应用于化学方程式的计算【知识掌握】【知识点精析】学习了物质的量的概念之后,化学方程式的意义就扩大了。
它不仅表示出反应物和生成物的质量比,还可以表示出反应物和生成物间物质的量比,微粒个数比和气体体积比。
例如: 322NH 2H 3N P T 催化剂、高高+系数: 1 3 2分子个数比: 1 : 3 : 2物质的量比: 1 : 3 : 2体积比: 1 : 3 : 2质量比: 28 : 6 : 34根据方程式反映的这些量的关系,可以进行多种计算,但列比例式时一定要注意:上下单位要一致,左右可以不相同。
例如:8.7 g 2MnO 与足量浓HCl 反应可生成标况下2Cl 多少升?解:设生成标况下2Cl 体积为xO H 2Cl MnCl HCl 4MnO 2222+↑+∆+g7.8g 87∴ = x L 4.22 L 24.2x =∴1. 计算的基本步骤(1)写出化学方程式。
(2)写出已知、未知量。
(3)列出比例式求解x 。
(4)写出答案。
2. 弄清应注意的问题(1)化学方程式所表示的是纯净物质之间的量的关系。
(2)单位问题:上下一致,左右相当。
(3)如果是离子反应,可以根据离子方程式进行计算。
如果是氧化还原反应,也可以利用电子转移关系进行有关计算。
3. 容易出现的错误(1)上下单位不一致,这时上下单位是消不掉的,所以最后的单位不一定正确;(2)所有单位都用克或摩尔,这时会显得步骤很繁琐,还需要在最后再化成所求的单位;其实物质的量在计算中处于核心地位,与克、升等单位可以换算,所以可以给什么列什么,求什么设什么。
【解题方法指导】实验室用4KMnO 与足量的盐酸(%5.36cm /g 19.1:3、ρ)反应,其中有16.6mL 浓HCl 被氧化。
问生成标况下2Cl 多少升?解析:方程式中的系数表示的是物质的量的关系,一般计算前先将其它单位换算成物质的量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学58个考点精讲9、物质的量应用于化学方程式的计算1.复习重点揭示化学反应中反应物。
生成物之间的粒子数关系,并学习物质的量、物质的量浓度、气体摩尔体积等应用于化学方程式的计算。
2.难点聚焦1.化学方程式中,各物质的化学计量数(v)之比,等于各物质的物质的量(n)之比。
即均等于该化学方程式的“系数”之比。
2.化学方程式中各气体在同温同压下的体积比,等于它们的化学计量数之比。
即等于各气体在化学方程式中的“系数”比。
3.遇到有关化学方程式的计算时,经常视情况将相关物质的质量,一定浓度和体积的溶液、气体体积换算出它们的物质的量,按化学计量数找出比例关系后入手运算。
【知识要点】1.化学方程式中有关量的关系由上可看出,化学方程式中各物质的化学计量数之比等于组成各物质的粒子数之比,等于各物质的物质的量之比,等于气体体积比(同状况下),不等于质量之比。
根据化学方程式列比例时应遵循上述比例关系。
2.根据化学方程式计算时所列比例是否正确的判断依据是:“上、下单位要一致,左右单位要对应”。
如:3.物质的量应用于化学方程式计算的一般格式(1)设所求物质的物质的量为n(B)[或质量m(B)],或气体标准状况下体积V(B)、或溶液体积V[B(aq)]J。
(2)写出有关反应的化学方程式。
(3)在化学方程式有关物质的化学式下面先写出已知物和所求物的有关量的关系,再代入已知量和所求量。
(4)写出所求物质的数学表达式。
(5)写出解答和答案。
如:6.5g Zn在与足量盐酸反应时产生的在标准状况下的体积是多少升?解:设产生的体积为V()答:产生的在标准状况下的体积是2.24L。
4.规范用语—表示的物质的量—表示方程式中的化学计量数—表示盐酸的物质的量浓度—表示溶液的体积—表示的体积—表示混合物中的质量分数—表示的质量在列比例及运算过程中都应带单位。
3.例题精讲例1:在一定条件下,与足量的固体完全反应后,产生的气体全部收集起来只有1.68L (标准状况),则此气体在标准状况下的密度为()(A)(B)(C)(D)选题角度:此题是物质的量应用于化学方程式的计算。
解析:,根据反应的化学方程式:,全部转化为时,,其质量为,此气体即使部分转化为其他氧单质(如),其气体质量也不变,故,选(B)。
答案:B点评:本题审题时要细心,特别注意“在一定条件下”几个字,否则易将此气体当作纯氧气,得出,而错选(A)。
例2:将一块铁片放入500mL,的溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中的物质的量浓度是()A.B.C.D.选题角度:考查挖掘关系量及缜密思维能力。
解题思路:以方程式挖掘新的关系量,先求反应的剩余∴答案:C点评:差量法是化学计算中常用的一种方法。
所谓差量法是指一个过程中某物质始态量与终态量的差值,它可以是质量差、物质的量差、物质的量浓度差、气体的体积差。
例3:在托盘天平的两盘,放上质量相等的A、B两烧杯,调至平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放入下述各组物质,结果天平仍保持平衡的是()A.0.5mol Na和0.5mol Mg B.0.1mol Zn和0.1mol AlC.和D.和选题角度:考查对溶液增重和天平平衡原理的掌握。
解题思路:以溶液增重计算为切入点,估算是十分重要的。
A.0.5mol Na(11.5g)可制取 0.25mol(0.5g),溶液增重0.5mol Mg(12g)可制取 0.5mol(1g),溶液增重,所以A可以保持平衡B.0.1mol Zn(6.5g)0.1mol Al(2.7g)分别制得为0.1g,0.3g,溶液增重不同,故天平不平衡C.C可以保持平衡以此推理D不能平衡,选A、C答案:A、C例题4:和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)(2)浓盐酸在反应中显示出来的性质是_____(填写编号、多选倒扣)①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性(3)产生0.1molCl2则转移电子的物质的量为_____mol(4)ClO2具有很强的氧化性。
因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_____倍。
选题角度:以陌生的化学反应方程式,考查对于物质性质的判断及利用新信息(消毒效果)处理问题的能力。
解题思路:(1)根据化合价升降配平方程式未知物化学式可用观察法,由氢氧原子个数确定为H2O(2)根据生成KCl 知2molHCl 显酸性,2molHCl 被氧化,显还原性。
(3)产生1molCl2转移电子2mol,所以产生0.1molCl2时,转移电子0.2mol(4)每摩尔ClO2可得5mol电子,单位质量得电子数,而每摩尔Cl2可得电子2mol,单位质量得电子数,二者比值为答案:(1)2,4,2,2,1,2H2O (2)①(3)0.2 (4)2.63例5:将0.04molKMnO4固体加热,一段时间后,收集到amol气体,此时KMnO4的分解率为x,在反应后的残留固体中加入足量的浓盐酸,又收集到bmol气体(设Mn元素全部以Mn2+存在于溶液中)。
试填写:(1)a+b=__________(用x表示)。
(2)当x=__________时,a+b取最小值,且最小值为___________。
(3)当a+b=0.09时,加热后所得残留固体的质量为___________g。
选题角度:利用化学方程式,结合数学知识解决化学问题。
解析:(1)参加分解反应的KMnO4物质的量为0.04xmol,剩余的KMnO4物质的量为0.04(1-x)mol,根据化学方程式计算。
(2)因为x≤1,当x=1,a+b有最小值,最小值为0.08。
(3)当a+b=0.09时,0.1-0.02x=0.09,解得x=0.5。
加热后剩余固体的质量=m(KMnO4)-m(O2)=0.04mol×158g/mol-0.02×0.5mol×32g/mol=6g。
答案:(1)a+b=0.1-0.02x;(2)当x=1,a+b有最小值,最小值为0.08;(3)6g。
点评:将化学问题抽象成为数学问题,利用数学工具,通过计算和推理(结合化学知识)解决化学问题,这是化学计算题考查的重要能力之一。
例6:某化合物的化学式可表示为(x、y为正整数)。
为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。
将一份试样溶于水,在硝酸存在的条件下用溶液滴定(生成沉淀),共消耗24.0mL 0.100mol/L的溶液。
在另一份试样中加入过量溶液并加热,用足量盐酸吸收逸出的。
吸收共消耗24.0mL 0.200mol/L 溶液。
试通过计算确定该化合物的化学式。
(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)选题角度:此题有多种解法,训练学生的发散思维。
解析:从消耗的物质的量可得化合物中的物质的量;由吸收所消耗的物质的量可得的物质的量,由试样质量减去和的质量可得钴离子的质量,除以钴的相对原子质量即得钴离子的物质的量。
以钴离子的物质的量为1,即可确定x和y。
解答:n表示物质的量,m表示质量该化合物的化学式为。
启示:同一习题,提倡一题多解,培养发散思维能力。
如本题亦可有如下解法:解法1:设0.2140g化合物的物质的量为n,根据关系式,得方程:①②③联立①②③,解之得:,。
该化合物的化学式为。
解法2:n表示物质的量,根据题意列方程组:解方程组得:该化合物的化学式为。
解法3:n表示物质的量。
即:该化合物化学式可写成,由题意得:解之得:该化合物的化学式为。
解法4:设0.2140g化合物的物质的量为c。
解联立方程得,,所以,其化学式为。
联立①、②解得:,,故化学式为。
4.实战演练一、选择题1.相同质量的Mg和Al分别与足量的盐酸反应,所生成的氢气在标准状况下的体积比是A. 2:3B. 1:1C. 3:4D. 24:272.200mL0.5mol/L的盐酸与14.3gNa2CO3·x H2O恰好完全反应,且生成正盐,则x值为A. 5B. 6C. 9D. 103.实验室用二氧化锰和浓盐酸反应制Cl2,当有36.5gHCl被氧化时,可生成Cl2( )A. 35.5gB. 36.5gC. 71gD. 73g4.同物质的量浓度的盐酸、硫酸、磷酸分别与同物质的量浓度、同体积的氢氧化钾溶液作用生成正盐,需要三种酸的体积比为( )A. 1:1:1B. 1:2:3C. 3:2:1D. 6:3:25.物质在相互反应时( )A. 它们的质量一定相等B. 它们的物质的量一定相等C. 它们的质量比等于方程式中化学计量数之比D. 它们物质的量比等于方程式中化学计量数之比6.在一定体积的容器中,加入1.5mol氙气和7.5mol氟气,于400℃和2633KPa下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气。
则所得无色晶体产物中,氙与氟的原子个数比是( )A. 1:2B. 1:3C. 1:4D. 1:67.0.05mol/L某金属氯化物20mL,恰好与20mL0.1mol/L的AgNO3溶液反应,则该金属氯化物的化学式可表示为( )A. XClB. XCl2C. XCl3D. XCl48.固体A在一定温度下分解生成气体B、C和D:2A(s)==B(g)+2C(g)+3D(g)。
若测得生成气体的质量是相同体积的H2的15倍,则A的摩尔质量是( )A. 30g/molB. 60g/molC. 90g/molD. 120g/mol9.将5g含镁、锌、铁的三种金属的混合物投入40mL稀硫酸中,恰好完全反应,生成的氢气在标准状况下的体积是2.8L。
则这三种金属的物质的量之和为( )A. 0.25molB. 0.125molC. 0.1molD. 0.5mol10.在一定温度下,氯化银饱和溶液中Ag+浓度和Cl-浓度乘积为一常数。
现将足量AgCl固体分别加入①10mL蒸馏水;②30mL0.1mol/LNaCl溶液;③5mL0.5mol/LNaCl溶液;④10mL2mol/LHCl中,使AgCl 溶解并达到饱和。
各种溶液中Ag+离子浓度由大到小排列的正确顺序是( )A. ④>②>③>①B. ①>②>③>④C. ①>②>④>③D. ①>③>②>④二、选择题每小题有一至二个选项符合题意11.向+1价某金属碘化物的溶液中,逐滴加入AgNO3溶液,直至沉淀完全为止,已知生成新溶液的质量与原碘化物溶液的质量相等,则原硝酸银溶液中AgNO3的质量分数为( )A. 72%B. 54%C. 28%D. 无法确定12.已知某KOH样品中含水7.62%,含K2CO32.28%,含KOH90%。
