3.2.P.5.5杂质谱分析模板的整理
化学药品6类-注射用XXXX-CTD资料模板生产申报资料编号:3.2.P

1.理化性质及其对本品产品质量影响评估
在开发过程中对我司研发用XXXX的理化性质进行了研究,并分析评估了其对本品产品质量的影响,详见表3.2.P.2-4。
表3.2.P.2-4我司研发用XXXX理化性质及其对本品产品质量影响评估
项目
性质
对本品产品质量影响评估
性状
XXXX
--------
溶解性
XXXX
D.小试稳定性考察
将XXXX批小试重现样品进行强制降解试验和加速试验以考察小试样品初步的稳定性。
强制降解:高温(60℃)和光照(4500lx)
加速:40℃±2℃,RH75%±5%
包装条件:高温(60℃)考察为最小拟市售包装(低硼硅玻璃管制注射瓶和XXXX胶塞包装后,再压铝塑组合盖密闭),光照考察为去标签后的最小拟市售包装,加速为拟市售包装(低硼硅玻璃管制注射瓶和XXXX丁基橡胶塞包装后,再压铝塑组合盖密闭,外置小纸盒中放置)。
适量,控制药液在pHXX±XX范围内
注射用水加至
将上述制备的成品进行高温60℃考察10天,检测0天和10天样品的性状、pH及有关物质,结果见表3.2.P.2-12,有关物质图谱见图P.2-3-1~P.2-3-14。
表3.2.P.2-12中间体pH值筛选样品考察检测结果
批号Βιβλιοθήκη 考察条件性状pH
有关物质(%)
(3)小试设备
表3.2.P.2-9小试主要设备表
设备名称
型号
(4)XXXX筛选
一般来说,pH值对冻干粉针产品的稳定性影响较大。因此我司对本品中间体药液的pH值进行了重点筛选。
注射用XXXX国家标准中指出XXXX®产品的pH值按XXXXg加XXXXml水溶解后pH应为XXXX~XXXX。我司对XXXX®产品XXXX批的pH值检测结果为:XXXX。
化学药品新注册分类申报资料要求新旧对比表

立题目的与依据注册分类2:需要专门说明拟解决的问题和支持其具有明显临床优势的证据。
2号证明性文件申请制剂提供辅料的合法来源证明文件,包括辅料的批准证明文件、标准、检验报告、辅料生产企业的营业执照、《药品生产许可证》、销售发票、供货协议等的复印件4号自评估报告原4号:对主要结果结果的总结与评价的部分内容申请人对主要研究结果进行的总结,从安全性、有效性、质量可控性等方面对所申报品种进行综合评价,判断能否支持拟进行的临床试验或上市申请。
申请人应建立科学委员会,对品种研发过程及结果等进行全面审核,保障数据的科学性、完整性和真实性。
申请人应一并提交对研究资料的自查报告。
上市许可人根据《MAH制度试点方案》,符合试点行政区域、试点品种范围和申请人条件,申请成为药品MAH的申请人,应提交:1)资质证明性文件。
2)药品质量安全责任承担能力相关文件。
说明书相关5.1类药品说明书:提供生产国家或者地区药品管理机构核准的原文说明书,在生产国家或者地区上市使用的说明书实样,并附中文译本。
包装、标签设计样稿:需提供该药品在生产国家或者地区上市使用的包装、标签实样。
药品标准:中文本必须符合中国国家药品标准的格式。
原研药信息提供:合法来源证明(购货发票、赠送证明等)、实物照片、原研上市证明文件、说明书、质量标准(如有,请提供)、检验报告等。
非临床药物临床前研究应当执行有关管理规定,其中安全性评价研究必须执行GLP。
非临床安全性评价研究必须在经过GLP认证,符合GLP要求的机构进行。
2类需在相关研究中增加原研药品对临床报临床:临床试验计划及方案不需事先通过伦理委员会审查鼓励申请人提供的临床试验方案事先通过伦理委员会和科学委员会审查。
3类口服固体制剂:报临床前不需要BE3类口服固体制剂:报临床前进行BE备案及完成BE(疑惑:对已获得临床。
制剂C T D格式药学研究信息汇总表(4、5.2)
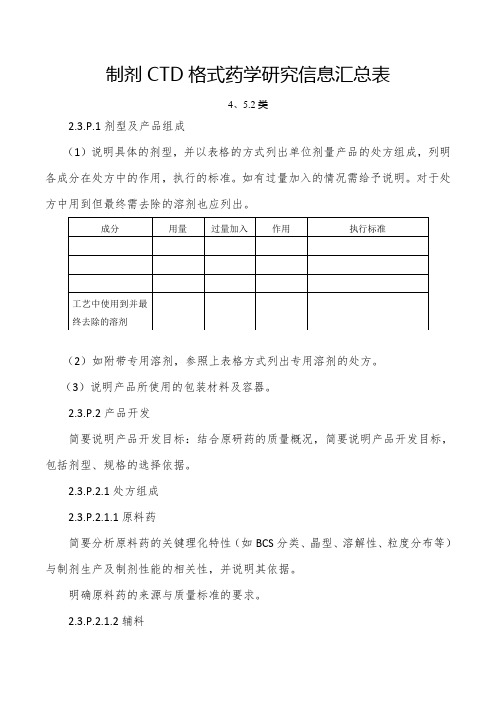
制剂CTD格式药学研究信息汇总表4、5.2类2.3.P.1剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
(2)如附带专用溶剂,参照上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
2.3.P.2产品开发简要说明产品开发目标:结合原研药的质量概况,简要说明产品开发目标,包括剂型、规格的选择依据。
2.3.P.2.1处方组成2.3.P.2.1.1原料药简要分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等)与制剂生产及制剂性能的相关性,并说明其依据。
明确原料药的来源与质量标准的要求。
2.3.P.2.1.2辅料简述辅料及其用量适合所用的给药途径的依据,结合辅料在处方中的作用简述辅料的与制剂性能相关的关键特性。
简述原料药和辅料的相容性试验的情况,包括试验设计、考察指标、试验结果等。
如未进行原料药和辅料的相容性试验,应提供相应的依据。
2.3.P.2.2 制剂研究2.3.P.2.2.1处方开发过程简述处方研究的主要内容。
包括处方开发的基本思路、试验设计、考察指标和方法、试验结果、与原研药的比较研究情况、处方的放大和调整等。
示例如下:某普通片剂的处方研究小结:参考原研药说明书、原辅料相容性试验情况、相关生产经验等,确定了辅料的基本种类;参考原研药的重量和大小、以及各辅料常规用量,确定了辅料的用量范围,以××××为指标,采用××××方法,对××××的种类和用量进行了比较筛选,对××××处方进行了研究,以原研药为对照药,结果显示××××,根据以上研究确定了初步的处方;在以上研究基础上,进行了影响因素稳定性考察,与原研药进行了××××的质量对比;在批量放大过程中,对××××进行了调整,确定了最终处方。
化学药品仿制药口服固体制剂质量和疗效一致评价申报资料要求

变化)及相关的支持性验证研究,包括生产工艺变更的基本思路、
试验设计、考察指标和方法、试验结果等,以及与原研药或参比
制剂的比较研究情况,批量放大过程中的调整等。
汇总研发过程中代表性批次(应包括但不限于临床研究批、
中试放大批、工艺验证批等)的样品情况,包括:批号、生产时
间及地点、批规模、用途(如用于稳定性试验或生物等效性试验
说明再评价品种具体的已上市信息。包括剂型、规格、批 准时间(批准文号)、执行标准、标准号、有效期等内容,并提 供相关的证明性文件。
简要说明本再评价品种自批准上市以来的生产销售、相关 变更及质量稳定性情况,相关变更提供最新有效证明性文件。
3.自评估报告 申请人应对此次一致性评价具体内容的相关研究进行全面 论述。结合每项研究内容,对处方工艺研究、关键步骤和中间体 的控制、原辅料、包装材料进行分析,重点针对与参比制剂一致 性相关的质量研究情况、体内评价研究结果等的分析,提出对本 品种与参比制剂质量和疗效一致性的综合评价结果。 申请人应保证该品种研发过程及结果和申报资料的科学性、 完整性和真实性。 4.临床信息及不良反应 本品种的临床使用情况,主要不良反应,收集历年来生产企 业统计的不良反应反馈情况,对于治疗窗狭窄的药物说明临床治 疗安全窗口指数。 5.最终确定的处方组成及生产工艺情况
8.3.2.(3.2.P.3.2)批处方
以表格的方式列出典型生产规模产品的批处方组成,列明各
成分执行的标准。如有过量加入的情况需给予说明并论证合理性。
对于处方中用到但最终需去除的溶剂也应列出。
表 XX:典型生产批的处方
成分
用量
过量加入 作用
执行标准
工艺中使用并最终 去除的溶剂
8.3.3.(3.2.P.3.3)生产工艺和工艺控制 (1)工艺流程图:以单元操作为依据,提供完整、直观、 简洁的工艺流程图,其中应涵盖工艺步骤,各物料的加入顺序,
生物制品注册分类和申报资料要求(试行)

生物制品注册分类及申报资料要求(试行)生物制品是指以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制成,用于预防、治疗和诊断人类疾病的制剂,如疫苗、血液制品、生物技术药物、微生态制剂、免疫调节剂、诊断制品等。
为便于生物制品注册申报和管理,将生物制品分为预防性生物制品和治疗性生物制品两类。
预防用生物制品是指用于传染病或其他疾病预防的细菌性疫苗、病毒性疫苗、类毒素等人用生物制品。
治疗用生物制品是指采用不同表达系统的工程细胞(如细菌、酵母、昆虫、植物和哺乳动物细胞)所制备的蛋白质、多肽及其衍生物,包括细胞因子、纤维蛋白溶解酶原激活因子、重组血浆因子、生长因子、融合蛋白、酶、受体、激素和单克隆抗体等;也包括从人或者动物组织提取的单组分的内源性蛋白;以及基因治疗产品、变态反应原制品、由人或动物的组织或者体液提取或者通过发酵制备的具有生物活性的多组份制品、微生态制品等生物制品。
申请人欲将细胞治疗类产品按药品进行注册上市的,可按治疗用生物制品相应类别要求进行申报。
按照药品管理的体外诊断试剂,包括用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂。
申请人欲将细胞治疗类产品按药品进行注册上市的,可按治疗用生物制品相应类别要求进行申报。
对于治疗用疫苗产品,申请人可根据产品主要用途自行选择按预防用或治疗用生物制品进行申报。
审评部门将依据申请人的申请,按照相应类别的技术要求进行技术审评。
第一部分预防用生物制品一、注册分类按照产品成熟度不同,将治疗用生物制品分为以下五个类别:1类:新型疫苗:指境内外均未上市的创新疫苗。
在境内外已上市制品基础上制备的新的结合疫苗或者联合疫苗,与境内外已上市疫苗对应的抗原群或者型别不同的疫苗,境内外已上市疫苗保护性抗原谱不同的重组疫苗,更换其他未经批准使用过的表达体系或者细胞基质生产的疫苗,DNA疫苗,应当按照注册分类1类申报。
2类:改良型疫苗:指对境内已上市疫苗产品进行改良创新,使新产品具有重大技术进步和/或具有显著临床优势,或者对制品的安全性、质量控制方面有显著改进的疫苗。
新旧申报资料2.3.P 制剂汇总表对比
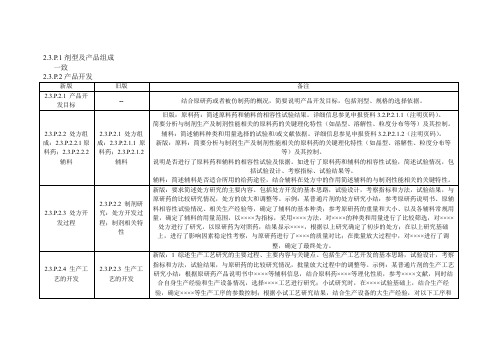
2.3.P.1剂型及产品组成一致主要的生产设备:列表提供本品的实际生产线的主要生产设备的相关信息,如型号、操作原理、规格、正常的批量范围、生产厂、用于的工艺步骤等,并说明与现有最大批量的匹配性。
如不匹配,应提供充分的依据。
量超出了目前生产的最大批量(包括临床试验/BE试验样品)所用生产设备的正常批量范围,应提供放大研究的依据。
制定依据包括处方工艺研究放大情况、验证情况、生产设备情况、临床试验/BE试验样品情况等。
一致2.3.P.5新版增加项,标题为临床试验/BE试验样品的生产情况,要求列表比较临床试验/BE试验样品的处方工艺、生产设备、批量、关键工艺步骤和工艺参数的控制、中间体的控制等与拟定的生产线的异同点,说明这些差异是否影响产品的质量,简要说明研究情况。
三个连续批次(批号:)和临床试验/BE试验样品的检验报告情况小结。
比较研究等。
自拟质量标准与可参考的同品种质量标准的比较,示例如下:条件、系统适用性要求、已知杂质的定位定量方法和控制限度等。
提供充分的依据(包括我国与ICH颁布的指导原则、各国现行版药典、原研厂同品种质量对比研究的结果等),证明质量标准制定的合理性。
说明各项目设定的考虑,总结分析各检查方法选择以及限度确定的依据。
提供和已上市原研发厂生产的原料药(或相应的制剂)进行的质量对比研究的资料及结果,以充分证明仿制品的质量与已上市原研发厂产品的质量是一致的。
对于化药注册分类6的特殊制剂,应提供与被仿已上市同品种比较的药代动力学研究资料,一般涉及吸收(主要药代动力学参数测定)和组织分布研究。
(3)对供试品和对照品吸收和组织分布等药代动力学特征一致性的评价:2.6.P.6 毒理学总结2.6. P.6.7 局部耐受性致性。
2.6. P.6.8 其他毒性研究(如可用)说明:正文标题采用宋体四号,正文为宋体小四号,1.5倍行间距,表格采用竖版,宋体五号,单倍行间距。
CTD资料模板

CTD资料模板(常用)资料来自:/download.do?method=list&class_id1=1,(整理:刘)目录CTD格式申报资料撰写格式(制剂) (1)CTD格式申报资料撰写格式(原料药) (2)CTD格式申报主要研究信息汇总表(制剂) (3)CTD格式申报主要研究信息汇总表(原料药) (14)化药综述资料(药学研究) (22)化药综述资料(药理毒理) (22)化药综述资料(立题目的与依据) (23)化药综述资料(主要研究结果的总结及评价) (23)化药综述资料(临床试验) (24)中药、天然药物综述资料(药学研究) (25)中药、天然药物综述资料(药理毒理) (26)中药、天然药物综述资料(临床试验) (27)中药、天然药物综述资料(主要研究结果的总结和评价) (28)化药制剂(说明书) (29)化药OTC说明书 (31)中药“生产现场检查用生产工艺”格式和内容 (33)中药生产现场检查用生产工艺的参考案例 (37)非大容量注射剂生产工艺信息表 (43)大容量注射剂生产工艺信息表 (44)CTD格式申报资料撰写格式(制剂)3.2.P.1 剂型及产品组成3.2.P.2 产品开发3.2.P.2.1 处方组成3.2.P.2.1.1 原料药3.2.P.2.1.2 辅料3.2.P.2.2 制剂3.2.P.2.2.1 处方开发过程3.2.P.2.2.2 制剂相关特性3.2.P.2.3 生产工艺的开发3.2.P.2.4 包装材料/容器3.2.P.2.5 相容性3.2.P.3 生产3.2.P.3.1 生产商3.2.P.3.2 批处方3.2.P.3.3 生产工艺和工艺控制3.2.P.3.4 关键步骤和中间体的控制3.2.P.3.5 工艺验证和评价3.2.P.4 原辅料的控制3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准3.2.P.5.2 分析方法3.2.P.5.3 分析方法的验证3.2.P.5.4 批检验报告3.2.P.5.5 杂质分析3.2.P.5.6 质量标准制定依据3.2.P.6 对照品3.2.P.7 稳定性3.2.P.7.1 稳定性总结3.2.P.7.2 上市后的稳定性研究方案及承诺3.2.P.7.3 稳定性数据CTD格式申报资料撰写格式(原料药)3.2.S 原料药3.2.S.1 基本信息3.2.S.1.1 药品名称3.2.S.1.2 结构3.2.S.1.3 理化性质3.2.S.2 生产信息3.2.S.2.1 生产商3.2.S.2.2 生产工艺和过程控制3.2.S.2.3 物料控制3.2.S.2.4 关键步骤和中间体的控制3.2.S.2.5 工艺验证和评价3.2.S.2.6 生产工艺的开发3.2.S.3 特性鉴定3.2.S.3.1 结构和理化性质3.2.S.3.2 杂质3.2.S.4 原料药的质量控制3.2.S.4.1 质量标准3.2.S.4.2 分析方法3.2.S.4.3 分析方法的验证3.2.S.4.4 批检验报告3.2.S.4.5 质量标准制定依据3.2.S.5 对照品3.2.S.6 包装材料和容器3.2.S.7 稳定性3.2.S.7.1 稳定性总结3.2.S.7.2 上市后稳定性承诺和稳定性方案3.2.S.7.3 稳定性数据CTD格式申报主要研究信息汇总表(制剂)2.3.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
注射用XXXX CTD资料模板3.2.P.1~P.5

目录3.2.P.1 剂型及产品组成 (3)3.2.P.1.1剂型和产品组成 (3)3.2.P.1.2专用溶剂 (3)3.2.P.1.3包装 (3)3.2.P.2 产品开发 (3)3.2.P.2.1 处方组成 (4)3.2.P.2.1.1 原料药 (4)3.2.P.2.1.2 辅料 (7)3.2.P.2.2 制剂研究 (7)3.2.P.2.2.1 处方开发过程 (8)3.2.P.2.2.2 制剂相关特性 (14)3.2.P.2.3 生产工艺的开发 (16)3.2.P.2.3.1 小试工艺研究 (16)3.2.P.2.3.2 中试及验证生产工艺研究 (18)3.2.P.2.3.3 工艺变更情况汇总 (19)3.2.P.2.3.4代表性批次汇总 (19)3.2.P.2.4 包装材料/容器 (21)3.2.P.2.4.1 包材类型、来源及相关证明文件 (21)3.2.P.2.4.2 包材的选择依据 (21)3.2.P.2.4.3 包材选择的支持性研究 (22)3.2.P.2.5 相容性 (22)3.2.P.3 生产 (23)3.2.P.3.1 生产商 (23)3.2.P.3.2 批处方 (23)3.2.P.3.3 生产工艺和工艺控制 (23)3.2.P.3.3.1 工艺流程图 (23)3.2.P.3.3.2 工艺描述 (26)3.2.P.3.3.3 主要的生产设备 (26)3.2.P.3.3.4 拟定的大生产规模 (26)3.2.P.3.4关键步骤和中间体的控制 (26)3.2.P.3.4.1 关键步骤和工艺参数 (27)3.2.P.3.4.2 中间体的控制 (27)3.2.P.3.5 工艺验证和评价 (30)3.2.P.3.5.1 冻干粉针剂培养基模拟灌装验证 (30)3.2.P.3.5.2 除菌过滤系统验证 (30)3.2.P.3.5.3 内包材密封完整性验证 ........................................................ 错误!未定义书签。
化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求

化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)一、申报资料项目(一)概要1.历史沿革2.批准及上市情况3.自评估报告4.临床信息及不良反应5.最终确定的处方组成及生产工艺情况6.生物药剂学分类(二)药学研究资料7.(2.3.P,注:括号内为CTD格式的编号,以下同)制剂药学研究信息汇总表8.(3.2.P)制剂药学申报资料8.1.(3.2.P.1)剂型与产品组成8.2.(3.2.P.2)产品再评价研究8.2.1.(3.2.P.2.1)处方组成8.2.2.(3.2.P.2.2)制剂再研发(适用于处方、工艺有改变的品种)8.2.2.1.(3.2.P.2.2.1)处方再研发8.2.2.2.(3.2.P.2.2.2)工艺再研发8.3.(3.2.P.3)生产信息8.3.1.(3.2.P.3.1)生产商8.3.2.(3.2.P.3.2)批处方8.3.3.(3.2.P.3.3)生产工艺和工艺控制8.3.4.(3.2.P.3.4)关键工艺步骤和中间体的控制8.3.5.(3.2.P.3.5)工艺验证和评价(适用于工艺有改变的品种)8.3.6.(3.2.P.3.6)临床试验/生物等效性(BE)样品的生产情况8.4.(3.2.P.4)原辅料的控制8.5.(3.2.P.5)制剂的质量控制8.5.1.(3.2.P.5.1)质量标准8.5.2.(3.2.P.5.2)分析方法8.5.3.(3.2.P.5.3)分析方法的验证8.5.4.(3.2.P.5.4)批检验报告8.5.5.(3.2.P.5.5)杂质谱分析8.5.6.(3.2.P.5.6)质量标准制定依据8.6.(3.2.P.6)对照品8.7.(3.2.P.7)包装材料8.8.(3.2.P.8)稳定性8.8.1.(3.2.P.8.1)稳定性总结8.8.2.(3.2.P.8.2)后续稳定性承诺和稳定性方案(适用于处方、工艺有改变的品种)8.8.3.(3.2.P.8.3)稳定性数据(三)体外评价9.参比制剂9.1.参比制剂的选择9.2.基本信息9.3.质量考察9.4.溶出曲线考察9.5.溶出曲线稳定性考察(适用于理化性质不稳定品种)10.质量一致性评价10.1.国内外质量标准收载情况比较10.2.关键质量属性研究10.3.参比制剂与被评价制剂的检验结果11.溶出曲线相似性评价11.1.建立体外溶出试验方法11.2.批内与批间差异考察11.3.溶出曲线相似性比较结果(四)体内评价12.(2.5. P)制剂临床试验信息汇总表13.制剂临床试验申报资料13.1.(5.2)临床试验项目汇总表13.2.(5.3)生物等效性试验报告13.2.1.(5.3.1.2.1)空腹生物等效性试验报告13.2.2.(5.3.1.2.2)餐后生物等效性试验报告13.2.3.(5.3.1.4)方法学验证及生物样品分析报告13.3.(5.3.5.4)其他临床试验报告14.参考文献及相关实验数据研究资料二、申报资料项目说明(一)概要1.历史沿革说明同品种原研产品上市背景信息,包括品种治疗领域、国内外上市情况。
3.2.P.5.5杂质谱分析模板的整理

3.2.P.5.5杂质谱分析模板的整理-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN3.2.P.5.5杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2)到ICHQ3D的相关规定结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质)N SOH OONO 2OH N OC 22H 19N 3O 7S MW: 469.47NON OH SOOK C 16H 17KN 2O 4S MW: 372.48BrNO 2+NON OH SOONO 2C 23H 23N 3O 6S MW: 469.51C 7H 6BrNO 2MW: 216.03PAA22N OH NOH S OONO 2OC 23H 23N O S MW: 485.51TMP toluene N S NH HOOO23H 21N 3O 5S N S N H HOH OO2OC 22H 19N 3O 6S MW: 453.47CH 2Cl 2/CH 3OHO 3, TMPCH 2Cl 2/TEBAC TsClmorpholineN S N HHN OO2OOC 26H 26N 4O 6S MW: 522.571) Br 2-pyrindineCH 2Cl 2N SCl OONO 2O2NC 14H 12ClN 3O 5S MW: 406.00HClHCl 1) (PhO)3P/CH 2Cl 22) N,N-dimethyl aniline, PCl 5 i BuOHNa 2S 2O 4N SOHOCl OH 2NH C 7H 7ClN 2O 3S MW: 234.661、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。
杂质谱分析模板的整理

3.2.P.5.5杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2)到ICHQ3D的相关规定结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质)N SOH OONO OH N OC H N O S MW: 469.47NON OH SOOK C H KN O S MW: 372.48BrNO +NON OH SOONO C H N O S MW: 469.51C H BrNO MW: 216.03N OH NOH S OONO OC H N O S MW: 485.51TMP toluene N S NH HOOOH N O S N S N H HOH OOOC H N O S MW: 453.47CH Cl /TEBAC TsClmorpholineN S N HHN OONO OOC H N O S MW: 522.571) Br -pyrindineCH Cl N SCl OOONC H MW: 406.00HClHCl 1) (PhO)P/CH Cl 2) N,N-dimethyl aniline, PCl i BuOHNa S O N SOHOCl OH NH C H ClN O S MW: 234.661、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。
药物制剂C T D申报资料(4、5.2类)最新模板

制剂CTD格式申报资料4、5.2类3.2.P 制剂3.2.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
表1(注:表格依次编号,下同):处方(2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
3.2.P.2 产品开发说明产品开发目标。
说明原研药上市情况。
详细提供包括原研药的质量概况在内的相关研究资料或文献资料来论证本品的剂型、处方组成、生产工艺、包装材料选择和确定的合理性。
3.2.P.2.1处方组成3.2.P.2.1.1原料药参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等)与制剂生产及制剂性能的相关性,并提供相关的研究资料与文献。
3.2.P.2.1.2辅料说明辅料是否适合所用的给药途径结合辅料在处方中的作用分析辅料的哪些性质会影响制剂特性,提供相关的研究资料与文献。
3.2.P.2.2 制剂研究3.2.P.2.2.1处方开发过程参照《化学药物制剂研究的技术指导原则》,提供处方的研究开发过程和确定依据,包括文献信息(如对照药品的处方信息)、研究信息(包括处方设计,处方筛选和优化、处方确定等研究内容)、辅料种类和用量选择的依据、分析辅料用量是否在常规用量范围内,以及自制样品与原研药的质量特性对比研究结果(需说明原研药的来源、批次和有效期,自研样品批次,对比项目、采用方法),并重点说明在药品开发阶段中处方组成的主要变更、原因以及支持变化的验证研究。
如生产中存在过量投料的问题,应提供过量投料的必要性和合理性的相关研究资料。
3.2.P.2.2.2制剂相关特性对与制剂性能相关的理化性质,如pH、离子强度、溶出度、再分散性、复溶、粒径分布、聚合、多晶型、流变学等进行分析。
化学药品CTD格式申报资料撰写要求

(4)说明大生产的拟定批量范围。
3.2.S.2.3 物料控制 按照工艺流程图中的工序,以表格的形式列明生产中用到的所有物料(如 起始物料、反应试剂、溶剂、催化剂等),并说明所使用的步骤 。 提供物料的质量控制信息,明确引用标准,或提供内控标准(包括项目、 检测方法和限度),并提供必要的方法学验证资料。 对于关键的起始原料,尚需根据相关技术指导原则、技术要求提供其制备 工艺资料。
3.2.P.2.4 包装材料/容器
(1)包材类型、来源及相关证明文件: (2)阐述包材的选择依据。 (3)描述针对所选用包材进行的支持性研究。 在常规制剂稳定性考察基础上,需考虑必要的相容性研究,特别是含有有 机溶剂的液体制剂或半固体制剂。
3.2.P.2.5 相容性
提供研究资料说明制剂和附带溶剂或者给药装置的相容性。
3.2.S.5 对照品
药品研制过程中如果使用了药典对照品,应说明来源并提供说明书和批号 。 药品研制过程中如果使用了自制对照品,应提供详细的含量和纯度标定过 程。
3.2.S.6 包装材料和容器 :相当于原15号资料
(1)包材类型、来源及相关证明文件: (2)阐述包材的选择依据。 (3)描述针对所选用包材进行的支持性研究。 3.2.S.7 稳定性:相当于原14号资料 3.2.S.7.1稳定性总结 总结所进行的稳定性研究的样品情况、考察条件、考察指标和考察结果,
(1)工艺流程图:按合成步骤提供工艺流程图,标明工艺参数和所用溶剂 。如为化学合成的原料药,还应提供其化学反应式,其中应包括起始原料 、中间体、所用反应试剂的分子式、分子量、化学结构式。
(2)工艺描述:按工艺流程来描述工艺操作,以注册批为代表,列明各反 应物料的投料量及各步收率范围,明确关键生产步骤、关键工艺参数以及 中间体的质控指标。
化药仿制药制剂质量研究和稳定性研究审评常见问题及案例分析

进行包括检测能力和样品测定结果的方法比照研究, 优选专属性好、灵敏度高,能够充分检出相关杂质 的检测方法
二、分析方法
常见问题
1、局部关键信息缺失,如:含量测定和有关物 质检查的仪器型号、柱温、流速等;有关物质检 查中杂质的定位和定量方法。
三、分析方法建立与验证
技术要求:
3、除药典附录规定的通用检测工程,原则上每 个〔检测工程所采用的分析方法均需进行方法验 证以证明所采用的分析方法科学合理。 4、根据检查工程设计相应的验证内容,验证试 验设计符合常规要求,验证内容是否标准、全面, 测定条件、检测手段等是否符合相关成份或杂质 的特点,验证结果是否能够证明方法的可行性。
化药仿制药制剂质量研究和稳定 性研究审评常见问题及案例分析
CTD资料中的模块3
3.2.P.5.1质量标准 3.2.P.5.2分析方法 3.2.P.5.3分析方法的验证 3.2.P.5.4批检验报告 3.2.P.5.5杂质分析 3.2.P.5.6质量标准制定依据 3.2.P.6对照品 3.2.P.7稳定性研究
如HPLC法仪器型号及编号;供试品、对照 品流动相、系统适用性溶液等的配制方法; 色谱条件色谱柱〔型号〕、柱长度、内径、 填料粒径、柱温、流速、检测器、检测波 长、运行时间、系统适用性进样体积;具 体操作,计算公式、拟定限度等。
二、分析方法
技术要求:
1、是否具有文献依据或试验依据,关注ICH成员国 药典同品种或同类品种质量标准收载的方法
通常采用溴化钾压片法,如供试品为盐酸盐且制样时又 易发生离子交换现象,可采用氯化钾压片法。如〔研磨 和压片〕时易发生晶型变化,则应采用石蜡糊法或其他 适宣制样法。磷酸盐类阴离子具有强吸收,可采用游离 碱作为IR鉴别,但应明确规定供试品的预处理方法。
新注册分类及申报资料(2020)

模块 4:非临床试验报告 4.1 模块4目录 4.2 试验报告 4.3 参考文献
模块 5:临床研究报告 5.1 模块5目录
5.2 所有临床研究列表 5.3 临床研究报告 5.4 参考文献
实施 M4 CTD的意义
减少注册申请编纂所需的时间和资源,有助于电子注册文件准备 1
利于审评及与申请人之间的交流 2
3
内 未 上 市 、适应症、给药途径和用法用量的原料药及其 的药品。该类药品应与参比制剂的质量和疗效一
原 研 药 品 制剂。
致。
的药品
仿制境内 已上市原
具有与原研药品相同的活性成份、剂型、规格
境内申请人仿制已在境内上市原研药品的药品。
注册管理要求
(一)化学药品1类为创新药,应含有新的结构明确的、具有药理作用的化合物,且具有临床价值,不 包括改良型新药中2.1类的药品。含有新的结构明确的、具有药理作用的化合物的新复方制剂,应按照化学 药品1类申报。
方案和承诺
3.2.P.8.3 稳定性数据
原注册分类申报资料要求与现行版M4通用技术文档的对比
原注册分类1、2、3、5.1类 (三)药学研究资料 13.(3.2.P)制剂
13.1.(3.2.P.1) 剂型及产品组成 13.2.(3.2.P.2 )产品开发 13.3.(3.2.P.3 )生产 13.4.(3.2.P.4 )原辅料的控制 13.5.(3.2.P.5 )制剂的质量控制 13.6.(3.2.P.6 )对照品
且具有临床价值的药品。
2.1含有用拆分或者合成等方法制得的已知活性 2.1含有用拆分或者合成等方法制得的已知活性成
成份的光学异构体,或者对已知活性成份成酯,份的光学异构体,或者对已知活性成份成酯,或
或者对已知活性成份成盐(包括含有氢键或配 者对已知活性成份成盐(包括含有氢键或配位键
CTD格式申报资料撰写要求(制剂)

质量控制及稳定性资料要求解读
3.2.P.5.2 分析方法
列明质量标准中各项目的检查方法
包括①项目②检查方法(并给与编号)③具体实验操作,如供试 品、对照品、流动相、系统适用性溶液等的配制方法;④色谱条 件,如色谱柱(型号)、柱长度、内径、填料粒径、柱温、流速、 检测器、检测波长、运行时间、系统适用性、进样体积等;⑤计 算公式等。
应承诺对上市后生产的前三批产品进行长期留样稳定性考察,并 对每年生产的至少一批产品进行长期留样稳定性考察,如有异常 情况应及时通知管理当局。
提供后续稳定性研究方案(实验方案,各时间点的考察项目,考 察项目、方法和可接受标准均用表格形式)。
质量控制及稳定性资料要求解读
3.2.P.7.3 稳定性数据
CTD格式申报资料撰写要求(制剂)
质量控制及稳定性资料要求解读
李洪霞
质量控制及稳定性资料要求解读
一、前言 二、质量控制研究资料 三、稳定性研究资料 四、色谱数据和图谱提交要求
一、前言
质量控制及稳定性资料要求解读
CTD格式的特点:
先给出结果,后陈述过程,再附上支持性实验数据
资料整理模块化,试验设计及结果表格化、数据化
单一杂质B
总杂质
含量
其他项目
(2)加速试验
质量控制及稳定性资料要求解读
批号1:(三批样品) 批量: 规格: 包装: 考察条件:
考察项目Байду номын сангаас
限度要求
时间(月)
性状
0
1
2
3
6
单一杂质A 单一杂质B 总杂质
含量
其他项目
(3)长期试验
质量控制及稳定性资料要求解读
杂质谱的分析

杂质谱的分析(总3页) -CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除杂质谱的分析在药品研发及药品评价的过程中,杂质研究是一项非常重要的内容。
因为药物在临床使用过程中所发生的不良反应除了与药品本身的药理活性有关外,有时还与药品中所含有的杂质有很大的关系。
众所周知,从事药品研发及药品评价所要遵循的一个基本原则就是要保证上市药品的安全性和有效性,由于药品质量的稳定可控是保证药品安全有效的前提和基础,而杂质研究又是药品质量研究的一项重要内容,所以杂质研究及杂质控制是药品质量保证的关键要素,是确保药品安全有效性的重要体现。
2005年SFDA颁布的《化学药物杂质研究技术指导原则》中明确说明任何影响药物纯度的物质统称为杂质。
具体的解释就是指药物中所含有的没有治疗作用、可能影响药物的稳定性和疗效,甚至是对人体健康有害的物质。
杂质的来源有工艺杂质和降解产物等,工艺杂质指的是药品在制备工艺过程中引入的杂质,它包括没有反应完全的反应物、反应过程中所生成的中间体及副产物、反应过程中所使用的试剂及催化剂等。
降解产物指的是药品在生产和贮藏过程中发生化学变化而产生的杂质,如发生水解、氧化、开环等反应,降解产物主要与药物的结构特征密切相关。
由于杂质研究与药品的质量及安全有效性直接相关,为了提高药品的质量,保障公众的用药安全,因此,在药品研发过程中需规范地进行杂质研究,并将其控制在安全、合理的限度范围内。
在杂质研究总体原则的指导下,其中杂质谱的分析应是杂质研究的重要内容之一。
一、杂质研究的总体原则杂质研究的总体原则就是要结合在研产品具体的工艺以及产品的特点开展研究。
首先,要结合具体工艺及产品特点来分析产品中可能产生什么样的杂质,通过杂质谱的分析对产品中杂质的来源及结构情况有较为全面的了解;然后,在杂质谱分析的基础上,有针对性地选择合适的分析方法,以确保杂质的有效检出及控制;最后,需综合药学、药理毒理及临床研究结果确定合理的杂质限度,从而保证药品的质量及安全性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.2.P.5.5杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2)到ICHQ3D的相关规定2 克/天结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质)N SOH OONO 2OH N OC 22H 19N 3O 7S MW: 469.47NON OH SOOK C 16H 17KN 2O 4S MW: 372.48Br2+NON OH SOONO 2C 23H 23N 3O 6S MW: 469.51C 7H 6BrNO 2MW: 216.03PAA22N OH NOH S OONO 2OC 23H 23N O S MW: 485.51TMP toluene N S NH HOOO23H 21N 3O 5S N S N H HOH OO2OC 22H 19N 3O 6S MW: 453.47CH 2Cl 2/CH 3OHO 3, TMPCH 2Cl 2/TEBAC TsClmorpholineN S N HHN OONO 2OOC 26H 26N 4O 6S MW: 522.571) Br 2-pyrindineCH 2Cl 2N SCl OO2O2NC 14H 1235MW: 406.00HClHCl 1) (PhO)3P/CH 2Cl 22) N,N-dimethyl aniline, PCl 5 i BuOHNa 2S 2O 42N SOHOCl OH 2NH C 7H 7ClN 2O 3S MW: 234.661、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。
比如上述列表中的钯元素控制。
2、普通有机杂质。
3、 对映异构体(根据品种的情况具体分析);考察不同的对应异构体对最终产品质量的影响情况。
4、 非对映异构体:比如ACCA 的△异构体;还包括非对应异构体自身的各种对映体。
第二部分:反应的每个步骤引入的杂质:需要结合实际反应监控(HPLC,LC-MS 为主)过程对杂质消除过程以及对后续的影响进行实际说明。
这个内容主要在工艺描述部分进行,本部分引用工艺描述内容。
1、步骤1引入的杂质。
2、步骤2引入的杂质。
3、步骤3引入的杂质。
以及后续的步骤产生的杂质以及消除过程和简单的控制描述……4、精制过程引入的杂质。
第三部分:结合小试中试数据汇总列表、方法适用性、实际检测结果等内容说明各个有机杂质的分布情况。
第四部分:潜在杂质在成品中的检测结果第五部分:自制原料与原研片杂质对比:据进行对比性说明。
第六部分:制剂中的特定杂质:主要分析制剂与原料药储存过程中降解产生的杂质,以及因为辅料和原料药相容性而产生的特定杂质:比如纤维素类的曼德拉反应产生的杂质等。
储存降解产生的杂质包括酸碱氧热光降解杂质,空气中水分造成的水解杂质,或者跟空气中二氧化碳反应产生的杂质。
1.说明各杂质的限度:****杂质阈值(举例)2. 3.2.P.5.5.1潜在杂质的推测由****公司提供**原料药简单工艺路线,分析整理本品的杂质见下表。
表3.2.P.** ,-------------潜在杂质推测3.潜在杂质特征的鉴定a)原料合成过程带入的相关杂质特征的鉴定由厂家提供的原料药合成过程中所用的起始原料及各步中间产物的色谱行为和紫外光谱特征进行汇总分析,初步鉴定注射用头孢地嗪钠成品中原料合成过程中带入的杂质。
起始原料及各步中间产物鉴定特征如下表:表3.2.P.5-X ****原料合成过程相关杂质特征鉴定b)注射用头孢地嗪钠强制降解试验中杂质的特征鉴定试品与对照品强制降解试验表3.2.P.** 热破坏试验主要降解产物色谱信息表3.2.P.5-50 酸破坏试验主要降解产物色谱信息表3.2.P.5-51 碱破坏试验主要降解产物色谱信息表3.2.P.5-52 氧化破坏试验主要降解产物色谱信息表3.2.P.5-53 光照破坏试验主要降解产物4.制剂杂质列表a)以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度。
杂质的结构和种类的鉴定在其他模块或者附件中体现。
按照以前惯例,自制杂质的结构确认是通过工艺描述加氢谱确认即可,特殊的需要提供其他佐证手段。
外购杂质的结构确认一般是要提供完整的结构鉴定谱图。
b)说明各杂质在最终质量标准中是否进行控制以及控制的限度,并提供充分的依据。
报告阈值是指所有高于此阈值的杂质及其含量均应在每批产品的检验报告中记录,并在申报资料中反映;鉴定阈值是指所有高于此阈值的杂质均应对其结构进行确证;合理限度是指只要质量标准中制订的杂质限度不高于此限度,就不需要提供该限度的制订依据,认为该限度是合理的。
c)提供详细的降解途径与降解产物研究资料与图谱。
应在对原料药的降解途径与降解产物有充分了解的基础上,进行系统的降解途径与降解产物研究,明确说明本品的降解途径与降解产物5.对比自制制剂片和原料药杂质谱以及纯度数据,相对保留时间杂质峰(%)原料制剂1607021605041605081607021607041607060.15////0.01/0.80(杂质A).03.03.02.03.02.036.对比自制制剂片和参比制剂杂质谱以及纯度数据,化、图谱以及纯度数据。
**************************************************************************************** ********************************************************************************附件1:《CTD申报资料中杂质研究的几个问题》这篇需要我们认真研究一下:下面做了简单的抄录。
(/dzkw.do?method=largePage&id=312898)杂志谱研究需要以杂质谱分析为主线,安全性为核心,按照风险控制的策略,将杂质研究与CMC各项研究,乃至药理毒理及临床安全性研究等环节关联思考、综合考虑,而不仅仅拘泥于提供准确分析数据的传统思维,不是一项孤立的分析工作。
1、杂质控制要做到源头控制、过程控制与终点控制相结合的杂质控制理念:CTD格式中杂质控制的考虑要体现在CMC的各个环节,而不是仅仅局限在“质量控制”模块。
比如原辅料首先要满足制剂质量要求;关键工艺步骤及参数的确立、工艺开发过程等要考虑以杂质是否得到有效控制为重点关注。
制剂相关特性中要体现与原研产品杂质谱等的对比情况;包材、贮藏条件以及有效期的确立等也要以杂质是否处于安全合理的可控范围内为核心。
2、关注杂质分析与控制的系统性与整体性,不能割裂各项内容的必然联系和有机统一:杂质分析与控制的相关内容会分布在分析方法(3.2.S.4.2)、方法学验证(3.2.S.4.3)、杂质对比研究与杂质谱分析(3.2.S.4.5)、杂质情况分析总结(3.2.S.3.2)、样品检测与数据积累(3.2.S.4.4)、控制限度(2.3.S.4.1)等各模块中,但杂质研究又是一项系统工程,具有统一的整体性。
因此,不要因为申报资料格式的模块化而人为割裂各项研究内容的相互联系。
3、从杂质谱分析入手确立科学的杂质研究基本思路。
杂质谱包括药物中所有杂质的种类、来源及特性等信息。
有针对性地选择合适的杂质分析方法,以确保杂质的有效检出和确认;通过与原研产品杂质谱的对比研究,根据各相应杂质的一致性求证,或跟踪杂质谱对安全性试验或临床试验结果产生的影响,评估各杂质的安全性风险和可接受水平;结合规模化生产时杂质谱的变化情况,确立安全合理的杂质控制水平。
4、分析方法的验证应具备针对性和全面性。
5、杂质限度的确定应符合相关技术指导原则的要求。
在分析方法相同的情况下,各特定杂质应不超过同品种或同类品种法定标准的相应限度;非特定杂质应采用LC/UV、LC/MS、PDA等多种方法与原研产品或ICH成员国产品进行杂质比较,说明各杂质与原研产品的一致性,相同杂质限度可参考ChP、USP、BP/EP、JP等药典同品种最严格的单个杂质限度确定。
附件2:引用的5.30文件的要求:化学仿制药电子通用技术文档申报指导原则(征求意见稿)A.以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度B.说明各杂质在最终质量标准中是否进行控制以及控制的限度,并提供充分的依据。
C.提供详细的降解途径与降解产物研究资料与图谱。
应在对原料药的降解途径与降解产物有充分了解的基础上,进行系统的降解途径与降解产物研究,明确说明本品的降解途径与降解产物化学药品新注册分类申报资料要求(试行)-4类A.以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度。
可以表格形式整理B.说明各杂质在最终质量标准中是否进行控制以及控制的限度,并提供充分的依据。
C.提供详细的降解途径与降解产物研究资料与图谱。
应在对原料药的降解途径与降解产物有充分了解的基础上,进行系统的降解途径与降解产物研究,明确说明本品的降解途径与降解产物化学药品新注册分类申报资料要求(试行)-3类A.以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度。
B.对于最终质量标准中是否进行控制以及控制的限度,应提供依据。
