高等有机化学第六章 极性加成于消除
高等有机化学消除反应

消除反应在有机合成中应用
形成碳碳双键或三键
立体选择性合成
通过消除反应可以方便地构建碳碳双 键或三键,这是有机合成中常用的手 段之一。
一些消除反应具有立体选择性,可以 用于合成具有特定立体结构的化合物。
构建复杂分子骨架
消除反应还可以用于构建复杂分子的 骨架,例如通过分子内的消除反应可 以形成环状化合物。
影响因素及改进方法
01
底物结构
底物结构对消除反应有很大影响,如卤代烃中卤素原子的种类和位置、
醇类化合物中羟基的位置等都会影响反应速率和产物分布。
02
反应条件
反应温度、溶剂种类、碱性强度等反应条件也会影响消除反应的进行。
03
改进方法
针对底物结构和反应条件的影响,可以采取相应的改进方法,如优化底
物结构、调整反应条件、使用催化剂等,以提高消除反应的效率和选择
A
B
C
D
催化剂种类和用量
对于使用过渡金属催化剂的烯烃消除反应, 催化剂种类和用量也是影响反应效率和选 择性的重要因素之一。
反应温度和溶剂
反应温度和溶剂对烯烃消除反应也有重要 影响,需要根据实际情况进行优化选择。
03 炔烃和芳香族化合物消除 反应
炔烃和芳香族化合物消除特点
高选择性
炔烃和芳香族化合物的消除反应 通常具有高度的选择性,能够生 成特定的产物。
消除反应特点
反应后生成物分子中的化学键总数减少,多数消除反应为可逆反应,甚至完全 可逆。
消除反应分类及机理
分类
根据反应物和产物的结构以及反应机 理的不同,消除反应可分为E1、E2 、E1cb三种类型。
机理
消除反应的发生往往伴随着碳正离子 、碳负离子、自由基等中间体的生成 ,这些中间体的稳定性和反应活性决 定了消除反应的速率和选择性。
有机化学基础知识点整理酸和酯的加成与消除反应

有机化学基础知识点整理酸和酯的加成与消除反应酸和酯的加成与消除反应是有机化学中的重要基础知识点之一。
它们在有机合成和生物化学等领域中有着广泛的应用。
本文将对酸和酯的加成与消除反应进行整理,并介绍其反应机制和应用。
一、酸的加成与消除反应酸的加成反应是指酸与有机物发生加成反应的过程。
常见的酸的加成反应有酸与烯烃的加成反应、酸与炔烃的加成反应。
1. 酸与烯烃的加成反应酸与烯烃的加成反应是指酸与烯烃在适当条件下发生加成反应,生成饱和化合物。
常见的酸的加成反应有硫酸与烯烃的加成反应和盐酸与烯烃的加成反应等。
以硫酸与烯烃的加成反应为例,其反应机制为:首先,硫酸通过质子化生成了H2SO4,然后H2SO4与烯烃发生亲核加成反应,生成硫酸烃酯。
最后,硫酸烃酯通过水解反应脱除硫酸基团,生成饱和化合物。
2. 酸与炔烃的加成反应酸与炔烃的加成反应是指酸与炔烃在适当条件下发生加成反应,生成饱和化合物。
常见的酸的加成反应有硫酸与炔烃的加成反应和盐酸与炔烃的加成反应等。
以硫酸与炔烃的加成反应为例,其反应机制为:首先,硫酸通过质子化生成了H2SO4,然后H2SO4与炔烃发生亲核加成反应,生成硫酸炔基酯。
最后,硫酸炔基酯通过水解反应脱除硫酸基团,生成饱和化合物。
酸的消除反应是指酸与有机物发生消除反应的过程。
常见的酸的消除反应有酸催化的脱水反应和酸催化的脱羟基反应等。
以酸催化的脱水反应为例,其反应机制为:首先,酸通过质子化生成了H+,然后H+与有机物的含氢官能团发生亲核反应,生成碳正离子。
最后,碳正离子通过β-消除反应或酸催化的重排反应,生成烯烃或炔烃等。
二、酯的加成与消除反应酯的加成反应是指酯与有机物发生加成反应的过程。
常见的酯的加成反应有酯的加成酰基反应和酯的加成羟基反应等。
以酯的加成酰基反应为例,其反应机制为:首先,酯中的C-O键被酸催化断裂,生成酸酐。
然后,酸酐与其他有机物发生亲核加成反应,生成酯。
酯的消除反应是指酯与有机物发生消除反应的过程。
邢其毅《基础有机化学》笔记和课后习题(含真题)详解(脂肪族饱和碳原子上的亲核取代反应 β-消除反应)

圣才电子书 十万种考研考证电子书、题库视频学习平台
超共轭效应的大小不碳上 C-H 键的多少有关,C-H 键越多,超共轭效应越大。超共轭 效应的大小次序为
CH3->RCH2->R2CH-> R3C4.场效应 叏代基在空间可以产生一个电场,对另一头的反应中心有影响,这就是场效应。距离越 进,场效应越小。
3 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
定程度的减弱,亲核试剂、离去基团不碳原子成一直线,碳原子上另外三个键逐渐由伞形转 发成平面,亲核试剂不碳原子间的键开始形成,碳原子不离去基团间的键断裂,碳原子上三 个键由平面向另一边偏转。若中心碳原子为手性碳原子,在生成产物时,中心碳原子的构型 完全翻转,这也是 SN2 反应在立体化孥上的重要特性。
(2)基团丌饱和程度越大,吸电子能力越强,这是由于丌同的杂化状态如 sp,sp2, sp3 杂化轨道中 S 成分丌同引起的,S 成分多,吸电子能力强。
(3)带正电荷的基团具有吸电子诱导效应,带负电荷的基团具有给电子诱导效应。不 碳直接相连的原子上具有配价键,亦有强的吸电子诱导效应。
(4)烷基有给电子的诱导效应,同时又有给电子的超共轭效应。 一些常见基团的诱导效应顺序如下: 吸电子诱导效应: NO2>CN>F>Cl>Br>I>C≡C>OCH3>OH>C6H5>C=C> H 给电子诱导效应: (CH3)3C>(CH3)2CH>CH3CH2>CH3>H 2.共轭效应 共轭效应:在共轭体系中,由于原子间的相互影响而使体系内的 π 电子(或 p 电子) 分布収生发化的一种电子效应。 吸电子的共轭效应用-C 表示,给电子的共轭效应用+C 表示。叏代基的共轭效应和诱导 效应方向有时丌一致。共轭效应只能在共轭体系中传递,且贯穿于整个共轭体系中。 3.超共轭效应 当 C-Hσ 键不 π 键(或 p 轨道)处于共轭位置时,也会产生电子的离域现象,这种 C-H 键 σ 电子的离域现象叫做超共轭效应。
高等有机化学第六章 极性加成于消除
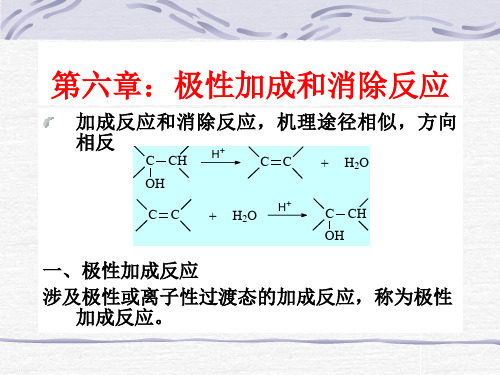
(II)当离去原子团带正电荷时,离 子对增加反式消除的量
C H O R C NHMe
当离去原子团带正电荷时,游离的碱进攻离去原子 团,并处于有利进攻顺式β氢的位置发生顺式消除, 但离子对将减少这种进攻。 (III)碱的浓度 强碱多半显示高比例的顺式消除作用,弱碱反式消 除占绝对优势。
B H CH3 Br C6H5 H H C6H5 CH3 H Br C6H5 C6H5 CH3 C6H5 H C6H5
(1R,2R)
B H CH3 Br C6H5 H H C6H5 CH3 C6H5 Br H C6H5 CH3 C6H5 C6H5 H
(1R,2S)
均说明卤素与位于反式的氢原子发生消 除反应。又如氯代反丁烯二酸脱氯化氢 的反应速度比顺式二酸快48倍,反式消 除作用比顺式消除作用占优势
1. 消除反应的历程
一 双分子消除反应历程(E2) 在双分子消除反应中,碱进攻反应物的β—H的同时, 离去基团带着一对电子从分子中离去,在两个碳原子 之间形成新的π键:
H C L C + B
-
H C L C
B C C + BH + L
-
B:和消除的X不一定都是负离子,可以带不同电荷: B: = H2O, N(CH3)3, CH3COO-, O2NC6H4O-, C6H5O-, HO-, -OC H , -NH , CO 22 5 2 3 X = -+NR3, -+PR3, -+SR2, -SO2R, -Cl, -Br, -I, -OSO2R, OCOR
CH2 H2C CH CH CH2 + H+ (1) (2) + Cl
快 慢
CH CH CH2 H
第五章 极性加成和消除反应

5.1 极性加成反应的典型机理
加成反应有多种,如环加成、光化加成、自由基加成、 极性加成等,在此,我们只讨论极性加成反应。 按照极限情况,可以分为以下三种:
(1)
E Y C C
极性加成和消除反应在微观上可看作是一个可逆的反应, 其最终的方向取决于反应物的性质和反应条件。
E +
B B H X C C X 顺式 反式 H
在开链体系中,E2机理,反式消除是主要的。 例:对苯磺酸 3-苯基-2-丁酯消除反应的立体化学:
Ph H 3C H 赤式 H 3C Ph H OTs NaOEt C C CH 3 OTs NaOEt C C H 苏式 CH 3 EtOH Ph CH 3 H EtOH H 3C H CH 3 Ph H
PhCH OH
CD 2 H
用一般烯烃时,观察到一般酸催化作用和溶剂同位素效 应,认为烯烃的质子化为决定速度的步骤。 烯烃的催化水解反应速度,可以被烷基取代基所加速。 烯烃在硫酸中的反应速度 烯烃 k(M-1S-1) Krel
CH 2 CH 3 CH CH 3 (CH) 2 CH (CH 3 ) 2 C CH 2 CH 2 CH 2 CHCH
RCH 2 CH R' X + BRCH CHR' + BH X RCH CHR' + X
H+ 先离去,X- 后离去,β位有羰基、硝基、氰 基等时,易按E1cb机理反应。
可以把三个机理连起来,成为可能性的连续 变化的机理—可变E2过渡态理论。
影响过渡态的因素主要有以下四个: 离去基团的性质:一个好的离去基团,使底物容易电离, 倾向于E1历程;反之,则倾向于E1cb; 底物的性质:底物中有稳定碳正离子的因素(给电子基、 大基团、大张力等),则有利于电离,倾向于E1历 程;底物中有稳定碳负离子的因素,如强吸电子基 等,有利于H+的离去,倾向于E1cb; 溶剂:电离能力很强的溶剂,有利于离去基团离去,即 有利于E1; 碱的性质:⑴极强的碱有利于碳负离子的形成,倾向于 E1cb; ⑵较强的碱,使E1比SN1有利。
有机消除反应大全

*第六章 消除反应消除反应(Elimination)指从有机分子中除去两个原子或基团(XY ),生成双键、三键或环状结构的反应。
++XAYA X Y根据消去的原子或基团(X ,Y )相对位置的不同,消除反应可分为下面三类。
(一)α-消除(1,1-消除)被消去的两个基团(X ,Y )连在同一原子上,此种反应称α-消除。
+碳烯(卡宾Carbene )(X , Y)R 2CXYR 2C+氮烯(氮宾 Nitrene )(X , Y)RNXYRN例如,氯仿在强碱液中消去质子和氯负离子生成二氯卡宾(二氯碳烯):+++CHCl 3OHCCl 2ClH 2ON-对-硝基苯磺酰氧胺基甲酸乙酯(Ⅰ)在乙醇钠液中,消去质子和对-硝基苯磺酸根负离子,生成乙氧甲酰氮烯(Ⅱ):(Ⅰ)++NO 2OSO 2NHCOC 2H 5O C 2H 5O 2NOSO 2+C 2H 5OHN COC 2H 5O (Ⅱ)碳烯、氮烯均为不稳定的中间体,立即产生重排、二聚、加成等反应。
如氯仿在醇钠中生成的二氯卡宾,继续与乙醇作用得到原甲酸三乙酯(抗疟药氯喹原料): CH (OC 2H 5)3(二)β-消除(1,2-消除)消去的两个基团(X ,Y )连在相邻的两个原子上,反应后形成新的不饱和键如烯键、炔键或偶氮键等。
R 2CYXYCR 2R 2C+CR 2XX RCCR 2YXYCR RC +XY NRRN+RNXNYR反应中带着孤电子对离开的基团Y 称为离去基团,与Y 相连的碳原子称为α碳原子,与另一离去基团X (通常为氢)相连的碳原子称为β碳原子。
故在相邻原子上发生的消除反应称为β-消除反应。
β-消除是最重要最普遍的消除反应,常应用于药物合成。
例如五氯乙烷消去氯化氢,生成驱虫药四氯乙烯:CHCl 2CCl 2CCl 3CCl 222,3-二溴丁二酸消去两分子溴化氢,得到解毒药二巯琥钠的中间体丁炔二酸钠:BrHC BrHC NaOHC COONa CCOONa COOH COOH2-氯-9-(3-二甲氨基丙基)-9-羟基噻吨(Thiaxanthene )在硫酸催化下脱水制取神经官能症治疗药泰尔登:SCH 2CH 2CH 2N(CH 3)2HO SCHCH 2CH 2N(CH 3)2ClCl2466α-苯基丁酰胺脱水生成α-苯基丁腈,为全盛催眠药苯乙哌啶酮的中间体。
第六章 加成和消除反应

Hg RCH=CH2 Hg RCH=CH2 H2O RCHCH2Hg OH NaBH4 OH
RCHCH2OH OH
溶剂汞化反应 醋酸汞在亲核溶剂与烯烃加成 反应机理通过桥式汞正离子 高选择性反式加成产物
按鎓型离子机理进行反应的体系结构特点:
1) 底物是简单的烯烃或非共轭链的烯烃, 即C + 不稳定的体系; 2) 亲电试剂的进攻原子是第二周期以上的元素。
更稳定
CH3CH=CH2 HBr CH3CHCH3 CH3CH2CH2 Br Br Br CH3CHCH3 CH3CH2CH2Br
共轭二烯烃的亲电加成反应
C C C C C C
E Nu
C
C
C C E
C C
Nu
E C E
Nu C C C Nu
X2 Cl2, Br2 X C C C C
四.亲核加成反应
饱和碳原子进行亲核取代反应时 常伴随消除反应的发生
RCH2CH2OH + HX
RCH2CH2X + H2O RCH CH2 + H2O + HX
二.β-消除反应机理
根据离去基团和 β-氢从分子中离去 的顺序分为三种机理
C C H L
单分子消除反应 (E1)机理
双分子消除反应(E2)机理 共轭碱单分子消除 (E1CB)机理
底物
试剂
溶剂
底物
双键上的电子云密度越大 越利于亲电试剂的进攻
CH3 2C C CH3 2 > CH3 2C CHCH3 > CH3 2C CH2
CH3CH CH2 > CH2 CH2 > BrCH CH2 > CH2 CHCOOH
CH CH2 > CH2 CH2 >
第6章 脂肪族饱和碳原子上的亲核取代反应 消除反应

烷基结构对SN1的影响
V3 o RX > V2 RX > V1 RX > VCH X
o o 3
R-Br + H2O R: CH3 1
甲酸
R-OH + HBr (CH3)2 CH 45 R2CHX S N1 , S N2 (CH3)3 C 108 R3CX S N1
CH3CH2 1.7 RCH2X S N2
C C C O
特点 1 只能在共轭体系中传递。
2 不管共轭体系有多大,共轭效应能贯穿于整个共轭体系中。
6.1.3 超共轭效应
定义:当C-H 键与键(或p电子轨道)处于共轭位置时,也会 产生电子的离域现象,这种C-H键 电子的离域现象叫
做超共轭效应。
H H C H
H
+
R R
CH
CH2
H H
C
C
C2H5OH SN1
CH3
C2H5ONa, C 2H5OH SN2
CH3CCH2OC2H5 + Br
CH3 CH3 + CH3C=CHCH3
CH3CCH2CH3 OC2H5 (2)
(3)
重排产物
消除产物
重排反应
当化学键的断裂和形成发生在同一分子中时, 引起组成分子的原子的连接方式发生改变, 从而形成组成相同,结构不同的新分子,这 种反应称为重排反应。
V=K1[ CH3Br] 一级反应
R1 R2 R3
-Br -
R1 C Br + :Nu
R2 R1
R2 R3
R3 :Nu
C
Nu + Br-
(+) -
定义:只有一种分子参与了决定反应速度关键步骤 的亲核取代反应称为SN1 反应。
高等有机化学课件第六章

CH2 CH3CH CH CH3
(2)插入反应 卡宾可以插入到碳与其他原子所形成的单键中,如
C-H、C-Cl、O-H,但不能插入C-C中。
CCl4 + CH2:
CH2Cl CH2Cl C CH2Cl
CH2Cl
CH3OH + CH2:
CH3CH2OH + CH3OCH3
二、乃春 乃春有称氮烯、氮宾,与卡宾类似,是NH 及其衍
咪唑类卡宾已合成
2、卡宾的产生 (1)α-消除反应
NaOH R2CHCl
R2C: +
HCl
Cl3CH NaOH CH2: + HCl
(2)重氮盐或烯酮分解
CH3 N N
CH2: + N2
CH3 C O
CH2: + CO
3、卡宾的反应 (1)加成反应 单线态为典型的顺式加成,三线态则生成混合产物
CH3CH=CHCH3 + CH2:
二、自由基的产生
1、共价键受热均裂 气相或非极性溶剂中均裂
过氧化物分解 偶氮化合物分解
2、共价键光分解 气相、液相被光照均分解,光照是特定能量的转移,
具有一定的专一性,副反应少。
第三节 双自由基
一、卡宾 卡宾有称碳烯、碳宾,是CH2: 及其衍生物的总称。
1、卡宾的电子构型 最简单的卡宾是亚甲基 CH2: 它以单线态和三线
态存在。 单线态卡宾接近于sp2杂化,有空的p轨道和填
充一对电子的sp2轨道。(既亲电又亲核) 三线态卡宾接近sp杂化,两条p轨道中,各填充
一个单电子。(双自由基) 根据洪特规则:三线态卡宾比单线态卡宾稳定
当亚甲基上有给电子基团时,单线态比三线态稳定
高等有机化学之消除反应机理

H
BH
B-H
B
X
X
X
解释事实:
CH(CH3)2 Cl fast
- HCl CH3
CH(CH3)2
+
CH3 75%
CH(CH3)2
CH3 25%
CH(CH3)2
解释事实: Cl slow
CH(CH3)2 Cl
- HCl CH3
CH3
H
CH(CH3)2 H
Cl
CH3
CHMe2 H
H Cl
CH(CH3)2
0
64
36
0.02
54
46
0.08
44
56
1.0
2
98
思考:试剂体积增加有利于取代还是消除反应?
CH3
CH3
SN1 (CH3)3C OH + H
83%
(2) 重排产物的生成:
Wanger-Meerwein 重排
H3C
CH3 C CH2Br EtOH H3C
Br
CH3
CH3 C CH2 CH3
H3C C CHCH3 CH3H
H3C C C CH3
H H3C
H
按E1机理反应的底物结构特: 形成稳定正碳离子的体系。
Br
(CH3)3CO
D HH
(94%)
H
氢化原菠烷基溴
由于环的刚性,Br-Cα-Cβ-H不能同处一个平面, 但Br-Cα-Cβ-D共平面。是顺叠构象,所以进行顺 式消除。
b. β-H的活泼性 活泼性的β-H处于顺位,则顺式占优势;处于反位,则反 式占优势
Hb H Ar (CH3)3COK H OTHs a
遵守Hofmann 规律 E1CB 类似E1CB 协同E2 类似E1 E1
智慧树知到《高等有机化学》章节测试答案

A.α-羟基酯 B.β-羟基酯 C.α,β-环氧酯 D.α,β-不饱和酯 答案:C 9、狄克曼缩合是分子间的克莱森缩合反应() A.对 B.错 答案:B 10、下列化合物中,能发生相同克莱森酯缩合反应的是() A.甲酸乙酯 B.甲酸苯酯 C.丙酸乙酯 D.苯甲酸乙酯 答案:C 第五章 1、频哪醇重排一般发生在() A.酸性条件 B.碱性条件 C.中性条件 D.上述条件都可以 答案:A
C.转金属 D.还原消除 答案:ABCD 10、铃木反应过程中催化剂金属钯的化合价没有发生变化() A.对 B.错 答案:B 第四章 1、罗宾逊环化可用于合成α,β-不饱和环酮() A.对 B.错 答案:A 2、在碱性条件下,丙二酸二乙酯与丙烯醛会发生() A.羟醛缩合反应 B.迈克尔加成反应 C.达村斯反应 D.曼尼希反应 答案:B 3、下列不能发生曼尼希反应的化合物是() A.甲胺 B.二甲胺 C.苯胺
D.是典型的亲核取代反应 答案:生成产物芳酮 3、付克酰基化反应与烷基化类似,反应只需要催化量的 AlCl3() A.对 B.错 答案:错 4、利用付克酰基化反应可以在芳环上引入直链烷烃() A.对 B.错 答案:对 5、当苯环的β-位有离去基团时,可以发生邻基参与得到苯鎓离子中间体() A.对 B.错 答案:对 6、反应过程中如果得到构型保持的产物,该反应可能发生了() A.邻基参与 B.SN1 反应 C.SN2 反应 D.芳香亲核取代反应 答案:邻基参与 7、卤素中,邻基参与能力最强的是哪一个() A.氟
C.外消旋体 D.Z,E 构型混合物 答案:B 6、瑞福尔马斯基反应使用的有机锌试剂较格氏试剂稳定,不与下列哪个化合物反 应() A.乙醛 B.丙酮 C.环戊酮 D.乙酸甲酯 答案:D 7、醛、酮与α-卤代酯的有机锌试剂生成β-羟基酯的反应称为瑞福尔马斯基反应 () A.对 B.错 答案:A 8、瑞福尔马斯基试剂除了与醛酮反应,还可以与酰氯、亚胺等亲电试剂发生反应 () A.对 B.错 答案:A 9、铃木反应的机理经历了哪些过程() A.氧化加成 B.配体交换
高等有机化学 第5章 加成与消除反应

B r
C H 3
C H 3
C H 2=C H C H =C H C H C H +3 C H 2=C H C H 2C H =C H C H 3
m ajor product
m inor product
C H 3 C H =C H C H C H 3 +
m ajor product
C H 3 C H 2C H =C C H 3
R L n M
R '
R '
R '
R ' R '
R '
• 烃烃复分解反应(fǎnyìng)所用的催化剂如:Cy为环已基。
Cl PPh3 H Ru
Cl PPh3 H
Ph
Cl PCy3 H Ru
, Cl PCy3 Ph
Ph
精品资料
二 消除反应 1.消除反应定义与类型 消除反应(Elimination Reaction):是指从一个化合物的 分子中消除两个原子或原子团的反应。
两个底物烯烃在催化剂作用下发生卡宾交换反应,即一对烯烃中 由双键相连接的两部分发生了交换,进而(jìn ér)生成了两个 新的烯烃。它是一种形成碳碳骨架的新颖有效方法。
R 1C C R 2 + R 1C C R 2催 化 剂 R 1C C R 1 + R 2C C R 2
R 1 R 2R 1 R 2
立体化学:不具立体选择性,产物是顺和反式异构体
重排现象:重排后能形成更稳定的碳正离子;
有烷基或氢重排。
精品资料
4.卤素(lǔ sù)的加成反应
(I) 卤素与烯烃的加成立体化学与卤化氢与烯烃的加成类似 (lèi sì),孤立烯反式加成为主,共轭烯产物情况复杂:
高等有机化学:6.4 消除反应 (Elimination Reaction)
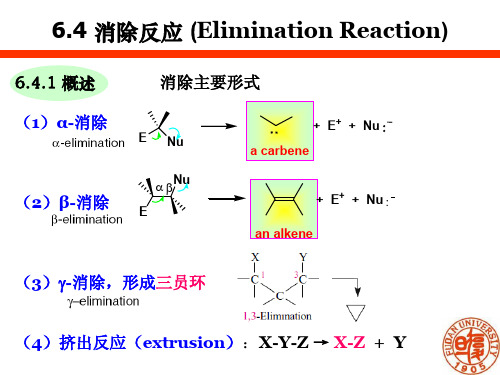
+ δ
Br δ-
(←) solv
H
+
B
H
+
Br- intimate
ion-pairs
k2
O Br- H S solvent separated
B
H
+
+ BH+
+ Br-
Solv
28
erythro-3-d-2-butyl tosylate
MeH H
anti-elim. Me Me Me H
TsO DMe
6.4 消除反应 (Elimination Reaction)
6.4.1 概述 (1)α-消除
(2)β-消除
消除主要形式
E Nu
Nu
E
+ E+ + Nu a carbene
+ E+ + Nu an alkene
(3)-消除,形成三员环
(4)挤出反应(extrusion):X-Y-Z → X-Z + Y
OTs
A
OTs
B 25
2. E1: 与SN1 相似
易于离解为碳正离子的化合物易于按E1 历程进行 发生取代或消除的比例与离去基无关
H-CR2-CR2-X H-CR2-CR2+
slow fast
H-CR2-CR2+ + X CR2=CR2 + H+
Kinetic order in E1: substrate 1, base 0 -proton exchange: No Base catalysis: No
离去基团体积较大(如芳基磺酸酯)与较大且碱性强的碱作用时, 反应物的空间因素决定反式消除产物为主产物
高等有机化学 第6章_羰基化合物的反应

PhCH
O CHC R
EtMgBr
Et PhCHCH2COR
PhCH2
Et CH C R OH
R 1,4 产率
H 0%
Me Et 60% 71%
i-Pr 100%
结论:羰基是醛-1,2 - 加成, 酮-1,4 - 加成 亲核试剂是烷基锂为1,2 - 加成, 亲核试剂是烷基铜锂为1,4 - 加成
C=NH
消去反应 *酸催化:控pH=6, *可用作醛酮的鉴别、分 离和提纯 * 反应范围:所有的醛、 酮。叫羰基试剂 *醛、酮的有效检别方法: 用2,4-二硝基苯肼,生 成黄色沉淀。 *亚胺和取代亚胺不稳定, 芳醛形成的稳定。
亚胺
取代亚胺 (希夫碱)
NH-C-NH2
=O
三、醛、酮亲核加成反应的立体选择性
CH2Cl2
CH3 H3C C C COCH 3 H
96 %
硫叶利德的反应
1 硫叶利德的结构
O R2S-CH 2
+
O
-
R2S=CH2
R2S-CH2
+ -
R2S=CH2
2 硫叶利德的制备
O CH3-S-CH3 + CH3I
O CH3-S-CH3 I CH3
+
NaH, (CH3)2SO -HI
O R2S-CH2
O HO + H CH2CH HOH + O CH2 CH O CH2 CH
O CH3CH
O CH2 CH CH2 O CH
O
O
CH3CHCH2CH
O
6 消除反应

(CH3)3C+ + H2O H + OSO2OH (CH3)2C=CH2 + H2SO4
CH2
2.E1CB(单分子共轭碱消除反应)
该反应分两步进行:首先在碱催化下,碱与反应物中的β—H原子结 合生成共扼碱(Conjugate Base)的负碳离子,该负碳离子中的离去基 团带着一对电子离去并形成键。
RCH2CHR' X
慢 X
RCH2CHR'
快 B
RCH=CHR’ + HB
由于在决定反应速度的步骤中仅反应物分子参加,因而叫单分子消除 反应(E1)。El的反应速度与反应物的浓度成正比。
醇消除反应历程
? (CH3)3C-OH+ H2SO4 + (CH3)3C-OH2 + (CH3)2C
慢
快
+ (CH3)3C-OH2 + HSO4-
6.2.2 离子型消除反应与取代反应
离子型消除反应与取代反应具有类似的机理,前者无论 为单分子消除抑或双分子消除,每每与后者相伴发生。以何 者为主,常依反应物的结构、试剂、介质、温度等诸因素而 异,情况颇为复杂。虽迄今定量的描述尚付阙如,唯仍可总 结出一些定性的经验规律。 1. 双分子反应(E2):一般说来伯卤代烷与亲核试剂作 用较易发生SN2,尤其与强亲核试剂作用时这一倾向更大。 而若其β—位有活泼氢(如苯甲型、烯丙型),则E2的速度增 加。 当伯卤代烷与强碱试剂作用时将以E2为主,如由于碱 性NaNH2>EtONa,则:
6.2. 4 热消除反应的机理
不需酸碱催化的热消除反应为单分子反应,它系通过环状过渡状 态进行的。消除的 β-H与离去基团处于顺式共平面时才能形成这种 过渡状态,因而具有顺式消除的立体化学特征,谓之Ei. (1)酯的热分解:常用的酯为醋酸酯,主要产物为Hofmann烯烃。
第六章有机化学课后习题答案

第六章卤代烃1.回答下列问题(1).在CH3CH2Cl(I),CH2═CHCl(II),CH≡CCl(III),C6H5Cl(IV)四种一氯代烃中,按C-X键键长次序排列,并讨论其理由。
解: IV< II < III <I(2).将四种化合物(A) CH3CH2CH2F,(B) CH3CH2CH2I ,(C) CH3CH2CH2Br ,(D) CH3CH2CH2Cl的沸点从最高到低排列,并讨论其理由。
解: B> C> D> A(3).四种化合物(A) CH3CHClCH2OH,(B) CH3CHNH2CH2Br ,(C) HC≡CCH2Cl,(D) CH3CONHCH2CH2Cl 中,哪些能生成稳定的格氏试剂?为什么?解: D(4).比较(A) CH3CH2CH2CH2Cl,(B) (CH3)2CHCH2Cl,(C) CH3CH2CH(Cl)CH3,(D) (CH3)3CCl四个氯代烃,它们发生S N2反应情况如何。
解: A> B> C> D(5).将①苄溴,②溴苯,③1–苯基–1–溴乙烷,④1–溴–2–苯基乙烷四个化合物按 S N1 反应的反应活性顺序排列,并讨论其理由。
解: ③>①>④>②(6).不活泼的乙烯型卤代烃能否生成格氏试剂?为什么?解:由于卤原子与双键间的 p-π共轭效应,使C-X键之间的键能增加,难以断裂。
(7).化合物:(A)正溴戊烷,(B)叔溴戊烷,(C)新戊基溴,(D)异戊基溴分别与水反应生成相应的醇,讨论它们的反应速率的差异?解: A> D> C> B(8).用极性溶剂代替质子溶剂对(A) S N1,(B) S N2,(C) 烯的亲电加成, (D) 醇的失水反应有何影响?解: 极性溶剂有利于S N1反应和烯的亲电加成反应的进行,不利于S N2反应和醇的失水反应的发生。
(9). 2–氯环己醇的反式异构体可以跟碱反应转化成环氧化物, 但顺式异构体却不能, 为什么?解: 2–氯环己醇的反式异构体跟碱反应时,进行反式消除,热力学能量低,反应速率快, 顺式异构体则不能。
有机化学(上)第六章 6.2.3

CO2↑
O
O
Mn
O
>C=C<
KMnO4 冷、稀 OH -
>C
O C< H2O
顺邻二 醇OH OH >C Nhomakorabea C< + MnO2
由于邻二元醇的进一步氧化,反应条件不易控制, 收率低。如用四氧化锇代替高锰酸钾,使用H2O2作为 氧化剂,则收率大大提高,但毒性大。
+ H2O2
Os O4
H OH
H OH
2.催化氧化
H2C CH CH3 + O2
Cu2O
350℃,0.25MPa
H2C CHCHO + H2O
丙烯在铋、钼、磷等催化剂存在下,用空气和 氨直接氧化生成丙烯腈的反应称为氨氧化反应。
H2C
CH
CH3+
3 2
O2+
NH3
催化剂 470℃
H2C CHCN + 3 H2O
C
Cα
δ-
δ+
XX
X·
高温或光照α-氢卤代,低温双键加成
与氯相比,溴的反应活性较差,但是选择性比氯 好。对于苄基或者烯丙基的溴代通常使用N-溴代 丁二酰亚胺(简称NBS)作溴化剂。
+ Br2
光照
Br + HBr
O
+
CCl4 N Br
O NBS
Br +
O NH
O
二、α-氢的氧化反应
工业上以金属氧化物(如Cu2O)为催化剂,用 空气氧化丙烯,生成丙烯醛:
3)烯烃加次卤酸后在碱性条件下脱卤化氢
4.臭氧化
CH3CH=CH2 O3
O H3C CH CH2
OO
第五章 极性加成和消除反应PPT课件
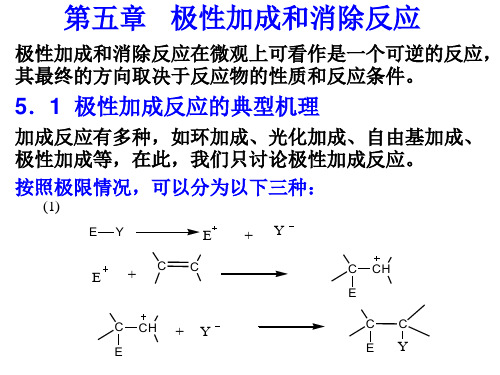
C CH E
C CH + Y
E
CC
EY
E Y首先解离成两个离子,然后形成一个独立的碳正 离子,最后与Y-加成为产物。
( 2 ) E Y +CC
C C + H Y
E
CC
EY
E-Y 不解离,直接加成形成碳正离子,然后形成产物, (1)、(2) 均为双分子反应,称为AdE2历程。
YE
(3 )2EY+CC
32:68 45:55
生成溴桥正离子,溴负离子从背后进攻, 反式加成。
CC
C C+EY
YE
EY
两个E-Y协同加成到碳碳双键上, 分别提供E,Y, 协同形 成产物。属三分子反应AdE3.
5.2 卤化氢对烯烃的加成
这是一个进行了多年机理研究的反应。主要集中在以下三 方面的研究:①加成反应的方向;②加成反应的立体化 学;③加成反应的动力学。
5.2.1加成反应的方向:
首先,我们来看一下区域选择的(regioselictive)和区域专 一(regiospecific)的反应:
XH
X
ArCH + H X R ArCHR AC rC H
反应首先形成离子对,如果离子对崩溃形成产物的速 度比旋转的速度快,则形成顺式加成反应, 反应为
二级。
动力学研究结果支持离子对机理,反应对卤化 氢是一级而不是二级。
另外有些情况,将使产物复杂化:
①反应在一个具有亲核能力的溶剂中进行时, 溶剂起亲核试剂的作用
第五章 极性加成和消除反应
极性加成和消除反应在微观上可看作是一个可逆的反应, 其最终的方向取决于反应物的性质和反应条件。
5.1 极性加成反应的典型机理
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cl- 离子加成生成1,2-加成产物(4)和1,4-加成产 物5)
1,3-丁二烯和溴的加成也是亲电加成,第一步 反应先形成碳正离子(I),而不是碳正离子(II)。
CH2 CH CH CH2 + Br Br
CH2 CH CH CH2 Br + CH2 CH CH CH2
(Ⅰ)
(Ⅱ) Br
因为碳正离子(I)中正电荷和双键共轭,体系
Br
如2-甲基-1,3-丁二烯和HBr加成时主要得到 1,4-加成产物,因为1,4-加成产物有8个C-Hσ 键与双键发生超共轭,而1,2-加成产物没有CHσ键和双键共轭,因此生成1,4-加成产物。
CH3
CH3
CH3
CH2 C CH CH2 HBr CH3 C CH CH2 Br + CH3 C CH CH2
(3)共轭烯烃的加成反应
共轭烯烃的亲电加成也是朝形成相对稳定的中间体 方向进行。第一步反应,亲电试剂的亲电部分总是 加到共轭链的一个末端碳上,而不会加到共轭链的 中间碳上。如1,3-丁二烯与HCl反应:
H2C CH CH CH2 + H+ 慢
CH2 CH CH CH2 H
CH2 CH CH CH2 H (2)
(1)
× H2C CH CH CH2
(2) + Cl
H
(3)
快 CH2 CH CH CH2 + CH2 CH CH CH2
Cl H (4) Cl
H (5)
第一步慢反应是H+或HCl分子的δ+ 端进攻共轭体系
的末端碳原子生成(2),而不是进攻共轭体系中
间碳原子生成(3)。因为碳正离子(2)比(3)
稳定容易生成。第二步快反应是碳正离子(2)与
1,4 加成
Br 1,2 加成
1-苯基-1,3-丁二烯和HBr的加成反应主要为 1,2-加成产物,该产物中苯环和双键共轭,较 其它形式的加成产物稳定。
Ph CH CH CH CH2
HBr Ph CH CH CH CH3 Br
1,4-二苯基-1,3二丁烯和溴加成的产物主要也 为1,2-加成产物,1,4-加成产物不超过4%。
HX
H
CC
H+ + C C + X
X HX
实际上有效的三分子碰撞的情况是罕见 的,有可能涉及烯与卤化氢的络合物与 另一分子卤化氢的相互作用:
C
C +H
快
X
HX CC
HX
慢
C C + HX
HX CC
HX
H CC X
+ HX
c.立体化学
(I)非共轭烯和卤化氢加成主要为反式加成。
(II) 当双键和能使碳正离子中间体稳定的 原子团共轭时,主要是顺式加成
H3C
CH3
CC
+ δBr δBr 慢
H
H
H3C Br CH3
CC
+ Br
H
H
H CH3
Br
或 Br
C Br+ 快 C
H CH3
CH3
CH3
Br
H
H
Br
H
Br + Br
H
CH3
CH3
(± )外消旋体
反应的第一步是极化了的Br2分子中δ+ 一端 进攻顺CH3CH=CHCH3,生成环状溴鎓离子 中间体。这是慢的一步。环状结构的溴鎓离 子中间体阻止了C—C单键的转动。第二步Br进攻这两个环碳原子的机会是均等的,所以 生成的产物是外消旋体,且是快反应。
YE
Y
(C) 2E Y + C C
CC
C C +Y E
YE
E
AdE3(三分子亲电加成反应)
1.卤化氢对烯的加成反应
a.马尔科夫尼科夫规则
如果一个不对称的烯反应结果得到两种可能的 加成产物,其中卤原子连接到烯的取代最多的 碳原子的产物占优势。(主要与碳正离子中间 体的稳定性有关)
R2C CHR H X R2CCH2R X 有利
简单和非共轭烯烃被认为易生成溴鎓离子, 理论计算结果表明环状溴鎓离子比相应的开 链碳正离子能量约低40kJ/mol,稳定得多因 而易于生成。Cl2、Br2、I2,对多数烯烃的 AdE2反应可形成桥鎓离子中间体,但有的先 经过烯—卤素络合物,再生成桥鎓离子中间 体。
X2 CC
X+ CC
X CC
加成反应的立体化学可以说明桥鎓离子的存在。形
ArHC CHR + HX
X ArHC
H CHR
XH ArHC CHR
“离子对”,碳正离子中心的稳定性较高, 碳氢键的形成不需要卤离子的协同进攻。
由于中间体为碳正离子,因此易被具有亲核 性的溶剂捕获,发生重排等作用。
2.卤素的加成反应
(I) 卤素与烯烃的加成立体化学与卤化氢与 烯烃的加成类似,孤立烯反式加成为主,共 轭烯顺式加成为主:
成桥鎓离子以后,亲核试剂需要从背面进攻,因此
会得到反式加成产物。桥式溴鎓离子的有力证明是 在 SbF5–SO2或 SbF5–SO2ClF溶 液 中 于 –60℃ 得 到 稳定的溴桥鎓离子盐:
Br C C SbF6
Br H
H
CC
H3C
Ph
桥式溴鎓离子并非都是对称结构,Yetes提出溴原 子和β–碳之间可以形成一个较弱的桥键,如当β–碳 上连有苯环时即是如此
第六章:极性加成和消除反应
加成反应和消除反应,机理途径相似,方向
相反
C CH H+
C C + H2O
OH
CC
H+
+ H2O
C CH OH
一、极性加成反应
涉及极性或离子性过渡态的加成反应,称为极性 加成反应。
(A)
EY
E+ Y
E+
+Y E
E EY
(B) E Y + C C
C C +Y
CC
EY
(A),(B)称为AdE2(双分子亲电加成反应)
R2C
CHR H
X
X R2ห้องสมุดไป่ตู้HCHR
不利
R2CCH2R X
R2CHCHR X
当供电子基团与烯烃相连时:
Y
H
Cl C C H + Y
Cl C C H 或 Cl C C H
HH
HH (I)
YH (II)
形成的碳正离子和卤素的未共享电子对共轭,使 体系能量降低。
当强吸电子的原子团与不饱和碳原子相连时:
F3C C H
(CH3)3N
CH2 + HBr AlBr3 CH CH2 + HI
F3C CH2 CH2Br (CH3)3N CH2 CH2I
b.动力学
卤化氢对烯的加成反应常常表现三级动力学
过程,反应速率方程是:v=k[烯烃][HX]2,
分子E—Nu的E端 和分子E—Nu的Nu端两进 攻基团分别从双键的两侧同时进攻形成加成 产物,叫做三分子亲电加成,其立体化学特 征也是反式加成:
稳定;而碳正离子(II)电荷定域,体系的能量
高。
第二步是Br-进攻碳正离子,得到1,4-加成产
物和1,2-加成产物,1,4-加成和1,2-加成产
物何者占优势,取决于反应物本身的结构和反
应条件。 CH2 CH CH CH2 Br
Br CH2 CH CH CH2 Br + CH2 CH CH CH2 Br
