《中国药典》2020版—胶囊用明胶国家药用辅料标准
中国药典明胶空心胶囊标准

明胶空心胶囊(中国药典2015年版四部--药用辅料p522页)Mingjiao Kongxin JiaonangVacant Gelatin Capsules本品系由胶囊用明胶加辅料制成的空心硬胶囊。
【性状】本品呈圆筒状,系由可套合和锁合的帽和体两节组成的质硬且有弹性的空囊。
囊体应光洁、色泽均匀、切口平整、无变形、无异臭。
本品分为透明(两节均不含遮光剂)、半透明(仅一节含遮光剂)、不透明(两节均含遮光剂)三种。
【鉴别】(1)取本品0.25g,加水50ml,加热使溶化,放冷、摇匀,取溶液5ml,加重铬酸钾试液-稀盐酸(4:1)数滴,即产生橘黄色絮状沉淀。
(2)取鉴别(1)项下剩余的溶液1ml,加水50ml,摇匀后,加鞣酸试液数滴,即发生浑浊。
(3)取本品约0.3g,置试管中,加钠石灰少许,产生的气体能使湿润的红色石蕊试纸变蓝色。
【检查】黏度取本品4.50g,置已称定重量的100ml烧杯中,加温水20ml,置60℃水浴中搅拌,使溶化。
取出烧杯,擦干外壁,加水使胶液总重量达到下列计算式的重量(含干燥品15.0%),将胶液搅匀后倒入干燥的具塞锥形瓶中,密塞,置40℃±0.1℃水浴中,约10分钟后,移至平氏黏度计内,照黏度测定法(附录ⅥG第一法,毛细管内径为2.0 mm),于40℃±0.1℃水浴中测定,本品运动黏度不得低于60mm2/s。
(1-干燥失重)×4.50×100胶液总重量(g)=─────────────15.0松紧度取本品10粒,用拇指与食指轻捏胶囊两端,旋转拔开,不得有粘结、变形或破裂,然后装满滑石粉,将帽、体套合、锁合,逐粒于1m的高度处直坠于厚度为2cm的木板上,应不漏粉;如有少量漏粉,不得超过1粒。
如超过,应另取10粒复试,均应符合规定脆碎度取本品50粒,置表面皿中,移入盛有硝酸镁饱和溶液的干燥器内,置25±1℃恒温24小时,取出,立即分别逐粒放入直立在木板(厚度2cm)上的玻璃管(内径为24mm,长为200mm)内,将圆柱形砝码(材质为聚四氟乙烯,直径为22mm,重20±0.1g)从玻璃管口处自由落下,视胶囊是否破裂,如有破裂,不得超过5粒。
药用明胶 执行标准

药用明胶执行标准
本标准旨在规定药用明胶的原料要求、生产工艺、质量标准、临床试验、稳定性、标签和说明书、储存和运输等方面的要求。
适用于药用明胶的生产和质量控制。
1. 原料要求
药用明胶的原料应为新鲜、健康、无病的猪皮或牛皮。
原料应无霉变、无污染,并经过严格检验,确保符合国家相关法规和标准。
2. 生产工艺
药用明胶的生产工艺应严格遵守国家相关法规和标准,包括工艺流程、操作规程、质量控制等方面的要求。
生产过程中应严格控制温度、湿度、压力等参数,确保产品质量稳定。
3. 质量标准
药用明胶的质量标准应符合国家相关法规和标准,包括外观、性状、鉴别试验、崩解时限、热原检查等方面的要求。
产品应无杂质、无异物,符合微生物学和化学方面的要求。
4. 临床试验
药用明胶在上市前应进行临床试验,以验证其疗效和安全性。
临床试验应遵循相关法规和标准,包括试验设计、试验方法、数据分析等方面的要求。
5. 稳定性
药用明胶应经过稳定性试验,以验证其在储存和使用过程中的稳定性和有效性。
稳定性试验应包括温度、湿度、光照等方面的测试,以确定产品的有效期和储存条件。
6. 标签和说明书
药用明胶的标签和说明书应符合国家相关法规和标准,包括产品名称、成分、性状、适应症、用法用量等方面的说明。
标签和说明书应清晰、易读,并符合医学和药学常识。
7. 储存和运输
药用明胶应储存在干燥、通风、阴凉的地方,避免阳光直射和潮湿环境。
储存期间应定期检查产品的质量状况,如发现质量问题应及时处理。
在运输过程中应采取措施防止产品破损或受污染,确保产品质量稳定。
2020版药典胶囊用明胶内控质量标准
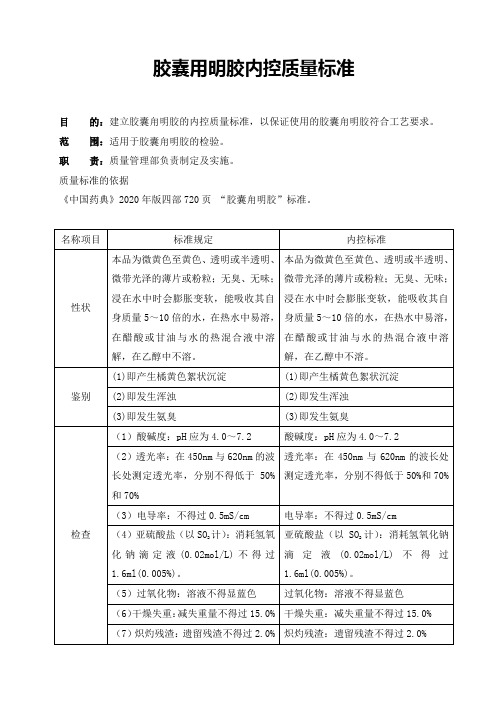
(9)砷盐:应符合规定(0.0001%)
砷盐:应符合规定(0.0001%)
(10)重金属:不得过百万分之二十
重金属:不得过百万分之二十
(12)微生物限度:每1g供试品中需氧菌总数不得过103cfu、霉菌及酵母菌总数不得过102cfu,不得检出大肠埃希菌;每10g供试品中不得检出沙门菌。
本品为微黄色至黄色、透明或半透明、微带光泽的薄片或粉粒;无臭、无味;浸在水中时会膨胀变软,能吸收其自身质量5~10倍的水,在热水中易溶,在醋酸或甘油与水的热混合液中溶解,在乙醇中不溶。
鉴别
(1)即产生橘黄色絮状沉淀
(1)即产生橘黄色絮状沉淀
(2)即发生浑浊
(2)即发生浑浊
(3)即发生氨臭
(3)即发生氨臭
检查
(1)酸碱度:pH应为4.0~7.2
酸碱度:pH应为4.0~7.2
(2)透光率:在450nm与620nm的波长处测定透光率,分别不得低于50%和70%
透光率:在450nm与620nm的波长处测定透光率,分别不得低于50%和70%
(3)电导率:不得过0.5mS/cm
电导率:不得过0.5mS/cm
(4)亚硫酸盐(以SO2计):消耗氢氧化钠滴定液(0.02mol/L)不得过1.6ml(0.005%)。
胶囊用明胶内控质量标准
目的:建立胶囊甪明胶的内控质量标准,以保证使用的胶囊甪明胶符合工艺要求。
范围:适用于Biblioteka 囊甪明胶的检验。职责:质量管理部负责制定及实施。
质量标准的依据
《中国药典》2020年版四部720页“胶囊甪明胶”标准。
名称项目
标准规定
内控标准
性状
本品为微黄色至黄色、透明或半透明、微带光泽的薄片或粉粒;无臭、无味;浸在水中时会膨胀变软,能吸收其自身质量5~10倍的水,在热水中易溶,在醋酸或甘油与水的热混合液中溶解,在乙醇中不溶。
明胶空心胶囊行业标准

明胶空心胶囊行业标准首先,明胶空心胶囊的原材料应符合国家相关标准,包括明胶、甘油、蔗糖等。
其中,明胶是明胶空心胶囊的主要原料,其品质直接影响到产品的质量。
因此,在原材料采购阶段,生产企业应选择正规、有资质的供应商,并对原材料进行严格的检验和质量控制。
其次,明胶空心胶囊的生产应符合国家相关的生产标准和规定。
生产企业应建立健全的生产工艺流程,严格执行生产操作规程,确保产品质量稳定可靠。
同时,生产现场应符合卫生标准,保持生产环境的清洁和整洁,避免外来污染对产品质量的影响。
另外,明胶空心胶囊的质量控制也是非常重要的一环。
生产企业应建立完善的质量管理体系,包括原材料检验、生产过程控制、成品检验等环节,确保产品符合国家相关标准和规定。
同时,生产企业还应建立完善的质量档案,对产品的质量信息进行记录和归档,以备日后的追溯和管理。
此外,明胶空心胶囊的包装和储存也需要符合相应的标准要求。
包装材料应符合食品包装卫生标准,确保产品在包装过程中不受污染。
同时,产品的储存条件也需要符合相关要求,避免产品受潮、受热、受阳光直射等不利因素的影响。
总的来说,明胶空心胶囊行业标准的制定和执行,对于保障产品质量和安全性具有重要意义。
生产企业应严格执行相关标准要求,加强质量管理,提升产品质量,为消费者提供安全、可靠的明胶空心胶囊产品。
同时,相关监管部门也应加强对明胶空心胶囊行业的监督和管理,确保行业健康有序发展。
在实际生产和使用过程中,我们还应不断总结经验,加强技术创新,不断提高产品质量和生产效率,为明胶空心胶囊行业的发展做出更大的贡献。
通过本文的介绍,相信读者对明胶空心胶囊行业标准有了更深入的了解,希望能够对相关生产企业和使用单位有所帮助。
同时,也希望明胶空心胶囊行业能够在规范化生产的基础上不断发展壮大,为人们的健康和生活提供更好的保障。
明胶空心胶囊质量标准

明胶空心胶囊质量标准(中国药典2010年版二部)Mingjiao Kongxin JiaonangVacant Gelatin Capsules本品系由胶囊用明胶加辅料制成的空心硬胶囊。
【性状】本品呈圆筒状,系由可套合和锁合的帽和体两节组成的质硬且有弹性的空囊。
囊体应光洁、色泽均匀、切口平整、无变形、无异臭。
本品分为透明(两节均不含遮光剂二氧化钛)、半透明(一节含遮光剂,一节不含)、不透明(两节均含遮光剂)三种。
【鉴别】(1)取本品0.25g,加水50ml,加热使溶化,放冷、摇匀,取溶液5ml,加重铬酸钾试液-稀盐酸(4:1)的混合液数滴,即生产橘黄色絮状沉淀。
(2)取鉴别(1)项下剩余的溶液1ml,加水50ml,摇匀后,加鞣酸试液数滴,即发生浑浊。
(3)取本品约0.3g,置试管中,加钠石灰少许,产生的气体能使湿润的红色石蕊试纸变蓝色。
【检查】松紧度取本品10粒,用拇指与食指轻捏胶囊两端,旋转拔开,不得有粘结、变形或破裂,然后装满滑石粉,将帽、体套合、锁合,逐粒于1m的高度处直坠于厚度为2cm的木板上,应不漏粉;如有少量漏粉,不得超过1粒。
如超过,应另取10粒复试,均应符合规定脆碎度取本品50粒,置表面皿中,移入盛有硝酸镁饱和溶液的干燥器内,置25±1℃恒温24小时,取出,立即分别逐粒放入直立在木板(厚度2cm)上的玻璃管(内径为24mm,长为200mm)内,将圆柱形砝码(材质为聚四氟乙烯,直径为22mm,重20±0.1g)从玻璃管口处自由落下,视胶囊是否破裂,如有破裂,不得超过5粒。
崩解时限取本品6粒,装满滑石粉,照崩解时限检查法(附录ⅩA)胶囊剂项下的方法,加挡板进行检查,各粒均应在10分钟内全部溶化或崩解。
如有1粒不能全部溶化或崩解,应另取6粒复试,均应符合规定。
亚硫酸盐(以SO2计)取本品5.0g,置长颈圆底烧瓶中,加热水100ml使溶化,加磷酸2ml与碳酸氢钠0.5g,即时连接冷凝管,以0.05mol/L碘溶液15ml为接收液,收集馏出液50ml,加水至100ml,摇匀,量取50ml,置水浴上蒸发,随时补充水适量,蒸至溶液几乎无色,加水至40ml,照硫酸盐检查法(附录ⅧB)检查,如显浑浊,与标准硫酸钾溶液3.75ml制成的对照液比较,不得更浓(0.01%)。
0103胶囊剂(2020版中国药典四部)

0103 胶囊剂胶囊剂系指原料药物或与适宜辅料充填于空心胶囊或密封于软质囊材中制成的固体制剂。
胶囊剂可分为硬胶囊和软胶囊。
根据释放特性不同还有缓释胶囊、控释胶囊、肠溶胶囊等。
硬胶囊(通称为胶囊)系指采用适宜的制剂技术,将原料药物或加适宜辅料制成的均匀粉末、颗粒、小片、小丸、半固体或液体等,充填于空心胶囊中的胶囊剂。
软胶囊系指将一定量的液体原料药物直接密封,或将固体原料药物溶解或分散在适宜的辅料中制备成溶液、混悬液、乳状液或半固体,密封于软质囊材中的胶囊剂。
可用滴制法或压制法制备。
软质囊材一般是由胶囊用明胶、甘油或其他适宜的药用辅料单独或混合制成。
缓释胶囊系指在规定的释放介质中缓慢地非恒速释放药物的胶囊剂。
缓释胶囊应符合缓释制剂(指导原则9013)的有关要求,并应进行释放度(通则0931)检查。
控释胶囊系指在规定的释放介质中缓慢地恒速释放药物的胶囊剂。
控释胶褒应符合控释制剂(指导原则9013)的有关要求,并应进行释放度(通则0931)检查。
肠溶胶囊系指用肠溶材料包衣的颗粒或小丸充填于胶囊而制成的硬胶囊,或用适宜的肠溶材料制备而得的硬胶囊或软胶囊。
肠溶胶囊不溶于胃液,但能在肠液中崩解而释放活性成分。
除另有规定外,肠溶胶囊应符合迟释制剂(指导原则9013)的有关要求,并进行释放度(通则0931)检查。
胶囊剂在生产与贮藏期间应符合下列有关规定。
一、胶囊剂的内容物不论是原料药物还是辅料,均不应造成囊壳的变质。
二、小剂量原料药物应用适宜的稀释剂稀释,并混合均匀。
三、硬胶囊可根据下列制剂技术制备不同形式内容物充填于空心胶囊中。
(1)将原料药物加适宜的辅料如稀释剂、助流剂、崩解剂等制成均匀的粉末、颗粒或小片。
(2)将普通小丸、速释小丸、缓释小丸、控释小丸或肠溶小丸单独填充或混合填充,必要时加入适量空白小丸作填充剂。
(3)将原料药物粉末直接填充。
(4)将原料药物制成包合物、固体分散体、微囊或微球。
(5)溶液、混悬液、乳状液等也可采用特制灌囊机填充于空心胶囊中,必要时密封。
《中国药典》2020年版中胶囊用明胶标准注释

《中国药典》2020年版中胶囊用明胶标准注释
王丹丹;俞辉
【期刊名称】《中国药品标准》
【年(卷),期】2022(23)4
【摘要】通过比较现行版欧美英日药典中明胶与《中国药典》中胶囊用明胶质量标准异同,了解国内外明胶质量标准项目设置目的和意义,对《中国药典》2020年版中胶囊用明胶质量标准进行注释,并对标准中存在问题提出的修订建议。
【总页数】4页(P347-350)
【作者】王丹丹;俞辉
【作者单位】浙江省食品药品检验研究院
【正文语种】中文
【中图分类】R921.2
【相关文献】
1.《中国药典》(2010年版)"明胶空心胶囊"
2.剖析2010年版中国药典中明胶空心胶囊中铬的测定
3.对2020年版《中国药典》中动物药质量标准的商榷
4.进阶中的中国药品标准——《中国药典》2020年版编制大纲编写说明
5.关于中药饮片质量和质量标准及《中国药典》2020年版饮片标准修订的思考与建议
因版权原因,仅展示原文概要,查看原文内容请购买。
国内外明胶标准汇总

--
--
二氧化硫/(mg/kg)
≤
40
160
40
4.5(75)
50
50
100
过氧化物/(mg/kg)
≤
--
不应检出
10
10
不应检出
砷(As)/(mg/kg)
≤
1
1
0.8
1
1.0
铬(Cr)/(mg/kg)
≤
--
2.0
10
10
2.0
铅(Pb)/(mg/kg)
≤
1.5
--
重金属(以Pb计)/(mg/kg)
项目
JECFA
中国药典
美国药典
日本药典
英国药典
欧洲药典
胶囊用明胶(药典4部)
水分/(w%)
≤
18
15
15
15
15
15
凝冻强度(6.67%,60℃)/(Bloom g)
≥
--
--
180
180
灰分/(w%)
≤
2
2.0
2.0
透射比/%
波长/(nm)
450
≥
--
50
50
620
≥
70
70
水不溶物/(w%)
不应检出
兰氏(血清学分类法)D群链球菌/g
100
--
霉菌及酵母菌
≤
100
100
100
凝冻浓度
不应流下
pH
3.6-7.6
4.0-7.2
3.8-7.6
3.8-7.6
4.0-7.2
电导率/mS·cm-1
≤
保健食品备案产品可用辅料及其使用规定2020年版
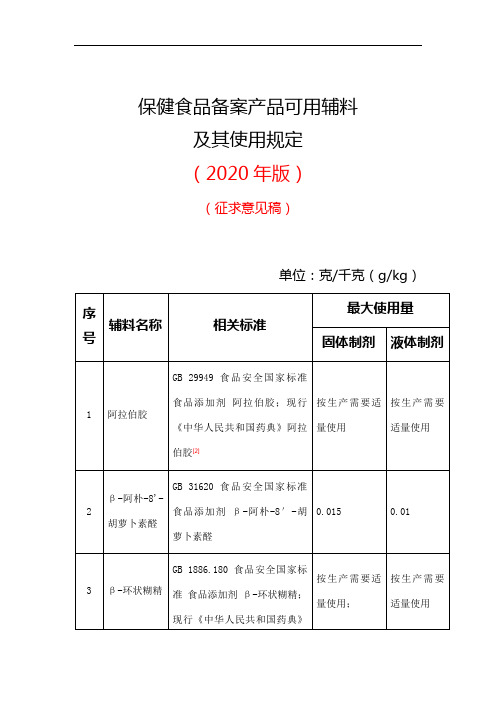
保健食品备案产品可用辅料及其使用规定(2020年版)(征求意见稿)单位:克/千克(g/kg)注:[1]不可作为凝胶糖果的辅料;[2]不可作为凝胶糖果、粉剂的辅料使用标准;[3]是凝胶糖果生产允许使用量;[4]不可作为粉剂的辅料。
关于《保健食品备案产品可用辅料及其使用规定(2020年版)》的说明:1.保健食品备案产品辅料的使用应符合国家相关标准及有关规定,必须遵循以下原则:对人体不产生任何健康危害;不以掩盖产品腐败变质为目的;不以掩盖产品本身或加工过程中的质量缺陷或掺杂、掺假、伪造为目的;不降低产品本身的保健功能和营养价值;在达到预期效果的前提下尽可能降低在产品中的使用量;加工助剂的使用应符合《食品安全国家标准食品添加剂使用标准》(GB2760)及有关规定。
2.本规定中的固体制剂是指每日最大食用量为20g的片剂、胶囊、软胶囊、颗粒剂、丸剂、凝胶糖果、粉剂。
液体制剂是指每日最大食用量为30ml的口服液和滴剂,超过30ml的液体制剂其辅料的使用按饮料类管理。
3.食品形态产品辅料的使用应符合《食品安全国家标准食品添加剂使用标准》(GB2760)等有关规定;允许使用本规定中收录的食品原料。
4.固体制剂及液体制剂中香精的使用应符合国家相关标准及有关规定,其组成成分应收录于《食品安全国家标准食品添加剂使用标准》(GB2760)或GB 30616 中附录A《食品用香精中允许使用的辅料名单》,用量可根据生产需要适量使用。
5.包衣预混剂、被膜剂的使用应符合国家相关标准及有关规定,其组成成分应收录于《食品安全国家标准食品添加剂使用标准》(GB2760)或《中华人民共和国药典》(2015版)中,用量可根据生产需要适量使用。
6.包埋、微囊化原料制备工艺中使用的辅料应符合国家相关标准及有关规定,其组成成分应收录于《食品安全国家标准食品添加剂使用标准》(GB2760)中,允许使用本规定中收录的辅料,使用本规定中辅料时应符合用量要求。
明胶生产-药用明胶质量标准及检验规程

**集团明胶事业部目的:明确明胶质量标准,规范明胶的检验。
适用范围:明胶的质量标准和检验规程责任人:质量部经理、QC部主管、QC人员、生产部经理。
引用标准:《中国药典》20**年版。
内容:2 性状2.1本品为淡黄色至黄色、半透明、微带光泽的粉粒或薄片;无臭;潮湿后,易为细菌分解;在水中久浸即吸水膨胀并软化,重量可增加5-10倍。
2.2 本品在热水或甘油与水的热混合液中溶解,在乙醇、三氯甲烷或乙醚中不溶;在醋酸中溶解。
3 鉴别3.1 理化鉴别3.1.1 仪器与试剂3.1.1.1 仪器:分析天平;滴管;移液管(5ml);试管(100㎜×10㎜)。
3.1.1.2 试剂:重铬酸钾试液;稀盐酸。
3.1.2 操作:取本品约0.5g,加水50ml,加热使溶解后,取溶液5ml,加重铬酸钾试液-稀盐酸(4:1)数滴,即生成橘黄色絮状沉淀。
3.1.3 判定:本品鉴别应呈正反应。
3.2 理化鉴别3.2.1 仪器与试剂3.2.1.1 仪器:分析天平;滴管;移液管(10ml);试管(100㎜×10㎜)。
3.2.1.2 试剂:鞣酸试液。
3.2.2 操作方法:取鉴别3.1.2项下的剩余的溶液1ml,加水10ml,摇匀后,加鞣酸试液数滴,即发生浑浊。
3.2.3 判定:本品鉴别应呈正反应。
3.3 理化鉴别3.3.1 仪器与试剂3.3.1.1 仪器:试管(100㎜×10㎜);电炉。
3.3.1.2 试剂:钠石灰3.3.2 操作方法:取本品,加钠石灰后,加热,即发生氨臭。
3.3.3 判定:本品鉴别应呈正反应。
4 检查4.1 凝冻浓度取本品1.10g,置称定重量的锥形瓶中,加水80ml,在15~18℃放置2小时,使完全膨胀后,置60℃水浴中加热溶解,取出,称重,加水适量使内容物成100g,取10ml,置内径13mm的试管中,在0℃冰裕中冷冻6小时,取出,倒置10秒钟,应不流下。
4.2 酸碱度4.2.1 仪器:酸度计;分析天平;量筒(100ml);定性滤纸。
胶囊质量标准

胶囊质量标准一、原料1.1 胶囊的原料应符合相关法规和标准,来源合法且质量稳定。
1.2 胶囊的原料应具有相应的检验报告和合格证明,以确保其质量和安全性。
二、胶囊壳2.1 胶囊壳的材料应为食用级明胶,且符合相关法规和标准。
2.2 胶囊壳的颜色应均匀,表面光滑,无明显瑕疵和变形。
2.3 胶囊壳的厚度应适中,且具有足够的强度和韧性,以保证填充和运输过程中的安全性。
三、内容物3.1 胶囊的内容物应符合相关法规和标准,质量稳定且对人体无害。
3.2 胶囊的内容物应具有良好的流动性,以便于填充和计量。
3.3 胶囊的内容物不应与胶囊壳发生化学反应或产生有害物质。
四、胶囊填充4.1 胶囊填充应保证内容物量的准确性,误差应在规定范围内。
4.2 填充过程中应避免污染和交叉污染,确保产品的卫生质量。
4.3 填充完成后,应对胶囊进行质量检查,确保其完整性、美观性和功能性。
五、胶囊密封性5.1 胶囊的密封性应符合相关法规和标准,确保其在使用过程中不漏药、不变质。
5.2 胶囊的密封性检验应包括压力测试、渗透测试等项目,以确保其满足使用要求。
六、胶囊标识6.1 胶囊的标识应清晰、易读,包括产品名称、生产日期、有效期、生产批号、使用方法等信息。
6.2 标识应采用合适的材料和颜色,以突出显示重要信息,避免误导消费者。
七、稳定性7.1 胶囊应具有良好的稳定性,确保在正常储存和使用条件下不发生变质或性能下降。
7.2 稳定性测试应包括加速老化试验、温度湿度试验等项目,以评估胶囊的质量和可靠性。
八、安全性8.1 胶囊应符合食品安全性标准,无毒无害,不含有对人体健康造成危害的物质。
8.2 安全性测试应包括急性毒性试验、慢性毒性试验、致畸致突变试验等项目,以确保产品的安全性和可靠性。
对毒胶囊事件简述、分析及思考

对毒胶囊事件简述、分析及思考【简述】:毒胶囊事件最早由中央电视台的《每周质量报告》栏目于2012年4月15日在《胶囊里的秘密》这一期节目中曝光的。
随后该事件在社会上引起了广泛关注,同时政府相关部门也高度重视该事件。
该事件为一些胶囊生产企业利用工业明胶生产胶囊并销售给药品生产企业所引起。
全国著名的胶囊之乡位于浙江省新昌县所出产的同种型号的胶囊之间的单位出厂价格差别很大。
调查者对此随即展开调查,一位业内人士透露,胶囊的主要原料是明胶,胶囊价格悬殊跟明胶原料有很大的关系。
为此,调查者展开了更深一步的调查并最终发现了廉价明胶原料大多来自河北、江西等地。
再对明胶原料的生产做进一步调查后发现,生产廉价胶囊的胶囊企业所用的明胶原料为工业明胶,该明胶的生产使用了一种价格低廉的“蓝矾皮”作为原料。
“蓝矾皮”即皮革厂鞣制后的皮革上面裁剪下来的下脚料,重金属铬含量超标严重。
由“蓝矾皮”生产的明胶铬含量严重超标,由这种“蓝皮胶”生产的胶囊铬含量同样超标即为“毒胶囊”。
此事件一经报道,即在社会上引起了强烈的反响,国家有关部门对此也高度。
卫生部长陈竺对毒胶囊事件表示,“胶囊重金属超标要依法管理,有责任的企业家应承担起社会责任。
”卫生部于2012年4月21日要求各级各类医疗机构要积极配合药监部门,召回铬超标药用胶囊事件相关药品生产企业生产的检验不合格批次药品,立即暂停购入和使用相关企业生产的所有胶囊剂药品,随后并发出了《关于召回和暂停使用部分药品生产企业胶囊剂药品的通知》。
与此同时,最高人民检察院表示,要坚决查处毒胶囊事件所涉渎职等职务犯罪。
公安部门高度重视此事件,立即部署有关地方公安介入侦查并积极会同有关部门展开查处工作。
国家食品监督管理局发出紧急通知,“由于涉嫌铬超标,要求对13个药用空心胶囊产品暂停销售和使用。
药用胶囊视同药品进行管理。
”【分析】:依据《中华人民共和国刑法》第三十条,用含铬超标的工业明胶生产药用空心胶囊并销售的企业以及用铬含量超标胶囊生产药品并销售的企业的行为为单位犯罪,应当负刑事责任。
中国药典明胶空心胶囊标准

明胶空心胶囊(中国药典2015年版四部--药用辅料p522页)Mingjiao Kongxin JiaonangVacant Gelatin Capsules本品系由胶囊用明胶加辅料制成的空心硬胶囊。
【性状】本品呈圆筒状,系由可套合和锁合的帽和体两节组成的质硬且有弹性的空囊。
囊体应光洁、色泽均匀、切口平整、无变形、无异臭。
本品分为透明(两节均不含遮光剂)、半透明(仅一节含遮光剂)、不透明(两节均含遮光剂)三种。
【鉴别】(1)取本品0.25g,加水50ml,加热使溶化,放冷、摇匀,取溶液5ml,加重铬酸钾试液-稀盐酸(4:1)数滴,即产生橘黄色絮状沉淀。
(2)取鉴别(1)项下剩余的溶液1ml,加水50ml,摇匀后,加鞣酸试液数滴,即发生浑浊。
(3)取本品约0.3g,置试管中,加钠石灰少许,产生的气体能使湿润的红色石蕊试纸变蓝色。
【检查】黏度取本品4.50g,置已称定重量的100ml烧杯中,加温水20ml,置60℃水浴中搅拌,使溶化。
取出烧杯,擦干外壁,加水使胶液总重量达到下列计算式的重量(含干燥品15.0%),将胶液搅匀后倒入干燥的具塞锥形瓶中,密塞,置40℃±0.1℃水浴中,约10分钟后,移至平氏黏度计内,照黏度测定法(附录ⅥG第一法,毛细管内径为2.0 mm),于40℃±0.1℃水浴中测定,本品运动黏度不得低于2/s。
60mm(1-干燥失重)×4.50×100胶液总重量(g)=─────────────15.0松紧度取本品10粒,用拇指与食指轻捏胶囊两端,旋转拔开,不得有粘结、变形或破裂,然后装满滑石粉,将帽、体套合、锁合,逐粒于1m的高度处直坠于厚度为2cm的木板上,应不漏粉;如有少量漏粉,不得超过1粒。
如超过,应粒复试,均应符合规定10另取.脆碎度取本品50粒,置表面皿中,移入盛有硝酸镁饱和溶液的干燥器内,置25±1℃恒温24小时,取出,立即分别逐粒放入直立在木板(厚度2cm)上的玻璃管(内径为24mm,长为200mm)内,将圆柱形砝码(材质为聚四氟乙烯,直径为22mm,重20±0.1g)从玻璃管口处自由落下,视胶囊是否破裂,如有破裂,不得超过5粒。
2015药典第四部胶囊用明胶

2015中华人民共和国药典——胶囊用明胶Jiaonangyong MingjiaoGelatin for Capsules本品为动物的皮、骨、腱与韧带中胶原蛋白不完全酸水解、碱水解或酶降解后纯化得到的制品,或为上述三种不同明胶制品的混合物。
【性状】本品为微黄色至黄色、透明或半透明微带光泽的薄片或粉粒;无臭、无味;浸在水中时会膨胀变软,能吸收其自身质量5〜10倍的水。
本品在热水中易溶,在醋酸或甘油与水的热混合液中溶解,在乙醇中不溶。
【鉴别】(1)取本品o. 5g,加水50ml,加热使溶解,取溶液5ml,加重铬酸钾试液-稀盐酸(4 : 1 )的混合液数滴,即产生橘黄色絮状沉淀。
(2 )取鉴别(1 )项下剩余的溶液lm l,加水100ml,摇匀后,加鞣酸试液数滴,即发生浑浊。
(3 )取本品,加钠石灰后,加热,即发生氨臭。
【检查】冻力强度(仅限硬胶囊)取本品两份各7.50g,分别置冻力瓶内,加水制成6.67%的胶液,加盖,放置1〜4 小时后,在65T:士2°C的水浴中搅拌加热15分钟使供试品溶散均勻,在室温下放置1 5分钟后,将冻力瓶水平放置在10°C 士0. 1°C的恒温水浴中,用橡胶塞密塞保温1 7小时士1小时后,迅速移出冻力瓶,擦干外壁,置冻力仪测试台上测试,计算两次结果的平均值,冻力强度应不低于180Bloom g0酸碱度取本品l.Og,加入热水100ml, 充分振摇使溶解,放冷至35°C,依法测定(通则0631),p H 值应为4.0〜7. 2。
透光率取本品2.0g,加50〜60T:水溶解并制成含6. 67%的溶液后,冷却至45°C,照紫外-可见分光光度法(通则0 4 0 1 ) ,分别在450nm和620nm的波长处测定透光率,分别不得低于50%和70% 。
电导率取本品l.O g,加不超过60*€的水溶解并制成含1.0%的溶液,作为供试品溶液,另取水100ml作为空白溶液,将供试品溶液与空白溶液置于30°C±1°C的水浴中保温1小时后,用电导率仪测定,以铂黑电极作为测定电极,先用空白溶液冲洗电极3 次后,测定空白溶液的电导率,其电导率值应不得过5 . 0 # / cm。
《中国药典》2020版—明胶空心胶囊国家药用辅料标准

附件:明胶空心胶囊Mingjiao Kongxin JiaonangVacant Gelatin Capsules本品系由胶囊用明胶加辅料制成的空心硬胶囊。
【性状】本品呈圆筒状,系由可套合和锁合的帽和体两节组成的质硬且有弹性的空囊。
囊体应光洁、色泽均匀、切口平整、无变形、无异臭。
本品分为透明(两节均不含遮光剂)、半透明(仅一节含遮光剂)、不透明(两节均含遮光剂)三种。
蒸至溶液几乎无色,用水稀释至40ml,照硫酸盐检查法(通则0802)检查,如显浑浊,与标准硫酸钾溶液3.75ml 制成的对照液比较,不得更浓(0.01%)。
对羟基苯甲酸酯类(此项适用于以对羟基苯甲酸酯类作为抑菌剂的工艺)取本品约0.5g,精密称定,置已加热水30ml 的分液漏斗中,振摇使溶解,放冷,精密加乙醚50ml,小心振摇,静置分层,精密量取乙醚层25ml,置蒸发皿中,蒸干乙醚,用流动相转移至5ml 量瓶中并稀释至刻度,摇匀,作为供试品溶液;另精密称取羟苯甲酯、羟苯乙酯、羟苯丙酯、羟苯丁酯对照品各25mg,置同一250ml 量瓶中,加流动相溶解并稀释至刻度,摇匀,精密量取5ml 置25ml 量瓶中,用流动相稀释至刻度,摇匀,作为对照品溶液。
照高效液相色谱法(通则0512)试验,用十八烷基硅烷键合硅胶为填充剂,以甲醇-0.02mol/L 醋酸铵(58∶ 42)为流动相,检测波长为254nm,理论板数按羟苯乙酯峰计算应不低于1600。
精密量取供试品溶液与对照品溶液各10μl,分别注入液相色谱仪,记录色谱图;供试品溶液如出现与对照品溶液相应的峰,按外标法以峰面积计算,含羟苯甲酯、羟苯乙酯、羟苯丙酯与羟苯丁酯的总量不得过0.05%。
氯乙醇(此项适用于环氧乙烷灭菌的工艺)取本品适量,剪碎,称取2.5g,置具塞锥形瓶中,加正己烷25ml,浸渍过夜,将正己烷液移至分液漏斗中,精密加水2ml,振摇提取,取水溶液作为供试品溶液。
另取氯乙醇适量,精密称定,加正己烷溶解并定量稀释成每1ml中约含柱温110100ml试验,用柱温45(0.000117.5%。
《中国药典》2020版—胶囊用明胶国家药用辅料标准

附件:胶囊用明胶Jia OnangyOng Min gjiaoGeIatin for CaPSUleS本品为动物的皮、骨、腱与韧带中胶原蛋白不完全酸水解、碱水解或酶降解后纯化得到的制品,或为上述三种不同明胶制品的混合物。
【性状】本品为微黄色至黄色、透明或半透明微带光泽的薄片或粉粒;无臭、一在水中时会膨胀变软,能吸收其自身质量5~10倍的水。
本品在热水中易溶,在醋酸或甘油与水的热混合液中溶解,在乙醇中不溶。
【鉴别】(1)取本品0∙5g,加水50ml ,加热使溶解,取溶液5ml ,加重铬酸钾试液-稀盐酸(4:1)的混合液数滴,即产生橘黄色絮状沉淀。
(2)取鉴别(1)项下剩余的溶液1ml ,加水100ml ,摇匀后,加鞣酸试液数滴,即发生浑浊。
(3)取本品,加钠石灰后,加热,即发生氨臭。
【检查】凝冻强度(仅限硬胶囊)取本品两份各7.50g ,分别置内径为59±mm的冻力瓶中,加水105g用橡胶塞密塞,在室温下放置1〜4小时,使供试品充分吸水膨胀,在65 ± C 的水浴中搅拌加热15分钟使溶散均匀,取冻力瓶置磁力搅拌器上,打开瓶塞,加磁力搅拌子,再盖上橡胶塞,磁力搅拌5分钟,使溶液分散均匀,且凝结在冻力瓶内壁的水已混合到溶液中,制成 6.67%的供试胶液。
在室温条件放置,使瓶内的胶液温度降至约30C 后,再将冻力瓶放入已调节水平的恒温水浴箱中,在10C ±.2 C中保温16〜18小时后,迅速取出冻力瓶,擦干外壁水珠,打开冻力瓶的橡胶塞盖,将冻力瓶放置在凝胶强度测定仪的测试平台上,使冻力瓶的中心在探头正下方,采用直径为______________ 12.7 ±.1mm且底部边缘锐利的圆柱型探头,以每秒0.5mm 的下行速度,测定探头下压至凝胶表面下凹4mm处的凝冻强度,取两份供试品测定结果的平均值,即得。
凝冻强度应在标示值的⅛20%以内,两份供试品测量值的绝对差值不得过10BlOOm g。
明胶药典检验标准

胶囊用明胶Jiaonangyong MingjiaoGelatin for Capsules本品为动物的皮、骨、腱与韧带中胶原蛋白不完全酸水解、碱水解或酶降解后纯化得到的制品,或为上述三种不同明胶制品的混合物。
【性状】本品为微黄色至黄色、透明或半透明微带光泽的薄片或粉粒;无臭、无味;浸在水中时会膨胀变软,能吸收其自身质量5-10倍的水。
本品在热水中易溶,在醋酸或甘油与水的热混合液中溶解,在乙醇中不溶。
【鉴别】(1)取本品0.5g,加水50ml,加热使溶解后,取溶液5ml,加重铬酸钾试液-稀盐酸(4:1)的混合液数滴,即产生橘黄色絮状沉淀。
(2)取鉴别(1)项下剩余的溶液1ml,加水100ml,摇匀后,加鞣酸试液数滴,即发生浑浊。
(3)取本品,加钠石灰后,加热,即发生氨臭。
【检查】酸碱度取本品1.0g,加入热水100ml,充分振摇使溶解,放冷至35℃,依法测定(附录ⅥH),pH值应为3.0~7.2。
透光率取本品2.0g,加50℃~60℃水溶解并制成含6.67%(g/g)的溶液后,冷却至45℃,照紫外-可见分光光度法(附录ⅥA)分别在450nm和620nm的波长处测定透光率,分别不得低于50%和70%。
电导率取本品1.0克,加不超过60℃的水溶解并制成含1.0%的溶液作为供试品溶液,另取水100ml作为空白溶液,均置于30±1℃的水浴中保温1小时后,用电导率仪测定(按仪器说明书操作),以铂黑电极作为测定电极,先用空白溶液冲洗电极3次后,测定空白溶液的电导率,其电导率值应不得过5.0 μS/cm。
取出电极,再用供试品溶液冲洗电极3次后,测定供试品溶液的电导率,应不得过0.5mS/cm。
冻力强度取本品两份各7.50g,分别置冻力瓶内,加水制成6.67%(g/g)的胶液,加盖,放置1-4小时后,在65±2℃的水浴中搅拌加热15分钟使样品溶散均匀,在室温下放置15分钟后,将冻力瓶水平放置在10±0.1℃的恒温水浴中,用橡胶塞密塞保温17±1小时后,迅速移出冻力瓶,擦干外壁,置冻力仪测试台上测试,计算两次结果的平均值,冻力强度应不低于180Bloom g。
药用辅料聚乙二醇400特性、用法用量

聚乙二醇400性质、用法用量一、性质:1.1 2020中国药典:本品为环氧乙烷和水缩聚而成的混合物。
分子式以HO(CH2CH2O)nH表示,其中n代表氧乙烯基的平均数。
【性状】本品为无色或几乎无色的黏稠液体;略有特臭。
本品在水或乙醇中易溶,在乙醚中不溶。
凝点本品的凝点(通则0613)为4~8℃。
相对密度本品的相对密度(通则0601)应为1.110~1.140。
黏度本品的运动黏度(通则0633第一法),在40℃时(毛细管内径为1.2mm)应为37~45mm2/s。
1.2 药用辅料手册:聚乙二醇描述为环氧乙烷和水的加成聚合物。
聚乙二醇200-600级是液体;在环境温度下,1000级及以上是固体。
液体等级(PEG 200-600)为透明、无色或微黄色的粘性液体。
它们有一种轻微但独特的气味和一种苦的、轻微燃烧的味道。
在环境温度下,PEG 600可以以固体形式发生。
聚乙二醇不支持微生物生长,也不会腐臭。
固体(PEG>1000)颜色为白色或灰白色,从糊状到蜡状薄片的稠度不等。
它们有一种淡淡的甜味。
PEG 6000及以上的牌号可作为自由流动的磨粉。
1.3 化学性质:性质:氮的平均值在8.2和9.1之间,摩尔重量范围380-420。
粘稠、微吸湿的液体;轻微的特征气味;d2525 1.128。
mp 4-8°。
粘度(210°F):7.3 cSt。
大鼠口服LD50:30ml/kg(Bartsch)。
二、作用2.1 药用辅料手册(聚乙二醇):○1聚乙二醇化学上比脂肪反应性更强;在处理过程中需要更加小心,以避免栓剂中不美观的收缩孔;○2水溶性药物的释放速率随聚乙二醇分子量的增加而降低;与脂肪相比,聚乙二醇对粘膜的刺激更大。
○3聚乙二醇水溶液既可以用作悬浮剂,也可以调节其他悬浮剂的粘度和稠度。
当与其他乳化剂一起使用时,聚乙二醇可以作为乳液稳定剂。
○4液体聚乙二醇作为水溶性溶剂用于软明胶胶囊的含量测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件:
胶囊用明胶
Jiaonangyong Mingjiao
Gelatin for Capsules
本品为动物的皮、骨、腱与韧带中胶原蛋白不完全酸水解、碱水解或酶降解后纯化得到的制品,或为上述三种不同明胶制品的混合物。
【性状】本品为微黄色至黄色、透明或半透明微带光泽的薄片或粉粒;无臭、无味;浸在水中时会膨胀变软,能吸收其自身质量5~10 倍的水。
取本品
1 . 0 g ,加水取本品7.5g,加水105g,加盖,放置1~4 小时,在65℃±
2 ℃的水浴中加热15分
钟,充分搅拌使供试品溶散均匀,制成6.67%的供试胶液,冷却至45℃,照紫外-可见分光光度法(通则0401)分别在450nm 和620nm 的波长处测定透光率,分别不得低于50%和70%。
电导率取本品1.0g,加水99g,加盖,放置1~4 小时后,在65℃±2 ℃的水浴中加热15 分钟,充分搅拌使供试品溶散均匀,制成2%的胶液,作为供试品溶液,另取水100ml 作为空白溶液,将供试品溶液与空白溶液置于30℃±1 ℃的水浴中保温1 小时后,用电导率仪测定,以铂黑电极作为测定电极,先用空白溶液冲洗电极3 次后,测定空白溶液的电导率,
其电导率值应不得过5.0μS/cm。
取出电极,再用供试品溶液冲洗电极3 次后,测定供试品溶液的电导率,应不得过0.5mS/cm。
亚硫酸盐(以SO2计)取本品20g,置长颈圆底烧瓶中,加水50ml,放置使溶胀后,加稀硫酸50ml,即时连接冷凝管,用水蒸气蒸馏,馏液导入过氧化氢试液(对甲基红-亚甲蓝混合指示液显中性)20ml 中,至馏出液达80ml,停止蒸馏;馏出液中加甲基红-亚甲蓝混合指示液数滴,用氢氧化钠滴定液(0.02mol/L)滴定至溶液显草绿色,并将滴定的结果用空白试验校正,每1ml 氢氧化钠滴定液(0.02mol/L)相当于0.64mg 的亚硫酸盐(以SO2计),消耗氢氧化钠滴定液(0.02mol/L)不得过1.6ml(0.005%)。
过氧化物取本品10g,置250ml 具塞烧瓶中,加水140ml,放置2 小时,在50℃的水浴
微生物限度取本品,依法检查(通则1105 与通则1106),每1g 供试品中需氧菌总数不得过103cfu,霉菌和酵母总菌数不得过102cfu,不得检出大肠埃希菌;每10g 供试品中不得检出沙门菌。
【类别】药用辅料,用于硬胶囊等。
【贮藏】密封,在干燥处保存。
【标示】1. 应标明使用的抑菌剂名称或灭菌方式。
2. 应标明本品凝冻强度的标示值及运动黏度(按所附测定方法之一测定)的标示值及范围。
附:黏度测定方法1 取本品4.50g,置已称定重量的100ml 烧杯中,加温水20ml,置
60℃水浴中搅拌使溶化;取出烧杯,擦干外壁,加水使胶液总重量达到下列计算式的重量(含商品胶浓度 15%),在40℃±0.1 ℃时,照黏度测定法(通则0633 第一法,毛细管内径为 2.0mm )测定。
胶液总重量(g )= 4.50╳100 15.0
黏度测定方法 2 取本品 7.5g ,置锥型瓶中,加水 105g ,加盖,室温放置 1~4 小时,在65 ℃±2℃的水浴中加热 15 分钟,充分搅拌使供试品溶散均匀制成 6.67%的胶液,冷却至 6
1
℃
;
开
启
超
级
恒
温
器
,使
流
过黏
度
计
夹
套中
水
的
温
度
为
6
℃
±
.
1
(单位为毫米)
按下式计算黏度值:
式中 n 为供试品的勃氏黏度,mPa·s ;
1.005 为 6.67%明胶溶液在 60℃时的密度,g/mL ; t 为流过时间,s ; A ,B 为黏度计常数,通过校正测定。
计算结果精确到小数点后一位。
重复测定两次结果的绝对差值不得过 0.1mPa.s 。
