cochrane评分表
cochrane评分表

Risk of biasItem Authors'judgementDescriptionAdequate sequence generation? Yes Prinicipal author stated thatcomputer generatedallocation was usedAllocation concealment? Yes Prinicipal author stated thatallocation was concealedBlinding? Unclear No mention of study personnelor participants being blindto treatment groupIncomplete outcome data addressed? Yes All participants accountedfor, one 'drop out' recordedbut included by us in analysisFree of other bias? Unclear Possible uneven distributionof complete and incompleteparalysis at start of studybetween the two treatmentgroupsCochrane RCT质量评价标准:①随机方法是否正确。
②是否隐蔽分组。
③盲法的使用情况。
④失访或退出描述情况,有无采用意向性(ITT)分析。
以上质量标准中,如所有标准均为“充分”,则发生各种偏倚的可能性很小;如其中一条为不清楚,则有发生相应偏倚的中等度可能性;如其中一条为“不充分”或“未采用”,则有发生相应偏倚的高度可能性。
可参见:RCT的质量评价标准选择总结/bbs/topic/18137535?tpg=1&age=-1Quality assessmentThe quality of the trials was assessed and graded independently by two authors according to the criteria described in The Cochrane Handbook 4.2.6 (Higgins 2006). Gradings were compared and any inconsistencies between the authors in the interpretation of inclusion criteria and their significance to the selected study were discussed and resolved.The selected study was assessed for the following characteristics:1. The adequacy of the randomisation process (possible selection bias). Adequate randomisation includes any one of the following methods: computer generated or table of random numbers, drawing of lots, coin-toss, shuffling cards or throw of a dice. Inadequate methods of randomisation include the following: case record number, date of birth or alternate numbers.2. The adequacy of the allocation concealment (possible selection bias). Adequate methods of allocation concealment include either central randomisation (i.e. separate to other aspects of trial administration) or sequentially numbered sealed opaque envelopes. Inadequate concealment means an open allocation sequence in which either participants or trialists were able to foresee the upcoming assignment.3. The blinding of outcome assessors (i.e. whether the persons assessing the outcome of care were aware of which treatment the participant had received - possible performance bias).4. The extent and handling of losses to follow up (possible attrition bias). Adequate handling of losses to follow up involves a clear description and explanation being given of any significant difference between the losses of the intervention groups. An unacceptable loss in any one intervention group was considered to be loss greater than 20%.Study gradings A, B or C were employed for overall quality as follows.A: Minimisation of bias in all four categories above: i.e. adequate randomisation, few losses to follow up and intention-to-treat analysis, blinding of outcome assessors, high quality outcome assessment;B: Each of the criteria in A partially met;C: One or more of the criteria in A not met.Risk of bias in included studiesWe classified this study as grade C because of the uncertainty about blinding. The possibility of an uneven distribution of complete and incomplete palsies between the two groups is another potential source of bias and we conclude overall that this is a low quality study.Table 8.5.a: The Cochrane Collaboration’s tool for assessi ng risk of biasTable 8.5.c: Criteria for judging risk of bias in the ‘Risk of bias’ assessment toolFigure 8.6.a: Example of a ‘Risk of bias’ table for a single study (fictional)Table 8.7.a: Possible approach for summary assessments of the risk of bias for each important outcome (across domains) within and across studies。
COCHRANE系统评价计划书

COCHRANE系统评价计划书1. 简介COCHRANE(协作网)是世界范围内最具影响力的提供可信赖的医学证据的机构之一。
COCHRANE系统评价是一种对医学研究进行全面综合分析的方法,旨在提供最可靠、最全面的证据来指导临床实践和政策制定。
本文档旨在概述COCHRANE系统评价计划的目的、方法和预期结果。
2. 计划目的本计划旨在通过COCHRANE系统评价来回答以下研究问题:[填写具体研究问题]。
通过对现有的研究进行综合分析,我们希望能够提供对该问题的最可靠的证据,以便指导医疗决策和改善患者的治疗结果。
3. 计划方法3.1 检索策略我们将通过系统检索的方式收集与研究问题相关的文献。
检索策略将包括关键词和限制条件的应用,以确保只有满足特定标准的研究被纳入综合分析。
3.2 研究选择根据预定的纳入和排除标准,我们将筛选符合条件的研究。
纳入标准将包括[填写具体纳入标准],排除标准将包括[填写具体排除标准]。
研究选择将由两个独立的评审员进行,如有争议将通过讨论或第三位评审员进行决定。
3.3 数据提取我们将从纳入的研究中提取必要的数据,并进行质量评估。
数据提取将由两个独立的评审员进行,以确保数据的准确性和一致性。
3.4 数据分析我们将采用统计学分析方法对纳入的研究进行综合分析。
根据研究设计和数据类型的不同,我们将选择合适的分析方法,如荟萃分析、子组分析等。
4. 预期结果通过COCHRANE系统评价,我们预计将得出对研究问题的最可靠的证据。
这包括对干预措施的有效性、安全性和成本效益的评估。
我们将根据预定的终点指标,如临床结局、生活质量等,提供定量或定性的结果。
5. 计划时间表本计划的时间表如下:•检索策略制定和文献检索:[填写具体时间]•研究选择和数据提取:[填写具体时间]•数据分析和结果呈现:[填写具体时间]•最终报告编写和提交:[填写具体时间]6. 计划团队本计划的执行需要一个专业的团队,包括研究者、信息专家、统计学家等。
(完整版)cochrane纳入的RCT文献质量评价中文版

洗牌的卡片和信封
掷骰子
抽签
最小化
*最小化,可实现无随机元素,被认为相当于是随机的。
判断为高风险的标准
研究者描述序列的产生使用的是非随机的方法。通常是系统的非随机方法,例如:
通过奇偶或出生日期产生序列
通过入院日期产生序列
通过类似住院号或门诊号产生序列
相对于上面提到的系统方法,其它非随机的方法少见的多,也更明显。通常包括对参与者进行判断或非随机的方法,例如:
研究未描述此情况
选择性发表
选择性发表导致发表偏倚
偏倚低风险标准
任何如下标准:
实验的计划书可获取,系统评价感兴趣的所有首要或次要结局均按计划书预先说明的方式报道
实验计划书不可得,但很明显发表的报告包括所有的结局,包括预先说明的结局(这种性质的有说服力的文字可能少见)
高风险判断标准
任何如下标准:
不是所有的预先说明的首要结局均被报道
尝试对关键的参与者和实施者行盲法,但盲法很可能被打破,结局很可能受到缺乏盲法的影响
风险未知
任何如下标准:
没有足够信息判断为低风险或高风险
研究未描述此情况
结局数据不完整
不全结局数据的数量,性质,处理方式导致失访偏倚
偏倚低风险标准
任何如下标准:
无缺失数据
缺失数据的产生不大可能与真实结局相关(对于生存数据,删失不大可能引入偏倚)
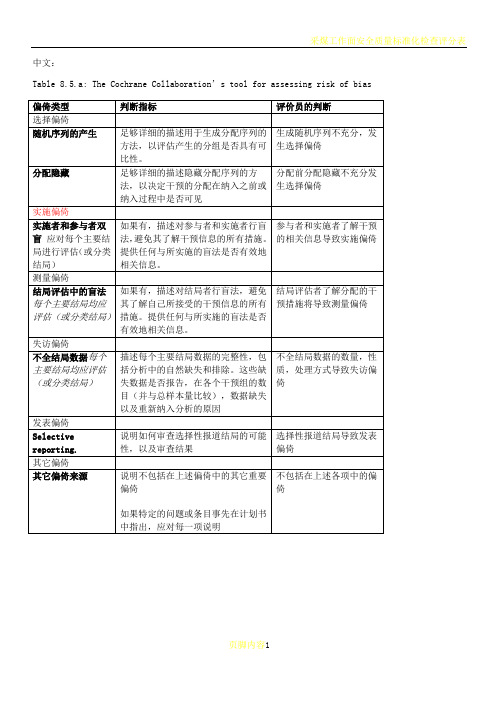
Table 8.5.a: The Cochrane Collaboration’s tool for assessing risk of bias
偏倚类型
判断指标
评价员的判断
选择偏倚
随机序列的产生
足够详细的描述用于生成分配序列的方法,以评估产生的分组是否具有可比性。
cochrane纳入的RCT文献质量评价(风险偏倚评估工具)中英文对照版

交替或循环
出生日期
病历号
其它明确的非隐藏过程
风险未知
没有足够信息判断为低风险或高风险。通常因分配隐藏的方法未描述或描述不充分。例如描述为使用信封分配,但为描述信封是否透明?密封?顺序编号?
对参与者和实施者的盲法
因参与者和实施者了解干预情况而导致实施偏倚
低风险判断标准
参与者以及纳入参与者的研究者因以下掩盖分配的方法或相当的方法,事先不了解分配情况
中心分配(包括电话,网络,药房控制随机)
相同外形的顺序编号的药物容器;
顺序编号、不透明、密封的信封
高风险判断标准
参与者以及纳入参与者的研究者可能事先知道分配,因而引入选择偏倚,譬如基于如下方法的分配:
使用摊开的随机分配表(如随机序列清单)
Selectionbias(biasedallocationtointerventions)duetoinadequateconcealmentofallocationspriortoassignment.
Performancebias.
BlindingofparticipantsandpersonnelAssessmentsshouldbemadeforeachmainoutcome(orclassofoutcomes).?
可能存在偏倚风险,但存在以下两种中的一种
没有足够信息评估是否存在其它重要的偏倚风险
没有足够的证据认为发现的问题会引入偏倚
summaryassessmentsoftheriskofbiasforeachimportantoutcome(acrossdomains)withinandacrossstudies
cochrane文献评价手册

Cochrane文献评价手册在医学和健康领域,Cochrane文献评价手册是一个备受推崇的参考资料。
它是一个致力于提供高质量、广度和深度兼具的文献评价和系统评价信息的权威评台。
通过对临床试验和其他医学研究进行全面评估和分析,Cochrane文献评价手册为医生、医学研究者和患者提供了宝贵的参考意见。
在Cochrane文献评价手册中,我们可以查找到各种主题的文献评价和系统评价,涵盖了从疾病预防到治疗、康复的各个方面。
无论是针对特定疾病、特定干预措施或特定人群的研究,Cochrane文献评价手册都提供了可靠的信息和意见,帮助人们做出更明智的医疗决策。
对于医学研究者来说,Cochrane文献评价手册提供了一个值得借鉴和学习的标准。
他们可以通过查阅Cochrane文献评价手册,了解到如何进行高质量的文献评价和系统评价,以及如何准确地汇总和分析研究结果。
这有助于提高他们的学术水平,促进医学研究的发展和进步。
对于医生和医疗工作者来说,Cochrane文献评价手册则是一个宝贵的临床参考工具。
他们可以在这里找到与自己临床实践相关的最新研究成果和最可靠的证据,以指导自己的临床决策。
这有助于提高临床实践的质量,保证患者获得更好的医疗服务。
对于患者和公众来说,Cochrane文献评价手册提供了一个可靠的信息来源。
他们可以在这里了解到关于自己健康问题的最新研究成果和治疗建议,从而更好地了解自身疾病,做出更明智的健康决策。
Cochrane文献评价手册是一个对医学研究、临床实践和健康决策都具有重要意义的权威评台。
它以其高质量、深度和广度兼具的文献评价和系统评价信息,为医学领域的各个参与者提供了宝贵的帮助和指导。
相信随着医学研究的不断进步和发展,Cochrane文献评价手册将为我们带来更多的惊喜和启发。
Cochrane文献评价手册作为权威评台,其对医学领域具有重要意义的确无庸置疑。
在现代医学研究中,由于信息的爆炸性增长和研究成果的不断涌现,医生和研究者需要一个可靠的参考工具来指导他们的决策和实践。
cochrane纳入的RCT文献质量评价(风险偏倚评估工具)中英文对照版
中文:Table 8.5.a: The Cochrane Collaboration’s tool for assessing risk of biasTable 8.5.d: Criteria for judging risk of bias in the ‘Risk of bias’ assessment tool研究者描述随机序列产生过程譬如:参考随机数字表使用计算机随机数字生成器扔硬币洗牌的卡片和信封掷骰子抽签最小化*最小化,可实现无随机元素,被认为相当于是随机的。
研究者描述序列的产生使用的是非随机的方法。
通常是系统的非随机方法,例如:通过奇偶或出生日期产生序列通过入院日期产生序列通过类似住院号或门诊号产生序列相对于上面提到的系统方法,其它非随机的方法少见的多,也更明显。
通常包括对参与者进行判断或非随机的方法,例如:临床医生判断如何分配参与者判断如何分配基于实验室检查或系列测试的结果分配基于干预的可获取性进行分配中心分配(包括电话,网络,药房控制随机)相同外形的顺序编号的药物容器;顺序编号、不透明、密封的信封参与者以及纳入参与者的研究者可能事先知道分配,因而引入选择偏倚,譬如基于如下方法的分配:使用摊开的随机分配表(如随机序列清单)分发信封但没有合适的安全保障(如透明、非密封、非顺序编号)交替或循环出生日期病历号其它明确的非隐藏过程任何如下标准:无盲法或盲法不充分,但系统评价员判断结局不太可能受到缺乏盲法的影响参与者和主要实施者均实施可靠的盲法,且盲法不太可能被打破任何如下标准:无盲法或盲法不充分,但系统评价员判断结局很可能受到缺乏盲法的影响尝试对关键的参与者和实施者行盲法,但盲法很可能被打破,结局很可能受到缺乏盲法的影响任何如下标准:没有足够信息判断为低风险或高风险研究未描述此情况任何如下标准:无盲法或盲法不充分,但系统评价员判断结局不太可能受到缺乏盲法的影响参与者和主要实施者均实施可靠的盲法,且盲法不太可能被打破任何如下标准:无盲法或盲法不充分,但系统评价员判断结局很可能受到缺乏盲法的影响尝试对关键的参与者和实施者行盲法,但盲法很可能被打破,结局很可能受到缺乏盲法的影响任何如下标准:没有足够信息判断为低风险或高风险研究未描述此情况任何如下标准:无缺失数据缺失数据的产生不大可能与真实结局相关(对于生存数据,删失不大可能引入偏倚)缺失数据的数目在各干预组相当,且各组缺失原因类似对二分类变量,与观察事件的发生风险相比,缺失比例不足以影响预估的干预效应对连续性结局数据,缺失数据的合理效应规模(均数差或标准均数差)不会大到影响观察的效应规模;缺失的数据用合适的方法进行估算任何如下标准:缺失数据的产生很大可能与真实结局相关, 缺失数据的数目及缺失原因在各干预组相差较大对二分类变量,与观察事件的发生风险相比,缺失比例足以影响预估的干预效应对连续性结局数据,缺失数据的合理效应规模(均数差或标准均数差)足以影响观察的效应规模;意向治疗分析中存在实际干预措施与随机分配的干预相违背的情况对缺失数据进行简单的不合适的估算任何如下标准:没有报道缺失或排除的情况,无法判断高风险或低风险(如未说明随机的数量,未提供数据缺失的原因)研究未描述此情况任何如下标准:实验的计划书可获取,系统评价感兴趣的所有首要或次要结局均按计划书预先说明的方式报道实验计划书不可得,但很明显发表的报告包括所有的结局,包括预先说明的结局(这种性质的有说服力的文字可能少见)任何如下标准:不是所有的预先说明的首要结局均被报道一个或多个首要结局为采用预先说明的测量方法、分析方法或数据子集来报道系统评价感兴趣的一个或多个首要结局报道不全,以至于不能纳入meta分析研究未报道此研究应当包含的主要关键结局具有与特殊试验设计相关的潜在偏倚来源或被指欺诈或其它问题可能存在偏倚风险,但存在以下两种中的一种没有足够信息评估是否存在其它重要的偏倚风险没有足够的证据认为发现的问题会引入偏倚Table 8.7.a: Possible approach for summary assessments of the risk of bias for each important outcome (across domains) within and across studies英文:Table 8.5.a: The Cochrane Collaboration’s tool for assessing risk of biasTable 8.5.d: Criteria for judging risk of bias in the ‘Risk of bias’ assessment toolprocess such as:Referring to a random number table;Using a computer random number generator;Coin tossing;Shuffling cards or envelopes;Throwing dice;Drawing of lots;Minimization*.*Minimization may be implemented without a random element, and this isconsidered to be equivalent to being random.judgement The investigators describe a non-random component in the sequence generation process. Usually, the description would involve somesystematic, non-random approach, for example:Sequence generated by odd or even date of birth;Sequence generated by some rule based on date (or day) of admission;Sequence generated by some rule based on hospital or clinic recordnumber.Other non-random approaches happen much less frequently than thesystematic approaches mentioned above and tend to be obvious. Theyusually involve judgement or some method of non-random categorization ofparticipants, for example:Allocation by judgement of the clinician;Allocation by preference of the participant;Allocation based on the results of a laboratory test or a seriesof tests;Allocation by availability of the intervention.Criteria for a judgement Participants and investigators enrolling participants could not foreseeassignment because one of the following, or an equivalent method, was usedto conceal allocation:Central allocation (including telephone, web-based andpharmacy-controlled randomization);Sequentially numbered drug containers of identical appearance;Sequentially numbered, opaque, sealed envelopes.judgement Participants or investigators enrolling participants could possiblyforesee assignments and thus introduce selection bias, such as allocationbased on:Using an open random allocation schedule (e.g. a list of randomnumbers);Assignment envelopes were used without appropriate safeguards(e.g. if envelopes were unsealed or nonopaque or not sequentiallynumbered);Alternation or rotation;Date of birth;Case record number;Any other explicitly unconcealed procedure.Criteria for a judgement Any one of the following:No blinding or incomplete blinding, but the review authors judgethat the outcome is not likely to be influenced by lack of blinding;Blinding of participants and key study personnel ensured, andunlikely that the blinding could have been broken.judgementAny one of the following:No blinding or incomplete blinding, and the outcome is likely tobe influenced by lack of blinding;Blinding of key study participants and personnel attempted, butlikely that the blinding could have been broken, and the outcomeis likely to be influenced by lack of blinding.judgement ‘Unclear risk’ ofAny one of the following:Insufficient information to permit judgement of ‘Low risk’ or ‘High risk’;The study did not address this outcome.Criteria for a judgement Any one of the following:No blinding of outcome assessment, but the review authors judge thatthe outcome measurement is not likely to be influenced by lack ofblinding;Blinding of outcome assessment ensured, and unlikely that theblinding could have been broken.judgementAny one of the following:No blinding of outcome assessment, and the outcome measurement islikely to be influenced by lack of blinding;Blinding of outcome assessment, but likely that the blinding couldhave been broken, and the outcome measurement is likely to beinfluenced by lack of blinding.judgement ‘Unclear risk’ ofAny one of the following:Insufficient information to permit judgement of ‘Low risk’ or‘High risk’;The study did not address this outcome.Criteria for a judgement Any one of the following:No missing outcome data;Reasons for missing outcome data unlikely to be related to trueoutcome (for survival data, censoring unlikely to be introducingbias);Missing outcome data balanced in numbers across interventiongroups, with similar reasons for missing data across groups;For dichotomous outcome data, the proportion of missing outcomescompared with observed event risk not enough to have a clinicallyrelevant impact on the intervention effect estimate;For continuous outcome data, plausible effect size (difference inmeans or standardized difference in means) among missing outcomesnot enough to have a clinically relevant impact on observed effectsize;Missing data have been imputed using appropriate methods.judgement Any one of the following:Reason for missing outcome data likely to be related to trueoutcome, with either imbalance in numbers or reasons for missingdata across intervention groups;For dichotomous outcome data, the proportion of missing outcomescompared with observed event risk enough to induce clinicallyrelevant bias in intervention effect estimate;For continuous outcome data, plausible effect size (difference inmeans or standardized difference in means) among missing outcomesenough to induce clinically relevant bias in observed effect size;‘As-treated’ analysis done with substantial departure of theintervention received from that assigned at randomization;Potentially inappropriate application of simple imputation.judgement ‘Unclear risk’ ofAny one of the following:Insufficient reporting of attrition/exclusions to permit judgement of ‘Low risk’ or ‘High risk’ (e.g. number ran domized not stated,no reasons for missing data provided);The study did not address this outcome.Criteria for a judgement Any of the following:The study p rotocol is available and all of the study’spre-specified (primary and secondary) outcomes that are of interestin the review have been reported in the pre-specified way;The study protocol is not available but it is clear that thepublished reports include all expected outcomes, including thosethat were pre-specified (convincing text of this nature may beuncommon).judgementAny one of the following:Not all of the study’s pre -specified primary outcomes have beenreported;One or more primary outcomes is reported using measurements,analysis methods or subsets of the data (e.g. subscales) that werenot pre-specified;One or more reported primary outcomes were not pre-specified(unless clear justification for their reporting is provided, suchas an unexpected adverse effect);One or more outcomes of interest in the review are reportedincompletely so that they cannot be entered in a meta-analysis;The study report fails to include results for a key outcome thatwould be expected to have been reported for such a study.judgementThere is at least one important risk of bias. For example, the study: Had a potential source of bias related to the specific study designused; orHas been claimed to have been fraudulent; orHad some other problem.judgement ‘Unclear risk’ ofThere may be a risk of bias, but there is either:Insufficient information to assess whether an important risk of bias exists; orInsufficient rationale or evidence that an identified problem willintroduce bias.Table 8.7.a: Possible approach for summary assessments of the risk of bias for each important outcome (across domains) within and across studies。
Cocharane偏倚风险评估表

很可能受缺乏盲法的影响
风险不清楚
信息不充分不足以判断“低风险”或“高风险”
研究未提及这一结果
对结果评价
者施盲
低风险
无盲法,但系统评价者判断结果测量不太可能因缺乏盲法而受影响
确保对结果评价者施盲,并且不太可能破盲
高风险
无盲法,但系统评价者判断该结果测量很可能受缺乏盲法的影响
对于二分类结果数据,与观察的事件风险相比,缺失结果数据的比例足以对干预效应估计产生临床相关影响
对于连续性结果数据,缺失结果数据中似真的效应大小(均数差或标准均数差)足以对观测效应大小产生临床相关影响
采用“视为治疗(as-treated)”分析,但改变随机入组时干预措施的人数较多
可能不恰当地使用简单估算方法
风险不清楚
关于随机序列产生过程的信息不充分不足以判断“低风险”或“高风险”
分配隐藏
低风险
中心化分配(包括电话、基于网络和药房控制的随机化)
同一外观、连续编号的药物容器
按顺序编号、不透光、密封的信封
高风险
使用开放的随机分配表(如随机数字清单)
使用无适当保护措施的分配信封(如信封未密封、透光信封、
信封未按顺序编号)
风险不清楚
报告减员/排除的信息不充分不足以判断“低风险”或“高风险(如随机人数未说明,未提供缺失数据的原因)
研究未提及这一结果
选择性结果
报告
低风险
有研究方案,且系统评价关心的方案中预先指定的(主要和次要)结果指标均有报告
没有研究方案,但所有期望的结局指标,包括在发表文章中预先指定的指标均有报告
高风险
对于二分类结果数据,与观察的事件风险相比,缺失结果数据的比例不足以对干预效应估计产生临床相关影响
cochrane评分表

Risk of biasItem Authors'judgementDescriptionAdequate sequence generation? Yes Prinicipal author stated thatcomputer generatedallocation was usedAllocation concealment? Yes Prinicipal author stated thatallocation was concealedBlinding? Unclear No mention of study personnelor participants being blindto treatment groupIncomplete outcome data addressed? Yes All participants accountedfor, one 'drop out' recordedbut included by us in analysisFree of other bias? Unclear Possible uneven distributionof complete and incompleteparalysis at start of studybetween the two treatmentgroupsCochrane RCT质量评价标准:①随机方法是否正确。
②是否隐蔽分组。
③盲法的使用情况。
④失访或退出描述情况,有无采用意向性(ITT)分析。
以上质量标准中,如所有标准均为“充分”,则发生各种偏倚的可能性很小;如其中一条为不清楚,则有发生相应偏倚的中等度可能性;如其中一条为“不充分”或“未采用”,则有发生相应偏倚的高度可能性。
可参见:RCT的质量评价标准选择总结/bbs/topic/18137535?tpg=1&age=-1Quality assessmentThe quality of the trials was assessed and graded independently by two authors according to the criteria described in The Cochrane Handbook 4.2.6 (Higgins 2006). Gradings were compared and any inconsistencies between the authors in the interpretation of inclusion criteria and their significance to the selected study were discussed and resolved.The selected study was assessed for the following characteristics:1. The adequacy of the randomisation process (possible selection bias). Adequate randomisation includes any one of the following methods: computer generated or table of random numbers, drawing of lots, coin-toss, shuffling cards or throw of a dice. Inadequate methods of randomisation include the following: case record number, date of birth or alternate numbers.2. The adequacy of the allocation concealment (possible selection bias). Adequate methods of allocation concealment include either central randomisation (i.e. separate to other aspects of trial administration) or sequentially numbered sealed opaque envelopes. Inadequate concealment means an open allocation sequence in which either participants or trialists were able to foresee the upcoming assignment.3. The blinding of outcome assessors (i.e. whether the persons assessing the outcome of care were aware of which treatment the participant had received - possible performance bias).4. The extent and handling of losses to follow up (possible attrition bias). Adequate handling of losses to follow up involves a clear description and explanation being given of any significant difference between the losses of the intervention groups. An unacceptable loss in any one intervention group was considered to be loss greater than 20%.Study gradings A, B or C were employed for overall quality as follows.A: Minimisation of bias in all four categories above: i.e. adequate randomisation, few losses to follow up and intention-to-treat analysis, blinding of outcome assessors, high quality outcome assessment;B: Each of the criteria in A partially met;C: One or more of the criteria in A not met.Risk of bias in included studiesWe classified this study as grade C because of the uncertainty about blinding. The possibility of an uneven distribution of complete and incomplete palsies between the two groups is another potential source of bias and we conclude overall that this is a low quality study.Table 8.5.a: The Cochrane Collaboration’s tool for assessi ng risk of biasTable 8.5.c: Criteria for judging risk of bias in the ‘Risk of bias’ assessment toolFigure 8.6.a: Example of a ‘Risk of bias’ table for a single study (fictional)Table 8.7.a: Possible approach for summary assessments of the risk of bias for each important outcome (across domains) within and across studies。
Cochrane系统评价 ppt课件

30
❖ ④在“Date next stage expected”信息框中输入预期完成的日 期,从当前日期算起,不得大于12个月;
❖ ⑤选择“Sane系统评价
❖ 若此时出现“Mark chang”对话框时,可用鼠标点击 “Don’t ask me again in this RevMan session”前的方框进行 标志,如图,然后按“OK”返回“Title ( New review)”对话 框;
12
Australasian
Chinese
Cochrane系统评价
♠ The Cochrane Collaboration 标识在说 明一个实际由七个随机对照试验所产生的 系统评价。
♠ 图表提供早产孕妇随机对照试验的系统 评价结果。第一个试验于1972年发表,试 验结果透露corticosteroid的治疗能够降低 婴儿因为早产所出现的并发症。1991年, 更多试验结果也陆续发表,同时也更加强 这项治疗方式的说服力-可减少 30%到 50%的死亡机率。
Cochrane系统评价
31
Cochrane系统评价
●Cover sheet
该系统评价的封面(cover),主要包括了该系统评价题 目和作者以及支助来源的一些基本的情况。
●Text of review
可以录入系统评价的草案、摘要以及全文。文章的框架、 格式主要参照这一部分。
Cochrane系统评价

❖ ⑤选择“Save”(保存)按钮;
第二十八页,共64页。
相关步骤
❖ 若此时出现“Mark chang”对话框时,可用鼠标点击“Don’t ask me again in this RevMan session”前的方框进行标志,如图,然后按 “OK”返回“Title ( New review)”对话框;
第三十四页,共64页。
Included study
第三十五页,共64页。
●Figures
显示各文献数据经综合定量合并分析后得出的Meta分析森 林图和评价文献发表偏倚的倒漏斗图(funnelplot)等。
●Comments and Criticisms
供作者回馈Cochrane系统评价资料库中读者的评论和建设 性的评判。
第三十二页,共64页。
评价者(Reviewers)
循证医学
❖ 1979 -> Archie Cochrane 教授倡导应依据特定地疾病及治疗 方法,搜集并分析所有相关的随机对照试验,同时随着新数 据的出现不断更新,以便获得更为可靠的结论。
❖ 1980 -> 加拿大著名临床流行病学家 David Sackett 教授将临 床流行病学的方法和原理实际应用于临床指导,以提高临床 疗效,为循证医学的方法学奠定重要基础。
该部分提供了被纳入Meta分析的研究和其他参考文献相关信息的 储存位置。
第三十一页,共64页。
系统评价的6个部分
●Tables
各入选研究的数据经处理提取后输入这里的表格以待 RevMan软件计算。“Tables”是RevMan的核心部分, “References”和“Figures”中的大部分功能都可以在“Tables” 中实现,请着重留意。其实只要不以电子刊物的形式发表到 Cochrane图书馆,只要搞清楚“Tables”这部分就基本上可以 把文章炮制出来了。
(完整版)Cochrane协作网偏倚风险评价工具

表1 Cochrane协作网偏倚风险评价工具评价条目评价内容描述具体评价问题1.随机分配方法详细描述产生随机分配序列的方法,有助于评估组间可比性随机化分配序列的产生是否正确?2.分配方案隐藏详细描述隐藏随机分配序列的方法,从而帮助判断干预措施分配情况是否可预知分配方案是否有效地隐藏?3.盲法描述对受试者或试验人员实施盲法的方法,以防止他们知道受试者的干预措施,提供判断盲法是否成功的相关信息盲法是否完善?4.结果数据的完整性报告每个主要结局指标的数据完整性,包括失访和退出的数据。
明确是否报告以上信息及其原因,是否采用意向性分析(ITT)结果数据是否完整?5.选择性报告研究结果描述选择性报告结果的可能性及情况研究报告是否提示无选择性报告结果?6.其它偏倚来源除以上5个方面,是否存在其他引起偏倚的因素?若事先在计划中提到某个问题或因素,应在全文中作答研究是否存在引起高度偏倚风险的其他因素?表2 Cochrane协作网偏倚风险评价的具体标准评价条目评价结果评价内容描述1.随机分配方法正确♦采用随机数字表、计算机产生随机数字、抛硬币、掷骰子或抽签等方法不正确♦按患者生日、住院日或住院号等的末位数字的奇数或偶数;♦交替分配方法;♦根据医师、患者、实验室检查结果或干预措施的可获得性分配患者入组不清楚♦根据干预措施的可获得性;♦信息不详、难以判断正确与否2.方案隐藏完善♦中心随机,包括采用电话、网络和药房控制的随机♦按顺序编号或编码的相同容器♦按顺序编码、密封、不透光的信封不完善♦公开随机分配序列如列出随机数字♦未密封、透光或未按顺序编号的信封♦交替分配♦根据住院号、生日等末位数字的奇数或偶数不清楚♦未提及分配方案隐藏♦提供的信息不能判断是否完善,如使用信封,但未描述是否按顺序编码、密封、不透光3.盲法正确♦没有采用盲法,但结果判断和测量不会受影响♦对患者和主要研究人员采用盲法,且盲法不会被破坏♦对结果测量者采用盲法,未对患者和主要研究人员采用盲法,但不会导致偏倚不正确♦未采用盲法或盲法不完善,结果判断或测量会受影响♦对患者和主要研究人员采用盲法,但盲法可能被破坏♦对患者和主要研究人员均未采用盲法,可能导致偏倚不清楚♦信息不全,难以判断是否正确♦文中未提及盲法4.结果数据的完整性完整♦无缺失数据;缺失数据不影响结果分析(生存分析中缺失值)♦组间缺失的人数和原因相似♦缺失数据不足以对效应值产生重要影响;缺失数据采用恰当方法赋值不完整♦组间缺失的人数和原因不平衡♦缺失数据足以对效应值产生重要影响♦采用“as-treated”分析,但改变随机入组时干预措施的人数较多♦不恰当应用简单赋值不清楚♦信息不全,难以判断数据是否完整(缺失人数或原因未报告)♦文中未提及数据完整性问题5.选择性报告研究结果无选择性报告♦有研究方案,且系统综述关心的方案中预告指定的结果指标(主要和次要结果)均有报告♦没有研究方案,但所有期望的结局指标,包括在发表文献中预先指定的指标均有报告有选择性报告♦未报告所有预先指定的主要结局指标♦报告的一个或多个主要结局指标采用预先未指定的测量和分析方法♦报告的一个或多个主要结局指标未预先指定♦系统综述关心的一个或多个结局指标报告不完善,以致不能纳入行Meta分析♦未报告重要的结局指标不清楚♦信息不全、难以判断6.其他偏倚来源无♦纳入研究无其他偏倚来源有至少存在一种重要偏倚风险:♦与使用的研究设计方案相关的偏倚♦研究提前终止(数据原因或正规终止原因)♦基线明显不平衡♦声称有欺骗行为♦其他问题不清楚♦信息不全,难以判断是否存在重要偏倚♦发现的问题是否导致偏倚,理由或依据不足。
cochrane文献质量评价分级

cochrane文献质量评价分级医学文献的定义及类别“文献”一词出现在中国已有2000多年的历史,从春秋战国时期就有关于文献的记载,最早见于《论语八佾》。
随着人类文明的发展,“文献”的概念也发生了巨大的变化,人们对文献的研究一直持续至今。
文献的具体定义尚缺乏统一的定论,《现代汉语词典》对文献的定义是“有历史价值或参考价值的资料”[1];《中华人民共和国国家标准—文献著录总则》将文献定义为“记载有知识的一切载体”[2]。
有学者将文献定义为“文献就是将知识、信息用文字、符号、图像、音频等记录在一定物质载体上的结合体”[3]。
有历史价值和研究价值的知识、一定的载体、一定的方法和手段、一定的意义表达和记录体系这4个方面构成文献的基本要素。
医学文献(medicalliterature)就是与医学有关的有参考价值的资料。
按照文献的研究类型分为:系统评价、随机对照临床试验、队列研究、病例对照研究、病例系列研究、病例报告和专家经验总结等。
决定文献质量的关键部分:研究有首创性或提供了新证据、研究对象的选择合理、科研设计合理、偏倚得到有效控制、研究样本量足够大和研究的时间足够长。
然而医学文献是如何发挥作用的,前提就是该文献必须有一定的价值,而且有可靠的等级评价体系。
医学文献的价值就是根据其文献内在及外在真实性及临床意义的重要性去评判,是根据医学研究的方向不同确定评价的原则和方法[4],其中内在真实性是文献评价的重点。
2西医文献评价体系2.1证据分级20世纪60年代,首次提出证据分级概念,将随机对照研究的质量定为最高,并引入内部真实性和外部真实性的概念。
证据分级为西医识别文献可靠性的准则。
最初3级标准:1级:设计良好的随机对照试验(RCT);2级:1级和3级中间的类型;3级:专家经验。
老5级标准:1级:收集所有质量可靠的RCT后做出的系统评价或Meta分析结果,大样本多中心随机对照试验;2级:单个大样本的RCT结果;3级:设有对照但未用随机方法分组的研究病例对照研究和队列研究;4级:无对照的系列病例观察;5级:专家意见、描述性研究和病例报告。
cochrane文献评价手册

cochrane文献评价手册【原创实用版】目录1.Cochrane 文献评价手册的概述2.手册的目的和适用范围3.手册的主要内容4.手册的评价标准和方法5.手册的优点和不足6.对我国相关领域的影响和启示正文1.Cochrane 文献评价手册的概述Cochrane 文献评价手册是由 Cochrane 协作组织编写的一本关于如何评价和分析医学文献的指南。
Cochrane 协作组织是一个国际性的、非营利的医学研究组织,致力于通过系统评价和荟萃分析的方法,为临床决策提供高质量的证据。
2.手册的目的和适用范围本手册的主要目的是为系统评价和荟萃分析提供一种标准和方法,以便为临床决策提供可靠的证据。
它适用于所有从事医学研究、临床实践和卫生政策制定的人员。
3.手册的主要内容手册主要包括以下几个方面:(1)文献筛选:包括文献的检索、筛选和纳入;(2)文献的质量评估:包括随机对照试验、队列研究、病例对照研究等不同类型文献的质量评估;(3)数据提取和分析:包括数据的提取、整理和分析;(4)结果的报告和解释:包括结果的报告方式、如何解释结果等。
4.手册的评价标准和方法手册提供了一套详细的评价标准和方法,包括风险偏倚、质量评估、数据提取和分析等。
这些标准和方法被广泛接受和应用,是进行系统评价和荟萃分析的基础。
5.手册的优点和不足手册的优点在于提供了一套系统、全面、实用的评价方法和标准,对于提高研究的可靠性和质量具有重要的指导作用。
然而,手册也存在一些不足,例如部分内容较为复杂,对研究者的统计学和医学知识要求较高。
6.对我国相关领域的影响和启示Cochrane 文献评价手册对我国的医学研究、临床实践和卫生政策制定产生了深远的影响。
它提供了一种科学的、可靠的评价方法,有助于提高我国医学研究的质量和水平。
(优质医学)Cochrane系统评价

由于资源终将有限,因此应该使用已被 证明有明显效果的医疗保健措施
来自于随机对照试验(Randomised Controlled Trials,RCT)的证据,比其它 任何证据更为可靠。
CBE 司令勋章(不列颠帝国 勋章第三级) FRCP 皇家内科医师学会会员 FFCM 皇家内科医学院公共生 医学科院士
11
Cochrane Centres
San Francisco
San Antonio
New England
Canadian
UK Dutch French Spanish
Nordic German
Italian
Brazilian
South African
12
Australasian
Chinese
The Cochrane Collaboration Logo
是否做Meta分析需要视纳入研究是否有足够的相 似性。
Meta分析也并非一定要做系统评价,因为其本质 是一种统计学方法。
包含有对具同质性的多个研究进行Meta分析的系 统评价称为定量系统评价。
如果纳入研究不具有同质性,则不进行Meta分析, 而仅进行描述性的系统评价,此类系统评价称为 定性系统评价。
♠ 由于直到 1989年才有相关的系统评论 数据及随机对照试用被出版报导,大部份 的产科医师无从得知这项治疗方法的效用, 也因此许多早产儿无辜地受难及及死亡 (并浪费许多无效的医疗资源)。
13
二、系统评价的制作过程
制订课题计划书(protocol) 科学背景 研究目的 纳入标准和排除标准
15
系统评价的制作过程
统计分析
异质性分析(同质性分析)
Cochrane风险偏倚评估工具

Cochrane 偏倚风险评估工具水天之间2013年11月11日目录随机对照试验/临床对照试验 偏倚的来源偏倚风险评估工具的解读偏倚风险评价结果的总结 偏倚风险评估工具的软件实现 偏倚风险评估工具的实例Cochrane 手册将RCT (randomized controlled tril )和CCT (controlled clinical trial )进行了区分,判定标准为:1.在1个或多个患者中进行的一种研究;2.比较两种干预措施,试验措施可以为一种药物、外科手术、物理疗法、预防措施,对照措施为另一种药物、安慰剂或不做任何处理的空白对照;3.RCT 为采用随机分配方法如随机数字表法、计算机随机排序、抛硬币法等将受试者分入不同处理组,CCT 则为采用办随机分配法(按入院顺序、住院号、研究对象的生日的奇偶数交替分配)分配到对照或治疗组者;4.提示性术语有:随机(random )、交替(crossover/cross-over )或安慰剂(placebo )等。
符合这4条的文献将在美国国家医学图书馆(the US national library of medicine, NLM )指定其出版类型是RCT 或CCT ,并在取得NLM 的许可后纳入Cochrane 临床对照试验中心注册库(the Cochrane Central Register of Controlled Trials ,CENTRAL)选择性偏倚(selection bias ):发生在选择和分配研究对象时,因随机方法不完善造成的组间基线不可比,可夸大或缩小干预措施的疗效。
采用真正的随机方法并对随机进行分配隐藏可避免这类偏倚的影响。
实施偏倚(performance bias ):发生在干预措施的实施过程中,指除比较的措施外,向试验组和对照组对象提供的其他措施不一样。
标准化治疗方案和对研究对象及实施研究措施者采用盲法可避免实施偏倚。
cochrane rct质量评价标准

Cochrane RCT质量评价标准
在Cochrane图书馆中,对随机对照试验(RCT)的质量评价是至关重要的。
以下是一些关键的质量评价标准,主要包含以下几个方面:
1. 随机方法是否正确:
随机方法的描述是否清晰明确,易于理解?
随机序列的产生是否使用了合适的方法,如随机数字表、计算机生成的随机数等?
是否做到了分配隐藏,以避免分配意向的干扰?
2. 是否隐蔽分组:
分组是否做到了隐蔽,以避免选择性偏倚?
实施盲法的过程中是否考虑了所有涉及的人员,包括研究对象、试验人员、数据分析人员等?
3. 盲法的使用情况:
在试验过程中是否使用了盲法?
盲法的实施是否充分考虑了可能的破盲情况?
盲法的使用是否贯穿了整个试验过程?
4. 失访或退出描述情况:
在试验报告中是否详细描述了失访或退出的情况?
对于失访或退出的人员,是否进行了适当的处理,如ITT分析等?
5. 有无采用意向性(ITT)分析:
是否采用了意向性治疗分析(ITT)?
ITT分析的执行是否正确,如对所有随机分配的患者进行分析,无论他们是否接受了治疗等?
在评价RCT的质量时,需要综合考虑以上标准。
此外,还应关注其他因素,如研究对象的
招募、研究团队的资质和经验、研究的经费来源等。
这些因素都可能对试验的质量产生影响。
cochrane文献评价手册

cochrane文献评价手册(最新版)目录1.Cochrane 文献评价手册概述2.手册的目的和适用范围3.手册的主要内容4.手册的评价标准和方法5.手册的实际应用和影响正文1.Cochrane 文献评价手册概述Cochrane 文献评价手册是由 Cochrane 协作组织编写的一本评价手册,旨在为系统评价和荟萃分析提供一套标准和方法。
该手册是全球公认的文献评价“金标准”,广泛应用于临床医学、公共卫生、健康政策等领域。
2.手册的目的和适用范围Cochrane 文献评价手册的主要目的是提高系统评价和荟萃分析的质量,确保研究结果的可靠性和准确性。
该手册适用于所有进行系统评价和荟萃分析的研究人员,无论他们处于哪个领域或研究阶段。
3.手册的主要内容Cochrane 文献评价手册主要包括以下几个方面:(1)评价过程:从确定研究问题、筛选文献、提取数据、分析结果到撰写报告,手册为研究人员提供了详细的指导。
(2)评价标准:手册规定了进行系统评价和荟萃分析时需要满足的标准,包括纳入研究、排除研究、数据提取、结果分析等方面。
(3)评价方法:手册介绍了多种荟萃分析方法,如固定效应模型、随机效应模型、网络荟萃分析等,并指导研究人员如何选择合适的方法。
(4)评价工具:手册提供了一系列工具,如 Cochrane 风险偏倚工具、Cochrane 偏倚风险评估表等,以帮助研究人员评估研究偏倚和风险。
4.手册的评价标准和方法Cochrane 文献评价手册采用严格的评价标准和方法,以确保荟萃分析的可靠性和准确性。
具体包括:(1)明确研究问题:研究人员需明确研究的问题、目的、人群、干预和结局等要素。
(2)全面搜索文献:研究人员需通过多种途径搜索相关文献,并采用标准化的筛选流程。
(3)严格数据提取:研究人员需按照手册规定的标准和表格提取文献数据,避免主观判断。
(4)采用恰当的统计方法:手册推荐使用荟萃分析方法,根据研究特点选择合适的模型。
cochrane纳入的RCT文献质量评价(风险偏倚评估工具)中英文对照版..

cochrane纳⼊的RCT⽂献质量评价(风险偏倚评估⼯具)中英⽂对照版..中⽂:Table 8.5.a: The Cochrane s tool for assessing riskTable 8.5.d: Criteria for judging risk ofbias in the assessment tool Risk of bias分配隐藏分配前不充⾜的分配隐藏导致选择偏倚Table 8.7.a: Possible approach for summarya ssessments of the risk of bias for each important outcome (across domains) within and across studies英⽂:Table 8.5.a: The Cochrane Collaboration ' s tool for assessing risk of biasTable 8.5.d: Criteria for judging risk of bias in the ‘Risk of bias ' assessment toolriskorsOTHER BIASTable 8.7.a: Possible approach for summary assessments of the risk of bias foreach important outcome (across domains) within and across studiesthose that were pre-specified (convincing text of this naturemay be uncommon).Criteria for theudgement o f ‘Highrisk of bias. Any one of the following: ' Not all of the study'-spse pcrifeied primary outcomes havebeen reported; One or more primary outcomes is reported using measurements,analysis methods or subsets of the data (e.g. subscales) thatwere not pre-specified;One or more reported primary outcomes were not pre-specified(unless clear justification for their reporting is provided,such as an unexpected adverse effect);One or more outcomes of interest in the review are reportedincompletely so that they cannot be entered in a meta-analysis;The study report fails to include results for a key outcomethat would be expected to have been reported for such a study.Criteria for the udgement of ‘ Unclear isk ' of bias.Insufficient information to permit judgement of ‘Low risk ' or ‘Hi It is likely that the majority of studies will fall into this category. gh risk。
cochrane文献评价手册

cochrane文献评价手册
(原创实用版)
目录
1.Cochrane 文献评价手册的概述
2.手册的目的和适用范围
3.手册的主要内容
4.手册的评价标准和方法
5.手册的实际应用和影响
正文
Cochrane 文献评价手册是由 Cochrane 协作组织编写的一本关于如何评价和分析医学研究文献的手册。
Cochrane 协作组织是一个国际性的非营利组织,致力于通过系统评价和荟萃分析的方法,为医疗决策提供高质量的证据。
手册的目的是为了帮助 Cochrane 协作组织的成员和其它医学研究者,更好地评价和分析医学研究文献,以提供更准确、更全面、更可信的医学证据。
适用范围主要是针对 Cochrane 系统评价和荟萃分析的研究项目,也适用于其它类型的医学研究。
手册的主要内容包括:如何选择研究文献,如何提取和分析研究数据,如何评价研究的质量,如何解决研究中的偏倚和误差,以及如何撰写系统评价和荟萃分析报告等。
手册的评价标准和方法主要是根据 Cochrane 协作组织的标准和方法,结合循证医学和统计学的原理,对研究文献的质量、数据的可靠性、研究的有效性等进行评价和分析。
手册的实际应用和影响非常广泛。
它不仅被 Cochrane 协作组织的成员广泛使用,也被其它医学研究者和医疗机构所接受和应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Risk of bias
Item Authors'
judgement
Description
Adequate sequence generation? Yes Prinicipal author stated that
computer generated
allocation was used
Allocation concealment? Yes Prinicipal author stated that
allocation was concealed
Blinding? Unclear No mention of study personnel
or participants being blind
to treatment group
Incomplete outcome data addressed? Yes All participants accounted
for, one 'drop out' recorded
but included by us in analysis
Free of other bias? Unclear Possible uneven distribution
of complete and incomplete
paralysis at start of study
between the two treatment
groups
Cochrane RCT质量评价标准:
①随机方法是否正确。
②是否隐蔽分组。
③盲法的使用情况。
④失访或退出描述情况,有无采用意向性(ITT)分析。
以上质量标准中,如所有标准均为“充分”,则发生各种偏倚的可能性很小;如其中一条为不清楚,则有发生相应偏倚的中等度可能性;如其中一条为“不充分”或“未采用”,则有发生相应偏倚的高度可能性。
可参见:
RCT的质量评价标准选择总结
/bbs/topic/18137535?tpg=1&age=-1
Quality assessment
The quality of the trials was assessed and graded independently by two authors according to the criteria described in The Cochrane Handbook 4.2.6 (Higgins 2006). Gradings were compared and any inconsistencies between the authors in the interpretation of inclusion criteria and their significance to the selected study were discussed and resolved.
The selected study was assessed for the following characteristics:
1. The adequacy of the randomisation process (possible selection bias). Adequate randomisation includes any one of the following methods: computer generated or table of random numbers, drawing of lots, coin-toss, shuffling cards or throw of a dice. Inadequate methods of randomisation include the following: case record number, date of birth or alternate numbers.
2. The adequacy of the allocation concealment (possible selection bias). Adequate methods of allocation concealment include either central randomisation (i.e. separate to other aspects of trial administration) or sequentially numbered sealed opaque envelopes. Inadequate concealment means an open allocation sequence in which either participants or trialists were able to foresee the upcoming assignment.
3. The blinding of outcome assessors (i.e. whether the persons assessing the outcome of care were aware of which treatment the participant had received - possible performance bias).
4. The extent and handling of losses to follow up (possible attrition bias). Adequate handling of losses to follow up involves a clear description and explanation being given of any significant difference between the losses of the intervention groups. An unacceptable loss in any one intervention group was considered to be loss greater than 20%.
Study gradings A, B or C were employed for overall quality as follows.
A: Minimisation of bias in all four categories above: i.e. adequate randomisation, few losses to follow up and intention-to-treat analysis, blinding of outcome assessors, high quality outcome assessment;
B: Each of the criteria in A partially met;
C: One or more of the criteria in A not met.
Risk of bias in included studies
We classified this study as grade C because of the uncertainty about blinding. The possibility of an uneven distribution of complete and incomplete palsies between the two groups is another potential source of bias and we conclude overall that this is a low quality study.
Table 8.5.a: The Cochrane Collaboration’s tool for assessi ng risk of bias
Table 8.5.c: Criteria for judging risk of bias in the ‘Risk of bias’ assessment tool
Figure 8.6.a: Example of a ‘Risk of bias’ table for a single study (fictional)
Table 8.7.a: Possible approach for summary assessments of the risk of bias for each important outcome (across domains) within and across studies。
