2022届高考化学鲁科版一轮复习学案:第二单元 第4节 铁及其重要化合物
高考化学一轮复习 2.4 铁及其重要化合物讲解课件 鲁科版

KMnO4(H+)、HNO3、浓硫酸、H2O2 等。例如:2Fe2++Cl2 2Fe3++2Cl-。
5.Fe3+
Fe2+的转化:铁盐溶液与比较强的还原剂反应,如 Fe、Cu、碘化
物、硫化物等。例如:2Fe3++Cu 2Fe2++Cu2+;2Fe3++2I- 2Fe2++I2。
考点1
考点2
考点3
触摸(chù mō)高考
考纲要求
1.了解铁的主要性质及应 用。 2.了解铁的重要化合物的 主要性质及应用。
高考热点
1.Fe2+、Fe3+的检验、转化及其有关实验。 2.以铁及其化合物知识为载体,综合考查氧化还原 反应、电化学、水解、除杂等。
第一页,共36页。
考点 1 铁的性质
1.铁的存在及其物理性质 铁在周期表中位于第四周期第Ⅷ族;在地壳中的含量位于第四,在自然 界中主要以化合态存在,主要化合价有+2、+3,其中+3 价较为稳定。 2.铁的化学性质
答案:B
Fe 与 Cl2 反应只能得到 FeCl3,而不会得到 FeCl2,与反应物的用量无关。
重点(zhòngdiǎn)1 重点(zhòngdiǎn)2
第十七页,共36页。
重点1 “铁三角”中的转化(zhuǎnhuà)关系
例1
变式训练 (xùnliàn)1
在有关铁元素单质及其化合物的转化中,下列说法正确的是( )
考点(kǎo diǎn)1 考点(kǎo diǎn)2 考点(kǎo diǎn)3 触摸高考
第十页,共36页。
4.在 Fe2+、Fe3+大量共存的溶液中,如何检验 Fe2+和 Fe3+的存 在? 提示:取少许待测液于两支小试管中,向其中一份中滴加 KSCN 溶液,溶液变 成红色说明含有 Fe3+,向另一份中滴加酸性 KMnO4 溶液,KMnO4 溶液紫色 褪去,则证明含有 Fe2+。
2022届高三化学高考备考一轮复习铁及其重要化合物

铁及其重要化合物复习评价作业一、单选题(共16小题)1.将铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是() A.Fe(OH)3Fe2O3B.Fe(OH)2Fe2O3C.Fe(OH)2Fe(OH)3D.Fe(OH)2Fe3O42.将铁屑溶于过量的稀盐酸后,再加入下列物质,会有Fe3+生成的是()A.硫酸B.氯水C.硫酸锌D.氯化铜3.下列关于物质或离子检验的叙述正确的是()A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO24.有关铁的氧化物的说法中,不正确的是()A.赤铁矿的主要成分是Fe2O3,Fe2O3是红棕色的,常用作红色油漆和涂料B.Fe3O4是黑色晶体,其中13的铁显+2价,23的铁显+3价C.FeO、Fe2O3、Fe3O4都不溶于水,但都能和盐酸反应生成相应的盐D.FeO不稳定,在空气中加热迅速被氧化成Fe2O35.某学生以铁丝和Cl2为原料进行下列实验。
从分类角度分析,下列说法正确的是()A.实验①③反应制得的物质均为纯净物B.实验②③均未发生氧化还原反应C.实验②③均为放热过程D.实验①②所涉及的物质均为电解质或非电解质6.《唐本草》记载“本来绿色,新出窟未见风者,正如琉璃。
陶及今人谓之石胆,烧之赤色,故名绛矾矣”。
文中“绛矾”为()A.FeSO4·7H2O B.CuSO4·5H2OC.Na2SO4·10H2O D.KAl(SO4)2·12H2O7.某学生以铁丝和Cl2为原料进行下列三个实验。
下列从分类角度分析正确的是()A.实验①、③反应制得的物质均为纯净物B.实验②、③均未发生氧化还原反应C.实验①、③均为放热反应D.实验①、②所涉及的物质均为电解质8.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是()A.只有④B.只有③C.③和④均错D.全部错误9.录音磁带是在醋酸纤维、聚酯纤维等纤维制成的片基上均匀涂上一层磁性材料——磁粉制成的。
高考化学一轮复习 2-4 铁及其化合物 鲁科版

第四讲铁及其化合物一、选择题1.铁是人类应用较早,当前应用量最大的金属元素,下列有关铁及其化合物的有关说法中正确的是( ) A.赤铁矿的主要成分是Fe3O4B.铁与水蒸气在高温下的反应产物为Fe2O3和H2C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤D.Fe3+与KSCN产生红色沉淀解析赤铁矿的主要成分是Fe2O3;铁与水蒸气在高温下的反应产物为Fe3O4和H2;+3 价铁离子遇KSCN溶液变为红色,但没有沉淀产生,一般可以用此方法检验+3价铁离子的存在。
答案 C2.王老师做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色,判断下列说法中正确的是()A.该条件下生成的水分子化学性质比较活泼B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性C.该条件下H2燃烧生成了只具有氧化性的物质D.该条件下H2燃烧的产物中可能含有一定量的H2O2解析酸性高锰酸钾溶液褪色,说明生成了一种具有还原性的物质,又它能使KSCN和FeCl2的混合溶液变红色,可见这一物质又具有氧化性,所以只有选项D正确。
答案 D3.下列实验中,金属或固体可以完全溶解的是 ( ) A.在H2O2溶液中加入少量MnO2粉末B.镀锌铁皮加入足量的NaOH溶液中C.1 mol铜片与含2 mol H2SO4的浓硫酸共热D.常温下,1 mol铜片投入含4 mol HNO3的浓硝酸中解析MnO2作催化剂,反应前后保持不变,故不溶;铁与NaOH溶液不反应,故不能完全溶解;1 mol铜片与含2 mol H2SO4的浓硫酸共热理论上恰好完全反应,但随着反应的进行硫酸变稀,反应不再进行。
答案 D4.某学生鉴定甲盐的方法如图所示:下列结论正确的是 ( ) A.甲中一定有Fe3+ B.丙中一定有Fe3+C.乙为AgI沉淀 D.甲一定为FeBr2溶液答案 B5.向某晶体的溶液中加入Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现红色,由此得出下列的结论错误的是( ) A.Fe3+的氧化性比溴的氧化性强B.该晶体中一定含有SCN-C.Fe2+与SCN-不能形成红色化合物D.Fe2+被溴氧化成Fe3+解析某晶体的溶液中没有与Fe2+发生反应的离子,当加入溴水后,Fe2+一定被氧化成Fe3+,此时溶液出现红色,说明原晶体是含有SCN-的盐,很明显判断出B、C、D均正确,在Br2与Fe2+反应中,Fe3+是氧化产物,Br2是氧化剂,所以Br2的氧化性应比Fe3+氧化性强。
高三化学一轮复习学案 铁及其重要化合物(课前案)

高三化学一轮复习学案铁及其重要化合物(课前案)一、铁1. 原子结构与物理性质电子排布式原子结构示意图自然界中 (有或无)游离态的铁元素2.化学性质⑴与非金属反应:①与氧气:,燃烧现象:火星四射,生成固体。
②与氯气:燃烧现象:生成色的烟。
(加水振荡后溶液显色)③与硫:,现象:混合物保持红热状态。
特别注意:只能生成价Fe,由此可证明硫单质氧化性(“>”或“<”)氯气氧化性。
⑵与水反应:①在高温下,铁能与水蒸气反应生成H2: Fe + H2O(g)②在常温下,在水和空气中的O2、CO2等的共同作用下,Fe易发生电化腐蚀(铁生锈Fe2O3) 2Fe+O2+2H2O=2Fe(OH)2, 4Fe(OH)2+O2+2H2O====4Fe(OH)3, 2Fe(OH)3 =Fe2O3+3H2O。
⑶与酸反应:①与非氧化性酸(如稀盐酸、稀H2SO4等)的反应离子方程式:②与氧化性酸。
a.铁遇冷的浓H2SO4、浓HNO3时,有现象,因此浓H2SO4或浓HNO3可盛放在铁容器中.b.铁粉少量与HNO3(稀)生成Fe3+:Fe+ HNO3(稀)===c.铁粉过量与HNO3(稀)生成Fe2+: Fe+ HNO3(稀)===(4)铁与盐溶液的反应①铁能置换比它活动性弱的金属如CuSO4溶液:Fe+ CuSO4===②铁能与FeCl 3溶液反应生成FeCl 2。
离子方程式: 3.铁的制备:高炉反应 二、铁的氧化物高温,过量铁与O 2反应:2 Fe+ O 22FeO氢氧化铁加热分解 2Fe(OH)3 Fe2O3+3H2O铁在氧气中燃烧 3Fe + 2O2 Fe3O4①FeO 与稀硝酸反应的化学方程式: ②FeO 与HI 溶液反应的化学方程式: ③Fe 2O 3与HI 溶液反应的化学方程式: 三、铁的氢氧化物完成下列变化的离子方程式,体会Fe2+与Fe3+转化条件。
(1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:。
高三化学一轮复习 第二章 第4节 铁及其化合物 精品课件 鲁科版必修1

MnO4 (H )在溶液中因氧化还原反应不能大量共存。
-
+
(2)盐溶液的配制与保存 ①Fe2+的盐溶液:加少量铁粉,防止 Fe2+被氧化;加少量 相应的酸,防止 Fe2+水解。 ②Fe3 的盐溶液:加少量相应酸防止 Fe3 水解。
+ +
(3)制取 Fe(OH)3 胶体
△ Fe3 +3H2O===== Fe(OH)3(胶体)+3H ,应用于净水。
• • • •
1.铁的化学性质 (1)和非金属的反应 ①与O2的反应 常温下,铁在潮湿的空气中易被氧化生成 Fe2O3 铁锈,主要成分为 。 • 点燃条件下,铁在纯氧中反应生成Fe3O4, 化学方程式为 3Fe+2O2 Fe3O4 • 。
• ②与S的反应 • 铁与硫在加热条件下反应,生成FeS,化学 Fe+S FeS 方程式为 • 。 • (2)和水的反应 3Fe+4H2O(g) Fe3O4+4H2 • 铁在高温下与水蒸气发生反应,化学方程 式为: • 。
• ②写出C的酸性溶液与双氧水反应的离子方 程式: _____________________________________ ___________________________________ • _____________________________________ ___________________________________。 • (4)写出鉴定E中阳离子的实验方法和现象: _____________________________________ ___________________________________ • _____________________________________ ___________________________________。
(创新方案)高考化学一轮 第二章 第4讲 铁及其化合物课件 鲁科版

受热分解: 2Fe(OH)3
分解产物很复杂 Fe2O3+3H2O
化学式
制法(填离 子方程式)
Fe(OH)2 可溶性亚铁盐与强碱
反应 Fe2++2OH- Fe(O=H=)2=↓
Fe(OH)3 可溶性铁盐与强碱
反应 Fe3++3OH- === Fe(OH)3↓
化学式
Fe(OH)2
Fe(OH)3
(2)若CuCl2有剩余,则容器中不可能有Fe,可能有Fe2+、 Fe3+;一定有Fe2+,可能有Cu,但Cu与Fe3+不共存.
(3)若FeCl3和CuCl2均有剩余,则容器中不可能有Fe、Cu, 可能有Fe2+.
[答案] (1)Fe3+、Cu2+ (2)Fe2+、Fe3+或Cu、Fe2+ (3)Fe、Cu Fe2+ (4)Fe、Cu
色变化应该是
()
A.颜色变浅
B.逐渐加深
C.没有改变
D.变棕黄色
解析:Fe(NO3)2溶液中有Fe2+、 ,加入盐酸后, HNO3把Fe2+氧化为Fe3+,溶液变棕黄色.
答案:D
2.在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待
反应结束,所剩余的固体滤出后能被磁铁吸引,则反
应后溶液存在较多的阳离子是
某学生设计了如图所示的方法,鉴定盐A的组
成成分.由此分析,下列结论中正确的是
()
A.A中一定有Fe3+ C.B为AgI沉淀
B.C中一定有Fe3+ D.A一定为FeBr2溶液
解答本题应抓住三个关键点并注意三个点的整合: (1)由浅黄色沉淀说明了什么? (2)红色溶液说明了什么? (3)HNO3具有较强的氧化性,由C如何推A?
判断下列说法是否正确: 1.(2009·徐州调研T8-C)
高三鲁科版化学一轮复习教案 铁及其化合物

合物中 FeO、Fe2O3和 Fe3O4的物质的量之比是
()
A.1∶2∶1
B.2∶1∶1
C.1∶3∶1
D.1∶1∶3
答案 D
解析 可用平均组成法来求解:在混合物中铁原子和氧原子物质的量之比为(21/56)∶(8/16)
=3∶4,则混合物的平均组成为 Fe3O4,在三种组合中 Fe3O4则不必多考虑,应注意 FeO 和 Fe
()
A.Fe3+、Al3+
B.Al3+
C.Fe2+、NH错误!
D.Fe3+
答案 B
解析 2Na2O2+2H2O===4NaOH+O2↑,Fe2+转变为 Fe3+,Fe3+转变为 Fe(OH)3沉淀
析出,Al3+转变为[Al(OH)4]—,NH错误!转变为 NH3气体,NH错误!减少。没有过滤,再加入过
B.向某溶液中通入 Cl2,然后再加入 KSCN 溶液变血红色,说明原溶液中含有 Fe2+
C.向某溶液中加入 NaOH 溶液,得红褐色沉淀,说明溶液中含有 Fe3+
D.向某溶液中加入 NaOH 溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有
Fe2+,不含有 Mg2+
答案 C
解析 A 项中只能说明含有 Fe3+,不合理;B 项原溶液中可能只有 Fe3+而没有 Fe2+;D 项中氧化
归纳总结
分析铁与稀 HNO3反应的关键 一是明确哪种物质过量,二是根据两种物质的量分析讨论判断,根据反应方程式: HNO3过量:Fe+4HNO3===Fe(NO3)3+NO↑+2H2O, Fe 过量时:Fe+2Fe(NO3)3===3Fe(NO3)2,两者相加得总方程式:3Fe+8HNO3=== 3Fe(NO3)2+2NO↑+4H2O,可以用数轴表示:
高考化学一轮复习(鲁科版)高频考点通关讲练第2章 第4讲 铁及其化合物

Fe2++2H2O 3H O 2
受热分解
3+ + Fe Fe2 可溶性铁盐与碱反应: 可溶性亚铁盐与碱反应:___ _____ 制法 ++2OH-=== Fe(OH) ↓ 3OH-=== Fe(OH)3↓ ____________________ __________________ 2 空气中, Fe(OH)2 能够非常迅速地被氧气氧化成 Fe(OH)3 , 二者的关 现象是 白色沉淀迅速变成 灰绿 色,最后变成 系 4Fe(OH)2+O2+2H2O===4Fe(OH)3 红褐 色,化学方程式为____________________________
与Cl2反应生成FeCl3,而Fe与盐酸反应Байду номын сангаас成FeCl2。
(2)铁在潮湿的空气中生成铁锈的主要成分是Fe2O3, 而铁在纯氧中燃烧的产物是Fe3O4。
(3)铁与硫蒸气反应生成的是FeS而不是Fe2S3。
(4)分析铁与稀HNO3反应的关键: 一是明确哪种物质过量,二是根据两种物质的量分析讨论判 断。根据反应的化学方程式: HNO3过量:Fe+4HNO3===Fe(NO3)3+NO↑+2H2O, Fe过量时:3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O, 可以用数轴表示:
[认知无盲区]
(1)Fe3O4 是一种纯净物,而不是由 FeO 和 Fe2O3 组成的 混合物。Fe3O4 的组成可以用氧化物形式表示为 FeO· Fe2O3, Fe3O4 与盐酸反应的化学方程式为:Fe3O4+8HCl===2FeCl3 +FeCl2+4H2O。
+ 2+ (2)NO- 与 Fe 在酸性条件下不能大量共存, 原因是 H 、 3 - - 2+ 3+ NO- 能将 Fe 氧化成 Fe ,类似的离子还有 ClO 、 MnO 3 4
新高考化学鲁科版一轮复习全国通用铁及其化合物

③3Fe+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O
5.把 22.4 g 铁粉完全溶解于某浓度的硝酸中,若反应只收集到 0.3 mol NO2 和 0.2 mol NO,下列说法正确的是( )
A.反应后生成的盐只为 Fe(NO3)3 B.反应后生成的盐只为 Fe(NO3)2 C.反应后生成的盐为 Fe(NO3)3 和 Fe(NO3)2,其物质的量之比为 1∶3 D.反应后生成的盐为 Fe(NO3)3 和 Fe(NO3)2,其物质的量之比为 3∶1
1234 567
C [由于铁的物质的量为562g2·.m4 ogl-1=0.4 mol,所以在反应的过程 中它失去的电子数应介于 0.8 mol(此时只产生 Fe2+)和 1.2 mol(此时只 产生 Fe3+)之间,又产生 0.3 mol NO2 和 0.2 mol NO,即反应过程中硝 酸得到的电子物质的量为 0.3 mol×(5-4)+0.2 mol×(5-2)=0.9 mol, 所以对应的产物既有 Fe(NO3)3 又有 Fe(NO3)2,设前者的物质的量为 x, 后者的物质的量为 y,则由铁原子守恒可得 x+y=0.4 mol,由得失电 子守恒得 3x+2y=0.9 mol,解得 x=0.1 mol,y=0.3 mol。]
命题点 1 铁及氧化物、氢氧化物的性质及应用 1.我国清代《本草纲目拾遗》中叙述了“铁线粉”:“粤中洋行
高考化学一轮复习 第2章 元素与物质世界 第4节 铁及其化合物学案 鲁科版
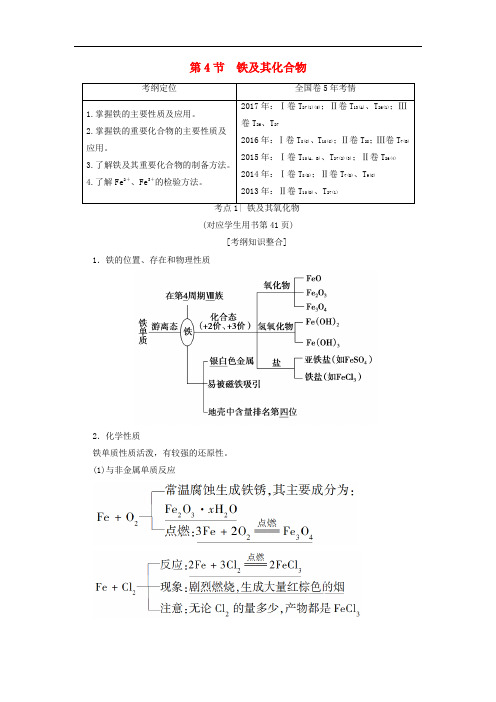
第4节 铁及其化合物(对应学生用书第41页)[考纲知识整合]1.铁的位置、存在和物理性质2.化学性质铁单质性质活泼,有较强的还原性。
(1)与非金属单质反应Fe 与S 反应:Fe +S=====△FeS 。
(2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应①与非氧化性酸反应的离子方程式:Fe +2H +===Fe 2++H 2↑。
②与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H 2产生。
(4)与某些盐溶液的反应①与CuSO 4溶液反应的离子方程式:Fe +Cu 2+===Cu +Fe 2+。
②与FeCl 3溶液反应的离子方程式:Fe +2Fe 3+===3Fe 2+。
提醒:(1)铁分别与氯气和盐酸反应所得的产物中铁元素的价态不同,Fe 与Cl 2反应生成FeCl 3,而Fe 与盐酸反应生成FeCl 2。
(2)铁在潮湿的空气中生成的铁锈的主要成分是Fe 2O 3,而铁在纯氧中燃烧的产物是Fe 3O 4。
(3)铁与硫蒸气反应生成的是FeS 而不是Fe 2S 3;铁与碘蒸气反应生成的是FeI 2而不是FeI 3。
3.铁的三种典型氧化物 (1)物理性质(2)①FeO、Fe 2O 3、Fe 3O 4分别与盐酸反应的离子方程式为 FeO +2H +===Fe 2++H 2O ,Fe 2O 3+6H +===2Fe 3++3H 2O , Fe 3O 4+8H +===2Fe 3++Fe 2++4H 2O 。
②FeO 不稳定,在空气中受热生成Fe 3O 4,其方程式为6FeO +O 2=====△2Fe 3O 4。
提醒:(1)Fe 3O 4的组成可用氧化物的形式表示为FeO·Fe 2O 3,即有1/3的铁显+2价,2/3的铁显+3价。
(2)Fe 3O 4与一般酸反应生成两种盐,Fe 3O 4与稀HNO 3反应生成一种盐。
铁及其化合物-鲁科版高中化学一轮复习PPT(配有doc练习)公开课获奖课件百校联赛一等奖课件

考素点养深优度化
最新考纲 1.了解铁旳主要性质及其应用。2.了解铁旳主要化合物 旳主要性质及其应用。3.了解Fe2+、Fe3+旳检验措施。
考素点养深优度化
考点一 铁及其主要化合物旳性质 1.铁旳存在
考素点养深优度化
2.铁旳物理性质 铁具有导电、导热和延展性,具有能被 磁体 吸引旳特征。
高温 应:3Fe+4H2O(g)=====Fe3O4+4H2。
考素点养深优度化
(3)与酸的反应: ①与非氧化性酸反应的离子方程式:Fe+2H+===Fe2++H2↑。 ②与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在 加热条件下与浓硫酸、浓硝酸反应,但无 H2 产生。 (4)与某些盐溶液的反应: ①与 CuSO4 溶液反应的离子方程式:Fe+Cu2+===Fe2++Cu。 ②与 FeCl3 溶液反应的离子方程式:Fe+2Fe3+===3Fe2+。
考素点养深优度化
[规律应用]
主要旳转化关系——“铁三角”
考素点养深优度化
考点二 Fe2+和Fe3+旳性质及其检验措施
1.Fe2+、Fe3+的性质 (1)Fe2+的氧化性和还原性 Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以 还原性 为主,如:Fe2+遇 Br2、Cl2、H2O2、NO- 3 (H+)等均表 现 还原性。 (2)Fe3+的氧化性 Fe3+处于铁的高价态,只有 氧化性 ,如:它能 氧化 Fe、Cu、 HI、H2S 等。
B.溶解镀锌层
C.清除铁锈
D.钝化
(2)调整溶液A旳pH可产生Zn(OH)2沉淀,为制得ZnO,后续 操作环节是________。
(3)由溶液B制取Fe3O4胶体粒子旳过程中,须连续通入N2, 其原因是_________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第4节铁及其重要化合物备考要点素养要求1.结合应用实例或通过实验探究,了解铁及其重要化合物的性质及其在生产、生活中的应用。
2.了解常见金属及其重要化合物的制备方法。
1.宏观辨识与微观探析:认识铁及其化合物的性质,能以Fe2+、Fe3+的相互转化为例,理解变价金属元素的氧化还原反应实质。
2.科学探究与创新意识:能发现和提出有探究价值的氢氧化亚铁的制备方案,进行实验探究。
考点一铁的单质、氧化物及氢氧化物必备知识自主预诊知识梳理1.铁的物理性质颜色、状态导电、导热性延展性地壳含量银白色固体良好占第位2.铁的化学性质(写出化学方程式或离子方程式)铁的化学性质活泼,有较强的还原性,主要化合价为价和价。
微点拨(1)铁分别与氯气和盐酸反应所得的产物中铁元素的价态不同,Fe 与Cl 2反应无论用量多少都生成FeCl 3,而Fe 与盐酸反应生成FeCl 2。
(2)铁在潮湿的空气中生成铁锈的主要成分是Fe 2O 3,而铁在纯氧中燃烧的产物是Fe 3O 4。
3.铁的制备方法 (1)生铁的冶炼。
①原料:铁矿石、焦炭、空气、石灰石。
②设备:高炉。
③主要反应:还原剂 的生成C+O 2CO 2、CO 2+C2CO(2)利用铝热反应焊接无缝钢轨,以氧化铁和铝粉为铝热剂,反应的化学方程式为 。
4.铁的氧化物 (1)物理性质。
(2)化学性质。
①FeO、Fe2O3分别与盐酸反应的离子方程式:、。
②FeO与稀硝酸反应的化学方程式:。
③FeO、Fe2O3分别与HI溶液反应的化学方程式:、。
5.铁的氢氧化物续表微点拨①FeO、Fe 3O4、Fe(OH)2与足量HNO3反应时,均发生氧化还原反应,Fe2+被HNO3氧化生成Fe3+。
②Fe2O3、Fe3O4、Fe(OH)3与足量HI反应时,均发生氧化还原反应,Fe3+被I-还原生成Fe2+。
自我诊断1.判断正误,正确的打“√”,错误的打“×”。
(1)Fe分别与氯气和盐酸反应所得氯化物相同。
()(2)Fe与稀硝酸、稀硫酸反应均有气泡产生,说明Fe与两种酸均发生置换反应。
()(3)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2。
()(4)铁与硫混合加热生成Fe2S3。
()(5)氧化铁能与酸反应,所以可用于制作红色染料。
()(6)Fe3O4可用FeO·Fe2O3表示,故Fe3O4为混合物。
()(7)氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+3H+Fe3++3H2O。
()2.下列各图中能较长时间看到Fe(OH)2白色沉淀的是(填序号)。
关键能力考向突破考向1铁单质的性质【典例1】(2020山东泰安第四中学期中)向含Fe(NO3)3、Cu(NO3)2、HNO3的某种稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。
下列说法错误的是()A.横轴0~1:Fe+N O3-+4H+Fe3++NO↑+2H2OB.横轴1~2:Fe+2Fe3+3Fe2+C.横轴2~3:Fe+Cu2+Fe2++CuD.原溶液中三种溶质浓度相等易错警示反应产物中铁元素价态的判断(1)铁与弱氧化剂(如S、I2、H+、Cu2+)等反应所得产物中铁元素的价态为+2价,如Fe+I2FeI2。
(2)铁与强氧化剂(如Cl2、Br2、浓硫酸、过量硝酸等)反应所得产物中铁元素的价态为+3价,如2Fe+3Br22FeBr3。
(3)铁在纯氧中燃烧得到的产物为Fe3O4,铁元素的价态为+2、+3价。
(4)铁与稀硝酸反应产物的判断。
①当HNO3过量时:反应原理:Fe+4HNO3Fe(NO3)3+NO↑+2H2O,铁元素的存在形式为Fe3+,铁元素的价态为+3价。
②当Fe过量时:反应原理:3Fe+8HNO33Fe(NO3)2+2NO↑+4H2O,铁元素的存在形式为Fe2+,铁元素的价态为+2价。
③当14<n(Fe)n(HNO3)<38时:铁元素的存在形式为Fe2+和Fe3+,铁元素的价态为+2、+3价。
对点演练1(2020山东德州夏津第一中学月考)铁和铁合金是生产、生活中常用的材料,下列说法中错误的是()A.不锈钢比生铁抗腐蚀能力强B.以铁制品为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜C.铁与稀硫酸反应,铁与浓硫酸不能反应D.铁轨焊接时可以用铝热反应的方法制取少量的铁考向2铁的氧化物、氢氧化物的制备和性质【典例2】(2020浙江金华质检)纳米级Fe3O4是一种非常重要的磁性材料,同时也可用作催化剂载体和微波吸收材料。
纳米级Fe3O4有多种不同的制法,请回答下列相关问题。
Ⅰ.如图是用共沉淀法制备纳米四氧化三铁的流程。
(1)除Fe3O4外,铁的两种常见氧化物中在空气中性质比较稳定的是(填化学式),该物质的用途是(任写一种)。
(2)实验室保存溶液B时为了防止出现浑浊,通常采取的措施是。
(3)证明沉淀已经洗涤干净的操作是。
(4)写出该方法中发生的主要反应的离子方程式:。
(5)实际生产中为提高产率,起始所用FeSO4·7H2O和FeCl3·6H2O的物质的量之比大于1∶2,原因是。
Ⅱ.制备纳米四氧化三铁的另一种流程如图所示。
FeCl3·6H2O FeOOH纳米Fe3O4(6)写出上述流程中第2步反应的化学方程式:,其中氧化产物和还原产物的物质的量之比为。
(7)将粒子直径为几十纳米的Fe3O4投入分散剂中形成的分散系是。
对点演练2如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。
实验提供的试剂:铁屑、6 mol·L-1硫酸溶液、NaOH溶液。
下列说法错误的是()A.B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑B.实验开始时应先将活塞E关闭C.生成Fe(OH)2的操作为关闭活塞E,使A中溶液压入装置B中D.取下装置B中的橡皮塞,使空气进入,发生的有关反应的化学方程式为4Fe(OH)2+O2+2H2O4Fe(OH)3深度指津1.成功制备Fe(OH)2的关键Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3。
在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成功的关键有以下两点:①溶液中不含Fe3+和O2等氧化性物质;②制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。
2.实验室中制备Fe(OH)2的常用方法方法一:有机层覆盖法将吸有NaOH溶液的胶头滴管插到亚铁盐溶液液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图1所示。
方法二:还原性气体保护法用H2将装置内的空气排尽后,再将亚铁盐溶液与NaOH溶液混合,这样可长时间观察到白色沉淀,如图2所示。
方法三:电解法用铁作为阳极电解NaCl(或NaOH)溶液,并在液面上覆盖苯(或煤油),如图3所示。
考点二Fe2+、Fe3+的转化与检验及铁三角的应用必备知识自主预诊知识梳理1.亚铁盐与铁盐(1)亚铁盐。
①Fe2+的氧化性和还原性。
含有Fe2+的溶液呈浅绿色,Fe2+处于铁的中间价态,既有性,又有性,其中以性为主,如遇Br2、Cl2、H2O2、N O3-(H+)等均表现为性。
Fe2+的酸性溶液与H2O2反应的离子方程式:。
FeCl2溶液与HNO3溶液反应的离子方程式为。
②Fe2+可发生水解反应。
Fe(OH)2是弱碱,含Fe2+的盐(如硫酸亚铁)溶液呈酸性。
配制硫酸亚铁溶液时常加少量硫酸抑制Fe2+的水解,加少量铁屑防止Fe2+被氧化。
(2)铁盐。
①氧化性:含有Fe3+的溶液呈色,Fe3+具有氧化性,Fe3+与Fe、Cu反应的离子方程式分别为:,。
②特性:含有Fe3+的盐溶液遇到时变成红色。
③FeCl3易水解:将其饱和溶液滴入沸水中制备胶体的化学方程式为FeCl3+3H2O Fe(OH)3(胶体)+3HCl。
2.Fe3+和Fe2+的检验方法(1)Fe2+的检验:(2)Fe3+的检验:(3)含Fe2+、Fe3+的混合溶液中Fe3+、Fe2+的检验。
①Fe3+的检验:②Fe2+的检验:微点拨(1)检验Fe2+时,不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加入到足量的新制氯水中(新制氯水有可能氧化SCN-)。
(2)Fe3+、Fe2+、Cl-同时存在时不能用酸性KMnO4溶液检验Fe2+(Cl-能还原KMnO4,会造成干扰)。
3.含Fe2+、Fe3+的除杂问题4.铁及其化合物的相互转化写出下列变化的离子方程式,体会Fe2+与Fe3+的转化条件。
(1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:。
(2)将FeCl3溶液滴入KI淀粉溶液,溶液变蓝:。
(3)用FeCl3溶液腐蚀废旧线路板上的铜箔:。
(4)将H2O2溶液滴入到酸性FeCl2溶液中:。
(5)将FeCl2溶液滴入到稀的HNO3溶液中,有无色气体放出:。
微点拨FeCl 3溶液发生反应时的颜色变化(1)向FeCl3溶液中加几滴KSCN溶液后,溶液呈红色。
(2)FeCl3与NaOH溶液反应生成红褐色沉淀。
(3)向FeCl3溶液中通入H2S气体,生成淡黄色沉淀。
(4)向FeCl3溶液中加入几滴Na2S溶液,生成淡黄色沉淀,当加入的Na2S溶液过量时,又生成黑色沉淀。
(5)向FeCl3溶液中加入过量Fe粉,溶液变成浅绿色。
(6)向FeCl3溶液中滴入淀粉碘化钾溶液,溶液变成蓝色。
(7)向FeCl3溶液中滴入苯酚溶液,溶液变成紫色。
(8)将饱和FeCl3溶液滴入沸水中,继续加热至液体呈红褐色,生成红褐色Fe(OH)3胶体。
自我诊断1.判断正误,正确的打“√”,错误的打“×”。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为Fe3++3SCN-Fe(SCN)3。
()(2)可用铁粉除去FeCl2溶液中的FeCl3。
()(3)将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红,检验Fe(NO3)2晶体是否已氧化变质。
()(4)室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色,说明Fe3+的氧化性比I2的强。
()(5)用NaOH溶液和盐酸能除去FeCl2溶液中混有的CuCl2。
()(6)(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制备Fe(OH)2的离子方程式:Fe2++2OH-Fe(OH)2↓。
()2.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中存在Fe3+的常用试剂是,证明Fe3+存在的现象是。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:请写出上述实验中加入的有关物质的化学式。
