大学化学之电化学基础.ppt
合集下载
大学化学-第4章-电化学原理及应用
氧化剂与还原剂在反应中的变化规律
氧化剂 得电子 还原剂 失电子
氧化数降低 具有氧化性 使还原剂氧化
本身被还原
氧化数升高 具有还原性 使氧化剂还原
本身被氧化
+1 +2 -1 +3 NaClO + 2FeSO4 + H2SO4 = NaCl + Fe2(SO4)3 + H2O
氧化剂 还原剂 还原产物 氧化产物
第 章 电化学原理及应用
4
4.2 原电池与电极电势
氧化-还原电极 电极
Fe3+(c1), Fe2+(c2) | Pt Cu2+(c1), Cu+(c2) | Pt
电极反应
Fe3+(c1) + e- →Fe2+(c2) Cu2+(c1) + e- →Cu+(c2)
Sn4+(c1), Sn2+(c2) | Pt
第 章 电化学原理及应用
4
4.2 原电池与电极电势
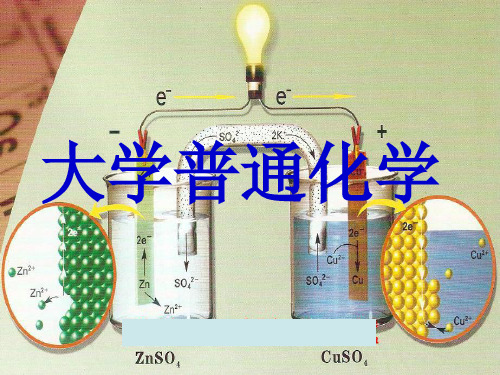
工作原理:Zn比Cu活泼,Zn原子失去电子被氧 化成 Zn2+进入ZnSO4 溶液;电子沿导线流向Cu片,
CuSO4 溶液中的Cu2+ 从 Cu片上获得电子还原成Cu
原子沉积在Cu片上。外电路上电子的定向流动产生 了电流 , 所以指针偏转,原电池对外做了电功。
氧化还原反应 直观的认识(20世纪):氧化数变化 2e如:电子得失: Zn + Cu2+ 电子偏移: 2H2 + O2 氧化数变化: Zn + Cu2+
0 +2 0 0
本质的认识(19世纪):电子得失或偏移
Zn2+ + Cu 2H2O
大学无机化学-第七章-氧化还原反应-电化学基础-课件

② 分别写出氧化剂被还原和还原剂被氧化的半反应 ③ 分别配平两个半反应方程式,等号两边的各
种元素的原子总数各自相等且电荷数相等 ④ 确定两半反应方程式得、失电子数目的最小公倍
数。将两个半反应方程式中各项分别乘以相应的 系数,使得、失电子数目相同。然后,将两者合 并,就得到了配平的氧化还原反应的离子方程式。 有时根据需要可将其改为分子方程式。
3Cl2 (g) + 6OH- = 5Cl- + ClO3- + 3H2O 3Cl2 (g) + 6NaOH = 5NaCl + NaClO3 + 3H2O
无机化学
§7.1 氧化还原反应的基本概念
例 4 配平方程式
Cr(OH)3 (s) + Br2 (l) + KOH
K2CrO4 + KBr
Cr(OH)3 (s) + Br2 (l)
电极组成:Pt , Cl2(p) | Cl- (a)
电极反应: Cl2 + 2e
2Cl-
无机化学
§7.2 电化学电池
3. 金属-金属难溶盐-阴离子电极
将金属表面涂有其金属难溶盐的固体,然后浸 入与该盐具有相同阴离子的溶液中构成的电极
电极组成:Ag ,AgCl(s)| Cl- (a) 电极反应:AgCl + e Ag + Cl电极组成:Hg ,Hg2Cl2(s)| Cl- (a) 电极反应:Hg2Cl2+2e 2Hg +2Cl-
无机化学
§7.1 氧化还原反应的基本概念
2-2 半反应法(离子—电子法) 配平原则 (1)反应过程中氧化剂得到的电子数等于还
原剂失去的电子数 (2)反应前后各元素的原子总数相等
种元素的原子总数各自相等且电荷数相等 ④ 确定两半反应方程式得、失电子数目的最小公倍
数。将两个半反应方程式中各项分别乘以相应的 系数,使得、失电子数目相同。然后,将两者合 并,就得到了配平的氧化还原反应的离子方程式。 有时根据需要可将其改为分子方程式。
3Cl2 (g) + 6OH- = 5Cl- + ClO3- + 3H2O 3Cl2 (g) + 6NaOH = 5NaCl + NaClO3 + 3H2O
无机化学
§7.1 氧化还原反应的基本概念
例 4 配平方程式
Cr(OH)3 (s) + Br2 (l) + KOH
K2CrO4 + KBr
Cr(OH)3 (s) + Br2 (l)
电极组成:Pt , Cl2(p) | Cl- (a)
电极反应: Cl2 + 2e
2Cl-
无机化学
§7.2 电化学电池
3. 金属-金属难溶盐-阴离子电极
将金属表面涂有其金属难溶盐的固体,然后浸 入与该盐具有相同阴离子的溶液中构成的电极
电极组成:Ag ,AgCl(s)| Cl- (a) 电极反应:AgCl + e Ag + Cl电极组成:Hg ,Hg2Cl2(s)| Cl- (a) 电极反应:Hg2Cl2+2e 2Hg +2Cl-
无机化学
§7.1 氧化还原反应的基本概念
2-2 半反应法(离子—电子法) 配平原则 (1)反应过程中氧化剂得到的电子数等于还
原剂失去的电子数 (2)反应前后各元素的原子总数相等
无机化学第11章 电化学基础

正极:Cu2+ + 2e- → Cu
二、半电池/原电池符号、电极的分类
• 原则上,任何氧化还原半反应都可以设计成半 电池。 • 两个半电池连通,都可以形成原电池。 • 原电池符号: 习惯上把负极写在左边,正极写在右边,其中 “︱”表示两相界面,“‖”表示盐桥,c表示 溶液的浓度。
(-) Zn ︱ ZnSO4(c1) ‖ CuSO4(c2) ︱Cu (+)
五、能斯特方程
∵△rGm= -nFE ; △rGm= -nFE 非标准态下: △rGm= △rGm+RTlnJ ∴-nFE= -nFE +RTlnJ 对氧化还原反应:
RT EE ln J nF
能斯特方程
对电极反应:
RT [还原型] RT [氧化型] ln 或 ln nF [氧化型] nF [还原型]
活泼金属或浓度小
金属溶解的趋势小于 离子沉积的趋势,达 平衡时金属表面带正 电荷,靠近金属附近 溶液带负电荷。 Cu2++2eCu(s)
在原电池中做正极
不活泼金属 或浓度大
金属的平衡电极电势
• 产生在金属与其盐溶液之间的电势差称为 该金属的平衡电极电势() • 电势差不仅取决于金属本性,而且与盐溶 液浓度、温度等因素有关 • 原电池,两极之间的电势差称为电动势(E) • 电动势 E = 正 - 负
例: 将下列氧化还原反应设计成原电池, 并写出它 的原电池符号。
2Fe2+(1.0mol/L)+Cl2(101325Pa) →2Fe3+(0.10mol/L)+2Cl-(2.0mol/L)
负极: Fe2+-e-=Fe3+
正极: Cl2+2e- =2Cl原电池符号:
大学化学电子课件

Atomic radii (in pm)
Li Be
157 112
B
88
C
77
N
74
O F
66 64
Na Mg
191 160
Al Si P S
143 118 110 104
Cl
99
K
235
Ca Sc Ti V
197 164 147 135
Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br
制作:张思敬等
理学院化学系
8
第2章 物质结构基础 章
Chapter 2 Basic of Substance Structure
本章教学要求
1. 了解原子核外电子运动的基本特征,明确量子数的取值规 了解原子核外电子运动的基本特征, 了解原子轨道和电子云的空间分布。 律,了解原子轨道和电子云的空间分布。 2. 掌握核外电子排布的一般规律及其与元素周期表的关系。 掌握核外电子排布的一般规律及其与元素周期表的关系。 3. 了解化学键的本质及键参数的意义。 了解化学键的本质及键参数的意义。 4. 了解杂化轨道理论的要点,能应用该理论判断常见分子 了解杂化轨道理论的要点, 的空间构型、极性等。 的空间构型、极性等。 5. 了解分子间作用力以及晶体结构与物质物理性质的关系。 了解分子间作用力以及晶体结构与物质物理性质的关系。
制作:张思敬等
理学院化学系
5
课件内容
第1章 化学的发展 章 第2章 物质结构基础 章 第3章 气体反应 大气污染 章 第4章 热化学 能源 章 第5章 水溶液中的反应 水污染 章 第6章 配位化合物 章 第7章 电化学 金属材料腐蚀 章 第8章 金属化学与材料 章 第9章 非金属化学与材料 章 第10章 高分子化合物与材料 章 第11章 表面与胶体化学 章 第12章 生命活动与化学 章
分析化学第九章电化学分析概论(大学课件)

二. 现代电化学分析的特点及发展趋势
时间和空间上体现“快 小”:仪器袖珍化,电极微型化
(1)化学修饰电极(chemically modified electrode) (2)生物电化学传感器(Biosensor) 生命过程的模拟研究,生命过程的氧化还原反应类似电 极上的氧化还原,用电极膜上反应模拟生命过程,可 深 化认识生命过程。 (3)光谱一电化学方法 ( Electrospectrochemistry) (4)超微电极(Ultramicroelectrode) 活体现场检测(无损伤分析 )
(2)液体接界电位与盐桥
在两种不同离子的溶液或两种不同浓度的溶液接触界 面上,存在着微小的电位差,称之为液体接界电位。 液体接界电位产生的原因:各种离子具有不同的迁移速率 而引起。
二、仪器分析方法的分类
Classification of instrument analytical method
光分析法 电化学分析法 仪器分析 质谱分析法
色谱分析法
分析仪器联用技术
热分析法
电化学分析方法的分类
Classification of electrochemical analysis 电导分析法 电位分析法 电化学分析法 电解分析法
(Galvanic cell) 阳极:发生氧化反应的电极(负极); 阴极:发生还原反应的电极(正极); 阳极≠正极 阴极≠负极 电极电位较正的为正极 (Electrolytic cell ) 阳极:发生氧化反应的电极(正极);
阴极:发生还原反应的电极(负极);
阳极=正极 阴极=负极
2.电极电位与液接电位
(5)微型计算机的应用Fra bibliotek30 25 20 15 b a c
I/
电化学理论基础

静思笃行 持中秉正
1.1、电化学体系的基本单元
一、电极:
电极是与电解质溶液接触的电子导体或半导体, 为多相体系。电化学体系借助电极实现电能的 输入和输出,电极是实施电极反应的场所。对 于三电极体系,三个电极分别为工作电极、参 比电极和辅助电极(对电极)。对于化学电源来 说,分正负极;对于电解池则分为阴阳极。
电极/溶液界面的性质就类似 于一个电容器,如图所示: 电极/溶液界面上的荷电物质 能部分地定向排列在界面两 侧,称为双电层。
静思笃行 持中秉正
1.3、法拉第过程和电极反应
一、电极反应的种类
电极反应是一种电荷传递过程。可分为阴极还原 过程:O xze Red 和阳极氧化过程: Red Oxze 其主要反应类型如下:
电化学理论基础
秋记与你分享
静思笃行 持中秉正
参考书
1、《应用电化学》肖友军、李立清,化学工业 出版社; 2、《应用电化学》杨绮琴,中山大学出版社; 3、《应用电化学》贾梦秋、杨文胜,高等教育 出版社;
秋记与你分享
静思笃行 持中秉正
1.1、电化学体系的基本单元
电化学体系至少由电解质溶液和浸没于其中的 电极组成,电极可以是两电极体系(阴极和阳极), 也可以是三电极体系(阴极、阳极和参比电极), 有时电极之间还可以用隔膜分开。
P b O 2 4 H S O 4 2 2 e P b S O 4 2 H 2 O
静思笃行 持中秉正
1.3、法拉第过程和电极反应
4、气体析出反应:
指某些存在于溶液中的非金属离子借助于电极发 生还原或氧化反应产生气体析出。
2H2e H2
静思笃行 持中秉正
1.3、法拉第过程和电极反应
静思笃行 持中秉正
1.3、法拉第过程和电极反应
1.1、电化学体系的基本单元
一、电极:
电极是与电解质溶液接触的电子导体或半导体, 为多相体系。电化学体系借助电极实现电能的 输入和输出,电极是实施电极反应的场所。对 于三电极体系,三个电极分别为工作电极、参 比电极和辅助电极(对电极)。对于化学电源来 说,分正负极;对于电解池则分为阴阳极。
电极/溶液界面的性质就类似 于一个电容器,如图所示: 电极/溶液界面上的荷电物质 能部分地定向排列在界面两 侧,称为双电层。
静思笃行 持中秉正
1.3、法拉第过程和电极反应
一、电极反应的种类
电极反应是一种电荷传递过程。可分为阴极还原 过程:O xze Red 和阳极氧化过程: Red Oxze 其主要反应类型如下:
电化学理论基础
秋记与你分享
静思笃行 持中秉正
参考书
1、《应用电化学》肖友军、李立清,化学工业 出版社; 2、《应用电化学》杨绮琴,中山大学出版社; 3、《应用电化学》贾梦秋、杨文胜,高等教育 出版社;
秋记与你分享
静思笃行 持中秉正
1.1、电化学体系的基本单元
电化学体系至少由电解质溶液和浸没于其中的 电极组成,电极可以是两电极体系(阴极和阳极), 也可以是三电极体系(阴极、阳极和参比电极), 有时电极之间还可以用隔膜分开。
P b O 2 4 H S O 4 2 2 e P b S O 4 2 H 2 O
静思笃行 持中秉正
1.3、法拉第过程和电极反应
4、气体析出反应:
指某些存在于溶液中的非金属离子借助于电极发 生还原或氧化反应产生气体析出。
2H2e H2
静思笃行 持中秉正
1.3、法拉第过程和电极反应
静思笃行 持中秉正
1.3、法拉第过程和电极反应
大学化学第4章 电化学原理及应用

4
Ⅱ条件
任何自发进行的氧化还原(oxidation-reduction) 反应,只要设计适当,都可以设计成原电池用 以产生电流。
Ⅲ构成
将Zn浸入CuSO4溶液中 (△rGm =-271kJ/mol<0)。 可知反应能够自发发生,但不能形成电流。 原因:设计不合理。 但如果设计合理可以形成电流,A.Volta电池
法拉第
(Michael Faraday 1791-1867)
英国物理学家、化学家,也是著名的自学成才的科学家。出生在一 个贫苦铁匠家庭。仅上过几年小学,13岁时便在一家书店里当学徒。 在 此读到许多科学书籍。在送报、装订等工作之余,自学化学和电 学,并动手做简单的实验,验证书上的内容。利用业余时间听自然 哲学讲演,因而受到了自然科学的基础教育。1813年3月由戴维举荐 到皇家研究所任实验室助手。这是法拉第一生的转折点,从此他踏 上了献身科学研究的道路。同年10月戴维到欧洲大陆作科学考察, 讲学,法拉第作为他的秘书、助手随同前往。历时一年半,先后经 过法国、瑞士、意大利、德国、比利时、荷兰等国,结识了安培、 盖.吕萨克等著名学者。沿途法拉第协助戴维做了许多化学实验,这 大大丰富了他的科学知识,增长了实验才干,为他后来开展独立的 科学研究奠定了基础。1824年1月当选皇家学会会员,1825年2月任 皇家研究所实验室主任,1833----1862任皇家研究所化学教授。1846 年荣获伦福德奖章和皇家勋章。1867年8月25日逝世。
5
eA -Zn +Cu
Zn2+ SO42-
KCl饱 和溶液 胶冻
Cu2+ SO42-
铜-锌原电池
6
Ⅳ原电池的图示(cell diagram)表示 1负极(anode)写左边,正极(cathode)写右边;
6.3 电池反应的热力学

对于普遍的电极反应:
氧化型 + n e-
还原型
《大学化学基础》
第6章 电化学原理及其应用
这是具有普遍性的电极电势的Nernst 方程,它
反映了非标准电极电势和标准电极电势的关系。
《大学化学基础》
第6章 电化学原理及其应用
6.3.4 Nernst方程式的表示规则 氧化型 + ne还原型 注
意
《大学化学基础》
《大学化学基础》
第6章 电化学原理及其应用
若利用 Cu - Zn 电池完成这一反应,则 有电流产生,属于恒温恒压做非体积功— 电功(W非)的过程。 其中体系所做电功等于电荷量与电势差之积, 即 - W体系 = qE (“-”为体系对环境做功)。 当电池反应中转移的电子数为n ,其电 荷量为 q,则有:q = nF
a Ab B g G d D
由热力学等温方程式有:
《大学化学基础》
第6章 电化学原理及其应用
这就是电池电
动势的能斯特 方程,它反映 了非标准电动 势和标准电动 势的关系。
《大学化学基础》
第6章 电化学原理及其应用
6.3.3 电极电势的Nernst方程
将电池反应: a A + b B — gG + d D 分成两个电极反应 正极: a A + ne-— g G A为氧化型 G为还原型 负极: d D + ne-— b B D 为氧化型 B 为还原型 n为转移电子的化学计量数。
对于反应进度 =1电池反应,则 将rG = -nFE 表示为: rGm = - nFE 式中 n为电池反应中转移的电子数。 当各反应物均为标准状态时,
《大学化学基础》
第6章 电化学原理及其应用
武汉大学分析化学课件电分析

1 恒电位法的基本原理和计算方法
理解恒电位法的原理和如何进行计算。
2 恒电位法在分析化学中的应用
探索恒电位法在分析化学中的应用领域。
极谱法
1 极谱法的基本原理
了解极谱法的基本原理和工作原理。
2 极谱法的分类和原理
介绍不同类型的极谱法及其原理。
3 极谱法在分析化学中的应用
探索极谱法在分析化学中的广泛应用领域。
武汉大学分析化学课件电 分析
这是一个关于武汉大学分析化学课程的演示文稿,重点介绍电分析的概念、 原理、方法和应用。让我们一起探索电分析的世界吧!
电化学基础概念
1 电解质和电极
2 电极反应
了解电解质的特性以及不同类型的电极。
揭示电极反应的池如何将化学能 转化为电能。
2 活性电极和惰性电
极
探索不同类型的电池电 极。
3 电池的种类和分析
应用
介绍不同类型的电池及 其在分析化学中的应用。
电解
1 电解的基本原理
深入了解电解的机制和 条件。
2 电解过程中的电极
反应
分析电解过程中发生的 电极反应。
3 电解分析的基本原
理和方法
介绍电解分析的基本原 理和一些常用方法。
恒电位法
电化学测量
1 电位差测量
使用电位差测量技术来获得相关数据。
2 电流测量
探索电流测量技术和其在电分析中的应用。
3 电导测量
了解电导测量的原理和应用。
电化学仪器
1 电化学分析仪器的
分类和原理
介绍常见的电化学仪器 及其工作原理。
2 电位计和电解槽的
原理和应用
深入了解电位计和电解 槽的原理和实际应用。
3 极谱仪和电导仪的
理解恒电位法的原理和如何进行计算。
2 恒电位法在分析化学中的应用
探索恒电位法在分析化学中的应用领域。
极谱法
1 极谱法的基本原理
了解极谱法的基本原理和工作原理。
2 极谱法的分类和原理
介绍不同类型的极谱法及其原理。
3 极谱法在分析化学中的应用
探索极谱法在分析化学中的广泛应用领域。
武汉大学分析化学课件电 分析
这是一个关于武汉大学分析化学课程的演示文稿,重点介绍电分析的概念、 原理、方法和应用。让我们一起探索电分析的世界吧!
电化学基础概念
1 电解质和电极
2 电极反应
了解电解质的特性以及不同类型的电极。
揭示电极反应的池如何将化学能 转化为电能。
2 活性电极和惰性电
极
探索不同类型的电池电 极。
3 电池的种类和分析
应用
介绍不同类型的电池及 其在分析化学中的应用。
电解
1 电解的基本原理
深入了解电解的机制和 条件。
2 电解过程中的电极
反应
分析电解过程中发生的 电极反应。
3 电解分析的基本原
理和方法
介绍电解分析的基本原 理和一些常用方法。
恒电位法
电化学测量
1 电位差测量
使用电位差测量技术来获得相关数据。
2 电流测量
探索电流测量技术和其在电分析中的应用。
3 电导测量
了解电导测量的原理和应用。
电化学仪器
1 电化学分析仪器的
分类和原理
介绍常见的电化学仪器 及其工作原理。
2 电位计和电解槽的
原理和应用
深入了解电位计和电解 槽的原理和实际应用。
3 极谱仪和电导仪的
大学化学(1)PPT课件

课堂内容。习题以习题册为主(不要题海 战术)。 • 认真做好每一个实验,认真完成好实验报 告的书写。
.
17
实验课教学
• 实验二 化学反应热效应的测定 • 实验三 污水中六价铬离子的测定 • 实验四 醋酸解离常数的测定
及缓冲溶液的性质 • 实验五 氧化还原反应 • 实验六 水的净化与水质检测 • 实验九 化学反应速率常数的测定
18实验课教学实验二化学反应热效应的测定实验三污水中六价铬离子的测定实验四醋酸解离常数的测定及缓冲溶液的性质实验五氧化还原反应实验六水的净化不水质检测实验九化学反应速率常数的测定19化学实验报告格式要求要有实验记彔统一用整张数学作业纸记彔包拪实验时间地点名称原始数据等实验结束以后教师审核签字
《大学化学》
化学反应遵守质量守恒定律 化学变化遵守能量守恒定律
.
15
三大函数的关系图
热效应 焓
混乱度 熵
△G(T)= △H(T)-T△S(T)
方向判据 等温等压
△G(T) = △Gθ(T) + RT lnQ
自由能
本课程的核心公式
.
标准条件
程度判据
16
你要做的
• 上课前先预习。 • 听好每一堂课(事半功倍), • 下课以后做好小结。做一定量的习题巩固
第三章 溶液与离子平衡 6学时
第四章 氧化还原及电化学 5学时
第五章 选讲材料
2学时
习题讨论课
4学时
.
13
大学化学学习方法
• 读书的三个层次: 1)把书读厚 2)把书读薄 3)把书读没(手中有书,心中无书) 要灵活掌握知识要点、以点(公式)带线 (各个基本点和慨念)、以线扩面(整个 大学化学的要求内容)。融会贯通,不要 死记硬背。
.
17
实验课教学
• 实验二 化学反应热效应的测定 • 实验三 污水中六价铬离子的测定 • 实验四 醋酸解离常数的测定
及缓冲溶液的性质 • 实验五 氧化还原反应 • 实验六 水的净化与水质检测 • 实验九 化学反应速率常数的测定
18实验课教学实验二化学反应热效应的测定实验三污水中六价铬离子的测定实验四醋酸解离常数的测定及缓冲溶液的性质实验五氧化还原反应实验六水的净化不水质检测实验九化学反应速率常数的测定19化学实验报告格式要求要有实验记彔统一用整张数学作业纸记彔包拪实验时间地点名称原始数据等实验结束以后教师审核签字
《大学化学》
化学反应遵守质量守恒定律 化学变化遵守能量守恒定律
.
15
三大函数的关系图
热效应 焓
混乱度 熵
△G(T)= △H(T)-T△S(T)
方向判据 等温等压
△G(T) = △Gθ(T) + RT lnQ
自由能
本课程的核心公式
.
标准条件
程度判据
16
你要做的
• 上课前先预习。 • 听好每一堂课(事半功倍), • 下课以后做好小结。做一定量的习题巩固
第三章 溶液与离子平衡 6学时
第四章 氧化还原及电化学 5学时
第五章 选讲材料
2学时
习题讨论课
4学时
.
13
大学化学学习方法
• 读书的三个层次: 1)把书读厚 2)把书读薄 3)把书读没(手中有书,心中无书) 要灵活掌握知识要点、以点(公式)带线 (各个基本点和慨念)、以线扩面(整个 大学化学的要求内容)。融会贯通,不要 死记硬背。
电化学工程基础-绪论

• • • • • • •
• 1.5电化学过程的物料管理与能量管理 1.5.1物料衡算 物料衡算步骤: ①选择衡算体系; ②规定衡算基准; ③建立衡算方程; ④数学运算、求得答案; ⑤必要时编制衡算清单。
1.4电化学反应器的基本组成
• • • • • 反应器由电极、电解质、隔膜和壳体组成。 1.4.1电极 电极是电化学反应器的核心部件。 1)活性电极材料:参与反应并消耗; 2)“惰性”电极材料:参与反应并损耗, 惰性是相对的! • 金属与合金、碳素材料、金属氧化物、陶 瓷材料。
• 工业电解和合成对电极材料的要求: • 物理性能:密度、熔点、导电率、电阻率、 线膨胀系数等; • 稳定性:化学稳定性、机械稳定性等; • 表面性能:吸附、催化、表面化学等; • 经济性:来源、加工、造价。
• 1.2.2化学品生产
• 1)无机化学品 • 氢氧化钠、氯气及氯酸盐、氟气、氢气 (氢能时代,电解水)、重铬酸钾、高锰 酸钾、过二硫酸钠、二氧化锰、氧化亚铜 等; • 2)有机化学品 • 己二腈、四烷基铅、邻苯二甲酸、蒽醌、 葡萄糖酸等;
• 1.2.3化学电源 • 化学能直接转化为电能的装置。
• • • •
• • • • • • •
1.4.2隔离器 1)隔离器作用 ①隔离电极,防止短路(如枝晶引起的); ②阻止电解液混合(阴极室与阳极室采用不同电解 质); ③保存电极上的活性物质不脱落。 2)隔离器种类 ①隔板、②多孔隔离器和隔膜、③离子交换膜 3)隔离器的选择 ①隔离性、选择性、电阻值及对传质的影响; ②耐污染性能、使用寿命; ③化学稳定性、机械稳定性能。
3)燃料电池发电 化学反应(自由能)→电能,涉及: 燃料重整、纯化、循环; 水循环(反应生成水,加湿水等); 热交换(换热或余热利用); 直流变交流过程(逆变、直流电机)。 热电联供:利用自由能的同时,利用热效 应。
天津大学物理化学第七章-电化学PPT课件

解:电极反应为: 阳极 Ag→Ag++e阴极 Ag++e- →Ag
对阳极区的Ag+ 进行物料衡算,假定通电前后阳极区的水量不变(水分 子不迁移),则电解前阳极区23.14g水中原有AgNO3的物质的量为:
n 电 解 前 ( A g N O 3 )4 1 3 0 . 0 5 0 0 2 3 . 1 4 m m o l1 . 0 0 7 m m o l = n 电 解 前 ( A g + )
化学能与电能之间 相互转换的规律
原电池
利用化学反应来 产生电能将 能够自发进行的 化学反应放在原 电池装置中使化 学能转化为电能
电解池
利用电能来驱动 化学反应将 不能自发进行的 反应放在电解池 装置中输入电流 使反应得以进行
-
4
无论是原电池还是电解池,其内部工作介质都离不 开电解质溶液。因此本章除介绍原电池和电解池外,还
电解过程 法拉第定律 同时适用于
原电池放电过程
1 mol 电子电量=L×e = 6.023×1023(mol-1)×1.602×10-19 (库仑,C) = 96485 C·mol-1 = 1 F
-
12
电极反应的通式可写为:
或:
M ( 氧 化 态 ) z e
M ( 还 原 态 )
M ( 还 原 态 ) M ( 氧 化 态ቤተ መጻሕፍቲ ባይዱ)z e
但如将逆反应放入如图 所示装置内,通电后,逆反 应可进行。
极板/溶液:电子得失 溶液中: 离子定向迁移
利用电能来发生化学反 应的装置成称为电解池
H2 阴极-
Fe
电解池
-
电源
O2 +阳极 Ni
KOH 水溶液
6
对阳极区的Ag+ 进行物料衡算,假定通电前后阳极区的水量不变(水分 子不迁移),则电解前阳极区23.14g水中原有AgNO3的物质的量为:
n 电 解 前 ( A g N O 3 )4 1 3 0 . 0 5 0 0 2 3 . 1 4 m m o l1 . 0 0 7 m m o l = n 电 解 前 ( A g + )
化学能与电能之间 相互转换的规律
原电池
利用化学反应来 产生电能将 能够自发进行的 化学反应放在原 电池装置中使化 学能转化为电能
电解池
利用电能来驱动 化学反应将 不能自发进行的 反应放在电解池 装置中输入电流 使反应得以进行
-
4
无论是原电池还是电解池,其内部工作介质都离不 开电解质溶液。因此本章除介绍原电池和电解池外,还
电解过程 法拉第定律 同时适用于
原电池放电过程
1 mol 电子电量=L×e = 6.023×1023(mol-1)×1.602×10-19 (库仑,C) = 96485 C·mol-1 = 1 F
-
12
电极反应的通式可写为:
或:
M ( 氧 化 态 ) z e
M ( 还 原 态 )
M ( 还 原 态 ) M ( 氧 化 态ቤተ መጻሕፍቲ ባይዱ)z e
但如将逆反应放入如图 所示装置内,通电后,逆反 应可进行。
极板/溶液:电子得失 溶液中: 离子定向迁移
利用电能来发生化学反 应的装置成称为电解池
H2 阴极-
Fe
电解池
-
电源
O2 +阳极 Ni
KOH 水溶液
6
第7章 电化学极化 ppt课件

ppt课件 40
Tafel曲线
• lg|J|对于η作图所得半对数极化曲线称为Tafel曲线
阴极极化 Tafel曲线
• β可通过斜率得到,J0可pp通t课件过截距得到 41
(3) 低过电势下的近似公式:线 性极化公式
• η<12mV或J<0.5J0时,可使用线性极化公式,误 差<1%
• 线性极化公式的误差受传递系数影响较大,相对而 言,Tafel公式适用条件基本不受传递系数影响。
电化学原理
高鹏 哈尔滨工业大学(威海)
ppt课件
1
第7章 电化学极化
• 7.1 电化学动力学理论基础 • 7.2 电极动力学的Butler-Volmer模型 • 7.3 单电子反应的电化学极化 • 7.4 多电子反应的电极动力学 • 7.5 电极反应机理的研究 • 7.6 分散层对电极反应速率的影响 • 7.7 平衡电势与稳定电势
• 精细平衡原理:平衡时体系中每一个基元反应在 正、逆两个方向进行反应的速率相等。 – 在复杂反应中如果有一个决速步骤,则它必然 是逆反应的决速步骤。
ppt课件 6
v v v0
(3)绝对电流密度与交换电流密度
ppt课件 7
ppt课件 8
(4)过渡态理论
ppt课件 9
ppt课件 10
ppt课件 67
习题
ppt课件 68
7.6 分散层对电极反应速率的影响
• ψ1效应:分散层电势 ψ1对电子转移步骤反应速度的 影响。 –Tafel曲线不是直线 –k、J0是电势的函数,也是支持电解质浓度的函 数
ppt课件 13
(8)电荷转移的微观理论
• 建立在量子力学和统计热力学基础之上 • 电子迁移的Marcus理论在电化学研究中已有广泛的
Tafel曲线
• lg|J|对于η作图所得半对数极化曲线称为Tafel曲线
阴极极化 Tafel曲线
• β可通过斜率得到,J0可pp通t课件过截距得到 41
(3) 低过电势下的近似公式:线 性极化公式
• η<12mV或J<0.5J0时,可使用线性极化公式,误 差<1%
• 线性极化公式的误差受传递系数影响较大,相对而 言,Tafel公式适用条件基本不受传递系数影响。
电化学原理
高鹏 哈尔滨工业大学(威海)
ppt课件
1
第7章 电化学极化
• 7.1 电化学动力学理论基础 • 7.2 电极动力学的Butler-Volmer模型 • 7.3 单电子反应的电化学极化 • 7.4 多电子反应的电极动力学 • 7.5 电极反应机理的研究 • 7.6 分散层对电极反应速率的影响 • 7.7 平衡电势与稳定电势
• 精细平衡原理:平衡时体系中每一个基元反应在 正、逆两个方向进行反应的速率相等。 – 在复杂反应中如果有一个决速步骤,则它必然 是逆反应的决速步骤。
ppt课件 6
v v v0
(3)绝对电流密度与交换电流密度
ppt课件 7
ppt课件 8
(4)过渡态理论
ppt课件 9
ppt课件 10
ppt课件 67
习题
ppt课件 68
7.6 分散层对电极反应速率的影响
• ψ1效应:分散层电势 ψ1对电子转移步骤反应速度的 影响。 –Tafel曲线不是直线 –k、J0是电势的函数,也是支持电解质浓度的函 数
ppt课件 13
(8)电荷转移的微观理论
• 建立在量子力学和统计热力学基础之上 • 电子迁移的Marcus理论在电化学研究中已有广泛的
大学化学第二章电势和电池热力学课件

E S nF ( T ) p
E ( T ) p E ( T ) p
电池的温度系数
>0 电池放电时从环吸收热量 =0 电池放电时与环境无热交换 <0 电池放电时向环境放出热量
RT lnK = -∆G θ = nFE θ E HG TS
nF
T
T
R
体系对外所做的最大非体积功等于体系自由能的减少
TS 0 lim QC 43kJ
R
-G = W非 = nFE
可逆电池热效应
(3) 实际的可逆性
因为所有真实过程都有一定的速度,所以 它们不可能具有严格的热力学上的可逆性。然 而,实际上它们可以以这样一种方式进行,以 至于在所期望的某一准确度下,一些热力学方 程式可以适用。在这种情况下,可以称这些过 程为可逆过程
可逆电池 = 化学可逆 + 热力学可逆
等温可逆
等压可逆 等容可逆
2、可逆性和吉布斯(Gibbs)自由能
体系自由能的减少等于体系对外所做的 最大非体积功。
可逆时体系对外所做的非体积功最大
-G = W非 = W电 = nFE 实例 反应 Zn + 2 AgCl → Zn2+ + 2Ag + 2 Cl- 以三种不同方式进行
充电: 阳极
阴极:
PbSO4 2H2O PbO2 4H SO42 2e PbSO4 2e Pb SO42
Zn│H+ , SO42-│Pt
电池放电时
负极: Zn → Zn2+ + 2 e
正极: 2 H+ + 2 e → H2 电池反应是: Zn + 2H+ → H2 + Zn2+ 电池充电时 负极: 2 H2O → O2 + 4H+ + 4e(在铂电极上)
大学化学课件第七章-氧化还原与电化学

中性介质 +H2O ----2OH-
+H2O ----2H+
返回
第二节 原电池与电动势
一、原电池 二、原电池的电动势 三、电极电势 四、电动势E与ΔG的关系 五、能斯特公式
返回
一、原电池
1、原电池的定义 2、原电池的组成 3、原电池的半反应式 4、原电池的电池图解
1、原电池的定义
既然氧化还原反应是电子转移的反应,就有可 能在一定的装置中利用氧化还原反应获得电流。
3、氧化还原电对
一个氧化还原反应由二个半反应组成,例如:
Zn + Cu2+ = Zn2+ + Cu 写成二个半反应:
Zn = Zn2+ + 2e
Cu2+ + 2e = Cu
每个半反应由同一元素的两个不同氧化数的物质 构成的电对组成,例如:
Zn2+/Zn 电对; Cu2+/Cu 电对— 氧化还原电对
MnO
4
Mn 2
离子---电子法
第三步,配平两个半反应
M
n
O
4
8H
5e
Mn 2
4H 2O
S
O
2 3
H
2O
S
O
2 4
2H
2e
第四步,根据电子得失数相等原则,将两个半反应组
合成一个方程
2
M
n
O
4
5 S O 32
16 H
5H 2O
2Mn 2
氧化型 + Z e -
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
M(s)
Mn+(aq)+ ne
由于在金属与溶液间的界面处形成双电层结构,电 极电势产生了。
27
双电层结构的电极电势为绝对电极电势。
2.影响电极电势的因素 电极电势的大小与以下因素有关:
(1)电极物质的本性; (2)电极物质离子的浓度或气体的分压; (3)温度。
28
5.3.2 标准电极电势
1.标准氢电极的作用 无法直接测出表面电势和相间电势→不能确
4
5.1 氧化还原反应 5.1.1 氧化还原反应 5.1.2 氧化还原电对 5.1.3 氧化还原反应方程式的配平
5
5.1.1 氧化还原反应
1.定义
元素的氧化值发生了变化的化学反应。
2.特点
Sn2+ + Fe3+ → Sn4+ + Fe2+
(1)存在着氧化剂与还原剂;
(2)存在着氧化态与还原态。
Ox(氧化态)+ ne 还原 Red(还原态)
20
5.2.2 原电池的符号表示
1.书写要求 (1) 负极写在左边,正极写在右边; (2)正负极之间用盐桥“‖”相接; (3)电极固体标志用一竖线“│”表示; (4)同相之不同物质间用“,”间隔; (5)若为离子时应注明其活度(浓度亦可); (6)若电对不含金属导体,则需加一惰性导体; (7)纯气体、液体或固体与惰性电极名称之间以
②
MnO4- / Mn2+; CO2 /H2C2O4
9
5.1.3 氧化还原反应方程式的配平
离子-电子法
1.配平原则:
①电荷守恒:反应过程中氧化剂与还原剂 得失电子数相等。
②质量守恒:反应前后各元素的原子总数相 等。
2.配平的具体步骤:
(1)写出离子方程式: MnO4-+SO32- + H+ → Mn2+ + SO42- +H2O
EΘ = E+Θ - E- Θ = EΘ H+/H2- EΘ Zn2+/Zn = 0 - EΘ Zn2+/Zn
∴ EΘ Zn2+/Zn =- 0.7618 V。
35
5.标准电极电势的物理意义: 标准电极电势表中,以标准氢电极为界,氢
以上电极的EΘ 均为负值,氢以下电极的EΘ均为 正值。
某电极的EΘ代数值愈小,表示此电对中还 原态物质愈易失去电子,即还原能力愈强,是较 强的还原剂;
Ag+ + e Fe3++ e
Ag Fe2+
EΘAg+ /Ag = + 0.7996 V EΘFe3+ /Fe2+ = + 0.771V
反应系统中较强的氧化剂是Ag+ ,较强的 还原剂是Fe2+ ,故反应正向(向右)进行。
40
(2)使用标准电极电势表注意事项:
1)电极反应均写ቤተ መጻሕፍቲ ባይዱ:Ox+ne
Red
其次,找出标准电极电势高的电对中的氧化态 (Br2 ), 和标准电极电势低的电对中的还原态 (Fe2+ ),此二者应是该自发反应的反应物。
故该反应正向(向右)自发进行。
39
例7 判断标准状态下反应Ag+ + Fe2+ Fe3+ 自发进行的方向。
Ag +
解 将此氧化还原反应拆成两个半反应,并 查出两个电对的标准电极电势:
23
5.2.3 电池电动势
1.定义 电池电动势是电池正负极之间的瞬时电势
差。(在接近零电流下所测定的电势差) 2.表示
电池电动势 E= E+ - EE+ ─ 某时刻正极的电势, E- ─ 某时刻负极的电势。
思考:为什么手电筒电光愈用愈暗?
因为其电池电动势愈用愈低。
24
5.2.4 电极类型
1.金属-金属离子电极:Zn | Zn2+(c) 电极反应 Zn2+ + 2e → Zn
×2) MnO4- +8H+ + 5e = Mn2+ +4H2O + ×5) SO32- + H2O = SO42- + 2H+ + 2e
2MnO4-+5SO32-+6H+ = 2Mn2++5SO42-+3H2O
例2 配平下列氧化还原反应:
H2S + H2SO3 → S + H2O H2S - 2e → S + 2H+ ① H2SO3 + 4H+ + 4e → S + 3H2O ②
(4) EθH+/ H2 =0.0000V
30
(5)标准氢电极的组成式(电极符号)
铂黑上吸附的H2与溶液中的H+建立如下动 态平衡:
2H+(aq) + 2e
H2(g)
标准氢电极的组成式可表示为: Pt,H2(100kPa)∣H+(a=1)
31
3.标准电极电势
(1)定义 处于标准态下的电极的电势称为该电极的
若电极的EΘ代数值愈大,表示此电对中氧 化态物质愈易得到电子,即氧化能力愈强,是较 强的氧化剂。
36
6. 标准电极电势表及其应用
附录:常见的氧化还原电对的标准电极电势 (1)标准电极电势与氧化还原反应的关系 1)对比两个氧化还原电对的标准电极电势的
大小,便可知道此氧化还原反应在标准态 时谁是氧化剂,谁是还原剂。
38
例6 判断标准状态时下列氧化还原反应自发
进行的方向:2Fe2++Br2
2Fe3++2Br-。
解 首先,将此氧化还原反应拆成两个半反应,
并查出这两个电对的标准电极电势:
Fe3++ e
Fe2+
EΘFe3+ /Fe2+ = + 0.771V
Br2 + 2e
2Br- EΘBr2 /Br- = + 1.087 V
标准电极电势(standard electrode potential), 用符号Eθ表示。 (2)标准态
溶液活度为1 , 或气体压力为100kPa , 液体 和固体为纯净物。
32
4.标准电极电势的测定 电池电动势 EΘ= E+Θ - E-Θ
首先和标准氢电极组成原电池,其次确定被测电极是正 极还是负极。
EΘFe3+/Fe2+ =EΘ =0.771V.
式中E 的右下角注明了参加电极反应物质的氧 化态和还原态,上角的Θ表示标准状态。
34
又:标准锌电极与标准氢电极组成原电池: (-) Zn | Zn2+(1.0)‖H+(1.0) | H2(100kPa), Pt (+) 测得此原电池的电动势EΘ =0.7618 V,由于
无论反应物是电对中的氧化态,还是其还原态,
氧化还原电对的EΘ的符号不变。
2Fe3+ + Sn2+ → 2Fe2+ + Sn4+
EΘ Fe3+ /Fe2+ = + 0.771V
定电极电势的绝对值。 实际中选定一个标准电极,将其电极电势定
义为零,即可确定其它电极的电极电势。 IUPAC规定,采用标准氢电极作为基准电极。
29
2.标准氢电极的组成
Standard Hydrogen Electrode, SHE
(1)海绵状铂黑作电 极导体;
(2)H2压力维持 100kPa;
(3)H+活度为1 (1.184mol·L-1);
25
5.3 电极电势 5.3.1 电极电势的产生 5.3.2 标准电极电势 5.3.3 Nernst方程式
26
5.3 电极电势
5.3.1 电极电势的产生 1.电极的双电层结构
+++++ +++++
+++++ +++++
----- -----
-----
---
(a)溶解>沉积
(b)沉积>溶解
图-2 双电层的形成
22
(2)电极组成:
正极:Pt│MnO4- (c1),Mn2+(c2),H+ (c3) 负极:Pt, O2 (p)│ H2O2 (c4), H+ (c3)
(3)电池符号:
(-)Pt, O2 (p)│ H2O2 (c4), H+ (c3)‖ MnO4- (c1),Mn2+(c2),H+ (c3) │ Pt(+)
(2)将反应拆分为氧化和还原两个半反应式: 还原反应: MnO4-→ Mn2+ 氧化反应: SO32- → SO42-
(3) 配平:使半反应两边的原子数和电荷数相等
MnO4- +8H+ + 5e = Mn2+ +4H2O SO32- + H2O = SO42- + 2H+ + 2e
11
(4) 使两个半反应得失电子数为其最小公倍 数,合并成一个配平的离子反应式:
Fe3+ + e → Fe2+ Sn2+ → Sn4+ + 2e 氧化-还原反应的实质: 两个共轭电对之间的电子转移反应。
8
3.电对拆分:
2MnO4-+5H2C2O4 + 6H+ → 2Mn2+ + 10CO2 + 8H2O
MnO4- + 8H+ + 5e → Mn2+ + 4H2O ①
H2C2O4 → 2CO2 + 2H+ + 2e
3Cl2(g)+ 6OH- = 5Cl- + ClO3-+ 3H2O 3Cl2(g)+ 6NaOH = 5NaCl + NaClO3+ 3H2O
5.2 原电池 5.2.1 原电池的概念 5.2.2 原电池的符号 5.2.3 电池电动势 5.2.4 电极类型
