南京理工大学无机化学2003
南京理工大学博士毕业发表论文规定-2005

南理工研〔2005〕4号南京理工大学关于对博士研究生发表学术论文要求的规定根据《南京理工大学博士、硕士学位授予工作细则》的要求,博士研究生在学期间至少在国际正式期刊或国内核心期刊上发表三篇与学位论文有关的学术论文,且对其中的一篇提出了更高的要求(以下简称“高水平论文”),并以文件《南京理工大学博士学位授予细则补充规定》(以下简称“补充规定”)的形式下发执行。
根据“补充规定”的执行情况,为了便于博士生在学习和科研过程中更准确地掌握申请学位时对发表学术论文的要求,校学位评定委员会对博士学位申请人发表学术论文的要求进行了细化和修订,现公布如下:博士学位申请人在学期间在国际正式期刊或国内核心期刊上至少发表三篇与学位论文有关的学术论文,其中至少有一篇为高水平论文,国内核心期刊目录以南京理工大学科学技术处《国内期刊投向指南》为准。
高水平论文必须符合以下条件之一:1、被SCI、EI、SSCI检索。
2、在国际正式期刊上发表。
3、在选定的中国科协所属一级学会直接主办的期刊上发表(刊物目录见附件一)。
4、在学位评定分委员会提出的其它期刊上发表(刊物目录见附件二,本条规定的期刊仅适用于属于本学位评定分委员会所属学科的博士学位申请人)。
此外,博士生符合以下条件之一者,经个人申请、导师同意、学位评定分委员会初审、校学位评定委员会批准,在申请学位时可减少或免除对发表学术论文的要求:1、博士生参加了省部级以上科研项目,承担了相对独立的重要任务,由于保密等原因,无法将研究成果公开发表,但研究成果通过省部级以上鉴定或者获得省部级以上奖励,认定有较大学术价值。
2、博士生参加了导师指定的科研项目,承担了相对独立的重要任务,经审查认定博士生在该项目中取得了创造性的成果且不能公开发表相关的学术论文。
本规定从发布之日起实行。
为保持对学位申请者发表学术论文要求的连贯性,2005年6月31日以前投稿的学术论文可以参照“补充规定”的要求执行。
附件:1、选定的中国科协所属一级学会直接主办的期刊目录。
中科院《无机化学》2005-2012考研真题及答案(很清晰)

中国科学院研究生院2012年招收攻读硕士学位研究生入学统一考试试题科目名称:无机化学考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
一、选择题 ( 共20题,每题2分,共40分 )1.下列各氧化物中,金属的原子轨道中不存在单电子的是:(A) Mn 3O 4 (B) Fe 3O 4 (C) Pb 3O 4 (D) Cr 2O 32. 根据软硬酸碱理论,下列金属离子中,最软的酸是:(A) Zn 2+ (B) Ca 2+ (C) Mn 2+ (D) Ni 2+3.下列金属中,与汞不能生成汞齐合金的是:(A) Zn (B) Ag (C) Fe (D) Cu4. 主量子数n=4, m s =1/2时,可允许的最多电子数为:(A) 6 (B) 16 (C) 12 (D) 85. 下列叙述正确的是:(A) 在复合反应中,反应级数与反应分子数必定相等(B) 通常,反应活化能越小,反应速率常数越大,反应越快(C) 加入催化剂,使正反应和逆反应的活化能减小相同的倍数(D) 反应温度升高,活化分子数减低,反应加快6. 下列含氧酸盐中热稳定性最差的是:(A) K 2CO 3 (B) ZnCO 3 (C) CaCO 3 (D) Na 2CO 37. 下列离子半径从小到大顺序正确的是:(A) Li +< Na +< Mg 2+<F -<S 2- (B) Li +< F - < Na + < Mg 2+<S 2-(C) Li +< Na + < F -< S 2- < Mg 2+ (D) Li +< Mg 2+ < Na + < F -<S 2-8. 下列物种中,键角最小的是:(A) NO 2- (B) NO 2 (C) NO 2+ (D) N 2O9. H 2O 2既可作氧化剂又可作还原剂,下列叙述中错误的是:(A) H 2O 2可被氧化生成O 2 (B) H 2O 2可被还原生成H 2O(C) pH 变小,H 2O 2的还原性也增强 (D) pH 变小,H 2O 2的氧化性增强10. 在Y X 2208923292 的放射衰变中,发射出的α粒子和β粒子数为:(A) 3α和2β (B) 5α和3β (C) 5α和5β (D) 3α和3β11. 下列物质中, m f H 不等于零的是:(A) O(g) (B) Fe(s) (C) C(石墨) (D) Ne(g)12. 已知 ϕ(Cr 2O 72-/Cr 3+)> ϕ(Fe 3+/Fe 2+)> ϕ(Cu 2+/Cu)> ϕ(Fe 2+/Fe),则上述诸电对的各物种中最强的氧化剂和最强的还原剂分别为:(A) Cr 2O 72-,Fe 2+ (B) Fe 3+,Cu (C) Cr 2O 72-,Fe (D) Cu 2+,Fe 2+13. 关于V 2O 5的下列叙述中错误的是:(A)是酸性氧化物 (B)是无色晶体 (C)具有强氧化性 (D)可作为催化剂14. 室温下用CCl 4萃取I 2的分配系数D =2I C (CCl 4 )/2I C (H 2O), CCl 4萃取AtI 的分配系数D1=C AtI (CCl 4)/ C AtI (H 2O),则:(A) D>D1 (B) D<D1 (C) D=D1 (D)无法确定15. 对于常见分子筛的成分中,硅铝比越大,下列说法正确的是:(A) 耐酸性强,热稳定性差 (B) 耐酸性差,热稳定性差(C) 耐酸性强,热稳定性强 (D) 耐酸性差,热稳定性强16. 仅用一种试剂,即可将Ag +, Hg 2+, Zn 2+, Fe 3+ , Ni 2+ 五种离子区分开,这种试剂可选用:(A) H 2S (B) Na 2S (C) NaCl (D) NaOH17.锰的下列物种能在酸性溶液中发生歧化反应的是:(A) MnO 42- (B) MnO 2 (C) MnO 4- (D) Mn 2+18. 下列叙述错误的是:(A) Ce(OH)3在空气中易被氧化生成黄色的Ce(OH)4(B) Ce 4+的价电子构型为4f 0(C) 镧系元素草酸盐是难溶的(D) 钍和铀是人工放射性元素19. 下列混合物中,可以制成温度最低的制冷剂体系是:(A) 水+甘油 (B) 水+食盐 (C) 冰+氯化钙 (D)水+冰20. 对于下列基元反应 A + 2 B → C ,其速率常数为 k ,若某一个时刻(时间以 s 计)A 的浓度为 2 mol · L -1,B 的浓度为 3 mol · L -1,则反应速率 υ=:(A) 6k mol · L -1 · s -1 (B) 18k mol · L -1 · s -1(C) 12k mol · L -1 · s -1 (D) 36k mol · L -1 · s -1二、填空题 ( 共 5题,共30分 )21. (每空1分)相同温度,压力,体积下,两种气体(1,2)的摩尔质量分别为M 1和M 2(M 1>M 2)试比较,物质的量1 _____ 2,质量1_____ 2,平均动能1 _____ 2,平均速度 1 _____ 2,密度 1 _____ 2。
无机化学专业课大纲南京理工 (1)

南京理工大学813无机化学参考教材:大连理工大学无机化学教研室主编《无机化学》第五版配套指导书:大连理工大学无机化学教研室主编《无机化学学习指导》教材大纲说明:此份大纲并非学校所给,而是本人根据半年来的复习总结所得,结合历年真题自己划定的一些考点与重点,目的是方便大家学习,重点复习考试内容,对于不考的知识点仅作了解即可,这样可以节约大量时间,提高效率,以便取得高分。
第一章气体1.1 理想气体状态方程注意公式中每个参量的单位,气体的密度和摩尔质量公式要能自己推倒出来。
两个例题都要看1.2 气体混合物分压定律和分体积定律,三个例题都要看课后习题2.3.9第二章热化学2.1 热力学的术语和基本概念仅作了解,虽然不考,必须要看2.2 热力学第一定律也属于基本知识,都要重点关注2.3 化学反应的反应热所有内容都要重点对待,特别是标准摩尔生成焓,常考的选择题2.4 Hess定律 2.5 反应热的求算往年计算题常考内容两个例题都要看懂。
课后习题2.8.9.14第三章化学动力学基础3.1 化学反应速率的概念仅作了解3.2 速率方程重点放在3.2.1上,各级反应的单位要记清楚 3.2.2和3.2.3仅作了解,但是半衰期要看。
3.3 Arrhenius方程重点放在3.3.2方程其应用上3.4 反应速率理论和反应机理简介只用看P58中间部分3-12与下面的图3-8 图3-9,其他有兴趣就看,没时间不用看3.5催化剂与催化作用只用看3.5.1课后习题不用做,这一章考的少,只考选择题和填空题。
大家记下那些考点即可。
第四章化学平衡熵和Gibbs函数计算题必考章节,一定要重点关注4.1 标准平衡常数基础知识,必须了解,三个例题都要看4.2 标准平衡常数的应用重点章节,必须搞懂例题4-4重点关注,要明白为什么那么设置x的原因是简化计算,并掌握此种方法4.3 化学平衡的移动重点章节,记住结论即可,例题可不用看4.4 自发变化和熵重点放在4.4.2和4.4.3上,一定要明白其含义,选择题常考。
南京理工大学考研初试参考书
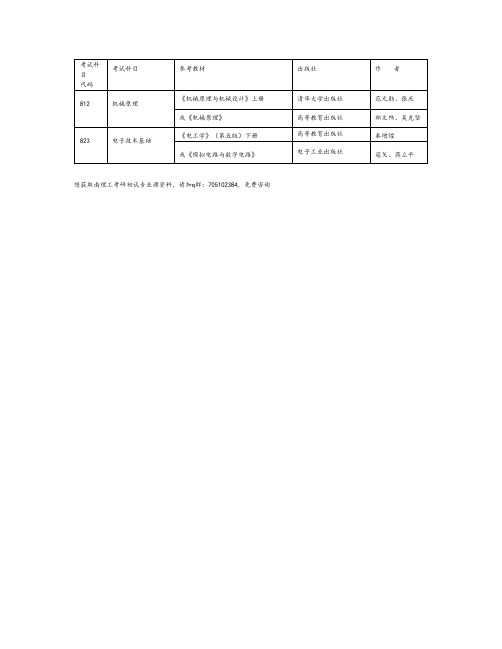
考试科目代码
考试科目
参考教材
出版社
作者
617
毛泽东思想与中国特色社会主义理论体系概论
《毛泽东思想和中国特色社会主义理论体系概论》(2018 修订版)
高等教育出版社
公共教材
871
马克思主义基本原理
国家马克思主义理论研究和建设工程重点教材,《马克思主义基本原理概论》(2018 年修订版)
高等教育出版社
大学语文
华东师范大学出版社
徐中玉等
现代汉语
高等教育出版社
黄伯荣、廖序东
253
英语(二外)
《现代大学英语》(1-4 册)
外语教学与研究出版社
杨立民等
624
基础日语
新编日语(重排版)(1-4)
上海外语教育出版社
周平、陈小芬
高级日语(1-2)
上海外语教育出版社
吴侃、村木新次郎
858
日语翻译
日汉翻译教程
上海外语教育出版社
人民教育出版社
中日合编
252
德语(二外)
《新编大学德语》(第二版)(1-3)
外语教学与研究出版社
朱建华等
623
基础英语
《现代大学英语》(1-6 册)
外语教学与研究出版社
杨立民等
《高级英语》(第三版)
张汉熙
857
翻译与写作
《实用翻译教程(英汉互译)》(第 3 版)
上海外语教育出版社
冯庆华
《英语写作手册》
中国人民大学出版社
高鸿业
828
管理学原理
《管理学教程》(2011 年)第 3 版
上海财经大学出版社
周健临
829
会计学
南理工-无机化学核心考点--基础知识点框架梳理及其解析

无机化学核心考点基础知识点框架梳理及其解析第一章气体1.1理想气体状态方程式理想气体状态方程式及其应用★1.2气体的分压定律分压定律与应用★(标★号是考试重点)本章包括四个小节,理想气体状态方程式,气体混合物,气体分子运动论,真实气体。
其中前两个小节是考试的重点,理想气体状态方程式及应用,分压定律及应用。
后两小节基本不考在复习每一个知识点的过程中,首先要了解知识点,熟悉教材内容、分析教材例题,并注意应用条件,最后再通过本讲义如下内容对应的例题,从分析、解题、注意易错点到完成老师布置的作业完成相应知识点的掌握过程知识点一理想气体状态方程PV nRT各物理量的单位:压力P-Pa;体积V-dm3;气体摩尔数n- mol;气体常数R- 8.314 J.mol-1.K-1;绝对温度T-K.如在标况下1摩尔气体,压力,温度,体积一般有如下关系P=101325 Pa; V =22.4 dm3;T=273.15 k;从中可以算出:R=PV/nT=101325*22.4/1*273.15=8.314 J.mol-1.K-1.知识点二分压定律一个容器内有几种混合气体,相互间不发生化学反应的条件下,总压强 P总与各种气体的分压Pi之间有如下关系:P总= P1 + P2 + P3 +...+ Pn对于理想气体,容易得证:n总=n1 + n2 + n3 +. ... + nn左边: P总= n总RT/V右边 = n1*RT/V +n2*RT/V+...+nn*RT/V= [n1+n2+...+nn]*RT/V= n 总*RT/V = 左 边例题:某容器中含有NH3、O2 、N2等气体的混合物。
取样分析后,其中n (NH3)=0.320mol ,n (O2)=0.180mol ,n (N2)=0.700mol 。
混合气体的总压p =133.0kPa 。
试计算各组分气体的分压解:n= n (NH3)+n (O2)+n (N2)=0.320mol+0.180mol+0.700mol=1.200mo l30.320() 1.200NH b b ==0.3201.200ⅹ133.0kPa =35.5 kPa22(O )(O )n p p n= =0.1800.320ⅹ35.5kPa =20kPa223()()()N NH p p p p o =--=(133.0-35.5-20)kPa=75.5 kPa总结这一章知识点比较简单,先熟悉课本,把例题弄明白,再分别做两道课后习题巩固一下看课本例题1-2,1-3,1-4课后习题做1,3,9,12••第二章 热化学• 2.1热力学的术语和基本概念• 2.2热力学第一定律• 热力学第一定律★、焓变和热化学方程式★、Hess 定律★知识点一• 学习本章首先注意几个基本概念• 系统(封闭系统,敞开系统,隔离系统),环境,状态• 过程(定温过程,定压过程,定容过程),相,反应进度知识点二热力学第一定律• 1.热和功的概念与比较• 2.热力学第一定律对于封闭系统热力学第一定律为:U Q V ∆=+3.焓与焓变在定压过程中焓 H U pV =+ 状态函数焓变 21H H H ∆=- p Q H =∆吸热反应H ∆>0, 放热反应H ∆<0• 4.热化学方程式书写原则 (看课本)5.标准摩尔生成焓• 在温度T 下,由参考状态单质生成物质B(νB=+1)的标准摩尔焓变,称为物质B 的标准摩尔生成焓• 标准摩尔燃烧焓• 在温度T 下, 物质B (νB= -1)完全氧化成指定产物时的标准摩尔焓变,称为物质B 的标准摩尔燃烧焓6 Hess 定律化学反应不管是一步完成还是分几步完成,其反应热总是相同的 例:已知298.15K 下,反应:(1)22()()()C s O g CO g +=(1)rHm ∆=-393.5/kJ mol(2) 2212()()()CO s O g CO g +→计算298.15K 下,CO 的标准摩尔生成焓 应用:1.利用方程式组合计算•总结•看课本例题2-1,2-2•课后习题做2,3,8,11,21•这一章中hess定律比较重要,考的几率比较大,要熟练掌握,会计算。
南京理工大学 无机化学 周宝晶 lec-10 氢原子的薛定谔方程和原子轨道

10
自旋(Spin)量子数 ms / the 4th Quantum Number
11
Spin, A Brief History
• 1921: Stern-Gerlach Experiment (SGE) • January 1925: Pauli had proposed that the
electron should be given an additional fourth quantum number which was a half integer
5
l (角量子数)
0, 1, 2, .. n-1
ml (磁量子数)
-l..0..+l
Total # of orbitals in lth subshell = 2 l + 1
主量子数 n / Principal Quantum Number
• The principal qs the principal shell (壳层) of the orbital. • Higher n means higher energy.
l=3
l=2 l=1 l=0 对单电子原子,如 氢,E不受l 影响 对多电子原子: E ns E np E nd
0703化学招生单位(一级学科)(1)

是否研究生院是否985是否自划线是否有博士点是是是是是是是是是是是是否否否是是是是是是是是是是否否是否否否是是是是是是是是是否否否是是否否是是否否是是否否是否否否是否否否是否否否是否否否是否否否是是是是是是是是是否否否是否否否是否否否是否否否是否否否是否否否是否否否是否否否是否否否是否否否是否否否是否否否否否否否是是是是是是是是是否否否否否否否否否否否是否否否是否否否否否否否否否否否否否否否否否否否是是是是是否否否是否否否是否否否否是否否是否否否否否否否否否否否否否否否是否否否是是是是是否否否是否否否是否否否是否否否是否否否否否否否否是是是是是是是是是是是是是否否是否否否是是是否是否否否是否否否是否否否是否否否是否否否是是否否是是是是是否否否是是是是是是否否是是否否是是否否是否否否是否否否否否否否是否否否是否否否是否否否是否否否否否否否是是是是是否否否是否否否是否否否否否否否否否否否是否否否是是是是是否否否是否否否否否否否是否否否否否否否否是是是是否否否是否否否是否否否是否否否否否否否是否否否是否否否否否否否否否否否是否否否否是是是是否是否是是否否是否否否是否否否否否否否否否否否否否否否是否否否是否否否是否否否否否否否否否否否是否否否否否否否是否否否否否否否否否否否是否否否是否否否否是是是是是是是是否否否否是否否是否否否否否否否是否否否是否否否否否否否是否否否否否否否否否否否是否否否是否否否否是是是是是是是是否否否否否否否是否否否是否否否是是是否是是是是是否否否是否否否是是是是是否否否是否否否是否否否是否否否是否否否是否否否是否否否否否否否是否否否否否否否否是是是是否否否是是是是是否否否是否否否否否否否是否否否否否否否是否否否是否否否是否否否否否否否是否否否是否否否否否否否是是是是是是是是是否否否是否否否否是否否是否否否是是是是是否否否是否否否是否否否是否否否否否否否否否否否是否否否是否否否是否否否否。
南京理工大学 无机化学 周宝晶 lec-3 化学动力学基础

14
二级反应 / Second-Order Reactions
A product rate = k [A]2 D[A] rate = Dt
rate = k [A]2 or rate = k [A][B] rate M /s = k= 2 = 1/M•s 2 M [A] 1 1 D[A] 2 = + kt = k [A] [A] [A]0 Dt
19
T 1 T2 TT 1 2
Temperature Dependence of the Rate Constant (sec. 3.3)
• 气体分子动理论: gas molecules frequently collide with each other
13
First-order reaction
A # of half-lives 1 2 3 4 product
[A] = [A]0/n 2 4 8 16
• The half-life of a first-order reaction is independent of the initial concentration of the reactant
[A] is the concentration of A at any time t [A]0 is the concentration of A at time t=0
[A] = [A]0exp(-kt)
ln[A] = ln[A]0 - kt
11
The reaction 2A B is first order in A with a rate constant of 2.8 x 10-2 s-1 at 800C. How long will it take for A to decrease from 0.88 M to 0.14 M ? ln[A] = ln[A]0 - kt [A]0 = 0.88 M [A] = 0.14 M ln [A]0 [A] k = ln
