直接胆红素测定试剂盒 (胆红素氧化酶法)产品技术要求豪迈
直接胆红素测定试剂盒(钒酸盐氧化法)产品技术要求meigaoyi

直接胆红素测定试剂盒(钒酸盐氧化法)适用范围:用于体外定量测定人血清中直接胆红素的浓度。
1.1包装规格a) 试剂1:2×60ml,试剂2:2×15ml;b) 试剂1:4×60ml,试剂2:4×15ml;c) 试剂1:3×80ml,试剂2:3×20ml;d) 试剂1:2×40ml,试剂2:2×10ml;e)试剂1:2×400ml,试剂2:2×100ml;f)试剂1:2×72ml,试剂2:2×18ml;g)试剂1:12×16ml ,试剂2:12×4ml;h)试剂1:1×40ml,试剂2:1×10ml。
1.2 主要组成成分试剂1主要组成成分:柠檬酸缓冲液(pH 2.0-4.0 ) 100mmol/L,曲拉通3mmol/L试剂2主要组成成分:磷酸缓冲液 10mmol/L,钒酸钠 4mmol/L 2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡褐色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白测定试剂空白吸光度,应≤0.5。
2.4 分析灵敏度测试300 umol/L的被测物时,吸光度变化(ΔA)应不低于0.055。
2.5 准确度与比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,样本浓度在(1,396)umol/L区间内,测定结果相关性(r)≥0.975 在[30,396)umol/L区间内相对偏差≤15%,在(1,30)umol/L绝对偏差≤4.5umol/L。
2.6 重复性变异系数(CV)应不超过5%。
2.7 线性2.7.1在(1,396) umol/L范围内,线性回归的确定系数应不低于0.990;2.7.2 [30,396) umol/L范围内,相对偏差≤15%;2.7.3 (1,30) umol/L范围内,绝对偏差≤10umol/L。
BS-300试剂规格 - 迈瑞

液体双剂型
120ml(3*30;1*30)
总胆汁酸(TBA)测定试剂盒
(第5代)循环酶法
液体双剂型
60ml(1*45;1*15)
总胆固醇(TC)测定试剂盒
氧化酶法
液体单剂型
300ml(6*50)
甘油三酯(TG)测定试剂盒
氧化酶法
液体单剂型
Glu-G:氧化酶法
液体单剂型
300ml(6*50)
葡萄糖(Glu)测定试剂盒
Glu-H:己糖激酶法
液体双剂型
300ml(4*50;2*50)
高密度脂蛋白-胆固醇(HDL-C)测定试剂盒
直接法(不受干扰物质影响)
液体双剂型
120ml(3*30;1*30)
低密度脂蛋白-胆固醇(LDL-C)测定试剂盒
300ml(6*50)
总蛋白(TP)测定试剂盒
双缩脲法
液体单剂型
300ml(6*50)
尿酸(UA)测定试剂盒
氧化酶法
液体单剂型
300ml(6*50)
尿素(UREA)测定试剂盒
紫外-谷氨酸脱氢酶法
液体双剂型
250ml(4*50;2*25)
无
机
离
子
类
钙(Ca)测定试剂盒
液体双剂型
60ml(1*45;1*15)
免疫球蛋白A(IgA)测定试剂盒
免疫透射比浊法(无需样品预稀释)
液体双剂型
60ml(1*40;1*20)
免疫球蛋白G(IgG)测定试剂盒
免疫透射比浊法(无需样品预稀释)
液体双剂型
血清直接胆红素测定标准操作规程

血清直接胆红素测定标准操作规程1.检验原理:(机酸盐法)pH值接近3时,在锐酸盐和表面活性剂的作用下,胆红素被氧化成胆绿素。
此时,胆红素特有的黄色减少,在波长450nm处通过测定帆酸作用前后的吸光度的差可以求得样品中直接胆红素的浓度。
胆红素佩姗/表面活性剂>胆绿素3.样本要求新鲜无溶血血清,勿使用肝素抗凝血浆。
22〜25C保存8小时,2〜8℃保48小时,-20℃保存7天,样本不可反复冻融!4.检验方法:仪器法(详见DF-603∕DI-600标准操作规程)5.参考范围:6.检验结果的解释6.1样本含量超出线性范围时,建议用0.9%(W∕V)的氯化钠溶液稀释样本。
通常稀释2倍,当样本浓度较大时提高稀释倍数。
6.2单位换算:mg∕dL=umol∕L×0.05857检验方法的局限性6.1结果的准确性依赖于仪器的校正和测定温度、时间的控制。
7.2若试剂浑浊或以水空白在450nm处吸光度大于0.500时不能使用。
8.产品性能指标8.1线性范围:在给定的样本/试剂比例和条件下测定时,本世纪线性范围可达0-320umol∕Lo8.2试剂空白吸光度:在45Onm处,光径ICm时,空白吸光度AW0.500,△A空白/分钟WO.002.8.3准确度:相对偏差≤10%<.8.4精密度8. 4.1批内精密度CV≤3%8. 4.2批间精密度:R≤10%8.5分析灵敏度:在给定的样本/试剂比例和条件下测定时,IUmOl/L的直接胆红素对应的4A不低于1.5×IO-3内。
9.7方法比较:本试剂盒与商品化试剂盒测定40个样本测定结果相关性如下:y=1.052χ-1.254;r=0.9989.临床意义:在肝细胞内质网中,胆红素结合成水溶性的胆红素双葡糖醛酸酯,能和重氮试剂直接反应,故称直接胆红素。
它和总胆红素同时测定可作为黄疸的鉴别依据。
16. 直接胆红素标准操作规程(DBIL-SOP)

前言为使临床检验操作规范化,指导检验人员严格按规程进行正确的常规操作,保证检验质量,特制定本操作规程。
本规程的编写遵循了ISO 15189《医学实验室——关于质量和能力的特殊要求》及WS/T 227-2002《临床检验操作规程编写要求》的有关规定并结合产品实际情况制订,作为本产品的标准操作程序。
本规程从2007年5月2日起实施,每2年复审1次。
本规程由浙江伊利康生物技术有限公司编制。
本规程起草单位:伊利康生物技术有限公司技术部。
本规程主要起草人:蒙凯、蔡其浩。
本规程首次起草。
目录1 检验申请 (3)2 标本采集与处理 (3)3 试剂及成份 (4)4方法原理 (4)5 仪器 (4)6 校准液及校准模式 (4)7质控品与室内质控规则 (4)8标本检测步骤 (5)9 结果计算 (5)10 操作性能 (5)11试剂使用的注意事项 (5)12参考范围及医学决定水平 (5)13检验结果的报告及范围 (5)14临床意义 (6)15结果审核分析以及相关项目的联系 (6)16威胁生命的“紧急值”及报告规定. (6)17有关引用程序与文件 (6)18参考文献附录A XXX型生化分析仪参数直接胆红素测定标准操作规程1.检验申请单独检验项目申请:血清直接胆红素(缩写DBIL)测定;组合项目申请:肝功能测定项目组合。
临床医生根据需要提出检验申请。
2.标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后。
体检对象抽血前应有两周的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2标本采集2.2.1除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带,不抗凝,置普通试管中。
多项生化校准品产品技术要求senmeixikema
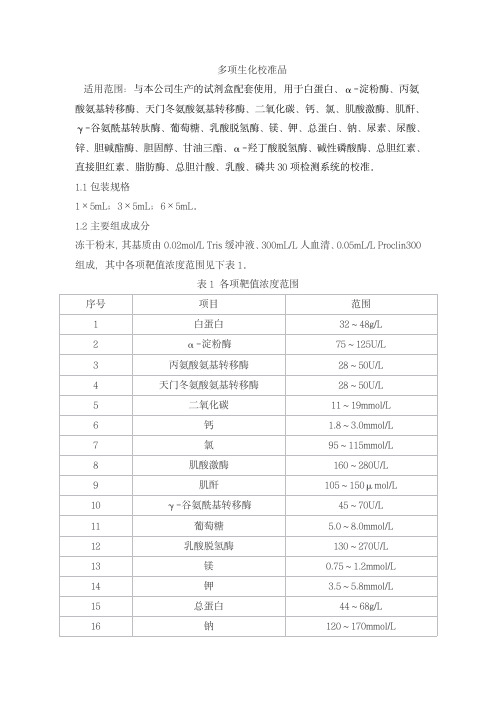
多项生化校准品适用范围:与本公司生产的试剂盒配套使用,用于白蛋白、α-淀粉酶、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、二氧化碳、钙、氯、肌酸激酶、肌酐、γ-谷氨酰基转肽酶、葡萄糖、乳酸脱氢酶、镁、钾、总蛋白、钠、尿素、尿酸、锌、胆碱酯酶、胆固醇、甘油三酯、α-羟丁酸脱氢酶、碱性磷酸酶、总胆红素、直接胆红素、脂肪酶、总胆汁酸、乳酸、磷共30项检测系统的校准。
1.1包装规格1×5mL;3×5mL;6×5mL。
1.2主要组成成分冻干粉末,其基质由0.02mol/L Tris缓冲液、300mL/L人血清、0.05mL/L Proclin300组成,其中各项靶值浓度范围见下表1。
表1各项靶值浓度范围校准品靶值批特异,详见说明书。
2.1外观和性状2.1.1各组分应齐全、完整、无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2开封前应为白色或淡黄色冻干粉。
2.1.3复溶后应为浅黄色溶液,无浑浊,无未溶解物。
2.2准确度见表2:表2准确度要求2.3重复性变异系数(CV)应不超过10%。
2.4批内瓶间差变异系数(CV)应不超过10%。
2.5量值溯源根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源情况见表3:表3溯源情况2.6稳定性2.6.1复溶稳定性复溶后的校准品在2℃~8℃条件下密闭避光保存,其中:1)二氧化碳可稳定6小时;2)胆红素可稳定6小时;3)其余项目可稳定1天。
各项目检测结果应符合2.2、2.3之规定。
复溶后的校准品在-20℃条件下密闭保存,可以稳定15天,应符合2.2、2.3之规定。
2.6.2效期稳定性该产品在2℃~8℃条件下密闭贮存有效期为24个月,取效期末的产品进行检测,应符合2.2、2.3之规定。
胆红素的检测的现实意义

成都中医药大学2011年秋季学期期末考试立题格式论据行文结论总分得分姓名:学号:班级:胆红素检测的前景概况摘要:近年来,健康问题逐渐成为人们最关注的问题之一。
健康保健,健康体检逐渐成为人们生活中不可缺少的一部分。
在这些检查中,也不断地反映出一些情况来。
为了方便找出更有效的各种疾病的诊断、治疗方法,了解胆红素与人体各种疾病的关系便变得势在必行。
而血清胆红素在各种疾病诊断、治疗、及预后工作中的就显得尤为重要了。
血清胆红素浓度的测定在疾病诊断中也扮演着极其重要的角色,无论是肝功检测还是心血管疾病的诊断检测,血清胆红素都可作为一个很有力的参考依据。
于是,提高检测的灵敏度和特异度便可通过分析比较各种检测方法,找出精准度相对较高的检测方法或者寻找到更好的检测方法。
关键字:胆红素;重氮法;化学氧化法;KHC3法正文:胆红素(英文:Bilirubin)是胆色素的一种,它是人胆汁中的主要色素,呈橙黄色,同时也是内源性抗氧化活性的生物还原剂,它是血红蛋白分解代谢的一种产物[1],即它是体内铁卟啉化合物的主要代谢产物,有毒性,可对大脑和神经系统引起不可逆的损害,但也有抗氧化剂功能,可以抑制亚油酸和磷脂的氧化。
胆红素是临床上判定黄疸的重要依据,也是肝功能的重要指标。
胆红素有游离胆红素和结合胆红素两种形式,结合胆红素不存在分子内氢键,可以直接与重氮试剂结合,生成紫红色偶氮化合物,因此又称直接胆红素,游离胆红素存在分子内氢键[2],不能直接与重氮试剂结合,必须先用乙醇或尿素破坏氢键,才能与重氮试剂反应,因此又称间接胆红素。
正常人每天产生250-350mg的胆红素,其中70%是衰老红细胞血红蛋白血红素的降解产物,即衰老细胞被单核吞噬细胞系统破坏,释放出血红蛋白,再被分解成珠蛋白和血红素。
胆红素裂解成胆绿素,胆绿素还原成胆红素,即游离胆红素。
肝脏可以有效地摄取血浆游离胆红素,并将其转化成结合胆红素,提高其极性和水溶性,使其易于随胆汁排入肠道。
直接胆红素(DBIL)测定试剂盒(钒酸盐氧化法)产品技术要求ldm

直接胆红素(DBIL)测定试剂盒(钒酸盐氧化法)适用范围:本产品用于体外定量测定人血清中直接胆红素的含量。
1.1 规格试剂1(R1):5×60mL,试剂2(R2):5×15mL;试剂1(R1):4×80mL,试剂2(R2):4×20mL;试剂1(R1):3×40mL,试剂2(R2):3×10mL;试剂1(R1):2×80mL,试剂2(R2):2×20mL;试剂1(R1):2×400mL,试剂2(R2):2×100mL;试剂1(R1):1×20mL,试剂2(R2):1×6mL;1.2试剂组成表1 试剂组成2.1 外观液体双试剂:试剂1(R1)为无色澄清液体,试剂2(R2)为浅黄绿色澄清液体。
2.2 装量液体试剂的净含量不得低于标示体积。
2.3空白吸光度在37℃、450nm波长、1cm光径条件下,试剂空白吸光度<0.1ABS。
2.4分析灵敏度浓度为100umol/L,吸光度变化范围在(0.07-0.2)之间。
2.5线性范围在[1-430]umol/L线性范围内,线性相关系数r2≥0.995。
在(150–430]umol/L,范围内的相对偏差≤15%;测定结果[1-150]umol/L时绝对偏差≤22.5umol/L。
2.6精密度试剂盒测试项目精密度 CV<5%。
2.7批间差不同批号之间测定结果的相对偏差应<10%。
2.8准确度回收率:回收率80%-120%。
2.9稳定性原包装试剂,在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其准确度和线性,试验结果满足2.5、2.8的要求。
肝功多项检测卡(微流控干化学法)产品技术要求参考版

医疗器械产品技术要求:肝功多项检测卡(微流控干化学法)适用范围:本产品与本公司的干式生化分析仪配套使用,用于体外定量测定人静脉全血、末梢全血、血浆、血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、L-γ-谷氨酰基转移酶(GGT)、白蛋白(ALB)、总蛋白(TP)、碱性磷酸酶(ALP)、总胆红素(TBIL)、直接胆红素(DBIL)共8项的含量。
1.1包装规格10人份/盒。
1.2主要组成成分每盒包括10人份检测卡密封袋、1张信息卡(NFC卡,内含标准曲线信息)。
每人份检测卡密封袋含有1张检测卡和1个干燥剂。
检测卡:由载有化学试剂的固相聚合物载体组成;化学试剂成分如表1所示。
表1肝功多项检测卡(微流控干化学法)主要组成成分2.1外观试剂盒外观应整洁,各组分齐全,文字、符号标识清晰、内容完整。
2.2空白限用空白样本加入检测卡测试,各指标空白限应满足以下要求,见表2。
表2肝功多项检测卡(微流控干化学法)空白限要求2.3准确度2.3.1用有证参考物质作为样本进行检测,碱性磷酸酶(ALP)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、L-γ-谷氨酰基转移酶(GGT)、总胆红素(TBIL),其相对偏差在±15%范围内;白蛋白(ALB)、总蛋白(TP),其相对偏差在±10%范围内;2.3.2使用标准溶液作为样本进行检测,直接胆红素(DBIL)回收率在85%~115%范围内。
2.4线性检测卡线性须满足以下要求,见表3表3肝功多项检测卡(微流控干化学法)线性要求2.5精密度2.5.1重复性测试血清样本或质控样本的变异系数(CV)应满足:碱性磷酸酶(ALP)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、L-γ-谷氨酰基转移酶(GGT)、总胆红素(TBIL)、直接胆红素(DBIL)均应不大于10.0%;白蛋白(ALB)、总蛋白(TP)均应不大于5.0%。
索莱宝BC5185总胆红素(TBIL)含量检测试剂盒说明书
总胆红素(TBIL)含量检测试剂盒说明书微量法货号:BC5185规格:100T/96S产品内容:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件试剂一液体30mL×1瓶4℃保存试剂二液体10mL×1瓶4℃保存产品说明:总胆红素(Total bilirubin,TBil)是直接胆红素和间接胆红素的总和。
血清总胆红素的测定是肝、胆功能检查中的一项重要检测项目。
能准确地反映黄疸的程度,对临床诊断隐性黄疸有重要意义。
在表面活性剂的存在下,总胆红素能被亚硝酸钠氧化,生成胆绿素。
通过检测450nm下波长变化,可计算出总胆红素的含量。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计/酶标仪、低温离心机、可调式移液器、微量玻璃比色皿/96孔板、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)血清、血浆等液体样本:直接测定。
若有浑浊可以离心后取上清进行测定。
二、测定步骤1、分光光度计/酶标仪预热30min以上,调节波长至450nm,分光光度计蒸馏水调零。
2、按下表步骤加样(在EP管或者96孔板上加入下列试剂):试剂名称(μL)测定管空白管样本20蒸馏水20试剂一240240充分混匀,37℃避光孵育5min,测定450nm处吸光度,分别记为A1测定、A1空白试剂二6060充分混匀,37℃避光反应5min,测定450nm处吸光度,分别记为A2测定、A2空白;ΔA测定=A1测定-A2测定;ΔA空白=A1空白-A2空白。
空白管只需测1-2次。
(使用比色皿反应时,第一步5min反应完成将液体倒入比色皿比色后,可直接在比色皿中加入试剂二混合均匀反应5min直接进行测定;使用96孔板反应时,可以将上述试剂直接加入96孔板中反应第一步的5min,之后直接加入试剂二进行第二步反应)三、TBIL含量计算1、计算公式(1)使用96孔板:TBIL含量(μmol/L)=874.67×(ΔA测定-ΔA空白)+10.699(2)使用微量比色皿:TBIL含量(μmol/L)=491.98×(ΔA测定-ΔA空白)+18.478注意事项:1、胆红素见光易分解,测定时要尽量避光。
直接胆红素测定试剂盒(钒酸盐氧化法)产品技术要求baiding

直接胆红素测定试剂盒(钒酸盐氧化法)适用范围:本试剂用于体外定量测定人血清中直接胆红素的含量。
1.产品型号/规格产品组成:2.1 外观2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为浅黄色透明液体,无混浊,无未溶解物。
2.1.3 校准品为浅黄色冻干粉,溶解后为黄色液体,无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 含水量校准品冻干粉含水量≤3%。
2.4 试剂空白吸光度A≤0.080(光径1.0cm,546nm±20nm 波长)。
2.5 分析灵敏度测定20μmol/L样本,吸光度变化在0.02~0.04范围内。
2.6 线性区间2.6.1 [1,342]μmol/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.6.2 [1,10]μmol/L范围内,线性绝对偏差应不超过±1μmol/L;(10,342]μmol/L范围内,线性相对偏差应不超过±10%。
2.7 精密度2.7.1 重复性变异系数CV≤5.0%。
2.7.2 批内瓶间差试剂盒内校准品瓶间差CV≤5.0%。
2.7.3 批间差批间相对极差≤6.0%。
2.8 准确度回收率在(100±10)%范围内。
2.9 稳定性2.9.1 校准品冻干粉复溶后在2℃~8℃避光保存稳定4天,测定结果应符合2.8要求。
2.9.2 原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.1、2.4、2.5、2.6、2.7.1、和2.8要求。
直接胆红素测定试剂盒(钒酸盐氧化法)产品技术要求北京科美生物

直接胆红素测定试剂盒(钒酸盐氧化法)适用范围:本试剂盒用于体外定量测定人血清中直接胆红素(DBiL)的浓度。
1.1 包装规格1)试剂1:2×60mL,试剂2:2×15mL;2)试剂1:5×60mL,试剂2:5×15mL;3)试剂1:2×80mL,试剂2:2×20mL。
1.2 主要组成成分试剂1:酒石酸缓冲液(87mmol/L)试剂2:磷酸缓冲液(4.4mmol/L),偏钒酸纳(2mmol/L)2.1 外观2.1.1试剂1应为无色或淡黄色透明溶液,无混浊,无未溶解物。
2.1.2试剂2应为无色或淡黄色透明溶液,无混浊,无未溶解物。
2.2 净含量液体试剂的净含量应不少于标示值。
2.3 试剂空白吸光度DBiL试剂盒在主波长450nm/副波长546nm处测定试剂的吸光度值,应不大于0.0500。
2.4 分析灵敏度DBiL试剂盒测试样本浓度为30µmol/L时,吸光度差值(△A)应不小于0.0200。
2.5 准确度用本公司DBiL试剂盒和已上市DBiL试剂盒同时测定40个临床样本,相关系数(r2)应不小于0.95,在(0,30]μmol/L区间内,绝对偏差应不超过±3μmol/L;在(30,340]μmol/L区间内,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性重复测试(4.8±2)μmol/L和(40±5)μmol/L的样本,所得结果的变异系数CV 应不大于5%;2.6.2批间差测试(40±5)μmol/L的样本,所得结果的批间相对极差应不大于10%。
2.7 线性范围DBIL试剂盒在(0,340]μmol/L范围内,线性相关系数(r)应不小于0.990;2.7.1在(0,30]μmol/L区间内,线性绝对偏差应不超过±3μmol/L;2.7.2在(30,340]μmol/L区间内,线性相对偏差应不超过±10%。
D-Bil 文档,直接胆红素(D-Bil钒酸盐氧化法)标准操作规程

1、方法依据:深圳迈瑞生物医疗电子股份有限公司直接胆红素(D-Bil钒酸盐氧化法)测定方法2、适用范围:适用于人血清直接胆红素(D-Bil)的测定。
3、试剂仪器:3.1 试剂:深圳迈瑞生物医疗电子股份有限公司原装试剂盒。
3.2未开启的试剂盒在2℃~8℃保存有效期为一年。
试剂开瓶后应避光保存,在2℃~8℃可稳定28天。
试剂不可冰冻。
3.3 仪器:迈瑞BS-2000M全自动生化分析仪.4、操作程序4.1方法原理直接胆红素在pH3.0附近,以及钒酸盐和表面活性剂存在下,可以被氧化成胆绿素。
与此同时,胆红素特有的黄色也随之消失。
测定胆红素氧化前后吸光度的差,可以计算出样品中直接胆红素的浓度。
4.2样本要求新鲜血清,样本收集后应尽快测定,必须避光保存。
避免溶血。
4.3上机操作4.3.1试剂装载、校准、样品和质控血清分析操作详见“《迈瑞BS-2000M全自动生化分析仪标准操作、维护、保养规程》”。
4.3.2 校准:4.3.2.1 标准液的准备:校准品使用迈瑞医疗国际股份有限公司配套冻干品,按说明书要求稀释后分装,-20℃冷冻保存,用前提前15分钟从冰箱中取出,复溶到室温后上机检测。
4.3.2.2 校准程序:首次使用校准。
当有以下情况时需重新校准:1)换试剂批号或出现质控漂移时;2)当仪器做完保养后;3)仪器进行零件更换时。
每次试验前用准备好的校准品进行校准,校准通过后进行检测。
4.3.2.3 质控:在标本开始之前做质控,质控通过后方能进行标本的检测。
4.3.3 测试基本参数4.4参考范围1.7~6.8 mol/L(0.1~0.4 mg/dL)(注:各实验室应有自己的参考范围。
)4.5 方法评价线性范围:1~430 μmol/L。
样本中含量超出可报告范围,请用生理盐水稀释后测定,结果乘以稀释倍数。
反应曲线异常时应进行重复测定确认。
精密度:批内CV ≤ 5.0%批间CV ≤ 6.0%分析灵敏度:本试剂盒的检测低限1 μmol/L。
直接胆红素测定试剂盒(钒酸盐氧化法)产品技术要求beijian

直接胆红素测定试剂盒(钒酸盐氧化法)
适用范围:本产品用于体外定量测定人血清中直接胆红素的含量。
1.1 规格
具体产品规格见下表:
(p H2.6) 0.1mol/L
试剂2:
磷酸盐缓冲液(pH7.0) 10 mmol/L
偏钒酸盐 4.0mmol/L
2.1 外观
2.1.1 外包装完整无破损;
2.1.2 试剂1:无色澄清透明液体;
2.1.3 试剂2:无色或淡黄色澄清透明液体。
2.2 净含量
净含量不低于标示值。
2.3 试剂空白吸光度
在主波长450nm、副波长546nm、37℃条件下,试剂空白吸光度小于0.2。
2.4 线性
2.4.1 线性范围
[3.0,340.0]μmol/L,相关系数r>0.990。
2.4.2 线性偏差
(50.0,340.0]μmol/L线性范围内,相对偏差不超过±10%;
[3.0,50.0]μmol/L线性范围内,绝对偏差不超过±5.0μmol/L。
2.5 分析灵敏度
检测浓度为126.5μmol/L的样本时,吸光度变化不小于0.01。
2.6 重复性
测试高、低浓度的新鲜人血清样本或质控品,重复测试至少10次,CV≤10%。
2.7 批间差
用三个不同批号的试剂测试同一样本,重复测试3次,相对极差R≤10%。
2.8 准确度
回收率在85%~115%范围内。
2.9 稳定性
原包装试剂2~8℃避光储存,有效期12个月。
效期后1个月内产品,检测结果应符合2.3、2.4和2.8的要求。
直接胆红素测定的标准操作程序

直接胆红素(DBIL)测定的标准操作程序【应用范围】体外检测血清、血浆DBIL浓度测定。
【适用仪器】Olympus AU-27全自动生化分析仪。
【程序改变】严格遵循仪器、试剂说明书及校准品使用说明。
【方法学原理】在PH2.9环境中,表面活性剂和偏钒酸盐与直接胆红素作用形成胆绿素,胆红素的减少引起在波长450nm处吸光度的下降,吸光度的变化与直接胆红素的含量成正比。
【试剂】溶液A(R1):酒石酸缓冲液PH 2. 90.1 mmol/L表面活性剂稳定剂70mmol/L溶液B(R2):偏钒酸盐4mmol/L磷酸盐缓冲液PH7.010mmol/L稳定剂2.校准品:DiaSys TruCal U。
3.质控品:Randox Assayed Multiseral Level 1 and Level 2.【标本收集与准备】1.血清或血浆标本根据实验室标准采集程序采集标本,适用标本为血清或肝素抗凝血浆(肝素钠抗凝结果高0.5mmol/l),不可从正在静脉滴注手臂上采血,上机标本不能有凝块,样品采集后2天内离心标本,分离血清,血清或血浆标本室温保存4天,冷藏7天,冷冻保存6个月。
【操作步骤】1. 仪器测定参数设置2. 试剂准备:将准备好的试剂置仪器试剂盘中(8C )。
3. 校准校准物的准备:将校准物从冰箱取出,冻干校准物按说明书加入蒸馏水复溶,轻轻颠倒混匀3次,不可用力震摇,室温放置30分钟至完全溶解;液体校准物从冰箱取出,室温放置15分钟以平衡至室温。
校准物的选择尽可能选择配套仪器厂家校准品。
亦可将校准液复溶后分装保存于-20C 冰箱中,每周校准一次或更换试剂批次后进行校准。
上机校准程序:[1] 选择用户菜单USERCalibrationStart Entry 进入输入界面。
[2] 用光标键选欲校准项目,。
确认后按叵互。
⑶将校准品按屏幕显示放入绿色校准架相应位置,将校准架置入进样轨道,按▲开始。
【参考范围】血清/血浆DBIL : 1.7-6.8 mol/L 【临床意义】D.Bil 临床上多用于黄疸的诊断和黄疸性质的鉴别。
直接胆红素测定方法及试剂盒[发明专利]
![直接胆红素测定方法及试剂盒[发明专利]](https://img.taocdn.com/s3/m/5996c45f1fb91a37f111f18583d049649a660e59.png)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 201811105221.X(22)申请日 2018.09.21(71)申请人 武汉中太生物技术有限公司地址 430073 湖北省武汉市东湖新技术开发区高新二路388号武汉光谷国际生物医药企业加速器1.1期6号楼1-3层(72)发明人 陈莹 (74)专利代理机构 武汉河山金堂专利事务所(普通合伙) 42212代理人 胡清堂(51)Int.Cl.G01N 33/72(2006.01)G01N 21/31(2006.01)(54)发明名称直接胆红素测定方法及试剂盒(57)摘要本发明公开了一种直接胆红素测定方法及试剂盒,其中直接胆红素测定方法是利用氧化酶和其底物反应生成过氧化氢,再使过氧化氢和过氧化物酶反应释放氧气,将溶液中的直接胆红素氧化成胆绿素,进而使得吸收峰在450nm处发生下降,记录下降程度计算得出直接胆红素含量。
本发明采用价格便宜、易于获得且稳定性良好的能够产生过氧化氢的其他氧化酶及其底物替代直接胆红素氧化酶,相对于原直接胆红素氧化酶的测定方法,成本大大降低,且检测方法所得的实验数据证实其分析灵敏度、准确性和重复性俱佳,检测试剂的使用安全性高,对环境的污染小,具有较好的实用性。
权利要求书1页 说明书3页 附图1页CN 109541238 A 2019.03.29C N 109541238A1.一种直接胆红素测定方法,其特征在于:利用氧化酶和其底物反应生成过氧化氢,再使过氧化氢和过氧化物酶反应释放氧气,将溶液中的直接胆红素氧化成胆绿素,进而使得吸收峰在450nm处发生下降,记录下降程度计算得出直接胆红素含量。
2.根据权利要求1所述直接胆红素测定方法,其特征在于:所述氧化酶和其底物分别为葡萄糖氧化酶和葡萄糖,尿酸酶和尿酸,胆固醇氧化酶和胆固醇,肌氨酸氧化酶和肌氨酸,乳酸氧化酶和乳酸,酒精氧化酶和甲醇,抗坏血酸氧化酶和抗坏血酸,胆碱氧化酶和胆碱,丙酮酸氧化酶和丙酮酸。
总结总、直接胆红素的检测方法

总结总、直接胆红素的检测⽅法⾎清总胆红素和直接(结合)胆红素测定⽬前测定⾎清胆红素的⽅法主要有重氮试剂法(包括改良J-G法、⼆甲亚砜法、⼆氯苯重氮盐法和2,5⼆氯苯重氮四氟硼酸盐法等)、胆红素氧化酶法、钒酸盐氧化法、⾼效液相⾊谱法、导数分光光度法、经⽪胆红素测定法以及直接分光光度法等。
改良咖啡因(J-G)法:⼀、实验原理⾎清中结合胆红素可直接与重氮试剂反应,⽣成紫⾊的偶氮胆红素;在同样条件下,未结合胆红素须有加速剂破坏胆红素氢键后才能与重氮试剂反应。
咖啡因、苯甲酸钠作为加速剂,醋酸钠缓冲液可维持反应的PH值同时兼有加速作⽤。
叠氮钠破坏剩余重氮试剂,终⽌结合胆红素测定管的偶氮反应。
最后加⼊碱性酒⽯酸钠,在碱性条件下,紫⾊偶氮胆红素转变为蓝⾊偶氮胆红素,使最⼤吸光度由530nm转移到598nm,此时,⾮胆红素的黄⾊⾊素及其它红⾊与棕⾊⾊素产⽣的吸光度可忽略不计,使测定的灵敏度和特异性增加。
最后形成的绿⾊是由蓝⾊的碱性偶氮胆红素和咖啡因与对氨基苯磺酸之间形成的黄⾊⾊素混合⽽成。
⼆、实验⽅法(⼀)器材试管,刻度吸管,分光光度计,37℃⽔浴箱。
(⼆)试剂1.咖啡因-苯甲酸钠试剂⽆⽔醋酸钠41g,苯甲酸钠37.5g,⼄⼆胺四⼄酸⼆钠EDTANa2 0.5g,溶于约500mL 的蒸馏⽔中,再加⼊咖啡因25g,搅拌⾄完全溶解(不可加热),然后加蒸馏⽔稀释⾄1000mL,混匀,过滤后放置棕⾊试剂瓶中,室温保存可稳定6个⽉。
2. 5g/L 亚硝酸钠溶液:亚硝酸钠5.0g,加蒸馏⽔溶解并稀释⾄100mL,若发现溶液呈淡黄⾊时,应丢弃重配。
3. 5g/L 对氨基苯磺酸溶液:对氨基苯磺酸(NH2C6H4SO3H·H20)5.0g,加于约800mL 蒸馏⽔中,加浓盐酸15mL,待完全溶解后,加蒸馏⽔⾄1000mL。
4. 重氮试剂临⽤前,取5g/L 亚硝酸钠溶液(试剂2)0.5mL 与5g/L 对氨基苯磺酸溶液(试剂3)20mL 混合。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
直接胆红素测定试剂盒(胆红素氧化酶法)
适用范围:本试剂用于体外定量测定人血清中直接胆红素[DBIL]的浓度。
1.1包装规格
1.2主要组成成分
本试剂由试剂1(R1)和试剂2(R2)组成
试剂1(R1):
邻苯二甲酸盐缓冲液 120mmol/L
NaF(氟化钠) 2.5mmol/L NAC (N-乙酰半胱氨酸) 2.5mmol/L
对甲苯磺酸钠 50mmol/L EDTA 2g/L 叠氮钠 0.5g/L 试剂2(R2):
Tris缓冲液 100mmol/L 胆红素氧化酶 3KU/L
酶稳定剂k-80 4g/L
叠氮钠0.5g/L 2.1 外观
试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰;R1试剂应为无色澄清液体,R2试剂应为无色或淡黄色澄清液体。
液体试剂不得有沉淀和絮状物。
2.2 净含量
用通用量具测量,液体试剂的净含量应不少于标示值。
2.3 试剂空白
在450nm处测定试剂空白吸光度,应≤0.050A。
2.4 分析灵敏度
测试50umol/L的被测物时,吸光度变化(ΔA)应不低于0.005A。
2.5 准确性
在样品中加入一定体积的纯品,计算回收率,应介于90%~110%之间。
2.6 重复性
用两个水平的样本检测,检测结果批内变异系数(CV)应不超过5%。
2.7 线性
2.7.1在[0.2,342]umol/L范围内,线性相关系数r应不低于0.990;
2.7.2 在[0.2,34.2)umol/L范围内绝对偏差不超过±
3.4umol/L;
[34.2,342]umol/L范围内相对偏差不超过±10%。
2.8 批间差
对同一份样品进行重复测定,相对极差≤10%。
2.9 稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取到效期后的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7的要求。
