生物型硬脑膜补片
生物型硬脑膜补片在眼睑重建与结膜囊成形术中的应用研究的开题报告

生物型硬脑膜补片在眼睑重建与结膜囊成形术中的应用研究的开题报告一、研究背景及意义眼睑和结膜囊是构成眼部外部形态的重要组成部分。
眼睑缺损、结膜囊缺失或畸形会严重影响视觉、美观和生活质量。
传统的眼睑重建和结膜囊成形术通常采用自体或异体的组织移植或充填材料,但存在损伤供体区、手术后感染和移植物缩小等问题。
因此,寻求一种安全、高效、成本低的替代方法具有重要的临床意义。
生物型硬脑膜补片具有良好的生物相容性和组织相似性,已经在神经外科等领域广泛应用。
但在眼睑重建和结膜囊成形术中的应用尚未充分研究。
二、研究目的本研究旨在探讨生物型硬脑膜补片在眼睑重建与结膜囊成形术中的应用效果和安全性,为临床提供新的替代方法,为患者恢复良好的视觉和生活质量提供技术支持。
三、研究内容1. 收集眼睑重建和结膜囊成形术的病例,并进行术前评估和术后随访;2. 应用生物型硬脑膜补片进行眼睑重建和结膜囊成形术,记录手术方式、手术难度和手术时间等;3. 对手术效果进行评价,包括手术恢复期、切口愈合、眼睑外形恢复和结膜囊成形效果等;4. 统计手术并发症,如感染、移植物排斥反应、移植物缩小等;5. 对数据进行统计分析,评估生物型硬脑膜补片在眼睑重建和结膜囊成形术中的应用效果和安全性。
四、研究方法1. 对符合入选标准的患者开展前瞻性、单臂、单中心临床试验;2. 术前评估包括眼睑外形评估、眼球位置评估、视力等级评估、结膜囊大小评估等,术后随访时间为6个月,其中1个月、3个月、6个月各进行一次随访;3. 手术时采用生物型硬脑膜补片进行修复,手术方式根据缺损情况选用不同的方法,如眼轮医术、松解术、移植术等;4. 按照手术效果进行等级评定,优、良、中、差分别对应手术效果非常满意、满意、一般和不满意;5. 统计并分析手术并发症和不良反应的发生率和影响因素。
五、研究预期结果1. 生物型硬脑膜补片在眼睑重建和结膜囊成形术中的应用能够实现良好的手术效果;2. 通过对手术并发症和不良反应的统计分析,评估生物型硬脑膜补片在眼睑重建和结膜囊成形术中的安全性;3. 为患者提供一个新的、便捷、安全的眼睑重建和结膜囊成形术的选择。
一种硬脑膜补片、制备方法及在硬脑膜损伤修复中的应用[发明专利]
![一种硬脑膜补片、制备方法及在硬脑膜损伤修复中的应用[发明专利]](https://img.taocdn.com/s3/m/b9bf101e2bf90242a8956bec0975f46527d3a7b4.png)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 201611246006.2(22)申请日 2016.12.29(71)申请人 北京桀亚莱福生物技术有限责任公司地址 101101 北京市通州区云景东路68号(72)发明人 孙继煌 石清东 吴文华 (74)专利代理机构 北京路浩知识产权代理有限公司 11002代理人 王文君(51)Int.Cl.A61L 27/50(2006.01)A61L 27/36(2006.01)(54)发明名称一种硬脑膜补片、制备方法及在硬脑膜损伤修复中的应用(57)摘要本发明提供一种硬脑膜补片及其制备方法。
所述硬脑膜补片是由脱细胞异体真皮基质制成的。
所述脱细胞异体真皮基质是由异体皮经过交联处理、蛋白酶溶液消化处理、含表面活性剂的高渗盐溶液脱细胞处理、DNA降解处理、氨基酸营养处理、冷冻干燥获得。
本发明还提供所述硬脑膜补片在制备治疗硬脑膜损伤的修复材料中的应用。
本发明的脱细胞异体真皮基质取材于人体皮肤组织,经特殊的理化、生化处理,去除了可能引起免疫排异反应的所有成份,完整地保留了原有组织的纤维立体支架结构,植入后很快有新生血管和成纤维细胞长入,取得了良好的临床效果。
权利要求书2页 说明书11页 附图9页CN 106581770 A 2017.04.26C N 106581770A1.一种脱细胞异体真皮基质,其特征在于,其是由异体皮经过交联处理、蛋白酶溶液消化处理、含表面活性剂的高渗盐溶液脱细胞处理、DNA降解处理、氨基酸营养处理、冷冻干燥获得。
2.如权利要求1所述的脱细胞异体真皮基质,其特征在于,所述脱细胞异体真皮基质的顶破强度≥20kPa、缝合强度≥18N、拉伸强度为4.0MPa-6.5MPa、拉伸伸长率为10%-15%。
3.一种脱细胞异体真皮基质的制备方法,其特征在于,包括如下步骤:步骤一,将异体皮原料投入盛有交联剂溶液的容器中,浸泡;步骤二,将浸泡原料取出,投入盛有生理盐水溶液容器中浸泡,得半成品A;步骤三,将半成品A投入盛有蛋白酶溶液的容器中,浸泡振荡处理,得半成品B;步骤四,将半成品B投入盛有含有表面活性剂和高渗盐溶液的容器中,超声浸泡处理;更换表面活性剂和高渗盐溶液,超声浸泡处理;重复该操作多次,得半成品C;步骤五,将半成品C用生理盐水浸泡,振荡处理,得半成品D;步骤六,将半成品D投入盛有DNA水解酶溶液的容器中,浸泡处理,得半成品E;步骤七,将半成品E用生理盐水浸泡振荡处理,得半成品F;步骤八,将半成品F取出,用氨基酸溶液浸泡后,投入盛有生理盐水溶液容器中,静置,得半成品G;步骤九,将半成品G取出,置于冷冻干燥机内进行冷冻干燥,得半成品H;步骤十,将半成品H取出,包装,灭菌,得成品I。
2022年上半年我国生物型硬脑(脊)膜补片行业领先企业冠昊生物主营业务收入构成情况及优势分析

在产品类型方面,冠昊生物的硬脑(脊)膜补片产品主要包括传统硬脑(脊)膜补片、生物型硬脑(脊)膜补片和可吸收硬脑(脊)膜补片。 其中,生物型硬脑(脊)膜补片产品销售收入为4.4亿元,占比83.33%,这表明冠昊生物的生物型硬脑(脊)膜补片产品在市场上的认 可度较高。
不同地区收入分析
1.冠昊生物上半年收入构成分析
在2022年上半年,我国生物型硬脑(脊)膜补片行业的领先企业冠昊生物的主营业务收入构成情况及其 优势值得关注。报告内容将根据主题《关于市场,2022年上半年我国生物型硬脑(脊)膜补片行业领先 企业冠昊生物主营业务收入构成情况及优势》进行撰写,以下为具体内容:
冠昊生物主营业务收入构成情况
1. 生物型硬脑(脊)膜补片产品:上半年收入为1.9亿元,占 比72.56%,为公司主要收入来源。 2. 其他业务:包括生物材料、医疗器械等,上半年收入为 0.75亿元,占比27.44%。
冠昊生物优势分析
1.冠昊生物上半年收入构成分析
在2022年上半年,我国生物型硬脑(脊)膜补片行业领先企业冠昊生物的主营业务收入主要由两部分构成:脑膜补片产品和生物 医用材料。
目录
上半年收入构成分析 营收概况 不同产品类别收入分析 不同地区收入分析 不同客户类型收入分析 未来收入增长点
上半年收入构成分析
Analysis of income composition in the first half of the year
上半年收入构成分析
冠昊生 物
2022年 上半年
冠昊生物的生物型硬脑(脊) 膜补片业务表现强劲
冠昊生物上半年收入构成分析 生物型硬脑(脊)膜补片业务收入 2022年上半年,冠昊生物的生物型硬脑(脊)膜补片业 务收入达到1.96亿元,占主营业务收入的一半以上。 这一数据表明,冠昊生物在生物型硬脑(脊)膜补片领域 的市场地位稳固,具有较强的竞争力。
生物型硬脑膜补片在神经外科手术中的应用

·5594·
中国老年学杂志 2012 年 12 月第 32 卷
意义。但目前研究认为,手术修补硬膜,封闭硬脑膜下腔,恢复 正常解剖结构,有利于降低癫痫、脑脊液漏等术后并发症的发 生,同时工硬膜 手 术 修 补 并 不 增 加 颅 内 感 染 的 概 率 。 不 同 种 类人工硬膜的术后感染率有所不同,即使同一种硬膜修补材料 的感染率也有不同报道,但与正常清洁开颅手术无显著相关。
生物型硬脑膜补片在神经外科手术中的应用
曹国彬 陈秀梅 沈少仪1 曹志恺1 方泽鲁 柯炎斌 陆永建 ( 广州医学院第二附属医院,广东 广州 510260)
〔关键词〕 人工硬脑膜; 生物材料; 脑膜补片; 脑膜缺损; 颅脑手术 〔中图分类号〕 R651. 1 + 5 〔文献标识码〕 A 〔文章编号〕 1005-9202( 2012) 24-5593-02; doi: 10. 3969 / j. issn. 1005-9202. 2012. 24. 125
2 于书卿,付 辉,郑细良,等 . 847 例胶原海绵人工硬脑膜的临床应 用〔J〕. 中华神经外科疾病研究杂志,2006; 5( 1) : 272-3.
3 Malliti M,Page P,Gury C,et al. Comparison of deep wound infection rates using a synthetic dural substitute( Neuro-Pateh) or perieranium grafl for daral closure: a clinical review of 1 year〔J〕. Neurosurgery,2004; 54 ( 3) : 599-604.
脑外科手术耗材xls - 杭州市第一人民医院杭州市妇幼保健院

Stryker 直径10mm
脑外科手术耗材 三维动态钛网
德国Stryker Leibinger GmbH & Co.KG
Stryker
40×40× 0.3mm
脑外科手术耗材 三维动态钛网
德国Stryker Leibinger GmbH & Co.KG
Stryker
90×90× 0.3mm
脑外科手术耗材 低切迹双Y异型板
北京天新福医疗器材有限公 司
天义福
50*70mm
脑外科手术耗材 人工硬脑膜
北京天新福医疗器材有限公 司
天义福
60*70mm
脑外科手术耗材 人工硬脑膜
北京天新福医疗器材有限公 司
天义福
70*90mm
脑外科手术耗材 脑外科手术耗材
YL-1型一次性使用颅内 血肿粉碎穿刺针
北京万特福科技有限责任公 司
万特福
脑外科手术耗材
Yasargil迷你型脑动脉 瘤夹
德国AESCULAP AG&CO.KG
70g,80g, 90g, 110g,
脑外科手术耗材 连发头皮夹
德国AESCULAP AG&CO.KG
FF013P
脑外科手术耗材
Yasargil标准型脑动脉 瘤夹
德国AESCULAP AG&CO.KG
110g, 90g, 150g, 180g, 200g,70g
Codman ETHISORB
Codman ETHISORB
Codman ETHISORB
Codman ETHISORB
Codman ETHISORB
4mm*6mm 6mm*14mm 2cm*3cm 4cm*6cm 6cm*14cm
脑外科手术耗材 颅颌面螺钉
生物型硬脑膜补片

二、 医疗器械(脑膜建)分类及原因
编码代号:6846植入材料和人工器官 分类编号: 6846-01 按人体接触性质分类:植入材料和人工器官 按接触时间分类:持久接触(C)(>30d) 管理类别:第 Ⅲ类
医疗器械分类及原因
什么是人工硬脑膜?
人的硬脑膜是脑组织表面一厚而坚韧的双层膜性组织,紧贴颅骨内 侧,是保护脑和防止脑脊液与外界交通的重要屏障。人工硬脑膜 (Artificial Dura Mater)是用生物材料制成人体脑膜的替代物, 用于因颅脑、脊髓损伤、肿瘤及其他颅脑疾病引起的硬脑膜或脊膜 缺损的修补,防止脑脊液外漏、颅内感染、脑膨出、脑粘连和疤痕 等严重并发症,以恢复其完整性。
由广东冠昊生物科技股份有限公司出具 所提交材料的清单 生产企业承担法律责任的承诺 加盖生产企业公章
谢谢!! 完
第Ⅲ类医疗器械
国家对于医疗器械有着严格的分类,而第Ⅲ类是最高级别的医疗器 械,也是必须严格控制的医疗器械,是指植入人体,用于支持、维 持生命,对人体具有潜在危险,对其安全性、有效性必须严格控制 的医疗器械。
人工硬脑膜属于第Ⅲ类医疗器械
医疗器械分类标准目录
医疗器械分类及原因
人工硬脑膜 (脑膜建)
相关生物学评价
皮肤致敏试验
选用18只白色豚鼠,随机分3组,鼠背去毛,三组动物分 别涂敷脑膜建(猪的心包膜)浸出液,冰醋酸及2.4-二硝 基氯苯。并于其后7天、14天重复涂敷,第28天对侧涂敷 上述各溶液,观察记录各鼠皮肤反应(红斑、水肿、水泡、 坏死)。
相关生物学评价
刺激或皮内反应——皮内注射试验
生物型硬脑膜补片 ——产品申报
应用生物型硬脑膜补片行义眼座暴露修补患者的围手术期护理

应用生物型硬脑膜补片行义眼座暴露修补患者的围手术期护理【摘要】目的探讨应用生物型硬脑膜补片行义眼座暴露修补的护理方法。
方法15例应用生物型硬脑膜补片行义眼座暴露修补患者于术前加强心理护理,做好术前准备,术后加强绷带加压包扎护理、疼痛的护理、眼部护理、注重病情观察及出院健康指导等护理。
结果15例患者顺利完成手术,手术后恢复良好,未发现植片有明显的脱落、感染、溶解、排异等并发症。
术后无再次出现义眼座暴露,义眼座活动度良好。
结论做好充分术前评估及准备,加强心理护理,细致的观察病情及详细的出院健康指导是保证手术成功的关键。
【关键词】生物型硬脑膜补片;义眼座暴露;护理眼球摘除术后眼窝凹陷,如果眶内未放置义眼座填充术后的空缺,会出现眼窝综合征,影响义眼的活动度及安装。
如何修复无眼球眼窝是眼部整形的重要课题之一。
近20年来义眼座植入术已在临床广泛开展并取得相当满意的效果。
但义眼座暴露仍是义眼座植入术后的主要并发症。
目前义眼座暴露的处理方法很多,但采用生物型硬脑膜补片行义眼座暴露修补是一种新的安全有效的手术方法[1]。
我院2007年10月至2010年10月15例义眼座暴露患者应用生物型硬脑膜补片行义眼座暴露修补手术,取得满意疗效,现报告如下。
1 资料与方法1.1 一般资料2007年10月至2010年10月义眼座暴露病例15例(15眼),其中男9例,女6例。
年龄26~48岁,平均30.5岁。
右眼10例,左眼5例。
眼球摘除联合Ⅰ期植入术后发生暴露6例,期义眼座Ⅱ植入后发生暴露9例。
眼球摘除原因:眼外伤8例,眼内炎3例,视网膜母细胞瘤4例。
义眼座暴露发生时间:术后3个月内5例,3个月至6个月4例,6个月至1年4例,1年以上2例。
1.2 材料的选择采用广东冠昊生物科技有限公司生产的生物型硬脑膜补片MⅡ型(商品名脑膜建),厚度为0.3~0.7 mm。
该材料以动物膜性组织为原料,经过多方位去抗原技术和组织诱导技术等处理加工而成。
生物型硬脑膜补片在脑外伤去骨瓣减压术的应用

12 手术方法 .
3 4例患者 分别于术后 3 2 ~1 个月 内行颅骨修补术 ,
缝合处 所有病例均急诊在全麻下行颅 内血肿清除 + 去骨瓣 术中发现人 工硬脑膜与正常硬脑膜 已完个愈合 , 已被层 自身组织部 分替代覆盖 、无不 良反应 。组织学检 减压术 。手术 中将硬脑膜 剪开,边缘尽可 能光滑 整齐 ,
者 因开颅去 骨 瓣减压 术 而采用人 工脑 膜进 行硬膜 修 补 ,对其 术后相 关并发 症及 其 随访 结果进行 分析 。 结
果 术后 1天 、7天及 出院前 均行 头颅 c T检 查 ,植 入人 工硬膜 的部位 未见异 常影像 学改 变。发现 患者 并 发 皮下局部 积液 1例 ,外 伤性 癫痫 1例 ,脑 积水 1例 ,迟发 性硬 膜外血 肿 1例 。无 颅 内感 染 、脑 脊液 漏 的发 生。3 4例患者分 别于术后 3~1 月内行 颅骨修补 术 ,术 中发现人 工硬脑膜 与正常硬脑 膜 已完个愈 2个 合 ,缝合 处 已被 层 自身组织 部 分替代 覆盖 、无不 良反应 。组织 学检 查提 示为 纤维 细胞构 成 。结论
,
‘ 在传统 的手术 中 ,由于颅 内压较高不 能缝合硬脑
科研 课题 :2 0 0 5年广州市 医药 卫生科技项 目,编号 :2 0 一 B 1 7 0 5 Y 一 4
5
维普资讯
国际医药卫生导报
20 年 08
第 1卷 4
第1 ( 0期 半月刊)
清除血肿或失活挫裂 的脑组织后 ,严格止血 ,用生理盐 查提 示为纤维 细胞构 成 。 水反复冲洗。确无出血 后,再根据骨 窗大小及脑压情况
3 讨 论
选用适当的人工硬膜修 补。 修补 时人工硬膜光面朝 向皮
生物型人工硬脑膜与自体膜在颅脑损伤硬膜修补术中的应用效果比较

生物型人工硬脑膜与自体膜在颅脑损伤硬膜修补术中的应用效果比较杨金理;欧小晶;冯志铁;黄开让;申隆【摘要】目的:比较生物型人工硬脑膜与自体膜在颅脑损伤硬膜修补术患者中的应用效果。
方法选取2012年3月至2015年2月在我院行硬脑膜修补术的126例颅脑损伤患者,按随机数表法分为甲组和乙组,每组各63例。
所有患者均采用硬膜修补术进行治疗,其中甲组使用生物型人工硬脑膜,乙组使用自体膜。
比较两组患者的并发症发生率、二期手术时间、二期手术出血量、硬膜外总引流量及预后。
结果甲组患者的并发症发生率为6.35%,明显低于乙组的23.81%,差异有显著统计学意义(P<0.01);甲组患者的二期手术时间为(75.89±21.53) min,明显短于乙组的(91.62±24.09) min,术中出血量为(70.85±17.36) mL,少于乙组的(83.64±20.89) mL,差异均统计学意义(P<0.05);两组患者的硬膜外总引流量相当,差异无统计学意义(P>0.05);甲组患者的GOS评分Ⅰ级5例,Ⅱ级1例,Ⅲ级12例,Ⅳ级10例,Ⅴ级35例;乙组GOS评分Ⅰ级7例,Ⅱ级0例,Ⅲ级13例,Ⅳ级11例,Ⅴ级32例,两组GOS评分比较差异均无统计学意义(P>0.05)。
结论与自体膜相比较,生物型人工硬脑膜在颅脑损伤硬膜修补术患者中应用能有效的降低并发症发生率,并为二期手术创造良好条件,但远期疗效则相差无异。
【期刊名称】《海南医学》【年(卷),期】2016(027)015【总页数】2页(P2521-2522)【关键词】生物型人工硬脑膜;自体膜;颅脑损伤;硬膜修补术;疗效【作者】杨金理;欧小晶;冯志铁;黄开让;申隆【作者单位】阳江市人民医院综合神经外科广东阳江 529500;阳江市人民医院内三科广东阳江 529500;阳江市人民医院综合神经外科广东阳江 529500;阳江市人民医院综合神经外科广东阳江 529500;阳江市人民医院综合神经外科广东阳江 529500【正文语种】中文【中图分类】R651.1+5颅脑损伤在临床具有较高的发病率,硬膜修补术是目前常用的治疗方法之一[1]。
生物型硬脑膜补片

ppt课件完整
生物型硬脑(脊)膜补片的技术报告
由广东冠昊生物科技股份有限公司国家工程实验室(广州科 学城广州国际企业孵化器D区408室)出具报告 加盖生产企业公章
安全风险分析报告
由广东冠昊生物科技股份有限公司国家工程实验室(广州科
学城广州国际企业孵化器D区408室)出具报告
25
加盖生产企业公章
ppt课件完整
ppt课件完整
医疗器械检测机构出具的产品注册检测报告
由上海生物材料研究测试中心出具报告 所检产品(脑膜建)的规格型号应在本次注册申请范围内 检测类型应为注册检测或全性能国家监督抽查检测原件 在有效期内(执行《医疗器械注册管理办法》附件3第7条
27
申报文档目录
医疗器械临床试验资料
由吉林医药学院附属医院、上海交通大学医学院附属第九人民医院出 具临床试验资料
ppt课件完整
医疗器械说明书
由广东冠昊生物科技股份有限公司出具
应提供说明书,说明书应加盖生产企业公章;申请人提交
的医疗器械说明书应当符合《医疗器械说明书、标签和包
装标识管理规定》。
28
ppt课件完整
申报文档目录
药监部门出具的质量体系考核的有效证明文件
由广东省食品药品监督管理局出具文件 省、自治区、直辖市(食品)药品监督管理部门签章;若为医
生产企业(广东冠昊生物科技股份有限公司)应当提供所申请 产品符合国家标准、行业标准的声明,并加盖生产企业公章;
生产企业(广东冠昊生物科技股份有限公司)承担产品上市后 的质量责任的声明,并加盖生产企业公章;
生产企业(广东冠昊生物科技股份有限公司)有关产品型号、 规格划分的说明,并加盖生产企业公章。
规格型号
共有两种型号:MⅠ为超薄号型(0.05-0.3mm)、MⅡ为普通型
硬脑膜修补的材料有哪些
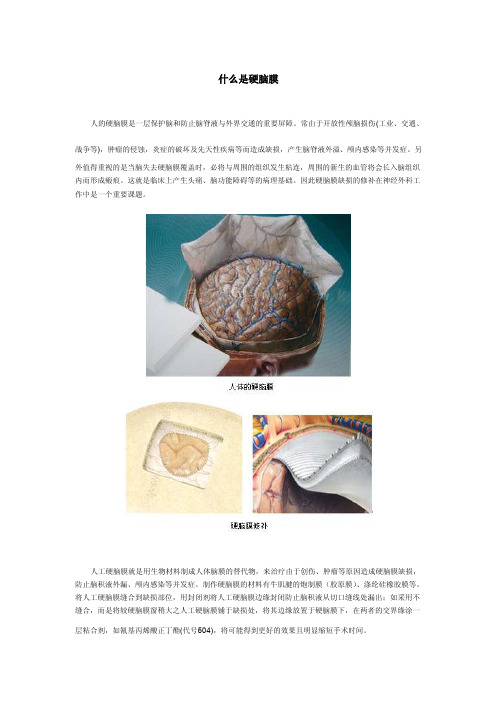
什么是硬脑膜人的硬脑膜是一层保护脑和防止脑脊液与外界交通的重要屏障。
常由于开放性颅脑损伤(工业、交通、战争等),肿瘤的侵蚀,炎症的破坏及先天性疾病等而造成缺损,产生脑脊液外溢、颅内感染等并发症。
另外值得重视的是当脑失去硬脑膜覆盖时,必将与周围的组织发生粘连,周围的新生的血管将会长入脑组织内而形成瘢痕。
这就是临床上产生头痛、脑功能障碍等的病理基础。
因此硬脑膜缺损的修补在神经外科工作中是一个重要课题。
人工硬脑膜就是用生物材料制成人体脑膜的替代物,来治疗由于创伤、肿瘤等原因造成硬脑膜缺损,防止脑积液外漏、颅内感染等并发症。
制作硬脑膜的材料有牛肌腱的炮制膜(胶原膜)、涤纶硅橡胶膜等。
将人工硬脑膜缝合到缺损部位,用封闭剂将人工硬脑膜边缘封闭防止脑积液从切口缝线处漏出;如采用不缝合,而是将较硬脑膜窗稍大之人工硬脑膜铺于缺损处,将其边缘放置于硬脑膜下,在两者的交界缘涂一层粘合剂,如氰基丙烯酸正丁酯(代号504),将可能得到更好的效果且明显缩短手术时间。
硬脑膜修补的材料有哪些国外近几十年来(自1895年)有不少神经外科工作者寻找了一些硬脑膜代用品,概括起来可分为两类。
(1)能吸收的移植物包括自体和异体的,如颞肌筋膜、颅骨骨膜、纤维蛋白膜、尿囊膜、羊肠膜、死人的硬脑膜、牛肌腱的炮制膜,牛心包膜及我国创用的特制胎膜。
(2)不能吸收的物质包括金属相高分子化合物,如金箔、银箔、不锈钢片、橡皮膜(最早被应用)、塞路璐膜、尼龙、维尼龙、特氟龙(聚四氟乙烯)、涤纶硅橡胶膜。
但因前者会引起不同程度的炎性反应,结果造成纤维性变和与脑粘连,后者会产生不同程度的结缔组织增生包裹。
当前国外以牛肌腱的炮制膜及涤纶硅橡胶膜较为多用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物型硬脑膜补片 ——产品申报
(商品名:脑膜建)
1汇报人:彭圣华. Nhomakorabea注册信息——脑膜建(2014-2018)
2
.
一、产品介绍(脑膜建)
产品特性
生物型硬脑(脊)膜补片来源于猪内脏膜材(猪心包膜),经冠昊 专有技术处理,具有类似脑膜的抗张性,柔韧性及弹性,致密性好, 不透水,操作简单,易于缝合。 EN-US>(牵拉)张力。冠朗产品作 为理想的人工硬脑膜,现已得到临床医生的广泛认可,可安全、有 效地用来修补硬脑膜。
规格型号
共有两种型号:MⅠ为超薄号型(0.05-0.3mm)、MⅡ为普通型
(0.3-0.7mm)
代表规格:
4
20mm×30mm
30mm×40mm 40mm×60mm 60
mm×80mm
80mm×120mm
.
二、 医疗器械(脑膜建)分类及原因
编码代号:6846植入材料和人工器官 分类编号: 6846-01 按人体接触性质分类:植入材料和人工器官 按接触时间分类:持久接触(C)(>30d) 管理类别:第 Ⅲ类
3
适应症
产品介绍
颅脑、脊柱损伤后,硬脑(脊)膜的修补;
脑、脊柱肿瘤术后,硬脑(脊)膜的修补;
脑出血术后,硬脑(脊)膜的修补;
颅内高压减压,椎管内减压,硬脑(脊)膜的修补;
硬膜下血肿,硬脑(脊)膜的修补;
其它有需硬脑膜替代或加强的病症,硬脑(脊)膜的修补。
.
使用说明
产品使用前肉眼分辨出“光面”和“毛面”,“光面”对着脑组 织,“毛面”向外,用常规方法缝合于硬膜缺损处。
19
五、临床研究 ——吉林医药学院附属医院
刺激或皮内反应——皮内注射试验
选家兔6只,随机分为两组,兔背去毛,第一组在兔脊柱右 侧实验区每点皮内注射脑膜建(猪的心包膜)花生油浸出液。 左侧每点皮内注射花生油。第二组则于右侧注射生理盐水浸 出液,左侧注射生理盐水。于注射后15分钟、1小时、2天 及3天观察实验区皮肤反应。
溶血试验
将脑膜建(猪的心包膜)浸提液 、生理盐水(阴性对照组) 和双蒸水(阳性对照组)各2ml,分别加入2%兔血悬液2ml, 观察有无细胞黏聚现象出现。离心后取上清液,在722型分 光光度计测定各样本密度。评判标注:溶血率>5%时,可 判断该材料有溶血作用。计算溶血率:溶血率=(样品吸光 度-阴性对照吸光度)/(阳性对照吸光度-阴性对照吸光 度)X100%。
5
.
医疗器械分类及原因
什么是人工硬脑膜?
人的硬脑膜是脑组织表面一厚而坚韧的双层膜性组织,紧贴颅骨内 侧,是保护脑和防止脑脊液与外界交通的重要屏障。人工硬脑膜 (Artificial Dura Mater)是用生物材料制成人体脑膜的替代物,用 于因颅脑、脊髓损伤、肿瘤及其他颅脑疾病引起的硬脑膜或脊膜缺 损的修补,防止脑脊液外漏、颅内感染、脑膨出、脑粘连和疤痕等 严重并发症,以恢复其完整性。
.
7
.
三、相关产品标准
YZB/USA 2037《脑膜生物补片》 YZB/国 6646-2012《生物型硬脑(脊)膜补片》
8
.
相关产品标准
9
.
相关产品标准
医疗器械临床试验的前提条件: (一)该产品具有复核通过的注册产品标准或相应的国
家、行业标准(YZB/国 6646-2012《生物型硬脑(脊)膜补 片》);
.
四、相关生物学评价
12
相关生物学评价
生物学评价流程图
.
开始
不适合进行生物学评价
器械与人体是否直
否
接或间接接触
器械是否有相同特性? 是
是 材料表征
是 材料是否与市场上器 械所用材料相同
a) 生产 b) 人体接触 c) 灭菌
器械定性 a) 接触性质 b) 接触时间
生物学评价试验
否
生物学评价
否
试验和/或原理阐述/证 明
第Ⅲ类医疗器械
国家对于医疗器械有着严格的分类,而第Ⅲ类是最高级别的医疗器 械,也是必须严格控制的医疗器械,是指植入人体,用于支持、维 持生命,对人体具有潜在危险,对其安全性、有效性必须严格控制 的医疗器械。
人工硬脑膜属于第Ⅲ类医疗器械 6
医疗器械分类标准目录
医疗器械分类及原因
人工硬脑膜 (脑膜建)
10
————《医疗器械临床试验规定》
FDA规范
相关产品标准
.
美国食品和药品管理局(FDA Food and Drug Administration )制订了 新的硬膜替代材料生产规范,作为硬膜 替代材料必须符合如下标准:
能够防止脑脊液漏
在类硬膜样组织生成后即能被机体吸收
具有足够的延展性和强度,能够和天然 11 硬膜紧密链接
否
是否有足够的证明和/或有 可提供的试验数据
是 最终评价
是
的选择,表1、2
符合GB/T16886.1-ISO 10993-1标准要求
13
生物相容性评价方式
生物相容性实验 已有的生物相容性实验报告 文献报道 临床使用资料
生物相容性实验
全身毒性试验 细胞毒性试验 刺激试验 致敏试验 血液相容性试验 植入实验 遗传毒性试验 致瘤致癌实验 升值和发育毒性试验
相关生物学评价
14
.
生物学相容性评价国家标准
相关生物学评价
.
15
.
相关生物学评价
16
细胞毒性试验
实验细胞采用L929成纤维细胞, 样品量4g。37℃培养24小时, 细胞贴壁生长,24小时后用 50%脑膜建(猪的心包膜)进 行交换,置37℃培养箱中继续 培养,分别于2、4、7天终止 培养,经洗涤固定和染色,然 后用MPS-2000型紫光分光光 度仪,在波长588nm处测定其 吸光度,根据吸光度求出细胞 相对增殖率,最后判断细胞毒 性级。
相关生物学评价
17
.
.
相关生物学评价
皮肤致敏试验
选用18只白色豚鼠,随机分3组,鼠背去毛,三组动物分别 涂敷脑膜建(猪的心包膜)浸出液,冰醋酸及2.4-二硝基氯 苯。并于其后7天、14天重复涂敷,第28天对侧涂敷上述各 溶液,观察记录各鼠皮肤反应(红斑、水肿、水泡、坏死)。
18
.
相关生物学评价
(二)该产品具有自测报告; (三)该产品具有国务院食品药品监督管理部门会同国 务院质量技术监督部门认可的检测机构(上海生物材料研 究测试中心)出具的产品型式试验报告,且结论为合格; (四)受试产品为首次用于植入人体的医疗器械,应当 具有该产品的动物试验报告; 其它需要由动物试验确认产品对人体临床试验安全性的 产品,也应当提交动物试验报告。
