初三化学方程式零基础拔高练习
初三化学方程式练习题及答案

初三化学方程式练习题及答案化学方程式是描述化学反应过程的重要工具,它由反应物、产物和反应条件组成。
熟练掌握化学方程式的书写对于初三化学学科的学习至关重要。
下面是一些针对初三学生的化学方程式练习题及答案,帮助大家巩固知识点。
1. 氢气与氧气发生反应生成水的化学方程式是什么?答案:2H₂ + O₂ → 2H₂O解析:根据氢气和氧气的元素符号H₂和O₂,以及反应生成的水的元素符号H₂O,我们可以得到方程式2H₂ + O₂ → 2H₂O。
2. 碳酸钙分解产生二氧化碳和氧化钙的化学方程式是什么?答案:CaCO₃ → CO₂ + CaO解析:根据碳酸钙的元素符号CaCO₃,二氧化碳的元素符号CO₂,以及氧化钙的元素符号CaO,我们可以得到方程式CaCO₃ → CO₂ + CaO。
3. 氮气与氢气反应生成氨的化学方程式是什么?答案:N₂ + 3H₂ → 2NH₃解析:根据氮气的元素符号N₂,氢气的元素符号H₂,以及氨的元素符号NH₃,我们可以得到方程式N₂ + 3H₂ → 2NH₃。
4. 硫酸与钠氢碳酸反应生成二氧化碳、水和硫酸钠的化学方程式是什么?答案:H₂SO₄ + NaHCO₃ → CO₂ + H₂O + Na₂SO₄解析:根据硫酸的元素符号H₂SO₄,钠氢碳酸的元素符号NaHCO₃,以及产物二氧化碳、水和硫酸钠的元素符号CO₂、H₂O 和Na₂SO₄,我们可以得到方程式H₂SO₄ + NaHCO₃ → CO₂ +H₂O + Na₂SO₄。
5. 磷酸与钠氢碳酸反应生成二氧化碳、水和磷酸钠的化学方程式是什么?答案:H₃PO₄ + NaHCO₃ → CO₂ + H₂O + Na₃PO₄解析:根据磷酸的元素符号H₃PO₄,钠氢碳酸的元素符号NaHCO₃,以及产物二氧化碳、水和磷酸钠的元素符号CO₂、H₂O 和Na₃PO₄,我们可以得到方程式H₃PO₄ + NaHCO₃ → CO₂ +H₂O + Na₃PO₄。
化学方程式综合测试题

化学方程式综合测试题本测试题共分为三个部分,每个部分包含多个化学方程式的题目,测试难度从易到难逐渐增加。
第一部分:基础练习1.1. 钙和水反应产生的化学方程式为?答案:Ca + 2H2O → Ca(OH)2 + H21.2. 标准氢氧化钠与硫酸反应产生的化学方程式为?答案:2NaOH + H2SO4 → Na2SO4 + 2H2O1.3. 燃烧甲烷时产生的化学方程式为?答案:CH4 + 2O2 → CO2 + 2H2O1.4. 一般硝酸银溶液与氯化钠反应产生的化学方程式为?答案:AgNO3 + NaCl → AgCl↓ + NaNO31.5. 氢气与氧气反应产生的化学方程式为?答案:2H2 + O2 → 2H2O第二部分:进阶练习2.1. 硫酸和钠碳酸反应的化学方程式?答案:H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2↑2.2. 乙醇燃烧后产生的化学方程式?答案:C2H5OH + 3O2 → 2CO2 + 3H2O2.3. 氢氧化钙和盐酸反应的化学方程式?答案:Ca(OH)2 + 2HCl → CaCl2 + 2H2O2.4. 氢氧化铝的化学式?答案:Al(OH)32.5. 硝酸铜和氢氧化钠反应的化学方程式?答案:Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3第三部分:高阶练习3.1. 铁与硫的反应产生的化学方程式为?答案:Fe + S → FeS3.2. 硫酸和氢氧化钡反应的化学方程式?答案:H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O3.3. 氯气和氢气反应产生的化学方程式为?答案:H2 + Cl2 → 2HCl3.4. 氯化钠和高氯酸反应的化学方程式为?答案:NaCl + HClO4 → NaClO4 + HCl3.5. 氧化亚银和氢氧化钠反应的化学方程式为?答案:2Ag2O + 2NaOH → 4Ag↓ + 2Na2O + H2O本测试题共包含15个化学方程式,分为基础、进阶、高阶三个部分,希望大家能够认真思考,完成相应的题目。
初三化学化学方程式的计算提高基础卷附答案

初三化学化学方程式的计算提高基础卷附答案一、初中化学利用化学方程式选择题1.看懂化学反应的微观示意图是学习化学反应的一种重要的能力,从如图微观示意图获取的信息正确的是()A.反应前后分子种类不发生改变B.反应前后原子的种类与数目发生改变C.该反应的基本类型是化合反应D.反应前两种分子的个数比是1:22.两个或多个同种含氧酸分子之间可以脱水形成相对分子质量更大的酸,如磷酸H3PO4可形成H4P2O7或H5P3O10等。
下列物质不属于硫酸(H2SO4)脱水后形成的是A.H2S2O7B.H2S2O8C.H2S3O10D.H2S4O133.下图是某反应的微观示意图,下列说法不正确的是A.B为单质B.生成物中C和D的分子个数比为1:1C.参加反应的A和B的质量比为17:16D.A中氢元素与硫元素的质量比为1:164.下图为某化学反应的微观粒子示意图,关于该反应说法错误的是A.参加反应的物质分子个数比为1:1B.该反应为置换反应C.生成物的质量比为7:22D.反应物均为氧化物且该反应遵循质量守恒定律5.25℃时,某气态碳氢化合物与氧气混合后装入密闭容器中,经充分反应后,又恢复25℃,此时容器内气体分子是反应前的一半。
再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。
此碳氢化合物可能是( )A.CH4 B.C2H6 C.C2H2 D.C3H86.质量守恒定律是帮助我们学习认识化学反应实质的重要理论,在化学反应aA+bB═cC+dD中,下列说法正确的是A.化学计量数a与b之和一定等于c与d之和B.若A和C都是盐,则该反应一定是复分解反应C.反应物A和B的质量比一定等于生成物C和D的质量比D.若取xgA和xgB反应,生成C和D的质量总和不一定是2xg7.科学家最新发现,可以将树木纤维素转变为超级储能装置,该反应的微观示意图如下。
下列说法正确的是A.反应前后分子总数不变B.反应中 X、Z 两种物质的质量比为 3:7C.反应中 Y 和 W 的物质的量之比为 4:5D.参加反应的 Y 中氮元素的质量一定等于生成 Z 的质量8.Fe和FeO的混合物,测得其中铁元素的质量分数为80%.取该混合物7.0g,加足量稀硫酸完全溶解,生成FeSO4的质量为()A.7.6g B.15.2g C.20.0g D.40.0g9.关于化学反应2X+Y=2Z的叙述正确的是()A.Z可能是单质,也可能是化合物B.反应中X、Y、Z三种物质的质量比是2:1:2C.若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为M+ND.若ag的X完全反应生成bg的Z,则同时消耗(b﹣a)g 的Y10.己知A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全反应生成4.4gC。
九年级上册化学化学方程式归纳练习及答案

1.【练习题】写出下列反应的化学方程式:
氯气和氢气的燃烧反应:
2HCl(g)+O2(g)→2H2O(g)+Cl2(g)
2.【练习题】写出下列反应的化学方程式:
硫酸钠溶液与氢氧化钠溶液反应:
Na2SO4(aq)+2NaOH(aq)→Na2SO4(aq)+2H2O(l)
3.【练习题】写出下列反应的化学方程式:
硫酸钡和铝粉反应:
BaSO4(s)+2Al(s)→Ba(AlO2)2(s)+SO2(g)
4.【练习题】写出下列反应的化学方程式:
硝酸铵溶液与氢氧化钠溶液的反应:
NH4NO3(aq)+ NaOH(aq)→NaNO3(aq)+H2O(l)+ NH3(g)
5.【练习题】写出下列反应的化学方程式:
金属铝与氯气反应:
2Al(s)+3Cl2(g)→2AlCl3(s)
6.【练习题】写出下列反应的化学方程式:
硝酸钠溶液和氢氧化钾溶液反应:
NaNO3(aq)+ KOH(aq)→KNO3(aq)+ H2O(l)
7.【练习题】写出下列反应的化学方程式:
氢氧化铝和氯化钠反应:
Al(OH)3(aq) + 3NaCl(aq) → AlCl3(aq) + 3NaOH(aq)
8.【练习题】写出下列反应的化学方程式:
碳酸钠溶液和氯化钠溶液的反应:
Na2CO3(aq)+ NaCl(aq)→2NaCl(aq)+ CO2(g)+H2O(l)
9.【练习题】写出下列反应的化学方程式:
铝粉和硫酸钠的反应:
2Al(s)+ 3Na2SO4(aq)→ Al2(SO4)3(aq) + 6Na(aq)
10.【练习题】写出下列反应的化学方程式:
硫酸铝和硫酸钠的反应:。
中考化学复习基础训练卷——化学方程式精选全文完整版

可编辑修改精选全文完整版2022年中考化学复习基础训练卷——化学方程式一、选择题1.若用碳酸钠粉末与盐酸反应验证质量守恒定律,从下列装置中,可选择的有( )A.a、b、e B.c、d、eC.b、d、e D.a、b、c、d、e2.根据化学方程式:2KClO32KCl+3O2↑无法获取的信息是()A.反应所需条件B.生成物的状态C.生成物的物质的量之比D.氧气可助燃3.化学方程式aC2H2 +bO2cH2O+dCO2配平后a、b、c、d之和为()A. 15B. 14C. 13D. 104.某反应的微观示意图如下,其中“”和“”表示不同元素的原子,下列说法错误的是()A. 化学反应前后原子个数不变B. 化学反应前后分子种类不变C. 化学反应前后元素种类不变D. 化学反应前后质子总数不变5.洁厕灵、84消毒液是两种常见的清洁、消毒用品,混合使用时会发生如图反应:下列说法正确的是()A.该反应是分解反应B.有毒气体是Cl2C.反应前后元素化合价不变D.84消毒液、洁厕灵能混合使用6.实验中有些变化虽然是“<”或“>”的,但仍然符合质量守恒定律,其中不符合的是()A.铜丝的质量为m g,在火焰上灼烧后的质量为n g,则m<nB.木炭的质量为m g,在火焰上灼烧后所有灰烬的质量为n g,则m>nC.浓盐酸的质量为m g,敞口放置于空气中一段时间后质量为n g,则m>nD.氢氧化钠溶液的质量为m g,敞口放置于空气中一段时间后质量为n g,则m<n7.下列化学方程式中符合题意且书写正确的是()A.军事上利用镁作燃烧弹: Mg+O2MgO2B.生活中利用氢气作燃料: H2+O2H2OC.古代利用湿铁炼铜法制铜:Fe+CuSO4═Cu↓+FeSO4D.工业上用石灰石制生石灰:CaCO3CO2↑+CaO8.在“新型状冠病毒”的疫情防控过程中,场室常用“84消毒液”进行消毒。
但如果将洁厕灵和“84消毒液”同时使用,则会产生一种有毒的气体,发生该反应的化学方程式是:2HCl+NaClO=X+NaCl+H O,则X的化学式为2A.ClO B.Cl2C.O2D.CO9.高纯度的单晶硅是制作电子集成电路的基础材料。
化学初三的化学方程练习题

化学初三的化学方程练习题化学方程是化学反应的符号描述,通过化学方程可以了解反应物和生成物的组成、比例以及反应过程中发生的化学变化。
对于初三学生而言,掌握化学方程的写法和平衡是十分重要的。
下面将通过一系列化学方程练习题来帮助初三学生巩固和提高化学方程的编写能力。
1. 单质与氧气反应(1) 氢气与氧气反应生成水,写出反应方程式。
答案:2H₂ + O₂ -> 2H₂O(2) 碳与氧气反应生成二氧化碳,写出反应方程式。
答案:C + O₂ -> CO₂(3) 硫与氧气反应生成二氧化硫,写出反应方程式。
答案:S + O₂ -> SO₂2. 金属与酸反应(1) 镁与盐酸反应生成氯化镁和氢气,写出反应方程式。
答案:Mg + 2HCl -> MgCl₂ + H₂(2) 锌与硫酸反应生成硫酸锌和氢气,写出反应方程式。
答案:Zn + H₂SO₄ -> ZnSO₄ + H₂(3) 铁与硫酸反应生成硫酸铁和氢气,写出反应方程式。
答案:Fe + H₂SO₄ -> FeSO₄ + H₂3. 金属氧化物与酸反应(1) 氧化铁与盐酸反应生成氯化铁和水,写出反应方程式。
答案:Fe₂O₃ + 6HCl -> 2FeCl₃ + 3H₂O(2) 氧化锌与硫酸反应生成硫酸锌和水,写出反应方程式。
答案:ZnO + H₂SO₄ -> ZnSO₄ + H₂O(3) 氧化铜与硝酸反应生成硝酸铜和水,写出反应方程式。
答案:CuO + 2HNO₃ -> Cu(NO₃)₂ + H₂O4. 酸碱中和反应(1) 盐酸与氢氧化钠中和反应生成氯化钠和水,写出反应方程式。
答案:HCl + NaOH -> NaCl + H₂O(2) 硫酸与氢氧化钾中和反应生成硫酸钾和水,写出反应方程式。
答案:H₂SO₄ + 2KOH -> K₂SO₄ + 2H₂O(3) 硝酸与氢氧化钙中和反应生成硝酸钙和水,写出反应方程式。
(完整)初三化学方程式零基础拔高练习

正确书写化学方程式练习题配平化学方程式练习题(目标:能够熟练运用这三种方法进行配平)一、最小公倍数法:(找出两边同种原子的个数最多的原子,然后求最小公倍数,得原子个数。
)1、Al + O2——Al2O32、Al + Fe3O4——Fe + Al2O33、Fe + O2——Fe3O44、Al + MnO2——Mn + Al2O35、N2+ H2——NH36、Al + H2SO4——Al2(SO4)3 + H2二、观察法:(观察顺序:从复杂入手,推导其它)(具体观察顺序——O、C、Fe)1、CO + Fe2O3 ——Fe + CO22、C + Fe2O3——Fe + CO23、CO + Fe3O4 ——Fe + CO24、C + Fe3O4——Fe + CO25、CO + FexOy ——Fe + CO26、C + FexOy——Fe + CO27、H2 + Fe2O3——Fe + H2O 8、H2 + Fe3O4——Fe + H2O9、H2 + Fe X O Y——Fe + H2O 10、H2 + WO3——W + H2O11、CO + O2 ——CO212、Fe + H2O——H2+ Fe3O413、Al(OH)3+ HCl ——AlCl3 + H2O三、奇数配偶法:(找出左右两边出现次数较多的元素,该元素的原子个数在两边为一基数一偶数)1、FeS2 + O2 ——Fe2O3 + SO22、C2H2 + O2——CO2+ H2O3、C + Fe2O3——Fe + CO24、MnO2 + HCl——MnCl2 + Cl2 + H2O5、Cl2 + Ca(OH)2——CaCl2 + Ca(ClO)2 + H2O书写化学方程式练习(目标:能够正确背诵并记住以下化学方程式)1.完成下列反应的化学方程式,并写出化学反应的基本类型:(1)氯酸钾与二氧化锰混合共热;(2)铁丝在氧气中燃烧;(3)镁与稀硫酸反应;上述三个化学反应的基本类型依次为。
初三化学方程式全练习及答案

初三化学方程式全练习及答案初三化学方程式全练一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2Mg + O2点燃=2.铁在氧气中燃烧:3Fe + 2O2点燃=3.铜在空气中受热:2Cu + O2加热=4.铝在空气中燃烧:4Al + 3O2点燃=5.氢气中空气中燃烧:2H2 + O2点燃=6.红磷在空气中燃烧:4P + 5O2点燃=7.硫粉在空气中燃烧:S + O2点燃=8.碳在氧气中充分燃烧:C + O2点燃=9.碳在氧气中不充分燃烧:2C + O2点燃=(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO + O2点燃=11.甲烷在空气中燃烧:CH4 + 2O2点燃=12.酒精在空气中燃烧:C2H5OH + 3O2点燃= 二.几个分化回响反映:13.水在直流电的作用下分解:2H2O通电=14.加热碱式碳酸铜:Cu2(OH)2CO3加热=15.加热氯酸钾(有少量的二氧化锰):2KClO3 =16.加热高锰酸钾:2KMnO4加热=17.碳酸不稳定而分解:H2CO3 ===18.高温煅烧石灰石:CaCO3高温=三.几个氧化还原反应:19.氢气复原氧化铜:H2 + CuO加热=20.柴炭复原氧化铜:C+ 2CuO高温=21.焦炭复原氧化铁:3C+ 2Fe2O3高温=22.焦炭复原四氧化三铁:2C+ Fe3O4高温=23.一氧化碳复原氧化铜:CO+ CuO加热=24.一氧化碳复原氧化铁:3CO+ Fe2O3高温=25.一氧化碳还原四氧化三铁:4CO+ Fe3O4高温= 四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸--------盐+氢气(置换反应)26.锌和稀硫酸Zn + H2SO4 =27.铁和稀硫酸Fe + H2SO4 =28.镁和稀硫酸Mg + H2SO4 =29.铝和稀硫酸2Al +3H2SO4 =30.锌和稀盐酸Zn + 2HCl ===31.铁和稀盐酸Fe + 2HCl ===32.镁和稀盐酸Mg+ 2HCl ===33.铝和稀盐酸2Al + 6HCl ==(2)金属单质+盐(溶液)-------另一种金属+另一种盐34.铁和硫酸铜溶液反应:Fe + CuSO4 ===35.锌和硫酸铜溶液反应:XXX ===36.铜和硝酸汞溶液回响反映:Cu + Hg(NO3)2 === (3)碱性氧化物+酸--------盐+水37.氧化铁和稀盐酸回响反映:Fe2O3 + 6HCl ===38.氧化铁和稀硫酸回响反映:Fe2O3 + 3H2SO4 ===39.氧化铜和稀盐酸回响反映:CuO + 2HCl ====40.氧化铜和稀硫酸反应:CuO + H2SO4 ====41.氧化镁和稀硫酸回响反映:MgO + H2SO4 ====42.氧化钙和稀盐酸反应:CaO + 2HCl ====(4)酸性氧化物+碱--------盐+水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== 47.消石灰吸收二氧化硫:Ca(OH)2 + SO2 ====(5)酸+碱--------盐+水48.盐酸和烧碱起回响反映:HCl + NaOH ====49.盐酸和氢氧化钾反应:HCl + KOH ====50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ====51.盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ====52.盐酸和氢氧化铁回响反映:3HCl + Fe(OH)3 ====53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ====54.硫酸和烧碱回响反映:H2SO4 + 2NaOH ====55.硫酸和氢氧化钾回响反映:H2SO4 + 2KOH ====56.硫酸和氢氧化铜回响反映:H2SO4 + Cu(OH)2 ====57.硫酸和氢氧化铁回响反映:3H2SO4 + 2Fe(OH)3====58.硝酸和烧碱反应:HNO3+ NaOH ====(6)酸+盐--------另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl ===60.碳酸钠与稀盐酸回响反映: Na2CO3 + 2HCl === 61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl ===62.盐酸和硝酸银溶液反应:HCl + AgNO3 ===63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 ===64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ====(7)碱+盐--------另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ====66.氢氧化钠与氯化铁:3NaOH + FeCl3 ====67.氢氧化钠与氯化镁:2NaOH + MgCl2 ====68.氢氧化钠与氯化铜:2NaOH + CuCl2 ====69.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 ===(8)盐+盐-----两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ====71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ====五.其它反应:1.碱+非金属氧化物==盐+水(不属于四种化学反应基本类型)NaOH+CO2==NaOH+SO3==NaOH+SO2==Ca(OH)2+CO2==2.三种还原剂(H2、、C、O2)跟氧化物回响反映H2+CuO(置换反应)CO+CuO CO+Fe2O3C+CuO(置换反应)C+CO2(化合回响反映)3.尝试室制取三种气体(经常使用办法)XXX4KClO3Zn+ HCl== Zn+ H2SO4==CaCO3+HCl==4.盐分解Cu2(OH)2CO3CaCO3XXX4KClO35.三种有机物燃烧CH4+ O2CH3OH+O2C2H5OH+O2初三化学方程式全操演谜底一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在氛围中熄灭:2Mg + O2扑灭2MgO2.铁在氧气中熄灭:3Fe + 2O2扑灭Fe3O43.铜在空气中受热:2Cu + O2加热2CuO4.铝在空气中燃烧:4Al + 3O2点燃2Al2O35.氢气中空气中燃烧:2H2 + O2点燃2H2O6.红磷在空气中燃烧:4P + 5O2点燃2P2O57.硫粉在氛围中熄灭:S + O2扑灭SO28.碳在氧气中充分燃烧:C + O2点燃CO29.碳在氧气中不充分燃烧:2C + O2点燃2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO + O2点燃2CO211.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O二.几个分化回响反映:13.水在直流电的感化下分化:2H2O通电2H2↑+ O2 ↑14.加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO + H2O + CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2↑16.加热高锰酸钾:2KMnO4加热K2MnO4 + MnO2 + O2↑17.碳酸不不乱而分化:H2CO3 === H2O + CO2↑18.高温煅烧石灰石:CaCO3高温CaO + CO2↑三.几个氧化复原回响反映:19.氢气还原氧化铜:H2 + CuO加热Cu + H2O20.柴炭复原氧化铜:C+ 2CuO高温2Cu + CO2↑21.焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑22.焦炭还原四氧化三铁:2C+ Fe3O4高温3Fe + 2CO2↑23.一氧化碳还原氧化铜:CO+ CuO加热Cu + CO224.一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO225.一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO2四.单质、氧化物、酸、碱、盐的彼此干系(1)金属单质+酸--------盐+氢气(置换反应)26.锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27.铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28.镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29.铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30.锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31.铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32.镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质+盐(溶液)-------另一种金属+另一种盐34.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35.锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36.铜和硝酸汞溶液回响反映:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物+酸--------盐+水37.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39.氧化铜和稀盐酸回响反映:CuO + 2HCl ==== CuCl2 + H2O40.氧化铜和稀硫酸回响反映:CuO + H2SO4 ==== CuSO4 + H2O41.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱--------盐+水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O47.消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5)酸+碱--------盐+水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49.盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51.盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52.盐酸和氢氧化铁回响反映:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物医治胃酸过量:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57.硫酸和氢氧化铁回响反映:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58.硝酸和烧碱回响反映:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐--------另一种酸+另一种盐59.大理石与稀盐酸回响反映:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液回响反映:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠回响反映:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl(7)碱+盐--------另外一种碱+另外一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68.氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐+盐-----两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO4。
2020-2021九年级中考化学利用化学方程式的简单计算解答题压轴题提高专题练习含详细答案.docx

2020-2021 九年级中考化学利用化学方程式的简单计算解答题压轴题提高专题练习含详细答案一、初中化学利用化学方程式的简单计算1.在一密闭容器中,有四种物质,在一定条件下存在某个反应,测得反应前后各物质的质量如下表:已知X 的相对分子质量为n、 Q 的相对分子质量为2n.下列推理中正确的是( )物质X Y Z Q反应前质量410121/g反应后质量01215待测/gA.该反应后待测Q 质量为 12gB.反应后生成15gZC.该化学方程式中X 与 Q 的化学计量数之比为2: 3D.该反应中Y 与 Q 质量之比为1: 1【答案】 C【解析】【分析】此题是借助质量守恒定律对反应物生成物先做出判断,再利用质量关系进行求解,反应中反应物质量会减少,生成物质量会增加,从而判断生成物与反应物,即可判断反应的类型,且反应物与生成物质量相等可求出Q 的质量。
【详解】根据质量守恒定律,反应后 Q 的质量为 4g+10g+1g+21g-0g-12g-15g=9g, Y、 Z 物质反应后质量增加,是生成物; X、Q 物质反应后质量减少,是反应物。
A、反应后Q 的质量为9g,故错误;B、反应后生成Z 的质量为: 15g-1g=14g,故错误;4g : 12g=2:3,故正确;C、化学方程式中X 与 Q 的化学计量数之比为:n 2nD、反应中Y 与 Q 发生改变的质量之比为:(12g-10g):( 21g-9g) =1:6,故错误;故选 C。
【点睛】在化学反应中遵循质量守恒定律,参加反应的物质的质量等于反应后生成的物质的质量。
2.下图为某化学反应的微观粒子示意图,关于该反应说法错误的是A.参加反应的物质分子个数比为1:1B.该反应为置换反应C.生成物的质量比为7:22D.反应物均为氧化物且该反应遵循质量守恒定律【答案】 B【解析】试题分析: A.该反应的化学方程式为: 2CO+2NO===N2 +2CO2;则参加反应的物质分子个数比为 1:1,正确; B.该反应不属于置换反应,错误; C.生成物的质量比为 7:22,正确;D.反应物均为氧化物且该反应遵循质量守恒定律,正确。
初三化学拔高试题及答案

初三化学拔高试题及答案一、选择题(每题2分,共20分)1. 下列物质中,属于混合物的是:A. 氧气B. 矿泉水C. 铁D. 氢气2. 化学反应中,质量守恒定律是指:A. 反应前后物质的总质量不变B. 反应前后原子的种类不变C. 反应前后元素的种类不变D. 反应前后原子的数目不变3. 下列物质中,属于氧化物的是:A. 二氧化碳B. 氢氧化钠C. 氯化钠D. 碳酸钙4. 金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,下列金属中不能与酸反应生成氢气的是:A. 铁B. 铜C. 锌D. 镁5. 根据化学方程式进行计算时,正确的做法是:A. 直接将化学方程式中的系数作为计算的依据B. 根据化学方程式中的系数和实际物质的量进行计算C. 忽略化学方程式中的系数,直接根据物质的量进行计算D. 化学方程式中的系数和物质的量都不需要考虑6. 实验室制取氧气时,使用的药品是:A. 过氧化氢B. 碳酸钙C. 氯化钠D. 硫酸铜7. 下列物质中,属于非金属单质的是:A. 氧气B. 铜C. 碳D. 铁8. 根据元素周期表,下列元素中属于金属元素的是:A. 氢B. 氧C. 钠D. 氯9. 根据化学方程式,下列反应中生成物是水的是:A. 碳与氧气反应B. 铁与硫酸反应C. 氢气与氯气反应D. 碳酸钙与盐酸反应10. 根据酸碱中和反应的原理,下列物质中能与酸发生中和反应的是:A. 碳酸钠B. 氢氧化钠C. 氯化钠D. 硫酸铜二、填空题(每空1分,共20分)1. 化学反应中,反应物和生成物的总能量不相等,反应物的总能量高于生成物的总能量,该反应是______反应;反之,则是______反应。
2. 根据元素周期表,元素的原子序数越大,其原子半径______(填“越大”或“越小”)。
3. 金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,排在氢后面的金属则______(填“能”或“不能”)与酸反应生成氢气。
4. 实验室制取氧气时,常用的药品是过氧化氢,其反应的化学方程式为:______。
初三化学方程式练习题

初三化学方程式练习题一、写出下列反应的化学方程式:1. 铁在氧气中燃烧生成四氧化三铁。
2. 氢气在氯气中燃烧生成氯化氢。
3. 碳酸钙受热分解生成氧化钙和二氧化碳。
4. 硫在氧气中燃烧生成二氧化硫。
5. 锌与稀硫酸反应生成硫酸锌和氢气。
二、配平下列化学方程式:1. 铜与稀硝酸反应生成硝酸铜、水和氮的氧化物。
2. 碳与水蒸气反应生成一氧化碳和氢气。
3. 钠与水反应生成氢氧化钠和氢气。
4. 氯酸钾在二氧化锰催化下加热分解生成氯化钾和氧气。
5. 过氧化氢在二氧化锰催化下分解生成水和氧气。
三、根据题目所给的反应物和生成物,写出相应的化学方程式:1. 氢氧化钠与盐酸反应生成氯化钠和水。
2. 铁与硫酸铜反应生成硫酸亚铁和铜。
3. 碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳。
4. 氧化铜与氢气反应生成铜和水。
5. 碳酸氢钠受热分解生成碳酸钠、水和二氧化碳。
四、写出下列物质的化学式:1. 氢氧化钙。
3. 硝酸银。
4. 碳酸氢铵。
5. 磷酸氢二钠。
五、根据题目所给的化学反应,判断下列说法是否正确:1. 镁在空气中燃烧生成氧化镁,反应的化学方程式为:Mg + O2 → MgO。
2. 二氧化碳与氢氧化钠反应生成碳酸钠和水,反应的化学方程式为:CO2 + 2NaOH → Na2CO3 + H2O。
3. 氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3 + 6HCl → 2FeCl3 + 3H2O。
4. 锌与硫酸铜反应生成硫酸锌和铜,反应的化学方程式为:Zn + CuSO4 → ZnSO4 + Cu。
5. 碳酸钠与稀硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式为:Na2CO3 + H2S O4 → Na2SO4 + H2O + CO2↑。
六、根据题目所给的反应物和生成物,写出相应的化学方程式,并配平:1. 铜与浓硝酸反应生成硝酸铜、水和二氧化氮。
2. 碳与氧气反应生成二氧化碳。
3. 钠与氯气反应生成氯化钠。
2023年中考化学三轮冲刺常考化学方程式过关练3

中考冲刺基础练常考化学方程式过关练3
建议用时:10分钟
四、置换反应
(一)活泼金属+酸→盐+氢气
1.镁与稀盐酸反应
2.铁与稀盐酸反应
3.锌与稀硫酸反应
4.铝与稀硫酸反应
(二)金属+金属盐溶液→新金属+新盐5.铁与硫酸铜溶液
6.铝与硫酸铜溶液
7.锌与硫酸铜溶液
8.铜与硝酸银溶液
9.铁与硝酸银溶液
10.焦炭还原氧化铁11.木炭还原氧化铜
12.氢气还原氧化铜
五、其他反应
(一)有机物与氧气反应
13.甲烷在氧气中完全燃烧
14.酒精在氧气中完全燃烧
(二)一氧化碳与金属氧化物反应15.一氧化碳还原氧化铁
16.一氧化碳还原氧化铜
(三)某些非金属氧化物+碱溶液→盐+水
17.用澄清石灰水检验二氧化碳18.用烧碱溶液吸收二氧化碳。
初三化学方程式练习题

初三化学方程式练习题初三化学方程式练习题化学是一门关于物质变化的科学,而方程式则是描述这些变化的重要工具。
在初中化学学习中,方程式的掌握是非常重要的一环。
下面,我们来做一些初三化学方程式的练习题,加深对方程式的理解和应用。
1. 氧气与石墨反应生成什么物质?氧气与石墨反应生成二氧化碳。
这个反应可以用化学方程式表示为:C + O2 → CO22. 硫化氢气与氯气反应生成什么物质?硫化氢气与氯气反应生成硫化氯。
这个反应可以用化学方程式表示为:H2S + Cl2 → S2Cl2 + HCl3. 氧化铁与硫化氢反应生成什么物质?氧化铁与硫化氢反应生成硫化铁。
这个反应可以用化学方程式表示为:Fe2O3 + 3H2S → 2FeS + 3H2O4. 铜与硝酸反应生成什么物质?铜与硝酸反应生成亚硝酸铜和水。
这个反应可以用化学方程式表示为:Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O5. 乙烯与氧气反应生成什么物质?乙烯与氧气反应生成二氧化碳和水。
这个反应可以用化学方程式表示为:C2H4 + 3O2 → 2CO2 + 2H2O6. 氢气与氧气反应生成什么物质?氢气与氧气反应生成水。
这个反应可以用化学方程式表示为:2H2 + O2 → 2H2O通过以上的练习题,我们可以看到化学方程式的应用范围非常广泛。
它可以描述元素之间的反应,也可以描述化合物之间的反应。
方程式中的反应物和生成物的系数表示了它们之间的摩尔比例关系,这是化学方程式中非常重要的一点。
此外,化学方程式还可以用于计算反应物和生成物的质量之间的关系。
通过方程式中的摩尔比例关系,我们可以利用化学计算方法计算出反应物和生成物的质量。
这对于实际生活中的化学实验和工业生产都非常重要。
在学习化学方程式时,我们还需要注意方程式的平衡。
平衡方程式是指反应物和生成物的摩尔数在化学反应中保持不变的方程式。
平衡方程式可以通过调整反应物和生成物的系数来达到。
初三化学拔高练习题推荐

初三化学拔高练习题推荐为了帮助初三学生提高化学知识水平,以下是一些适合拔高的化学练习题推荐。
通过认真练习这些题目,同学们可以巩固基础知识,增加对化学概念的理解,并提高在化学考试中的得分率。
1. 酸碱中和反应题目:下图所示是一个酸碱中和反应的示意图,请根据图示,补充化学方程式,并说明其中涉及到的反应类型。
(示意图)解析:根据示意图可知,左侧液体为盐酸溶液(HCl),右侧液体为氢氧化钠溶液(NaOH)。
根据酸碱中和的反应原理,可知该反应为酸碱中和反应,生成的产物为盐和水。
因此,正确的化学方程式为:HCl + NaOH → NaCl + H2O。
2. 元素周期表题目:根据给出的元素符号填写对应的元素名称。
(1)Li:_____(2)Ca:_____(3)Cl:_____(4)Fe:_____(5)Ne:_____解析:根据元素符号在元素周期表中的位置,填写对应的元素名称。
(1)Li:锂(2)Ca:钙(3)Cl:氯(4)Fe:铁(5)Ne:氖3. 化学方程式平衡题目:平衡下列化学方程式。
(1)H2 + O2 → H2O(2)Fe + Cl2 → FeCl3(3)CO2 + H2O → H2CO3解析:要使化学方程式平衡,需要保证反应前后原子数目相等。
根据平衡原理,可以调整化学方程式中的系数来平衡方程式。
(1)H2 + 1/2 O2 → H2O(2)2 Fe + 3 Cl2 → 2 FeCl3(3)CO2 + H2O → H2CO34. 离子反应式题目:将下列化学方程式转化成离子反应式。
(1)FeCl2 + 2 NaOH → Fe(OH)2 + 2 NaCl(2)CuSO4 + NaOH → Cu(OH)2 + Na2SO4(3)HCl + NaOH → NaCl + H2O解析:离子反应式是指将化学方程式中的物质转化成离子的形式。
离子反应式中需要注意离子的电荷平衡。
(1)Fe2+ + 2 OH- → Fe(OH)2(2)Cu2+ + 2 OH- → Cu(OH)2(3)H+ + OH- → H2O5. 物质的密度计算题目:已知物质的质量和体积,计算其密度。
初三化学化学方程式的计算提高基础卷含答案解析

初三化学化学方程式的计算提高基础卷含答案解析一、初中化学利用化学方程式选择题1.某混合物由Mg和MgO组成,取该混合物12.8g与一定量稀硫酸恰好完全反应,所得溶液中溶质的质量为52g,则原混合物中氧元素的质量为()A.4.8g B.4.0g C.3.2g D.2.4g2.下图是某反应的微观示意图,下列说法不正确的是A.B为单质B.生成物中C和D的分子个数比为1:1C.参加反应的A和B的质量比为17:16D.A中氢元素与硫元素的质量比为1:163.甲和乙在一定条件下反应生成丙和丁的微观示意图如下,结论正确的是()A.丁的式量为18g B.生成物都是氧化物C.参与反应的甲和乙的质量比为22:3D.反应前后分子个数不变4.偏二甲肼(C2H8N2)与N2O4反应能放出巨大的能量,化学方程式为C2H8N2+2N2O4═2X↑+3N2↑+4H2O↑,下列说法正确的是()A.该反应属于化合反应B.X的化学式为COC.偏二甲肼中氮的质量分数最大D.生成N2和H2O的质量比14:15.实验时有一块未知质量的石灰石样品(含杂质20%,杂质不含钙元素,不溶于水,也不参加反应),高温煅烧一段时间后,称得固体质量为10.3g,向固体中加入100g稀盐酸,恰好完全反应,过滤,所得滤液质量为105.6g,则与稀盐酸反应的碳酸钙在样品质量分数为() A.20% B.40% C.50% D.80%6.取NaCl、NaOH、Na2CO3固体混合物28.6g于烧杯中,向其中加入过量的稀盐酸至充分反应后,共生成二氧化碳气体4.4g,将溶液蒸干,得无水固体33.4g,则原混合物中氯化钠质量为A.8.4g B.10.0g C.11.7g D.13.6g7.在一密闭容器内有氧气、氮气、水蒸气和一种初中课本中出现的气体物质W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法中错误的是( )物质W氧气氮气水蒸气前质量/g6810022反应后质量/g X458110A.X的值应为0B.反应前后氮元素的化合价发生了变化C.物质W中不含氧元素D.W与氧气的相对分子质量之比为17:248.在 CO、CO2的混合气体中,氧元素的质量分数为 64%,将该混合气体 10克通过灼热的氧化铜,充分反应后,将气体再全部通过足量的澄清石灰水,过滤,得到白色沉淀的质量是()A.40g B.30g C.10g D.5g9.一定条件下,密闭容器中发生化学反应,甲、乙、丙、丁四种物质的质量变化如图所示,下列说法正确的是()A.乙属于混合物B.该反应可以表示为:甲+丙+丁乙C.参加反应的甲和丁的质量比为2:5D.参加反应的甲和丁的分子个数比一定为8:1210.看懂化学反应的微观示意图是学习化学反应的一种重要的能力,从如图微观示意图获取的信息正确的是()A.反应前后分子种类不发生改变B.反应前后原子的种类与数目发生改变C.该反应的基本类型是化合反应D.反应前两种分子的个数比是1:211.用镁和铝分别同稀硫酸反应,若要各制得10克氢气,则需要用去的镁和铝的质量比是A.4∶3 B.8∶9 C.3∶1 D.1∶312.如图是某汽车尾气净化装置中发生反应的微观示意图。
初三化学拔高练习题

初三化学拔高练习题化学是我们日常生活中不可或缺的一部分,通过学习化学,我们能够更好地理解和探索这个世界。
为了帮助初三学生提升化学水平,下面是一些拔高练习题,希望对大家的化学学习有所帮助。
题目一:物质的分类1. 请根据物质的组成和性质将物质分成三类,并举例说明。
2. 物质在化学反应中的相变现象有哪些?请简要描述每种相变现象的特点和例子。
题目二:化学方程式1. 以下反应方程式中哪些是不平衡的化学方程式?请对不平衡方程式进行平衡。
a) H2 + O2 → H2Ob) Na + Cl2 → NaClc) CH4 + 2O2 → CO2 + 2H2O2. 对于下列的离子方程式,请写出相应的分子方程式和离子方程式。
a) AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)b) FeCl2(aq) + NaOH(aq) → Fe(OH)2(s) + NaCl(aq)题目三:酸碱中和反应1. 碱溶液和酸溶液的中和反应中,产生的物质有哪些?请写出反应方程式。
2. 用两种方法可以判断酸碱中和反应是否已经完成,分别是什么?题目四:化学反应的速率1. 化学反应的速率受到哪些因素的影响?请简要说明每个因素对反应速率的影响。
2. 如何通过实验方法来测定化学反应的速率?请列出三种测定速率的方法,并简要描述其原理。
题目五:元素周期表1. 请简要解释元素周期表中的周期和族的含义。
2. 根据元素的周期和族,回答以下问题:a) Ba属于元素周期表的第几周期和第几族?b) F属于元素周期表的第几周期和第几族?题目六:化学键的类型1. 请解释离子键、共价键和金属键的概念。
2. 下列化合物中,哪些是离子化合物,哪些是共价化合物?a) NaClb) H2Oc) CO2d) MgO题目七:化学反应的能量变化1. 请解释放热反应和吸热反应的概念,并举例说明。
2. 反应物和生成物能量变化的图像中,如何判断反应是放热反应还是吸热反应?以上是初三化学拔高练习题,希望对大家的化学学习有所帮助。
2023年中考化学提升复习 化学方程式(含答案)
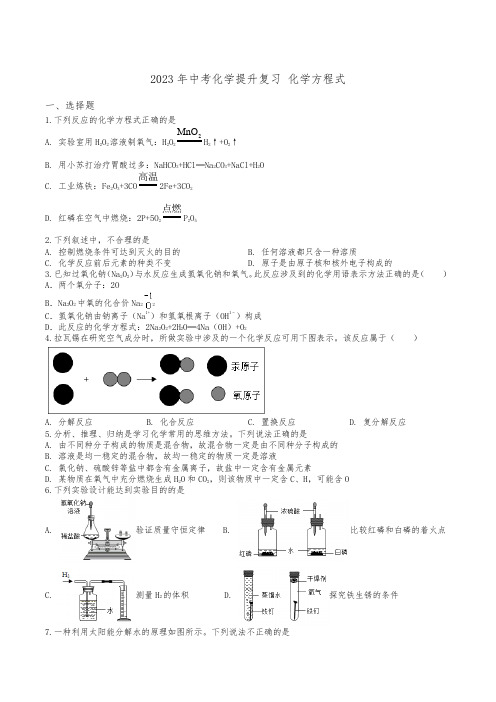
2023年中考化学提升复习化学方程式一、选择题1.下列反应的化学方程式正确的是A. 实验室用H2O2溶液制氧气:H2O22MnOH2↑+O2↑B. 用小苏打治疗胃酸过多:NaHCO3+HCl═Na2CO3+NaCl+H2OC. 工业炼铁:Fe2O3+3CO 高温2Fe+3CO2D. 红磷在空气中燃烧:2P+5O2点燃P2O52.下列叙述中,不合理的是A. 控制燃烧条件可达到灭火的目的B. 任何溶液都只含一种溶质C. 化学反应前后元素的种类不变D. 原子是由原子核和核外电子构成的3.已知过氧化钠(Na2O2)与水反应生成氢氧化钠和氧气。
此反应涉及到的化学用语表示方法正确的是()A.两个氧分子:2OB.Na2O2中氧的化合价Na22C.氢氧化钠由钠离子(Na1+)和氢氧根离子(OH1﹣)构成D.此反应的化学方程式:2Na2O2+2H2O═4Na(OH)+O24.拉瓦锡在研究空气成分时,所做实验中涉及的一个化学反应可用下图表示。
该反应属于()A. 分解反应B. 化合反应C. 置换反应D. 复分解反应5.分析、推理、归纳是学习化学常用的思维方法。
下列说法正确的是A. 由不同种分子构成的物质是混合物,故混合物一定是由不同种分子构成的B. 溶液是均一稳定的混合物,故均一稳定的物质一定是溶液C. 氯化钠、硫酸锌等盐中都含有金属离子,故盐中一定含有金属元素D. 某物质在氧气中充分燃烧生成H2O和CO2,则该物质中一定含C、H,可能含O6.下列实验设计能达到实验目的的是A. 验证质量守恒定律B. 比较红磷和白磷的着火点C. 测量H2的体积D. 探究铁生锈的条件7.一种利用太阳能分解水的原理如图所示。
下列说法不正确的是A. 反应I 的化学方程式:22224I +SO +2H O=2HI+H SOB. 理论上每生成2gH 2,同时生成32gO 2C. 反应Ⅲ中生成SO 2和O 2的分子个数比为2:1D. 反应I 、Ⅱ和Ⅲ在反应前后均有元素化合价发生改变 8.下图为制备有机物X 的微观过程。
【化学】初三化学《化学方程式》技巧(很有用)及练习题及解析

【化学】初三化学《化学方程式》技巧(很有用)及练习题及解析一、选择题1.已知NaHCO 3受热分解生成Na 2CO 3,323222NaHCO Na CO +CO +H O Δ↑。
把12克NaHCO3和Na 2CO 3的混合物样品加热至完全反应,剩余固体的质量为8.9克。
下列说法正确的是( )A .反应生成的CO 2质量为4.4克B .样品中Na 2CO 3的质量分数为30%C .样品中NaHCO 3的质量为8.6克D .样品中钠元素的质量分数为43.3%【答案】B 【解析】 【分析】碳酸氢钠受热分解生成碳酸钠和水和二氧化碳,反应前后的质量差即为反应生成的水和二氧化碳的质量。
设碳酸氢钠质量为x 、反应生成的碳酸钠y 、二氧化碳的质量为z323222NaHCO Na CO +CO +H O 1681064462xy 2.2g 3.1g↑∆固体质量差1681064462===x y z 3.1gx=8.4g y=5.3g z=2.2g【详解】A 、反应生成的CO 2质量为2.2克,故A 不正确;B 、样品中Na 2CO 3的质量分数为12g-8.4g100%=30%12g⨯,故B 正确; C 、样品中NaHCO 3的质量为8.4克,故C 不正确; D 、样品中钠元素的质量为23468.4g 100%+(12g 8.4g)100% 3.9g 84106⨯⨯-⨯⨯=,样品中钠元素的质量分数为3.9g100%=32.2%12g⨯,故D 不正确。
故选B 。
【点睛】=100%⨯碳酸钠的质量样品中碳酸钠的质量分数样品的质量。
2.火箭常用联氨(N 2H 4)作燃料,反应的化学方程式为:N 2H 4+2NO 2X+2H 2O .则X的化学式是( ) A .N 2B .NO 2C .NH 3D .N 2O【答案】A【解析】试题分析:根据质量守恒定律的元素守恒可知,原子的种类不变,原子的个数不变。
在N2H4+2NO2X +2H2O反应中,反应前共有氮原子4个、氢原子4个、氧原子2个;反应后的原子为:氢原子4个、氧原子2个,则2X中含有氮原子4个,故X的化学式为N2,故选A。
【化学】初三化学《化学方程式》技巧(很有用)及练习题及解析

【化学】初三化学《化学方程式》技巧(很有用)及练习题及解析一、选择题1.“天宫一号”搭载的长征二号火箭使用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,其完全反应的化学方程式:C2H8N2+2N2O4=3X+2CO2+4H2O,则X的化学式为()A.CO B.N2C.O2D.H2【答案】B【解析】【分析】在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
【详解】在化学反应前后除X外,其他各原子相差的个数分别是::,:,:,:,所以3个X分子中共含⨯⨯⨯⨯⨯C2-2=0H8-42=0N2+22-0=6O24-22-41=0有6个N原子,每个X分子中含有2个N原子,即X的化学式为N2,故选B。
2.如图表示氯酸钾和二氧化锰混合受热至完全反应的过程中某变量y随时间的变化趋势,纵坐标表示的是()A.剩余固体的质量B.生成氧气的质量C.固体中二氧化锰的质量D.氯酸钾的质量【答案】A【解析】【详解】A.氯酸钾在二氧化锰的催化作用下在加热条件下生成氯化钾和氧气,反应后氧气逸出,固体质量逐渐减少,至完全分解,固体的质量不再改变,与图象对应;故符合题意;B.生成氧气的质量不断增加,直到反应结束为止,与图像不对应;故不符合题意;C.二氧化锰作催化剂,反应前后质量不变,与图象不对应;故不符合题意;D.氯酸钾在二氧化锰的催化作用下在加热条件下生成氯化钾和氧气,由于需要加热到一定的温度氯酸钾才能分解,随着反应的进行,氯酸钾的质量逐渐减少,至完全分解,氯酸钾的质量为0,与图象不对应。
故不符合题意;故选A【点睛】本题是一道图象坐标与化学知识相结合的综合题,解题的关键是结合所涉及的化学知识,正确分析各变化的过程,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,进而确定正确的图象。
3.火箭常用联氨(N2H4)作燃料,反应的化学方程式为:N2H4+2NO2X+2H2O.则X 的化学式是()A.N2B.NO2C.NH3D.N2O【答案】A【解析】试题分析:根据质量守恒定律的元素守恒可知,原子的种类不变,原子的个数不变。
【化学】九年级化学《化学方程式》技巧(很有用)及练习题及解析
【化学】九年级化学《化学方程式》技巧(很有用)及练习题及解析一、选择题1.一种由甲醇为原料的薪型手机电池,可连续使用一个月才充一次电,其反应原理为:2CH3OH+3X+4NaOH=2Na2CO3+6H2O,其中X的化学式为()A.CO B.O2C.CO2D.H2【答案】B【解析】【分析】根据质量守恒定律,反应前后原子个数不变,原子种类不变。
【详解】有化学方程式可知,反应前有2个碳原子,12个氢原子,6个氧原子,4个钠原子,反应后有2个碳原子,4个钠原子,12个氧原子,12个氢原子,根据质量守恒定律,反应前后原子个数不变,原子种类不变,则X的化学式为O2,故选B。
2.在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。
则关于此反应的认识正确的是()A.该反应为分解反应B.该反应为化合反应C.m=1 D.反应后容器中Z与Y的质量比为1:6【答案】B【解析】【分析】反应后质量减少的物质是反应物,减少的质量是参加反应的质量,反应后质量增多的物质是生成物,增多的质量是生成的质量。
X反应后质量增多,是生成物,生成的质量是18g-2g=16g,Z反应后质量减少,是反应物,参加反应的质量是16g-6g=10g,W反应后质量减少,是反应物,参加反应的质量是16g-11g=5g,5g+10g<16g,所以Y是反应物,参加反应的质量是16g-15g=1g,该反应是Y+W+Z==X。
【详解】A.该反应不是分解反应,错误;B.该反应为化合反应,正确;C.m=1-1=0,错误;D.反应后容器中Z与Y的质量比为6:0,错误。
故选B。
3.某金属单质 X与非金属单质Y可发生反应:2X+Y=X2Y。
某实验探究小组进行了两次实验,测得数据如下表:实验序号X的用量/g Y的用量/g生成X2Y的质量/g17.4 1.68.029.6 3.212.0参加反应的X与Y的质量比为 ( )A.4:1 B.3:1 C.2:1 D.37:8【答案】A【解析】【分析】【详解】由两次实验数据表,Y的用量增加1倍,而生成X2Y的质量却没有增加1倍,说明第2次反应时,Y有剩余,9.6gX完全反应,生成12.0gX2Y,则同时参加反应的Y的质量为12.0g ﹣9.6g=2.4g;故参加反应的X与Y的质量比为9.6g:2.4g=4:1.故选A.4.下图为某反应的部分微观示意图,其中不同的球代表不同元素的原子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
正确书写化学方程式练习题
配平化学方程式练习题(目标:能够熟练运用这三种方法进行配平)
一、最小公倍数法:
(找出两边同种原子的个数最多的原子,然后求最小公倍数,得原子个数。
)
1、Al + O2——Al2O3
2、Al + Fe3O4——Fe + Al2O3
3、Fe + O2——Fe3O4
4、Al + MnO2——Mn + Al2O3
5、N2+ H2——NH3
6、Al + H2SO4——Al2(SO4)3 + H2
二、观察法:
(观察顺序:从复杂入手,推导其它)(具体观察顺序——O、C、Fe)
1、CO + Fe2O3 ——Fe + CO2
2、C + Fe2O3——Fe + CO2
3、CO + Fe3O4 ——Fe + CO2
4、C + Fe3O4——Fe + CO2
5、CO + FexOy ——Fe + CO2
6、C + FexOy——Fe + CO2
7、H2 + Fe2O3——Fe + H2O 8、H2 + Fe3O4——Fe + H2O
9、H2 + Fe X O Y——Fe + H2O 10、H2 + WO3——W + H2O
11、CO + O2 ——CO212、Fe + H2O——H2+ Fe3O4
13、Al(OH)3+ HCl ——AlCl3 + H2O
三、奇数配偶法:
(找出左右两边出现次数较多的元素,该元素的原子个数在两边为一基数一偶数)
1、FeS2 + O2 ——Fe2O3 + SO2
2、C2H2 + O2——CO2+ H2O
3、C + Fe2O3——Fe + CO2
4、MnO2 + HCl——MnCl2 + Cl2 + H2O
5、Cl2 + Ca(OH)2——CaCl2 + Ca(ClO)2 + H2O
书写化学方程式练习(目标:能够正确背诵并记住以下化学方程式)
1.完成下列反应的化学方程式,并写出化学反应的基本类型:
(1)氯酸钾与二氧化锰混合共热;(2)铁丝在氧气中燃烧;(3)镁与稀硫酸反应;上述三个化学反应的基本类型依次为。
2.完成下列化学方程式:(完成目标:背诵并且默写)
(1)硫在空气中燃烧:;(2)蜡烛在空气中燃烧:;(3)红磷在空气中燃烧:;(4)双氧水制取氧气:;(5)加热高锰酸钾制取氧气:;
(6)电解水: ;
(7)氢气在氧气中燃烧: 。
4.下列现象不能用质量守恒定律解释的是( )
A .将2g 氢气在20g 氧气中燃烧,生成18g 水
B .将20mL 酒精与20mL 水混合,总体积小于40mL
C .将浓硫酸置于空气中一段时间,溶液质量增加
D .将二氧化碳的水溶液加热,溶液质量减轻
5.化学方程式4P+5O 22P 2O 5的读法正确的是( )
A .在点燃条件下,磷加氧气等于五氧化二磷
B .4P 和5O 2等于2P 2O 5
C .在点燃条件下,4个磷和5个氧已反应,生成2个五氧化二磷
D .磷和氧气在点燃的条件下发生反应,生成五氧化二磷
6.在化学反应中一定没有发生变化的是( )
A .原子的种类
B .分子的种类
C .物质的种类
D .元素的化合价
7.(1)在反应Mg CuO MgO Cu ++△中, 分质量的镁跟 分质量的氧化铜反应,生成 分质量的氧化镁和 分质量的铜。
