中国石油大学化工原理萃取
化工原理第五章 萃取

图 连结线斜率的变化
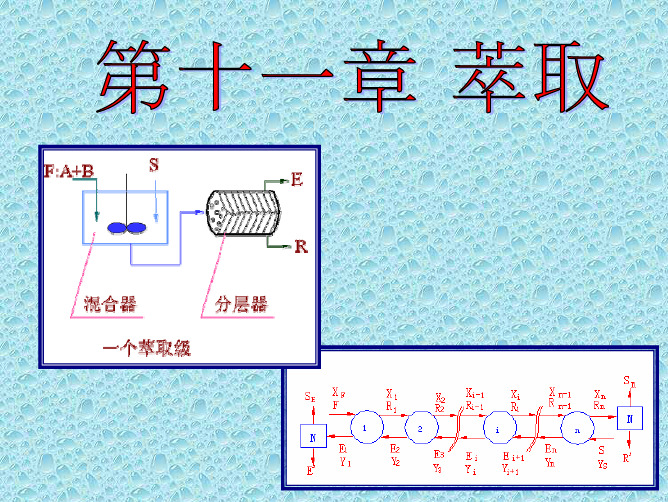
二.相平衡关系在三角形相图上的表示方法
1.溶解度曲线与联接线 一定温度下,测定体 系的溶解度曲线时,实验 测出的联结线的条数(即 共轭相的对数)总是有限 的,此时为了得到任何已 知平衡液相的共轭相的数 据,常借助辅助曲线(亦 称共轭曲线) 。
图 辅助曲线
2.辅助曲线和临界混溶点
第二节
液液相平衡
一. 三角形坐标图及杠杆规则 1.三角形坐标图 等边三角形 等腰直角三角形 不等腰直角三角形
一般而言,在萃取过程中很少遇到恒摩尔流的简化情况, 故在三角形坐标图中混合物的组成常用质量分数表示。 习惯 上,在三角形坐标图中,AB边以A的质量分率作为标度,BS 边以B的质量分率作为标度,SA边以S的质量分率作为标度。 三角形坐标图的每个顶点分别代表一个纯组分,即顶点A表示 纯溶质A,顶点B表示纯原溶剂(稀释剂)B,顶点S表示纯萃 取剂S。 三角形坐标图三条边上的任一点代表一个二元混合 物系,第三组分的组成为零。例如AB边上的E点,表示由A、 B组成的二元混合物系,由图可读得:A的组成为0.40,则B 的组成为(1.0-0.40)= 0.60,S的组成为零。
3. 分配系数和分配曲线
(1)分配系数 一定温度下,某组分在互相平衡的 E 相与 R 相中的组成之比称为该组分的分配系数,以 yA k表示,即溶质A
kA
yB 原溶剂B k B xB
xA
式中 yA、yB ——萃取相E中组分A、B的质量分数; xA、xB——萃余相R中组分A、B的质量分数。
分配系数kA表达了溶质在两个平衡液相中的分
第五章
▲ 第一节 概述
萃取
▲ 第二节 液液相平衡 ▲ 第三节 萃取分离效果及主要影响因数
▲ 第四节 萃取过程的计算
石油化学工程原理习题答案第十1章萃取

1.现有含15%(质)醋酸的水溶液30kg ,在25℃下用60kg 纯乙醚作萃取剂进行单级萃取,试求:(1)萃取相、萃余相的量及组成;(2)平衡两相中醋酸的分配系数;(3)萃取剂的选择性系数。
在25℃时醋酸(A)—水(B)—乙醚(S)系统的平衡数据列于附表。
解:(1) 根据相平衡数据作出三角形相图,由F x =0.15(质量分率)在三角形相图的AB 边上确定F 点,连接FS 。
有杠杆定律确定点M495.73603060=⨯+=⋅=FS M S MF 由图中读得A y =5% , B y =4% , S y =91%;A x =6% ,B x =87% , S x =7%。
过M 点的平衡联结线RE ,从图中量得线段ME 和RE 的长度,由杠杆定律可得萃取相的流量为==RE RMME (30+60)8863⨯=64.4kg/h R=M-E=90-64.4=25.6kg/h(2) 平衡两相中醋酸的分配系数:==A A A x y k 83.0%6%5= (3) 萃取剂的选择性系数:1.18%87/%6%4/%5//===B A B A x x y y β2.在单级萃取器内,用800kg 水作萃取剂,从醋酸与氯仿的混合液中萃取醋酸。
已知原料液的量也为800kg ,其中醋酸的组成为35%(质),在操作条件下(25℃)萃取系统的平衡曲线的数据列于附表。
试求:(1)萃取相和萃余相中醋酸的组成及两相的量; (2)萃取液和萃余液中醋酸的组成及各自的量;(3)醋酸的萃取率。
解:(1) 根据相平衡数据作出三角形相图,由F x =0.35(质量分率)在三角形相图AB 边上确定F 点,连接FS 。
因为F =S ,则混合点M 位于线段FS 的中点:M=F+S=800+800=1600kg/h过M 点的作平衡联结线RE ,量出线段RM 和RE 的长度,由杠杆定律:8456)800800(+==RERM ME =1067kg/hR=M-E=1600-1067=533kg/h从图读得萃取相和萃余相中醋酸的组成:y =25% ,x =7%(质量分率)。
化工原理(下)萃取

各组分的浓度本章均以质量%表示。
(也可用摩尔%) 三角形的三个顶点分别代表纯组 分A、B、S(100%); 三角形的三条边分别代表一个二 元物系,每边等分100份;
即:
xA+xB=1 或 xA+xS=1 或 xB+xS=1 三角形内任意一点代表一个三元混 合物 过M点做三条边的平行线
2、
结论:
1*
B、S物系一定,两相组成 一定,即:L、J点位置一定; B、S混合物的比例不同, 混溶点位置不同。 2* 若B、S完全不互溶, 则点L、J分别与三角形 的顶点B、S重合。
3*
溶解度曲线的“口”在哪条 边上,哪条边上的两组分 就为部分互溶 或完全不互溶。
如:制药工业中青霉素等的制备。 4、其他:稀有金属的提炼、环境
污染的治理等。
四、三元液—液萃取分类
(A与B是互溶的均相物系) 第Ⅰ类: A与B、S完全互溶, B、S为一对部分互溶组分: ( 此类物系的萃取相和萃余相 一般均为三组分溶液)
第Ⅱ类:
A、B完全互溶, B、S及A、S为两对部分互溶组分 以下主要讨论第Ⅰ类物系
关
第三节
萃取剂的选择 从以上分析可见,萃取剂的 性质和选择很重要。 对萃取剂要求: 既要分散好,又要分层快;与 B互溶度要小;回收要方便。这些 性质决定了该萃取剂能否工业化。
从以下几方面讨论: 一、选择性系数β:
(萃取剂选择性) 如前述,当kA>1、<1、=1 三种情况下均可萃取,但并没表 明S与B的互溶情况对萃取的影响, 我们希望萃取剂能尽可能多地溶 解A,尽可能少地溶解B,
二、三角形相图中的平衡关系: 1、溶解度曲线和连接线: (1)溶解度曲线:
化工原理(天大版)---(下册)第四章 萃取

选择性系数与kA、kB有关。 kA越大, kB越小,就越大, 说明:
A、B的分离也就越容易 凡是影响kA、kB的因素都影响(温度、组成) 若 =1,则萃取相和萃余相在脱除溶剂S后将具有相同的 组成,并且等于原料液的组成,故没有分离能力 萃取剂的选择性越高,对A的溶解能力就大,则一定的分离 任务,可越少萃取剂用量,降低回收溶剂操作的能耗,并且 可获得高纯度的产品A 当组分B、S完全不互溶时,则选择性系数趋于无穷大,这 是最理想的情况。
MF FN F ( xF xM ) (4 7) SF F xM y S MS NB
R'
B
(b)
S
EM
M ( xM x R ) 其中yE、xM、xR 由相图读出 y E xR R) 把4-6、4-7代入4-9得: E F ( xF x 其中xF、x' 'R、y''E由相图读出 y E x R R F E
表达了溶质在两个平衡液相中的分配关系。 A值愈大,萃取分离的效果 愈好 A值与联结线的斜率有关 不同的物系具有不同的分配系数 A值 同一物系, A值随温度和组成而变。 一定温度下,仅当溶质组成范围变化不大时, A值才可视为常数 Y KX 式中:Y——萃取相E中溶质A的质量比组成;
X ——萃余相R中溶质A的质量比组成; K——以质量比表示相组成时的分配系数
4.2.2 液-液相平衡关系
3、分配系数和分配曲线
分配曲线:若以xA为横坐标,以yA为纵坐标,则可在x-y直角坐标图上得到
表示互成平衡的一对共轭相组成的点N。将这些点联结起来即可得到曲线 ONP,称为分配曲线
曲线上的P点即为临界混溶点。 分配曲线表达了溶质A在互成平衡的E相与R相中的分配关系。若已知某液相组成, 则可由分配曲线求出其共轭相的组成。 若在分层区内y均大于x,即分配系数 A >1,则分配曲线位于y=x直线的上方,反 之则位于y=x直线的下方。 若随着溶质A组成的变化,联结线倾斜的方向发生改变,则分配曲线将与对角线出 现交点,这种物系称为等溶度体系
化工原理 第十一章-液液萃取

萃取的分类
(1)按组分数目分: 多元体系:原料液中有两个以上组分或溶剂为两种 不互溶的溶剂 三元体系:原料液中含有两个组分,溶剂为单溶剂
(2)按有无化学反应分:
物理萃取:萃取过程中,萃取剂与原料液中的有关 组分不发生化学反应 化学萃取 本章主要讨论三元体系的物理萃取。
石油化工学院---Department of Petroleum chemical Engineering
③ 混溶点: 曲线内为两相区,曲线外为单相区,曲线上的点称
为混溶点; ④ 临界混溶点(褶点) :共轭相的组成相同,其位置和物系有关; ⑤ 萃取相和萃余相: 以原溶剂为主的相称为萃余相,以溶剂为 主的相称为萃取相。
石油化工学院---Department of Petroleum chemical Engineering
石油化工学院---Department of Petroleum chemical Engineering
液液萃取的应用
1、在石油化工中的应用 随着石油化工的发展,液液萃取已广泛应用于分离各 种有机物质。轻油裂解和铂重整产生的芳烃混合物的分离是
重要的一例。该混合物中各组分的沸点非常接近,用一般的 分离方法很不经济。工业上采用 Udex 、Shell、 Formex等萃 取流程,分别用环丁砜、四甘醇、N-甲基吡咯烷酮为溶剂, 从裂解汽油的重整油中萃取芳烃。对于难分离的乙苯体系, 组分之间的相对挥发度接近于 1,用精馏方法不仅回流比大, 塔板还高达 300 多块,操作费用极大。可采用萃取操作以 HF-BF3 作萃取剂,从 C8 馏分中分离二甲苯及其同分异构体。
业中用TBP从发酵液中萃取柠檬酸也得到了广泛应用。可以 说,萃取操作已在制药工业、精细化工中占有重要的地位。
中国石油大学化工原理萃取

S
39
三、三元物系的相平衡关系-作法P1
溶解度曲线(以 B 、 S 部分互溶): 溶解度曲线(以 B 、 S 部分互溶):
A
在纯组分B中加S使其溶 解(d1),S加到一定数量 后,到达R点时,溶液由透明 变混浊,即S在B中达到饱 和,出现两相,R点称为分层 点(混溶点), 继续加S,则 到达E点又重新透明, E点亦 称为分层点(混溶点) 。
34
二、物料衡算与杠杆定律
3.杠杆定律的推导 3.杠杆定律的推导
物料衡算: 总:U+V=M A: UyA+VxA=MzA S: UyS+VxS=MzS
U z A x A xS z S V y A z A zS yS
y A z A z A xA z S y S xS z S
10
三、萃取过程特点-完全不互溶概念
完全不互溶特点: 完全不互溶特点:
(B和S)
⑴ 仅有组分A富集到E相,E相由A+S组成,脱SE后得到A ⑵ 组分B全部富集到R相,R相由A+B组成,分离A后得到B ⑶ 同单组分吸收过程一样,E、R相都是二元混合物
11
三、萃取过程特点-完全不互溶物平
浓度表示与吸收接近: 浓度表示与吸收接近:
A
P R4 R3 R2 R1
E4
E3 E2 E1
S
B
已知共轭相中任一相的组成,可利用辅助线得出另一相的组成。
45
三、三元物系的相平衡关系-辅助曲线
辅助曲线 辅助曲线 Auxiliary Auxiliary curve curve
A
方法二: 分别从E1、E2、E3、E4点引 AB平行线,与分别从R1、 R2、R3、R4点引出的AS平 行线相交,连结各交点得辅 助曲线。 辅助曲线延长线与溶解度曲 B 线的交点即为临界混溶点P。
化工原理 萃取

化工原理萃取
化工原理中的一种常用技术是萃取。
萃取是一种通过在两个不相溶的相中转移物质的过程。
该过程常用于分离和提取化合物,以及从溶液或混合物中去除杂质。
在萃取中,通常会使用两种相,即有机相和水相。
有机相通常是有机溶剂,可以与待提取物质发生相互作用。
而水相则是用于分离提取物质的溶剂,通常是水或酸碱溶液。
萃取过程的关键是选择合适的有机相和水相,以及调节温度、酸碱度等条件,使得待提取物质能够在两相间分配达到最大程度。
常用的有机相包括醚类、醇类、酮类等,而常用的水相则是酸碱溶液或水。
萃取操作一般分为简单萃取和多级萃取两种方式。
简单萃取是指一次性使用一种有机溶剂进行提取,适用于提取量较少的情况。
而多级萃取则是指使用多种有机相进行多次提取,以提高提取效率和纯度。
在萃取过程中,要注意控制各种条件,如溶剂的选择、溶解度、温度、pH值等。
此外,还需要注意操作的安全性,如通风、
避免火源等。
萃取操作还需要进行后续的分离、过滤、干燥等步骤,以获得纯净的提取物质。
综上所述,萃取是一种常用的化工原理技术,通过在两个不相溶的相中转移物质,实现分离和提取化合物的目的。
在进行萃
取操作时,需要注意选择合适的溶剂、控制条件,并进行后续的分离和处理步骤。
化工原理萃取的原理和过程

化工原理萃取的原理和过程
化工原理中的萃取是一种分离技术,通过两种或更多互不溶解的液体相中的溶质分子在物理或化学作用下从一个相转移到另一个相,以实现溶质的分离和纯化。
萃取的基本原理是根据溶质在两相之间的相对溶解度不同,利用两相的不溶性将溶质从原始混合物中分离出来。
萃取过程可以分为以下几个步骤:
1. 选择合适的溶剂:根据待分离的目标溶质的性质,考虑到它在溶剂中的溶解度和选择性,选择的溶剂应与混合物的其他组分无相容性。
2. 混合物与溶剂接触:将混合物与溶剂加入一起,并充分搅拌或搅拌以实现溶质的均匀分配。
3. 平衡:让混合物与溶剂在一定的时间内保持接触,使得溶质在两相之间达到平衡分配。
4. 相分离:通过物理或化学手段,使得混合物与溶剂分成两个不溶的相。
根据溶质的亲疏水性,可以利用重力、离心、过滤或蒸发等方法分离两相。
5. 萃取:溶质会根据其相对溶解度的差异,从一个相转移到另一个相。
适当调
整操作条件,如温度、压力、pH值等,以促进溶质在两相之间的传递。
6. 分离和回收:在萃取过程中,根据溶质在两相之间的分配系数和两相的溶解度,可以通过进一步处理两相来分离和回收溶质。
综上所述,化工原理中的萃取利用两相的不溶性和溶质在两相之间的相对溶解度差异,将溶质从混合物中分离出来。
通过选择合适的溶剂、混合物与溶剂接触、平衡、相分离、调整操作条件、分离和回收等步骤,完成溶质的萃取过程。
中国石油大学化工原理第二十五讲萃取设备及本章小结
第五节 萃取设备
三、萃取设备的选择
2. 萃取设备的选择
选择萃取设备时应考虑: ①需要的理论级数 ②生产能力 ③物系的物性 ④物系的稳定性和液体在设备内的停留时间 ⑤其它
萃取设备选用
设 比 较 项 目 工艺 条件
理论级数多 处理量大 两相流量比大 密度差大 粘度高 界面张力大 腐蚀性强 有固体悬浮物 制造成本 操作费用 维修费用 面积有限 高度有限 喷淋塔 填料塔 筛板塔
第五节 萃取设备
一、萃取设备的基本要求与分类
1. 萃取设备的基本要求
液体分散 两液相的相对流动与分层
2. 萃取设备的分类
萃取设备分类
液体分散的动力 重力差 外 加 能 量 搅 脉 拌 冲
逐级接触离心机
逐级接触式
筛板塔 混合—澄清器
微分接触式
喷淋塔 填料塔 转盘萃取塔 搅拌萃取塔 脉冲填料塔 脉冲筛板塔 振动筛板塔 连续接触离心机
稀释剂与萃取剂的互溶度
萃 取 计 算
萃取剂回收的难易 萃取剂的物性 ——密度、界面张力、 萃取基本原理 粘度、蒸汽压
萃 取 设 备
萃取剂的选择
基本概念
萃 取 计 算
设备类型
萃取基本原理 设备选择
萃 取 设 备
萃取剂的选择
【选择题】
进行萃取操作时,应使______。 (A)分配系数kA > 1 (B)分配系数kA < 1 (C)选择性系数β > 1 (D)选择性系数β < 1
第五节 萃取设备
二、萃取设备的主要类型[601]
转盘塔(P602 图11-42)
结构:塔体+偏心转盘+挡板 优点:①传质效率高; ②操作弹性大、适应性强。 缺点:结构较复杂,对转速的要求较高。
化工原理(第十二章萃取)

双结点溶解度曲线(Binodal solubility curve)
A
吉 首 大 学
0.8 0.6 0.4 0.2 R B 0.8
0.2
单相区
0.4 0.6 E 0.4
组成落在单相区的三元混合物形成 一个均匀的液相; 共轭相 (Conjugate phase) :组成落 在双相区的三元混合物所形成的两 互成平衡的液相,其组成分别由 R 和 E 点表示; 联结线 (Tie line):联结E、R两点 的直线。
萃取剂 Solvent 吉 首 大 学 料液A+B Feed 混合澄清槽 Mixer-settler 萃取相 Extract
分级接触式 微分接触式 连续接触式
单级 多级错流 多级逆流
萃余相 Raffinate
单级萃取最多为一次平衡,故分离程度不高,只适用于溶质在萃 取剂中的溶解度很大或溶质萃取率要求不高的场合。
微分接触式(连续接触式)
一般为塔式设备(喷淋塔、填料塔、转盘塔、振动筛板塔等)。
化 工 原 理
吉 首 大 学
一液相为连续相,另一液相 为分散相,分散相和连续相 呈逆流流动; 两相在流动过程中进行质量 传递,其浓度沿塔高呈连续 微分变化; 两相的分离在塔的上下两端 进行。
重液进口 Heavy liquid inlet
D MC M CD
三角形相图 (三元体系的液-液平衡关系) 化 工 原 理
按组分间互溶度的不同,可将三元混合液分为: (1) 溶质A可完全溶解于B及S中,而B、S不互溶; (2) 溶质A可完全溶解于B及S中,而B、S只能部分互溶; (3) 溶质A与B完全互溶,B与S和A与S部分互溶。 萃取中(2)类物系较普遍,故主要讨论该类物系的液-液相平衡。
《化工原理》第九章 萃取.

(2)E相和R相的量与线段MR和ME的长度成比例,即:
E MR R ME
(9-1)
第一节 液-液萃取的基本原理
式中 E、R ——分别代表相和相的质量,kg;
MR 、ME ——分别代表线段MR和ME的长度。
若三元混合物M是由二元混合液F和纯组分混合S而成 的,如图9-4所示,则为M与S的和点F,M与S、F处于同一 直线上。同样可依杠杆规则得出如下关系:
2.组分的热敏性大,采用蒸馏方法易导致热分解、 聚合等化学变化。
3.溶液沸点高,需要在高真空下进行蒸馏。 4.溶液中溶质的浓度很低,用蒸馏方法能耗太大, 经济上不合理。 液-液萃取技术的应用不限于以上几个方面,而是有 着广泛的前景。萃取与蒸馏两种分离方法可以互相补充。 实践证明,适当选用蒸馏或萃取,几乎所有液体混合物都 能有效而经济的实现组分间的完全分离。
第一节 液-液萃取的基本原理
1.三组分系统组成的表示法
液-液萃取过程也是以相际的平衡为极限。三组分系 统的相平衡关系常用三角形坐标图来表示。混合液的组成 以在等腰直角三角形坐标图上表示最方便,因此萃取计算 中常采用等腰直角三角形坐标图。
在图9-1中,三角形的三个顶点分别表示纯组分。习 惯上以顶点A表示溶质,顶点B表示原溶剂,顶点S表示萃 取剂。三角形任何一个边上的任一点代表一个二元混合物, 如AB边上的H点代表由A和B两组分组成的混合液,其中A的 质量分数为0.7,B为0.3。三角形内任一点代表一个三元 混合物,如图M中的点,过M点分别作三个边的平行线ED、 HG与KF,其中A的质量分数以线段MF表示, B的以线段MK表 示,S的以线段ME表示。由图可读得:WA =0.4,WE=0.3, WS=0.3。可见三个组分的质量分数之和等于1。
化工原理课件12萃取(LiquidExtraction)

05
萃取过程的优化与改进
提高萃取效率的途径
选择合适的萃取剂
根据待分离物质的特点和分离要 求,选择具有高选择性、高溶解
度、低能耗的萃取剂。
优化萃取工艺参数
通过调整温度、压力、浓度等工 艺参数,提高萃取效率和分离效
果。
强化传质过程
采用多级萃取、逆流萃取等工艺, 增加萃取剂与待分离物质接触机
会,提高传质效率。
3
萃取技术的优化
根据不同天然产物的性质和目标成分,选择合适 的萃取剂和工艺条件,提高萃取效率和纯度。
THANKS
感谢观看
它由多个塔板组成,液体在塔 内逐板下降,同时与上升的气 体或液体逆流接触,实现传质 与分离。
塔式萃取器的优点是处理能力 大、分离效果好,但结构复杂、 造价高、操作维护困难。
离心萃取器
离心萃取器利用离心力的作用使两液 相实现分离。
离心萃取器的优点是处理能力大、分 离效果好、结构简单、操作方便,但 制造成本较高。
04
萃取过程的设备
混合-澄清槽
混合-澄清槽是一种简单的萃取 设备,适用于两相接触后能迅速
分离的情况。
它由一个混合室和一个澄清室组 成,混合室用于使不相溶的两液 相混合,澄清室则用于分离两液
相。
混合-澄清槽结构简单,操作方 便,但处理能力较小,且分离效
果不够理想。
塔式萃取器
塔式萃取器是一种常见的萃取 设备,适用于处理大量物料。
双水相萃取技术
利用两种水相间物质分配的差异,实现高效分离和纯化。
06
萃取过程的实例分析
工业废水处理中的萃取应用
工业废水中的有害物质
01
工业废水可能含有重金属、有机污染物等有害物质,对环境和
化工原理下萃取过程的流程与计算

化工原理下萃取过程的流程与计算化工原理中的萃取过程是指利用溶剂将目标物质从混合物中分离出来的操作过程。
该过程适用于从可溶液中获得目标物质,或者将两相液体或气体中的目标物质转移至另一相中。
萃取过程的流程一般包括以下几个步骤:1.选择合适的溶剂:根据目标物质的物化性质,选择适合的溶剂。
该溶剂应与混合物中其他成分相互不溶或溶度低。
同时,溶剂的选择还要考虑到需求的目标物质浓度、产率和分离度等因素。
2.混合物预处理:将待萃取的混合物进行预处理,以提高目标物质的相对浓度。
预处理手段可以包括调整溶剂酸碱性、溶剂萃取剂的加入以及混合物的预处理等。
3.萃取过程:在一定温度条件下,将混合物与溶剂充分接触并反应。
在这个过程中,目标物质会从混合物中转移到溶剂中,得到所需的提取液。
4.分离过程:对提取液进行分离,获得目标物质。
分离过程可以采用各类分离工艺,如蒸馏、结晶、过滤等。
萃取过程的计算主要涉及到平衡和热力学方面的内容。
其中,平衡计算主要包括挥发分离计算、浸出平衡计算和溶剂选择计算等。
而热力学计算主要包括传热和传质方面的内容,例如浸出塔传质速率的估算、提取液的热力学性质计算等。
以浸出平衡计算为例,其步骤如下:1.确定混合物的成分:通过实验或其他手段,获得混合物的成分组分,包括所需的目标物质。
2.根据热力学平衡关系,建立分离物质在混合物与溶剂中的分配系数。
该系数表示分离物质在两相中的相对分配情况。
3.在给定温度和溶剂比例下,根据分配系数计算提取液中目标物质浓度。
4.根据计算结果,可以调整溶剂比例、反应温度或溶剂浓度等参数,以提高目标物质的回收率和分离度。
需要注意的是,萃取过程的最终计算结果可能受到外部因素的影响,如反应速率、传质速率、传质过程中的温度变化和浓差极化等。
因此,在进行计算时,需要综合考虑多个因素,进行系统的分析和优化。
综上所述,化工原理中的萃取过程是一种分离技术,其流程包括溶剂选择、混合物预处理、萃取过程和分离过程。
化工原理实验—萃取

化工原理实验—萃取萃取是化工工程中常见的分离纯化技术,其基本原理是将混合物中的目标化合物转移至另一种不相混溶的可溶剂中,从而实现分离纯化。
萃取广泛应用于化工、生物工程、食品行业等领域,具有操作简便、分离效率高、纯度可控等优点。
本实验旨在通过萃取实验,加深学生对萃取原理及操作技巧的理解,提高学生解决工程问题的能力和综合实验操作技能。
实验一:两相萃取分离苯和甲苯实验原理:苯和甲苯是两种不同的有机物,可以用两相萃取法进行分离。
两相萃取法是指两种可相互溶解的液体用分液漏斗分离,其中一种液体通常为水,称为水相,另一种液体为无水溶液,称为有机相。
以苯和甲苯为例,实验原理如下:苯和甲苯对水不溶,可以用水作为萃取剂,使其溶于水相中,从而完成两相分离。
实验步骤:1. 将5 mL苯和5 mL甲苯混合在干净干燥的锥形瓶中,摇匀后记录混合物体积。
2. 将混合液倒入分液漏斗中,加入等体积的水。
3. 将分液漏斗盖住并轻轻摇动,使两相充分混合。
4. 等两相分离后,打开分液漏斗的滴嘴,放出有机相,记录体积。
5. 重复取两组数据。
6. 根据实验数据计算苯和甲苯在水中的分配系数。
实验结果:实验数据如下表所示:混合物体积/mL 有机相体积/mL10 5.5计算分配系数:由于苯和甲苯对水不溶,可以假设二者在水相中的浓度非常接近于0,因此可以利用分配定律(分配系数=有机相中溶质的摩尔浓度/水相中溶质的摩尔浓度)计算分配系数。
在实验中,混合物体积相同,有机相中苯和甲苯的摩尔浓度分别为:由于苯和甲苯的分子量相似,可将它们的平均摩尔浓度作为计算结果(C=(0.043+0.043)/2=0.043 mol/L)。
水相中溶质的摩尔浓度非常接近于0,可认为不对分配系数产生影响。
Kd = (5.5 mL/10 mL)/(4.5 mL/10 mL) ≈ 1.22实验二:萃取纯化对乙酰氨基酚实验原理:对乙酰氨基酚是一种亲水性较强的化合物,可以通过萃取纯化的方法提高其纯度。
化工原理萃取

化工原理萃取首先,我们来谈谈萃取的基本原理。
萃取是利用两种或多种互不相溶的溶剂对混合物进行分离的方法。
在化工生产中,通常会选择一种有机溶剂和水作为两相,通过它们之间的分配系数差异,实现混合物中组分的分离。
这种分离方法在化工生产中具有广泛的应用,可以用于提取、分离、净化各种化合物。
其次,萃取的操作过程需要注意的一些关键因素。
首先是溶剂的选择,溶剂的选择直接影响到萃取的效果。
其次是溶剂的用量,合理的溶剂用量可以提高萃取效率,降低成本。
另外,萃取的操作条件也需要严格控制,包括温度、压力、搅拌速度等参数的选择。
在进行萃取操作时,需要根据具体的混合物成分和要求,选择合适的操作条件,以达到最佳的分离效果。
在化工原理萃取的应用中,有一些常见的萃取设备。
例如,萃取塔是一种常见的萃取设备,它通常由填料层和萃取剂层组成,通过填料的大表面积接触,实现混合物中组分的分离。
此外,还有萃取离心机、萃取萃取器等设备,它们都在化工生产中发挥着重要的作用。
最后,化工原理萃取在工业生产中具有广泛的应用。
它可以用于石油化工、化学工业、生物工程等领域,实现各种物质的提取、分离和净化。
在石油化工中,萃取可以用于提取石油中的杂质和有用成分;在化学工业中,可以用于有机合成反应中的产物提取和分离;在生物工程中,可以用于生物制品的提取和纯化。
可以说,化工原理萃取在化工生产中发挥着不可替代的作用。
综上所述,化工原理萃取是一种重要的分离技术,它通过溶剂在两种或多种相之间的传质作用,实现混合物中组分的分离。
在化工生产中,萃取具有广泛的应用,需要化工工程师们熟练掌握其基本原理、操作过程和常见设备。
只有深入理解化工原理萃取,才能更好地应用于工业生产中,实现物质的提取、分离和净化,为化工生产的高效运行提供有力支持。
中国石油大学化工原理萃取5

35
3.用纯溶剂S对A、B混合液进行单级(理论)萃取,当 萃取剂用量增加时(进料量和组成均保持不变)所获得 的萃取液组成变化是( D )。 A 增加 B 减少 C不变 D变化趋势不确定
4.单级(理论)萃取中,在维持进料组成和萃取 相浓度不变的条件下,若用含有少量溶质的萃 取剂代替纯溶剂所得萃余相浓度将( C )。 A 增加 B 减少 C不变 D不一定
13
X F Y2 代入上式,得 X1 1 1
第3级的萃余相组成X3为
X F Y4 (1 1 1 2 ) X3 1 1 1 2 1 2 3
依次类推,直至第N级(最末一级)的萃余相组成XN为
XN X F Y0 (1 1 1 2 1 2 N 1 ) 1 1 1 2 1 2 N
B Yi X i-X i-1 S
Y1
N
E1 E2 E3 E4
E
X lg ( F ) XN N lg (1 )
Y
XN XF
1
Y2 Y3 Y4
0
X4 X3 X2 X
X1
XF
多级逆流萃取过程
1.流程
多级逆流萃取操作线
F E1 R 1 E 2 R i -1 E i R n S
25
逐级接触式萃取设备 筛板塔
液滴夹带 不设出口堰
26
连续接触式萃取设备
优点: 结构简单,投资小 缺点: 效率低、轴向返混
27
连续接触式萃取设备 脉动萃取塔 往复(振动)筛板塔 转盘萃取塔
28
二、连续逆流萃取的流程与计算
1、连续逆流萃取的流程
29
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
BX F SY BX
12
四、应用场合-之一
沸点接近或相对挥发度接近于1的物系分离: 沸点接近或相对挥发度接近于1的物系分离:
1
环己烷(A)与苯(B)常压沸点为80.73OC、 80.1OC,α→1,加入糠醛后,α可达到2分离: 恒沸物分离:
上层:苯0.761,乙醇0.189,水0.05
44
三、三元物系的相平衡关系-辅助曲线
辅助曲线 辅助曲线 Auxiliary Auxiliary curve curve
方法一: 联结线E1R1、E2R2、E3R3、 E4R4,分别从E1、E2、E3、E4点作AB 平行线,与由R1、R2、R3、R4点分 别作的BS平行线相交,连结各交点 得辅助曲线; 辅助曲线与溶解度曲线的交点即 为临界混溶点P。
S MS F FM
S↑M向S移动
37
三、三元物系的相平衡关系
-B、S完全不互溶
38
三、三元物系的相平衡关系
-B、S部分互溶
A
根据A、B在S中溶解度的不同分为三种情况:
A A
B A-B完全互溶 A-S完全互溶 B-S部分互溶
S B A-B完全互溶 A-S部分互溶 B-S部分互溶
S
B A-B完全互溶 A-S部分互溶 B-S部分互溶
-总结
纯物质— 三角形顶点 A、B、S
A
二元混合物—三角形的边AB、BS、SA 三元混合物—三角形内部的点M 如何确定点的坐标?
M
B
S
32
二、物料衡算与杠杆定律
1.物料衡算 1.物料衡算 material material balance balance
两种不同浓度的溶液U和V(均含有A、B和S)混 合后形成混合溶液M,则U、V和M的质量及组成关 系为:
43
三、三元物系的相平衡关系-临界混溶点
A
临界混溶点 Plait : 临界混溶点 Plaitpoint point :
对B、S两相混合物,当加入A的量使 混合液恰好变为均相的点称为混溶点。 两个共轭相组成相同时的混溶点称为 临界混溶点,以P表示。
B
P E1 E
S
R1 R
M1 d
注 P点将溶解度曲线分为萃取相区域与萃余相区域。一般临界混溶点并不 是溶解度曲线的最高点。
15
四、应用场合-之四
浓度低且为难挥发组分的分离: 浓度低且为难挥发组分的分离: 以乙酸乙酯为萃取剂从 稀醋酸水溶液中回收醋 酸(90%左右)。
16
五、萃取剂S的选择
选择性好: 选择性好:
17
五、萃取剂S的选择
E 、 R 易分相: E 、 R 易分相:
为使萃取相 E 与萃余相 R 能较快的分层,要求萃取剂 S 与稀释剂B有较大的密度差。
原料液F (A+B) 萃取剂 (S)
混合槽
5
二、简单的萃取过程
-沉降分离
E yA R xA
萃取相 萃余相
萃取相,以E表示(A+SE+B少) 萃余相,以R表示 (B+A少+SR)
沉降分离
6
二、简单的萃取过程
-脱除溶剂
萃取液E’ 萃取相 SE S 萃余相 SR 萃余液R’
脱除溶剂
E和R脱溶剂后分别得萃取液 (E’) 和萃余液 (R’) 萃取液(Solvent-free extract,A+B少) , 萃余液(Solvent-free raffinate,B+A少)。
B
R1 R
M1 d
E1 E
S
42
三、三元物系的相平衡关系-共轭相
溶解度曲线: 溶解度曲线:
A 0.8 0.6 0.4 0.2 0.2
单相区
0.4 0.6
两相区
0.8 0.2 S
E R M
0.8 0.6 0.4
B
溶解度曲线将三角形分 为两个区域:曲线以内为 两相区,曲线以外的为单相 区。 共轭相 (Conjugate phase) :互成平衡的液相。 其组成分别由R和E点表 示。
S
39
三、三元物系的相平衡关系-作法P1
溶解度曲线(以 B 、 S 部分互溶): 溶解度曲线(以 B 、 S 部分互溶):
A
在纯组分B中加S使其溶 解(d1),S加到一定数量 后,到达R点时,溶液由透明 变混浊,即S在B中达到饱 和,出现两相,R点称为分层 点(混溶点), 继续加S,则 到达E点又重新透明, E点亦 称为分层点(混溶点) 。
S B
M
S
25
一、三元组成的表示方法-△
顶点
纯组分 A 、 B 、 S )的表达 纯组分 ( ( A 、 B 、 S )的表达
A
点A:xA=100% 点B:xB=100% 点S:xS=100%
B S
26
一、三元组成的表示方法-△
三边
二元混合物( A+B,A+S,B+S )的表达 二元混合物( A+B,A+S,B+S )的表达
10
三、萃取过程特点-完全不互溶概念
完全不互溶特点: 完全不互溶特点:
(B和S)
⑴ 仅有组分A富集到E相,E相由A+S组成,脱SE后得到A ⑵ 组分B全部富集到R相,R相由A+B组成,分离A后得到B ⑶ 同单组分吸收过程一样,E、R相都是二元混合物
11
三、萃取过程特点-完全不互溶物平
浓度表示与吸收接近: 浓度表示与吸收接近:
21
第二节 萃取的基本原理
一、三元组成的表示方法 二、物料衡算与杆杠定律 三、三元物系的相平衡关系 四、分配系数kA与选择性系数 五、萃取过程在三角形相图上的表示
22
一、三元组成的表示方法-问题的提出
y A yB 1
x A xB 1 y A yB 1
y A y B ys 1
A
F
如何确定 M 如何确定 M 点坐标? 点坐标?
过M作S对边AB的平行线
S
M
B
xS =AF=0.3
30
一、三元组成的表示方法-△
内部
三元混合物中 B 含量如何表达: 三元混合物中 B 含量如何表达:
A
如何确定M 如何确定M 点坐标? 点坐标?
M
xB =1- xA - xS =0.3
S
B
31
一、三元组成的表示方法
物料衡算: 总:U+V=M A: UyA+VxA=MzA S: UyS+VxS=MzS
33
二、物料衡算与杠杆定律
2.杠杆定律的内容 2.杠杆定律的内容 (1) M、U、V三点共线。 (2)溶液U与溶液V的质量之比 等于线段MV与线段MU之比。即
U MV 或 U MU V MV V MU
3
二、简单的萃取过程-工艺流程
原料液F (A+B) 萃取剂 (S) 萃取液E’
萃取相 萃余相
E R
-SE
S
-SR 萃余液R’
混合槽
沉降分离
脱除溶剂
4
二、简单的萃取过程
-混合
原料液F由溶质A+稀释剂B组成; 溶质(Solute ),以A表示; 稀释剂(Diluter/Diluting agent )以B表示 萃取剂(Extractant ),以S表示;
A
P R4 R3 R2 R1
E4
E3 E2 E1
S
B
已知共轭相中任一相的组成,可利用辅助线得出另一相的组成。
45
三、三元物系的相平衡关系-辅助曲线
辅助曲线 辅助曲线 Auxiliary Auxiliary curve curve
A
方法二: 分别从E1、E2、E3、E4点引 AB平行线,与分别从R1、 R2、R3、R4点引出的AS平 行线相交,连结各交点得辅 助曲线。 辅助曲线延长线与溶解度曲 B 线的交点即为临界混溶点P。
⑴ E相 气相, R相 液相 ⑵ 萃取剂S全部进入E相,稀释剂B全部进入R相
m XF A mB F mA YA Y m S E m XA X A mB R
B : BF BR B S : S SE A : FA E A R A BF X F S E Y BR X
U MU V MV
35
二、物料衡算与杠杆定律
4.杠杆定律的总结 4.杠杆定律的总结 a)U、V 、M 三点共线,M 点为U与V点的和点,U(V) 点为M点与V(U)点的差点。 b)分量与合量的质量与直线 上相应线段的长度成比例。
36
二、物料衡算与杠杆定律
5.杠杆定律的应用 5.杠杆定律的应用 U,V或M点的确定 原料中加入S
x A xS 1
x A xB xS 1
在精馏与吸收中 xA已知,xB=1-xA; yA已知,yB=1-yA
23
一、三元组成的表示方法-问题的提出
三元物系平衡关系 三元物系平衡关系 如何表示? 如何表示?
24
一、三元组成的表示方法-解决方法
利用三角形……
A A A
M
B S B
M
7
二、简单的萃取过程-总结
工业萃取过程由三个基本过程组成,即 (1)混合 使S和F(A+B)充分混合,实现溶质A由F向S传递。 (2)沉降分离 进行萃取相E和萃余相R的分离。 (3)脱除溶剂 E和R脱溶剂得E’(A+B少)和R’ ( B+A少) ,S
循环使用。
8
三、萃取过程特点
-与蒸馏、吸收比较
乙醇-水二元 混合物相图
苯
下层:苯0.017,乙醇0.316,水0.667
乙醇-水恒沸组成:乙醇 0.894 (mol%),水/乙醇≈0.12,加入 苯,形成三元恒沸物,乙醇: 0.23;水:0.226,水/乙醇≈1 。
