晶体的结合力及结合能第二章
第二章 晶体的结合

范德瓦尔斯力的分类: 1)葛生互作用力:取向力,固有电偶
极矩间的作用力(极性分子晶体中) 2)德拜互作用力:感应力,感应电偶极
矩间的作用力(极性分子晶体中) 3)伦敦互作用力:弥散力,瞬时电偶极
矩间的作用力(非极性分子晶体中)
一、极性分子结合 因为两极性分子同性相斥,异性相吸,有使偶极矩 排成一个方向的趋势。
r
12
A6
r12
j
1 a1j2
,
A6
j
1 a6j
2.2.4 离子晶体的结合能
若两个离子间的互作用势为
r
e2
40r
b rn
I族元素:Li、Na、K、Ru、Cs具有最低的负 电性,它们的晶体是最典型的金属。负电性 较低的元素对电子束缚较弱,容易失去电子, 因此形成晶体时便采取金属性结合。 IV族至VI族元素:具有较强的电负性,它们 束缚电子比较牢固,获取电子的能力较强, 这种情况适于形成共价结合。 IV族元素:最典型的结构是金刚石结构,金 刚石结构直接反映了共价结合的特点。
2.2.3 分子晶体的结合能
惰性气体分子间的相互作用是瞬时偶极矩与
瞬时感应偶极矩间的作用,类同于极性分子
与非极性分子的吸引势,所以一对分子间的
互作用势能为
r
A r6
B r12
引入两个参量
A2 4B
,
1
B 6 A
r
4
r
12
原子间吸引力和排斥力的来源: 吸引力:异种电荷的库仑引力。 排斥力: 1.同种电荷的静电排斥。
固体物理:第二章 晶体的结合

晶体为什么形成这么有序的结构?
7
原子结合成晶体时,原子的外层电子要作重新
分布
不同分布产生了不同类型的结合
力
不同类型的结合力,导致了晶体结合
的不同类型。
+ = 原子
原子核+ 芯电子(稳定、满壳层)
价电子
原子外层的芯电子层对相互作用贡献不大,价电子的
相互作用
决定了原子间的相互作用后的性质。
同一种原子,不同的结合类型中具有不同的电子云分布,因此呈现出
10
我们讲到:
原子外层的芯电子层对相互作用贡献不大,价电子相互
作用
决定了原子间相互作用的性质。
原来中性的原子能够结合成晶体,除了外界的压力和温度 等条件的作用外,主要取决于原子最外层电子的作用。没 有一种晶体结合类型,不是与原子的电性有关的。
下面我们来系统学习一下:18
各壳层容纳的电子数
19
能量最低原理 “电子优先占据最低能态”
20
21
22
原子捕获电子的能力(电性)
一、电离能
定义:使原子失去一个电子所需要的能量称为原子的电离能。 从原子中移去第一个电子所需要的能量为第一电离能,从正1 价离子中再移去一个电子所需要的能量为第二电离能。
Na + 5.14 eV Na+ + e
23
电离能的大小可以用来度量原子对价电子的束缚强弱。 电离能越大,越难失去电子;电离能越小,越易失去电 子,金属性越强。 在一个周期内,从左到右,电离能不断增加。
24
二、电子亲和能
定义:一个中性原子获得一个电子成为负离子所释放出的能 量称为电子亲和能,亲和过程不能看成是电离过程的逆过程。 电子亲和能越大,那么得到电子的能力越大。 电子亲和能一般随原子半径的减小而增大。因为原子半径小, 核电荷对电子的吸引力较强,对应较大的互作用势。
7、晶体的结合力(第二章)详解

A Wi A (e)
原子半径、有效核电荷和原子的 电子构型 电离能的意义:反映了元素原子失
电子的难易,电离能越大,失电子
越难,金属性越弱,电离能越小, 金属性越强。
电离能变化规律:
A:同周期元素而言,ⅠA族第一电离能小,ⅦA族第一电离能最大,从左到右总体 呈现增大趋势. B:同主族,从上到下,第一电离能逐渐减弱
胞是体心立方结构。碳原子
熔于铁的体心立方组织叫铁 素体--单相α 相 。 纯 铁 在 912℃ 以 上 的 晶 胞也是一个立方体 -- 面心立 方结构。碳原子熔于铁的面 心立方组织叫奥氏体。
第 26 页
§2.2 晶体的结合类型
Page 27
不同金属的熔点,在很宽的范围内变化。铅的熔点:327度,锡的熔
第 21 页
§2.2 晶体的结合类型
三、金属结合(金属晶体)
(1)元素族:
大多数的元素是金属,周期表上I, II
族元素及过渡元素(Cu, Al, Mg, Zn, Ni)
(2)结合方式: 原子的最外层电子形成共有化的电子云,剩下的原子实(正离子)具有 稳定的满壳层结构。 (3)结合力: 原子实(正离子)和电子云之间的静电库仑力。无饱合性和方向性。 原子实与电子云之间的作用,不存在明确的方向性,原子实与原子实
原子中各壳层可以容纳的最多电子数
壳层 (主量子数)
K(n=1)
L(n=2) M(n=3) N(n=4) O(n=5)
支壳层2(2l+1)
S(l=0) P(l=1) d(l=2) f(l=3) g(l=4)
最多电 子数
(2n2)
2
2 2 2 2
6 6 6 6
10 10 10
14 14
固体物理-第二章

本
如H2、N2、O2在低温时可以变成固体,室温下它们都是以气态分
特
子形式存在的,也就是说,室温的热能已足够破坏分子之间的结
点
合力,但分子内的结合力是很牢固的。这种分子间的力实际上是 范德瓦尔斯力,分子内的力就是共价键力,由于电子对键的客观
限制,使得H2、N2、O2只能以低配位的形式存在。
➢ 固态:存在一些相对高配位的共价键晶体结构,即整个晶体是靠 共价键力结合起来的,例如:金刚石的结构。
➢共价键与共价晶体
金刚石
典
➢ 和闪锌矿的结构有点类似:几何结构上两者的构型
型
完全相同(四配位),只是闪锌矿由S2-和Zn2+两种
的
离子组成,金刚石则全都是碳原子。
纯
共
价
键
晶
体
➢共价键与共价晶体
金刚石
典
型
➢ 两者存在本质差别:结合力不同。
的
✓ 闪锌矿是一种典型的离子晶体,同其它AB型离子结构一
纯
样,是由于S2-和Zn2+两种离子的相对大小恰好合适,使 得相等数目的阴、阳离子成为六方密堆积,即大个的阴
1 k
V
P V
T
V
2U
V
2
V
应 用
在T=0K时(忽略原子振动的影响),晶体平衡体积为V0,则:
2U
K
V0
V 2
V V0
➢原子间相互作用能
抗张强度的计算
抗张强度Pm:晶体所能承受的最大引力
结
合
当晶体所受张力处于r=rm处时,有效引力最大,此时张力
氢键与氢键晶体
离子晶体的结合力与结合能混合键与混合键晶体
第二章晶体的结合

两个相互平行的电偶极子的库仑势能可以求 出:
ur
1
40
q2 r
r
q2 l2 l1
q2 r l1
q2 r l2
ur
q2
40r
1 1
1 l2 l1
1 1 l1
1 1 l2
q2l1l2
1 2
N i 1
N j 1
' 4
rij
6
rij
12
N 2
N j 1
'
4
rij
6
rij
12
说明:金属晶体中,价电子不再属于个别 原子,而是为所有原子所共有,在 晶体中做共有化运动,或者说金属中 所有原子都失掉了最外层价电子成为 原子实(离子实),原子实浸没在 共有电子的电子云中,金属晶体的 结合力主要是原子实和共有化电子的 静电库仑力。
4. 范德瓦耳斯键和分子晶体
分子间的相互作用力(范德瓦耳斯力)分为三种:
配位数小,4 特点:
1)饱和性(一个原子只能形成一定数目的共价 键。)
2)方向性:原子只在特定的方向上形成共价键。 3)熔点高、硬度大、导电性差,结合能大 约为800kJ/mol。
饱和性经验公式:当原子的价电子壳层不到半满 时,所有的价电子都未配对,共价键数目与价电 子数相等。N=n(N为价电子数);当原子的价 电子壳层不满但超过半满时,形成的共价键数目n =8-N。
固体物理第二章复习

式中
B
1
6
;
A2
A
4B
'N 1
A12
j
a12 j
A6 , A12 是仅与晶体结构有关的常数。
'N 1
A6
j
a6 j
3.原子晶体、金属晶体和氢键晶体
(1)原子晶体
结构:第Ⅳ族、第Ⅴ族、第Ⅵ族、第Ⅶ族元素都可以形成
原子晶体。
结合力: 共价键 (2)金属晶体
饱和性 方向性
层一共有 8 个量子态, 最多能接纳(8- N)个电子, 形成(8- N)个共价键. 这就 是共价结合的 “饱和性”.
共价键的形成只在特定的方向上, 这些方向是配对电子波函数的对称轴方向, 在这个方向上交迭的电子云密度最大. 这就是共价结合的 “方向性”.
10. 为什么许多金属为密积结构? 金属结合中, 受到最小能量原理的约束, 要求原子实与共有电子电子云间的
(2)结合力: 范德瓦尔斯力。
(3)配位数: 通常取密堆积,配位数为12。
(4)互作用势能:
u(r )
4
12
6
r r
U ( R)
2 N
A12
R
12
A6
R
6
雷纳德-琼斯势
r1 rA a, a1 1, r2 rB 2a, a2 2, r3 rC 3a, a3 3,
2( 1 1 1 1 ) ln( 1 x ) x x2 x3 x4
第二章晶体结构结合力和结合能
较弱 无方向性键、结构密堆、低 熔点、绝缘
氢键 氢原子核与极性分子 弱 有方向性和饱和性 间的库仑引力School of materials Science and engineering Prof. Y.X. Li 第五页,编辑于星期五:十七点 四十九分。
2.3 晶体中质点的堆积
2.3.1 原子半径和离子半径 原子半径或离子半径
有效半径
离子半径 共价半径 金属半径
一种原子在不同的晶体中,与不同的元素相结合时, 其半径有可能发生变化。晶体极化、共价键的增强和配位 数的降低都可使原子或离子之间距离缩短,而使其半径减 小。
School of materials Science and engineering Prof. Y.X. Li 第十三页,编辑于星期五:十七点 四十九分。
对于1molAX型晶体,原子总数N=2N0,于是晶格
能计算如下:
EL
N0 Az1z2e2 1 1
4 0r0
n
取决于晶体 结构类型
式中:A-马德龙常数见表2.4(P24)
n-Born Index.(与离子的电子层结构有关)。
ε0-真空的介电常数,
取决于电子 ≈8.85×10-12C2.N-1m-2 层结构
School of materials Science and engineering Prof. Y.X. Li 第二十一页,编辑于星期五:十七点 四十九分。
2.3.3 内在因素对晶体结构的影响-化学组成 (1)原子或离子半径
•原子半径或离子半径是定值吗?
•原子半径或离子半径的大小与哪些因 素有关?
氢键:指氢原子同时与两个电负性很大而原子半径较
第二章 晶体结合

方向性------各个共价键之间有确定的取向。 成键时,电子云发生交叠,交叠越多键能越大,系统 能量越低,键越牢固。
例如:金刚石结构的4个键的方向是沿着正四面体的4 个顶角方向,键间的夹角恒为109028‘。
特性:
特性差别较大。典型的原子晶体,具有熔点高、热 膨胀系数小,导电性能差、硬度高等特点。 例如: 从熔点来看,金刚石约为3280k、而Si为1693k,Ge 为1209k。 从导电性来看,金刚石是一种良好的绝缘体,而Si 和Ge在极低温度下才是绝缘体,同时它们的电阻率 随温度升高而急速的下降,是典型的半导体材料。
结合能 强 数ev/键
稳定的正、负离子相 间排列通过库仑静电 力相互吸引。
熔点高:硬度大,膨胀系数 小,易沿解理面劈裂,高温 下有良好的离子导电性。
周期表左右两 边负电性差异 大的原子之间 形成结合。 负电性接近且 较大的原子或 同种原子相互 结合。
共价键:两原子共有 的自旋相反配对的电 子结构。
完整晶体硬度大, 熔点一般较高, 低温下导电性能较差,为绝缘体 或半导体。化学惰性大,由于饱 和性、方向性,决定了原子排列 只能取有限的几种形式。
四、电负性
度量原子吸引电子的能力。一般选定某原子的 电负性为参考值,其他原子的电负性与此参考值作 比较。
穆力肯提出的电负性定义为: 负电性=0.18(电离能+亲和能) 常数的选择以方便为原则,例如一种常用的选择方 法:为使锂(Li)的负电性为1,选上常数为0.18。
泡林提出的电负性计算为:
E(A-B)= [E(A-A)×E(B-B)]1/2+96.5(xA-xB)
xA,xB 原子A和B的电负性;
E(A-B):双原子分子AB的离解能
E(A-A) :双原子分子AA的离解能
1第二章 晶体的结合答案(共90道题)解读

目录第二章晶体的结合题目(共90道题) (2)一、名词解释(共12道题) (2)二、简答题:(共33道题) (3)三、作图题(共2道题) (12)四、证明题(共8道题) (13)五、计算题(共35道题) (22)第二章晶体的结合题目(共90道题)一、名词解释(共12道题)1.晶体的结合能答:一块晶体处于稳定状态时,它的总能量(动能和势能)比组成此晶体的N个原子在自由状态时的总能量低,两者之差就是晶体的结合能。
2.电离能答:一个中性原子失去一个电子所需要的能量。
3.电子的亲和能答:指一中性原子获得一个电子成为负离子时所放出的能量。
4.电负性答:描述化合物分子中组成原子吸引电子倾向强弱的物理量。
5.离子键答:两个电负性相差很大的元素结合形成晶体时,电负性小的原子失去电子形成正离子,电负性大的得到电子形成负离子,这种靠正、负离子之间库仑吸引的结合成为离子键。
6.共价键答:量子力学表明,当两个原子各自给出的两个电子方向相反时,能使系统总能量下降,从而使两个原子结合在一起,由此形成的原子键合称为共价键(原子晶体靠此种键相互结合)。
7.范德瓦尔斯键答:分子晶体的粒子间偶极矩相互作用以及瞬时偶极矩相互诱生作用称为范德瓦耳斯力。
8.氢键答:氢原子处于两个电负性很强的原子(如氟、氧、氮、氯等)之间时,可同时受两个原子的吸引而与它们结合,这种结合作用称为氢键。
9.金属键答:在金属中,组成金属的原子的价电子已脱离母原子而成为自由电子,自由电子为整个晶体共有,而剩下的离子实就好像沉浸在自由电子的海洋中。
自由电子与离子实间的互相吸引作用具有负的势能,使势能降低形成稳定结构。
这种公有化的价电子(自由电子)与离子实间的互作用称为金属键。
10.葛生力答:葛生力是极性分子的永久偶极矩间的静电相互作用。
11.德拜力答:德拜力是非极性分子被极性分子电场极化而产生的诱导偶极矩间的相互作用。
12.伦敦力答:伦敦力:非极性分子的瞬时偶极矩间的相互作用。
第二章 晶体的结合

固体材料是由大量的原子(或离子)组成约1 mol / cm 3原子(或离子)结合成晶体时,外层电子作重新分布,外层电子的不同分布产生了不同类型的结合力.Na Cl +=NaCl 离子键共价键金属键结合力类型决定了晶体的微观结构乃至宏观物理性质.本章主要介绍不同结合类型中原子间相互作用与晶体内能、晶体的微观结构和宏观物理性质之间的联系.共价键结合(金刚石)--原子间束缚非常强,导电性差金属键结合(金属Cu )--对电子束缚较弱,良导体——原子的电子分布核外电子的分布遵从泡利不相容原理、能量最低原理和洪特规则.能量最低原理电子在原子核外排布时,要尽可能使电子的能量最低1s、2s、2p、3s、3p、4s、3d、4p、4d……泡利不相容原理每一轨道中只能客纳自旋相反的两个电子.洪特规则电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行——原子的电子分布_----电离能_----电离能_----电离能_----电子亲和能_----原子电负性_----原子电负性2.Pauling鲍林提出的电负性计算方法(较通用):_----原子电负性•横向•电离能•亲和能•电负性按结合力的性质和特点,晶体可分为5种类型:离子晶体(离子结合)共价晶体(共价结合)金属晶体(金属结合)氢键晶体(氢键结合)如何理解各种晶体呢?离子晶体:正离子与负离子的吸引力就是库仑力.共价结合:靠近的两个电负性大的原子各出一个电子形成电子共享的形式.金属结合:原子实依靠原子实与电子云间的库仑力紧紧地吸引着.氢键结合:氢先与电负性大的原子形成共价结合后, 氢核与负电中心不在重合, 迫使它通过库仑力再与另一个电负性大的原子结合.分子结合:电偶极矩把原本分离的原子结合成了晶体. 电偶极矩的作用力实际就是库仑力.可见, 所有晶体结合类型都与库仑力有关.原子间相互作用势能----结合力的共性吸引力排斥力库仑引力库仑斥力泡利原理引起(1)吸引力和排斥力都是原子间距离r 的函数.注:(2)吸引力是长程力,排斥力短程力.(3)当r =r 0时, 原子间合力为零, 原子处于平衡.类比于弹簧振子()()⎟⎠⎞⎜⎝⎛−−=−=++11n m r nB r mA dr r du r f 为什么排斥力是短程力?()()()B A r u r u r u +−=+=()()⎜⎛−−=−=nB mA r du r f设晶体中第i个原子与第j个原子之间的相互作用势能u(r)为ij()()∑∑∑==NNNr u r u U 1晶体的结合能:()()∑=N r u Nr u晶格常数由于晶格具有周期性,设临近两原子间距R,则晶体体积可写成体弹性模量单位压强引起的体积的相对变化率。
固体物理学:第二章 晶体的结合 (2)

两粒子间的相互作用力f(r)和相互作用势能u(r)随粒子间距r变化 的一般关系如图
1:两粒子间的相互作用势能u(r) 两粒子间的相互作用势能u(r),可用下面的表达式表示
1:两粒子间的相互作用力
二. 晶体的结合能
Eb 为负值,表示晶体的能量比构成晶体的粒子处在自由状态时 的能量总和低。 Eb 的绝对值就是把晶体分离成自由原子所需要 的能量。Eb 也称为晶体的总相互作用能。
3:离子晶体:由正离子和负离子组成。
4:
二:基本特征
1. 离子晶体的模型:正、负离子—— 刚球 化合物:NaCl, CsCl是典型的离子晶体,晶体结
构如图所示。一种离子的最近邻离子为异性离子,离子 晶体的配位数最多只能是8(例如CsCl 晶体)。氯化钠 配位数是6。
2. 离子结合的特征
(1)离子键的形成 以 NaCl 为例 ,在凝聚成固体时,Na 原子失去
离子间的相互作用分为两大类:吸引作用和排斥作用。 (1) 静电引力,即正、负离子之间的库仑作用力(又称为 离子键;异极键)。
离子键无方向性和饱和性: 与任何方向的电性不同的离 子相吸引,所以无方向性;且只要是正负离子之间,则彼 此吸引,即无饱和性。
(2) 由于泡利不相容原理,两个离子的闭合壳层电子云的交 迭产生强大的排斥力; —— 排斥力和吸引力相互平衡时,形成稳定的离子晶体。
F
+-+-+-+-
-+-+-+-+
位错
+-+-+-+- -+-+-+-+
受力时发生错位,使正正离子相切,负负离子相切,彼此排 斥,离子键失去作用,故离子晶体无延展性 。如 CaCO3 可 用于 雕刻,而不可用于锻造,即不具有延展性 。
晶体的结合

第二章 晶体的结合组成晶体的原子能够保持中性稳定的周期性排列,说明原子之间有着强烈的相互作用力。
晶体粒子之间的相互作用力包括两种类型:吸引力和排斥力。
当原子受到压缩时,这种作用表现为斥力;当晶体受到拉伸时,这种作用表现为引力。
当斥力和引力平衡时,晶体保持一定的体积和外形。
因此,晶体结构取决于组成晶体的原子的性质及相互作用。
从能量的观点来看,一块晶体处于稳定状态时,它的总能量0E (原子的动能和相互作用势能的总和)比组成这晶体的原子处于自由状态时的总能量N E 低。
两者之差被定义为晶体的结合能W :即0N W E E =-。
结合能就是把晶体分离成自由原子所需要的能量。
对于晶体中原子相互作用的研究,实际上是量子力学的多粒子问题。
由于问题的复杂性,只能采取多种近似的方法进行处理。
本章首先介绍晶体结合类型的物理本质,然后利用经典理论重点讨论离子晶体和分子晶体的结合能。
§2-1晶体的结合类型与原子电负性对原子结合成晶体起主要作用的是各原子的最外层的电子。
按原子间相互作用的性质,可把晶体分为离子晶体、共价晶体、金属晶体、分子晶体和氢键晶体等等。
2.1.1晶体的结合类型 1.离子晶体离子晶体是由正、负离子所组成,依赖离子之间的静电相互作用结合成晶体。
最典型的离子晶体是碱金属元素和卤族元素之间形成的化合物,它们的晶体结构也比较简单,分别属于NaCl 或CsCl 两种典型结构。
在NaCl 晶体中,Na +和Cl -离子相间排列,每一种离子都是以异性离子为最近邻,总的库仑作用的效果是吸引的。
同时,由于Na +和Cl -离子都具有满电子壳层结构,当两个离子相互接近电子云发生重叠时,除静电相互作用外,由于泡利不相容原理,它们之间将产生很强的排斥作用,晶体正是依靠库仑吸引和排斥相平衡结合成稳定的结构。
由于离子具有满壳层电子结构,其电荷分布近似于球对称,所以离子键是没有方向性的,是晶格配位数较高的结构。
这种离子键是相当强的,其结合能的数量级约为800kJ/mol ,离子间的吸引能的数量级约为几eV ,因此一般离子晶体的熔点较高,硬度较大。
02第二章-晶体结构-基础-结合力和结合能-140903

D: [211]
在四方晶系中,晶面(110)与晶棱[110]相互( C)。
A: 正交
B: 平行
C: 斜交
D: A或B
School of materials Science and engineering
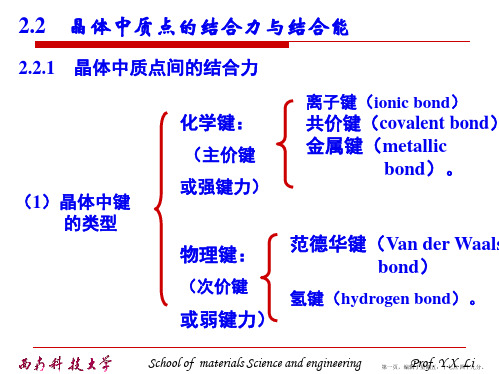
2.2 晶体中质点的结合力与结合能
2.2.1 晶体中质点间的结合力
(1)晶体中键 的类型
(略讲)
范德华键(分子键):通过“分子力”而产生的键合。
葛生力(Keesen force)或定向作用力: 发生在极性分子与极性分子间;
分子力
德拜力(Debye force)或诱导作用力:发 生在极性分子与非极性分子之间;
伦敦力(London force)或分散作用力 (色散力):发性在非极性分子与 非极性分子之间。
氢键 氢原子核与极性分子 弱 有方向性和饱和性
间的库仑引力
School of materials Science and engineering
(2)晶体中离子键、共价键比例的估算
1 离子键(%)=1 exp[ 4 ( X A
X B )2 ]
式中:XA、XB为A、B元素的电负性值。如:SiO2 离子键成分约45%,有的书中说47%。
(1)选坐标轴“一般标记为X(a)轴、 Y(b)轴、Z(c)轴”。三个坐标 轴的交点应位于晶体的中心。选坐 标轴不同任意的,一般选对称轴或 平行于晶棱的直线等。对于不同的 晶系的晶体,有不同的选择结晶轴 的方法。每两个坐标轴之间的交角 称为轴角,通常α=b∧c、β= c∧a、γ=a∧b。
(2)决定坐标轴的轴单位。
School of materials Science and engineering
晶向与晶面的关系
固体物理教案

1
2
3
4
i j rij
个原子组成的晶体的总的相互作用势能为: 则由N个原子组成的晶体的总的相互作用势能为:
1N 1 N N' u(r) = ∑ui = ∑∑u(rij ) 2 i=1 2 i=1 j=1
第二章 晶体的结合
因为晶体中原子数很多, 因为晶体中原子数很多,因此晶体表面原子与晶体内部原 子的差别可以忽略,上式近似为: 子的差别可以忽略,上式近似为:
第二章 晶体的结合
体积弹性模量是压缩系数的倒数: 体积弹性模量是压缩系数的倒数:
K =− ( V P ∂ ) V ∂
由热力学第一定律: 由热力学第一定律:
dU = − pdV +TdS= − pdV
P ∂ d2U K =− ( V ) =V dV2 V ∂
dU p=− dV
V
第二章 晶体的结合
2.3.3 结合能与晶体几个常量的关系
1.原胞体积
∂U(r) |r=r0 = 0 ∂r
r0
a
v0
v0
U ∂ (v) |v=v0 = 0 v ∂
2.压缩系数和体积弹性模量(体积压缩模量) 压缩系数: 单位压强引起的体积的相对变化率。 压缩系数: 单位压强引起的体积的相对变化率。
1 ∂V k =− ( )T V ∂P
第二章 晶体的结合
2.3 结合力及结合能
第二章 晶体的结合
2.3.1 结合力的普遍性质 原子之间的结合力多种多样,但总的可 以分成吸引力和排斥力两类。
F = F 斥+F 引 总 排 吸
第二章 晶体的结合
如果两个原子之间的结合势能为U(r): 如果两个原子之间的结合势能为U(r): 则两个原子之间的结合力为:
固体物理 第二章 晶体的结合

第二章晶体的结合填空体1.晶体的结合类型为:离子结合分子结合、金属结合和氢键结合。
2.共价结合的特点—方向性和饱和性。
3.晶体中原子的相互作用力可分为两类吸引力—和排斥力。
4.一般固体的结合可概括为范德瓦耳斯结合、金属结合、离子结合和共价结合四种基本类型。
5.金属具有延展性的微观根源是金属原子容易相对滑动。
6.石墨晶体的结合涉及到的结合类型有共价结合、氢键结合和金属结合。
7.GaAs晶体的结合涉及到的结合类型有共价结合和离子结合。
二、基本概念1.电离能始原子失去一个电子所需要的能量。
2.电子的亲和能电子的亲和能:一个中性原子获得一个电子成为负离子所释放出的能量。
3.电负性描述化合物分子中组成原子吸引电子倾向强弱的物理量。
4.共价键原子间通过共享电子所形成的化学键。
5.离子键两个电负性相差很大的元素结合形成晶体时,电负性小的原子失去电子形成正离子,电负性大的得到电子形成负离子,这种靠正、负离子之间库仑吸引的结合成为离子键。
6.范德瓦尔斯力答:分子晶体的粒子间偶极矩相互作用以及瞬时偶极矩相互诱生作用力称为范德瓦耳斯力。
7.氢键答:氢原子处于两个电负性很强的原子(如氟、氧、氮、氯等)之间时,可同时受两个原子的吸引而与它们结合,这种结合作用称为氢键。
8.金属键答:在金属中,组成金属的原子的价电子已脱离母原子而成为自由电子,自由电子为整个晶体共有,而剩下的离子实就好像沉浸在自由电子的海洋中。
自由电子与离子实间的互相吸引作用具有负的势能,使势能降低形成稳定结构。
这种公有化的价电子(自由电子)与离子实间的互作用称为金属键。
三、简答题1.共价结合为什么有“饱和性”和“方向性”答:饱和性:当一个原子与其它原子结合时,能够形成共价键的数目有一个最大值,这个最大值决定于它所含的未配对的电子数,这个特性称为共价键的饱和性。
方向性:两个原子在以共价键结合时,必定选取尽可能使其电子云密度为最大的方位,电子云交迭得越厉害,共价键越稳固。
第2章 晶体结合

《固体物理学》 微电子与固体电子学院
15
2.1 晶体结合的普遍特征
结论:同一周期元素自左至右电负性逐渐增大,同一族元素 自上而下电负性逐渐减小,过渡族元素的电负性比较接近。
电负性定性判断晶体类型:
(1)当两个成键原子的电负性差值较大时,晶体结合往往采
取离子键; (2)同种原子之间的成键,主要是共价键或金属键; (3)电负性差值小的原子之间成键主要是共价键。
4
2.1 晶体结合的普遍特征
(3)排斥作用起源于:(a) 同性电荷之间的库仑力;(b) 由于Pauli不相容原理的限制所 引起的排斥作用。
O
U(r)
r0 rm
r
b 排斥势可表示为: u R ( r ) rn
b是晶格参量,n是玻恩指数, 都是实验确定的常数
O
f(r)
r
《固体物理学》 微电子与固体电子学院
12
2.1 晶体结合的普遍特征
3. 体弹性模量
(1)晶体受外力时体积的变化。即∆P与-∆V/V之比。
P U 2U K V V ( ) V V V V V 2
2U T=0时,K V0 2 V V0
弹性模量可由实验测定。
《固体物理学》 微电子与固体电子学院
N 2 2
《固体物理学》 微电子与固体电子学院
20
2.2 离子键与离子晶体
设 rij ij R ,R是最近邻间距:
N U U ( R) 2 2e 2 ' 1 1 ' b ( ) n ( n ) ij R ij 40 R
19
2.2 离子键与离子晶体
第 i 个离子与其它N-1个个离子间的互作用势:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4)
式中U(r)表示相距r的两个原子之间的互作用势能。
结合能的计算方法: 在平衡态下,晶体势能最低
由组成晶体的原子(离子)的总相互作用能对距离r求微商
得到平衡时的原子(离子)的最近邻距离r0
再代回到晶体的总能量中,就可以求得晶体的结合能。
第二章 晶体的结合
第 10 页
三、三维晶体参数与结合能的关系
交叠区内的部分电子必须占据更高能级,因而使整个晶体 的能量增加,产生近距离的排斥作用。
这种形式表达了由泡利不相容原理所产生的短程排斥 作用随距离增加而急据下降的特点。
第二章 晶体的结合
第3页
相距r的两个原子之间的互作用势能用U(r)表示:
AB U(r) rm rn
(1) (m n)
体积为
V0 NR 3 (9)
这里 是与晶体几何结构有关的参数。
ቤተ መጻሕፍቲ ባይዱ
简立方简单格子:
面心立方简单格子: 体心立方简单格子:
1 2
2
4 3
9
第二章 晶体的结合
第 14 页
面心立方简单格子:
2R 2a
V N a3 4
2 N
2
第二章 晶体的结合
第 15 页
K
2U r 2
第二章 晶体的结合
第 11 页
体积弹性模量等于压缩系数的倒数:
热力学第一定律:
K 1 V P (6) k V T
dU TdS pdV
零温时
dU pdV ,
p dU dU dr dV dr dV
p 0 由于外界压强通常很小,
分子晶体的结合力(基元:分子) 分子晶体分为极性分子和非极性分子晶体。 极性分子晶体
晶体中粒子的互作用可分 为两大类: 吸引作用:是由于异性电荷之 间的库仑引力; 排斥作用:来源有两个,一是 同性电荷之间的库仑力,另一 是泡利原理所引起的排斥。
第二章 晶体的结合
第2页
泡利原理所引起的排斥: 当两个离子间距离近时,电子云的交叠会产生强烈的
排斥作用。 当两个原子的电子壳层相互交叠,由于泡利原理,在
2、结合能的一般形式 在绝对零度下,除各原子的零点振动外,结合能就是各原子间
的互作用势能之和。 N个原子组成的晶体的总相互作用能可表示为:
第二章 晶体的结合
第9页
E U(r) 1 N
2i
N j
u(rij )
N 2
u(rij )( j 1, j 2,3,, N )
f
(r)
du(r ) dr
mA r m1
nB r n1
它相应于两原子间的互作用力,当
r r0 du(r)
0 dr r0
第二章 晶体的结合
第5页
f (r0 ) 0
r0
nm
Bn Am
(2)
UC
U (r0 )
A r0m
(1
m) n
(3)
互作用势能达极小值,由此决定原子 间的平衡距离r0。
dU dr
r0
d 2r dV 2
2U r 2
r0
dr dV
V0
2U r 2
r0
dr dV
V0
(8)
第二章 晶体的结合
第 13 页
当T=0时,原子间的平衡间距为R 。
假设晶体有N个原胞,每个原胞的体积应与R3 成正比,因此晶体的平衡
吸引力达极大值
当超过 rm
吸引力就逐渐减少
du(r ) f (rm ) dr rm
表示晶格所能容耐的在一个方向上的最 大张力。
第二章 晶体的结合
第8页
二、结合能 1、结合能的定义:原子结合成晶体后释放的能量
Eb EN E0
E0:晶体的总能量(内能) EN:是组成该晶体的N个原子在自由状态时的总能量
原子相互作用势能的大小由两个因素决定: 原子相互作用势能是晶体体积的函数。
原子的数目 原子的间距
已知原子相互作用势能 可以求出与体积相关的有关常数:晶体的压缩系数和体积弹性模量。 晶体压缩系数:
由热力学,压缩系数的定义是:单位压强引起的体积的相对变化,
即
k 1 V
(5)
V P T
r0
dr dV
V0
(8)
V NR3 (9)
由(8)、(9)式,得平衡时晶体的体积弹性模量:
K
R02 9V0
2U r 2
r R0
1
9 NR0
2U r 2
r R0
第二章 晶体的结合
第 16 页
§2.4 分子力结合 由具有封闭满电子壳层结构的原子或分子组成的晶体称为分子晶体。 惰性气体He,Ne,Ar,Xe等,常温下气体:Cl2,SO2,H2,O2等。
晶体的平衡体积:
dU 0 (7)
dV V0
上式将晶体的内能函数与晶体的平衡体积和点阵常数联系起来。
第二章 晶体的结合
第 12 页
体积弹性模量表示为:
K
1 k
V
P V
T
p dU dU dr dV dr dV
2U
K
( V
2
)V0
V0
§2.3 结合力及结合能 一、结合力的共性(两个原子间的相互作用势能)
双粒子模型 晶体中粒子的相互作用能
可以看成是由一对对粒子的相 互作用能叠加而得;
先只考虑晶体中一对粒子 的相互作用能,然后再对晶体 中所有粒子求和,可求出晶体 的相互作用能。
第二章 晶体的结合
第1页
各种不同的晶体,其结合力的类型和大小是不同的。 在任何晶体中,两个粒子间的相互作用力或相互作用 势与它们的间距离的关系在定性上是相同的。
此时的状态称为稳定状态。
第二章 晶体的结合
第6页
(2)有效引力最大位置rm的确定:当r= rm时,
d 2u(r )
dr 2
0, or
rm
df (r) 0
dr rm
n1
rm
r nm 0
m1
两原子间距离r>r0时
原子间产生吸引力
第二章 晶体的结合
第7页
n1
rm
r nm 0
m1
当r= rm时
A、B、m、n皆为大于零的常数。
-A/rm :代表吸引能,来自异性电荷间的库仑吸引力,长程 作用;
+B/rn :代表排斥能,来自同性电荷间的库仑斥力及泡利原理 所引起的排斥力,总体表现短程作用。
第二章 晶体的结合
第4页
互作用势能的一般性质
(1)平衡位置r0的确定:
图(a):互作用势能曲线
图(b): 互作用势能曲线的微商曲线
