2019年人教版化学必修二:第2章-思维导图【1】(含答案)
高中化学必修2思维导图(Word版)
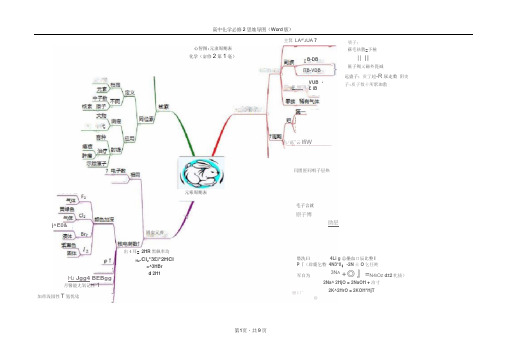
j^E0&主箕LA^'J UA 7心智图:元隶周期表化学(宓修2第1毫)B-DBITB-VDB却_畑飞之VUB ・£I B元寒周期表園实元養H J Jgg4 BEBgg月醫能尢氧记性1出4耳= 2HR黑飙率均Hz.Cl z*3£i*2HCl=^3HBrd 2H1加帝浅园性T氢忧唸占/菇"云lfiW* -----------JL-L -------------------------- 1--------------------------------------------嘖子;蘇毛祛敷=予極II II匾子羯乂磁外毘减远蛊子;贡亍超-R尿走数阴吏子:质子数十所駅珈敷闫匱匪同唱子层热毛子言就原子博助层塔洗曰4Li g总壘血口辰比整IP『(辟鹿乞特4N3*0;-2N士O乞任盹3N A+◎』=N4I O Z d±2牝拔)2Na^ 2HjO = 2NaOH + 泊寸2K^2HrO = 2KOH*HjT军白为屉卜厂◎H 原子子站斎武核电荷參堵勺打同誨牟宣走文元拱 元青哥朝潼叱学强心皆暨;元袞周期律化学锂化学(必悸2第1童)隔吉寿于乍毛力丑□r 贸性原子克:”空王咗托丄,屋_裁勻同N 「鳏论伽皐牛旳 fflMa 力酋WHHS 胡転占步輕理性质焉响舷性广莊匪辜議羸物廣寻找启发 fc ---- « J -------- 1 備/_■ : 兀魁隹凰不意圏宣口同匱或广—-电子昨叭 西石策子捋嵩!匚二—.它三玄塔二一 尉卜聽亍竝司"L]同主察桓同吾丢性晅子字效1一 E助层里孑救WL內吾+ ]r 4化台•'介医匪敷斗_原于半径暑13个V 电子敷 r ~《葩.塀呈苣之鱼寻梅心音圍:代学反应与能星 化宝(必修2第2章】•佶能与捣詬rs乏卫奉r wr 化学反应与蕃量学能与邑聽原电池丈A連□決:毛子不下取;禹子不上岸 爾垃匣©謹:如正还 禅池B 進謹:色過艺虽大割吏良应複门f *・严 「・r ・严厂 -----------------------------------'.叱円頁衣豈尺矽淞亶『圭豌牛1甘厂 —’ L -------- 卑检吁间 」H_U 便垦删浏严nnoi/(L-5) .袤云mol/CL-min ;j^B8y ― ----- --------il-t > Q 晅护•反应AH -Q L - Q /------------- ------------二” < D 京註乏二2)^册舷匝T 辭「 疋反帆_—TTA RB3®C T亦Yu 原电乜电輕罢甞近正視2屮f -H :T対E Zn ■ 2e- -Zn^ 靱云 rn ^ZH 1 -Zn 1- + HrT住期殺:Cu'- +Je- =Cu卿:2HK>-4e =O ;t*4H^总豈・M : ^Cu-^^H^O =£M ^Cu-0s r-H4H- 平衡丽珈師:直更标衣①¥丘-唾 g ■各柜琳室聞不娈 闻按耗:◎::总合住翌、总£3糕、总需底的垦科SB?阎的适毒恋 更②互处師空度或平垢相灯舒质星不墮冇间适而迪* 卷台休的廉色不輔时问应莊而逝 言瘻蘇任何时聞戒立:叵捷标志墓孤住趣恵呵竇⑥融侪电I® 达平斬也就是.交星不更砖池巨二二乂若乜冋更屋池裝餐老能-化我云皿二吨子兰垢tuSG-高中化学必修2思维导图(Word 版)心智囹:眉简单的有机物-甲烷昨(必想2第3韋)C-C 柜唾fe5a P=fl.717j/L j正匸荀W 空可希 同茎X 崔海唇■;…*时取1换代r ~\^TSC.H. + 心 愈” 0 4- 3H E O 匸丸事XiSM 不同强分辰茗体优■曲同分毛同廿予式 CH 4+CI J ^ fH^Cb 十 Cb CHClj + CL 庄整nci-bCHzCi 伺部麻那那卫斗Hd + CH^LCW 机君判】 t 呈邑nci 十匚HCM 氮访]制聞) -^£>HCI * <XL (四氣化瑕・灭火剂「有机海册Ik 上亦确皤申不竝 最简单的有WMir 甲烷 砂二样 冒英粗區 碍同元索 H-C -HH具一烷ZT 端 (T 烷两科同分吳梅樹 道式匚“甩“沁nn c;比曲+』$lq 逑+3丰1)円Q 前離点T兰一股一直T遇性俸取亡卜卯工+dj[垂诸中不证M :曰C^HiiJ^^CiHis-CiH^儘行子氏毎H 可以裂代谀朗4 乎6CO j + 3H;a火皓明亮「有、:T黒奉色代亦岫取代壽---------------------------------------―—1 + HO-NO;■| J(m^M)加.成PJ不迂奎KMnQ.逗化雅0+HO-SOjH-20住旳一^0 环己做加5皈劇平輕SOsH+H:OKMnOi 逐鱼80.代躍海蜒鱼KMnO*JH亦于萼 6 竝-nCO2 +伯幻垃威22磁c=c乙値来自石油和煤的两种基本化工嗣屁辱杓疾I 石fruk'MX低行于一壹分子■* -C-C-加虑反应一―.至使一皿CjFL + 3Oj 磁.JCOj + 2HjO(>d® 瞻・SSJ®CH;・ CH; * HCI - CHjCH^I (制気乙境CHi-CHj:+Br:- <H:BrChr8r f涙水歸iM = £H= + KQ +詈姿_■• *3山T戲乙對胃嗓加庄水平SMK丁 CHj=CH7+ HZ Ni> CHjCHi汽,Cl-I;-}? (MSJE®心智閏:来自石油和淇的两种基車化工恵料化学(魁修2第』章)nCHi = CHi乙晞聊匸或反应和肚聚豆应驴主KWrO-tISfigj CHjOII,——CHjY — H -H —O — I M 5 :—- 乙蒔 一—严军葢牛甘H 俎 右H 艇换□II-匚Hi —C —C^Czhii +HjO乙薛己塞拡取弋堆汩£连世疑中HCHXOOHOCHjCHrOH + SOj最基—COOH乙辱I 匯基—CHOI 赵—NO : r-la<Ot * 2CI~liCOO H=2C HjCOONa + CO :1 + HQ 霁鞍幡称Ch J €OOH>H ;CO=■■工盏穗、竺唾吵釉[L17贰沸蛊才吏虹炬石笈旦醴可 口M — 廿 _— _ ir^ja_»_^jL-rr~n g5i llCH J C-OHP<HjO *握址哥 亡u 或Aq 眈理性■鱼ZCHjCHfQH + Qj —— iCHsCHC+ZHjO 朋弓吃渦盡 门忙、"552 HH 7CHX>H+2lMa — JtHjCHiONa^MjT -舅ii 发 平屢IN 可质应 心宵團:生活中两种常见前有阴化学(凶02第垣)生活中两种常见的右翊滋H£6匪奩X.墓怛恫右智團;基本营养物庾此学(必修2第月章)I Q097僚蛋兰更麦芽请疥砖唐聲芝C<脂册憨BTF竝存在q脣9S IT(SkoCUh 亠riH£坐炮淀粉{或肝進襄)变黄疑雋打毛唳廉克蛊曲旨肪竝■c=cW匪匚计七Qx + H卫涅赫吏莓曲^±/—出薜歸病基本营舷质在■輛飪sq + GHq苇萄睹寻雀nQHizOt野華密比淒S+E<TX M作用内匪阳H退里議窘丈.... ............. <...... 1SS柞用]「加1u tt——忒.圣丁盘W*・,3*™ ■-=--———S ____有參二::匚热m髯杏活洩全寻-冒环令壬■聯戟术込4毎方旬裁禺伍廿4------- J潯水缺膏理幵再匚利用翠全原矿沏的幵勵」用右冒聞;开发^用金廣矿物和画水熒再化学(必惶2 S4M)毎水j籃利巨區海水如這源的开发利用、沖口列益臺csra , ■I~^^41薊鬭垦金黒览驾金畧資通.—盍于沁愛TS 咖査成本海水水誑浪利用m LixlOfl37%«ffi球环星>妁&_飞金寓飾?HgO 5^; 2Hg * C J F酣肿4Ag + Oil■- gF^Of * 3C0 2F* -H 3C0;(髙啡轶}阻J6*氛I臺墨2宅+ Al工id答心彬:?fuiS + Oz=^r Xu 亠50二叹1 去聞]Fe 十Cu 5(□二=FeSO^ +MgCL =Sfi= Mg Yb f 2A I7O54AI + 5O3t JNaCi 2Na + CIJ熔融塢融冬“u煖融g 蛊監需零f H WOWQH1°瞬也匪QMi 屮^\Tjfc±7心曾團:资砖合利用 环境懈护化字滋修2第4章)気上三■亟一%左碇酸兮裂化羊ct 合成“m 匕的单之CH ; =匚缶 拒节一£衬YH :I - ■“ ’fflW星盘聚化煤石油去愿吒资源煤合利用 环境探护:变忧隧戎屋二意贾遇士主乙殊8密气汽化盲工东二右-M 璽严曲■ 一生成物血垦._ 100旺丿CwHji 豐专z ■* C S H U +C I M H 血瞰血压* *T/Ure^=wt —I*三三n 犀合磴歆目生产甲磐不同洗点各锻廿乱冃台老気黃桝气。
人教化学必修2第2章第1节化学能和热能(共16张PPT)

E
∑E(2H 2Cl)
E
∑E(2H 2Cl)
∑E(H2 Cl2)
∑E(2HCl) ∑E(2HCl)
t 放出能量
∑E(H2 Cl2)
t 吸收能量
思考与交流
化学反应的基本特征是有新的物质生成,即在 化学反应中物质发生了变化。通过上面的学习, 你对化学反应的特征有什么进一步的认识?
化学反应的特征:物质在发生化学变 化的同时,还伴随有能量的变化。在 此过程中,质量和能量都是守恒的。
﹢
能量
能量
﹢
反应物的总能量低
课堂练习:金刚石和石墨是碳的两种结构不同的单质。在 100kPa时,1mol的石墨转化为金刚石需要吸收1.895kJ的 能量。据此,试判断在该条件下,
下列结论正确的是( AD )
A.石墨比金刚石稳定 B.金刚石比石墨稳定 C. 1mol石墨比1mol金刚石总能量高 D. 1mol石墨比1mol金刚石总能量低
E
∑E(2H 2Cl)
E
∑E(2H 2Cl)
∑E(H2 Cl2)
∑E(2HCl) ∑E(2HCl)
t 放出能量
∑E(H2 Cl2)
t 吸收能量
活动探究2:
吸热反应一定需要加热吗?
趣味实验:摇摇冰
Ba(OH)2·8H2O + 2NH4Cl =BaCl2 +2NH3 +10H2O
趣味实验:化学暖袋
CaO + H2O == Ca(OH)2 放出能量
光照
H2 + Cl2 ==== 2HCl 放出能量
1moL
HH
HH
放出能量 H Cl
Cl Cl
H 431kJ × 2 Cl
= 862kJ
人教版化学必修二:第2章-思维导图【2】(含答案)

人教版化学必修二:化学·必修2(人教版)1.(2013·北京高考)下列设备工作时,将化学能转化为热能的是()A.硅太阳能电池B.锂离子电池C.太阳能集热器D.燃气灶答案:D2.某小组为研究电化学原理,设计如下图装置。
下列叙述不正确的是()A.a和b不连接时,铁片上会有金属铜析出B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色D.a和b用导线相连时,电能转变为化学能答案:D3.①②③④四种金属片两两相连浸入稀硫酸中都可以组成原电池。
①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。
据此判断这四种金属活动性由大到小的顺序是()A.①③②④B.①③④②C.③④②①D.③①②④答案:B4.下列叙述正确的是()A.生铁中含有碳,抗腐蚀能力比纯铁强B.用锡焊接的铁质器件,焊接处不易生锈C.Zn具有还原性和导电性,可用作锌锰干电池的负极材料D.铁管上镶嵌锌块,铁管易被腐蚀答案:C5.研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。
下列“水”电池在海水中放电时的有关说法正确的有()A.正极反应式:Ag+Cl--e-===AgClB.每生成1 mol Na2Mn5O10转移2 mol 电子C.Na+不断向“水”电池的负极移动D.AgCl是还原产物答案:B6.研究人员制出一种锂水电池,可作为鱼雷和潜艇的储备电源。
该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。
关于该电池的下列说法不正确的是()A.水既是氧化剂又是溶剂B.放电时正极上有氢气生成C.放电时OH-向正极移动D.总反应为:2Li+2H2O===2LiOH+H2↑答案:C7.将铁棒和锌棒用导线连接插入CuSO4溶液中,当电池中有0.2mol电子通过时,负极质量的变化是()A.增加6.5 g B.减少6.5 gC.减少5.6 g D.增加6.4 g答案:B8.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是()A.电子通过外电路从b极流向a极B.b极上的电极反应式为:O2+2H2O+4e-===4OH-C.每转移0.1 mol电子,消耗1.12 L的H2D.H+由a极通过固体酸电解质传递到b极答案:D9.Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl 混合溶液。
2019年人教版化学必修二:第2章-思维导图【1】(含答案)

化学·必修2(人教版)1.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。
然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。
由此可见()A.NH 4HCO3和盐酸的反应是放热反应B.该反应中,热能转化为产物内部的能量C.反应物的总能量高于生成物的总能量D.反应离子方程式为:NH4HCO3+HCl―→NH4Cl+CO2↑+H2O答案:B2.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。
则反应S(s)+3F2(g)===SF6(g)的能量变化为()A.放出1 780 kJ的能量B.放出1 220 kJ的能量C.放出450 kJ的能量 D.吸收430 kJ的能量答案:B3.已知H2(g)+Br2(l)===2HBr(g)ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:H2/g Br2/g HBr/g1 mol分子中的化学键断裂时需要吸收436 a 369的能量/kJ则表中a为()A.404B.260C.230D.200答案:D4.(双选题)已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)―→2HCl(g)+Q1,H2(g)+Br2(g)―→2HBr(g)+Q2。
有关上述反应的叙述正确的是()A.Q1>Q2B.生成物总能量均高于反应物总能量C.生成1 mol HCl气体时放出Q1热量D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量答案:AD5.已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1(表示2 mol H2燃烧放出571.6 kJ的热量),CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890 kJ·mol-1(表示1 mol CH4燃烧放出890 kJ的热量)。
新人教版高中化学高一化学必修二知识点思维导图

高一化学必修 第二册化工生产中的重要非金属元素硫及其化合物氮及其化合物无机非金属材料硫二氧化硫硫酸不同价态含硫物质的转化硫元素位于元素周期表的第三周期第VIA族硫黄为黄色晶体,难溶于水,微溶于酒精,易溶于二硫化碳具有氧化性、还原性二氧化硫为无色气体,有刺激性气味的有毒气体,密度比空气大易溶于水,其水溶液显酸性二氧化硫具有漂白作用,但生成的化合物不稳定工业上常用二氧化硫来漂白纸浆,毛,丝等,此外,也可用于杀菌消毒,还有一种食品添加剂硫酸是重要的化工原料,可用于生产化肥,农药,炸药,染料和盐类等稀硫酸浓硫酸常见的硫酸盐硫酸根离子检验具有酸的通性溶于水完全电离可与酸碱指示剂作用可以活泼金属碱、碱性氧化物及其盐反应吸水性:能够吸收气体、液体中的水分,故常作干燥剂脱水性:能把有机物中的氢元素和氧元素按水的组成比脱去强氧化性与金属反应与非金属反应(加热)常温下能使铁,铝发生钝化硫酸钙,硫酸钡,硫酸铜硫酸根离子和钡离子反应生成不溶于稀盐酸的白色硫酸钡沉淀通过氧化还原反应可实现不同价态含硫物质的互相转化利用氧化剂,可将硫元素从低价态转化到高价态利用还原剂,可将硫元素从高价态转化到低价态氮气氮的固定一氧化氮二氧化氮氨铵盐硝酸酸雨及防治无色无味,难溶于水的气体化学性质不活泼,通常情况下难以与其他物质发生化学反应具有还原性和氧化性含义:将大气中游离态的氮转化为氮的化合物的过程自然固氮:如豆科植物的根瘤固氮,雷电作用人工固氮:如工业合成氨无色无味有毒性气体,且不溶于水一氧化氮不能和碱反应,是不成盐氧化物,不是酸性氧化物一氧化氮和氧气反应生成二氧化氮是红棕色有刺激性气味的有毒气体,易溶于水和碱反应生成硝酸根离子和亚硝酸根离子,不是酸性氧化物和水反应生成硝酸和一氧化氮无色有刺激性气味的气体,密度比空气小,易液化极易溶于水'且与水的水溶液呈碱性浓盐酸与氨反应生成氯化氨晶体;氨的催化氧化是工业制硝酸的基础氨气和二氧化碳在催化剂加热的条件下生成一氧化氮和水氯化铵和氢氧化钙在加热的条件下生成氨气和氯化钙和水湿润的红色石蕊试纸→变蓝氨盐在碱和加热的条件下生成氨气浓盐酸→白烟硝酸是无色,易挥发,有刺激性气味的液体酸性:在水中能电离不稳定性:浓硝酸见光或受热会分解产生二氧化氮是大气中的氮氧化物与硫氧化物以及他们在大气中发生反应后的生成物溶于雨水形成的直接损伤农作物,破坏森林和草原,使土壤、湖泊酸化加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀防治强氧化性铜与稀硝酸反应生成硝酸铜和一氧化氮和水铜与浓硝酸反应生成硝酸铜和二氧化氮和水浓硝酸与炭在加热的条件下生成二氧化氮和二氧化碳和水调整能源结构,发展清洁能源研究煤的脱硫技术,减少二氧化碳和氮氧化物的排放加强工厂废气的回收处理改进汽车尾气的处理技术,控制尾气排放铵盐是无色或白色的晶体,绝大多数易溶于水;农业上常用做化肥,如硫酸铵,碳酸氢铵,硝酸铵等;氯化铵受热分解生成氨气和氯化氢;氯化氨溶液与氢氧化钠溶液共热生成氨气和水和氯化钠硅酸盐材料新型无机非金属材料硅:高纯硅广泛用于信息技术和新能源技术等领域,以及光伏电站、人造卫星、硅太阳能电池二氧化硅:可用来生产光导纤维新型陶瓷:不再限于传统的硅酸盐体系,在光学,热学,电学,磁学等方面具有很多新的特性和功能碳纳米材料:主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、医药等领域有着广泛的应用前景第五章 化工生产中的重要非金属元素化学反应与能量化学能与热能在任何的化学反应中总伴有能量的变化当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量主要原因一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小E反应物总能量 > E生成物总能量,为放热反应;E反应物总能量 < E生成物总能量,为吸热反应常见的放热反应和吸热反应常见的放热反应所有的燃烧与缓慢氧化酸碱中和反应金属与酸反应制取氢气大多数化合反应特殊:C+CO₂=加热=2CO是吸热反应常见的吸热反应以C、H₂、CO为还原剂的氧化还原反应C(s)+H₂O(g)=加热=CO(g)+ H₂(g)铵盐和碱的反应Ba(OH)₂·8H₂O+NH₄Cl=BaCl₂+2NH₃↑+10H₂O大多数分解反应KClO₃、KMnO₄、CaCO₃的分解等能源的分类一次能源常规能源可再生资源不可再生资源新能源可再生资源不可再生资源二次能源一次能源经过加工、转化得到的能源称为二次能源电能(水电、火电、核电)、蒸汽、工业余热、酒精、汽油、焦炭等化学能与电能化学能转化为电能的方式火力发电化学能→热能→机械能→电能缺点:环境污染、低效原电池将化学能直接转化为电能优点:清洁、高效原电池原理概念把化学能直接转化为电能的装置叫做原电池原电池的工作原理通过氧化还原反应(有电子的转移)把化学能转变为电能构成原电池的条件电极为导体且活泼性不同两个电极接触(导线连接或直接接触)两个相互连接的电极插入电解质溶液构成闭合回路电极名称及发生的反应负极较活泼的金属作负极,负极发生氢化反应电极反应式:较活泼金属-ne⁻=金属阳离子负极现象正极较不活泼的金属或石墨作正极,正极发生还愿反应电极反应式:溶液中阳离子+ne⁻=单质正极的现象:一般有气体放出或正极质量增加原电池正负极的判断方法依据原电池两极的材料较活泼的金属作负极(K,Ca,Na太活泼,不能作电极)较不活泼金属或可导电非金属(石墨)、氧化物(MnO₂)等作正极根据电流方向或电子流向(外电路)的电流由正极流向负极电子则由负极经外电路流向原电池的正极根据内电路离子的迁移方向阳离子流向原电池正极,阴离子流向原电池负极根据原电池中的反应类型负极正极原电池电极反应的书写方法原电池反应所依托的化学反应原理是氧化还原反应,负极反应是氧化反应,正极反应是还原反应①写出总反应方程式②把总反应根据电子得失情况,分成氧化反应、还原反应③氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱介质和水等参与反应原电池的应用原电池的总反应式一般把正极和负极反应式相加而得加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快比较金属活动性强弱设计原电池金属的腐蚀化学电源基本类型干电池活泼金属作负极,被腐蚀或消耗充电电池燃料电池两极都参加反应的原电池,可充电循环使用两电极材料均为惰性电极,电极本身不发生反应,而是由引入到两极上的物质发生反应水能、风能、生物质能煤、石油、天然气等化石能源太阳能、风能、地热能、潮汐能、氢能、沼气核能失电子,发生氧化反应,现象通常是电极本身消耗,质量减小得电子,发生还原反应,现象是常伴随金属的析出或H₂的放出负极溶解,负极质量减少第六章 化学反应与能量化学反应与能量化学反应的速率和限度化学反应的速率概念化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示计算公式v(B)=|Δc(B)|/Δt=|Δn(B)|/V·Δt单位mol/(L·s)或mol/(L·min)B为溶液或气体,若B为固体或纯液体不计算速率以上所表示的是平均速率,而不是瞬时速率重要规律速率比=方程式系数比变化量比=方程式系数比影响化学反应速率的因素内因由参加反应的物质的结构和性质决定的(主要因素)外因温度:升高温度,增大速率催化剂:一般加快反应速率(正催化剂)浓度:增加C反应物的浓度,增大速率(溶液或气体才有浓度可言)压强:增大压强,增大速率(适用于有气体参加的反应)其它因素:如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、 原电池等也会改变化学反应速率化学反应的限度——化学平衡基本情况在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度,即化学平衡状态影响因素可逆反应温度、反应物浓度、压强等催化剂只改变化学反应速率,对化学平衡无影响在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应通常把由反应物向生成物进行的反应叫做正反应;而由生成物向反应物进行的反应叫做逆反应在任何可逆反应中,正方应进行的同时,逆反应也在进行可逆反应不能进行到底,即是说可逆反应无论进行到何种程度,任何物质(反应物和生成物)的物质的量都不可能为0特征逆:化学平衡研究的对象是可逆反应动:动态平衡,达到平衡状态时,正逆反应仍在不断进行等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于0。
高二化学人教版(2019)选择性必修第一册思维导图

化学反应的热效应反应热的计算反应热 焓变焓变反应热中和热 定义:在稀溶液中,强酸和强碱发生中和反应生成1mol 液态水时放出的热量叫做中和热。
导致中和反应反应热测定存在误差的原因①量取溶液的体积不准确。
②温度计读数有误(如未读取到混合溶液的最高温度,就记为终止温度)。
③实验过程中有液体溅出。
④混合酸、碱溶液时,动作缓慢。
⑤隔热层隔热效果不好,实验过程中有热量损失。
⑥测过酸溶液的温度计未用水清洗便立即去测碱溶液的温度。
⑦溶液浓度不准确。
⑧没有进行重复实验。
燃烧热限制条件 ◐反应条件:101kPa◐可燃物必须是1mol 纯物质◐生成指定产物表示方法 根据燃烧热的定义和热化学方程式的知识设计的表示方法,如计算方法 燃料燃烧的放热量=可燃物的物质的量×燃烧热的绝对值热化学方程式 ★定义:能表示参加反应物质的量和反应热的关系的化学方程式 ★注意:标物态;配平(包括∆H );∆H 的单位和“+” “-”;∆H 的值与n (反应物)同倍数变化盖斯定律 不管化学反应是一步完成或分几步完成,其反应热是相同的,即:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关反应热计算的依据 热化学方程式与数学上的代数方程式相似,可以移项同时改变正、负号,各项的化学计量数包括∆H 的数值可以同时扩大或缩小相同的倍数 根据盖斯定律,将几个热化学方程式包括其∆H 相加或相减,得到一个新的热化学方程式 任意反应∆H=反应物中化学键断裂所吸收的能量和- 生成物中化学键形成所放出的能量和任意反应生成物反应物应用盖斯定律计算反应热时的注意事项 热化学方程式同乘以或除以某一个数时,应热数值也必须乘以或除以该数 热化学方程式相加减时,同种物质之间可相加、减,反应热也随之相加、减 热化学方程式中反应热指反应按所给形式完全进行时的反应热正、逆反应的反应热绝对值相等,符号相反关键与方法关键方法目标方程式“四则运算式”的导出 写出目标方程式确定“过渡物质”(要消去的物质),然后用消元法逐一消去“过渡物质”导出“四则运算式”化学反应速率与化学平衡化学反应速率化学反应的调控化学反应进行的方向化学平衡化学反应速率影响化学反应速率的因素 ①表示方法通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示 ③重要比值同一反应在同一时间段内,用不同物质来表示的反应速率可能不同,但反应速率的数值之比等于这些物质在化学方程式中的化学计量数之比注意:化学反应速率一般指平均速率,不能用固体或纯液体的单位时间内的浓度变化表示化学反应速率,因为固体和纯液体的浓度在化学反应中视为定值 ④大小比较方法由于同一化学反应的反应速率用不同物质表示时数值可能不同,所以比较反应的快慢不能只看数值的大小,而要进行一定的转化◎看单位是否统一,若不统一,换算成相同的单位◎先换算成用同一物质表示的速率,再比较数值的大小◎比较化学反应速率与化学计量数的比值,即对于一般反应aA+bB=cC+dD,比较与②教学表达式及单位单位为或内因外因反应物本身的性质温度浓度催化剂压强充入惰性气体 ◈原因 浓度一定时,升高温度,分子的能量增加,从而增加了活化分子的百分数,反应速率增大 温度升高,使分子运动的速率加快,使一部分原来能量较低的分子变成活化分子,从而增加了活化分子的百分数,单位时间内反应物分子间的碰撞次数增加,反应速率也会相应加快 ◈规律 其他条件不变时,升高温度,可以增大反应速率,降低温度,可以减慢反应速率 ◈原因 在其他条件不变时,使用催化剂可以大大降低反应所需要的能量,会使更多的反应物分子成为活化分子,大大增加了反应物单位体积内活化分子的数目,因而使反应速率加快 ◈规律 正催化剂能够加快反应速率的催化剂 负催化剂能够减慢反应速率的催化剂◈原因 在其他条件不变时,对某一反应来说,活化分子百分数是一定的,即单位体积内的活化分子数与反应物的浓度成正比。
人教版化学必修二思维导图含答案

人教版化学必修二思维导图含答案集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]化学·必修2(人教版)1.短周期金属元素甲~戊在元素周期表中的相对位置如右图所示:下面判断正确的是( )A.原子半径:丙<丁<戊B.金属性:甲>丙C.氢氧化物碱性:丙>丁>戊D.最外层电子数:甲>乙解析:同周期从左到右原子半径逐渐减小,金属性逐渐减弱,其氢氧化物碱性逐渐减弱,故A项错,C项正确;同主族从上到下金属性逐渐增强,故B项错;同周期最外层电子数逐渐增大,故D项错。
答案:C2.(双选题)短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第ⅤA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则( )A.原子半径:丙>丁>乙B.单质的还原性:丁>丙>甲C.甲、乙、丙的氧化物均为共价化合物D.乙、丙、丁的最高价氧化物对应的水化物能相互反应解析:甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA 族,该氢化物应为NH3,则乙是N,甲是H;甲、乙、丙、丁的原子序数依次增大,且都是短周期元素,甲和丙同主族,则丙为Na,丁的最外层电子数和电子层数相等,则丁为Al。
综上所述B错,单质的还原性:丙>丁>甲;C错,丙的氧化物是氧化钠和过氧化钠,它们都是离子化合物。
答案:AD3.下表是元素周期表的一部分,有关说法正确的是( )A.e的氢化物比d的氢化物稳定B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,c元素单质的化学性质最活泼D.c、e、f的最高价氧化物对应的水化物的酸性依次增强解析:周期表中主要从金属性和非金属性递变推及到物质性质的递变。
答案:D4.(2013·广东高考)(双选题)元素R、X、T、Z、Q在元素周期表中的相对位置如下图所示,其中R单质在暗处与H2剧烈化合并发生爆炸。
人教版高中化学必修二第二章《归纳与整理》课件
新课标 ·化学 必修2
应用“三段法”进行有关化学反应的计 算
(1)计算模式:设 a mol·L-1、b mol·L-1 分别为 A、B 两
物质的起始浓度,m x mol·L-1 为反应物 A 的转化浓度,n x
mol·L-1 为 B 的转化浓度,反应时间为 t,则:
mA(g)+nB(g) pC(g)+qD(g)
新课标 ·化学 必修2
如图所示,在小试管里加入 2 g 新制备的无水 硫酸铜,把小试管套在具支试管内;在 U 型管内加入少量红 墨水;打开 T 形管螺旋夹,使 U 型管内两边的液面处于同一 水平面;再夹紧螺旋夹,把水滴入小试管内,白色的无水硫 酸铜完全变成蓝色的五水硫酸铜晶体,可观察到 U 型管右侧 的液面立即下降,左侧的液面上升。
新课标 ·化学 必修2
(2)v(B)=0.3 2msol/L=0.15 mol/(L·s) (3)A 的转化率=02.6×100%=30% (4)B 的体积分数=1.4+00..77+0.6×100%=26.3% 【答案】 (1)0.3 mol/(L·s) (2)0.15 mol/(L·s) (3)30% (4)26.3%
新课标 ·化学 必修2
【答案】 (1)①CuSO4+5H2O===CuSO4·5H2O ②放热 ③大于 (2)U 型管右侧液面上升,左侧液面下降
新课标 ·化学 必修2
原电池
1.原电池正负极的判断方法 (1)依据原电池两极的材料 较活泼的金属作负极(K、Ca、Na 太活泼,不能作电极); 较不活泼金属或可导电非金属(石墨)等作正极。 (2)根据电流方向或电子流向:(外电路)电流由正极流向 负极;电子则由负极经外电路流向原电池的正极。
新课标 ·化学 必修2
化学必修二第二章知识点总结[1]
![化学必修二第二章知识点总结[1]](https://img.taocdn.com/s3/m/4dd788ffb7360b4c2f3f6407.png)
化学必修二第二章知识点总结(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(化学必修二第二章知识点总结(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为化学必修二第二章知识点总结(word版可编辑修改)的全部内容。
第二章化学反应与能量第一节化学能与热能一.化学键与能量变化关系关系:在任何的化学反应中总伴有能量的变化.原因:当物质发生化学反应时,从微观来看,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。
化学键的断裂和形成是化学反应中能量变化的主要原因。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
2、常见的放热反应和吸热反应(1)常见的放热反应:①所有的燃烧与缓慢氧化;②酸碱中和反应(中和热);③金属与酸、水反应制氢气;④大多数化合反应(特殊:C+CO2=2CO是吸热反应);⑤铝热反应注:在稀溶液中,酸跟碱发生中和反应生成1 mol液态水时的反应热叫做中和热.ⅰ. 必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热ⅱ。
强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)====H2O(l)中和热均为57。
3 kJ·mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其反应热小于57。
3 kJ·mol-1;ⅲ。
以生成1 mol水为基准.(2)常见的吸热反应:① C、H2、CO为还原剂的氧化还原反应如:C(s)+H2O(g) CO(g)+H2(g)。
②盐和碱的反应如Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O③多数分解反应如KClO3、KMnO4、CaCO3的分解等。
人教版化学必修二2-2-2.

人教版· 化学· 必修2
进入导航
第二章 第二节 第2课时
系列丛书
正极:首先判断在正极发生反应的物质。①当负极材 料与电解质溶液能发生自发的化学反应时,在正极上发生 电极反应的物质是电解质溶液中的某种微粒;②当负极材 料与电解质溶液不能发生自发的化学反应时,在正极上发 生反应的物质是溶解在电解质溶液中的O2。 然后再根据具体情况写出正极反应式,在书写时也要 考虑正极反应产物是否与电解质溶液反应的问题,若反应 也要书写叠加式。
人教版· 化学· 必修2
进入导航
第二章 第二节 第2课时
系列丛书
电池总反应式为:10Li+4SOCl2===8LiCl+Li2SO4+ 3S 这种电池容量大,电压稳定,能在-56.7~71.1℃温度 范围内正常工作。
人教版· 化学· 必修2
进入导航
第二章 第二节 第2课时
系列丛书
2.二次电池 ①铅蓄电池 铅蓄电池可放电亦可充电,具双重功能。它是用硬橡 胶或透明塑料制成的长方形外壳,在正极板上有一层棕褐 色PbO2,负极是海绵状金属铅,两极均浸在一定浓度的硫 酸溶液中,且两极间用微孔塑料隔开。
人教版· 化学· 必修2
进入导航
第二章 第二节 第2课时
系列丛书
②氢氧燃料电池 氢氧燃料电池是一种高效低污染的新型电池,主要用 于航天领域。它的电极材料一般为活化电极,具有很强的 催化活性,如铂电极、活性炭电极等。电解质溶液一般为 40%的KOH溶液。在不同的介质中发生的电极反应归纳如 下:
人教版· 化学· 必修2
系列丛书
2.原电池反应式的书写 两电极反应式,得失电子数相等时,将两电极反应式 相加即得原电池反应式。
人教版· 化学· 必修2
进入导航
2019年人教版化学必修二:第1章-思维导图【2】(含答案)

化学·必修2(人教版)1.短周期金属元素甲~戊在元素周期表中的相对位置如右图所示:下面判断正确的是( )A.原子半径:丙<丁<戊B.金属性:甲>丙C.氢氧化物碱性:丙>丁>戊D.最外层电子数:甲>乙解析:同周期从左到右原子半径逐渐减小,金属性逐渐减弱,其氢氧化物碱性逐渐减弱,故A项错,C项正确;同主族从上到下金属性逐渐增强,故B项错;同周期最外层电子数逐渐增大,故D项错。
答案:C2.(双选题)短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第ⅤA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则( )A.原子半径:丙>丁>乙B.单质的还原性:丁>丙>甲C.甲、乙、丙的氧化物均为共价化合物D.乙、丙、丁的最高价氧化物对应的水化物能相互反应解析:甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,该氢化物应为NH3,则乙是N,甲是H;甲、乙、丙、丁的原子序数依次增大,且都是短周期元素,甲和丙同主族,则丙为Na,丁的最外层电子数和电子层数相等,则丁为Al。
综上所述B错,单质的还原性:丙>丁>甲;C错,丙的氧化物是氧化钠和过氧化钠,它们都是离子化合物。
答案:AD3.下表是元素周期表的一部分,有关说法正确的是( )A.e的氢化物比d的氢化物稳定B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,c元素单质的化学性质最活泼D.c、e、f的最高价氧化物对应的水化物的酸性依次增强解析:周期表中主要从金属性和非金属性递变推及到物质性质的递变。
答案:D4.(2018·广东高考)(双选题)元素R、X、T、Z、Q在元素周期表中的相对位置如下图所示,其中R单质在暗处与H2剧烈化合并发生爆炸。
则下列判断正确的是( )A.非金属性:Z<T<XB.R与Q的电子数相差26C.气态氢化物稳定性:R<T<QD.最高价氧化物的水化物的酸性:T>Q解析:R单质在暗处与H2A项错,非金属性Cl>S,而且Ar是稀有气体,没有非金属性;B项错,F跟Br原子核外电子数相差18;C项错,气态氢化物HF>HCl>HBr;D项正确,Cl非金属性比Br强。
人教版化学必修二思维导图含答案

人教版化学必修二思维导图含答案Standardization of sany group #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#化学·必修2(人教版)1.下列有关乙醇的物理性质的应用中不正确的是( )A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法答案:A2.下列关于乙醇结构方面的说法中正确的是( )A.乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性B.乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性C.乙醇与钠反应可以产生氢气,所以乙醇显酸性D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼答案:D3.乙酸的结构简式是CH3COOH,其官能团是( )A.-CH3B.-HC.-OHD.-COOH答案:D4.下列物质能够使紫色石蕊试液变色的是( )A.甲烷B.乙醇C.乙酸D.苯答案:C5.(双选题)关于冰醋酸的说法中正确的是( )A.冰醋酸是冰和醋酸的混合物B.冰醋酸是纯净的乙酸C.冰醋酸是无色无味的液体D.冰醋酸易溶解于水和乙醇答案:BD6.(双选题)能够用来鉴别乙醇、乙酸和苯的物质( )A.碳酸氢钠溶液B.氢氧化钠溶液C.水D.紫色石蕊试液答案:AD7.(双选题)水是一种廉价而且非常有用的试剂,下列用水就能鉴别的一组物质是( )A.苯、乙酸、四氯化碳B.苯、乙醇、四氯化碳C.硝基苯、乙醇、四氯化碳D.硝基苯、乙醇、乙酸答案:AB8.有A、B、C、D、E、F6种有机物,它们是烃或者烃的衍生物,在一定的条件下可以有下图的转化关系:A可以氧化生成D,A的气体与相同条件下的一氧化碳的密度相同,B与氢氧化钠溶液共同煮沸可以得到物质C和无机盐G,在G的溶液中加入硝酸酸化,再加入硝酸银溶液有淡黄色沉淀产生,试推断各物质,写出其化学式:A:________;B:________;C:________;D:________;E:________;F:________;G:________。
人教版化学必修2:第二章复习总结(共张PPT)

11、越是 没有本 领的就 越加自 命不凡 。2021/ 8/4202 1/8/42 021/8/ 4Aug-2 14-Aug -21
12、越是 无能的 人,越 喜欢挑 剔别人 的错儿 。2021/ 8/4202 1/8/42 021/8/ 4Wedne sday, August 04, 2 021
谢谢观赏
You made my day!
我们,还在路上……
复习课
一. 化学能与热能 二. 化学能与电能 三. 化学反应速率 四. 化学反应的限度
一、化学能与热能
1、化学反应的实质:
旧化学键断裂,新化学键形成的过程。
2、任何化学反应都伴随着能量的变化! 引起化学反应中的能量变化:
(1)微观:化学键的断裂和形成是化学 反应中能量变化的主要原因;
化学键的断裂——吸收能量; 化学键的形成——放出能量。
两极一液一回路
三 判断:正负极 、 (从活泼性比较、电子得失、氧化还原反应、电子电流 原 流向等多角度判断)
电 池
工作原理:(总的氧化还原反应,电极反应)
分析常见、简单电池工作原理。
设计简单电池。
应 用
比较金属活动性强弱。
加快化学反应速率
判断溶液pH变化。
电极反应式:铜.锌.稀H2SO4组成的原电池
②反应物总吸热反应
能 量
生成物
反应物
反应物总能量﹤生成物总能量
反应过程
练习:下列各图中,表示化学反应正反应是 吸热反应的是
5.常见的放热反应:
(1)所有的燃烧反应(剧烈的发光发热的化学反应)
(2)酸碱中和反应
(3)大多数的化合反应
(C
+
高温
CO2 = 2CO
人教版化学必修二:第2章-思维导图【1】(含答案)

人教版化学必修二:化学·必修2(人教版)1.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。
然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。
由此可见() A.NH4HCO3和盐酸的反应是放热反应B.该反应中,热能转化为产物内部的能量C.反应物的总能量高于生成物的总能量D.反应离子方程式为:NH4HCO3+HCl―→NH4Cl+CO2↑+H2O 答案:B2.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。
则反应S(s)+3F2(g)===SF6(g)的能量变化为()A.放出1 780 kJ的能量B.放出1 220 kJ的能量C.放出450 kJ的能量D.吸收430 kJ的能量答案:B3.已知H2(g)+Br2(l)===2HBr(g)ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:则表中a为()A.404B.260C.230D.2004.(双选题)已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)―→2HCl(g)+Q1,H2(g)+Br2(g)―→2HBr(g)+Q2。
有关上述反应的叙述正确的是()A.Q1>Q2B.生成物总能量均高于反应物总能量C.生成1 mol HCl气体时放出Q1热量D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量答案:AD5.已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1(表示2 mol H2燃烧放出571.6 kJ的热量),CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890 kJ·mol-1(表示1 mol CH4燃烧放出890 kJ的热量)。
第02章 物质世界的尺度、质量和密度单元总结(解析版)
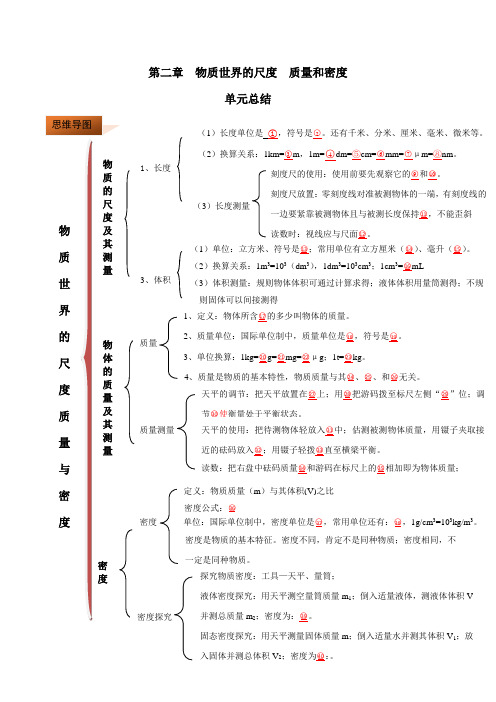
第二章物质世界的尺度质量和密度【思维导图答案】一、物质的尺度及其测量 ○1 ○2 ○3 ○4 ○5 ○6 ○7 ○8 米 m 103 10 100 103 106 109 ○9 ○10 ○11 ○12 ○13 ○14 ○15 ○16 量程分度值水平垂直m 3cm 3ml1二、物质的质量及其测量 ○17 ○18 ○19 ○20 ○21 ○22 ○23 ○24 ○25 ○26 物质 千克 kg 103 106 109 103 形状 状态 地理位置○27 ○28 ○29 ○30 ○31 ○32 ○33 ○34 ○35 水平桌面 镊子零平衡螺母左盘右盘游码总和读数三、密度○36 ○37 ○38 ○39 ○40 Vm=ρ kg/m 3g/cm 3Vm m 12-=ρ 12mV V -=ρ知识要点一:长度的测量与读数长度的测量与读数刻度尺的使用要注意的问题:使用前要观察它的量程、分度值;测量时,零刻度线对准被测长度的一端,有刻度线的一边要紧靠被测物体且与被测长度保持平行,不能歪斜;如因零刻度线磨损而取另一整刻度线作为零刻度线时,切莫忘记最后读数中减掉所取代零刻线的刻度值;读数时,视线应与尺面垂直;记录数据要由数字和单位组成;并要估读到最小刻度的下一位。
在平时,大家应多积累生活方面的知识,估测物体长度也是生活积累的一个方面。
如黑板的长度大概2.5m 、课桌高0.7m 、课本高30cm,篮球直径24cm 、铅笔芯的直径1mm 、一只新铅笔长度20cm 、手掌宽度1dm 、墨水瓶高度6cm 等等。
(2019·毕节)如图所示,铅笔的长度为 cm 。
【答案】7.50。
【解析】由图知:刻度尺上1cm之间有10个小格,所以一个小格代表1mm,即刻度尺的分度值为1mm;铅笔左端与1.00cm对齐,右端与8.50cm对齐,所以铅笔的长度为L=8.50cm﹣1.00cm=7.50cm。
故答案为:7.50。
刻度尺的使用与长度测量是本单元的最主要知识点,在知道长度的单位和换算关系基础上,应在长度测量上投入时间,做到三会:会看、会放、会读。
人教版化学必修二:第1章-思维导图(含答案)

化学·必修2(人教版)1.下列关于同温同压下得两种气体12C18O与14N2得判断正确得就是()A.体积相等时密度相等B.原子数相等时具有得中子数相等C.体积相等时具有得电子数相等D.质量相等时具有得质子数相等解析:12C18O与14N2得质子数与电子数相同均为14,而12C18O中子数为16,质量数为30,14N2得中子数为14,质量数为28。
同温同压且体积相同得两种气体,其物质得量也相同,则其质子数与电子数相同,但质量数不同,故A项错误,C项正确;当原子数相等时,两种气体得物质得量相同。
则其中中子数不同,B项错误;两种气体质量数不同,故当质量相等时,两种气体得物质得量不相同,则其质子数不相同,D项错误。
答案:C2.230Th与232Th就是钍得两种同位素,232Th可以转化成233U。
下列有关Th得说法正确得就是()A.Th元素得质量数就是232B.Th元素得相对原子质量就是231C.232Th转换成233U就是化学变化D.230Th与232Th得化学性质相同解析:Th元素得同位素含量不知道,所以其相对原子质量不能确定,B项错误;232Th可以转化为233U属于核裂变,不就是化学变化,C错误;230Th与232Th得核外电子排布相同,所以其化学性质相同,D 项正确。
答案:D3、13153I就是常规核裂变产物之一,可以通过测定大气或水中13153I 得含量变化来监测核电站就是否发生放射性物质泄漏。
下列有关13153I 得叙述中错误得就是()A、13153I得化学性质与12753I相同B、13153I得原子序数为53C、13153I得原子核外电子数为78D、13153I得原子核内中子数多于质子数解析:53131I得原子序数=质子数=核外电子数=53,质量数为131,中子数为131-53=78,故C项错误。
答案:C4.(2013·福建检测)下列叙述中正确得就是()A.除0族元素外,短周期元素得最高化合价在数值上等于该元素所属得族序数B.元素周期表有7个主族、7个副族、1个0族、1个第Ⅷ族,共18个纵行C.除短周期外,其她周期均有18种元素D.X2+得核外电子数目为18,则X在第三周期第ⅡA族解析:F、O没有正价态,A项错;第六周期有32种元素,第七周期有26种元素,C项错误;Ca2+得核外电子数目为18,但它在第四周期第ⅡA族,D项错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学·必修2(人教版)
1.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。
然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。
由此可见( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应离子方程式为:NH4HCO3+HCl―→NH4Cl+CO2↑+H2O
答案:B
2.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。
则反应S(s)+3F2(g)===SF6(g)的能量变化为( )
A.放出1 780 kJ的能量B.放出1 220 kJ的能量
C.放出450 kJ的能量 D.吸收430 kJ的能量
答案:B
3.已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
H2/g Br2/g HBr/g
1 mol分子中的化学键断裂时需要吸收
436 a 369
的能量/kJ
则表中a为( )
A.404 B.260 C.230 D.200
答案:D
4.(双选题)已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)―→2HCl(g)+Q1,
H2(g)+Br2(g)―→2HBr(g)+Q2。
有关上述反应的叙述正确的是( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1 mol HCl气体时放出Q1热量
D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量
答案:AD
5.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1(表示2 mol H2燃烧放出571.6 kJ的热量),CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1(表示1 mol CH4燃烧放出890 kJ的热量)。
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O (l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.11 B.13 C.14 D.23
答案:B
6.有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④CaO固体。
现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态,判断加入的物质可能是( )
A.①②③④ B.①②④
C.②③④ D.①②③
答案:B
7.根据下面信息,判断下列叙述中正确的是( )
A .氢气跟氧气反应生成水的同时吸收热量
B .生成1 mol H 2O 放出热量926 kJ
C .2 mol H 和1 mol O 所具有的能量大于1 mol H 2和12
mol O 2所具有的总能量 D .1 mol H 2跟12
mol O 2反应生成1 mol H 2O 一定释放能量242 kJ
答案:C
8.向盛有50 mL 1.00 mol/L HCl 溶液的绝热容器中加入NaOH 溶液,NaOH 溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如下图所示,下列说法不正确的是( )
A .该实验表明化学能可以转化为热能
B .NaOH 溶液的浓度大于1.00 mol/L
C .V =50 mL 时,混合液的pH >7
D .该实验表明有水生成的反应都是放热反应
答案:D
9.(双选题)下列有关能量转换的说法正确的是( )
A .煤燃烧是化学能转化为热能的过程
B .化石燃料和植物燃料燃烧时放出的能量均于太阳能
C .动物体内葡萄糖被氧化成CO 2是热能转变为化学能的过程
D .植物通过光合作用将CO 2转化为葡萄糖是太阳能转变成热能的过程
答案:AB
10.某氮肥厂氨氮废水中的氮元素多以NH 4+和NH 3·H 2O 的形式存在,该废水的处理流程如下:
氨氮废水――→Ⅰ低浓度氨氮废水――→Ⅱ含HNO 3废水――→Ⅲ达标废水
(1)过程 Ⅰ:加NaOH 溶液,调节pH 至9后,升温至30 ℃,通空气将氨赶出并回收。
用离子方程式表示加NaOH 溶液的作用:_______________________________________________________________________________________________________________。
(2)过程Ⅱ:在微生物作用的条件下,NH 4+经过两步反应被氧化成NO 3-。
两步反应的能量变化示意图如下:
第一步反应是________(选填“放热”或“吸热”)反应,判断依据是________________________________________________________________________。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。
若该反应消耗32 g CH3OH转移6 mol 电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
答案:(1)NH4++OH-===NH3·H2O
(2)放热反应物的总能量大于生成物的总能量
(3)56。
