结构化学课件第五章
结构化学-第五章

2012-3-10
16
对于s-p轨道: 对于 轨道: 轨道 等性杂化轨道夹角为: 等性杂化轨道夹角为:
α + βcos θ = 0
若为不等性杂化, 若为不等性杂化,则:
cos θij = −
αi α j βiβ j
分别表示两个sp杂化轨道中所含的 成分, 杂化轨道中所含的s成分 αi和αj分别表示两个 杂化轨道中所含的 成分, βi和βj分别表 示两个sp杂化轨道中所含的 成分 示两个 杂化轨道中所含的p成分。在中心原子含有孤对电子对 杂化轨道中所含的 成分。 的多原子分子中,通常采用不等性杂化。 的多原子分子中,通常采用不等性杂化。
2012-3-10 7
注
意
氧族原子作为配体时,可认为不提供电子( 氧族原子作为配体时,可认为不提供电子(如PO43-);但作为 中心原子,则提供所有的6个电子 个电子( 中心原子,则提供所有的 个电子(如SO2); 离子应加上或减去与电荷相应的电子数( 离子应加上或减去与电荷相应的电子数(如PO43-) ; 单电子作为一个电子对看待( 单电子作为一个电子对看待(如NO2) ; 孤电子对本身不能构成分子骨架,只对分子的形状产生影响。 孤电子对本身不能构成分子骨架,只对分子的形状产生影响。
2012-3-10 2
价电子对互斥理论( 一. 价电子对互斥理论(Valence shell electron pair repulsion) ) 1940年最初由 年最初由Sidgwick和 Powell提出 , 能解释许多化合物的几 提出, 年最初由 和 提出 何构型 价电子对互斥理论认为: 价电子对互斥理论认为:原子周围各个价电子对之间由于相互 排斥作用,在键长一定的条件下, 排斥作用,在键长一定的条件下,互 相之间的距离越远越稳定。 相之间的距离越远越稳定。即:分子 的几何构型总是采取价电子对相互排 斥最小的那种结构。 斥最小的那种结构。 价电子对间斥力的根据有二:一是电子对间的静电排斥作用; 价电子对间斥力的根据有二 : 一是电子对间的静电排斥作用 ; 二是Pauli斥力,即价电子对间自旋相同的电子互相回避的效应 斥力, 二是 斥力 价电子对包括:成键电子对 和孤对电子对( 价电子对包括:成键电子对( bp)和孤对电子对 lp) 和孤对电子对 判断分子几何构型的规则如下: 判断分子几何构型的规则如下:
结构化学第五章2
化学反应的可能性和限度由化学势决定,反应沿化学势降 低的方向进行,直至化学势相等,达到平衡状态。
化学反应的速度决定于活化能的高低:活化能高,反应不 易进行,反应速度慢;活化能低,反应容易进行,反应速度快 。在反应时,若正反应是基元反应,则逆反应也是基元反应, 且经过同一活化体,此即微观可逆原理。
5.6.2前线轨道理论
4 3
4 3
4 3
6 4
6 4
2 3
18 19
注意:上述条件也不是绝对的,根据实验测定的数据,有时虽满 足这两个条件并不一定能形成离域π键,从而也不出现共轭效应 所具有的性质,例如环丁二烯等。 层形(BN)x分子,它虽然和 石墨是等电子体系,满足形成离域π键的两个条件,但它是白色 ,绝缘性很好的固体,其原因是B—N键的极化作用,使其能带分 成两个亚带,带隙宽度达440kJ· -1,所以没有离域π键出现。 mol 在有些分子中,原子并不完全共面,但也有一定的共轭效应。
3.酸碱性 苯酚显酸性,苯胺显碱性,羧酸呈酸性,酰胺呈碱性,这些 均与离域π键的生成与否有关。例如苯酚和羧酸电离出H+后,酸 根
均生成离域π键,稳定存在。而苯胺和酰胺中就已有离域π键存 在:
它们不易电离,苯胺可以接受H+,故呈若碱性。
4.化学反应性
离域π键的存在对体系性质的影响在化学中常用共轭效应 表示,它是化学中最基本的效应之一。芳香化合物的芳香性, 许多游离基的稳定性,丁二烯类的1,4—加成反应性等都和离 域π键有关。
E 2 1.62 2 0.62 4 4.48 4.48
丁烯中2个电子的键能为2β,所以丁二烯离域结果比单 纯两个丁烯的双键能量要低0.48β,这一差值称为离域能。
结构化学课件第五章

j 1,2
2b2 c21 py c222
反键分子轨道
基组态 1a1 2 2a1 2 1b2 2 3a1 2 1b1 2 4a1 0 2b2 0
内层电子 成键电子
孤对电子
对应两个O-H 键
易生成氢键,易与过度金属离子配位
H2O 的光电子能谱的四个峰: 12.62,13.78,17.02,32.2 (eV) 被认定为,1b1,3a1,1b2,2a1 电子的电离能
1
2 1
2 1
2 1
2
1
2 1
2
1sa 1sb
1 2
1
11ssdc
2
a1
s
1 2
1sa
1sb
1sc
1sd
* a1
s
1 2
1sa
1sb
1sc
1sd
t2
px
1 2
1sa
1sb
1sc
1sd
* t2
px
1 2
1sa
1sb
1sc
1sd
t2
py
1 2
1sa
1sb
1.1 H2O
C2v 点群的特征标表
E
A1 1
A2 1
C 2 v xz v yz
1
1
1
z x2, y2,z2
1 -1
-1
xy
B1 1 -1
1
-1
B2 1 -1
-1
1
x, xz
y, yz
c2 z轴
C2
O
H
H
yz平面
氧原子的2s, pz属A1不可约表示,px属B1不可约表示,py属B2不可约表示 两个氢原子的1sa,1sb, 组合成一个二维可约表示的基
结构化学《结构化学》第5章 第2讲(5.6)5.2 《结构化学》第5章第2讲

13
根据上述考虑,可将反应过程中分子轨道的变化 关系用能量相关图联系起来。
在能量相关图中,如果反应物的每个成键轨道只 和生成物的成键轨道相关联,则反应活化能低,易 于进行,称为对称性允许,加热就能使反应进行;
如果反应物和生成物之间有成键轨道和反键轨道 相关联,则反应的活化能高,不易进行,称为对称 性禁阻,要使反应进行,需要进行光照,把反应物 的电子由基态激发到激发态。
14
3. 如何理解丁二烯在不同条件下电环化得到不同 构型的环丁烯?
CC
RC
C R 顺旋 R
HH
Δ
H
H
C2对称
R
CC
RC
C R 对旋 R
HH
+- -+
+
-
-
+
N2的HOMO
N2的LUMO
6
O2分子的价层电子结构为: (σ2s)2(σ2s*)2(σ2pz)2(π2px)2(π2py)2(π2px*)1(π2py*)1(σ2pz*)0 , 其 中4个2s电子占据(σ2s)2(σ2s*)2轨道,4个px、py中的电 子占据(π2px)2(π2py)2轨道,2个pz电子占据(σ2pz)2轨道。 其HOMO为π2p*,LUMO也为π2p*。
h
H
R σV对称
H
15
4
S
3 A
ψ2
S
ψ1
A
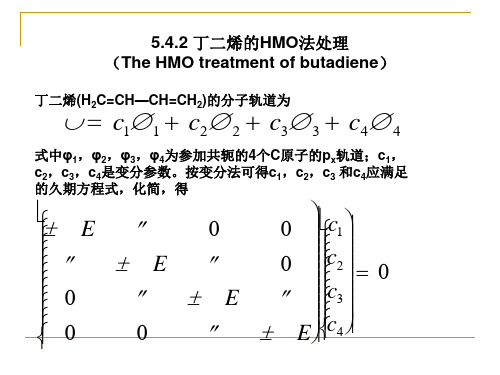
丁二烯
C2
*
A
*
S
A
环丁烯
S
C2
16
2012结构化学05-第五章-讲义

§5.0 预备知识5.0.1 数学复习第五章 分子轨道理论 P1055.0.2 线性变分法原理125.0.1 数学复习一、矩阵m×n 个数排成 m 行、n 列的矩形数 表,谓之。
(1) 矩阵相等⎛ a 11 a12 a 13 La 1n ⎞ ⎟ ⎜ ⎜ a a a La 2n ⎟ A m×n= ⎜ 21 22 23 = ( a ij ) m×n LLLLLLL ⎟ ⎟ ⎜ ⎟ ⎜a a ⎝ m1 m2 am3 Lamn ⎠例如:⎛a a ⎞ ⎛b b ⎞ ⎜ ⎟ ⎜ ⎟ A = ⎜ 11 12 ⎟ 和 B = ⎜ 11 12 ⎟ ⎝ a 21 a 22 ⎠ ⎝b 21 b 22 ⎠a ⎞ ⎛b b ⎞ a =b ,a =b ⎛a 所谓 A = B, 或 ⎜ 11 12 ⎟ = ⎜ 11 12 ⎟ 即是 11 11 12 12 ⎜ a a ⎟ ⎜b b ⎟ a 21 = b 21 , a 22 = b 22 ⎝ 21 22 ⎠ ⎝ 21 22 ⎠所谓 AB = C a b +a b ⎞ ⎛ a a ⎞⎛ b b ⎞ ⎛ c c ⎞ ⎛ a b + a b 即 ⎜ 11 12 ⎟⎜ 11 12 ⎟ = ⎜ 11 12 ⎟ = ⎜ 11 11 12 21 11 12 12 22 ⎟ ⎜ a a ⎟⎜b b ⎟ ⎜ c c ⎟ ⎜ a b + a b a b + a b ⎟ 22 22 ⎠ ⎝ 21 22 ⎠⎝ 21 22 ⎠ ⎝ 21 22 ⎠ ⎝ 21 11 22 21 21 12若( ij)×n = bij)×n a m ( mm×n 个等式则 aij = bij (i =1, 2,L, m ; j =1,2,L, n)(2) 矩阵的乘积A = (a ij) m×n 与 B = (b ij) n×P 的乘积,记为 AB = Cm× P = (cij ) m×Pc ij = ∑ a i k b k j = a i1 b 1 j + a i 2 b 2 j +L+ a i n b n j (i =1, 2,L, m ; j =1,2,L, n)k =1 n⎛ a11 a12 ⎞ ⎛ x1 ⎞ ⎛ b1 ⎞ ⎟⎜ ⎟ ⎜ ⎟ 例如:⎜ ⎜ a a ⎟ ⎜ x ⎟ = ⎜b ⎟ ⎝ 21 22 ⎠ ⎝ 2 ⎠ ⎝ 2 ⎠3⎧ a11 x1 + a12 x2 = b1 可写为: ⎨ ⎩a21 x1 + a22 x2 = b24二、m×n 阶线性代数方程组的缩写 二、mm个方程,n个未知数的一次代数方程组: 个方程,n若令系数矩阵A、未知数矩阵X和常数矩阵B 若令系数矩阵A、未知数矩阵X和常数矩阵B⎛ a 11 a12 a 13 La 1n ⎞ ⎜ ⎟ ⎜ a a a La 2n ⎟ A = ⎜ 21 22 23 LLLLLLL ⎟ ⎜ ⎟ ⎜ a a a La ⎟ mn ⎠ ⎝ m1 m2 m3⎛ x1 ⎞ ⎜ ⎟ ⎜x ⎟ X =⎜ 2 ⎟ M ⎜ ⎟ ⎜x⎟ ⎝ n⎠ ⎛ b1 ⎞ ⎜ ⎟ ⎜b ⎟ B =⎜ 2 ⎟ M ⎜ ⎟ ⎜b ⎟ ⎝ m⎠⎧ a11 x1 + a12 x2 +L+ a1n xn = b1 ⎪ a x + a x +L+ a x = b ⎪ 21 1 22 2 2n n 2 ⎨ ⎪ LLLLLLLLLLL ⎪am1 x1 + am2 x2 +L+ amn xn = bm ⎩则,方程组可表示为:AX = B⎛ a 11 a12 a 13 La 1n ⎞ ⎛ x1 ⎞ ⎛ b1 ⎞ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎜ a 21 a22 a 23 La 2n ⎟ ⎜ x2 ⎟ ⎜ b2 ⎟ ⎜ LLLLLLL ⎟ ×⎜ M ⎟ = ⎜ M ⎟ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜a a ⎝ m1 m2 am3 Lamn ⎠ ⎝ xn ⎠ ⎝ bm ⎠此式可缩写为:∑a xj =1nij j= bii =1, 2, 3,L, m例如:5⎧ a1 x1 + b1 x2 = c1 ⎨ ⎩a2 x1 + b2 x2 = c2⎛ a1 b1 ⎞⎛ x1 ⎞ ⎛ c1 ⎞ ⎟⎜ ⎟ ⎜ ⎟ 可写为: ⎜ ⎜ a b ⎟⎜ x ⎟ = ⎜ c ⎟ ⎝ 2 2 ⎠⎝ 2 ⎠ ⎝ 2 ⎠61三、行列式a 11 a12 a 13 La 1n a 21 a22 a 23 La 2nLLLLLLL行列式给出了各 个元素之间的一 个运算结果。
结构化学课件51

3。杂化轨道成键时要满足成键三原则 例: SP3杂化 • 以CH4为例:杂化轨道理论认为:C原子 在形成分子时,在H原子逼近时,C原子 首先要进行SP3杂化,形成四条SP3杂化轨 道。 • 再与四个H形成四个相同的C-H键,分子 空间构形由杂化轨道决定,与H结合时, 符合成键三原则。
k Cks s Ckx px Cky p y Ckz pz
和 X 轴平行,由等性杂化概念可知每一轨道 s 成分占 1/3 (1个 s 分
在3 个 sp2中 ),故组合系数为
成分全由p 轨道组成,因与 x 轴平行,与 y 轴垂直,py没有贡献,全部为px 。
1 1 1 / 3,(ai2 , ai ) ;其余2/3 3 3
所以: 1 s 2 p 1 x 3 3 同理:
Байду номын сангаас
VP LP
5 5 5
电子对的 空间构型
分子的 空间构型
例 SF4 ClF3 XeF2
1
2 3
三角双锥 三角双锥 三角双锥
变形四方体 T形 直线形
以IF2-为例,用上述步骤预测其空间构型。 (1)中心原子I的价电子数为7,2个配位原子F各提 供1个电子,负离子加一个电子,价电子对数为5。 (2)5对电子以三角双锥方式排布。 (3)因配位原子F只有2个,所以5对电子中,只有2 对为成键电子对,3对为孤电子对。有三种可能的情 况,选择结构中电子对斥力最小的,即IF2-的稳定构 型为直线形结构。
XeF4
(3)孤对电子占据的位置 VP = 5,电子对空间构型为三角双锥, LP占据轴向还是水平方向三角形的某个 顶点?原则:斥力最小。 例如:SF4 VP=5 LP=1 F F F S F S F F F F LP-BP(90o) 3 2 结论:LP占据水平方向三角形的某个顶点, 稳定分子构型为变形四面体(跷跷板形)
结构化学第五章 2节

dsp2杂化 杂化: 每个杂化轨道中α=1/4,β=1/2,γ=1/4,波函数的一般形式 波函数的一般形式: 每个杂化轨道中 波函数的一般形式
ψdsp
2
1 1 1 = s+ p+ d 2 2 2
杂化轨道间夹角为90 呈平面正方形. 杂化轨道间夹角为 o及180o,呈平面正方形 呈平面正方形 配位数为4的配合离子 如 配位数为 的配合离子,如Ni(CN)42-,Pt(NH3)42+等, 的配合离子 中心离子采取dsp2杂化 杂化. 中心离子采取
+
2
2
py
+
-
+
-
1 1 ψ s+ py 1= 2 2 1 1
++ x y
+
ψ2 =
s
+ + -
-
+ +
-
② sp2等性杂化 α=1/3,β=2/3 cosθ=-1/2, θ=120o 平面三角形分子:BF3,SO3等 平面三角形分子 波函数的一般形式: 波函数的一般形式 ψ 2 = 1 s + 2 p sp 3 3 杂化轨道ψ 最大方向为x方向 且由s,p 方向,且由 参与杂化. 设sp2杂化轨道ψ1最大方向为 方向 且由 x,py参与杂化 轴垂直,p 全部为p ψ1与y轴垂直 y无贡献 全部为 x 轴垂直 无贡献,全部为
例:sp等性杂化轨道夹角 等性杂化轨道夹角:180o; 等性杂化轨道夹角 sp2等性杂化轨道夹角 等性杂化轨道夹角:120o
4. 杂化轨道理论的应用 (1) 等性杂化 ① sp等性杂化 等性杂化 α=1/2,β=1/2
cosθ=-1, θ=180o 直线型分子:CO2,N3-等 直线型分子 1 1 s+ p ψ= 波函数的一般形式: 波函数的一般形式 2 2 若是s和 轨道参与,则 若是 和py轨道参与 则
最新结构化学第五章3节

0 .618 0 .618
x 4 1 .618
因为: 0 所以: E1E2E3E4
Ex
E 1 1 .618
E E
2 3
0 .618 0 .618
E 4 1 .618
(3) 求分子轨道的组合系数
x 1 0 0 c1
1
0 0
x 1 0
1 x 1
0 1 x
其分子轨道能级图为:
E1= +
E=2(+ )=2+2
②电荷密度
i
n c2 k ki
k
第i个原子上出现的π电子 数
i--第i个原子;k--π分子轨道编号;nk--π分子 轨道(Ψ)上的电子数;cki--π分子轨道(Ψ)上第i个原子 轨道的系数。
例如: ρ3 = 2×(0.6015)2 + 2×(-0.3717)2=1.0000
i和j原 子间的 电荷密 度
例如:P23 =2×(0.6015×0.6015)+2×(0.3717)×(-0.3717)=0.448 ψ2 = 0.6015φ1 + 0.3717φ2 - 0.3717φ3 - 0.6015φ4 ψ1 = 0.3717φ1 + 0.6015φ2 + 0.6015φ3 + 0.3717φ4
x100 1 x10
0 01 x1 001x
(2) 解方程
x10 ( 1)11 x 1 x 1
01x
110 ( 1)121 0 x 1 0 0
01 x
x43x210 (x21)2x20
(x2x1 )x (2x1 )0
1 5
1 5
x1,2 2
x3,4 2
x 1 1 .618
第5章多原子分子的结构与性质-2012年兰州大学李炳瑞最新结构化学课件

第5章目录5.1 非金属元素的结构化学:8-N法则5.2 非共轭分子几何构型与VSEPR规则5.3 分子几何构型与Walsh规则5.4 共轭分子与SHMO法5.4.1 丁二烯离域大π键的SHMO处理5.4.2 简并轨道的求解与等贡献规则5.4.3 直链和单环共轭体系本征值的图解法5.4.4 分子图:π电子密度、π键级、自由价5.4.5 共轭效应5.4.6 共轭分子在现代科技中的应用5.4.7 超共轭效应5.5 饱和分子的正则轨道与定域轨道5.6 缺电子分子的结构5.6.1 缺电子原子化合物的三种类型5.6.2 硼烷中的多中心键5.6.3 金属烷基化合物中的多中心键5.7 等瓣类似性关系5.7.1 等瓣类似性概念5.7.2 八面体构型金属-配体碎片与有机碎片的等瓣类似性5.7.3 其他构型的金属-配体碎片与有机碎片的等瓣类似性5.7.4 各种配位的分子碎片的等瓣类似关系小结5.7.5 等瓣类似性原理的应用实例5.8 多原子分子的谱项5.8.1 电子组态与分子谱项5.8.2 荧光与磷光5.9 配位场理论5.9.1 晶体场理论(CFT)5.9.2 配位场理论(LFT)5.9.3 T-S图与电子光谱5.10 分子轨道对称性守恒原理5.10.1 前线轨道理论5.10.2 相关图理论与金属相比, 非金属的数量要少得多。
目前在元素周期表中有110多种元素,非金属元素只占20余种, 分布在p 区(除H 的位置有不同看法外)。
在p 区中,整个一列稀有气体都是非金属元素,其余非金属元素很有规律地占据了右上角区域。
非金属元素数量虽少,但成键规律、结构特征都与金属元素有所不同。
非金属单质中定域共价键占主导地位,与金属单质中金属键占主导地位形成鲜明的对照。
金属键没有饱和性和方向性。
对于金属单质结构,几何因素起重要作用, 大多数金属单质晶体采取简单的密堆积结构。
共价键有饱和性和方向性。
非金属原子以共价单键结合时,周围通常配置8-N个原子,非金属间化合物配位也如此。
《结构化学》第五章

×△H △H2=△HC(C6H12)-△HC(C6H10)-3×△ C(H2) △ △ ×△ =3953.0 KJ•mol-1-3301.6 KJ•mol-1-3×285.8 KJ•mol-1 × =-206 KJ•mol-1 △H=3△H1-△H2 △ △ =3×(-119.4KJ•mol-1)-(-206 KJ•mol-1) × ( =-152.2 KJ•mol-1 [5.21] 试分析下列分子中的成键情况,指出 试分析下列分子中的成键情况,指出C—Cl键键长大小 键键长大小 次序,并说明理由。 次序,并说明理由。 (a)H3CCl (b)H2C=CHCl (c)HC≡CCl ) [解]: 解: 分子的衍生物。 分子一样, (a)H3CCl:该分子为 ) :该分子为CH4分子的衍生物。同CH4分子一样, C原子也采用 3杂化轨道成键。4个sp3杂化轨道分别与 个H原 原子也采用sp 原子也采用 杂化轨道成键。 个 杂化轨道分别与3个 原 子的1s轨道及 原子的3p轨道重叠共形成 个σ键。分子呈四面 子的 轨道及Cl原子的 轨道重叠共形成4个 键 轨道及 原子的 轨道重叠共形成 体构型, 点群。 体构型,属C3v点群。 (b) H2C=CHCl:该分子为 2C=C H2分子的衍生物,其成键情 分子的衍生物, :该分子为H 况与C 分子的成键情况即有相同之处又有差别。 况与 2H4分子的成键情况即有相同之处又有差别。在C2H3Cl分 分 子中, 原子 原子( ) 原子的1s轨 子中,C原子(1)的3个sp2杂化轨道分别与两个 原子的 轨 个 杂化轨道分别与两个H原子的 道
[5.22] 试分析下列分子的成键情况,比较 的活泼性,说明理由。 试分析下列分子的成键情况,比较Cl的活泼性 说明理由。 的活泼性, C6H5 Cl C6H5CH2Cl (C6H5)2CHCl (C6H5)3CCl [解]:在分 6H5 Cl子中,一方面,C原子相互间通过 2- sp2杂 子中, 原子相互间通过sp 解 :在分C 子中 一方面, 原子相互间通过 化轨道重叠形成C—Cσ键,另一方面,一个 原子与 原子间通 原子与Cl原子间通 化轨道重叠形成 键 另一方面,一个C原子与 过sp2- 3p轨道重叠形成 轨道重叠形成C—Clσ键。此外,6个C原子和 原子通 键 此外, 个 原子和Cl原子通 轨道重叠形成 原子和 轨道重叠形成垂直于分子平面的离域π键 由于Cl原子参与 过p轨道重叠形成垂直于分子平面的离域 键 。 由于 原子参与 轨道重叠形成垂直于分子平面的离域 形成离域π键 因而其活泼性较低。 形成离域 键,因而其活泼性较低。 分子中, 原子仍采用sp 在 C6H5CH2Cl分子中 , 苯环上的 原子仍采用 2 杂化轨道与周 分子中 苯环上的C原子仍采用 边原子的相关轨道重叠形成σ键 而次甲基上的C原子则采用 原子则采用sp 边原子的相关轨道重叠形成 键,而次甲基上的 原子则采用 3 杂化轨道与周边原子的相关轨道重叠形成σ键。此外,苯环上的 杂化轨道与周边原子的相关轨道重叠形成 键 此外, 6 π 6 。在中性分子 6个C原子相互间通过 轨道重叠形成离域 键: 原子相互间通过p轨道重叠形成离域 个 原子相互间通过 轨道重叠形成离域π键 次甲基上的C原子并不参与形成离域 原子并不参与形成离域π键 但当Cl原子被解 中,次甲基上的 原子并不参与形成离域 键,但当 原子被解 离后, 原子的轨道发生了改组, 杂化轨道改组为sp 离后,该 C原子的轨道发生了改组,由sp3杂化轨道改组为 2杂 原子的轨道发生了改组 化轨道,此时它就有条件参加形成离域π键。因此,在 6 [C6H5CH2]+中存在 π 7 。由于π电子的活动范围扩大了,π 7 的能 由于 电子的活动范围扩大了, 6 电子的活动范围扩大了 6 的能量低,这是C 分子中Cl原子活性高的另一 量比 π 6 的能量低,这是 6H5CH2Cl分子中 原子活性高的另一 分子中 个原因。 个原因。
结构化学5

实验测定 H2O 分子∠HOH=104.5o 。设分 子处在 xy 平面上。 O 原子的两个杂化轨道: O
104.5o
y H
H x
b c1 cos52.25 o px sin 52.25 o p y c2 s
0.61c1 px 0.79c1 p y c2 s
5.1.3 不等性杂化
NH4+、CH4均为正四面体结构,N和C采用等性sp3杂 化,而在H2O、NH3中,键角的实验值为104.5, 107.3, 虽 然它们与NH4+、CH4等电子分子,但键角小于10928‘,
也比采用纯 p 轨道成键的键角要大。为此提出H2O、NH3
采取不等性 sp3杂化的概念。
孤对电子占据轨道中 s 成份大于键轨道中 s 成分
5.2 饱和分子的分子轨道理论
用分子轨道理论处理多原子分子时,按照 MO的普遍性原则, 把整个分子作为一个整体,其 中每个电子都是在整个分子骨架上运动。例如:CH4 中每个电子都是在五个原子核及其它电子组成的场 中运动,而不是在两个键连原子间运动。
• 价电子对互斥理论:
• VSEPR :Valence shell electron pair repulsion
1940年提出,用来解释许多化合物的几何构. 原子周围各个价电子对之间由于互相排斥作用, 在键长一定的条件下,相互间距离愈远分子愈稳定。
· 价电子对之间排斥力的根源
1. 是各电子对之间的静电排斥力;
1 1 1 / 3,(a , ai ) ;其余2/3 3 3
2 i
所以: 1 s 2 p 1 x 3 3 同理:
2 3
300
结构化学第5章-1

5.2 杂化轨道理论
杂化轨道 sp sp2 sp3 dsp2 dsp3 dsp3 d2sp3 参加杂化的原子轨道 s , px s , px , py s , px , py , pz dx2-y2 , s , px , py dz2 , s , px , py , pz dx2-y2, s , px , py , pz 构型 直线型 平面三角形 四面体形 平面四方形 三方双锥形 四方锥形 对称性 D∞h D3h Td D4h D3h C4v Oh 实例 CO2 , N3BF3 , SO3 CH4 Ni(CN)42PF5 IF5 SF6
5.1 价电子对互斥理论 (VSEPR)
☺ 孤对电子占据的位置
vp= 5,电子对空间构型为三角双锥 , 原则: 原则:斥力最小 SF4 vp = 5 lp = 1
··
F F
lp-bp(90o) -
F
F
S F
3
F F
S F
2
√
··
vp = 2 vp = 3
BeCl2 (2bp) , 直线形
SnCl2 vp = 4
3 1 5 3
5.2 杂化轨道理论
例
H 2O
分子∠ 实验测定 H2O 分子∠HOH=104.5o 。
O
104.5o
y H
平面上。 设分子处在 xy 平面上。 O 原子的两个杂化轨道: 原子的两个杂化轨道:
H
x
ψ a = c1 ( cos 52.25o ) px + ( sin 52.25o ) p y + c2 s = 0.61c1 px + 0.79c1 p y + c2 s
5.2 杂化轨道理论
杂化轨道: 杂化轨道: 一个原子中不同原子轨道的线性组合称为原子的轨道 杂化后的原子轨道称为杂化轨道。 杂化 ,杂化后的原子轨道称为杂化轨道。 杂化的目的:更有利于成键。 杂化的目的:更有利于成键。 杂化的动力:受周围原子的影响。 杂化的动力:受周围原子的影响。 杂化的规律 轨道的数目不变, ★ 轨道的数目不变,空间取向改变 ; 杂化轨道能与周围原子形成更强的σ键 ★ 杂化轨道能与周围原子形成更强的 键,或安排孤对电 子,而不会以空的杂化轨道存在。 而不会以空的杂化轨道存在。
结构化学课件5

BF3
CH 4
PCl5
SF 6
八面体
② LP≠0 :分子的空间构型不同于电子对的空间 构型
VP 3 4
其中
LP
电子对的 空间构型
分子的 空间构型
例 SnCl2 NH3 H2O IF5
1
1 2
平面三角形 四面体 四面体 八面体
V形 三角锥 V形 四方锥
6
1
2
八面体
平面正方形
XeF4
孤对电子占据的位置: VP = 5,电子对空间构型为三角双锥, LP占据轴向还是水平方向三角形的某个 顶点?原则:斥力最小。 例如:SF4 VP=5 LP=1 F F F S F S F F F F LP-BP(90o) 3 2 结论:LP占据水平方向三角形的某个顶点, 稳定分子构型为变形四面体(跷跷板形)
氧与硫不提供价电子;
③正离子应减去电荷数,负离子应加上电荷数。 2 1 例:VP( SO 4 )= (6+4×0+2)=4 2
(2) 确定电子对的空间构型:
VP=2 直线形 : A
: :
A
VP=3
VP=4
平面三角形
:
:
:
A
四面体
:
:
:
VP=5
VP=6
三角双锥
八面体Biblioteka : A : : A : :
: : :
四面体形
Td
CH4
Ni(CN)42PF5
平面四方形 D4h 三方双锥形 D3h
dsp3
d2sp3
dx2-y2, s , px , py , pz
四方锥形
C4v
IF5
SF6
dz2, dx2-y2, s , px , py , pz 正八面体形 Oh
南开大学结构化学课件5

第五章分子结构Ⅲ计算化学基础(讲座)§5.0 计算化学发展背景5.0.1 计算机的发展—硬件背景计算机的硬件高速发展计算速度高速增长大量原来无法想象的计算可以轻易完成2005.11 TOP51. DOE/NNSA/LLNL 280.62. IBM Thomas J. Watson Research Center 91.293. DOE/NNSA/LLNL 63.394. NASA/Ames Research Center/NAS 51.875. Sandia National Laboratories 38.27 2006.11 TOP51. DOE/NNSA/LLNL 280.62. NNSA/Sandia National Laboratories 101.43. IBM Thomas J. Watson Research Center 91.294. DOE/NNSA/LLNL 75.765. Barcelona Supercomputing Center 62.63 2007.11 Top 51. DOE/NNSA/LLNL BlueGene 478.22. Forschungszentrum Jülich1673. New Mexico Computing Applications Center 1274. Computational Research Lab. TATA SONS 1185. Swedish Government Agency 103 2008.11 Top 51. DOE/NNSA/LANL Roadrunner11052. Oak Ridge National Lab Jaguar10593. NASA/Ames Res Center Pleiades4874. DOE/NNSA/LLNL BlueGene/L4785. Argonne National Laboratory BlueGene/P4502009.11 Top51. Jaguar -Cray XT5-HE Opteron Six Core2.6 GHz (Oak Ridge National Laboratory)17592. Roadrunner -BladeCenter QS22/LS21 Cluster, PowerXCell 8i3.2 Ghz / Opteron DC 1.8 GHz, Voltaire Infiniband (DOE/NNSA/LANL)10423. Kraken XT5 -Cray XT5-HE Opteron Six Core 2.6 GHz (National Institute for Computational Sciences/University of Tennessee)831.74. JUGENE -Blue Gene/P Solution(Forschungszentrum Juelich (FZJ))825.55. Tianhe-1-NUDT TH-1 Cluster, Xeon E5540/E5450, ATI Radeon HD 4870, Infiniband (National SuperComputer Center in Tianjin/NUDT)563.1TOP10 2010.61.Jaguar-Oak Ridge National Laboratory17592.Nebulae-Dawning TC3600 国家超级计算深圳中心12713.Roadrunner-DOE/NNSA/LANL10424.Kraken XT5-Cray XT5-HE National Institute forComputational Sciences/University of Tennessee831.75.JUGENE-Blue Gene Forschungszentrum Juelich825.56.Pleiades-SGI Altix ICE NASA/Ames ResearchCenter/NAS772.77.Tianhe-1国家超级计算天津中心563.18.BlueGene/L-DOE/NNSA/LLNL478.29.Intrepid-Blue Gene Argonne National Laboratory458.610.Red Sky-Sun Blade Sandia National Laboratories433.5TOP10 2010.111.Tianhe-1国家超级计算天津中心25662.Jaguar-Oak Ridge National Laboratory17593.Nebulae-Dawning TC3600 国家超级计算深圳中心12714.TSUBAME 2.0 GSIC Center, Tokyo Institute ofTechnology 11925.Hopper DOE/SC/LBNL/NERSC 10546.Tera-100 Commissariat a l'Energie Atomique(CEA)10507.Roadrunner-DOE/NNSA/LANL10428.Kraken XT5-Cray XT5-HE National Institute forComputational Sciences/University of Tennessee831.79.JUGENE-Blue Gene Forschungszentrum Juelich825.510.Cielo-DOE/NNSA/LANL/SNL816.6Cray XE6 12-core 2.1 GHzHopperHP ProLiant SL390s G7 Xeon 6C X5670,Nvidia GPUTSUBAME 2.0 Dawning TC3600 Blade, Intel X5650,NVidia Tesla C2050 GPUNebulae Cray XT5-HE Opteron 6-core 2.6 GHz JaguarNUDT TH MPP, 14336颗至强X5670处理器(六核,2.93GHz 主频),GPU 7168块Tesla M2050计算卡(1.15GHz ,双精度浮点515Gflops 、单精度浮点1.03Tflops)Tianhe-1A“南开之星”800个Xeon 3.06G CPU, 400个节点,实测计算能力最终达到了3.231万亿次,实测效率达到68.74% TOP 20(预测)Top 42(2004.6)Top 61(2004.11)Top135(2005.11)Top235 (2006.6)Top348 (2006.11)跌出Top500(2007.6 第500名4.005万亿)(2007.11 第500名5.93万亿)(2008.11 第500名12.60万亿)(2009.11第500名20.051万亿)1国家超算中心-天津255-257 Service Provider3国家超算中心-深圳261,262 Engineering Company28中科院过程工程研究所267,268 Telecommunication Company 35上海超算中心344-347 Network Company68中科院网络中心359 Network Company154Engineering Company 368 Telecommunication Company 172Telecommunication Company 394 吉林大学210Telecommunication Company 417-422 Internet Service211Telecommunication Company 438 Telecommunication Company 230Telecommunication Company 441 Telecommunication Company 243-245Engineering Company 442,443 Service Provider246-248Network Company 488 南京大学5.0.2 软件背景•软件的发展→使用户勿需具备高深的理论知识,只要有一般的计算机应用能力,就可以很容易地完成许多计算化学的简单工作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 2. 3. 4.
离域键函数 定域键函数 分子几何构型 分子几何构型 共轭分子
5.
硼烷
1.
离域键函数
分子轨道的基本要点是求得分子中各单电子波函数(分子轨道) 分子轨道的基本要点是求得分子中各单电子波函数(分子轨道) 及能级,按规则填入电子得到基态及各激发态。 及能级,按规则填入电子得到基态及各激发态。 这些结果不但 可与光电子能谱等实验结果相关联 ,而且可同分子中原子间的 局域键的特征相关联。 局域键的特征相关联。 尽管分子轨道中的电子不会定域在某两个原子之间,而是在多 尽管分子轨道中的电子不会定域在某两个原子之间, 个原子之间运动,遍及整个分子,即离域运动。 个原子之间运动,遍及整个分子,即离域运动。 这里主要讨论用群论方法获取此类分子轨道及其能级的问 题 1)按点群不可约表示分类组成原子的价轨道, 群轨道 ( )按点群不可约表示分类组成原子的价轨道,
* ψa = s + (1sa +1sb +1sc +1sd ) ψa = s − (1sa +1sb +1sc +1sd )
1
1 2
1
1 2
ψt = px + (1sa +1sb −1sc −1sd ) ψt* = px −
2
1 2
2
1 (1sa +1sb −1sc −1sd ) 2
1 1 * ψt2 = py + (1sa −1sb −1sc +1sd ) ψt2 = py − (1sa −1sb −1sc +1sd ) 2 2 1 ψt2 = pz + (1sa −1sb +1sc −1sd ) 2 1 ψ = pz − (1sa −1sb +1sc −1sd ) 2
* t2
定域键函数
定域键函与分子轨道相似,只是不离域,而是定域在两个原子间的区域, 定域键函与分子轨道相似,只是不离域,而是定域在两个原子间的区域, 并沿键轴扩展 键的定域性既有实验事实依据,又与 键的定域性既有实验事实依据,又与Lewis的电子对成键思想相吻合 的电子对成键思想相吻合 分子稳定性来自一组键轨函的形成,每个键轨可容纳一对自旋相反的电子, 分子稳定性来自一组键轨函的形成,每个键轨可容纳一对自旋相反的电子, 且对应一个化学键 以氧原子为坐标原点, 平面为分子平面, 以氧原子为坐标原点,以XY平面为分子平面,用定域键函讨论水分子。 平面为分子平面 用定域键函讨论水分子。 两个氢原子的1s轨道 轨道,生成两个定域键B1,B2 两个氢原子的 轨道Sa和Sb分别与氧的Px,Py轨道,生成两个定域键 轨道 分别与氧的
1 2 1 2
1 2 1s a 1 1sb − 2
将属同一不可约表示的群轨道组合成分子轨道
ψ ia = ci1s + ci 2 p z + ci 3φ1
1
i = 2,3,4
ψ 2 a = c21 ( s − p z ) + c22φ1
1
ψ 3a = c31 ( s + p z )
第五章 多原子分子
多原子分子的几何构型(需要一组键长和键角数据表征) 多原子分子的几何构型(需要一组键长和键角数据表征)和化学 键(原子间结合能),较双原子分子复杂的多。但原则上,求 原子间结合能),较双原子分子复杂的多。但原则上, ),较双原子分子复杂的多 解波动方程都可得到答案。借助计算机, 解波动方程都可得到答案。借助计算机,通常均可满意地完成 这类研究。现已有多种成熟的计算机程序软件可用。 这类研究。现已有多种成熟的计算机程序软件可用。 简化的模型与图像处理, 简化的模型与图像处理,对于化学家认识和总结多原子分子的 成键规律及建立相应的概念,同样具有重要意义。 成键规律及建立相应的概念,同样具有重要意义。 实验上,前者主要用衍射方法( 实验上,前者主要用衍射方法(如,X射线衍射、电子衍射、 射线衍射、电子衍射、 中子衍射)测定。 中子衍射)测定。 后者主要用谱学方法( 后者主要用谱学方法(如,分子光谱、电子能谱、 主要用谱学方法 分子光谱、电子能谱、 磁共振谱)测定。 磁共振谱)测定。
B1 = N ( p x + λ s a )
B 2 = N (p y + λ sb )
氧的P 轨道垂直于分子平面, 轨道能量较低 故均为非键轨道, 轨道能量较低, 氧的Pz轨道垂直于分子平面,S轨道能量较低,故均为非键轨道,用于描述 两对孤对电子。 两对孤对电子。
按定域键函处理结果,水分子两 键夹角应是90 不是104.50。 按定域键函处理结果,水分子两O-H键夹角应是 0,不是 键夹角应是 为此,假设氧的 轨道中混入一定成分的 轨道。 轨道中混入一定成分的s轨道 为此,假设氧的p轨道中混入一定成分的 轨道。
ai2 + bi2 + ci2 = 1
(2) 杂化轨道成键能力 增强。杂化后轨道数目不 增强。杂化后轨道数目不 变,但空间取向改变,以 但空间取向改变, 更有利于同外来原子相互 作用,因而有利于成键。 作用,因而有利于成键。 杂化轨道沿一个方向更 集中地分布, 集中地分布,与其他原 子成键时, 子成键时,重叠部分增 大,因而成键能力增强。 因而成键能力增强。
如, s 轨道与 p 轨道杂化出的杂化轨道可表成
φ = αS + βP
这种杂化轨道间的夹角按公式当为, 这种杂化轨道间的夹角按公式当为,
α cos θ = − β
考虑一个s与两个p 组成的三个等性sp 杂化轨道, 考虑一个s与两个p(如px和py)组成的三个等性sp2杂化轨道,
φ i = ai s + bi p x + ci p y , i = 1, 2,3
1 (1sa + 1sb ) φ1 = 2 1 (1sa − 1sb ) φ2 = 2
特征标: 特征标:2,0,0,2 比较特征标表知, A1,B2特征标之和恰是2, 0,0,2,即此二维可约 表示可约化成A1,B2 两个 不可约表示,也即1sa和 1sb可组合成分别属A1和 B2的基
A1
B2
φ1 φ = 2
1 被认定为,b1 ,3a1 ,1b2 ,2a1
电子的电离能
1.2 BH 3
不稳定中间体(质谱检出),理论计算认定,平面正三角形,D3h
B 原子的 属A1不可约表示 pz 属A2不可约表示 (px,py) 属E 原子的s 不可约表示, 不可约表示,
D3 点群的特征标表
不可约表示
' 3C2 1
E
A1 A2
ai2 + bi2 + ci2 = 1
基于p轨的向量性质,沿任意轴向的p轨都可表成: 基于p轨的向量性质,沿任意轴向的p轨都可表成:
MO 是由8个 AO 线性组合而成的
Td
衍射实验
1 (1sa +1sb +1sc +1sd ) 与 C 的 2s 匹配的线性组合是: A1 2 与 C 的 2px、2py、2pz 匹配的线性组合是: T2
1 , 1 (1sa −1sb −1sc +1sd ) , 1 (1s −1s +1s −1s ) (1sa +1sb −1sc −1sd ) a b c d 2 2 2
1 1 2 3
2C3 1
1 -1 0
-1 0 1
z
(x, y )
A1+E
Eห้องสมุดไป่ตู้
3H
三个氢原子的1s 三个氢原子的 a,1sb, 1sc组成的三维可约表示被约化成 A1,E ˆ ˆ ˆ ˆ ˆ ˆ D → E , 2 C ,3C , σ , 2 S ,3σ
3h
{
3
2
h
3
v
}
1 3 φ1 φ = 0 2 φ 3 2 6
基组态
(1 a 1 )2 (2 a 1 )2 (1t 2 )6 (3 a 1 )0 (2 t 2 )0
t2* a1 *
2p t2 1s
2s
a1 CH4 4H
C
CH4 的光电子能谱图
I/eV
成键电子对分子中每个化学键都有贡献, 成键电子对分子中每个化学键都有贡献,其成键作用要分摊到各化学键
2.
1sa 1 0 1sa 1sa E = 1s → 1s 1sb 0 1 b b 1sa 0 1 1sa 1sb C2 = 1s → 1s 1sb 1 0 b a
1sa 0 1 1sa 1sb σν (xz ) = 1s → 1s 1sb 1 0 b a 1sa 1 0 1sa 1sa σν ( yz ) = 1s → 1s 1sb 0 1 b b
1 3 1 − 2 1 − 6
1 3 1 2 1 − 6
1 s a 1 s b 1 s c
基组态
(1 a 1 )2 (2 a 1 )2 (1 e )4 (1 a 2 )0 (2 e )0 (3 a 1 )0
内层电子 成键电子
1.3
CH 4
1
ψ 4 a = c41 ( s + p z ) − c42φ1
1
成键分子轨道
非键分子轨道
反键分子轨道
ψ b = px
1
非键分子轨道
ψ jb = c j1 p y + c j 2φ2
2
j = 1,2
ψ 2b = c21 p y − c22φ2
2
ψ 1b = c11 p y + c12φ2
2
成键分子轨道
2.1
杂化轨道
原子中不同原子轨道的线性组合称为原子的轨道杂化, 原子中不同原子轨道的线性组合称为原子的轨道杂化, 杂化后的轨道称为杂化轨道。 杂化后的轨道称为杂化轨道
