结构化学第5章例题与习题
《结构化学》(1-5章)习题答案

目录第一章答案----------------------------------------------------------------------------1 第二章答案---------------------------------------------------------------------------26 第三章答案---------------------------------------------------------------------------47 第四章答案---------------------------------------------------------------------------63 第五章答案---------------------------------------------------------------------------711《结构化学》第一章习题答案1001 (D) 1002 E =h ν p =h /λ 1003,mvh p h ==λ 小 1004 电子概率密度 1005 1-241-9--34s kg m 10626.6s kg m 100.1106.626⋅⋅⨯=⋅⋅⨯⨯==-λhp T = m p 22 = 3123410109.92)10626.6(--⨯⨯⨯ J = 2.410×10-17J 1006 T = h ν- h ν0=λhc -0λhcT = (1/2) mv 2 v =)11(20λλ-m hc = 6.03×105 m ·s -11007 (1/2)mv 2= h ν - W 0 = hc /λ - W 0 = 2.06×10-19 J v = 6.73×105 m/s 1008 λ = 1.226×10-9m/10000= 1.226×10-11 m 1009 (B) 1010 A,B 两步都是对的, A 中v 是自由粒子的运动速率, 它不等于实物波的传播速率u , C 中用了λ= v /ν,这就错了。
结构化学第5章例题与习题

H2 C
CH 2
得 x1= - 3 , x2= x3= 0, x4= 3 , E1= + 3 , E2=E3=, E4= - 3,
以 x1= - 3 代入久期方程可得 Ψ1= (1/ 2)1+( 1/ 6)(2+3+4) x = 0 代入久期方程可得 c2+ c3+ c4= 0, c1= 0 ,
A
例4. 试比较CO2,CO和丙酮中碳-氧键键长大小次序,并 说明理由。 [解]: 三个分子中碳-氧键长大小次序为:
丙酮>CO2>CO
丙酮分子中的碳 - 氧键为一般双键,键长最长。 CO2分子 中除形成σ键外还形成两个离域π键。虽然碳-氧键键级
也为2,但由于离域 π键的生成使键能较大,键长较短,
但比一般三键要长。在 CO 分子中,形成一个 σ 键、一 个 π 键和一个 π 配键,键级为 3,因而碳 - 氧键键长最短。
习题5. 用前线轨道理论分析在加热或光照条件下,环己烯 和丁二烯一起进行加成反应的规律。
[解]:环己烯与丁二烯的加成反应和乙烯与丁二烯的加成反 应类似。在基态时,环己烯的π型HOMO与丁二烯的π型 LUMO对称性匹配,而环己烯的π型LUMO与丁二烯的π型 HOMO对称性也匹配。因此,在加热条件下,两者即可发 生加成反应:
1 (1 2 2 3 ) 2 6 1 ( ) 3 1 3 2
3
三个分子轨道的轮廓图示于下图中(各轨道的相对大小只是近 似的)。 + +
+ -
+ -
+ -
+ -
+ -
+
C3H3•分子轨道轮廓图
(2) C3H3•中有3个π电子,基态时有2个在ψ1上,一个在ψ2上。 所以π键键级为: 1 1 1 2 1 P12 P23 2 ( )0 3 3 3 6 6 1 1 1 1 5 P31 2 ( ) 0 6 3 3 6 6 (3) 各C原子的自由价
结构化学第五章习题及答案
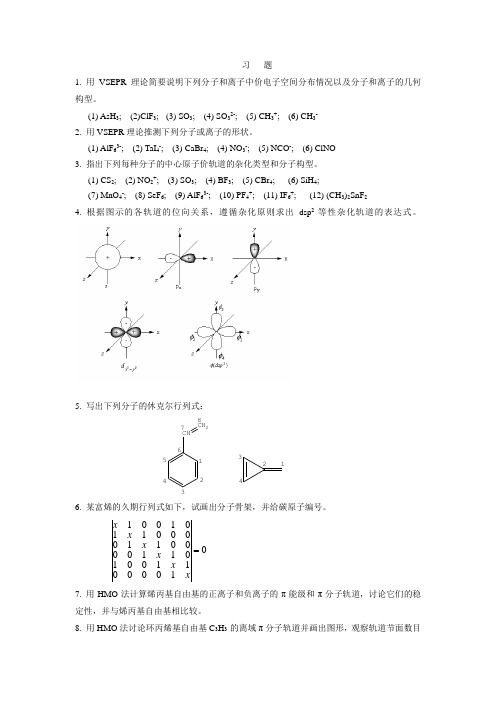
习 题1. 用VSEPR 理论简要说明下列分子和离子中价电子空间分布情况以及分子和离子的几何构型。
(1) AsH 3; (2)ClF 3; (3) SO 3; (4) SO 32-; (5) CH 3+; (6) CH 3- 2. 用VSEPR 理论推测下列分子或离子的形状。
(1) AlF 63-; (2) TaI 4-; (3) CaBr 4; (4) NO 3-; (5) NCO -; (6) ClNO 3. 指出下列每种分子的中心原子价轨道的杂化类型和分子构型。
(1) CS 2; (2) NO 2+; (3) SO 3; (4) BF 3; (5) CBr 4; (6) SiH 4;(7) MnO 4-; (8) SeF 6; (9) AlF 63-; (10) PF 4+; (11) IF 6+; (12) (CH 3)2SnF 24. 根据图示的各轨道的位向关系,遵循杂化原则求出dsp 2等性杂化轨道的表达式。
5. 写出下列分子的休克尔行列式:CH CH 21234567812346. 某富烯的久期行列式如下,试画出分子骨架,并给碳原子编号。
0100001100101100001100001101001 xx x x x x 7. 用HMO 法计算烯丙基自由基的正离子和负离子的π能级和π分子轨道,讨论它们的稳定性,并与烯丙基自由基相比较。
8. 用HMO 法讨论环丙烯基自由基C 3H 3·的离域π分子轨道并画出图形,观察轨道节面数目和分布特点;计算各碳原子的π电荷密度,键级和自由价,画出分子图。
9. 判断下列分子中的离域π键类型:(1) CO2(2) BF3(3) C6H6(4) CH2=CH-CH=O(5) NO3-(6) C6H5COO-(7) O3(8) C6H5NO2(9) CH2=CH-O-CH=CH2(10) CH2=C=CH210. 比较CO2, CO和丙酮中C—O键的相对长度,并说明理由。
江元生《结构化学》课后习题答案

第一章 量子理论1. 说明⎥⎦⎤⎢⎣⎡-=) (2cos ),(0t x a t x a νλπ及⎥⎦⎤⎢⎣⎡-=) (2sin ),(0t x a t x a νλπ都是波动方程22222),(1),(t t x a c x t x a ∂∂=∂∂的解。
提示:将),(t x a 代入方程式两端,经过运算后,视其是否相同。
解:利用三角函数的微分公式)cos()sin(ax a ax x=∂∂和)sin()cos(ax a ax x -=∂∂,将⎥⎦⎤⎢⎣⎡-=) (2c o s ),(0t x a t x a νλπ代入方程:⎥⎦⎤⎢⎣⎡-⎪⎭⎫ ⎝⎛-=⎪⎪⎭⎫⎝⎛⎥⎦⎤⎢⎣⎡--∂∂=⎭⎬⎫⎩⎨⎧⎥⎦⎤⎢⎣⎡-∂∂∂∂=⎥⎦⎤⎢⎣⎡-∂∂=) (2cos 2 ) (2sin 2 ) (2cos ) (2cos 2000022t x a t x x a t x x x a t x a x νλπλπνλπλπνλπνλπ左边 ()⎥⎦⎤⎢⎣⎡--=⎪⎪⎭⎫⎝⎛⎥⎦⎤⎢⎣⎡-∂∂=⎭⎬⎫⎩⎨⎧⎥⎦⎤⎢⎣⎡-∂∂∂∂=⎥⎦⎤⎢⎣⎡-∂∂=) (2cos 2 ) (2sin 2 ) (2cos ) (2cos 122020200222t x c a t x x c a t x t t c a t x a t c νλππννλππννλπνλπ右边 对于电磁波νλ=c ,所以⎥⎦⎤⎢⎣⎡-=) (2cos ),(0t x a t x a νλπ是波动方程的一个解。
对于⎥⎦⎤⎢⎣⎡-=) (2sin ),(0t x a t x a νλπ,可以通过类似的计算而加以证明:⎥⎦⎤⎢⎣⎡-⎪⎭⎫ ⎝⎛-=⎥⎦⎤⎢⎣⎡-∂∂=) (2sin 2) (2sin 20022t x a t x a x νλπλπνλπ左边()⎥⎦⎤⎢⎣⎡--=⎥⎦⎤⎢⎣⎡-∂∂=) (2sin 2) (2sin 12200222t x c a t x a t c νλππννλπ右边2. 试根据Planck 黑体辐射公式,推证Stefan 定律:4 T I σ=,给出σ的表示式,并计算它的数值。
结构化学第5章例题与习题

+
丁二烯
+ -
+
前线轨道叠加图
+ -
+
LUMO
-
+ +
+ +
HOMO
-
环己烯
+
+
-
-
-
+
HOMO
LUMO
环己烯和丁二烯前线轨道叠加图
习计算题π6.键键用级HM和O法C原解子环的丙自烯由C3价H3。• 的离域π键分子轨道波函数并
[解]: (1)C3H3• 的骨架如下图所示:
H
按分子骨架列出久期行列式:
+ CO + - - + (5σ)2
-
(2π)0
+
H2 +
- (σ﹡1s)0
+ (σ1s)2
图(a)CO和H2的前线轨道轮廓图
由图可见,当CO分子的HOMO和H2分子的LUMO接近时, 彼此对称性不匹配;当CO分子的LUMO和H2分子的HOMO接近 时,彼此对称性也不匹配。因此,尽管在热力学上CO加H2 (生 成烃或含氧化合物)反应能够进行,但实际上,在非催化条件下,
│1 x 0 0 │
│1 0 x 0 │= 0 ,
│1 0 0 x │
H2C
CH2
得 x1= - 3 , x2= x3= 0, x4= 3 ,
C
E1= + 3 , E2=E3=, E4= - 3, 以 x1= - 3代入久期方程可得
CH2
Ψ1= (1/ 2)1+( 1/ 6)(2+3+4)
若用亲核试剂与其反应,则反应位在:------ ( A )
王顺荣编高教版社结构化学习题答案第5章

因为 2 , 3 与 x 轴夹角相同,对称,则: c22 c32 ( p x 对 2 , 3 的贡献相同,且为负)
c23 c33 ( p y 对 2 , 3 的贡献符号相反)
再利用 px 的单位轨道贡献
2 3 2 3 C 22 C32 1
正振动的模式
6.核磁共振和电子自旋磁共振发生的条件是什么?它们含有那些结构信息? 答: (1)核磁共振发生的条件:①原子核必须具有核磁性质,即必须是磁性核② 需要有外加磁场, 磁性核在外加磁场作用下发生核自旋能级的分裂,产生不同能 量的核自旋能级, 才能吸收能量发生跃迁③只有那些能量与核自旋能级能量相同 的电磁辐射才能被共振吸收。 电子自旋磁共振需要满足类似上述三个条件才能发 生,但电子本身存在固有的自旋运动。 (2) 核磁共振条件随核外化学环境变化而移动的现象为化学位移,其包含了 有关结构的信息。因化学位移的大小是由核外电子云密度决定的。就 1H-NMR 来 说,分子中影响 1H 核外电子密度的所有因素都将影响化学位移。①最重要的因 素是相邻的、具有较大电负性的原子或基团的诱导效应。②反磁各向异性效应。 ③核的自旋-自旋耦合效应。由高分辨率的共振仪测得的 NMR 共振峰通常具有精 细结构,为多重峰。在 1H-NMR 谱中,共振峰的面积与此类质子数目成正比。对 于电子自旋磁共振, 化合物的 g 因子即包含了有关未成对电子的信息,也包含了 有关化学键的信息,可用于鉴别、分析未知样品的分子结构。主要用以用以研究 自由基的结构和存在、 过渡金属离子及稀土离子的电子结构和配位环境、催化剂 活性中心位置等。
4 =
即: 1 =0.5 s +0.866 px
2 =0.5 s -0.288 px +0.817 py
结构化学答案 Chapter5

第五章 多原子分子1. 试给出等键长弯曲构型分子H 3的分子轨道和能级图; 随着键角的增大(线形化), 能级图会产生什么变化? 根据能级图, 你认为稳定的实体是H 3, 还是H 3+或H 3-?解: 与水分子相同, H 3 分子属于点群C 2v , 参加成建的原子轨道涉及三个H 原子的1s 轨道容易验证, 中间的H 原子的1s 轨道属于恒等表示A 1, 而边上的两个H 原子的1s 轨道可重新组合成分别属于A 1和 B 2的两个基函数:)11(211b a a s s +=φ )11(212b a b s s -=φ21b a E E φφ<二中间原子的1s 轨道能量介于两者之间.按照对称性原理, 属于A 1的中间原子的1s 轨道与2b φ之间无相互作用, 但与1a φ有作用. 得到两个A 1对称性的分子轨道1a 1, 2a 1. 从能级图中可以看出, B 2对称性分子轨道的能量介于两个A 1对称性的分子轨道之间.当键角增大时, 1s a 和1s b 的重叠减小, 1a φ和2b φ能量差减小, 导致B 2对称性分子轨道的能量降低.由能级图可知, B 2对称性分子轨道为HOMO 轨道, 在H 3分子中, 其上填充有一个电子, 为不稳定电子结构, H 3+才是稳定的结构.2. 若H 4具有BH 3的几何构型, 请给出分子轨道和能级图、基组态及多重度(自旋单态、三态等), 由此判断它的稳定性如何?解: 与BH 3分子相同, H 4 分子属于点群D 3h , 由于所有原子都在同一个平面内, σh 是一个平庸的对称操作, 可以直接考虑在其子群D 3下讨这一体系. 参加成建的原子轨道涉及四个H 原子的1s 轨道容易验证, 中间的H 原子的1s 轨道属于恒等表示A 1, 周围的三个H 原子的1s 轨道可重新组合成分别属于A 1和E 的两个基函数:⎪⎪⎪⎭⎫ ⎝⎛⎪⎪⎪⎪⎪⎪⎪⎭⎫⎝⎛---=⎪⎪⎪⎭⎫ ⎝⎛c b a e e a y x 616162212103131311 按照对称性原理, 属于A 1的中间原子的1s 轨道与e x , e y 轨道之间无相互作用, 但与上述a 1轨道有作用. 得到两个A 1对称性的分子轨道1a 1, 2a 1.能级图如下:HH 43H基组态为 (1a 1)2(e x )1(e y )1, 多重度为3, 为不稳定电子构型, 倾向于失去两个电子而成为H 42+.3.若H 4具有正四面体构型, 请给出分子轨道和能级图、基组态及多重度; 你认为稳定的实体是H 4, H 4+, H 42+, H 4-, H 42-中的哪一个?解: 若H 4具有正四面体构型, 则属于T d 对称性, 四个1s 轨道重新组合成一个a 1轨道和三个t 2轨道. 若按如图所示的坐标, 容易得到所有分子轨道:⎪⎪⎪⎪⎪⎭⎫ ⎝⎛⎪⎪⎪⎪⎪⎪⎪⎪⎪⎭⎫ ⎝⎛------=⎪⎪⎪⎪⎪⎭⎫ ⎝⎛d c b a t t t a z y x 212121212121212121212121212121212221 能级图如下:基组态为 (a 1)2(t 2)2, 多重度为3, 为不稳定电子构型, 倾向于失去两个电子而成为H 42+.4. 对CH 4, 若选择一个三重轴(C -H)为z 轴, xz 平面上有两个H, 原点在C 上, 试造出分子轨道和能级图.解: 若选择一个三重轴(C -H)为z 轴, xz 平面上有两个H, 原点在C 上, 原子坐标如图所示为碳原子坐标为(0, 0, 0), 四个氢原子坐标为a(0, 0, 1), b(322, 0, -31),c(-32,36,-31), d(-32,-36,-31). 四个H 原子在组合成a 1轨道时仍然取全对称组合, 在组合成t 2轨道时, 参照第114页NH 3群轨道的构造方法, 每一原子的轨道系数各取其对应的坐标. 例如, 在构造t 2x 时,各原子轨道的系数为坐标的x 分量.d c b t x 32323222--=, 归一化后为,d c b t x 6161622--=.同理可得 t 2y , t 2z 的群轨道. 归结为1t 24HH 4⎪⎪⎪⎪⎪⎭⎫ ⎝⎛⎪⎪⎪⎪⎪⎪⎪⎪⎪⎭⎫⎝⎛------=⎪⎪⎪⎪⎪⎭⎫ ⎝⎛d c b at t t a z y x 1211211211232121006161620212121212221 上述群轨道分别与C 原子的2s , 2p x , 2p y , 2p z 组合成分子轨道. 能级图如下:5. 根据题二与题三的结果, 画出Walsh 相关图,讨论H 4的几何构型(C 3v 与T d )与电子数的关系.解: 在画出Walsh 图之前, 我们先对两种结构的分子轨道的能量逐一加以比较,1a 1: 在C 3v 构型中, 周围三个H 原子的距离较远,重叠较之T d 构型要小, 故T d 构型1a 1轨道能量较低.C 3v 下的1e 和2a 1相当于T d 下的t 2轨道在子群下的分裂的结果. 显然, 1e 的能量低于t 2的能量2a 1的能量高于t 2的能量. 据此可画出Walsh 图:由上述相关图可知, H 4+, H 4取C 3v 构型, 其余取T d 构型.6. 请补充画出AH 2能级-键角相关图5.13中未画出的两条相关线: 3σg -4a 1与2σu -2b 2,预测H 2O 的激发组态(2a 1)2(1b 2)2(3a 1)2(1b 1)1(4a 1)1与(2a 1)2(1b 2)2(3a 1)2(1b 1)1(2b 2)1的几何构型:线性还是弯曲?(提示:根据反键轨道4a 1与2b 2的位相, 可以推知E 3σg (线形)>E 4a 1(弯曲), E 2σu <E 2b 2).解: 3σg , 2σu 轨道的示意图分别为:4H2t 2CCH41a 1C 3vTd显然, 当分子采取弯曲构型时, 对于3σg 轨道, 两个同位相的氢原子相互靠近, 使轨道能量下降,故E 3σg (线形)>E 4a1(弯曲);而对于2σu 轨道, 两个反位相的氢原子相互靠近, 使轨道能量升高, 故E 2σu <E 2b2. 据此可补充画出AH 2能级-键角相关图5.13中未画出的两条相关线.由上述能级相关图容易判断, H 2O 的两个激发组态的构型为: (1b 1)1(4a 1)1取弯曲结构, (1b 1)1(2b 2)1取线形结构.7. 对于CH 4, 当一个C -H 键不断缩短,直至H 与C 成为联合原子N,就得到了NH 3, 请给出CH 4与NH 3的能级相关图。
结构化学第五章习题

______________________________。
5007 O3的键角为116.8°,若用杂化轨道=c1+c2描述中心O原子的成键轨 道,试按键角与轨道成分关系式cos=-c12/c22,计算: (1) 成键杂化轨道中c1和c2值; (2) 2s和2p轨道在杂化轨道中所占的比重。
5008 已知 H2O 的键角为104.5°,O原子进行了不等性sp3杂化,其中两个 与氢原子成键的杂化轨道中,O原子的p成分的贡献为:----------------------------- ( ) (A) 0.21 (B) 0.80 (C) 0.5 (D) 0.75 ( 已知键角和轨道成分的关系式为 cos= -c12/c22 ) 5009 实验测得乙烯(C2H4)分子∠CCH=121.7°,∠HCH=116.6°,分子处 在xy平面,C═C轴和x轴平行。 试计算C 原子 sp2杂化轨道的系数。 ( 已知键角和轨道成分的关系式为 cos=-c12/c22 )
5048 已知富烯的三个能量最低的轨道为: 1=0.2451+0.5232+0.429(3+6)+0.385(4+5) 2=0.5(1+2)-0.5(4+5) 3=0.602(3-6)+0.372(4-5) 若用亲核试剂与其反应, 则反应位在:------------------------------------ ( ) (A) 1 (B) 2 (C) 3,6 (D) 4,5 (E) 都可能
原子的2pz轨道的线性组合, 级。
用Huckel
MO法确定该键的波函数和能
5025 用HMO法计算H═C═H双自由基的电子的分子轨道和能量,并作出 分子图。
5026 若环丁二烯是平面正方形构型, 用HMO求其电子能级及其最低能级 的分子轨道。
结构化学习题解答5北大

和C原子(2)的sp2杂化轨道重叠形成3个σ键;C原子(2)的3 个sp2杂化轨道则分别与H原子的1s轨道、Cl原子的3p轨道及C原 子的相互平行的p轨道重叠形成离域π键。成键情况示于下图:
H σ σ H C1 σ σ C2 σ H
Cl
C2H3Cl分子呈平面构型,属于Cs点群。的形成使C—Cl键缩短, Cl的活泼性下降。 (c)HC≡CCl :该分子为 C2H2 分子的衍生物。其成键情况与 C2H2 分子的成键情况也既有相同之处又有区别。在C2HCl分子中,C 原子采取 sp 杂化。 C 原子的 sp 杂化轨道分别于 H 原子的 1s 轨道 (或Cl原子的3p轨道)及另一个C原子sp杂化轨道共形成两个 σ 键。此外,C原子和Cl原子的p轨道(3个原子各剩2个p轨道)相 互重叠形成两个离域 π键:。分子呈直线构型,属于C∞v 点群。 两个的形成使C2HCl中C—Cl键更短,Cl原子的活泼性更低。 根据以上对成键情况的分析,C—Cl键键长大小次序依次为: CH3Cl>C2H3Cl>C2HCl
[5.21] 试分析下列分子的成键情况,比较Cl的活泼性,说明理由。 C6H5 Cl C6H5CH2Cl (C6H5)2CHCl (C6H5)3CCl [解]:在分C6H5 Cl子中,一方面,C原子相互间通过sp2- sp2杂化 轨道重叠形成C—Cσ键,另一方面,一个C原子与Cl原子间通过 sp2- 3p轨道重叠形成C—Clσ键。此外,6个C原子和Cl原子通过p 轨道重叠形成垂直于分子平面的离域 π键。由于Cl原子参与形成 离域π键,因而其活泼性较低。 在C6H5CH2Cl分子中,苯环上的C原子仍采用sp2杂化轨道与周边 原子的相关轨道重叠形成 σ键,而次甲基上的C原子则采用sp3杂 化轨道与周边原子的相关轨道重叠形成 σ 键。此外,苯环上的 6 6 个C原子相互间通过p轨道重叠形成离域π键: 6。在中性分子中, 次甲基上的 C原子并不参与形成离域 π键,但当 Cl 原子被解离后, 该C原子的轨道发生了改组,由sp3 杂化轨道改组为 sp2 杂化轨道, 此时它就有条件参加形成离域 π 键。因此,在 [C6H5CH2]+ 中存 6 6 在 。由于π电子的活动范围扩大了, 的能量比 的能量低, 7 7 6 这是C H 6 6 5CH2Cl分子中Cl原子活性高的另一个原因。
结构化学 第五章练习题

第五章 多原子分子的化学键1. (东北师大98)离域π键有几种类型? (三种) 正常离域π键,多电子离域π键,缺电子离域π键2. 用HMO 法计算环丙烯基π体系能量。
1 11 10 1 1 x x x=展开x 3-3x+2=0 (x-1)2(x+2)=0 解得 x 1=-2,x 2=x 3=1E 1=α+2β E 2= E 3=α-β E D π=2E 1+E 2=3α+3β3. NO 2+为直线型, NO 3-为平面三角型,指出它们中心原子杂化类型,成键情况和所属分子点群。
..4.3O-N-O : 2 D h O N N SP π+⎡⎤∞⎣⎦.杂化 2643h N SP D O O π⎡⎤⎢⎥⎢⎥⎢⎥⎢⎥⎢⎥⎢⎥⎢⎥⎣⎦: 4. (东北师大99)推出y 轴的等性sp 2杂化轨道波函数 解: 等性杂化:c 112=c 212=c 312=1/3, Ψ1中只有py 成分:c 112+c 122=1 1s py ψ 123k k s k px k pyc c c ψφφφ=++11c =12c2s py px 3s py px ψψ5. (东北师大2000)乙烯中∠HCH=116.6。
,其中含-C-H 键指向x 轴的正向,试求形成该键的杂化轨道波函数和杂化指数。
解:x两个C -H 键夹角为116.6。
cos 0.3091kl αθαα==-=-p 成分/s 成分=(1- α)/α=2.236所以在C-H 方向上的杂化轨道为:sp 2.2361111222122233313233=c =c =c s pxs px py s px pyc c c c c ψφφψφφφψφφφ+++++22213123y 232222233323332333222221222322220.309, p , =1 +=1 0.191 c c c c c c c c c c c c c αψψψψ====++==等价,轨道对有相同的贡献231s px py s px py s pxψψψ+- 6. (东北师大2000) 分子离域π键的符号和久期行列式CH 2CH 2CH 2123456解:∏66x 1 0 0 0 0 1 x 1 0 1 0 0 1 x 1 1 0 0 0 1 x 0 0 0 1 1 0 x 1 0 0 0 0 1 x7. (北师大96)名词解释: 休克尔近似8. (北师大96)用HMO 法处理环丙烯基正离子C 3H 3+,计算该体系的π电子离域能。
《结构化学》第五章习题答案

《结构化学》第五章习题答案5001 (a) 小;(b) F的电负性比N高, NF3和NH3相比, NF3中电子离N远, 互斥作用小。
5002 (1) 两四面体共边连接;(2) 三个N原子呈直线型;(3) 四个配体近似四面体排列;(4) 四方锥形;(5) 平面四方形。
5003 NH35004 (a) 四面体形;(b) sp3;(c) 平面四方形;(d) sp3d2。
5005HgCl2: sp, 直线形; Co(CO)4-: sp3, 正四面体;ψ13/1φs+3/2φxpψ23/1φs-6/1φxp+2/1φypψ33/1φs-6/1φxp- 2/1φyp5005HgCl2: sp, 直线形; Co(CO)4-: sp3, 正四面体;ψ13/1φs+3/2φxpψ23/1φs-6/1φxp+2/1φypψ33/1φs-6/1φxp- 2/1φyp5007(1) c12= -c22cos116.8°= 0.4509c22由归一化条件c12+ c22= 1, 解得c1= 0.557, c2= 0.830;(2) ψ= 0.557ψ2s+ 0.830ψ2p在杂化轨道ψ中, ψ2s所占的比重为c12= 0.31,ψ2p所占的比重为c22= 0.69。
5008 (B) 5009ψ1= 0.617ψ2s+0.787ψ2xp;ψ2= 0.557ψ2s-0.436ψ2xp+0.707ψ2yp;ψ3= 0.557ψ2s-0.436ψ2xp-0.707ψ2yp。
5011 不对。
5012 不正确。
5013 (A)5015 (D)5016 不正确。
5018 (略去答案)5019 (B)5020 (C)5021分子中有两个垂直的∏33(1) 对每一个∏33E1= α + 2β, E2= α, E3= α - 2β;(2) 分子总离域能为1.65614;(3) 对每一个∏33ψ1= (1/2)φ1+ (2/2)φ2+(1/2)φ3 ,ψ2= (2/2)φ1- (2/2)φ3,ψ3= (1/2)φ1- (2/2)φ2+(1/2)φ3;(4) 分子总的π键键级P12= 1.414P23= 1.4145022采用HMO法, 中心C原子编号定为1, 得久期行列式│x 1 1 1 ││1 x 0 0 ││1 0 x 0 │= 0 ,│1 0 0 x│得x1= -3, x2= x3= 0, x4= 3,E1= α + 3β, E2= E3=α, E4= α -3β,以x1= -3代入久期方程可得ψ1= (1/2)φ1+( 1/6) (φ2+φ3+φ4)x = 0 代入久期方程可得c2+ c3+ c4= 0, c1= 0 ,c1= 0, 意味着在ψ2和ψ3中, 中心C原子的原子轨道没有参加, 中心C原子的π键级决定于ψ1, 其值为:P12=P13=P14=2×(1/2)×(1/6)=1/3中心C原子的成键度N=3+3×1/3=4.7325024依题意: │x 1 1 ││1 x 1 │=0│1 1 x │E1= α + 2β, E2= α - β, E3= α - βψ1= (1/ 3) (φ1+φ2+φ3)ψ2= (1/2)(φ2-φ3)ψ3= (1/6)(-2φ1+φ2+φ3)5025分子有两个垂直的∏33共轭体系,对每一个∏33为│x 1 0 ││1 x 1 │= 0, x=0,±2│0 1 x│E1= α + 2β, ψ1=(1/2)(φ1+ 2φ2+ φ3)E2= α, ψ2= (1/2) (φ1- φ3)E3= α - 2β, ψ3= (1/2)(φ1-2φ2+ φ3)1.318 0.096 1.318↑1.414 ↑1.414 ↑对整个分子C───C───C2.0 2.0 2.05026│x 1 0 1 ││1 x 1 0 ││0 1 x 1 │= 0 , x = 2,0,0,-2│1 0 1 x│E1= α + 2βE2= E3= αE4= α- 2βψ1=( 1/2)(φ1+ φ2+ φ3+ φ4)5027(1) E1= α + 2βE2= E3= αE4= α - 2β共轭能∆E = 2(2β) - 4β = 0(2) 由于共轭能为0 , 基态为双自由基, 稳定性差, 基态为三重态。
结构化学05chapter5习题答案

(2) 两个 3 3 离域能 1.656 (3) 对每一个 3 3
ψ1 1 φ1
2 φ2 1 φ3 2 2 2 2 2 ψ2 φ1 φ3 2 2 1 2 ψ3 φ1 φ2 1 φ3 2 2 2
(4) 分子键键级
P12= 1.414 P23= 1.414
结构化学第五章练习题答案
1.用 HMO 法处理环戊二烯基负离子,其久期方程的解 x=-2,-0.618,-0.618, 1.618,1.618。 求:(1) 解: E1 2 E2 E3 0.618 E4 E5 1.618 因此环戊二烯基负离子∏的总能量为: 2 E1 2 E2 2 E3 2 2 4( 0.618 ) = 6 6.472
6 6.472 4 2 = = 2.472 离域能=离域 π 键能量 小 π 键能量
6
5
键能,(2) 离域能。
2.写出下列分子休克尔行列式。(用 x 表示,x=(-E)/,自己给原子编号) (1) CH3—CH═CH—CH3 (2) CH2═CH—CH═CH2 (3)
E3 2 烯丙基中离域π电子的总能量为:
ห้องสมุดไป่ตู้x 2
E1 2
ED 2 E1 E2 2( 2 ) 3 2 2
离域能=离域π健总能量 - 定域π电子能量 一个 3 3 离域能 3 2 2 ( 2 2 ) 2 2 2 0.828
═C═ C H的 4.试用 HMO 法求丙二烯双自由基 H C
(1) 电子分子轨道能级能量; (2) 离域能; (3) 分子轨道波函数; (4) 键键级。 解:丙二烯双自由基有两个 3 3
结构化学习题解答5(北大)

分子或离子 AsH3 ClF3 SO3 CH 3 CH 3 SO32 m+n数 4 5 3 4 3 4 价电子空间分布 四面体 三角双锥 平面三角形 四面体 平面三角形 四面体 孤对电子对数 1 2 0 1 0 1 配位原子数 3 3 3 3 3 3 几何形状 三角锥 T形 平面三角形 三角锥 平面三角形 三角锥 是否有偶极矩 有 有 无 — — — 表中ClF3分子中Cl原子周围的5对价电子按三方双锥分布,可能 的形状有下面三种:
E4=α -2β E3=α -β α 6个C原子的p轨道 E2=α +β E1=α +2β 离域π 键分子轨道
按此电子排布,体系中π电子的总能量为: 2×(α+2β)+4×(α+β)=6α+8β 而根据定域键的经典结构,苯分子中生成3个小π键,π电子的 总能量为: 3×2×(α+β)= 6α+6β 因此,生成离域π键比生成3个定域π键体系中π电子的总能量降 低了(即键能增加了 -2β ),此能量降低值即苯的离域能或称 共轭能。 苯的离域能相当于环己稀氢化热的3倍与苯氢化热的差值,即 环己稀→苯这一过程的△H。据此,利用题中所给的热化学参 数,即可按以下步骤计算出苯的离域能。 C6H10+H2=C6H12 △H1 C6H6+3H2=C6H12 △H2 △H1=△HC(C6H12)-△HC(C6H10)-△HC(H2) =3953.0KJ•mol-1-3786.6 KJ•mol-1-285.8 KJ•mol-1 =-119.4KJ•mol-1
△H2=△HC(C6H12)-△HC(C6H10)-3×△HC(H2) =3953.0 KJ•mol-1-3301.6 KJ•mol-1-3×285.8 KJ•mol-1 =-206 KJ•mol-1 △H=3△H1-△H2 =3×(-119.4KJ•mol-1)-(-206 KJ•mol-1) =-152.2 KJ•mol-1 [5.20] 试分析下列分子中的成键情况,指出C—Cl键键长大小 次序,并说明理由。 (a)H3CCl (b)H2C=CHCl (c)HC≡CCl [解]: ( a ) H3CCl :该分子为 CH4 分子的衍生物。同时 CH4 分子一样, C原子也采用 sp3杂化轨道成键。4个sp3杂化轨道分别与 3个H原 子的1s轨道及Cl原子的3p轨道重叠共形成4个σ键。分子呈四面 体构型,属C3v点群。 (b) H2C=CHCl:该分子为H2C=C H2分子的衍生物,其成键情况 与C2H4分子的成键情况即有相同之处又有差别。在C2H3Cl分子 中,C原子(1)的3个sp2杂化轨道分别与两个H原子的1s轨道
结构化学练习(4-7章)

结构化学练习(4-7章)第四章练习(1)I3和I6不是独立的对称元素,因为I3= ,I6= 。
(2)下列等式成立的是A S3=C3+B S3=C6+σhC S3=C3+iD S3=C6+i(3)如果图形中有对称元素S6,那么该图形中必然包含A C6, σhB C3,C C3,iD C6,i(4)下列说法错误的是A 分子中有S n轴,则此分子必然同时存在C n轴和σh。
B 反映面σd一定也是反映面。
C I4是个独立的对称元素。
D 分子既有C n轴又有垂直于C n轴的σh,此分子必有Sn轴。
(5)对称元素C2与σh组合得到,C n轴与垂直于它的C2轴组合可得到。
(6)写出如下点群所具有的全部对称元素及其对称操作:(1)C2h (2)D3 (3)C3i(7)已知配合物MA2B4的中心原子M是d2sp3杂化,该分子中有多少种构造异构体,这些异构体各属于什么点群。
(8)下列说法正确的是A 凡是八面体配合物一定属于Oh点群B 异核双原子分子一定没有对称中心C 凡是四面体构型分子一定属于Td点群D 在分子点群中,对称性最低的是C1,对称性最高的是Oh(9)下列分子具有偶极矩,而不属于C nv群的是A H2O2B NH3C CH2Cl2D H2C=CH2(10)下列各组分子中有极性,但无旋光性的是(1)N3- (2)I3- (3)O3A (1),(2)B (2),(3)C (1),(2),(3)D (3)(11)下列具有相同阶的分子是(1)B2H6 (2)BrCl5 (3)SiF4A (1),(2)B (2),(3) B (1),(3) D 都不同(12)下列分子的点群不是16个群元素的是A CCl4B XeO4C S8D Ni(CN)4(13)(1)SO42- (2)PO43- (3)ClO4-三者中不是T d点群的是A (1)B (2)C (3)D 都是T d点群(14)下列空格中打上“+”或“-”分别表示对与错。
结构化学第五章题目学生用

第五章题目1、三种原子○,◎,●排列成按虚线单位重复的点阵结构,试画出点阵素单位,写出结构基元。
●┄┄┄○┄┄┄●|◎●|○●○|●◎|●┄┄┄○┄┄┄●2、根据划分点阵正当单位的基本原则,试证平面点阵的四种类型中只有矩形单位可以有带心和不带心两种型式,而其它均无带心的型式。
3、根据划分点阵正当单位的基本原则,试说明为什么四方晶系中没有四方F和四方C。
4、有一AB2型立方面心晶体,问一个晶胞中可能含有多少个A和多少个B。
5、已知黄铁矿(FeS2,即“愚人金”)属立方晶系,请作图(取c与纸面垂直)示出其晶面(100)、(010)、(110)、(210)取向,并由图中计算出各晶面间距相应的晶面交角。
6、给出在三个坐标轴上之截距分别为(2a,3b,c) ,(a,b,c) ,(6a,3b,3c) ,(2a,-3b,-3c)的点阵面的指标。
7、论证在晶体结构中不可能存在五重旋转轴。
8、有一AB4型晶体,属立方晶系,每个晶胞中有1个A和4个B,1个A的坐标是(1/2,1/2,1/2),4个B的坐标分别是(0,0,0);(1/2,1/2,0);(1/2,0,1/2);(0,1/2,1/2),试确定此晶体的点阵类型。
9、请在一正八面体的明矾晶体上确定立方晶胞a、b、c的取向,并在立方晶系国际记号三个位相应的方向上找出正八面体的对称元素,写出正八面体点群的国际记号。
10、 -SiC为立方晶系晶体,晶胞参数a=435.8pm,晶胞中原子的分数坐标为C:0,0,0;1/2,1/2,0;1/2,0,1/2;0,1/2,1/2Si:1/4,1/4,1/4;1/4,3/4,3/4;3/4,1/4,3/4;3/4,3/4,1/4(1)确定该晶体的结构基元和点阵型式;(2)说明碳原子和硅原子的配位数各是多少;(3)计算晶体密度;(4)计算晶体中C —Si 键长和Si 原子的共价半径(C 原子的共价半径为77pm)(5)求d 100;1112、求算A 2型密堆积结构中圆球的空间占有率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解之, 解之,得:c1= c2=c3 根据归一化条件, 根据归一化条件,有:
c12 + c 22 + c 32 = 1
由此求得: 由此求得: c1= c2=c3= 1 / 3 ψ1= 1 / 3 φ1+φ2+φ3) ( )
利用分子的镜面对称性,可简化计算工作: 利用分子的镜面对称性,可简化计算工作:若考虑分子对过 C2的镜面对称,则有:c1= c3 c2=-2c1 的镜面对称,则有: - 根据归一化条件可得: 根据归一化条件可得: c = c = 1 / 6 , c = −2 / 6 波函数为: 波函数为: ψ2= 1 / 6(φ1-2φ2+φ3)
0 1 x 1 0 0
0 0 1 x 1 0
1 0 0 1 x 1
0 0 0 =0 0 1 x
5 4 3 2 1
已知丁二烯的四个分子轨道为: 例3. 已知丁二烯的四个分子轨道为:
ψ1 = Aφ1 + Bφ2 + Bφ3 + Aφ4 ψ 2 = Bφ1 + Aφ2 − Aφ3 − Bφ4 ψ3 = Bφ1 − Aφ2 − Aφ3 + Bφ4 ψ 4 = Aφ1 − Bφ2 + Bφ3 − Aφ4
H2
+
-
(σ﹡1s)0 ﹡ )
+
(σ1s)2 )
图(a)CO和H2的前线轨道轮廓图 ) 和 的前线轨道轮廓图
接近时, 由图可见, 分子的HOMO和H2分子的 接近时 由图可见,当CO分子的 分子的 和 分子的LUMO接近时, 彼此对称性不匹配; 分子的LUMO和H2分子的 彼此对称性不匹配;当CO分子的 分子的 和 分子的HOMO接近 接近 彼此对称性也不匹配。因此,尽管在热力学上CO加H2 (生 时,彼此对称性也不匹配。因此,尽管在热力学上 加 成烃或含氧化合物)反应能够进行,但实际上,在非催化条件下, 成烃或含氧化合物)反应能够进行,但实际上,在非催化条件下, 该反应难以发生。 该反应难以发生。 C CO O H2 Ni +
利用价电子对互斥理论说明下列分子的形状: 例1. 利用价电子对互斥理论说明下列分子的形状: XeF4,XeO4,XeO3,XeF2,XeOF4。 [解]:根据价电子对互斥理论,根据中心原子 的价电子数和成键 解 :根据价电子对互斥理论,根据中心原子A的价电子数和成键 情况,确定其成键电子对BP数目 每形成一个BP, 原子A贡献一 情况,确定其成键电子对 数目(每形成一个 原子 贡献一 数目 每形成一个 个价电子, 另一个价电子由原子B贡献 及孤电子对LP数目的总 贡献) 个价电子 另一个价电子由原子 贡献 及孤电子对 数目的总 根据电子对尽量远离的原则,确定分子构型. 和. 根据电子对尽量远离的原则,确定分子构型 分子 BP(价电子对数 价电子对数) 价电子对数 LP(孤电子对数 孤电子对数) 孤电子对数 XeF4 4 2 XeO4 8 0 4 四面体 XeO3 6 1 3 三角锥 XeF2 2 3 2 直线形 XeOF4 6 1 5 四棱锥
H2C
CH 2
C
CH 2
2
)×(1/ ×
6
) =1/
中心C原子的成键度 中心 原子的成键度 N= 3×1/ ×
3 =1.732
3
习题1. 分子轨道为: 习题1. 已知烯丙基阳离子的三个π分子轨道为:
ψ1 = 1 φ1 +
2 φ2 + 1 φ3 2 2 2 ψ2 = 2 φ1 − 2 φ3 2 2 1 2 1 ψ3 = φ1 − φ2 + φ3 2 2 2
H
C2
x 1 1 1 x 1=0 1 1 x
H C1 C3 H
将行列式展开得: 将行列式展开得: x3-3x+2=(x-1)(x2+x-2)=0 解得: 解得:x1=-2,x2=1,x3=1 , , 值代入x=(α-E)/β,得: 将x值代入 值代入 , E1=α+2β,E2=α-β,E3=α-β , ,
配位原子数( 电子对 电子对) 配位原子数 σ电子对 4
几何构型
正方形
例2:画出下列久期行列式对应的共轭分子碳原子骨架: :画出下列久期行列式对应的共轭分子碳原子骨架:
x 0 1 1 0 x 0 1 1 0 x 0 1 1 0 x =0
C-C-C-C 3 1 4 2
6
x 1 0 0 1 0
1 x 1 0 0 0
例5:在三次甲基甲烷分子中, 中心 原子与邻近三个次甲基 :在三次甲基甲烷分子中, 中心C原子与邻近三个次甲基 组成大π 试证明中心C原子的键级为 原子的键级为1.732。 组成大π键。试证明中心 原子的键级为 。
采用HMO法, 中心 原子编号定为 得久期行列式 法 中心C原子编号定为 原子编号定为1, 采用 │x 1 1 1 │ │1 x 0 0 │ │1 0 x 0 │= 0 , │1 0 0 x │ 得 x1= - 3 , x2= x3= 0, x4= 3 , E1= α + 3 β, E2=E3=α, E4= α - 3β, α 以 x1= - 3 代入久期方程可得 Ψ1= (1/ 2)φ1+( 1/ 6)(φ2+φ3+φ4) x = 0 代入久期方程可得 c2+ c3+ c4= 0, c1= 0 , c1= 0, 意味着在 2和Ψ3中, 中心 原子的原子轨道没有参加 中心 原子的π键 意味着在Ψ 中心C原子的原子轨道没有参加 中心C原子的 原子的原子轨道没有参加, 原子的π 级决定于Ψ 其值为: 级决定于 1, 其值为 P12=P13=P14=2×(1/ ×
则其第一激发态的键级P 为何者? 则其第一激发态的键级P12,P23为何者?π P12 P23 (A) 2AB 2B2 (B) 4AB 2(A2+B2) (C) 4AB 2(B2-A2) (D) 0 2(B2+A2) (E) 2AB B2+A2
A
试比较CO2,CO和丙酮中碳 氧键键长大小次序,并 和丙酮中碳-氧键键长大小次序 例4. 试比较 和丙酮中碳 氧键键长大小次序, 说明理由。 说明理由。 [解]: 三个分子中碳 氧键长大小次序为: 解 : 三个分子中碳-氧键长大小次序为 氧键长大小次序为: 丙酮> 丙酮>CO2>CO 丙酮分子中的碳-氧键为一般双键, 键长最长。 丙酮分子中的碳 氧键为一般双键,键长最长。 CO2分子 氧键为一般双键 中除形成σ键外还形成两个离域 键 虽然碳-氧键键级 中除形成 键外还形成两个离域π键。虽然碳 氧键键级 键外还形成两个离域 也为2,但由于离域π键的生成使键能较大 键长较短, 键的生成使键能较大, 也为 , 但由于离域 键的生成使键能较大, 键长较短, 但比一般三键要长。 分子中, 但比一般三键要长 。 在 CO分子中, 形成一个 键 、 一 分子中 形成一个σ键 键和一个π配键 氧键键长最短。 个 π键和一个 配键 ,键级为 , 因而碳 氧键键长最短 。 键和一个 配键,键级为3,因而碳-氧键键长最短 丙 酮 、 CO2 和 CO 分 子 中 碳 - 氧 键 键 长 分 别 为 121pm , 116pm和113pm。 和 。
.
-
+
.
+
-
+ e
.
+ -
图(b)CO和H2的在 催化剂上轨道叠加和电子转移情况 ) 和 的在Ni催化剂上轨道叠加和电子转移情况
若使用某种过度金属催化剂, 若使用某种过度金属催化剂,则该反应在不太高的温 度下即可进行。以金属Ni为例 为例, 原子的 轨道与H 原子的d轨道与 度下即可进行。以金属 为例,Ni原子的 轨道与 2分子 对称性匹配, 原子的d电子转移 的LUMO对称性匹配,可互相叠加, Ni原子的 电子转移 对称性匹配 可互相叠加, 原子的 到分子的LUMO上,使之成为有电子的分子轨道,该轨道 到分子的 上 使之成为有电子的分子轨道, 可与CO分子的 分子的LUMO叠加,电子转移到 叠加, 分子的LUMO 可与 分子的 叠加 电子转移到CO分子的 分子的 这样, 加 反应就可顺利进行。 上。这样,CO加H2反应就可顺利进行。轨道叠加及电子 转移情况示于图5.30(b)中。 转移情况示于图 ( ) Ni 原子的 电子向 2分子的 原子的d电子向 分子的LUMO转移的过程即 2分 电子向H 转移的过程即H 转移的过程即 子的吸附,解离而被活化的过程,它是CO加H2反应的关 子的吸附,解离而被活化的过程,它是 加 键中间步骤。 键中间步骤。
亲核反应发生在电荷密度最小处
习题4. 用前线轨道理论分析CO加H2 反应,说明只有使用催化 习题 用前线轨道理论分析 加 反应, 剂该反应才能顺利进行。 剂该反应才能顺利进行。 [解]:基态 解 :基态CO分子的 分子的HOMO和LUMO分别为 和 2π,基态 2 分别为5σ和 ,基态H 分子的 和 分别为 分子的HOMO和LUMO分别 1s和σ﹡1s。它们的轮廓图示于图 分别σ 分子的 和 分别 。 5.30(a)。 ( )。 + CO + + (5σ)2 ) + (2π)0 )
习题3. 已知富烯的三个能量最低的π轨道为: 习题3. 已知富烯的三个能量最低的π轨道为: Ψ1=0.245φ1+0.523φ2+0.429(φ3+φ6)+0.385(φ4+φ5) Ψ2=0.5(φ1+φ2)-0.5(φ4+φ5) Ψ3=0.602(φ3-φ6)+0.372(φ4-φ5) 若用亲核试剂与其反应,则反应位在: 若用亲核试剂与其反应,则反应位在:------ ( A ) 3, 4, (A) 1 (B) 2 (C) 3,6 (D) 4,5 (E) 都可能
1 3 2
若考虑反对称, 若考虑反对称,则 c1= -c3 ,c2=0 根据归一化条件得: 根据归一化条件得: c1 = 1 / 2 , c3 = −1 / 波函数为:ψ= 1 / (φ1-φ3) 波函数为: 2 所以, 的离域π键分子轨道为 键分子轨道为: 所以,C3H3• 的离域 键分子轨道为:
