Luminal分子分型
Luminal_A型乳腺癌化疗

ER阳性HER-2阴性(Luminal A型)乳腺癌的辅助化疗策略福建省肿瘤医院乳腺内科刘健李娜妮陈心华洪熠李重颖激素受体阳性乳腺癌约占乳腺癌的75%~80%,其中ER 阳性HER-2阴性(luminal A型)乳腺癌约占65%~70%[1]。
NCI、NCCN和St.Gallen等世界性权威《指南》对ER阳性乳腺癌的辅助化疗指导原则不尽相同,对于ER阳性HER-2阴性(luminal A型)乳腺癌是否需要辅助化疗以及选择何种化疗方案,目前尚无统一标准。
《2009年St.Gallen 专家共识》[2]中的早期乳腺癌辅助化疗策略与以往不同,主要根据ER和HER2状态将乳腺癌分为三组,即HER2阳性乳腺癌、三阴性乳腺癌和ER阳性HER-2阴性乳腺癌;原则上对于HER2阳性乳腺癌采取曲妥株单抗和化疗联合为主治疗,对于三阴性乳腺癌以化疗为主,但对于ER阳性HER-2阴性乳腺癌,《共识》建议要参考临床病理学特征、生物学特征以及基因表型等特点加以选择治疗方案,目前尚缺乏标准治疗。
以下就近年来尤其是2009年ASCO上有关ER阳性HER-2阴性亚型乳腺癌的研究进展进行综述:一、早期乳腺癌辅助化疗的演进乳腺癌辅助化疗的目的是杀灭亚临床病灶,辅助化疗效果必须经过长期随访才能评估,因此,循证医学的证据是推动乳腺癌辅助化疗不断进步的动力和指导临床实践的依据。
三十年来乳腺癌辅助化疗在形式和内容上都取得长足的进步:70年代以Gianni Bonadonna发明的CMF方案为代表[3]标志着早期乳腺癌辅助化疗循证医学的开端,30年的随访结果表明,乳腺癌辅助化疗组的无病生存和总生存均高于单纯手术组,CMF辅助方案化疗使复发风险降低了34%(P=0.005),死亡风险降低了22%(P=0.04)。
80年代的蒽环类药物又将早期乳腺癌辅助化疗效果推进一大步,NSABP B-15[4]研究结果发现乳腺癌术后行AC方案辅助化疗4周期的疗效与CMF方案化疗6周期的疗效相同;EBCTCG[5]对14000例的分析结果表明,含蒽环类的化疗方案与CMF方案化疗比较,复发及死亡危险分别降低了11%及16%,5年及10年的死亡率绝对值分别降低了3%及4%。
St Gallen乳腺癌的分子分型

St Gallen 2013Luminal A ER/PR阳性,Ki低(<14%),her2阴性. Luminal B 分为her2 阴性(her2阴性,Ki67高),及her2阳性(无论Ki67表达程度)两种乳腺癌病理分析依据4个指标ER,PR,Ki67及her2 (免疫组化) 冯文英:ER/PR阳性,her2阴性,Ki67 高Luminal A型luminal b型的三苯氧胺耐药,目前无明确的临床证据,各大临床诊疗规范及指南亦无推荐,选择三苯氧胺与否,还是应依据患者激素受体的状态,绝经情况而定。
her2阳性乳腺癌对内分泌治疗的存在相对的抵抗,但内分泌治疗依然有获益可能,因此,标准治疗仍需包括内分泌治疗。
多数主流研究报告并没有细化ki67在分型中的作用,各类临床统计和实验的报告也都是以her2作为a型和b型的分类依据,进而得出的5年dfs以及各类用药方案,现在b型中又细化出两个亚型。
目前分子分型已被St Gallen共识在2011年接受,并作为选择辅助治疗的依据, 这应该是国际上早期乳腺癌最权威的共识之一了。
从临床研究角度,可能直接用Ki67选择病人或分层的比较少,但近来我看到的一些辅助治疗的研究的分析也多包括了Ki67亚组分析或根据分子分型的亚组分析。
当然,有些是在secondary的report里。
专家组认为区分luminal A型(内分泌治疗较敏感、惰性、预后较好)与luminal B型(内分泌治疗较差、侵袭性较强、预后较差)的主要目的是区分这两种人群之间辅助细胞毒性化疗有效还是无效。
有证据显示PR强阳性(>20%--译者注)有助于提高区分luminal A型与uminal B型乳腺癌的准确性。
由于增加了这一条件,必将会使分类为luminal A型乳腺癌的患者数减少,进而使得推荐给予化疗的人数增加。
利用分子生物学技术鉴别原生亚型最精确。
如果不具备该项技术,运用IHC法检测ER、PR、Ki67以及HER2或用原位杂交法检测HER2,来进行亚型的替代定义也是可行的。
乳腺癌的分子分型

乳腺癌的分⼦分型乳腺癌是⼀种⾼度异质性的恶性肿瘤,在组织形态、免疫表型、⽣物学⾏为、治疗反应上都存在着极⼤的差异。
因此,随着个体化治疗的要求不断提⾼,传统的肿瘤病理学分型遇到了巨⼤的挑战。
近年来,随着分⼦⽣物学技术的发展,以乳腺癌基因表达特征为基础的分⼦分型逐渐成熟。
为探讨乳腺癌的异质性、治疗靶点、预后评估及个体化治疗等提供了新的启⽰(1)。
乳腺癌分⼦分型?1999 年美国国⽴癌症研究所提出肿瘤分⼦分型的概念,即通过综合的分⼦分析技术,使肿瘤的分类基础由形态学转向以分⼦特征为基础的新的肿瘤分类系统(2)。
Perou等(3)在2000年提出了乳腺癌的分⼦分型这⼀学说,通过对3种免疫表型ER、PR、Her-2,将乳腺癌分为5型:管腔A型、管腔B型、(Her-2)过表达型、基底细胞样型及正常乳腺样型。
2011年在St.Gallen 会议上专家组达成了共识:可根据IHC对ER、PR、Her-2和低表达增殖细胞核抗原-67(Ki-67)指标的检测结果,将乳腺癌分为Luminal A型、Luminal B型、Her-2阳性和三阴性乳腺(TNBC)4个类型,作为⼀种简单的近似替代⽅法,特称为“临床病理分型”(4)。
2013年St.Gallen会议提出了临床病理替代分⼦分型分为Luminal A型、Luminal B型、Her-2过表达型、基底细胞型(三阴型乳腺癌属于此型)4个类型,各分⼦亚型间在基因特征、发病年龄、临床特征、恶性程度、治疗敏感性及预后等⽅⾯均存在差异(5)。
Perou等在2000年提出的分⼦分型概念可作为乳腺癌个体化综合治疗发展史上的⼀个⾥程碑,量化地定义了乳腺癌不是单⼀的疾病,⽽是在发病危险因素、⾃然病程、全⾝治疗和局部治疗反应性等⽅⾯迥异的⼀组异质性疾病。
这个理念的巨⼤变化开启了基于分⼦分型的临床研究及临床治疗的新时代(6)。
乳腺癌4种亚型具体分类1Luminal A型:病理IHC表达情况为:ER/PR阳性,且PR⾼表达(≥20%); HER2阴性;Ki-67低表达,⾼表达CK18、CK8 及AR。
乳腺癌临床分期、病理分类分级和分子分型在精准诊治中的应用

·专家讲座·乳腺癌临床分期、病理分类分级和分子分型在精准诊治中的应用殷凯 汪洁(上海交通大学医学院附属同仁医院乳腺外科,上海 200336)摘 要 乳腺癌临床分期、病理分类分级和分子分型,一直以来都是乳腺癌诊疗中明确诊断、制订治疗计划,选择治疗方案的依据。
临床实践中的新发现也促使各种分类不断得到完善、更新和改进,使每一种分类方法与其他分类依据和方法相结合,发展出更精准的新分类和新亚型,并进一步发现新的治疗方式和治疗靶点。
本文综述临床上通用的乳腺癌分类方法及应用,以及在此基础上发展的新分类、分型及临床试验在治疗中的应用,并对最新的基因工具的应用进行系统性介绍,力图理清现今乳腺癌标准化、个体化治疗的决策依据,并展望未来更为精准化的发展趋势和方向。
关键词乳腺癌;临床分期;分子分型;个体化治疗;精准医学中图分类号:R737.9 文献标志码:A 文章编号:1006-1533(2023)14-0003-06引用本文殷凯,汪洁. 乳腺癌临床分期、病理分类分级和分子分型在精准诊治中的应用[J].上海医药, 2023, 44(14): 3-8; 16.Application of clinical staging, pathological classification and molecular subtyping in precise diagnosis and treatment of breast cancerYIN Kai, WANG Jie(Department of Breast Surgery of Tongren Hospital Affiliated to School of Medicine of Shanghai Jiao Tong University, Shanghai 200336,China)ABSTRACT The diagnosis, treatment planning and regimen decision of breast cancer are routinely made according to its clinical stage, pathological classification and molecular subtype. On the other hand, novel findings and issues raised from clinical practice also facilitated the innovation and development of staging and subtyping, hence promoted novel therapies and therapeutic targets. This systematic review will focus on the fundamental clinical staging, classification and subtypes of breast cancer, as well as the up-to-dated gene assays developed recently as prognostic and decision-making tools, to elucidate the decision basis for current precision treatments of breast cancer, and to look forward the prospect of precision medicine tendency in the near future.KEY WORDS breast cancer; clinical staging; molecular subtype; individualized treatment; precision medicine癌症分期是研究者根据癌症对身体的影响程度提出的评估系统,通常可以帮助医生制订针对癌症的治疗方案,也可以预测癌症对治疗的反应以及癌症患者的生存期。
乳腺癌诊断及分子影像学分型

精选ppt
7
乳腺B超:B超扫描能
够鉴别乳腺的囊性与实
性病变。乳腺癌B超扫
描多表现为形态不规则、
内部回声不均匀的低回
声肿块,彩色超声可显
示肿块内部及周边的血
流信号。目前,国际公
认乳腺钼靶X线摄像是
最有效的乳腺普查手段。
但是钼靶X线摄像诊断
乳腺疾病的准确性会受
美国斯坦福大学的Perou 等在2000 年最先报道了乳腺 癌的分子分型,包括: 管腔型( luminal subtype) 、基 底细胞样型( basal-like subtype) 、人表皮生长因子受 体2过表达型( HER-2 over-expression subtype) 和正常 乳腺样型( normal breast-like subtype) 。
机会性筛查是妇女个体主动或自愿到提供乳腺筛查的 医疗机构进行相关检查;
群体普查是社区或单位实体有组织地为适龄妇女提供 乳腺筛查。
精选ppt
5
乳腺X线:是一
种经典的检查手
段,是通过专门
的钼靶X线机摄
片进行实现的。
乳腺癌在X线片
中病灶表现形式
常见有较规则或
类圆形肿块、不
规则或模糊肿块、
毛刺肿块、透亮
精选ppt
10
精选ppt
11
精选ppt
12Βιβλιοθήκη BRCA1BRCA1 定位于人类17 号染色体q21。
属于抑癌基因,编码抑癌蛋白,对肿瘤生长起负性调 节作用。
BRCA1 突变或缺陷可导致基因结构不稳定,促进细胞 增殖,阻止细胞正常分化,诱发了肿瘤发生。
其突变与30%-45%的家族性乳腺癌 、卵巢癌有关。
乳腺癌分子分型

分子分型的意义
• 乳腺癌为高度异质性疾病,分子分型反映疾病本身的基因 类型,可提供重要的预后信息,并为治疗策略的选择提供 参考 • 形成了对危险度分类(根据患者临床特征来确定)的良好 补充 • 虽然分子分型最初是通过基因芯片分析判定的,但其中涉 及的一些指标(ER、PR、HER2、Ki-67等)可以通过IHC等 病理学检测方法来进行判定
两个ห้องสมุดไป่ตู้题
• Luminal A 型乳腺癌单用内分泌治疗就能取 得良好效果,但即使早期,仍有一部分患 者早期就出现复发转移; • Luminal A 型乳腺癌应用内分泌治疗基础上 加用化疗能取得更好效果,但其中相当一 部分存在过度治疗。
Luminal A 型化疗
• • • • • • 大多数专家可以接受的增加化疗的相对适应症: (1)组织学分级3级 (2) ≥4枚淋巴结转移(少数专家认为只要1枚淋巴结转移) (3)高21-基因RS评分(即>25分),如果可用; (4) 70-基因高风险状态,如果可用; 专家组在年轻(<35岁)本身是否是一个化疗指征上,反对 与认同的几乎一样多; • CMF、AC、TC
Luminal A 型
• • • • ER 和/或 PR +,Her-2 –,Ki-67( ≤ 14%) 乳腺癌最常见的分子亚型,预后最好。 内分泌治疗效果最佳,对化疗反应较弱。 常采用内分泌治疗(±化疗)。
• 绝经前常选择三苯氧胺,药物性去势药物诺雷德,绝经后 常选择芳香化酶抑制剂如阿那曲唑、来曲唑等。
Luminal A 型新辅助化疗
• Luminal A型对新辅助化疗与其他亚型的乳 腺癌患者相比,疗效较差。
周波,谢菲,杨德启.乳腺癌分子亚型预测新辅助化疗疗效的研究[J].中国肿瘤临床,2009,36(4):199.
Luminal_A型乳腺癌的化疗

ER阳性HER-2阴性(Luminal A型)乳腺癌的辅助化疗策略福建省肿瘤医院乳腺内科刘健李娜妮陈心华洪熠李重颖激素受体阳性乳腺癌约占乳腺癌的75%~80%,其中ER阳性HER-2阴性(luminal A型)乳腺癌约占65%~70%[1]。
NCI、NCCN和St.Gallen等世界性权威《指南》对ER阳性乳腺癌的辅助化疗指导原则不尽相同,对于ER阳性HER-2阴性(luminal A型)乳腺癌是否需要辅助化疗以及选择何种化疗方案,目前尚无统一标准。
《2009年St.Gallen专家共识》[2]中的早期乳腺癌辅助化疗策略与以往不同,主要根据ER 和HER2状态将乳腺癌分为三组,即HER2阳性乳腺癌、三阴性乳腺癌和ER阳性HER-2阴性乳腺癌;原则上对于HER2阳性乳腺癌采取曲妥株单抗和化疗联合为主治疗,对于三阴性乳腺癌以化疗为主,但对于ER阳性HER-2阴性乳腺癌,《共识》建议要参考临床病理学特征、生物学特征以及基因表型等特点加以选择治疗方案,目前尚缺乏标准治疗。
以下就近年来尤其是2009年ASCO上有关ER阳性HER-2阴性亚型乳腺癌的研究进展进行综述:一、早期乳腺癌辅助化疗的演进乳腺癌辅助化疗的目的是杀灭亚临床病灶,辅助化疗效果必须经过长期随访才能评估,因此,循证医学的证据是推动乳腺癌辅助化疗不断进步的动力和指导临床实践的依据。
三十年来乳腺癌辅助化疗在形式和内容上都取得长足的进步:70年代以Gianni Bonadonna发明的CMF方案为代表[3]标志着早期乳腺癌辅助化疗循证医学的开端,30年的随访结果表明,乳腺癌辅助化疗组的无病生存和总生存均高于单纯手术组,CMF辅助方案化疗使复发风险降低了34%(P=0.005),死亡风险降低了22%(P=0.04)。
80年代的蒽环类药物又将早期乳腺癌辅助化疗效果推进一大步,NSABP B-15[4]研究结果发现乳腺癌术后行AC方案辅助化疗4周期的疗效与CMF 方案化疗6周期的疗效相同;EBCTCG[5]对14000例的分析结果表明,含蒽环类的化疗方案与CMF方案化疗比较,复发及死亡危险分别降低了11%及16%,5年及10年的死亡率绝对值分别降低了3%及4%。
HER2检测原则+乳腺癌分子分型

Luminal B样(HER-2阳性)
HER2阳性型
HER-2阳性 HER-2阳性(蛋白过表达或基因扩增) ER阴性和PR阴性
Basal-like型
三阴性(非特殊型浸润性导管癌) ER阴性 PR阴性HER-2阴性
三阴性乳腺癌和Basal-like型乳腺癌之间的吻合 度约80%;但是三阴性乳腺癌也包含一些特殊类 型乳腺癌如髓样癌(典型性)和腺样囊性癌。
ER、PR、Ki-67表达的判定值建议采用报告阳性 细胞的百分比。Ki-67高低表达的判定值在不同 病理实验中心可能不同,可采用20%~30%作为判 断Ki-67高低的界值;同时,以20%作为PR表达 高低的判定界值*,可进一步区分Luminal A样 和Luminal B样(HER-2阴性)
上述不满足Luminal A样条件的Luminal样肿瘤均 可作为Luminal B样亚型
44. 受体细胞外片段的释放 (ECD)
酶联免疫吸附测定 (ELISA)
3
2
1
4
HER2 检测原则
乳腺癌分子分型
分子分型
标志物
备注
Luminal A型
Luminal A样 ER/PR阳性且PR高表达HER-2阴性 Ki-67低表达
Luminal B型
Luminal B样 ER/PR阳性 HER-2阴性 且Ki-67高表达或PR低表达
*:以20%作为PR表达高低的判定界值,目前仅有1篇回顾性文献支持(参考文献, J Clin Oncol,2013,31:203-209
HER2检测原则+乳腺癌分子分型
HER2 检测方法
1. 基因拷贝数
原位杂交(ISH) – FISH, CISH
22. பைடு நூலகம்mRNA 转录水平
乳腺癌分子分型及治疗选择

乳腺癌分子分型及治疗选择传统的肿瘤解剖病理分期(如TNM分期,包括肿瘤大小、淋巴结转移数目、远处转移情况)对于预测肿瘤的复发转移价值不可低估,是临床上较成熟的风险评估指标。
但由于乳腺癌是一种异质性肿瘤,其在组织形态、免疫表型、生物学行为及治疗反应上存在着极大的差异,传统病理TNM分期相同的患者对临床治疗的反应及预后可能会有很大差别。
近年来,基于DNA微阵列技术和多基因RT-PCR定量检测的方法对乳腺癌进行的分子分型来预测乳腺癌的复发转移风险及其对治疗的反应,目前常将基因芯片技术的分子亚型和免疫组织化学结合起来,临床上通常应用ER、PR、HER-2 及Ki-67可将乳腺癌划分为4类分子亚型(见附表)。
由于不同分子亚型乳腺癌的临床治疗反应和生存截然不同,研究乳腺癌分子标志及分子分型对于指导临床治疗与判断预后有重要意义。
比如临床上比较棘手处理的“三阴乳腺癌”(指ER、PR及HER-2均阴性;Triple-negative breast cancer)的乳腺癌,相当于分子分型的Basal-like型分子表达(特征为基底上皮分子标志物高表达(CK5/6或17,EGFR)以及ER或ER相关基因及HER-2或HER-2相关基因低表达),约占全部乳腺癌的10%~15%。
三阴乳腺癌5年生存率不到15%,临床上往往作为一种预后差的乳腺癌类型代表。
三阴乳腺癌多见于绝经前年轻患者,内脏转移、脑转移几率较高,病理组织学分级较差,多为3级,细胞增殖比例较高,且多伴p53突变,p53、EGFR表达多为阳性,基底细胞标志物CK5/6、CK17也多为阳性。
三阴乳腺癌预后与肿瘤大小和淋巴结状况关系不大,复发迅速,1-3年是复发高峰,5年内是死亡高峰,脑转移发生率高,迅速出现远处转移而导致死亡。
“三阴乳腺癌”内分泌治疗和曲妥珠单抗(Herceptin)靶向治疗无效,治疗上依靠化疗为主,化疗敏感性差并容易产生耐药。
表:乳腺癌分子亚型的定义和治疗推荐(2011年St.Gallen共识)分子亚型定义治疗类型注释Luminal (管腔或激素受体阳性)A型ER和(或)PR阳性HER-2阴性Ki-67低表达(小于14%)单纯内分泌治疗Ki-67染色的质量控制非常重要。
乳腺癌患者生存率与分子分型

乳腺癌患者生存率与分子分型乳腺癌是女性最常见的恶性肿瘤之一,其发生率在不断上升。
乳腺癌的治疗是一个复杂的过程,包括手术、放疗、化疗、内分泌治疗等。
治疗效果的评判是乳腺癌治疗的关键之一。
其中,乳腺癌患者的生存率是评价治疗效果的重要指标之一。
但是,乳腺癌患者的生存率受到多种因素的影响,其中分子分型是一个重要的因素。
分子分型是指根据乳腺癌分子分析的结果,将乳腺癌分为几种不同的亚型。
现有的分子分析方法主要包括基因芯片、转录组测序等。
在乳腺癌中,最常用的分子分型方法是根据ER(雌激素受体)、PR(孕激素受体)和HER2(人类表皮生长因子受体2)状态将乳腺癌分为四类:ER+/PR+/HER2-(luminal A)、ER+/PR+/HER2+(luminal B)、ER-/PR-/HER2+(HER2过表达型)、三阴性乳腺癌(TNBC)。
随着对分子分型的研究深入和分子分析技术的不断进步,我们发现不同分子分型的患者的生存率存在显著差异。
以近年来的研究为例,一项关于中国乳腺癌患者生存率的调查发现,三阴性乳腺癌的患者相对于其他亚型的患者,其病死率更高,生存期更短,而luminal A亚型患者则具有最好的生存率;Lu W. 等人对乳腺癌的分子分型与治疗结果进行了分析,结果表明,HER2过表达型和TNBC患者的局部复发率更高,远处转移率更快,生存率更低;Joanne E. et al. 的一项研究发现,ER+/HER2-乳腺癌与ER+/HER2+乳腺癌对内分泌治疗的反应不同。
以上研究结果表明,不同分子分型的乳腺癌患者其生存率和治疗结果存在显著差异。
而这种差异主要源于各亚型的生物学特性不同。
例如,HER2过表达型和TNBC乳腺癌细胞的增殖速度快,易产生远处转移;而luminal A亚型乳腺癌则对内分泌治疗敏感,生长缓慢。
因此,根据患者的分子分型制定个性化的治疗方案十分必要。
个性化治疗是将患者的病理学特征、分子生物学标志等个体差异因素纳入治疗的考虑范畴,根据患者的分子分型和特点制定具有针对性的治疗方案,以提高治疗效果。
三阴性乳腺癌的分子分型

Triple negative
but not basal
Clinical assay (IHC)
Triple negative
and basal-like
Gene arrays
Basal
but not triple negative − 15-40% 是ER+, PR+
或 HER2+
Leslie K. et al. Adv. Anat. Pathol. 2007; 14: 419-430
Goldhirsch A, et al. Ann Oncol 2011; 22:1736-1747.
三阴性乳腺癌(TNBC)的概念
• ER- / PgR- / HER2-(2005年开始提出)
– ER/PR 阴性:IHC 检测 <1%的肿瘤ER/PR阳性表达 – HER2阴性:IHC检测0/1+,FISH检测0/1+/2+
腔型/雄激素受体型( luminal/androgen receptor,LAR ) 是分化程度最高的乳腺癌亚型,该亚型不表达TNBC传统常 见的基底样型,而是表达 Luminal 型上皮的细胞特征、并且 雄激素受体(androgen receptor,AR)阳性。
Metzger-Filho等对TNBC的异质性进行了研究,将TNBC细 分为基底样型、BRCA相关性亚型、CK和EGFR高表达亚型 、Claudin-low亚型、其他病理亚型和免疫系统亚型6种亚型 。
基底样型(BLBC)的概念,目前许多研究小组建议采用免 疫组织化学检测代替基因芯片来诊断基因组学所定义的 BLBC,BLBC定义为基底细胞角 蛋 白(basal cytokeratins ,CKs)中 CK5/6 和(或)CK14、CK17阳性者。
这5个基因亚型有各自的特征

这5个基因亚型有各自的特征[3, 4]:(一) Luminal A型高表达ER、雌激素调节蛋白,TP53突变率很低(13%)且与ERBB2+基因的表达有高度的一致性。
TP53是抑癌基因,正常组织中含量很低,高突变表示预后差。
50%以上的肿瘤中均找到了TP53的突变,因此被作为细胞转化或恶性化的标志。
此型预后最好。
多见于绝经后女性,对化疗不敏感而适合于内分泌治疗。
(二) Luminal B型表达低到中度的腔上皮特异基因,包括ER及其他上面提到的基因,但也表达ERBB2等基因。
此型与ERBB2+相似,但其浸润性却远远低于ERBB2+,其肿瘤体积较小且激素受体水平较高。
(三) Basal-like型高表达角蛋白5、角蛋白、c-KIT、层黏连蛋白及脂肪酸结合蛋白等的基因,而Lumin al/ER+的相关基因均阴性。
这类肿瘤多见于年青女性及BRCA1携带者,大部分(75%)有T P53突变及BRCA1(人类乳腺癌易感基因1,是一种抑癌基因,突变与家族性乳腺癌及卵巢癌的发生密切相关,约40%-50%的遗传性乳腺癌是由BRCA1突变引起的)突变。
患者的ER、PR、HER2表达均为阴性,即所谓“三阴型乳腺癌”(triple-negative tumors),此型对化疗最为敏感,病理完全缓解率高,但预后最为恶劣。
(四) ERBB2+ 型高表达ERBB2,ER阴性的肿瘤TP53的突变率也很高(40%一86%),肿瘤分化较差,通常是组织学Ⅲ级。
此型化疗也较为敏感,预后较差。
(五) Normal breast-like型也写为Normal-like型,高表达脂肪组织及非上皮细胞的基因,并强表达基底上皮基因,低表达腔上皮基因。
此型对化疗最不敏感但预后较好。
乳腺癌的术后病理评估与预后分析

乳腺癌的术后病理评估与预后分析乳腺癌是女性最常见的恶性肿瘤之一,术后病理评估和预后分析对于指导患者的治疗和预后判断非常重要。
本文将从乳腺癌的病理特征、病理分级、分子分型以及免疫组化等方面进行论述,以探讨乳腺癌患者术后病理评估的意义和方法,以及与预后相关的因素。
一、乳腺癌的病理特征乳腺癌是一种异质性肿瘤,不同的肿瘤细胞具有不同的形态和分子特征。
乳腺癌的病理特征包括肿瘤大小、病变类型、侵袭性以及淋巴结转移情况等。
乳腺癌的大小通常用最大肿瘤直径来表示,较小的乳腺癌常称为微小乳腺癌,大于2厘米的肿瘤则属于大肿瘤。
病变类型分为浸润性导管癌、浸润性小叶癌等,根据不同的类型对患者的治疗和预后有一定的指导意义。
乳腺癌的侵袭性是指肿瘤细胞侵入周围正常组织的能力,通常通过观察肿瘤的浸润深度、侵袭方式以及侵袭范围等因素来评估。
淋巴结转移是乳腺癌预后的重要影响因素,通过检查切除乳腺癌的淋巴结是否存在转移来判断患者的预后。
二、乳腺癌的病理分级乳腺癌的病理分级是根据肿瘤的组织学类型、细胞核形态以及核分裂指数等指标来评估肿瘤的恶性程度和预后。
常用的病理分级系统包括Elston和Ellis系统以及Scarff-Bloom-Richardson(SBR)系统。
Elston和Ellis系统主要通过观察肿瘤的核大小、核形态学特征以及核分裂指数来评估肿瘤的恶性程度,将分为I、II和III级。
SBR系统则通过观察肿瘤的核分裂指数、导管形态和核几何形状来进行评估,也将分为I、II和III级。
三、乳腺癌的分子分型乳腺癌的分子分型是根据肿瘤细胞中不同的分子标志物表达情况来进行分类,可以帮助预测患者的预后以及指导个体化治疗。
根据表达雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)的情况,乳腺癌分为四个分子分型,分别是Luminal A、Luminal B、HER2阳性和三阴性。
Luminal A型乳腺癌具有较好的预后,常见于ER和PR阳性,HER2阴性的乳腺癌。
乳腺癌的分子分型

郑州大学第一附属医院乳腺外2科 王 楠
Biological
3000 BC 1500’s
Chemotherapy
Radiotherapy
Hormonal manipulation
Surgery
1800’s
1937
1950 1997
• 282例,组织学分级Ⅲ级,1993~2000年在the Royal Marsden Hospital治疗的原发性乳腺癌(化疗方案含蒽环类 药物)
乳腺癌分子分型的临床特征
• 关于basal-like型乳腺癌的临床预后, 目前研究显示, 与其他类型乳腺 癌相比较, 其预后最差, 患者无病生存率及总生存率均明显降低。 basal-like亚型是乳腺癌的独立预后因素, 无论淋巴结转移与否, 患者 无病生存间期及总生存期均明显缩短, 成为除肿瘤大小外最重要的患 者预后预测因子。此外对basal-like型乳腺癌的转移部位进行分析发现, 其转移多发生于内脏及中枢神经系统, 如肝脏、 肺、 脊髓、 脑等部 位, 而很少出现其他乳腺癌最常见的骨转移, 分析可能与其特异性基因 表达产生的肿瘤细胞宿主选择性有关。对于basal-like型乳腺癌的治疗, 由于其激素受体及HER-2均阴性表达, 对内分泌治疗及曲妥珠单克隆 抗体治疗无效, 因此只能选择化疗。与非basal-like型乳腺癌相比较, basal-like型乳腺癌具有更高的化疗敏感性。 basal-like型乳腺癌的化 疗敏感性与其组织学高分级及激素受体阴性表达密切相关, 虽然对术 前新辅助化疗敏感, 病理缓解率高, 但在乳腺癌的分子分型中, 其预后 仍最差。
• CK5/6、CK14、CK17(免疫组化),三者有一个指标为阳 性---A组,共49例(17.4%),对照组49例
乳腺癌分子分型的研究进展

乳腺癌分子分型的研究进展一、本文概述乳腺癌作为全球女性最常见的恶性肿瘤之一,其发病机制和治疗方法一直是医学研究的热点。
近年来,随着分子生物学的飞速发展,乳腺癌的分子分型研究取得了显著的进展。
本文旨在全面概述乳腺癌分子分型的研究现状,探讨各种分子分型的特点、临床意义以及治疗策略,以期为提高乳腺癌的诊断和治疗水平提供理论支持和实践指导。
本文将首先介绍乳腺癌分子分型的概念和分类方法,包括基于基因表达谱的分型、基于蛋白质表达的分型以及基于基因突变和染色体异常的分型等。
随后,我们将详细阐述各种分子分型的生物学特征、临床表现和预后差异,包括Luminal A型、Luminal B型、HER2过表达型、三阴性乳腺癌等。
我们还将探讨乳腺癌分子分型与个体化治疗的关系,分析不同分子分型乳腺癌患者的治疗策略选择和预后情况。
本文将对乳腺癌分子分型研究的未来趋势进行展望,包括新型分子标记物的发现、精准治疗策略的研发以及多组学整合分析等方向的发展。
我们相信,随着研究的不断深入和技术的不断进步,乳腺癌分子分型将在提高诊断准确率、指导治疗决策以及改善患者预后等方面发挥越来越重要的作用。
二、乳腺癌的分子分型乳腺癌的分子分型是近年来乳腺癌研究领域的重大突破,它基于乳腺癌的基因组学、转录组学和蛋白质组学等分子特征,将乳腺癌分为多种不同的亚型,从而为我们理解乳腺癌的发生、发展和预后提供了全新的视角。
目前,乳腺癌的主要分子分型包括Luminal A型、Luminal B型、HER2过表达型和三阴性乳腺癌(TNBC)等。
Luminal A型乳腺癌通常表达雌激素受体(ER)和/或孕激素受体(PR),且具有较高的预后,其治疗策略主要包括内分泌治疗和化疗。
Luminal B型乳腺癌也表达ER和/或PR,但其基因表达谱和预后与Luminal A型有所不同,可能需要更为强烈的治疗手段。
HER2过表达型乳腺癌的特征是HER2基因扩增和蛋白过表达,这类乳腺癌通常具有较高的侵袭性和较差的预后。
2020乳腺癌luminal分型标准

2020乳腺癌luminal分型标准
2020年乳腺癌的Luminal分型标准主要基于雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体(HER2)和Ki67的表达情况来分类。
具体如下:
1.Luminal A型:ER和/或PR阳性,且Ki67小于14%。
这种类型对内分泌
治疗敏感,对化疗不敏感,一般不需要进行靶向治疗。
2.Luminal B型:ER和/或PR阳性,且Ki67大于14%或HER2阳性。
这种
类型对化疗的反应性较Luminal A型好,但对内分泌治疗的敏感度相对较差。
其中HER2阳性的患者还应该考虑抗HER2的靶向治疗。
3.HER2过度表达型:ER、PR阴性,HER2阳性,且一般需要考虑化疗和靶
向治疗。
4.三阴性乳腺癌:ER、PR及HER2表达均为阴性,此类患者只有化疗是有效
的全身治疗手段。
Luminal分子分型
±细胞毒治疗
多基因序列分析显示,高增殖基因多可预测患者预后较差;如果不能进行可靠的Ki67评估,可考虑其他替代指标,如分级;这些替代性指标也可用于区分Luminal A型和Luminal B(HER2阴性)型,而对后者是否选用化疗及选择具体化疗方案,可能取决于内分泌受体表达水平、危险度和患者意愿。
Luminal B(HER2阳性) ER和(或)PR阳性HER2过表达或增殖Ki67任何水平
细胞毒治疗
+内分泌治疗
+抗HER2治疗
对Luminal B(HER2阳性)型,目前无证据显示可去除细胞毒治疗。
Erb-B2过表达型
HER2阳性(非Luminal)ER和PR缺失HER2过表达或增殖
细胞毒治疗
+抗HER2治疗
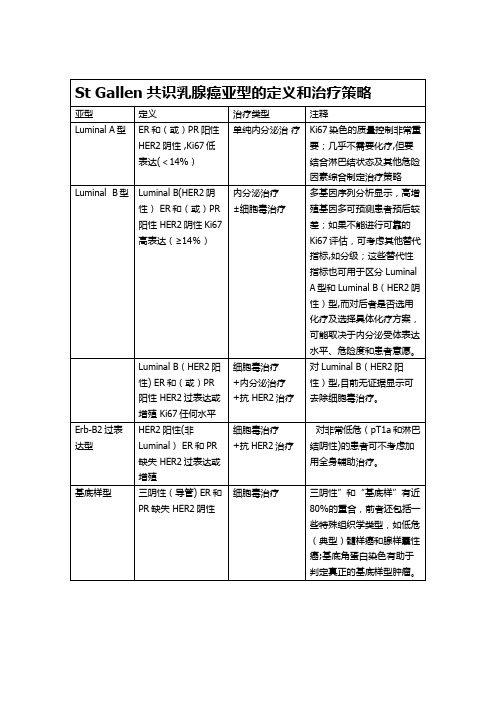
St Gallen共识乳腺癌亚型的定义和治疗策略
亚型
定义
治疗类型
注释
Luminal A型
ER和(或)PR阳性HER2阴性质量控制非常重要;几乎不需要化疗,但要结合淋巴结状态及其他危险因素综合制定治疗策略
Luminal B型
Luminal B(HER2阴性)ER和(或)PR阳性HER2阴性Ki67高表达(≥14%)
对非常低危(pT1a和淋巴结阴性)的患者可不考虑加用全身辅助治疗。
基底样型
三阴性(导管) ER和PR缺失HER2阴性
细胞毒治疗
三阴性”和“基底样”有近80%的重合,前者还包括一些特殊组织学类型,如低危(典型)髓样癌和腺样囊性癌;基底角蛋白染色有助于判定真正的基底样型肿瘤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
或增殖
考虑加用全身辅助治疗。
基底样型
三阴性(导管)ER HER2缺失阴PR和性
细胞毒治疗
三阴性”和“基底样”有近80%的重合,前者还包括一些特殊组织学类型,如低危(典型)髓样癌和腺样囊性癌;基底角蛋白染色有助于判定真正的基底样型肿瘤。
共识乳腺癌亚型的定义和治疗策略St Gallen
亚型
定义
治疗类型
注释
Luminal A型
ER和(或)PR阳性HER2阴性,Ki67低表达(<14%)
单纯内分泌治疗
Ki67染色的质量控制非常重要;几乎不需要化疗,但要结合淋巴结状态及其他危险因素综合制定治疗策略
Luminal B型
Luminal B(HER2 ER阴性)和阳性(或)PR Ki67HER2阴性高)表达(≥14%
内分泌治疗±细胞毒治疗
多基因序列分析显示,高增殖基因多可预测患者预后较差;如果不能进行可评估,可考虑靠的Ki67其他替代指标,如分级;这些替代性指标也可用于型和区分Luminal A阴性)HER2Luminal B(型,而对后者是否选用化疗及选择具体化疗方案,可能取决于内分泌受体表达水平、危险度和患者意愿。
Luminal B(HER2阳性)ER和PR阳性(或)HER2过表达或增殖任何水平Ki67
细胞毒治疗内分泌治疗+治疗+抗HER2
对LuminalB(HER2阳性)型,目前无证据显示可去除细胞毒治疗。
Erb-B2过表达型
HER2阳性(非PR和)Lumin3;HER2
