第十章 细胞骨架(Cytoskeleton)
第十章 细胞骨架(Cytoskeleton) 2(简)

第二节 微管及其功能
真核细胞中直径24~26nm的中空管状结构 ,其空间结 构与功能与微管结合蛋白有关。
一、化学组成 二、装配 三、微管结合蛋白 四、功能
一、化学组成
微
2
1
3
管 13
4
进化上高度保守,由同一祖先基因进化而来 横
断
12 11
5
6 7
10
面
98
微 管 蛋 白
微管蛋白 极性
(55KD 450aa) 异二聚体
驱动蛋白和胞质动力蛋白介导的细胞内膜泡和细胞器运输
(KIF,驱动蛋白超家族)
鞭毛和纤毛的摆动
纤毛Βιβλιοθήκη 鞭毛纤毛或鞭毛结构组成
纤毛动力蛋白的结构
外动力 蛋白
连 接 蛋 白
“9+2” 微管
内动力 蛋白
多亚基的ATP酶
纤毛/鞭毛运动的微管滑动学说
1234. 带动新结有力的合水A蛋的T解A白PT产结头P物合水部的于解与头动,相部力其邻与蛋释二B白放联微上的体管,能上的使量B另微头使一管部头个结与部位合相的点,邻角结促的度合进二复,A联原T开体。P始(水B微解管) 脱又A离一D。次P循+P环i(释。放),同时动力蛋白头部构象变化角度改变, 牵引相邻B微管向纤毛顶部滑动。
两端速率相等时,微管长度不变。
GTP的作用
调节微管的组装
GTP- GTP – tubulin 促进组装;
GTP→GDP+Pi; GTP- GDP -tubulin 去组装
装配过程 请你仔细找一下微管的“接缝”!
原纤维核装配
侧面加宽并延长
稳定阶段
踏车行为
缩短
延长
微管的体内组装特点
第10章_细胞骨架

第10章_细胞骨架第一篇:第10章_细胞骨架第10章细胞骨架 cytoslceleton 本章内容首先简介细胞骨架的组分、分类、功能和研究细胞骨架的技术,第二介绍对胞质骨架即微丝,微管和中间纤维的超分子结构特征、装配动力学,生物学功能和发挥功能作用中的相关蛋白,以及主要由微丝和高度组织化形成的横纹肌收缩系统的精细结构和收缩机制,由微管和相关蛋白构成的纤毛,鞭毛的精细结构和运动机制有较清楚和明确的认识,并了解分子发动机的概念。
第一节细胞骨架细胞骨架指细胞中除了细胞器外的三维蛋白纤维网架体系。
一、组成和分布1.微管核周围,呈放射状向四周扩散2.微丝质膜内侧3.中等纤维分布在整个细胞中细胞骨架具有动态的特点,并非静止不变。
二、细胞骨架的功能1.细胞结构和形态支持2.胞内运输3.收缩和运动 4.空间区域组织三、细胞骨架的研究方法 1.荧光显微镜荧光抗体基因工程改造的带有荧光的蛋白,一种藻类中centrin的荧光抗体显影,centrin分布在鞭毛和基体中,红色为藻类光合作用自身发出的荧光。
2.电镜 3.电视显微镜分子发动机蛋白质在微管上的移动(见箭头相对于微管位置的移动)第二节细胞骨架的各个组分一、微管 Micorotubules(MTs)1.形态、化学组成和超分子结构MT是刚性的直径约20-25nm的圆管状结构,其长度因种类和功能等的不同而有很大的变化。
完整的MT经负染法显示,其壁是由一层串珠样的纵行的纤维丝包围形成的,从横截面上看,细丝共13条,这些串珠样的细丝被称为原纤丝Protofilaments。
原纤丝的化学组成是微管蛋白tubutin。
微管蛋白是球状分子,分α和β两种,分子量均大约为5.5KD,在一般生物细胞内,它们均以各一个分子结合成异二聚体的形式存在。
原纤丝就是由异二聚体首尾相连而成。
α和β都有一个GDP结合位点,α中的位点也结合GTP,称可交换位点(exchangable site,E site)。
第10章细胞骨架
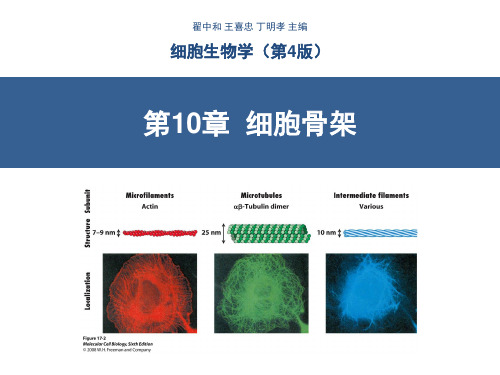
• 肌肉收缩的基本单位是肌小节(sarcomere)。 肌小节是相邻两Z线间的单位。主要结构有:
A带(暗带): 为粗肌丝所在。 H区:A带中央 色浅部份,此 处只有粗肌丝。 I带(明带): 只含细肌丝部 分。 Z线:细肌丝一 端游离,一端 附于Z线 。
肌纤维TEM照片
Sarcomere
肌小节模式图
蛋白丝,抑制肌动蛋白与肌球蛋白结合。
● 肌钙蛋白(troponin. Tn) • 肌钙蛋白分子量 80KD,由3个多肽。Tn-T是一种 长形的纤维状分子, Tn-I和Tn-C都是球形分子。 • 肌钙蛋白 C 特异地与钙结合,肌钙蛋白 T与原肌 球蛋白有高度亲和力,肌钙蛋白 I抑制肌球蛋白的 ATP酶活性,
• ● 原肌球蛋白(tropomyosin, Tm) • 原肌球蛋白是细肌丝中肌动蛋白的结合蛋白,由两
条平行的多肽链组成α螺旋构型,每条原肌球蛋白
首尾相接形成一条连续的链同肌动蛋白细肌丝结合, 正好位于双螺旋的沟中。每一条原肌球蛋白有7个 肌动蛋白结合位点,因此Tm同肌动蛋白细肌丝中7 个肌动蛋白亚基结合。主要作用是加强和稳定肌动
肌肉收缩(muscle contraction)
肌肉可看作一种特别富含细胞骨架的效力非常高的 能量转换器,它直接将化学能转变为机械能。
• 肌细胞在进化的过程中形成了一种高度特化的 的功能:肌收缩(muscle contraction)。在肌细 胞中, 肌动蛋白和肌球蛋白联合形成一种复合物: 称为肌动球蛋白(actomyosin), 一种高度有序的 结构, 并能高效地工作。
Myosin: The actin motor portein
ATPase
Myosin II--Dimer
Mainly in muscle cells
细胞生物学第四版(细胞骨架1) (2)资料

肌动蛋白结合蛋白与微丝的组装 (图10-4)
微丝的成核与加帽(图10-5)
3. 加帽蛋白:与微丝的末端结合从而阻止微丝解 聚或过度组装的蛋白。在微丝的负极端常有Arp2/3复 合物或原肌球调节蛋白(tropomodulin)结合而稳定; 在微丝的正极端常有CapZ或凝溶胶蛋白(gelsolin) 结合而加帽。 4. 交联蛋白:决定微丝排列成束状还是网状。 成束蛋白将相邻的微丝交联成束状结构。成束蛋 白的2个肌动蛋白结合域之间的区域都是僵直的。丝束 蛋白(fimbrin)和绒毛蛋白(villin)等交联而成的 微丝束为紧密包装型,肌球蛋白不能进入,因而没有 收缩能力。α-辅肌动蛋白交联形成的微丝束相邻的纤 维之间比较宽松,肌球蛋白可以进入与微丝相互作用, 这种类型的微丝束是可收缩的。 成网的蛋白将微丝交联成网状或凝胶样结构。细 丝蛋白(filamin)和血影蛋白(spectrin)的2个肌 动蛋白结合域之间的区域都是柔软的,或者本身就是 弯曲的。
临界浓度(Cc):当纤维正极组装的速度与 负极解聚的速度相同即纤维的长度保持不变 时,组装体系中肌动蛋白单体的浓度称为临 界浓度。 踏车行为(treadmilling):在体外组装过 程中有时可以见到微丝正极由于肌动蛋白亚 基的不断组装(添加)而延长,负极则由于 肌动蛋白亚基去组装(解聚)而缩短,这种 现象称为踏车行为。
体内肌动蛋白的组装在2个水平上受到 微丝结合蛋白的调节:①可溶性肌动蛋白 的存在状态;②微丝结合蛋白的种类及其 存在状态。 细胞内微丝网络的组织形式和功能通 常取决于与其结合的微丝结合蛋白,而不 是微丝本身。 根据微丝结合蛋白作用方式的不同,可将 其分成如下几种类型:
1. 肌动蛋白单体结合蛋白:储存在细胞 内的肌动蛋白单体常与单体结合蛋白结合在 一起,只在存在需求信号时才加以利用。
生物细胞骨架

第一节 微丝(Microfilament)
一、微丝的形态与组成
小肠上皮细胞横切图
小肠上皮细胞纵切图
(微绒毛的中轴是由微丝构成)
1、微丝的结构:微丝(microfilament)是由肌 动蛋白亚单位组成的实心螺旋状纤维,直径约 5--7nm 。
第十章 细 胞 骨 架
“人”有一定的形态是由于 有骨骼系统作为支架。
细胞为什么能维持一定的形态?
细胞质:微管 微丝 中等纤维
细胞核:核骨架
上皮细胞(红色:微 丝;绿色:微管)
细胞骨架(cytoskeleton): 是指真核细胞中由微管、 微丝和中等纤维等蛋白质 成分构成的一个复合的网 架系统。
作用:
成核期:球状肌动蛋白开始聚合, 生长期:两端速度不同 平衡期:正端延长速度等于负端
4.影响微丝组装的因素
• 组装:鬼笔环肽、肌动蛋白单体 的浓度(临界浓度)
• 解聚:细胞松弛素B
二、微丝的功能:1.参与肌肉收缩 2.支撑功能(微绒毛形态的维持)
3.微丝与细胞运动
变形虫的胞质运动 胞吞、胞吐作用等。 微丝参与细胞分裂
极到正极进行运动。 ·Myosin 主要分布于肌细胞,有两个球形头部结构
域(具有ATPase活性)和尾部链,多个Myosin尾部相互缠 绕,形成myosin filament,即粗肌丝。
如:肌球蛋白常聚合为两极纤维
肌球蛋白在 肌细胞中含 量丰富,规 则排列,在
非肌细胞中 含量少,且 无序排列。 是微丝动力 蛋白。
小结 细胞骨架的分布
• 微管主要分布在核 周围, 并呈放射状 向胞质四周扩散。
细胞生物学第十章_细胞骨架

微绒毛: MF同向平行排列
培养的成纤维细 胞中具有丰富的 应力纤维,并通 过粘着斑固定在 基质上。在体内 应力纤维使细胞 具有抗剪切力
当细胞受到外界 刺激时开始运动, 应力纤维发生变 化或消失
培养的上皮细胞中的应力纤维 (微丝红色、微管绿色)
MF反向平行排列
MF相互交错排 列
肌肉的组成
• 由肌原纤维组成,肌原纤维的粗肌丝主要成分是 肌球蛋白,细肌丝主要成分是肌动蛋白、原肌球 蛋白和肌钙蛋白。
• 研究细胞的内部工作机制,窥视细胞如何分裂。通过这些观察,可以揭开癌症工作机 制和组织生长之谜。
二、微丝结合蛋白
• 已知的的微丝结合蛋白有100多种,如: • 1 .核化蛋白:使游离actin核化,开始组装,Arp • 2.单体隐蔽蛋白:阻止游离actin向纤维添加,thymosin • 3.封端蛋白:使纤维稳定,Cap Z • 4.单体聚合蛋白:将结合的单体安装到纤维,profilin • 5.微丝解聚蛋白:cofilin • 6.交联蛋白:fimbrin • 7.纤维切断蛋白:gelsolin • 8.膜结合蛋白:vinculin
• 单体呈哑铃形,称G-actin;多聚体称F-actin。 • 结构高度保守,酵母和兔子actin有88%的同源性。 • 需要翻译后修饰,如N-端乙酰化或组氨酸残基的甲基化。
(二)微丝的装配
• 条件:ATP、适宜温度、K+和Mg2+。
• 过 程 : 2-3 个 actin 聚 集 成 核 心 ( 核 化 ) ; ATPactin分子向核心两端加合(延伸)。
• 属于马达蛋白,多数趋向微丝的(+)极。
• 肌球蛋白II构成粗肌丝。由2重链和4轻链组成,具有2 球形的头和1螺旋化的干,头部有ATP酶活性。
第10章细胞骨架(Cytoskeleton)

第十章细胞骨架(Cytoskeleton)教学目的: 1 掌握细胞骨架的概念2 掌握细胞骨架各成分性质、结构与功能3 了解细胞的各种运动形式教学重点:1 细胞骨架的狭义及广义概念2 细胞骨架各成分性质、结构与功能教学难点:细胞骨架各成分之间的关系讲授与讨论概述细胞骨架是真核细胞中的蛋白纤维网架体系,可以说是迄今为止,最新发现的一类细胞器,也是当前细胞生物学研究中最活跃的领域之一,并且这种研究正方兴未艾。
真正确认细胞中骨架系统的存在,则是在本世纪60年代,人们对制作电镜标本的固定剂和条件作了改动之后。
1963年,Slauterback使用戊二醛(代替锇酸)在室温(代替0℃)下固定标本,首先在水螅刺细胞中发现了细胞骨架成分之——微管,同年,Porter在植物细胞中也发现了微管的结构。
那么细胞骨架的概念如何呢?包括哪些内容呢?细胞骨架是真核细胞中的蛋白纤维网架体系。
早期狭义的范围主要指胞质骨架,现代广义的理解应为:细胞骨架(cell skeleton)细胞骨架的主要功能是(1)维持细胞形态多样性(2)行使细胞运动(3)保持细胞内结构的合理空间布局与有序性(4)细胞内物质的传递与运输(5)参与细胞内信号传导(6)作为多种蛋白、酶和细胞器的支持点(7)参与蛋白质合成(多聚体3,端锚定在骨架纤维上才启动)(8)核骨架、染色体骨架参与染色质和染色体的构建(9)核骨架为基因表达提供空间支架(10)细胞骨架参与细胞周期的调节,并与细胞分化和细胞衰老关系密切。
第一节细胞质骨架(Cytoskeleton)一、微丝(microfilament,MF)即肌动蛋白纤维(actin microfilament),是真核细胞中由肌动蛋白组成,直径约7nm的骨架纤维。
微丝在细胞中可以两种状态存在,一种是微丝互相平行排列成束,形成有规则的稳定结构,如肌细胞中形成粗丝和细丝。
另一种状态是网络状,在非肌细胞中这种状态较多。
(一)化学组成微丝是由总称为收缩蛋白(Contractile P)的物质组成,主要是肌动蛋白和微丝结合蛋白。
生物细胞的骨架分析

细胞松弛素B的结构
二、微丝结合蛋白
肌肉收缩系统中的有关蛋白 肌肉收缩系统中的有关蛋白(不讲)
■ 骨骼肌细胞的基本结构 三、肌肉的收缩机制 ● 肌纤维(myofibers) 肌纤维(myofibers)是圆柱形的肌 细胞(长度40mm, 宽10-100μ m), 并含有许多核(达100个核)。每个 肌纤维被一层细胞质膜包被,这 种 细 胞 膜 称 作 肌 纤 维 膜 (sarcolemma)。 ● 肌原纤维(myofibril) 肌原纤维是横纹肌中长的、圆柱 形的结构。肌原纤维有明暗相间 的带,明带称为I带(I band),暗 带称为A带(A band)。在I带中有 一条着色较深的线, 叫Z线 ● 肌节(sarcomere) 肌节是Z线将肌原纤维分成的一系 列的重复单位,含有一个完整的A 带和两个二分之一I带, 肌节是肌 收缩的单位
第十章 细胞骨架
西南大学生命科学学院 冯全义
第十章 细胞骨架
胞质骨架
1 微丝 2 微管 3 中间纤维 核骨架(nucleoskeleton)又叫核基质
(nuclear matrix )(见第八章第六节 核基质 与核体 )
第十章 细胞骨(cytoskeleton)
细胞骨架:指真核细胞中的蛋白 纤维网络结构 1、分类 狭义细胞骨架由微丝 (microfilament)、微管 (microtubule)和中间纤维 (intemediate filament)构 成 广义的细胞骨架还包括核骨架 (nucleoskeleton)、核纤层 (nuclear lamina)和细胞外 基质(extracellular matrix),形成贯穿于细胞核、 细胞质、细胞外的一体化网络 结构
种蛋白的结合有利于细肌丝的 稳定, 防止去聚合
10细胞骨架与细胞运动

第十章.细胞骨架与细胞运动细胞除了含有各种细胞器外,在细胞质中还有一个三维的网络结构系统,这个系统被称为细胞骨架(图10-1)。
图10-1细胞骨架系统10.1细胞骨架(c y t o s k e l e t o n)的组成和功能细胞除了具有遗传和代谢两个主要特性之外,还有两个特性,就是它的运动性和维持一定的形态。
细胞骨架是细胞运动的轨道,也是细胞形态的维持和变化的支架。
10.1.1细胞骨架的组成和分布●组成细胞骨架是细胞内以蛋白质纤维为主要成分的网络结构,由主要的三类蛋白纤丝(fi l a m e mt)构成,包括微管、微丝(肌动蛋白纤维)和中间纤维。
●分布微管主要分布在核周围,并呈放射状向胞质四周扩散。
微丝主要分布在细胞质膜的内侧。
而中间纤维则分布在整个细胞中(图10-2)。
图10-2细胞骨架的三类主要成分及其分布10.1.2细胞骨架的功能细胞骨架对于维持细胞的形态结构及内部结构的有序性,以及在细胞运动、物质运输、能量转换、信息传递和细胞分化等一系列方面起重要作用。
●作为支架(s c a f f o l d),为维持细胞的形态提供支持结构,如红细胞质膜膜骨架结构维持。
●在细胞内形成一个框架(f r a me w o r k)结构,为细胞内的各种细胞器提供附着位点。
细胞骨架是胞质溶胶的组织者,将细胞内的各种细胞器组成各种不同的体系和区域的网络结构。
●为细胞器的运动和细胞内物质运输提供机械支持。
细胞骨架作为细胞内物质运输的轨道;在有丝分裂和减数分裂过程中染色体向两极的移动,以及含有神经细胞产生的神经递质的小泡向神经细胞末端的运输都要依靠细胞骨架的机械支持。
●为细胞从一个位置向另一位置移动。
一些细支撑提供胞的运动,如伪足的形成也是由细胞骨架提供机械支持。
纤毛和鞭毛等运动器官主要是由细胞骨架构成的。
●为信使R N A提供锚定位点,促进mR N A翻译成多肽。
用非离子去垢剂提取细胞成分可发现细胞骨架相当完整,许多与蛋白质合成有关的成分同不被去垢剂溶解的细胞骨架结合在一起。
10 细胞骨架
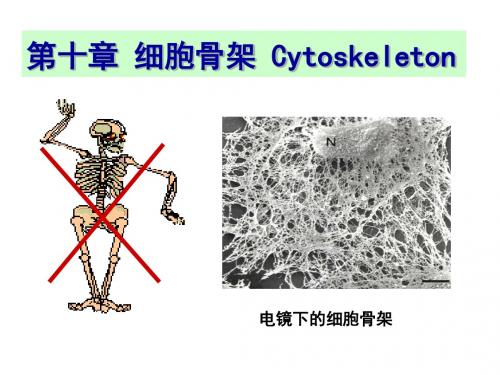
小结:组装过程
①成核反应
②纤维延伸 ③稳定期
(三)影响组装的特异性药物
◆细胞松弛素B(cytochalasins B)
真菌的代谢产物,切断微丝,并结合在微丝末端 阻抑聚合,破坏微丝的网格结构,阻止细胞的运动。
◆鬼笔环肽(phalloidin) 小分子结合在F-actin之间,抑制解聚,维持长度 稳定,但失去运动功能。其荧光标记物是鉴定 F-actin 的重要试剂。
颈部每个结合两条轻链,通过同钙调素或类似钙 调素的调节轻链亚基的结合来调节头部的活性。
胰 蛋 白 酶 解
LMM轻酶解肌球蛋白 HMM重酶解肌球蛋白
木 瓜 蛋 白 酶
HMM-S1头部 HMM-S2杆部
马达结构域
MyosinⅡ运动机理
低头
抬头
负极
低头
◆肌球蛋白的功能
不同种类肌球蛋白的特殊功能由它们的尾部决定: ●肌球蛋白Ⅰ、Ⅴ :运输作用 ●肌球蛋白Ⅱ:肌收缩、胞质分裂
Ca2+回收收缩停止
第二节 微管( Microtubule)
定义:存在于所有真核细胞中由微管蛋白
(tublin)聚合形成的管状蛋白多聚体结构。
状态:微管是中空的管状结构,长度变化不定,有些有刺 状结构 分布、功能: 真核细胞中普遍存在主要位于细胞质中, 控制着膜性细胞器的定位和胞内物质运输。 细胞特殊结构: 暂时性结构:纺锤体 永久性结构:纤毛、鞭毛内轴丝 神经元突起内微管束
微管在中心体上的聚合
A.中心体的无定形蛋白基质中含有γ微管蛋白环,它是微管生长的起始部位; B.中心体上的γ微管蛋白环,包裹微管负端,还可影响微管从中心粒上释放; C.中心体与附着其上的微管,负端被包围在中心体中,正端游离在细胞质中;
第十讲 细胞骨架
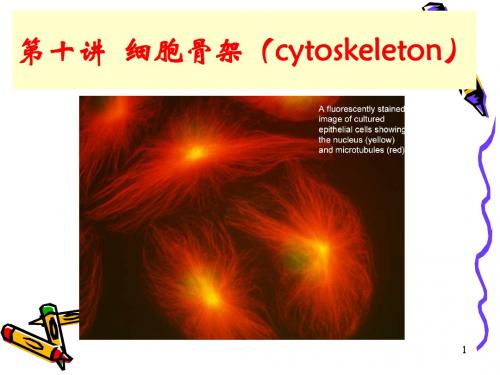
因此,就每一根微丝来说,长度一般不是固定不变 的,呈动力学不稳定状态。
11
12
溶液中ATP-肌动蛋白的浓度也影响组装的速度。 当处于临界浓度时,ATP-actin可继续在+端添加、 而在-端分离,且二者速度速度相等,新聚合上 的肌动蛋白单体从正极向负极作踏车式移动,此 即踏车模型 (treadmilling model)。
46
微管的极性: →→形成原纤维丝具极性,由原纤维丝 形成的微管也具极性;
微管装配是一个动态不稳定过程:即微管装配与 去装配是一个交替变换的现象; ·动力学不稳定性产生的原因:微管两端具GTP帽 (取决于微管蛋白浓度),微管将继续组装,反之,具 GDP帽则解聚。
47
48
长春碱类和秋水仙素类药物是通过阻滞微管蛋白聚 合,使有丝分裂不能进行从而破坏肿瘤细胞增殖。 紫杉醇及紫杉特尔的作用则是促进微管蛋白聚合作 用和抑制微管解聚,它们的作用位点与前述二类药不 同,主要作用于β-微管蛋白的N-末端31位氨基酸和 217-231氨基酸残基上,使具有可逆变化的微管不能解 聚,阻止丝状分裂,最后导致癌细胞死亡。紫杉醇源 于短叶紫杉的树皮。药理学研究表明,紫杉醇可明显 减少G1期的细胞群体,而增加G2期和M 期的细胞群。 紫杉醇对卵巢癌、乳腺癌及非小细胞肺癌等有突出的 疗效,被誉为近15年来最好的抗肿瘤新药。紫杉特尔 化学结构上属紫杉类药物,作用机制同紫杉醇,其稳 定微管作用比紫杉醇大2 倍,是现有药物中治疗转移 性乳腺癌和非小细胞肺癌最有效的药物之一。 49
第十讲 细胞骨架(cytoskeleton)
1
细胞骨架 (cytoskeleton)
• 概念: 一般是指真核细胞质内的蛋白纤维网架系统。 广义的细胞骨架: 细胞质骨架、细胞核骨架及 细胞膜骨架和细胞外基质; 狭义的细胞骨架: 指细胞质骨架,包括微丝 (肌动蛋白丝)、微管及中间纤维(中间丝); • 功能: 维持细胞形态、保持细胞内部结构的有序性, 还与细胞运动、物质运输、能量转换、信息传 递、细胞分裂、免疫行为、细胞分化等生命活 动密切相关。
第十章-细胞骨架

非肌细胞前缘肌动蛋白的聚合和伪足的形成
(五)微绒毛(microvillus) 是肠上皮细胞的指状突起,用以增加肠上皮细胞 表面积,以利于营养的快速吸收。 微丝束功能:支撑微绒毛,无收缩功能
微绒毛中的微丝和微丝结合蛋白
(六)胞质分裂环
胞质分裂环由大量反向平行排 列的微丝组成,其收缩机制是肌动 蛋白和肌球蛋白相对滑动。
2、Ca2+的释放:肌质网→肌浆
3、原肌球蛋白位移:暴露出肌动蛋白与肌球蛋白 结合位点 4、肌动蛋白丝与肌球蛋白丝的相对滑动:肌球蛋 白沿肌动蛋白丝滑动,水解ATP 5、Ca2+的回收 :收缩停止
结合
分开
-端
+端
+端抬升
构象改变
Pi释放
-端 Ga2+
+端
第二节、微 管(Microtubules)及其功能
促进微管的装配,并使已形成的微管稳定。
三、微管组织中心(MTOC)
◆概念:在生理状态或实验处理时,能够起始微管的 成核作用并使之延伸的细胞结构称为微管组织中心 (microtubule organizing center, MTOC)。
◆常见微管组织中心:
肌肉可看作一种特别富含细胞骨架的效力 非常高的能量转换器,它直接将化学能转变为 机械能。
(一)肌纤维的结构
骨骼肌及肌纤维的结构
粗肌丝与细肌丝的分子结构
(二)肌肉收缩系统中的有关蛋白
①肌球蛋白(myosin) 头部具ATP酶活力,沿微丝从负极到 正极进行运动。 主要分布于肌细胞,有两个球形头部结构域(具有 ATPase活性)和尾部链,多个Myosin尾部相互缠绕,形成 myosin filament,即粗肌丝。 ②原肌球蛋白(tropomyosin, Tm)由两条平行的多肽链形
第十章 细胞骨架

线虫C. elegans细胞中, 微管从中心体处发射出来
四、微管的动力学性质(了解) 五、 微管结合蛋白对微管网络结构的调节
微管结合蛋白(microtubule associated protein, MAP) -通常都是单基因编码,具有一个或数个带正电荷的微管结合域,该结构域 与带负电荷的(微管蛋白的C端所形成的)微管表面相互作用,具有稳定微 管的作用。
粘附
释放
2.钙释放
翘起
力的产生
3. 原肌球蛋白位移
粘附
第二节 微管及其功能
一、微管的结构组成与极性
微管呈中空的管状结构,其外径为24nm,内径为15nm 几乎存在于所有真核细胞中,但大部分微管在细胞质内形成暂时性的结构 间期细胞内的微管、分裂期细胞的纺锤体微管 另一些微管形成相对稳定的“永久性”结构 纤毛内的轴丝微管、神经元突起内部的微管束结构
驱动蛋白沿微管运动的分子模型有两种: ① “步行”(hand over hand) 模型 ② “尺蠖”(inchworm) 爬行模型
引发驱动蛋白沿微管持续向前移动的原因: ① 在每个驱动蛋白分子中有两个马达结构域的化学机械循环是互相协调的 ② 驱动蛋白的马达结构域在ATP酶循环的大部分时间里都与微观紧密结合
(一)肌球蛋白的种类及结构
肌球蛋白是一种特殊的酶,它能通过ATP 的水解引起构象的变化沿微丝运动,把化 学能转变为机械能,因此被称为机械化学 酶。或者称为motor蛋白。这种运动 以肌球蛋白为马达
以微丝为运动轨道 以ATP为能量燃料
马达结构域 - 肌球蛋白超家族成员间最保守的部位。
四、肌细胞的收缩运动
(四)细胞伪足的形成与细胞迁移 细胞运动主要通过肌动蛋白的聚合及与其他细胞结构组分的相互作用实现的。
第十章细胞骨架PPT课件

4.微管组织中心
20
微管在生理状态及实验 处理解聚后重新装配 的发生处称为微管组 织中心(microtubule organizing center,MTOC)。动物 细胞的MTOC为中心体。
21
Ganglion cells from the rat retina in cell culture. Labeled with antibody to microtubuleassociated protein (MAP-2).
Photomicrograph of microtubule-associated protein 2 (MAP2) immunoreactive neurones in the cortex. Cellular immunoreactivity appears as a brown insoluble precipitate when developed by the ABC-HRP method. Counterstained with cresyl violet magnification X42020.
F-actin filaments
containing
tropomyosin,
an elongated protein
which binds actin helix
alo6ng
the
(三) 微丝 结合蛋白
微丝结合蛋白 (microfilamentassociated protein) 参与形成微丝纤维 高级结构,对肌动 蛋白纤维的动态装 配有调节作用。
microtubule
18
(一)成分 微管由两种类型的微管蛋白亚基,
即α微管蛋白和β微管蛋白组成。 微管几乎存在于从阿米巴到高等
细胞生物学:第10章 细胞骨架
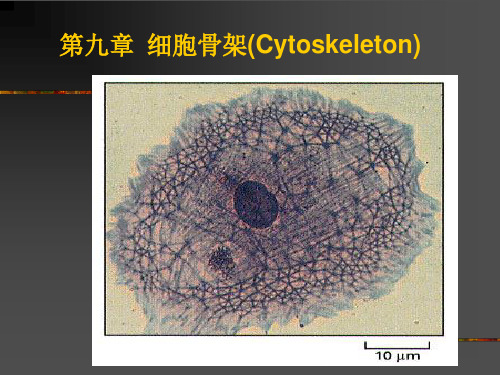
形态
◆ 微管是中空的管状结构
◆ 外径为24nm
◆内径为14nm
◆微管壁厚约5 nm
◆微管的长度变化不定
微管的结构
◆微管是由微管蛋白异源二聚体为 基本构件,螺旋盘绕形成的
◆在每根微管中二聚体头尾相接, 形
成细长的原纤维(protofilament)
◆13条原纤维纵向排列组成微管的壁
微管的结构
微管蛋白(tubulin)
◆交联蛋白(cross-linking protein) ◆纤维割断蛋白(filament-severing protein) ◆膜结合蛋白(membrane-binding protein) ……
(二)非肌肉细胞内微丝及其结合蛋 白形成的特殊结构及其功能
1、细胞皮层 功能:◆维持细胞形态,赋予质膜机械强度 ◆细胞变形运动 ◆胞质环流 2、应力纤维 功能:通过粘着斑与细胞外基质相连,参与细胞形态发 生、分化及组织构建等 3、细胞伪足与细胞迁移 功能:细胞迁移 4、微绒毛 功能:扩大小肠上皮细胞吸收营养物的面积 5、胞质分裂环 功能:参与胞质分裂
肌纤维的结构 肌肉收缩的基本过程
1、肌细胞的结构
肌原纤维的结构
2、由神经冲动诱发的肌肉收缩基本过程
·动作电位的产生 ·Ca2+的释放 ·原肌球蛋白位移 ·肌动蛋白丝与肌球蛋白丝的相对滑动 · 2+的回收 Ca
细 肌 丝 的 分 子 结 构
第二节、微管( Microtubule)
一 微管的结构和类型
中心体与基体中的中心粒
中心体结构(电镜照片)
中 心 粒
(五) 微管的功能
◆支架作用
◆细胞器的定位 ◆细胞内物质的运输 ◆鞭毛(flagella)运动和纤毛(cilia)运动
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
成束蛋白:将相邻的微丝交联成平行排列
如:丝束蛋白、绒毛蛋白、 α-辅肌动蛋白。
凝胶形成蛋白:将微丝连接成网状
如:细丝蛋白
4、交联蛋白
A、成束蛋白将相邻的微丝交联成束状结构。丝束蛋白和绒毛蛋白等交联而成的微丝 束为紧密包装型,肌球蛋白不能进入,无收缩功能;B、由α-辅肌动蛋白交联形成 的微丝束相邻的纤维之间比较宽松,肌球蛋白可以进入与之相互作用,可收缩。 C、细丝蛋白将微丝交联成网状。
三、微丝主要结构成分—肌动蛋白的类型
哺乳动物和鸟类已分离到6种肌动蛋白:4种α-肌动蛋白,分别
为横纹肌、心肌、血管平滑肌和肠道平滑肌所特有。另两种为
β-肌动蛋白和γ-肌动蛋白,存在于所有肌细胞和非肌细胞中。
特点:同源性很高,常作为内参基因。但微小差异可能上的变化。
四、微丝特异性药物
◆细胞松弛素(cytochalasins):可以切断微丝,并结合
马达结构域 2条重链
在心肌、骨骼肌、 平滑肌、收缩环、 张力纤维等产生 强大的收缩力。
内吞作用和吞噬泡运输 细胞内膜泡 和其他细胞 器的运输
部分肌球蛋白超家族成员的结构示意图
(二)肌球蛋白的结构
三个功能结构域:马达结构域、调控结构域和“货物” 结合的尾部结构域。 Ⅱ型肌球蛋白:在肌细胞中,组装成肌原纤维的粗丝, 在非肌细胞中,与收缩环的动态结构以及应力纤维的 活动相关。
(3)动力蛋白
特点:既有与微丝或微管结合的马达结构域,又有与
膜性细胞器或大分子复合物特异结合的“货物”结构
域,利用水解ATP所提供的能量有规则地沿微管或微丝
等细胞骨架纤维运动。
(一)肌球蛋白的种类
组装成粗肌丝的单位,肌球蛋白的头部和组成微丝的肌动蛋白 亚基之间的相互作用导致粗丝和细丝之间的滑动。
踏车行为:在微丝组装过程中,表现微丝的正极由于 肌动蛋白亚基的不断添加而延长,而负极则由于肌动 蛋白亚基去组装而缩短的现象。
肌动蛋白具有ATP酶活性,能催化ATP的水解。肌动蛋白单体在参与微丝的组 装前必须先与ATP结合,组装到微丝末端的肌动蛋白发挥ATP酶的活性,将ATP 水解ADP,并释放磷酸基。 当微丝的组装速度快于肌动蛋白水解ATP的速度时,处于微丝末端的一些肌动蛋白 亚基所携带的ATP还未来得及水解,即有一个由肌动蛋白-ATP亚基所构成的帽。带有 这种帽的微丝比较稳定,可以持续组装。 相反,当末端的肌动蛋白亚基所结合的是ADP时,则构成这段微丝的肌动蛋白 亚基比较容易解聚。
(四)细胞内伪足的形成与细胞迁移
片状伪足和丝状伪足的形成依赖于肌动蛋白的聚合,并由此产 生推动细胞运动的力:
伪足形成的过程:
非肌细胞前缘肌动蛋白的聚合和伪足的形成
伪足形成的分子机制
1.当细胞受到外来信号的刺激时; 2. 位于细胞质膜附近的WASP蛋白将Arp2/3复合物激活; 3.使之成为微丝组装的成核位点,启动微丝的组装; 4.前纤维蛋白可促进结合ATP的肌动蛋白单体在微丝正极端聚合,使 其向细胞质膜一侧延伸;待微丝延伸到一定的程度后, Arp2/3复合 物结合到微丝的侧面; 5.启动新的微丝的组装,形成分支;游离的肌动蛋白单体不断在正极 端而使侧支向细胞质膜处延伸; 6. 在侧支上面再形成新的分支,并继续延伸。
在微丝正极阻抑肌动蛋白聚合,因而导致微丝解聚。
◆ 鬼笔环肽 (philloidin) :是一种由毒蕈产生的双环杆肽,与微丝表面有强亲
和力,防止MF解聚。但不与激动蛋白单体结合。
因此,用荧光标记的鬼笔环肽染色可清晰地显示细胞中微丝的分布。
五、肌球蛋白:依赖于微丝的分子马达
1、在细胞内参与物质运输的马达蛋白: (1)沿微丝运动的肌球蛋白 (2)沿微管运动的驱动蛋白
微管的结构单位:微管蛋白亚基组装。 每个微管蛋白亚基:是由α-微管蛋白和β-微管蛋白结合形成异二 聚体。 α-微管蛋白:有一个GTP结合位点,结合该位点的GTP通常不会被水 解,即为不交换位点; β-微管蛋白:有一个GTP结合位点,结合该位点的GTP可被水解,即 为可交换位点。 微管蛋白:有二价阳离子结合位点,一个秋水仙素结合位点,一个 长春花碱结合位点。
第十章 细胞骨架(Cytoskeleton)
●细胞骨架是指存在于细胞内的蛋白纤维网架结构,
真核细胞中包括微丝、微管和中间丝3种结构组分。
●分别由相应的蛋白亚基组装而成,赋予细胞不同的形态和功能。
1、微丝 2、微管 3、中间丝
免疫荧光染色显示细胞内:A、微丝;B、微管;C、中间丝在体外 培养的小鼠上皮细胞内的分布,以及三种细胞骨架结构的叠加图(D)
二、微丝网络结构的调节与细胞运动
(一)非肌肉细胞内微丝的结合蛋白
1、肌动蛋白单体结合蛋白
胸腺素β4与肌动蛋白 单体结合以后抑制肌动 蛋白参与微丝的组装。 前纤维蛋白与肌动蛋白 单体的底部结合,促进 了微丝正极端的组装, 但阻断了负极断的组装。
2、成核蛋白
成核是肌动 蛋白在体外组装 的限速步骤。在 细胞内肌动蛋白 的组装受外部信 号的调控,其成 核过程收到成核 蛋白Arp2/3复合 物、形成蛋白 (formin)等的 催化。
称的,一端都是α-微管蛋白,而另一端都是β-微管蛋白,从而使整根微管
在结构上呈现极性状态。
结构上的不对称性导致了微管组装时微管蛋白二聚体在两端聚合速度不同, 将组装较快的一端称为正极,而另一端称为负极。微管的极性与微管的动态 性质及功能密切相关。
α/β-微管蛋白二聚体纵向排列而成原纤丝,13根原纤丝合拢后构成微管的管壁; 相邻的原纤丝之间在排列上存在1nm左右的交错,以至微管蛋白沿微管的圆周呈 螺旋排列。
13根微管蛋白亚基组成的环状结构
由于微管组装的基本结构单位是由α/β-微管蛋白组成的二聚体,每一个原 纤丝是由这些二聚体有规律地排列而成,这样每一根原纤丝的两端都是不对
3、加帽蛋白
细胞内微丝的组装一旦停止,其末端的肌动蛋白亚基所携带的ATP 很可能因为水解而使得整个纤维处于不稳定状态;而微丝过度组装不仅 浪费了原材料,也影响细胞的结构和功能。
加帽蛋白:与微丝的末端结合组织微丝解聚或过度组 装的蛋白。
4、交联蛋白
细胞内微丝排列方式主要有两种:束状排列和网状排列。 微丝的排列方式主要由微丝交联蛋白的种类决定。
极性:每个 肌动蛋白单体 周围有4个单体, 上下各一个, 另两个位于一侧。
组装过程:
(1)成核反应:即G-actin先形成数个亚基的低聚物; (Arp2/3与其他5种蛋白质参与) (2)快速延长:当微丝的组装速度快于肌动蛋白水解ATP的 速度时,则表现为持续组装纤维快速延长。 (3)稳定期:肌动蛋白亚基的组装/去组装达到平衡状态, 即组装和去组装的肌动蛋白亚基数目相当,微丝长度几乎保持 不变。
(五)微绒毛
轴心一束平行排列的微丝,微丝束正极指向微绒毛的顶端,其下终止于端网结构
(六)胞质分裂环
胞质分裂环(收缩环):是有丝分裂末期在两个即将分裂的子细胞之 间的质膜内侧形成的一个起收缩作用的环形结构。
收缩换由大量平行排列,但极性相反的微丝组成。胞质分裂的动力来源于收缩环上肌球蛋白所介导的极性相反 的微丝之间的滑动。
肌肉收缩系统中的有关蛋白
①肌球蛋白(myosin),其头部具ATቤተ መጻሕፍቲ ባይዱ酶活力,依赖于微丝的分子马达。
· Myosin Ⅱ主要分布于肌细胞,有两个球形头部结构域 ( 具有 ATPase 活性 ) 和尾部链 , 多个 Myosin尾部相互缠绕,即粗肌丝。
②原肌球蛋白(tropomyosin, Tm)由两条平行的多肽链形成α-螺旋构型,位于肌动蛋白螺旋 沟内,结合于细丝, 调节肌动蛋白与肌球蛋白头部的结合。 ③肌钙蛋白 (Troponin, Tn) 为复合物,包括三个亚基: TnC(Ca2+ 敏感性蛋白 ), 能特异与 Ca2+结合; TnT(与原肌球蛋白结合); TnI(抑制肌球蛋白ATPase活性)
组成细胞皮层的骨架系统的功能:
细胞内多种运动,如胞质环流、阿米巴运动、变
皱膜运动、吞噬以及膜蛋白的定位等都与皮层内肌动 蛋白的溶胶态-凝胶态转化有关。
(三)应力纤维
体外培养的细胞在基质表面铺展时,常在细胞质膜的 特定区域与基质之间形成紧密黏附的粘着斑。 应力纤维:在紧贴黏着斑的细胞质膜内侧有大量成束 状 排列的微丝,这 种微丝束称为应 力纤维。
一、微丝的组成及其组装
(一)结构与成分
肌动蛋白(actin) 球状(电镜),中间有裂缝 (经X射线衍射) 肌动蛋白单体(G-actin),由 G-actin组装而成纤维状 裂缝内部:一个核苷酸(ATP或 ADP)和一个二价阳离子(Mg2+或 Ca2+)结合位点。
一、微丝的组成及其组装
(二)微丝的组装及其动力学特征 低浓度的Na+、K+时,辅于适当浓度的Ca2+,微丝趋向于解聚; 较高浓度Na+、K+时,当辅于ATP、Mg2+,溶液中G-actin则趋向于 组装成F-actin.
由2条重链和4条轻链组成。 球形头部的马达结构域,包含一个肌动蛋白亚基结合位点和ATP结合 位点。 当ATP与肌球蛋白亚基结合时,裂隙稍稍开启,马达结构域与微丝的 亲和力降低。
调控结构域是连接马达结构域和尾部杆状区的一段α螺旋, 发挥杠杆作用。
六、肌细胞的收缩运动
(一)肌纤维的结构 肌纤维(骨骼肌细胞):是胚胎期由大量的单核成肌细胞融合 而成,但细胞核仍保留在肌纤维内。由数百条更细的肌原纤维 组成的集束。 每根肌原纤维由称为肌节的收缩单位呈线性重复排列而成。 每个肌节表现出特征性的带型。 肌原纤维的带状条纹由粗肌丝和细肌丝的纤维有序组装而成。 肌球蛋白的头部突出于粗肌丝表面,并可与细肌丝上肌动蛋白 亚基结合,构成横桥
