碳族和硼族元素练习
高三化学专题训练(碳族元素) doc

高三化学专题训练(碳族元素)座号_________姓名____________一、选择题1.1985年,科学家发现了一种新的单质碳系列—碳笼,其中最丰富的是C60。
根据其结构特点,科学家称之为“足球烯”,这是一种分子晶体。
据此推测下列说法中不正确的是()A.金刚石、石墨、足球烯都是碳的同素异形体 B.一定条件下,足球烯可发生加成反应C.石墨、足球烯均可作为高温条件下的润滑材料D.足球烯在苯中的溶解度比在酒精中的溶解度大2.用适量的原料经玻璃熔炉反应后制取的普通玻璃中,含钠9.6%,含钙8.4%,含硅35.1%。
习惯上可用下列哪个化学式来表示该玻璃的组成()A.Na2O·CaO·SiO2 B.2Na·CaO·6SiO2C.Na2O·CaO·6SiO2 D.Na2O·CaO·5SiO23.2MgO·SiO2中的酸根阴离子是()A.SiO32- B.Si2O64- C.SiO44- D.Si2O32-4.将足量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分燃烧,最后所得的固体物质是()A.Na2SiO3 B.Na2CO3、Na2SiO3 C.Na2CO3、SiO2 D.SiO25.下列说法正确的是(N A表示阿佛加德罗常数)()A. 常温下常压下,3g甲醛气体含有的原子数是0.4N AB. 7.59gCuO被CO完全还原,转移的电子数为0.2N AC. 100mL1mol/L的Na3PO4溶液中含有离子数多于0.4N AD.60gSiO2和12g金刚石中各含有4N A个Si—O键和4N A个C—C键6.2002年12月31日,世界上第一条商业磁悬浮铁路在上海投入运营。
磁悬浮的核心技术是利用超导体的反磁性,以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3O x。
现欲合成0.5mol此高温超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是()A.0.50、0.50、0.50 B.0.50、1.0、1.5C.0.25、1.0、1.5 D.1.0、0.25、0.177. 砖瓦是用含铁元素等杂质的粘土隔绝空气烧制而成的。
元素知识点

一、学习要点1一、学习要点1. 氮族、碳族和硼族元素的通性。
2. 碳、硅、硼的基本性质和成键特征。
3. HNO2及其盐的制备和性质,HNO3的结构、制法和性质,硝酸盐的化学性质。
4. CO、CO2、CO32--和乙硼烷的结构。
5. 碳酸、碳酸盐、硅酸、硅酸盐、锡、铅氢氧化物及其盐的性质。
6. 乙硼烷、硼酸、硼砂、氢氧化铝及其盐的性质。
7. 磷的氧化物、含氧酸(正、焦、偏、亚、次)及其盐的化学性质。
8. 砷,锑,铋氧化物及其水合物的性质和递变规律。
二、练习题1.Ag+分别与NaH2PO4和Na2HPO4溶液作用,将生成什么沉淀?2. 为什么单质铝不溶于水,却易溶于浓Na2CO3和NH4Cl溶液中?3.试说明下列现象的原因:(1)有水玻璃的试剂瓶长期敞开瓶口,水玻璃变浑浊。
(2)CO2和SiO2的组成相似,在常温常压下CO2为气体而SiO2为固体。
4.碳和氧的电负性差很大,但CO分子的偶极矩却很小,为什么?5. 配制纯净的SnCl2溶液时,应如何防止它被氧化和水解?6. 硼酸为何具有酸性?是几元酸?通常如何增强它的酸性?7.排列出下列磷的含氧酸酸度由强到弱的顺序:H3PO4、H3PO2、H3PO3、H4P2O78. 说明上述酸各是几元酸?9. 什么是“三中心两电子”键,它与通常的共价键有什么不同?10. 为什么PCl5可以稳定存在,但现在却未制得NCl5?11. 给出下列碳酸盐的热稳定性顺序:⑪BeCO3,MgCO3 , CaCO3 , SrCO3 , BaCO3⑫Na2CO3,NaHCO3,H2CO312. 什么是对角线规则?并说明锂和镁的相似性,铍和铝的相似性。
13. 完成下列化学反应方程式:《无机化学》第十章(碱金属和碱土金属)学习要点和练习题答案二、练习题1. 写出分子式生石膏CaSO4·2H2O 重晶石BaSO4方解石CaCO3天青石SrSO4明钒KAl(SO4)2·12H2O2. 根据碱金属的性质的递变规律,预测钫的下列性质:主要物理性质(密度、硬度、熔点);在空气中燃烧的主要产物;与水反应的情况;FrClO4在水中的溶解性如何?答:1、钫的密度不大,与铯接近;硬度很小,很容易用刀子切割;熔点很低,室温下即可熔化。
高三上学期化学单元测试—— 碳族元素

高三上学期化学单元测试——碳族元素注意事项:1.本试题分为第Ⅰ卷和第Ⅱ卷两部分,第Ⅰ卷为选择题,共48分;第Ⅱ卷为非选择题,共52分。
满分100分,考试时间为90分钟。
2.答第Ⅰ卷前务必将自己的姓名、考号、考试科目涂写在答题卡上。
考试结束,试题和答题卡一并收回。
3.第Ⅰ卷每题选出答案后,都必须用2B铅笔把答题卡上对应题目的答案标号(ABCD)涂黑,如需改动,必须先用橡皮擦干净,再改涂其它答案。
第Ⅰ卷(选择题,共48分)一、选择题(每题只有一个正确选项)1.1985年,科学家发现了一种新的单质碳形成:碳笼,其中最丰富的是C60,根据其结构特点,科学家称之为“足球烯”,它是一种分子晶体,据此推测下列说法中不正确的是()A.金刚石、石墨、足球烯都是碳的同素异形体B.一定条件下,足球烯可发生加成反应C.石墨、足球烯均可作为高温条件下的润滑材料D.足球烯在苯中的溶解度比在酒精中的溶解度大2.下列关于硅和硅的化合物叙述不正确的是()①硅晶体的结构和金刚石相似,都是原子晶体;②硅是地壳中含量最多的元素;③单晶硅是良好的半导体材料;④二氧化硅是制造光导纤维的重要原料;⑤二氧化硅分子是由两个氧原子和一个硅原子组成的;③二氧化硅是酸性氧化物,它不溶于任何酸。
A.①②③B.①⑤⑥C.③④⑤D.②⑤⑥3.生石灰中往往含有CaCO3和SiO2杂质,若检验是否存在这两种杂质,最适宜的试剂是()A.氟化氢B.浓硫酸C.盐酸D.苛性钠4.某氧化物X难溶于水,能熔于熔融态的烧碱,生成易溶于水的化合物Y,将少量Y溶液滴入盐酸中,最终能生成一种白色的胶状沉淀,则X是()A. MgOB. Al2O3C. SiO2D. P2O55.将一定量的二氧化碳通入含有7.4g Ca(OH)2的澄清溶液中,最后得到5.0g白色沉淀,则通入的二氧化碳的物质的量可能是()A. 0.05molB. 0.10molC. 0.15molD. 1.0mol6.10g含杂质的碳酸钙和足量的盐酸反应,产生标况下2.24升CO2,试推断杂质的组成是()A.碳酸镁和二氧化硅B.碳酸镁和碳酸氢钾C.碳酸钾和二氧化硅D.碳酸氢钾和二氧化硅7.石榴石是石榴石族矿物的总称,颜色随成分的不同而变化,其组成可以表示为A3B2(SiO4)3,式中A、B均为金属元素,则A、B对应的化合价依次为()A.+2,+3B.+3,+2C.+2,+2D.+3,+38.石棉在使用不当时,也会污染环境,使吸入石棉纤维者易患肺癌。
第1516章 碳硼族元素习题.doc

D,不水解第15、16章 碳硼族元素习题一、选择题1. 硼的成键特征是()A, 共价性 B,缺电子性 C.多面体性 D,前三者均是 2. 硼成键为SP2杂化,且含三个单键,1个兀46键的化合物是()A. B 2O 3B. BF4-C. BO 33-D. B 2H 63. 硼的独特性质表现在()A. 能形成正氧化态化合物,如BN ,其它非金属则不能B. 能生成大分子C. 能形成负氧化态化合物,其它金属则不能D. 在简单的二元化合物中总是缺电子的4. 在a 菱形硼的Bn 单元中,表现出硼原子是缺电子原子性质的原子个数是()A. 3 个B. 6 个C. 9 个D. 12 个5. 下列分子或晶体,何者的结构表现出硼原子的缺电子性.( )A. B 2O 3B. NaBO 2C. H3BO3D. H3BO3E. B 2H 66, 下列关于单质硼化性的描述,错误的是( )A. 常温下不活泼,但高温下可与许多非金属反应B, 与碳相似,炽热的硼可与水蒸气反应C. 可与盐酸反应 D,可与碱反应7. 硼与浓NaOH 反应,所得的含硼产物是( )A. NaBO 2B. Na 3BO 3C. B 2O 3D. H3BO38. 硼与浓硝酸反应,所得的含硼产物是( )A. B (NO 3)3B. H3BO3C. BND. B 2O 39. 乙硼烷( )A. 是强氧化剂B.是强还原剂C10. 下列对硼酸性质的描述不正确的是( )A, 硼酸是三元酸 B.硼酸是一元路易斯酸C. 硼酸与多元醇反应,生成配合物,使酸性增强D. 硼酸的溶解度小11. 硼酸可缩合成( )A, 链状或环状多硼酸 B,笼状多硼酸C.蛛网状多硼酸D.片层状多硼酸12,在硼酸中加入下列何种物质,可以提高其酸性()A.NaOHB. H3PO4C. C2H5OH D,多羟基醇13.鉴别硼酸根时,可用的物质是()A.CH3OHB. CH3OCH3C. HOCH2CH2OHD. CH3CHO14.H2CO3 H3BO3 H2SiO3的酸性强度顺序是()A.H2CO3<H3BO3<H2SiO3B.H2CO3>H3BO3>H2SiO3C.H2CO3>H2SiO3>H3BO3D.H2CO3<H2SiO3<H3BO315.在H3BO3中加入Na2CO3可制得()A.Na3BC)3B. NaBC)2C. NaqBzOsD. N3.2840716.H3BO3与过量的强碱NaoH作用河得到()A.N^BOsB. NaBC)2C. NaqBzOsD. NazBqO?17.硼砂的水溶液呈()A,碱性B,中性C.酸性D.弱酸性18.用盐酸滴定硼砂水溶液至恰好中和时,溶液呈()A,中性B.弱酸性C.弱碱性D,强碱性19.105BA08 下列关于硼酸结构的叙述错误的是()A.硼酸为白色片状晶体,其结构单元为B(OH)3三角形B.硼原子通过SP3杂化轨道与氧原子成键C.分子间通过氢键形成接近于六角形的对称层状结构D.层与层间以范德华力联系20.在分析化学中,硼砂被用来作标准溶液是因为它,A,易水解B,在干燥空气中易风化C.溶融态时可溶解金属氧化物D,稳定,易提纯21.反应H3BO3+3C2H5OH = B(OC2H5)3+3H2O(案件浓硫酸点燃).用于()A.硼化物的定性分析B.硼酸的定量分析C,两者均是D,两者均否22.CO2泡末灭火器的反应原理是()A.HCCh-离子的水解B,A13+水解C,HCO3- A13+双水解,相互促进D,反应生成A1(HCO3)3,然后水解23.硼族元素最重要的特征是()A.共价性特征B.缺电子性特征)甲酸脱水 水蒸气与炽热的炭反应) C.加合性 D.极性C.共价性和缺电子性特征D.易形成配合物和自身聚合的特征 24.硼的缺电子性表现在( ) A,易形成缺电子多中心键及配合物 B,易形成含桥键的化合物C.易形成不同类型杂化,形成化合物D.易形成共价化合物 25. 硼族元素的原子都属缺电子原子,而硼原子的缺电子性在形成化合物时表现 得尤为突出,其原因是() A, 原子的半径最小,电离能最高 B.原子的半径最小,电负性最大C.原子的非金属性最强D.原子半径小,电负性大,有空2P 轨道 26. 某白色晶体X 微溶于水,其水溶液呈弱酸性.在水溶液中加入甘油酸性增强,将 X强热,得固体Y 和气体C,C 冷却后成无色液体.Y 在熔融时可溶解固体NiO, 在X 的水溶液中加甲醇和浓硫酸,点燃混合物.产生绿色火焰,X,Y 分别是 ( )A. H 2SiO 3B. B 2O 3C. H2C2O4D. H3BO3E. N3.2840727, 从碳到铅,当原子序数增加时,+2氧化态的稳定性()A,增强 B,减弱 C,无变化 D.无法确定28. 碳族元素中,碳和其它元素相比性质差异较大是因为() A,原子量最小B,核电荷最少 C. 原子半径最小,电负性最大,电离能最高,又没d 轨道 D. 原子半径最小29. 实验室里用哪个反应制备CO?( A,分解草酸 B. C.分解蹶基镣D. 30. CO 对人体的毒性,源于它的( A,氧化性 B,还原性31. 1下列气体中容易与过渡金属形成配合物的是( )A. NO,B. SO 2C. COD. CO 232, 最常用实验室制CO 2的反应是( )A. CaCO3+H 2SO4=CaSO 4+CO2+H 2OB. CaCO3+2HCl=CaCl 2+CO 2+H 2OC. 3CaCO 3+2H3PO4=Ca3(PO4)2+3CO 2+3H 2OD. CaCO 3=CaO+CO 233. 气体X 和红热的炭反应,得到一种无色气体Y,Y 和CuO 在加热条件下反应又得到X和Cu,则X和Y依次为()A. CO,CO2B. CO2,COC.田0(气)D. C)2,C034.CO通过PdCb溶液生成黑色沉淀,此法可检出CO,此时CO的作用是()A,氧化剂B,还原剂C.配位剂D.催化剂35.CO分子的偶极矩较小,几乎为零,是因为()A.碳和氧的电负性差值小B.碳原子存在孤对电子C.氧原子是兀配键电子对接受体D.氧原子既吸引o键电子对,又是兀配键电子对的给予体,使氧原子略带正电荷36.干冰不经熔化而升华成气体,此事实说明()A. C02热稳定性差B. C02的键能小C. C02的分子对称D.干冰是分子晶体37.CO能与一些过渡元素的金属原子M形成稳定的蹶合物,原因是()A.CO与M形成了共价参键B.CO与M形成了螯合的两个。
碳族元素练习25题

碳族元素练习25题1、下列碳酸盐中最容易热分解的是()A、CaCO 3B、BaCO 3C、MgCO 3D、SrCO 3正确答案:C解析:离子极化2、下列化合物中最易水解的是()A、SiCl 4B、CCl 4C、CF 4D、SiF 62-正确答案:A解析:非金属化合物的水解机理解释3、在下列氧化物中,氧化性最强的是()A、CO 2B、PbO 2C、GeO 2D、SnO 2正确答案:B解析:惰性电子对效应4、下列各组化合物热稳定性关系正确的是()A、Na 2CO 3>Na 2SO 4B、K 2CO 3>Ag 2CO 3C、NaHCO 3>Na 2CO 3D、(NH 4)2CO 3>ZnCO 3正确答案:B解析:离子极化5、下列分子中偶极矩为零的是()A、SO 2B、CS 2C、PBr 3D、SF 4正确答案:B解析:通过预测分子的空间结构,判断是否非极性分子6、下列盐中热稳定性顺序正确的是()A、NaHCO 3<Na 2CO 3<BaCO 3B、Na 2CO 3<NaHCO 3<BaCO 3C、BaCO 3<NaHCO 3<Na 2CO 3D、NaHCO 3<BaCO 3<Na 2CO 3正确答案:D解析:离子极化7、ⅣA 族元素从Ge 到Pb,下列性质依次增大的是()A、+2氧化态的稳定性B、二氧化物的酸性C、单质的熔点D、氢化物的稳定性正确答案:A8、下列硫化物中能溶于Na 2S 溶液中的是()A、SnSB、SnS 2C、PbSD、Bi 2S 3正确答案:B9、下列各组中正确表示了两对物质还原性强弱的是()A、Cu +<CuCl;Pb 2+<Sn 2+B、Cu +>CuCl;Pb 2+<Sn 2+C、Cu +<CuCl;Pb 2+>Sn 2+D、Cu +>CuCl;Pb 2+>Sn 2+正确答案:B解析:CuCl 是难容盐,Cu+的浓度低,据nest 方程,Cu2+/CuCl 的E>Cu2+/Cu+的E 10、下列各组物质的性质递变顺序正确的是()A、FeCl 2<FeCl 3(熔点)B、Pb(Ⅱ)>Pb(Ⅳ)(稳定性)C、Si<P 4(硬度)D、Na>Al(密度)正确答案:B解析:A 错误:Fe3+离子极化强11、在下述溶解度大小的关系中,不正确的是()A、AgF>AgClB、Ca(H 2PO 4)2>CaHPO 4C、NaHCO 3>Na 2CO 3D、Ba(OH)2>Mg(OH)2正确答案:C12、配制SnCl 2溶液时,必须加入()A、足量的水B、盐酸C、碱D、Cl 2正确答案:B解析:防止Sn2+水解13、不能用H 2S(在0.3mol·L -1HCl 溶液中)分离的离子对是()A、Bi 3+、Pb2+B、Zn 2+、Cu2+C、Ni 2+、Cd 2+D、Ni 2+、Cu 2+正确答案:A解析:硫化物的溶解性14、铅易溶于稀的()A、醋酸B、硫酸C、盐酸D、磷酸正确答案:A解析:在B、C、D 中生成沉淀15、在下列物质中,水解度最大的是()A、FeCl 3B、FeCl 2C、BeCl 2D、BCl 3正确答案:D16、在下列盐中,能与碳酸钠溶液作用,生成沉淀,而且沉淀又能溶于氢氧化钠溶液的是()A、AgNO 3B、FeCl 2C、AlCl 3D、Ba(NO 3)2正确答案:C17、下列碳酸盐的热稳定性顺序正确的是()A、CaCO 3>K 2CO 3>ZnCO 3>(NH 4)2CO 3B、ZnCO 3>K 2CO 3>CaCO 3>(NH 4)2CO 3C、K 2CO 3>CaCO 3>ZnCO 3>(NH 4)2CO 3D、CaCO 3>K 2CO 3>(NH 4)2CO 3>ZnCO 3正确答案:C18、碳最多能与四个氟原子形成CF 4,而硅却能与六个氟原子形成SiF 62-,对于这点不同合理的解释是()A、硅的电离能比碳小B、硅的化学活泼性比碳强C、硅原子具有空的外层d 轨道,而碳原子没有D、化合前碳原子的d 轨道是充满的,而硅原子的d 轨道是空的正确答案:C19、SiCl 4在潮湿空气中冒“白烟”,这是因为()A、SiCl 4不稳定而分解为Cl 2和SiB、SiCl 4发生水解,生成SiO 2和HCl 气体C、SiCl 4发生水解,生成H 4SiO 4和HCl 气体D、SiCl 4化学活性很大,被O 2氧化为SiO 2和Cl 2O正确答案:C20、分子筛是一类多孔性的()A、碱金属硅酸盐B、碱金属铝酸盐C、铝硅酸盐D、硅烷衍生物正确答案:C21、下列气体中能用氯化钯(PdCl 2)稀溶液检验的是()A、O 3B、CO 2C、COD、N 2正确答案:C22、常温下不能稳定存在的是()A、GaCl 4-B、SnCl 4C、PbCl 4D、GeCl 4正确答案:C解析:惰性电子对效应23、下列物质中,酸性最强的是()A、H 2SnO 3B、Ge(OH)4C、Sn(OH)2D、Ge(OH)2正确答案:B24、下列化学式中代表金刚砂的是()A、Al 2O 3B、CaC 2C、SiO 2D、SiC正确答案:D25、某黄色固体化合物,不溶于热水,溶于热的稀盐酸,生成一橙色溶液,当所得溶液冷却时,有一白色沉淀析出,加热该溶液后白色沉淀又消失。
第12章 氮族碳族和硼族元素 习题参考答案

第12章氮族、碳族和硼族元素习题参考答案1. (1)解:3 + HClNH4Cl NH 3 + NH4HSO4(NH4)2SO4 NH 2O3 + N2 + 4H2O (NH4)2Cr2O7 Cr(2)解:2KNO3 2KNO2 + O2 2Cu(NO3)2 2CuO + 4NO2 + O22AgNO3 2Ag + 2NO2 + O25NO3- + 2Mn2+ + 3H2O2.解:(1) 5NO2-+ 2MnO4- + 6H+2? 3NO2-+ Cr2O7+ 8H+ →3NO3- +2Cr3++7H2O(2) 2NO2- + 2I- + 4H+(3) HNO2+NH33.解:(1) NH4Cl (NH4)2SO4(2)KNO2H2SO4 2NO↑+ I2 + 2H2O N2+ 2H2OBaCl2无现象产生白色沉淀(BaSO4)产生蓝色溶液(N2O3)、红棕色气体(NO2)无现象产生黄色沉淀(As2S3) KNO3(3)AsCl3SbCl3H2S产生橙红色沉淀(Sb2S3)产生黑色沉淀(Bi2S3) BiCl34.解:(1)S +2HNO3(浓) (2)4Zn + 10HNO3(很稀) (3)3CuS + 8HNO3 (4)PCl5+4H2OH2SO4 + 2NO↑4Zn(NO3)2 + NH4NO3 + 3H2O3Cu(NO3)2 + 3S↓ + 2NO↑ + 4H2OH3PO4+ 5HCl(5)2AsO33- + 3H2S + 6H+(6)AsO43- + 2I- + 5H+(8)Sb2S3 + 3S2-5.解:(1)NH4+NaOHH2SO4NH3O2Pt As2S3↓ + 6H2O H3AsO3 + I2 + H2O2MnO4- + 5Bi3+ + 5Na+ + 7H2O(7)2Mn2+ + 5NaBiO3 + 14H+ 2SbS33-NOO2 H2(Fe)纯O2高温高压燃烧N2NH3NO2Cu(浓HOHNO3)2Zn(稀HNO3)HNO3NH3N2OKIHNO2Cu(稀HNO3)NH4NO3H2SO4H2SO4(浓)NaOHO2NaNO2NaNO3H3AsO4H2S(HCl)As2S5Na2SHClNa3AsS4(2)AsCl3H2SNa3AsS3HClNa2SAs2S3H2O浓HClH3AsO3I2(pH=5~9)KI(pH<0.5)(3)Na3SbO3HCl(适量)NaOHSb(OH)3HClNaOH(过量)SbCl3H2SH2OHClNa2SHClSbOCl (4)Cl2(NaOH)NaBiO3Sb2S3Na3SbS3(NaOH)MnSO4 Cl2(HNO3)Bi(OH)3HNO3NaOHBi(NO3)3H2OHNO3BiONO36.解:A是AsCl3,B是AgCl,C是[Ag(NH3)2]Cl,D是As2S3,E是(NH4)3AsS4,F是As2S5,G是H2S。
元素化学 硼族、碳族元素

(2)B、C族元素的成键特征 ) 、 族元素的成键特征
元素 B 成键特征 Al3+ sp CO、CO2 、 sp2
石墨, 石墨,大π
Al
C
Si
离子键
sp2 BF3 共价键
sp2 AlCl3
sp3 SiO2 硅氧四面体, 硅氧四面体, 巨型分子
缺电子特征: 缺电子特征: 桥键 配位键
(作为中心离子) 作为中心离子)
(1)性质 )
大多数硼烷易挥发(但B10H14的熔、沸点都较高 大多数硼烷易挥发( 的熔、 在常温下为固体) , 在常温下为固体); • 所有挥发性硼烷都有毒; 所有挥发性硼烷都有毒 有毒; 稳定性很 • 多氢的硼烷BnHn+6热稳定性很低; 多氢的硼烷B • 少氢的BnHn+4对热较稳定; 少氢的B 对热较稳定; • 几乎所有硼烷都对氧化剂极为敏感; 几乎所有硼烷都对氧化剂极为敏感; • 除B10H14 不溶于水且几乎不与水作用外 , 其他 不溶于水且几乎不与水作用外, 所有硼烷在室温都与水反应而产生硼酸和氢 ; •BnHn2 - 阴离子的化学性质比相应的中性硼烷稳 B 定。
2.B、Al的缺电子性质及对比: 、 的缺电子性质及对比 及对比: • 单质 的多中心键(缺电子之故); 单质B的多中心键 缺电子之故); 的多中心键( • 硼烷中的氢桥键与多中心少电子键; 硼烷中的氢桥键与多中心少电子键; • 硼酸的酸式电离: 硼酸的酸式电离: OH
B(OH)3 +H2O → [HO-B ← OH]- +H+
OH • 卤化硼和卤化铝的特征:为路易斯酸,可以形 卤化硼和卤化铝的特征:为路易斯酸, 成加合物。酸性: 成加合物。酸性:BF3>BCl3>BBr3>BI3(?)
大学无机化学第17章 硼族元素习题解答
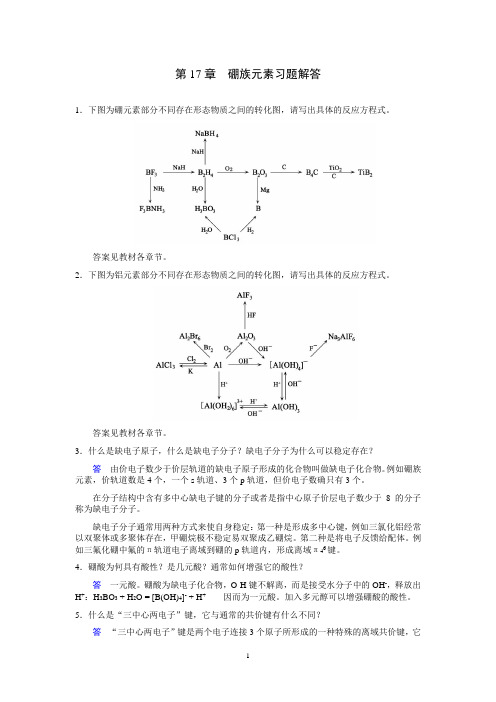
第17章硼族元素习题解答1.下图为硼元素部分不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
2.下图为铝元素部分不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
3.什么是缺电子原子,什么是缺电子分子?缺电子分子为什么可以稳定存在?答由价电子数少于价层轨道的缺电子原子形成的化合物叫做缺电子化合物。
例如硼族元素,价轨道数是4个,一个s轨道、3个p轨道,但价电子数确只有3个。
在分子结构中含有多中心缺电子键的分子或者是指中心原子价层电子数少于8的分子称为缺电子分子。
缺电子分子通常用两种方式来使自身稳定:第一种是形成多中心键,例如三氯化铝经常以双聚体或多聚体存在,甲硼烷极不稳定易双聚成乙硼烷。
第二种是将电子反馈给配体。
例如三氟化硼中氟的π轨道电子离域到硼的p轨道内,形成离域π46键。
4.硼酸为何具有酸性?是几元酸?通常如何增强它的酸性?答一元酸。
硼酸为缺电子化合物,O-H键不解离,而是接受水分子中的OH-,释放出H+:H3BO3 + H2O = [B(OH)4]- + H+因而为一元酸。
加入多元醇可以增强硼酸的酸性。
5.什么是“三中心两电子”键,它与通常的共价键有什么不同?答“三中心两电子”键是两个电子连接3个原子所形成的一种特殊的离域共价键,它是缺电子原子的一种成键特征。
它与通常的共价键的区别,在于它是一种缺电子的桥键,而一般的共价键是由两个原子共用两个电子所形成的。
6.铝在什么情况下生成致密的钝化膜,其应用如何?钝化膜又在什么情况下容易被破坏?答铝在空气中由于表面会生成致密的氧化膜而阻止进一步的反应,不易受到腐蚀,常被用来制造化学反应器、医疗器械、冷冻装置、石油精炼装置、石油和天然气管道等。
铝但遇到冷的浓硝酸或浓硫酸时,由于在金属表面生成薄而极其致密的氧化物薄膜,而发生钝化。
食盐可腐蚀铝表面的氧化膜,因此铝制器皿不宜长期存放咸的菜品等。
铝置于水中会生成紧密而很难溶解的氢氧化铝层。
高三化学训练题碳族元素训练题(1) 习题精练

高三化学训练题碳族元素训练题(1)一.选择题(包括5小题,每题只有一个正确答案)1.在玻璃、水泥工业生产中,都需要用的原料是()A. 石灰石B. 纯碱C. 粘土D. 石英2.普通玻璃的性质是()A. 没有固定的熔点B. 能耐骤冷、骤热的变化C. 肯定有固定的熔点D. 有效弱的导电性3.四种晶体:①干冰②氯化钠③钠④二氧化硅,它们的熔点由低到高的顺序是()A. ④②③①B. ①②③④C. ③①②④D. ①③②④4. 下列叙述正确的是()A. SiO2溶于水显酸性B. CO2通入硅酸钠溶液中可以得到原硅酸C. SiO2是酸性氧化物,不溶于任何酸D. 硅酸的酸性强于碳酸5.同温同压下,等质量的二氧化硫和二氧化碳相比,下列叙述正确的是()A. 与过量石灰水都生成同物质的量沉淀B.密度比为16:11C. 体积比为1:1D. 原子个数比为2:3二、选择题(本题包括15小题,每小题有一个或两个选项符合题意)6.下列能发生的反应中,离子方程式正确的是( )A. 氢氧化钡溶液跟稀硫酸混合:Ba2++SO42—= BaSO4↓B. 氯化镁溶液中通人二氧化碳:Mg2++CO2十H2O=MgCO3↓+2H+C. 足量氯气通人溴化亚铁溶液中:2Fe2++4Br—+3Cl2= 2Fe3++2Br2+6Cl—D. 碳酸钙和盐酸混合:CaCO3+2H+=Ca2++CO2↑+H2O7.在反应SiO2+2C 高温Si+2CO↑中,氧化剂和还原剂的质之比是()A. 2:1B. 5:2C. 1:2D. 1:18.下列物质:①SiO2 ②晶体硅③金刚石④CH4⑤NH4+⑤CHCl3⑦NH3,其中晶体或分子的空间结构均不属于正四面体的是( )A. ①③⑤B. ②④⑥C. ①⑥⑦D. ⑥⑦9.通入下列气体后,溶液不会产生浑浊的是( )A.CaCl2溶液中通入SO2B. 氢硫酸中通入Cl2气C. Na2SiO3溶液中通入CO2D. BaCl2溶液通入CO210.生产水泥的过程中,在熟料里加入适量的石膏,其作用是()A.调节水泥的硬化速率 B.增加水泥的强度C.使水泥变得软些 D.增加水泥的可塑性11. 能证明SO2有漂白性的是()A.将SO2通人酸性KMnO4溶液后紫色稍失B.向显红色的酚酞溶液中通入SO2后,红色消失C. 向品红溶液中通入SO2通后,红色消失D. 将SO2通入溴水后,橙色消失12. 下列说法正确的是()A. 将H2S通入CuSO4溶液后,无任何变化B. SO2跟H2O2反应生成H2SO4,反应中SO2表现出还原性C. 除去SO2中少量SO3,可将混合气通过水D.氨催化氧化制HNO3时,吸收塔的尾气用稀H2SO4处理13. 处于固态物质的四氯化硅,下列四项性质的叙述正确的是()A. 由分子间力结合,熔点很低B. 电的良导休,熔点在1000C左右C. 由共价键组成的网状晶体熔点很高D. 非导电体,但熔融后可以导电14.可以说明常温下SiO2是坚硬固体而CO2是气体的原因是()A. 硅的非金属性比碳弱B.SiO2是原子晶体,CO2是分子晶体C. SiO2里硅与氧结合的化学键和CO2中碳与氧结合的化学键不同D. Si-O键比C=O键能大15下列物质①活性炭②氯气③二氧化硫④漂白粉⑤过氧化钠,都能使品红溶液褪色,但褪色过程不是氧化-还原反应的是()A. ①③B. ①④⑤C. ②③D. ③⑤16.一定量氯酸钾加入到浓盐酸中发生如下反应:KC1O3+6HC1=KCl+3Cl2↑+3H2O,其中被氧化的元素和被还原的元素间质量比为()A. 6:1B. 1:6C. 5:1D.3:217,a、b、c是元素周期表中相邻的三种短周期元素,已知a、b同周期,b、c同主族,它们的核电荷数按a、b、c顺序增大,其质子总数为28,则这三种元素是()A. Li、Be、MgB. B、C、SiC. C、N 、PD. O、F、Cl18. 无色透明的酸性溶液中,可以大量共存的离子组是()A. NO3—、SiO32—、Na+B. HCO3—、Cl—、SO42—C. Na+、MnO4—、NO3—D. Al3+、SO42—、Mg2+19,能说明碳酸的酸性比硅酸强的事实是()A . CO2通入Na2SiO3溶液中生成白色胶状沉淀B. CO2溶于水可生成碳酸而SiO2不溶于水,也不跟水反应生成硅酸C. 碳酸易溶于水而硅酸难溶于水、D. SiO2和Na2CO3在高温下反应生成Na2SiO3和CO220. 大气中CO2增多,会引起“温室效应”你认为目前大气中的CO2主要来源是()A.植物的呼吸与植物腐败放出CO2B.人口增长呼出CO2气体量增大C.工业上大量燃烧含碳燃料D. 建筑工业的发展使大量碳酸盐分解三. 选择题(本题包括6小题,每小题只有一个正确答案)2l.下列说法正确的是()A.二氧化硅是原子晶体,所以“SiO2”仅表示晶体中Si原子与O原子的个数比为1:2.而不是分子式B. 石英玻璃的膨胀系数是普通玻璃的1/18.故不能经受温度的剧变C. 二氧化硅是酸性氧化物是硅酸酸酐,所以二氧化硅与水化合可生成硅酸D. 二氧化硅的熔点比二氧化碳高,原因是:要使二氧化硅熔化或气化必须克服Si-O共价键,而使CO2熔化或气化只克服范德华力就可以了22.下列说法正确的是( )①若证明生石灰中是否混有石英和石灰石,可向混和物中加入足量盐酸,看是否有气体生成和是否有剩余固体存在,此剩余固体可溶于热的浓NaOH溶液②水玻璃是一种矿物胶,既不能燃烧又不能受腐蚀,在工业上可用作粘剂和耐火材料。
化学奥赛无机元素化学习题 硼 族 元 素(含答案)

【高中化学奥林匹克竞赛辅导】无机元素化学习题第十一章硼族元素1.下列为有关硼酸的一些反应的图解,试写出其反应方程式,并指出反应条件。
B 2H 6 ?Mg 2B 2O 5·H 2O ?Na 2B 4O 7·10H 2O ?BF 3?H[BF 4] ?H 2SO 4B 2O 3?HBO 2?H 3BO 3?BPO 4 CH2-HO -CB -CH 2-O2.(1)3.B 2H 64.为什么5.6.硼酸H 37.×10-10)8.9.10.11.12.已知-1672(1)(2)若用(3)13.,如何解释?14.为什么不能制得TlI 3和Tl 2S 3?15.虽然TlI 与KI 是同晶型的,但为什么TlI 不溶于水?16.铊的化学性质,在某些方面相似于铝,在一些方面相似于IA 金属,试用化学事实来说明上述叙述。
17.今有K 2SO 4、Pb(NO 3)2、SnC12、SbC13、A12(SO 4)3和Bi(NO 3)3等六瓶溶液,如何用最方便的化学方法来区别它们?写出现象及有关离于方程式。
18.一单质A 难溶于浓硝酸,与NaOH 溶液作用放出气体B ,得到溶液C ,C 用盐酸酸化后得到白色沉淀D ,D 溶于过量的盐酸,若将A 与盐酸反应也能放出气体B ,同时生成溶液E ,用NaOH 将E 小心碱化,也能得到沉淀D ,D 溶于过量的NaOH ,如果在E 中加入Na 2CO 3或(NH 4)2S 也能得到沉淀D ,问A ?E 各是何物?写出有关反应式。
19.已知气态化合物(HNBCl)3(环状)的?H ?f =-1012kJ ?mol -1,气态单原子的B 、Cl 、N 和H 的标准生成焓分别为590kJ ?mol -1,122kJ ?mol -1,472kJ ?mol -1和218kJ ?mol -1,E (B-Cl)=456kJ ?mol -1,E (N-H)=390kJ ?mol -1,试计算此化合物中E (B-N)值。
大连理工大学无机化学教研室《无机化学》(第6版)笔记和课后习题(含考研真题)详解(13-18章)【圣

2.p 区元素特征 (1)各族元素性质自上而下呈规律性变化 同族自上而下:原子半径↑,金属性↑,非金属性↓。 (2)多种氧化值 ns2np1~6 的价电子构型使大部分 p 区元素具有多种氧化值。 (3)电负性大 电负性:p 区元素>s 区元素。 (4)第二周期元素具有反常性 第二周期元素单键键能(N、O、F)<第三周期元素单键键能(P、S、Cl)。 (5)第四周期元素表现出异样性 d 区元素的插入,使第四周期元素的原子半径显著减小,性质展现出特殊性。
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 13 章 p 区元素(一)
13.1 复习笔记
一、p 区元素概述 1.p 区元素 p 区元素:除 H 以外的所有非金属元素和部分金属元素。 惰性电子对效应:同族元素,自上而下,氧化值低的化合物的稳定性高于氧化值高的化 合物的现象。
圣才电子书 十万种考研考证电子书、题库视频学习平台
③加合反应:B2H6+2NH3→[BH2·(NH3)2]++[BH4]- 【注意】①乙硼烷自燃和水解放热较大,可用于制作火箭燃料。②乙硼烷是剧毒物质, 空气中其最高允许含量为 0.1µg/g。 (2)硼的含氧化合物 ①三氧化二硼 B2O3 a.物理性质 颜色:白色固体;密度:2.55g·cm-3;熔点:450C。 b.化学性质 被碱金属还原:B2O3+3Mg→2B+3MgO 与水反应:
B 2 O 3 HH 22OO 2 H B O 2 HH 22OO 2 H 3 B O 3
②硼酸 H3BO3 化学性质:硼酸为一元弱酸(固体酸);与多羟基化合物发生加合反应;受热易分解。 ③硼砂 硼砂:硼酸盐的一种,水解呈碱性;溶液中,n(H3BO3)=n(B(OH)4-),具有缓冲 作用。 (3)硼的卤化物 ①三卤化硼 BX3 BX3 在湿空气中发生水解反应 BX3+3H2O→B(OH)3+3HX ②氟硼酸 H[BF4] H[BF4]的酸性比 HF 强,可利用 BF3 的水解制备,反应方程为
化学奥赛无机元素化学习题 硼 族 元 素(含答案)

【高中化学奥林匹克竞赛辅导】无机元素化学习题第十一章硼族元素1.下列为有关硼酸的一些反应的图解,试写出其反应方程式,并指出反应条件。
B 2H 6 ?Mg 2B 2O 5·H 2O ?Na 2B 4O 7·10H 2O ?BF 3?H[BF 4] ?H 2SO 4B 2O 3?HBO 2?H 3BO 3?BPO 4 CH2-HO -CB -CH 2-O2.(1)3.B 2H 64.为什么5.6.硼酸H 37.×10-10)8.9.10.11.12.已知-1672(1)(2)若用(3)13.,如何解释?14.为什么不能制得TlI 3和Tl 2S 3?15.虽然TlI 与KI 是同晶型的,但为什么TlI 不溶于水?16.铊的化学性质,在某些方面相似于铝,在一些方面相似于IA 金属,试用化学事实来说明上述叙述。
17.今有K 2SO 4、Pb(NO 3)2、SnC12、SbC13、A12(SO 4)3和Bi(NO 3)3等六瓶溶液,如何用最方便的化学方法来区别它们?写出现象及有关离于方程式。
18.一单质A 难溶于浓硝酸,与NaOH 溶液作用放出气体B ,得到溶液C ,C 用盐酸酸化后得到白色沉淀D ,D 溶于过量的盐酸,若将A 与盐酸反应也能放出气体B ,同时生成溶液E ,用NaOH 将E 小心碱化,也能得到沉淀D ,D 溶于过量的NaOH ,如果在E 中加入Na 2CO 3或(NH 4)2S 也能得到沉淀D ,问A ?E 各是何物?写出有关反应式。
19.已知气态化合物(HNBCl)3(环状)的?H ?f =-1012kJ ?mol -1,气态单原子的B 、Cl 、N 和H 的标准生成焓分别为590kJ ?mol -1,122kJ ?mol -1,472kJ ?mol -1和218kJ ?mol -1,E (B-Cl)=456kJ ?mol -1,E (N-H)=390kJ ?mol -1,试计算此化合物中E (B-N)值。
硼族和碳族元素习题

一、选择题1 硼的独特性质表现在: (D)(A) 能生成正氧化态化合物如BN,其它非金属则不能(B) 能生成负氧化态化合物,其它非金属则不能(C) 能生成大分子(D) 在简单的二元化合物中总是缺电子的2 二氧化硅: (A)(A) 与NaOH共熔反应生成硅酸钠(B) 是不溶于水的碱性氧化物(C) 单质是分子晶体,与CO2晶体相似(D) 属AB2型的化合物,晶体结构属CaF2型3 CO与金属形成配合物的能力比N2强的原因是: (D)(A) C原子电负性小易给出孤对电子(B) C原子外层有空d轨道易形成反馈键(C) CO的活化能比N2低(D) 在CO中由于C-←O+配键的形成,使C原子负电荷偏多,加强了CO 与金属的配位能力6 下列无机酸中能溶解酸性氧化物SiO2的是: (C)(A) HCl (B) H2SO4(浓) (C) HF (D) HNO3(浓)7 下列元素性质最相似的是: (A)(A) B和Al (B) B和Si (C) B和Mg (D) B和C二、简答题:1 为什么SiCl4水解而CCl4不水解?要点:SiCl4具有空的3d轨道可接受H2O:中的孤电子对而水解,CCl4无空的价轨道不能接受H2O:中的孤电子对,因此不能水解.2 为什么说H3BO3是一个一元弱酸?要点:H3BO3是一个一元弱酸,它的酸性是由于B的缺电子性而加合了来自H2O中氧原子上的孤电子对成配键,而释放出H+,使溶液的[H+]大于[OH-]的结果:B(OH)3 + H2O ←→B(OH)4- + H+3、等电子原理是什么?与CO互为等电子体的有哪些?与CO2互为等电子体的有哪些?要点:核外电子总数相等的分子或离子; N2, NO+; NO2+ ,N2O,N3-三、推断题14mg某黑色固体A,与浓NaOH共热时产生无色气体B 22.4ml(标况下)。
A燃烧的产物为白色固体C,C与氢氟酸反应时,能产生一无色气体D,D通入水中时产生白色沉淀E及溶液F。
第12章氮族,碳族和硼族习题解

第12章氮族,碳族和硼族习题解第12章氮族,碳族和硼族思考题解析1.NH4NO3,(NH4)2Cr2O7属于具有氧化性酸的铵盐,它们的分解产物是氮⽓或氮的氧化物⽽不是氨;NH4HCO3在常温下即可分解,产物虽有氨⽓,但同时还有CO2。
NH4NO3→NO2↑+2H2O↑或2NH4NO3→2N2↑+O2↑+4H2O↑(NH4)2Cr2O7→N2↑+Cr2O3+4H2O↑NH4HCO3→NH3↑+CO2↑+H2O2.(1) 4NH3(g) + 5O2 (g) → 4NO(g) + 6H2O(g)f G m/(kJmol-1) -16.45 0 86.55 -228.572r G m=[4×(86.55)+6×(-228.572)-4×(-16.45)]kJmol-1=-959.43 kJ?mol-1因?r G m?<0,故该反应在常温下可以⾃发进⾏。
(2)4NH3(g) + 5O2 (g) → 4NO(g) + 6H2O(g)f H m/(kJmol-1) -46.11 0 90.25 -241.818S m?/(J?mol-1?K-1) 192.45 205.138 210.761 188.825r H m=[4×90.25+6×(-241.818)-4×(-46.11)] kJmol-1=-905.47 kJ?mol-1r S m=[(4×210.761+6×188.825)-(4×192.45+5×205.138)] Jmol-1K-1=180.50 J?mol-1?K-1因为?r H m?<0,?r S m?>0,温度升⾼不会使该反应反向进⾏,但温度升⾼可使反应速率加快,所以⽣产上⼀般选择反应温度在800℃左右。
3⾦属与浓稀硝酸反应产物不同,可能是由于存在下列平衡:NO+2HNO33NO2+H2O可以看出:硝酸浓度越⼩,平衡越向左移动,则氮(V)被还原的程度越⼤;也有认为浓硝酸可进⼀步氧化低氧化数的还原产物,所以这与浓稀硝酸的氧化能⼒强弱并不⽭盾。
第16章-硼族元素习题

第16章硼族元素习题1.选择题16-1硼族元素最重要的特征是…………………………………………………( ) (A) 共价性特征 (B) 缺电子性特征(C) 共价性和缺电子性特征 (D) 易形成配合物和自身聚合的特征16-2 硼成键为sp2杂化,且含三个单键, 1 个π46键的化合物是………….. ( )(A) B2O3(B) BF4-(C) BO33-(D) B2H616-3硼的独特性质表现在………………………………………………………( )(A) 能形成正氧化态化合物,如BN ,其它非金属则不能(B) 能生成大分子(C) 能形成负氧化态化合物,其它金属则不能(D) 在简单的二元化合物中总是缺电子的16-4在 菱形硼的B12单元中,表现硼原子是缺电子原子性质的原子个数是( )(A) 3个(B) 6个(C) 9个(D) 12个16-5 下列关于单质硼性质的描述,错误的是………………………………..( )(A) 常温下不活泼,但高温下可与许多非金属反应(B) 与碳相似,炽热的硼可与水蒸气反应(C) 可与盐酸反应 (D) 可与碱反应16-6 硼与浓NaOH反应,所得的含硼产物是………………………………..( )(A) NaBO2(B) Na3BO3(C) B2O3(D) H3BO316-7 硼与浓硝酸反应,所得的含硼产物是…………………………………( )(A) B(NO3)3(B) H3BO3(C) BN (D) B2O316-8 下列对硼酸性质的描述不正确的是…………………………………( )(A) 硼酸是三元酸(B) 硼酸是一元路易斯酸(C) 硼酸与多元醇反应,生成配合物,使酸性增强(D) 硼酸的溶解度小16-9 硼砂的水溶液呈…………………………………………………….( )(A) 碱性(B) 中性(C) 酸性(D) 弱酸性16-10用盐酸滴定硼砂水溶液至恰好中和时,溶液呈……………………( )(A) 中性(B) 弱酸性(C) 弱碱性(D) 强碱性16-11下列关于硼酸结构的叙述错误的是……………………………….( )(A) 硼酸为白色片状晶体,其结构单元为B(OH)3三角形(B) 硼原子通过sp3杂化轨道与氧原子成键(C) 分子间通过氢键形成接近于六角形的对称层状结构(D) 层与层间以范德华力联系16-12在分析化学中,硼砂被用来作标准溶液是因为它………………………( )(A) 易水解(B) 在干燥空气中易风化(C) 溶融态时可溶解金属氧化物(D) 稳定,易提纯16-13 CO2泡末灭火器的反应原理是…………………………………………..( )(A) HCO3-离子的水解(B ) Al3+水解(C) HCO3-Al3+双水解,相互促进(D) 反应生成Al(HCO3)3,然后水解16-14 下列物质中水解并放出H2的是………………………………………()(A) B2H6(B) N2H4(C) NH3 (D) PH316-15 硼的缺电子性表现在……………………………………………………( )(A) 易形成缺电子多中心键及配合物(B) 易形成含桥键的化合物(C) 易形成不同类型杂化,形成化合物(D) 易形成共价化合物16-16 可形成下面几种类型化合物的X元素是………………………………( ) (XH3)2;X2O3;XCl3;XO2-;XF3·HF(A) P (B) Al (C) B (D) S16-17铝在空气中燃烧时,生成……………………………………………….( )(A)单一化合物Al2O3 (B) Al2O3和Al2N3(C)单一化合物Al2N3 (D) Al2O3和AlN16-18下列含氧酸中属于三元酸的是…………………………………………. ( )(A) H3BO3(B) H3PO2(C) H3PO3(D) H3A s O416-19BF3通入过量的Na2CO3溶液,得到的产物是………………………()(A) HF和H3BO3(B) HBF4和B(OH)3(C) NaBF4和NaB(OH)4(D) HF 和B2O316-20 BF3,B2H6,Al2Cl6都是稳定的化合物,BH3,AlCl3则相对不稳定,其原因是……………………………………………………………………….( )(A) 前者形成大π键,后者缺电子(B) 前者通过大π键、多中心键、配位键补偿了缺电子,后者缺电子(C) 前者缺电子,后者有多中心键(D) 前者有配位键,后者缺电子16-21 铊可以生成氟化铊、氯化铊和碘化铊,Tl在这三种化合物中的氧化态是( )(A) 与F 结合为Tl(+III) (B)与Cl 结合为Tl(+III)(C) 与I 结合为Tl(+I)与F,Cl结合为Tl(+III) (D) 全部为Tl(+III)16-22 InCl2为反磁性化合物,其中In 的氧化数为…………………………….()(A) +1 (B) +2 (C) +3 (D) +1和+316-23三氯化铝经常以(AlCl3)2 形式存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳族和硼族元素练习一、选择题 ( 共17题 34分 )1. (7643)与Na 2CO 3溶液作用全部都生成碱式盐沉淀的一组离子是……………………( )(A) Mg 2+,Al 3+,Co 2+,Zn 2+ (B) Fe 3+,Co 2+,Ni 2+,Cu 2+(C) Mg 2+,Mn 2+,Ba 2+,Zn 2+ (D) Mg 2+,Mn 2+,Co 2+,Ni 2+2. (7462)下列说法不正确的是…………………………………………………………… ( )(A) SiCl 4在与潮湿的空气接触时会冒“白烟” (B) NF 3因会水解,不能与水接触 (C) SF 6在水中是稳定的 (D) PCl 5不完全水解生成POCl 3 3. (3718) 铅蓄电池在充电时,阳极反应是……………………………………………( )(A) PbSO 4 + H 2O =PbO 2 + 4H + + SO -24+ 2e (B) Pb + SO -24= PbSO 4+ 2e(C) PbSO 4 + 2e= Pb + SO-24 (D) PbO 2 + 4H ++ SO -24+ 2e = PbSO 4+ 2H 2O4. (0545) 已知在一定温度下 SnO 2(s) + 2H 2(g)Sn(s) + 2H 2O(g) K c = CO(g) + H 2O(g)CO 2(g) + H 2(g) K c =因此下列反应SnO 2(s) + 2CO(g)Sn(s) + 2CO 2(g) 的K c 值………………………( )(A) (B) (C) (D) 5. (7476)分离SnS 和PbS ,应加的试剂为…………………………………………………( )(A) 氨水 (B) 硫化钠 (C) 硫酸钠 (D) 多硫化铵6. (7475)鉴别Sn 4+和Sn 2+离子,应加的试剂为……………………………………………( )(A) 盐酸 (B) 硝酸 (C) 硫酸钠 (D) 硫化钠(过量) 7. (7466)下列分子中,C 与O 之间键长最短的是…………………………………………( )(A) CO (B) Ni(CO)4 (C) CO 2 (D) CH 3COOH 8. (7363)将过量SiF 4通入NaOH 溶液中,主要产物是……………………………………( )(A) H 4SiO 4,NaF (B) Na 2SiO 3,NaF (C) Na 2SiO 3,Na 2SiF 6 (D) SiO 2,HF 9. (4370)下列说法不正确的是………………………………………………………… ( )(A)HCO 3-可通过氢键形成双聚离子 (B) NaHCO 3的热稳定性不如NaCO 3高(C) BeCO 3在热水中就可发生分解 (D) 所有碱金属碳酸盐都是易溶于水的10. (4308) CO 32-的几何构型是………………………………………………………( ) (A) 平面三角形 (B) 三角锥形 (C) T 形 (D) 直线形11. (1460) 下列硫化物,能溶于Na 2S 溶液生成硫代酸盐的是…………………………( )(A) SnS (B) SnS 2 (C) PbS (D) Bi 2S 3 12. (1456) 试判断 Ge 、Sn 、Pb 分别与浓HNO 3作用时,正确的说法是………………( ) (A) 三元素都被氧化成 +2价 (B) 三元素都被氧化成 +4价 (C) Ge 和Sn 被氧化成 +4价,但Pb 却被氧化成 +2价 (D) Ge 被氧化成 +4价,但Sn 和Pb 只却被氧化成 +2价13. (1451) IVA 族元素从Ge 到Pb ;下列性质随原子序数的增大而增加的是…………( )(A) +2氧化态的稳定性 (B) 二氧化物的酸性 (C) 单质的熔点 (D) 氢化物的稳定性 14. (7354)从分子轨道理论出发,可以认为在B 2分子中存在的化学键是………………( )(A) 三中心二电子键 (B) 一个 键(C) 二个单电子 键 (D) 一个 键和一个 键15. (4403) BF 3通入过量的Na 2CO 3溶液,得到的产物是……………………………( ) (A) HF 和H 3BO 3 (B) HBF 4和B(OH)3 (C) NaBF 4和NaB(OH)4 (D) HF 和B 4O 316. (4333) 下列含氧酸中属于三元酸的是…………………………………………… ( )(A) H 3BO 3 (B) H 3PO 2 (C) H 3PO 3 (D) H 3AsO 417. (1478) 铝在空气中燃烧时,生成……………………………………………………( )(A) 单一化合物Al 2O 3 (B) Al 2O 3和Al 2N 3 (C) 单一化合物Al 2N 3 (D) Al 2O 3和AlN二、填空题 ( 共18题 36分 )18. (1509)将适量的SnCl 2溶液加入HgCl 2溶液中,有____________产生,其化学反应方程式为:__________________________________________________________。
19. (7419) HF 腐蚀SiO 2玻璃的反应方程式为 。
20. (1439) 在Sn(II)的强碱溶液中加入硝酸铋溶液,发生变化的化学方程式为: ________________________________________________________________。
21. (1281) 周期表(主族元素)中具有对角线关系的元素是________________________;_________________________________;_________________________________。
22. (7445) 由粗硅经氯化硅制备纯硅的反应方程式是 。
23. (7440) K 2CO 3与HCl(aq),Na 2SiO 3与酸反应的化学方程式分别是 和 。
24. (7336)当CO 2通入石灰水时,根据CO 2和Ca(OH)2物质的量的比值不同可能生成不同的产物,当n n CO Ca(OH)22/≤1时,其产物为 ,当n n CO Ca(OH)22/≥2时,其产物为 ;当1 < n n CO Ca(OH)22/< 2时,其产物为 。
25. (4455) 完成并配平二氧化铅与硫酸反应的化学方程式:_______________________________________________________________。
氧化剂是_____________________;氧化产物是__________________________。
26. (4408) 将Cl 2通入Pb(II)的碱性溶液中,这时发生的反应是_____________________________。
27. (4365) 两种区别开NaHCO 3和Na 2CO 3的方法是:(1) ____________________________________________________________;(2) ____________________________________________________________。
28. (1468) C 和O 的电负性相差较大,但CO 分子的偶极矩却很小。
其原因是___________________________________________________________________________。
29. (1455) 用> 或 < 号表示下列各对碳酸盐热稳定性的大小。
(1) Na 2CO 3______BeCO 3; (2) NaHCO 3______Na 2CO 3; (3) MgCO 3______BaCO 3; (4) PbCO 3______CaCO 3。
30. (1450) 由于SnCl2极易________和_______,所以在配制SnCl2水溶液时,必须先将SnCl2溶于____________中,而后还要加入少量____________。
31. (1447) 用 > 或 < 号表示下列化合物中键的离子性大小:(1) PbO____PbS (2) SnS____SnS232. (7325)试指出在IIIA和IVA族元素中:(1) 金属和非金属元素:;(2) 在自然界中能以氧化物形式存在的元素:。
33. (7474)BF3与BCl3的水解方程式分别为和。
-的几何构型为。
34. (7369) BF3的几何构型为,而BF4中的B—F键长比中的键要短。
35. (1477) H3BO3是极弱的一元酸,在定量分析中不能直接用强碱滴定,如果加一定量的_____________________,生成________________________________后,因酸性大为增强,则就可滴定了。
三、计算题 ( 共 1题 5分 )36. (4412) 利用金属电极电势,通过计算说明,用Sn从Pb2+ 盐溶液中置换Pb的过程,ϕ:Sn2+/Sn为 V, Pb2+/Pb为 V)实际上能否进行到底(四、问答题 ( 共20题 100分 )37. (1722)有人估计具有114个质子和184个中子的原子核可以稳定存在。
试估计:(1) 该元素的近似相对原子质量;(2) 该元素的价层电子排布;(3) 它和哪种元素的性质最相似。
38. (1653) 拟出准确鉴别标签不清的二氧化锰、二氧化铅、四氧化三铁三瓶黑色固体试剂的简要步骤,并写出主要化学方程式。
39. (7355)碳与硅为同族元素,SiCl4和CCl4结构相似,且根据:∆= -377 kJ·mol1 CCl4(l) + 2H2O(l) = CO2(g) + 4HCl(g) m r G∆= -282 kJ·mol1 SiCl4(l) + 2H2O(l) = SiO2(s) + 4HCl(g) m r GCCl4(l)的水解比SiCl4(l) 的水解在热力学上趋势更大。
然而,在实际上,SiCl4能激烈水解,而CCl4不发生水解,试阐明理由。
40. (4465) 某元素A能直接与VIIA族某元素B反应生成A的最高氧化态化合物,在此化合物中B的含量占 %,而在与此相应的氧化物中,氧的质量则占 %,又它与B形成的此化合物为一无色透明的液体,沸点为℃,其蒸气对空气的相对密度约为倍。
回答下列问题:(1) 该元素的名称,并指出属于第几周期第几族;(2) 该元素与B元素所生成的此化合物及此元素氧化物的分子式;(3) A与B的化合物的构型、极性大小。
