化学平衡三段式计算
化学平衡计算中“三段式”微课

40mol ×100%=33.3%。 20 mol+60 mol+40 mol
(4)同温同容下,压强比等于物质的量之比,所以
40 mol+120 mol p1 = =4∶3。 p2 20 mol+60 mol+40 mol
你学会了吗??
[解析] N2 起始 n(mol) 变化 n(mol) 平衡 n(mol) (1)v(H2)= (3)φ(NH3)= 40 20 20
60 mol 10L×2 s
+ 3H2 120 60 60
2NH3 0 40 40
=3 mol· (L· s)-1。
20 mol (2)α(N2)= ×100%=50%。 40 mol
“三段式”在化学计算中 的应用
列“三段式”的基本思路
• 在化学反应速率及化学平衡的计算中,常常 要计算反应物的转化率、平衡浓度、平衡时 物质的量、体积分数、压强比等。如果在反 应方程式下用“三段式”列出各物质的起始、 变化、平衡或最终态的物质的量或物质的量 浓度,则能理顺关系,找出已知与未知的关 系,对正确分析和解决问题有很大帮助。下 面我们就介绍“三段式”的具体列法:
基本步骤 1、根据题意确定所列“三段式”中各物质的物理量 (浓度或物质的量) 2、找出各物质的起始量 3、找出变化时间内各物质的变化量 4、找出平衡或最终态时各物质的最终量 三段式中各物质量的关系: 反应物:起始量—变化量=最终量 生成物:起始量 + 变化量=最终量 三段中,只有变化量之比等于化学方程式中计量数之 比.因此,当我们找出一种物质的变化量时,可以根 据反应的比例找出所有物质的变化量。
[例题]
向容积为10 L的密闭容器内通入40 mol N2和120 mol H2,在一定条件下进行反应,经2 s
化学平衡的相关计算(三段式法)

2014-2015学年度第一学期高二级理科化学导学案第1周编号:3 总编号:3 使用日期:主备人:周军锋审核人:班级:姓名:包组领导:3A(g)+ B(g)=== 2C(g)+ 2D(g)开始物质的量3mol 0 0转化的物质的量mol 1mol平衡时物质的量 2 mol 1mol 1 mol由D的生成量,根据方程式可计算出A、B的转化量分别为、。
所以,B的转化率为=20%。
根据平衡时A的物质的量,A的平衡浓度为2L=L。
探究案合作探究一在一个容积为3L的密闭容器里进行如下反应:反应开始时,,2min末。
(1)试用、和的浓度分别表示该反应的反应速率(2)并求出2min末的浓度合作探究二某温度下,在一个体积为2L的固定不变的密闭容器中充入 SO2和 O2,发生2SO2+O2 2SO3反应.5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%.求(1)以SO3的浓度变化表示该反应的化学反应速率;(2)该反应中SO2的平衡转化率.合作探究三27.将6 mol H2和3 molCO充入容积为0.5 L的密闭容器中,进行如下反应:2H2(g)+CO(g) CH3OH(g),6秒末时容器内压强为开始时的倍。
试计算:(1)H2的反应速率是多少(2)CO的转化率为多少检测案1、在一定条件下,将22BA和两种气体通入密闭容器中,反应按22yBxA+C2进行,2秒钟后反应速率如下:)/(5.0)(2sLmolvA⋅=,)/(5.1)(2sLmolvB⋅=,)/(1)(sLmolvC⋅=,则x、y的值分别为()A.3和2 B.1和3 C.3和1 D.4和52、对于某反应X+3Y=2E+2F,在甲、乙、丙、丁四种不同条件下,分别测得反应速率为甲:m in)/(3.0⋅=LmolvX,乙:m in)/(2.1⋅=LmolvY,丙:m in)/(8.0⋅=LmolvE,丁:m in)/(9.0⋅=LmolvF。
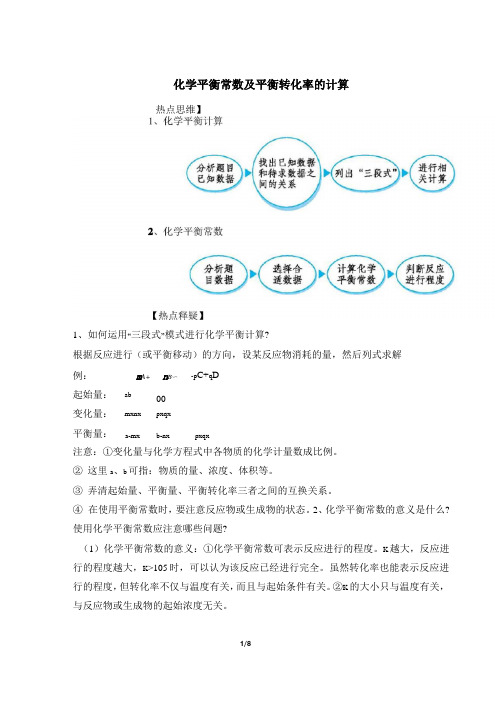
高考化学热点:化学平衡常数及平衡转化率的计算

化学平衡常数及平衡转化率的计算【热点思维】1、化学平衡计算2、化学平衡常数【热点释疑】1、如何运用“三段式”模式进行化学平衡计算?根据反应进行(或平衡移动)的方向,设某反应物消耗的量,然后列式求解。
例:m A+n B p C+q D起始量:a b0 0变化量:mx nx px qx平衡量:a-mx b-nx px qx注意:①变化量与化学方程式中各物质的化学计量数成比例。
②这里a、b可指:物质的量、浓度、体积等。
③弄清起始量、平衡量、平衡转化率三者之间的互换关系。
④在使用平衡常数时,要注意反应物或生成物的状态。
2、化学平衡常数的意义是什么?使用化学平衡常数应注意哪些问题?(1)化学平衡常数的意义:①化学平衡常数可表示反应进行的程度。
K越大,反应进行的程度越大,K>105时,可以认为该反应已经进行完全。
虽然转化率也能表示反应进行的程度,但转化率不仅与温度有关,而且与起始条件有关。
②K 的大小只与温度有关,与反应物或生成物的起始浓度无关。
(2)在使用化学平衡常数时应注意:①不要把反应体系中纯固体、纯液体以及稀溶液中水的浓度写进平衡常数表达式中,但非水溶液中,若有水参加或生成,则此时水的浓度不可视为常数,应写进平衡常数表达式中。
②同一化学反应,化学反应方程式写法不同,其平衡常数表达式及数值亦不同。
因此书写平衡常数表达式及数值时,要与化学反应方程式相对应,否则就没有意义。
【热点考题】【典例】【2014年高考四川卷第7题】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)M(g)+N(g),所得实验数据如下表:实验编号[ 温度/℃起始时物质的量/mol 平衡时物质的量/moln(X) n(Y) n(M)①700 0.40 0.10 0.090②800 0.10 0.40 0.080③800 0.20 0.30 a④900 0.10 0.15 b下列说法正确的是A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)B.实验②中,该反应的平衡常数K=2.0C.实验③中,达到平衡是,X的转化率为60%D.实验④中,达到平衡时,b>0.060【答案】C起始浓度(mol/L)0.020 0.030 0 0转化浓度(mol/L)0.012 0.012 0.012 0.012则该温度下平衡常数K=0.009×0.0090.031×0.001=2.9>1,这说明升高温度平衡常数减小,即平衡向逆反应方向移动,因此正方应是放热反应。
化学平衡计算题求解常用方法

下列叙述不正确的是( ) D A.放出热量关系:a < b < 92.4 B.起始时反应速率:③ >② >① C.达平衡时氨气的体积分数:③>① D.N2的转化率:② > ① > ③
方法二:放缩法(虚拟过程)
是一种有意识地对相关的量进行 放大或缩小的方法。 用于不同起始加入量的条件下达 到平衡后各物理量的比较。
练习
3、常温、常压下,可发生如下反应:A(g)+B(g) C(g)+nD(g),若将2molA和2molB混合充入体积可变的密闭容 器中,在不同条件下达到平衡时,C的浓度如下
n>1 (1)可逆反应中,化学计量数n取值范围为__________ ,理 由是___ ________________。 增大压强,平衡向逆向移动 液态或固态 (2)在5×105Pa时,D的状态为____________________。
0.1*P/P0
mol,n(A)= 0.1*(2-P/P0) mol
0.051 ②下表为反应物A浓度与反应时间的数据,计算a=?
分析该反应中反应反应物的浓度c(A)变化 与时间间隔(△t)的规律,得出的结论 是 每间隔4小时,c(A)减少一半 , 由此规律推 出反应在12h时反应物的浓度c(A)为 0.031 mol· L-1
结果
两次平衡时各组分百 分量、n、c均相同 两次平衡时各组分 百分量相同,n、c 同比例变化 两次平衡时各组分 百分量、c相同,n 同比例变化
(重庆)4、将E和F加入密闭容器中,在一定条件下发生反应: E(g)+F(s)⇌2G(g).忽略固体体积,平衡时G的体积 分数(%)随温度和压强的变化如下表所示.
(海南)3、 CuBr2分解的热化学方程式为: 2CuBr2(s)=2 CuBr(s)+ Br2(g) △H=+105.4kJ /mol 在密闭容器中将过量CuBr2于487K下加热 分解,平衡时P(Br2)为4.66×103Pa。 ①如反应体系的体积不变,提高反应温度, 则P(Br2)将会 (填“增大”、 “不变”或“减小”)。 ②如反应温度不变,将反应体系的体积 增加一倍,则P(Br )的变化范围为
2025届高中化学高考复习学案:化学平衡常数及转化率的计算

化学平衡常数及转化率的计算(答案在最后)1.提取信息计算化学平衡常数及转化率。
2.了解压强平衡常数的含义,并能进行简单计算。
考点一化学平衡常数及转化率的计算方法——“三段式”法1.分析三个量:即起始量、变化量、平衡量。
2.明确三个关系(1)对于反应物,起始量-变化量=平衡量。
(2)对于生成物,起始量+变化量=平衡量。
(3)各转化量之比等于各参加反应的物质的化学计量数之比。
3.计算模型——“三段式”法(1)步骤:书写(写出有关化学平衡的化学反应方程式)―→列变量(列出各物质的起始、变化、平衡量)―→计算(根据已知条件列方程式计算)。
(2)模式:如反应:m A(g)+n B(g)⇌p C(g)+q D(g),令A、B起始物质的量(mol)分别为a、b,达到平衡后,A的消耗量为mx,容器容积为1L。
m A(g)+n B(g)⇌p C(g)+q D(g)起始/mol a b00变化/mol mx nx px qx平衡/mol a-mx b-nx px qx【教考衔接】典例1[全国卷Ⅰ]H2S与CO2在高温下发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)。
在610K时,将0.10mol CO2与0.40mol H2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=________(保留三位有效数字)。
(2)在620K时重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________(填“>”“<”或“=”,下同)α1,该反应的ΔH________0。
听课笔记典例2[2023·全国甲卷,28(2)]电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。
MO+与CH4反应能高选择性地生成甲醇。
分别在300K和310K下(其他反应条件相同)进行反应MO++CH4===M++CH3OH,结果如下图所示。
高考化学热点:化学平衡常数及平衡转化率的计算
化学平衡常数及平衡转化率的计算热点思维】1、如何运用“三段式”模式进行化学平衡计算?根据反应进行(或平衡移动)的方向,设某反应物消耗的量,然后列式求解例:m A+n B〜-p C+q D起始量:ab00变化量:mxnx pxqx平衡量:a-mx b-nx pxqx注意:①变化量与化学方程式中各物质的化学计量数成比例。
②这里a、b可指:物质的量、浓度、体积等。
③弄清起始量、平衡量、平衡转化率三者之间的互换关系。
④在使用平衡常数时,要注意反应物或生成物的状态。
2、化学平衡常数的意义是什么?使用化学平衡常数应注意哪些问题?(1)化学平衡常数的意义:①化学平衡常数可表示反应进行的程度。
K越大,反应进行的程度越大,K>105时,可以认为该反应已经进行完全。
虽然转化率也能表示反应进行的程度,但转化率不仅与温度有关,而且与起始条件有关。
②K的大小只与温度有关,与反应物或生成物的起始浓度无关。
(2)在使用化学平衡常数时应注意:①不要把反应体系中纯固体、纯液体以及稀溶液中水的浓度写进平衡常数表达式中,但非水溶液中,若有水参加或生成,则此时水的浓度不可视为常数,应写进平衡常数表达式中。
②同一化学反应,化学反应方程式写法不同,其平衡常数表达式及数值亦不同。
因此书写平衡常数表达式及数值时,要与化学反应方程式相对应,否则就没有意义。
【热点考题】【典例】【2014年高考四川卷第7题】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)=M(g)+N(g),所得实验数据如下表:下列说法正确的是A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率u(N)1.0x10」2mol/(L・min)B.实验②中,该反应的平衡常数K=2.0C.实验③中,达到平衡是,X的转化率为60%D.实验④中,达到平衡时,b>0.060【答案】C【解析】取冥验①中,若血in时测得n(M)=0.050mol;浓度是0.0050mol/L^贝H根据反应的化学方程式可知,同时主成的N的物质的量也是O.OOBOmol/L,因此0至血山时间内,用M 表示的平均反应辭U(N)=0.0050mol/L-r-5min=l.OX10_3mol/(L■min);A不正确;E、实验②中,平衡时M的浓度是0.OOSOmol/L;则同时生成的N的浓度是0.OOSOmol/L,'消耗X与Y的浓度均是0.0080moL/L,因此平衡时蓝和Y的浓度分别为0.01mol/L-0.0080jnoL/L=0.002jnoL/L,0.04mol/L-0.0080mol/L=0.032mol/L,因此反应的平衡常数^To02X0.032°=b B 不正确'亡、根据反应的化学方程式可灿如果X的转化率为旳虬则X(g)+Y(g)亍二M(g)+N(g)转化浓度(mol/L)0.0120.0120.0120.012为砂緞C 正确;70013时X(g)++N(g)起始液度(mol/L)0.040 0.010 0 转化液度(mol/ll)0.009 0.009 0.009 平衡浓度(mol/L)0.031 0.0010.0090 0.009 0.0090.009x0.0090.031x0.001 =2.9>1,这说明升高温度平衡常数减小,温度不变,平衡常数不变,则在;:鶯;囂=1,即反应达到平衡状态,因此最终平衡时蓝的转化率即平衡向逆反应方向移动,因此正方应是放热反应。
化学平衡的有关计算

化学平衡的有关计算一.化学平衡计算的基本模式——三段式mA + nB == pC + qD起始浓度 a b c d转化浓度X平衡浓度各物质的转化浓度之比=转化率=恒温恒容时:p1/p2=恒温恒压时: v1/v2==混合气体平均式量的计算:(A.B.C三气体混合)M= M(A)×a%+M(B)×b%+M(C)×c%(a%.c%. b%表示三种气体的体积分数或物质的量分数)或M=m总/n总例 1. X.Y.Z都是气体,反应前X.Y的物质的量之比是1:2,在一定条件下可逆反应:X+2Y==2Z达平衡时,测得反应物总得物质的量等于生成物总得物质的量,则平衡时x 的转化率为()A 80 %B 20 %C 40%D 60%练. 将2molN2和6molH2置于密闭容器中,当有25%的N2转化为NH3达到平衡,计算:(1)平衡时混合物中各组成成分的物质的量。
(2)平衡时气体的总物质的量(3)平衡时混合物中各组分的物质的量的百分含量,体积百分含量(4)平衡混合气的平均相对分子质量(5)容器中反应前后的压强比二.化学平衡题的特殊解法1. 极端法例2 在密闭容器中进行下列反应:X2(g)+Y2(g)==2Z(g) 已知X2,Y2。
Z的起始浓度分别为0.1mol/L 0.3mol/L 0.2mol/L.当反应在一定条件下达到平衡时。
各物质的浓度有可能是()A Z为0.3mol/LB Y2为0.2mol/LC X2为0.2mol/LD Z为0.4mol/L2 假设法例3在密闭容器中某反应mA(g)+nB(g) == pC(g)+qD(g) . 平衡时测得A的浓度为0.5mol/L.保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时的浓度为0.2mol/L,下列有关判断正确的是()A m+n = p+qB 平衡向正反应方向移动C B 的转化率降低D C的体积分数下降3 估算法例4 在一个容积为VL的密闭容器中放入2LA(g)和1LB(g),在一定条件下发生下列反应3A(g) +B(g) == nC(g) +2D(g) 达到平衡后A物质的量浓度减小1/2.混合气体的平均摩尔质量增大1/8.则该反应的化学方程式中n的值是( )A 1B 2C 3D 44 守恒法例5. m molC2H2跟n molH2在密闭容器中反应,达到平衡时,生成p molC2H4,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是()A 3m+n molB 5/2m+1/2n-3p molC 3m+n+2 p molD 5/2m+1/2n mol。
化学平衡的计算

1.在一个密闭容器中发生如下反应
2SO2(g) + O2(g) 2SO3(g),反应过程中某一时刻 测得SO2、O2、SO3的浓度均为0.2mol/L,当反应达到 平衡时,可能出现的数据是 ( C D ) A .c(SO3) = 0.4mol/L B. c(SO2) = c(SO3) = 0.15mol/L C. c(SO2) = 0.25mol/L D. c(SO2) + c(SO3) = 0.4mol/L
H2(气)+I2(气) 2HI(气)
已知H2和I2的起始浓度均为0.10mol· -1时, L
达平衡时HI的浓度为0.16mol· -1。若H2和I2 L
的起始浓度均变为0.20mol· -1,则平衡时H2 L
的浓度(mol· -1)是: L
C
C. 0.04 D. 0.02
A. 0.16
B. 0.08
2.在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g) 2C(g),达到平衡 时容器内B的物质的量浓度为0.1mol/L,则A的转化率为 A.67% B.50% C.25% D.5%
3. (2004北京)在一定温度下,一定体积的密闭
容器中有如下平衡:
V小 A + 3B 2C 1 3 2 2 0.05V 0.15V 0.1V 0.1V 所以原混合气体的体积为VL + 0.1VL = 1.1VL,由此可得:气体A消耗 掉0.05VL,气体B消耗掉0.15VL。故本题选A。
解析:
2.在一定条件下.合成氨气的反应达到平衡后,混合气 体中NH3的体积分数为25%.若反应前后条件保持不 变,则反应后缩小的气体体积与原反应物体积的比值 是( A ) A.1/5 B.1/4 C.1/3 D.1/2 技巧三:守恒法
“三段式法”解答化学平衡计算题

6.2.2 “三段式法”解答化学平衡计算题(1)步骤①写出有关化学平衡的化学方程式。
②确定各物质的起始、转化、平衡时的量(物质的量或物质的量浓度)。
③根据已知条件建立等式关系并做解答。
(2)方法:如m A(g)+n B(g) p C(g)+q D(g),令A、B起始物质的量浓度分别为a mol·L−1、b mol·L−1,达到平衡后消耗A的物质的量浓度为mx mol·L−1。
m A(g)+n B(g) p C(g)+q D(g)起始物质的量浓度(mol·L−1) a b0 0变化物质的量浓度(mol·L−1) mx nx px qx平衡物质的量浓度(mol·L−1) a−mx b−nx px qxK=()() ()()p qm npx qxa mxb nx⋅-⋅-说明:①反应物:c(平)=c(始)−c(变);生成物:c(平)=c(始)+c(变)。
②各物质的转化浓度之比等于化学方程式中化学计量数之比。
某恒定温度下,在一个2 L的密闭容器中充入A气体,B气体,测得其浓度为2 mol/L和1 mol/L;且发生如下反应:3A(g)+2B(g) 4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5∶4,则下列说法中正确的是①该反应的化学平衡常数表达式为:K=4232(C)(D)(A)(B)c c c c②此时B 的转化率为35% ③增大该体系压强,平衡向右移动,但化学平衡常数不变④增加C 的量,A 、B 转化率不变A .①②B .②③C .①④D .③④【答案】D【解析】 3A(g)+2B(g) 4C(?)+2D(?)开始(mol/L ):2 1 0 0转化(mol/L ):0.6 0.4 0.8 0.4平衡(mol/L ):1.4 0.6 0.8 0.4设平衡时气体总的物质的量浓度为x mol/L ,根据压强之比等于物质的量之比可得:12=p n p n 前后, 又因为123n n x =,故534x =,可得x =2.4,从而可知C 为固体或液体,D 为气体。
(完整版)“三段式法”解化学平衡计算

“三段式法”解化学平衡计算在化学平衡的计算中,常常要计算反应物的转化率、各组分的转化浓度、转化的物质的量、平衡浓度、平衡时物质的量等。
若在反应方程式下用“三段式”列出各物质的开始、转化、平衡的量,能理顺关系,找出已知与未知的关系,对正确分析和解决问题有很大帮助。
[例1]在一定条件下已测得反应2CO2====2CO+O2其平衡体系的平均相对分子质量为M,则在此条件下二氧化碳的分解率为。
[分析]假设起始二氧化碳的物质的量为2mol,分解率为x2 CO2 ====2 CO + O2开始物质的量2mol 0 0转化的物质的量2x 2x x平衡物质的量2—2x 2x x根据质量守恒定律,反应前后气体的总质量为88g,反应后气体的总的物质的量为(2—2x)+2x+ =2—x由摩尔质量的定义得M=88g/(2—x)mol所以x=(88—2M)/M[例2]把3molA和2.5molB混合,充入2L密闭容器中,发生下列反应:3A(g)+B(g)===xC(g)+2D(g)经5秒钟反应达到平衡,生成1D,并测得C的平均反应速率为0.1mol·L-1·s-1,则此反应中B的转化率为,C的化学计量数x为,A的平衡浓度为。
[分析]在反应方程式下用“三段式”列出各物质的开始、转化、平衡的量3A(g)+B(g)===xC(g)+2D(g)开始物质的量3mol 2.5mol 0 0转化的物质的量 1.5mol 0.5 mol 1mol反应速率0.1mol·L-1·s-1平衡时物质的量 1.5mol 2 mol 1mol 1 mol由D的生成量,根据方程式可计算出A、B的转化量分别为1.5mol 、0.5mol。
所以,B的转化率为0.5/2.5=20%。
由题意,D的反应速率为1mol/(2L·5s)=0.1mol·L-1·s-1根据C、D的平均反应速率之比等于化学计量数比,可得x=2。
高一化学平衡三段式计算

化学平衡1(2010全国卷T26)将0.23molSO2和0.11mol氧气放入容积为1L的密闭容器中发生反应,在一定温度下,反应达到平衡,得到0.12molSO3,则平衡时SO2的浓度,氧气的转化率2(2011全国卷T27)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为3(2013全国卷II T28)在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)⇌B(g)+C(g)。
反应时间(t)与容器内气体总压强(P)的数据见下表:(2)由总压强P和起始压强P0计算反应物A的转化率的表达式(3)由总压强P和起始压强P0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n= mol,n(A)= mol总4(2015重庆)在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)⇌COS(g)+H2(g),反应前CO物质的量为10mol,平衡后CO物质的量为8mol。
平衡时COS的物质的量,CO的平衡转化率为6(2017全国卷I)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ⇌COS(g)+H2O(g)。
在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶,反应平衡后水的物质的量分数为0.02。
H2S的平衡转化率7(2018全国卷II T27)CH4-CO2催化重整反应为CH4(g)+ CO2(g)⇌2CO(g)+2H2(g)。
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,平衡时CO2的浓度,CH4的转化率8(2019全国卷II T27)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________。
“三段式法”解化学平衡计算

“三段式法”解化学平衡计算三段式法(The Three-Stage Method)是一种用于解决化学平衡计算问题的方法。
它是一种逐步逼近的方法,可以帮助我们求解出复杂的平衡计算问题。
下面将详细介绍三段式法的步骤和原理。
三段式法适用于已知反应物浓度以及平衡常数K,求解反应物消耗和产物生成的平衡浓度。
它将问题分为三个阶段进行求解,每个阶段的详细计算在下文中介绍。
第一阶段:假设所有反应物均未发生反应,即初始浓度为初始浓度。
根据这个假设进行平衡浓度的计算。
第二阶段:反应发生并消耗部分反应物,根据会消耗的反应物数量及计算出的平衡浓度进行推算。
第三阶段:计算所有产物生成的浓度,通过已知反应物的初始浓度和平衡浓度,以及平衡常数K的值进行计算。
接下来,我们将一步一步地演示三段式法的应用。
步骤一:列出化学方程式,鉴别反应物和产物。
例如,对于方程式aA+bB⇌cC+dD,a和b是反应物的摩尔系数,c和d是产物的摩尔系数。
步骤二:计算初始浓度。
根据实验数据或给定条件计算出反应物的初始浓度。
步骤三:计算平衡常数K。
平衡常数K可以通过实验数据或给定条件得到。
步骤四:进行第一阶段的计算。
假设所有反应物都未发生反应,计算出平衡浓度。
根据方程式中的摩尔比例关系和给定的初始浓度,可以计算出每个物质的平衡浓度。
步骤五:进行第二阶段的计算。
考虑到反应的进展,假设消耗了部分反应物。
根据消耗的反应物数量、初始浓度和已计算出的平衡浓度,可以推算出剩余的反应物浓度。
步骤六:进行第三阶段的计算。
根据已知的初始浓度、平衡浓度和平衡常数K,可以计算出所有产物的浓度。
步骤七:检查平衡。
检查计算出的浓度是否满足平衡条件,即是否满足化学方程式中的摩尔比例关系。
通过以上的步骤,我们可以使用三段式法求解化学平衡计算问题。
这种方法的优点是逐步逼近,并且能够确保计算的精度。
使用三段式法可以帮助我们理解化学平衡,并解决计算复杂平衡问题。
三段式的计算

“三段式”的计算对于化学反应速率与化学平衡问题,由于涉及不同状态下的不同物质,数据众多,容易混淆,“三段式”是有序整理数据的良好途径。
例1.氯化氢与O2在一定条件下反应可得到Cl2,现将HCl与O2混合于一密闭容器中,在一定条件下使之反应,温度高于100℃,经5 min即达到平衡,经过测定物质的浓度分别为c(HCl)=0.25 mol·L-1,c(O2)=0.2 mol·L-1,c(C12)=0.1 mol·L-1 。
则:(1)写出反应方程式:。
(2)开始时c(HCl)=,c(O2)=。
(3)从反应开始到反应平衡时,v(HCl)=。
【答案】(1)4HCl+O2一定条件2H2O+Cl2(2)0.45mol·L-1,0.25mol·L-1(3)0.04mol·L-1·min-1【解析】(2)4HCl + O2一定条件2H2O + 2Cl2始(mol ·L -1): 0.45 0.25 0 0 变(mol ·L -1): 0.2 0.05 0.1 0.1 5min(mol ·L -1): 0.25 0.2 0.1 0.1(3)v(HCl)=111min 04.0min 52.0---⋅⋅=⋅L mol L mol例2.一定温度下,在2 L 的密闭容器中,X 、Y 、Z 三种气体的物质的量随时间变化的曲线如右图所示:下列描述正确的是 ( )A .反应开始到10 s ,用Z 表示的反应速率为0.158 mol ·L -1·s -1B .反应开始到10 s ,X 的物质的量浓度减少了0.79 mol ·L -1C .反应开始到10 s 时,Y 的转化率为79.0%D .反应的化学方程式为:X(g)+Y(g)Z(g)【答案】C【解析】根据图示, X 、Y 的量在减少,为反应物,Z 的量在增大,为生成物,最终三个物质共存,该反应为可逆反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学平衡的相关计算
精品课件
三段式计算
三段式指可逆反应从起始到平衡反应 物与生成物所经历的变化,用物质的 量(或浓度)来表示。
精品课件
一、化学平衡三段式
•
mA + nB
起(pmCol)+ qDa
b
c变(mol)
dx
n/m x
x平(mol) qa/-mx x b- n/m x
(2)
精品课件
等效思维
• 例题:在一真空的一定体积的密闭容器中
盛有1molPCl5,加热到200℃时发生如下反
应:PCl5(g)
PCl3(g)+Cl2(g)
,反应达平衡时,PCl5所占体积分数为M%
。若在同一温度和容器中,最初投入的PCl5
是2 mol,反应达平衡时,PCl5所占体积分
数为N%,则M和N的正确关系是 [B
⑤平衡时混合气体的密度 8g/L
精品课件
2、恒温下,将amolN2与bmolH2的混合气 体通入一个固定容积的密闭容器中:
N2 + 3H2
2 NH3
(1)若反应进行至t时,n(N2)=13mol
n(NH3)=6mol计算a的值。
(2)反应达平衡,混合气体的体积为
716.8L(标况),其中NH3的含量为25%,
y 0.7 z 0.2
0 1 2t
精品课件
变式练习1:将1moL氧气和2moL二氧
化硫充入1L的容器中混合,在一定条 件下发生生成三氧化硫气体,5 min反
应达平衡, 测得混合物共2.5。
求:(1)氧气在5min内的反应速率
(2)氧气、二氧化硫的转化率
(3)氧气和二氧化硫的转化率有 什么关系
精品课件
经典题目解析
精品课件
例题——常规计算
在一定温度下,容积为20L的容器中充入2molSO2和
1molO2发生反应: 2SO2 +O2
2SO3 ,达到平
衡时,容器内气体压强为开始时的70%。试求:
①SO2的转化率
90%
②平衡时的O2浓度 0.005mol/L
③SO3的体积分数
85.7%
④混合气体的平均相对分子量 76.2
]
• A.M>N
B.M<N
• C.M=N
D.无法比较
精品课件
变式练1平 a、℅衡在;在2S密O温闭2+度O容2体器积中不充变2入S时O13m,,o测l再O得充2和S入O13m1体omlo积SlOS分2O,2数和达为 习1molO2,待又达平衡时,测得SO3体积分数为
1、将2molN2和6molH2置于密闭容器中, 当有0.5molN2转化为NH3时达到平衡。 计算(1)平衡时各物质的物质的量?
(2)H2的转化率?
N2 + 3H2
2 NH3
起(mol)
2
6
0变(mol)
0.5
1.5
1平(mol) 2 — 0.5
6 — 1.5
1 w% = 1.5/6 x 100% = 25%
(2)设N2消耗Xmol N2+3H2
2NH3
N2:28
5.
n始
0.1 0.4
H2:2
7.2
2
10
= 4
2x
20.8 3x
△n
x
3x
n平 0.1-x 0.42x
∴nN2=
1 × 0.5 = 5
0.1mol
则:
n平
0.5-2x
=
= 0.7
nH2= 4 × 0.5 = 0.4mol 5
n始
0.
6
5
2x=0.12mol
精品课件
差量法
• 例题:在一定条件下,合成氨反应达到平
衡,混合气中NH3的体积分数为25%,若反 应条件不变,则反应后缩小的气体体积与
原反应物体积的比值是 [ A ]
•
A.1/5
B.1/4
•
C.1/3
D.1/2
精品课件
守衡法
例题 :加热A2B3气体按下式分解: A2B5(g) A2B3(g)+B2(g)A2B3(g) A2B (g)+B2(g) 在容 积为2L的密闭容器中将4mol A2B3,加热到TOC 后,B2的浓度为0.5mol/L, A2B5的浓度为
计算平衡时NH3的物质的量。
(3)起始时与平衡时混合气体的压强比?
经典题目解析
精品课件
3、某温度下,在密闭容器中发生如下反应,
2A(g)
2B(g)+C(g)
若开始时只充入2 mol A气体,达平衡时,混 合气体的压强比起始时增大了20%,则平 衡时A的体积分数为?
2A(g)
起: 2
0变: x
平x/:2 2—x
0.7mol/L,则TOC时, A2B3的平衡浓度为( A )
A 0.1mol/L B 0.2mol/L C 0.9 mol/L D 1.5mol/L
精品课件
• 变式练习:五氧化二氮是一种白色固体,熔点30℃,
升温时易液化和气化,并发生分解反应:
N2O5(g)
N2O3(g)+O2(g)
N2O3(g)
O2+2SO2
2SO3 反 程 注
n始 1 2
n转 x 2x n平 1-x
2x 2-2x
n总=1-x + 2-2x+2x=2.5
0 应式意 物系:
2x 转 数 当 化比反
x=0.5 率 充 应
VO2=0.5/5×1=0.1mo l/L.min
相入物 同时按
αO2=50%;αSO2=50%
,方
精品课件
x/2
100 120
=
p1 p2
经典题目解析
2B(g) + C(g) 0 X=0.8mol x
x V%=50%
n1 n2
=
2 2+ x/2
精品课件
某温度时,在2L密闭容器中X、Y、Z三种物质的物质的量
随时间的变化曲线如图所______
1
x 0.9
反应开始至2min后,Z的平均 反应速率为_____________ X的转化率为____________。
N2O(g)+O2(g),
• 在0.5升的密闭容器中,将2.5摩尔N2O5加热气化,并 按上式分解,当在某温度下达到化学平衡时,氧气的
平衡浓度为4.4mol/L,N2O3的平衡浓度为1.6mol/L, 计算: (1)N2O5的分解率是多少?
(2)N2O的平衡浓度是多少?
答案、(1)60% 1.4mol/L
d- q/m x
计算理论:
p/m c- p/m x
1、物质的量的变化量之比 = 计量数之比
2、转化率 = 反应物转化的量 x 100% 反应物起始总量
精品课件
恒温、恒容:
阿伏伽德罗推论
混合气体的压强与其物质的量成正比
p1
n1
p2
n2
恒温、恒压:
混合气体的体积与其物质的量正比
v1
n1
v2
n2
精品课件
变式练习2:将氮气和氢气按一定比例混 合,其密度是相同状况下氢气的3.6倍。 取0.5mol该混合气发生反应达平衡,此时 容器内压强是同条件下反应前的0.76 倍。 求:
(1)反应前混合气中氮气和氢气的体积 比。
(2)平衡时氨气物质的量
(3)氮气的转化率 精品课件
解: (1)M混=2×3.6=7.2
