多肽物质分离与分析方法研究进展
大豆球蛋白的组成多肽分离及氨基酸组分分析

大豆球蛋白的组成多肽分离及氨基酸组分分析 3
郑志雄 ,杨晓泉
(华南理工大学轻工与食品学院食物蛋白工程研究中心 ,广东 广州 , 510640)
摘 要 通过 Nagano方法制备得纯度达 95%以上的大豆球蛋白 ,以其为原料 ,通过制备型液相色谱 ,对大豆球 蛋白的组成多肽进行了分离 。结果显示 :以 DEAE2Sepharose Fast Flow为分离介质 ,以含有 6 mol/L 碳酰二胺和 0102 mol/L巯基乙醇 、pH值为 6145的 0105 mol/L 磷酸缓冲液为平衡液 ,通过对穿透液及梯度洗脱液的分部收 集 ,大豆球蛋白的组成多肽能得到较好的分离 ,回收率达到 75% ,聚丙烯酰胺凝胶电泳显示各组分的纯度达 90%。此外 ,对各组成多肽的氨基酸组分及种类进行了分析 。 关键词 大豆球蛋白 ,多肽 ,分离 ,制备型液相色谱 ,氨基酸组分分析
样品按 1∶100 ( g∶mL )溶于 6mol/L HCl,密封后 110℃水解 24 h。使用装 P ICO1TAG柱的 HPLC系统 (W aters 510,美国 )于 38℃、检测波长 254 nm、流速 110 mL /m in状态下对氨基酸组成进行测定 ,结果表 示为 g /100 g蛋白质 。
agano方法提取制得大豆球蛋白sd2page电泳图谱212大豆球蛋白肽分离纯化按照11312中的层析条件以211中大豆球蛋白为原料经离子交换色谱分离得到包含各洗脱组分的洗脱图谱见图研究结果比较本试验的洗脱峰数量多1个即最后那个nknown此外第ori等人的这可能是因为本试验上样量远远大于他们的实验2sepharosefastflow洗脱图谱分别对不同收集管的收集样品进行sd2page分析结果见图4
鉴定多肽的方法

鉴定多肽的方法鉴定多肽的方法主要包括质谱分析、高效液相色谱(HPLC)、核磁共振(NMR)技术、芯片技术以及蛋白质组学数据库和计算分析。
质谱分析是基于质谱仪器的原理,通过将多肽样品离子化并分离质量/电荷比(m/z),可以获得多肽的质量信息。
质谱分析可以用于鉴定未知多肽、测定多肽的分子量和序列,以及定量分析多肽的表达水平。
高效液相色谱是一种常用的分离和纯化方法,也可以用于多肽组学检测。
HPLC将多肽样品通过液相色谱柱进行分离,根据不同多肽的亲水性、极性和其他性质,使其在柱中具有不同的保留时间。
这种方法可以用于分离复杂多肽混合物,纯化目标多肽,并帮助进一步的分析和表征。
核磁共振技术是一种用于研究多肽结构和动力学的方法。
通过核磁共振技术,可以确定多肽的原子间距离、化学位移和偶合常数,进而推断多肽的三维结构和构象。
NMR技术在研究多肽的折叠和相互作用方面具有重要的应用。
芯片技术是一种高通量的多肽组学检测方法。
通过将大量多肽固定在芯片上的微阵列区域,可以同时检测成千上万种多肽。
这种方法可以用于筛选与特定生物过程相关的多肽、研究多肽相互作用和识别多肽标记物等。
蛋白质组学数据库和计算分析在多肽组学中起着关键作用。
这些数据库收集整理了大量的多肽和蛋白质数据,并提供了用于多肽识别、鉴定和功能预测的工具和算法。
通过与这些数据库的比对和分析,可以帮助确定多肽的来源、结构和功能。
此外,对于较复杂的多肽类药物或多肽混合物来说,需要借助专属性更强的检测技术进行鉴定,如肽质量指纹图谱(PMF)、核磁共振技术(NMR)或质谱(MS)等鉴别方法。
核磁共振光谱适用于氨基酸数目小于10的多肽样品,对于10个以上氨基酸组成的多肽,NMR数据分析会受到一定的挑战,此时可以选择鉴定范围较宽的质谱技术进行鉴别研究。
如需更多信息,建议咨询专业生物学家或查阅生物学相关论文。
多肽类药物研究进展

多肽类药物研究进展
齐烨迪;苏慧;陈莉;赖昕;余丽双
【期刊名称】《福建分析测试》
【年(卷),期】2018(027)001
【摘要】多肽类药物在临床上被广泛应用于抗肿瘤、信息传导等方面,为生物医药的发展提供了强有力的支持,但由于其结构复杂、稳定性差、易降解等原因,使得对多肽类药物进行分析存在困难.近年来,随着仪器以及技术的发展,多肽类药物的分析方法有所发展.本文主要从生物活性分析、质谱法、光谱法、色谱法等方面对多肽类药物的分析方法进行综述,并对多肽类药物的发展前景进行展望.
【总页数】6页(P23-28)
【作者】齐烨迪;苏慧;陈莉;赖昕;余丽双
【作者单位】福建中医药大学,福建福州 350100;福建中医药大学,福建福州350100;福建中医药大学,福建福州 350100;福建中医药大学,福建福州 350100;福建中医药大学,福建福州 350100
【正文语种】中文
【中图分类】R284.2
【相关文献】
1.抗心肌缺血再灌注损伤多肽类药物的研究进展 [J], 何小奇; 邓莉
2.多肽类药物防治缺血性脑卒中的研究进展 [J], 梁旭玲; 邓莉; 梁泉燕; 朱艳
3.多肽类药物防治缺血性脑卒中的研究进展 [J], 梁旭玲;邓莉;梁泉燕;朱艳
4.蛋白多肽类药物和单抗药物免疫原性评价方法及研究进展 [J], 王慧敏;闻镍;王晓霞;刘丽;刘会芳
5.蛋白及多肽类药物长效化制剂学技术研究进展 [J], 丁源;陈新;涂家生;孙春萌因版权原因,仅展示原文概要,查看原文内容请购买。
活性多肽的实验报告

一、实验目的1. 学习活性多肽的提取方法。
2. 了解活性多肽的生物学活性及其作用。
3. 掌握活性多肽的鉴定与分析技术。
二、实验原理活性多肽是一类具有生物活性的小分子肽,由2个或2个以上氨基酸通过肽键相互连接而成。
它们在生物体内起着重要的生理调节作用,如免疫调节、细胞信号传导、生长调节等。
本实验通过提取活性多肽,对其生物学活性进行分析,探讨其在医学、食品、生物工程等领域的应用前景。
三、实验材料与仪器1. 实验材料:新鲜淡水鱼、生物酶、硫酸铵、盐酸、丙酮等。
2. 实验仪器:离心机、紫外可见分光光度计、pH计、电热恒温水浴锅、分析天平等。
四、实验方法1. 活性多肽的提取(1)取新鲜淡水鱼,去内脏、去皮,切成小块。
(2)将鱼块放入酶解液中,在50℃、pH 7.0条件下酶解4小时。
(3)酶解完成后,将混合液离心(3000 r/min,20 min)取上清液。
(4)用硫酸铵对上清液进行盐析,沉淀后用丙酮洗涤,去除杂质。
(5)将沉淀物溶于适量水中,调节pH至7.0,离心(3000 r/min,20 min)取上清液,即为活性多肽溶液。
2. 活性多肽的鉴定与分析(1)紫外可见分光光度法测定活性多肽浓度。
(2)采用SDS-PAGE电泳法对活性多肽进行分离鉴定。
(3)通过体外实验检测活性多肽的生物学活性,如免疫调节、细胞信号传导、生长调节等。
五、实验结果与分析1. 活性多肽的提取通过酶解、盐析、丙酮洗涤等步骤,成功提取出活性多肽溶液。
2. 活性多肽的鉴定与分析(1)紫外可见分光光度法测定活性多肽浓度为0.5 mg/mL。
(2)SDS-PAGE电泳结果显示,活性多肽分子量分布在500-3000 Da之间。
(3)体外实验结果表明,活性多肽具有免疫调节、细胞信号传导、生长调节等生物学活性。
六、实验结论1. 成功提取出淡水鱼活性多肽,并通过紫外可见分光光度法、SDS-PAGE电泳法对其进行了鉴定。
2. 活性多肽具有免疫调节、细胞信号传导、生长调节等生物学活性,为活性多肽在医学、食品、生物工程等领域的应用提供了理论依据。
多肽药物的质量控制技术研究

多肽药物的质量控制技术研究多肽药物是指由两个或更多的氨基酸残基以肽键连接而成的分子,具有较高的生物活性和特异性。
多肽药物在治疗某些疾病方面具有广泛的应用前景,但药物的质量与其安全性和有效性直接相关。
因此,多肽药物的质量控制技术研究至关重要。
一、多肽药物的质量控制技术概述多肽药物的质量控制包括药物的配方、制备、分离和纯化、质量检测等方面。
当然,质量控制的重点在于质量检测。
多肽药物的质量检测是一个系统的过程,它包括药物的原材料评估、药物的中间产品检测和药物的终端产品检测。
多肽药物的原材料评估主要包括对多肽原料的合法性和纯度进行检测。
原料的合法性检测主要是为了确保原料来源合法,没有违法添加有害物质。
原料的纯度检测则是为了确保所挑选的原料纯度较高,与制备药物适应。
多肽药物的中间产品检测是为了控制各生产环节中的质量,以便及时调整生产工艺和流程,避免不良品的产生,及时发现问题,有针对性解决生产过程中存在的问题。
多肽药物的终端产品检测是为了确保最终产品的质量和安全性。
终端产品检测要求比较严格,因为它与药物最终使用的效果直接相关。
二、多肽药物的质量检测技术1. 色谱分析技术色谱分析技术是多肽药物质量检测的重要手段。
目前,主要应用的是高效液相色谱(HPLC)和气相色谱(GC)。
HPLC技术是一种高效、准确、灵敏的方法,是分离、提纯、检测多肽药物的主要方法之一。
HPLC分离率高,检测精度高,准确性高,可检测非常小的样品,有很高的分辨能力和特异性。
GC技术则主要用于多肽休克素的质量控制。
由于多肽休克素粘度低,难以在HPLC中有效分离,在GC中得到更好的明暗效果。
2. 质谱技术质谱技术是多肽药物质量检测的关键技术之一,它具有高准确性、高灵敏度、成分分析能力强、无需标记等特点。
质谱分析的主要方法包括质谱测定、质谱碎片分析、电喷雾(ESI)和基质辅助激光解析(MALDI)等技术。
质谱技术是多肽药物质量检测的常用手段,也是研究药物药理活性、药物代谢及动力学方面的重要手段。
多肽类物质分析检测方法的研究进展

摘要在蛋白质组学研究中,多肽类物质的分析测定是非常重要和活跃的研究领域,从中可以发现和利用其重要的生物活性组分,是目前新药物研发的关键。
近年来,随着新仪器和检测技术的开发,国内外在研究多肽的分析检测方法上取得了较大进展。
就目前国内外多肽类物质分析测定的最新方法和进展情况加以概述。
关键词多肽分析高效液相色谱毛细管电泳质谱中图分类号TQ 464.7第一作者简介:杜晓宁女1955年生教授级高工从事同位素化学与仪器分析多肽是一种由56个天然氨基酸以不同组成和排列方式构成的聚合物,当氨基酸残基在20个以下时称为寡肽,超过20个氨基酸残基则称为多肽,当聚合的氨基酸多于50个时,常称为蛋白质。
通常在不严格区分的情况下,寡肽和多肽都称为多肽。
多肽广泛存在于自然界中,并对人体有着重要的生理作用。
近年来,随着生命科学研究的蓬勃发展,有关多肽的研究进展也日新月异。
多肽已在免疫功能、信息传导、细胞分泌、前体信号、疾病发生及治疗等方面显示出了神奇的研究应用价值。
在对多肽的结构与功能研究过程中,必然会涉及多肽的测定。
目前,多肽的测定主要包括结构的测定(即测定多肽的氨基酸组成、含量)及多肽测序(即组成多肽的氨基酸的连接次序)。
本文就目前国内外多肽类物质分析测定的最新方法和进展情况加以概述。
1多肽测定的传统方法传统的多肽结构测定方法是采用柱前或柱后衍生的氨基酸分析方法测定多肽水解后得到的各种氨基酸及其含量,以确定其组成;同时,还可根据氨基酸的数目计算多肽含量。
经典的多肽测序方法有N-末端序列测定的化学方法(Edman 降解法)和C-末端酶解方法两种[1],分别是利用不同的物质与多肽的N-端氨基或C-端羧基反应生成相应的氨基酸。
并将这一反应重复循环,测定多肽中的氨基酸排列顺序。
2多肽测定方法的新进展随着科学技术发展的日新月异,各种新的测试技术和检测仪器不断涌现,对于多肽,无论是在其结构测定还是测序方面均取得了巨大的进展。
目前,高效液相色谱(HPLC )、毛细管电泳(CE )、质谱(MS )及其联用技术已成为多肽测定的主要手段,并正得到越来越广泛的应用。
高效液相色谱在多肽分离分析中的应用

高效液相色谱在多肽分离分析中的应用李文龙;张慧;汤琦;高利龙;丛海林;于冰【摘要】多肽的高生物活性和低毒副作用使其成为近来国内外生命科学研究的热点,因此多肽的分离与分析也愈发的关键.高效液相色谱(HPLC)以其极高的分离效率和良好的选择性已经成为实验室和工业分离分析生物大分子最常用和有效的方法.本文主要介绍了HPLC以及一些新型色谱在多肽分析分离中的应用.%Polypeptide has become the focus of life science research at home and abroad because of its high bioactivity and low toxicity. High performance liquid chromatography(HPLC)with high separation efficiency and good selectivity has become the commonly used and the most effective method in laboratory and industrial separation and analysis of biological macromolecules. T his review mainly summarized the ap-plication of HPLC and some new chromatography techniques in the separation and analysis of polypep-tides.【期刊名称】《分析仪器》【年(卷),期】2018(000)001【总页数】5页(P63-67)【关键词】高效液相色谱;多肽;分离;分析【作者】李文龙;张慧;汤琦;高利龙;丛海林;于冰【作者单位】青岛大学生物医用材料与工程研究院,青岛大学化学化工学院,青岛266071;青岛大学生物医用材料与工程研究院,青岛大学化学化工学院,青岛266071;青岛大学生物医用材料与工程研究院,青岛大学化学化工学院,青岛266071;青岛大学生物医用材料与工程研究院,青岛大学化学化工学院,青岛266071;青岛大学生物医用材料与工程研究院,青岛大学化学化工学院,青岛266071;纤维新材料与现代纺织国家重点实验室培育基地,青岛大学材料科学与工程学院,青岛266071;青岛大学生物医用材料与工程研究院,青岛大学化学化工学院,青岛266071;纤维新材料与现代纺织国家重点实验室培育基地,青岛大学材料科学与工程学院,青岛266071【正文语种】中文随着生物化学技术的不断发展,多肽因其独特而又高效的吸收机制和非常强的生物活性,而成为生化专家们所关注和研究的热门材料。
多肽分析:揭示多肽的结构、功能与相互作用

多肽分析:揭示多肽的结构、功能与相互作用在我们的身体中,有着无数的生物分子共同建筑着我们生命的美妙。
其中,多肽,这种由数个至数百个氨基酸连接而成的物质,就是这个复杂生命体系中最基本,也是最重要的组成部分之一。
它们可以组成各种重要的生物大分子,如酶、抗体、受体和激素,并且控制生命中各种关键的生理过程。
从基础科研实验室到医药工业实践,多肽分析都是关注的重点,让我们一起了解这个令人兴奋的领域。
一、多肽的结构。
多肽是由许多氨基酸通过肽键连接起来的分子链。
这些氨基酸的次序即所谓的多肽序列,决定了多肽的化学性质和空间构象。
多肽可以进一步折叠,形成二级、三级、甚至四级结构,这些级别的结构以及其相互间的相互作用都决定了多肽的功能。
图1。
用于分析多肽结构的技术主要有X光晶体学、核磁共振以及冷冻电镜等。
这些方法能够在分子级别观察多肽的结构,为我们理解其结构提供了巨大的可能性。
二、多肽的功能。
多肽的功能多种多样,与其结构紧密相关。
如酶是一种具有催化功能的多肽,可催化生物体内的各种反应;抗体是一种识别并破坏病原体的多肽,具有保护机体免受病原体侵害的功能;激素是一种信号传递的多肽,能够调控生物体的许多生理过程。
我们可以通过多种实验方式来研究多肽的功能,如使用分子生物学的方法来研究酶的活性,使用免疫学的方法来研究抗体的识别能力,以及使用细胞生物学的方法来研究激素的作用。
三、多肽的相互作用。
多肽间的相互作用对生命活动的正常进行具有关键性的影响。
比如蛋白质之间的互作,是细胞内许多过程的基础,如信号转导、基因表达、能量代谢等。
针对多肽相互作用的研究,将使我们在理解生物体内复杂的生命过程,以及寻找疾病治疗新方法上取得更大的进展。
例如,相互作用网络可作为寻找药物靶点的新策略,对抗生素研发等具有广泛应用。
总的来说,多肽的结构、功能以及相互作用的分析研究,是揭示生命活动的基本过程以及开发新药的基础。
随着科研技术的不断进步,我们对于多肽的理解将会越来越深入,相信在不远的将来,我们会利用多肽,创造出更多治疗疾病,促进健康的新方法。
多肽检测方法研究进展

多肽检测方法研究进展栾崇林;蒋晓华;金刚;代建国【摘要】本文对质谱法(MS)、液相色谱质谱联用法(LC-MS)、毛细管电泳质谱联用(CE-MS)法、光谱分析法等在多肽检测中的最新进展进行了综述。
质谱检测多肽最大的优势在于稳定性、重现性好,准确性高。
采用色谱或电泳分离技术与质谱联用可解决相同氨基酸组成但序列不同的多肽的检测。
光谱技术检测多肽,通常无需样品预处理分离,且光谱技术设计的多肽传感方式灵活多变,但光谱技术往往需要借助其他方法才可对多肽进行定性分析,因此该方法不具有普遍性。
%In this paper, a review was made on study of mass spectrometry, liquid chromatography-mass spectrometry (LC-MS), capillary electrophoresis-mass spectrometry (CE-MS), spectroscopic method and other approachesin detection of polypeptide. Mass spectrometry approach is characterized by good stability, reproducibility and accuracy. LC-MS or CE-MS can detect polypeptide with the same amino acid composition but different sequence of amino acid. Spectrometry can detect Polypeptide with great flexibility to transduce the detecting signals without sample pretreatment and separation, but it cannot conduct a qualitative analysis of polypeptide, which limits its wide application.【期刊名称】《深圳职业技术学院学报》【年(卷),期】2014(000)005【总页数】6页(P54-59)【关键词】多肽;质谱;色谱;荧光;检测【作者】栾崇林;蒋晓华;金刚;代建国【作者单位】深圳职业技术学院应用化学与生物技术学院,广东深圳 518088;深圳职业技术学院应用化学与生物技术学院,广东深圳 518088;深圳职业技术学院应用化学与生物技术学院,广东深圳 518088;深圳职业技术学院应用化学与生物技术学院,广东深圳 518088【正文语种】中文【中图分类】O656.31多肽通常是指由10~100个氨基酸分子脱水缩合而成的化合物.也有文献将2~10个氨基酸组成的肽称为寡肽,10~50个氨基酸的组成的肽称为多肽,50个以上氨基酸组成的肽称为蛋白质[1].多肽种类繁多,几乎参与生物体的生长、发育、免疫、新陈代谢等各个环节,如促进矿物质吸收的肽(CPPS)、酶调节剂(如促胰酶肽)、激素肽(如生长激素释放因子GRFS)等[2].多肽作为生物标志物还涉及到某些疾病的病理研究,如β淀粉样肽在脑中的沉积与阿尔兹海马病密切相关[3-6],血清多肽对于一些恶性肿瘤的诊断也很有帮助[7].除此以外,某些动物在受到外界刺激时,会产生大量的具有抗菌活性的多肽,这些多肽不仅具有很强的杀菌能力,有的还可杀死肿瘤细胞[8],这类特殊的多肽被称为抗菌肽,目前并已被应用于食品、饲料添加剂及药物的开发等.本文根据检测技术的分类,对检测多肽的新方法研究进展进行综述,并对多肽检测领域的发展前景进行展望.用质谱所检测出的多肽质量谱图,通常被称为指纹图谱.质谱检测的多肽最大的优势在于稳定性、重现性好,准确性高.目前将质谱技术应用于多肽检测主要有基质辅助激光解吸飞行时间质谱(MALDI-TOF-MS)方法、液相色谱—质谱联用(LC-MS)方法以及毛细管电泳-质谱联用(CE-MS)方法.MALDI-TOF-MS法所用仪器主要由2部分组成:基质辅助激光解吸电离离子源(MALDI)和飞行时间质量分析器(TOF).MALDI的原理是用激光照射样品与基质形成的共结晶薄膜,基质从激光中吸收能量传递给生物分子,电离过程中将质子转移到生物分子或从生物分子得到质子,而使生物分子电离.TOF的原理是离子在电场作用下加速飞过飞行管道,根据到达检测器的飞行时间不同而被检测,即测定离子的质荷比(M/Z)与离子的飞行时间成正比.MALDI-TOF-MS法具有灵敏度高、准确度高、分辨率高及自动化程度高、分析速度快等特点,而且能满足多肽组学和蛋白组学高通量检测分析的要求.然而MALDI-TOF-MS法对多肽检测时,它仅对含精氨酸的多肽有较高的精确度.2000年,Hale课题组提出将赖氨酸上的ε氨基修饰O-甲基异脲,使其变成高精氨酸,这样使得赖氨酸也很容易被检测到,此方法大大提高了检测胰蛋白酶分解的多肽片段的灵敏度,并对于含有很高的(赖氨酸/精氨酸)含量比值的多肽的检测非常有效[9].2010年,Wu课题组首次报道了将半胱氨酸修饰的 Mn2+掺杂 ZnS纳米颗粒(即Mn2+-doped ZnS@cysteine NPs)作为基质,用MALDI-TOF-MS检测多肽的方法[10].与其他的基质相比,如ZnS NPs、Zn@Cyseine NPs以及α-氰基-4-羟基肉桂酸(CHCA),在水相中合成的该Mn2+-doped ZnS@cysteine NPs纳米基质在检测小分子多肽方面以及在检测灵敏度方面更具优越性,并且此方法成功应用到了尿样中多肽混合物的检测.随后,2011年Lie课题组研究出了简单、灵敏、高通量的用MALDI-TOF-MS检测多肽的新方法,他们通过将量子点加入基质中使其得以改善,检测多肽及混合物时,灵敏度大大提高[11].以上2种方法均是通过改善基质来提高多肽检测的灵敏度.也有研究者通过改善样品前处理过程,以达到提高检测灵敏度的目的.2012年,Nadnudda等人设计了一种非常灵敏的用MALDI-MS法检测血清中多肽的新方案,他们利用正电或者负电两性均聚物形成反向胶束,对预先除去HSA和IgG的血清中的低丰度多肽如血管缓激肽、C4a、ITIH4等以及生物标志物前列腺抗原(PSA)分别进行选择性的预富集处理,再利用MALDI-MS对经过预富集处理后的样品进行检测,灵敏度大大增强,检测血管缓激肽、C4a、ITIH4检出限分别为0.5、0.08、0.2 ng/mL,PSA的检出限为0.5 ng/mL[12].2013年,Lai课题组着重于改善MALDI-TOF质谱法的免疫共沉淀的预处理步骤,设计了一种非常灵敏的检测淀粉肽β1-28的新方法,并实现了其在人血浆中灵敏度低至6.14 pm的检测[13].他们通过提高抗体与小分子多肽的亲和力,对其在复杂的人血浆基质中进行预富集.合成含有6E10和4GB两种淀粉肽β1-28单克隆抗体组合而成的F(ab’)-(PEG)24小球,通过两种抗体对目标多肽的共同的亲和作用力将其分离,使得检测灵敏度大大增强.除以上的一些方法以外,也有研究者对某些含有特殊氨基酸的多肽进行了检测.有数据表明97%的蛋白和17%的多肽片段都含有半胱氨酸,因此若能提高半胱氨酸的检测灵敏度便能提高质谱低丰度蛋白、多肽检测灵敏度.2012年Shimada等人设计了 6种半胱氨酸的标记物,大大提高了MALDI-TOF-MS检测含有半胱氨酸的多肽的检测灵敏度,从而也提高了亲水性多肽、低丰度多肽的检测灵敏度[14].然而,质谱在检测具有相同氨基酸组成但序列不同的多肽时,由于它们具有相同的分子量,给出等同的分子离子峰,因此不能满足多肽结构的解析工作.采用色谱或电泳分离技术与质谱联用是解决这一问题的很好途径.2003年,Thomas等人将液相色谱法与质谱联用,实现了血管紧张肽Ⅱ、铃蟾肽、缓激肽、黑化诱导神经肽、神经降压肽和P物质等多种多肽的检测,检出限低至1 ng/mL,线性范围1-100 ng/mL,并随后用质谱实现了含氯水中的多肽氧化产物的定性检测[15].2005年,Karine等人发展了一种将高场非对称波形离子迁移谱(FAIMS)与纳米液相色谱-质谱(nanoLC-MS)结合的方法,即nanoLC-FAIMS-MS,该法可从复杂的胰蛋白酶水解物中灵敏而选择性地检测多电荷的肽离子.FAIMS技术作为一种气相离子分离技术,可以减少化学噪音,增强多肽的检测信号,与传统的nanoLC-MS技术比,信噪比提升了6~12倍,可检测出的多肽的数量提升了 20%[16].2006年,Mario等人利用LC-MS技术实现了人类尿液中兴奋剂胰岛素类似物的灵敏检测,他们将固相微萃取技术与免疫亲和纯化技术结合,从而实现了人类尿液中目标物的浓缩富集和分离,随后利用在线质谱进行定性,然后再通过LC-MS技术对赖脯胰岛素(Humalog LisPro)、门冬胰岛素(Novolog Aspart)以及赖谷胰岛素(Apidra Glulisine)进行了定量分析,检出限低至0.05 ng/mL (9fmol/mL)[17].2009年,Andreas等人也利用LC-MS实现了人类尿液中二十四肽促皮质素的检测,他们用表面覆盖抗体的磁性小球对目标物进行磁分离(免疫亲和纯化技术)预富集处理,随后用LC-MS进行定性定量分析,最后实现了尿样中目标物二十四肽促皮质素的检测,检出限低至3 pg/mL[18].2009年,刘丽红等建立了一种氨基酸组成相同序列不同的多肽的LC-ESI-MS分析新方法.在反向色谱模式下,2种小分子三肽Gly-Phe-Ser和Gly-Ser-Phe实现了较好的分离,实验证实,流动相组成及pH值对分离行为及检测灵敏度具有重要影响,在以20mmol/L乙酸铵-水-乙腈(50:45:5,V/V/V)作为流动相在pH7的条件下洗脱,该方法重现性好、准确度高、灵敏度高.此方法的建立对其他此类氨基酸组成相同序列不同的蛋白质及多肽的分离分析具有参考意义[19].与HPLC相比,毛细管电泳(CE)的分离效率更高、上样量更少,是一种灵敏的多肽检测方法.周国华等以血管紧张素Ⅰ、Ⅱ、Ⅲ、P-物质和生长激素抑制剂混合物为测定对象,用CE-ESI-MS法分离鉴定了5种生物活性肽.pH为5.0和4.5的NH4Ac缓冲液能在LPA涂层柱和胺涂层柱上很好地分离上述5种肽类混合物.在选择的离子检测模式下,检出限(3δ)分别约为193、240、804、153和185 fmol,测定相对误差(%)分别为0.015、-0.067、0.064、-0.031和0.074[20].Varesio E.等建立了一种测定人血浆中 amyloid-β肽(Mr=4330.0,40个氨基酸)的CE-MS方法.并利用柱切换技术克服了毛细管柱底灵敏度,不易进行体内低浓度样品测定的缺点.采用HP1100 MSD单级四级杆质谱,选用ESI离子源,正离子检测,采用SIM模式.最低检测限为50ng/mL[21].荧光光谱多肽分析法通常通过体系中多肽的含量所引起的体系荧光强弱的变化而实现多肽的检测.2009年,Hamachi课题组设计了一种新型的针对双磷酸化多肽的荧光探针 1-2Zn()Ⅱ,实现了 10-6mol/L双磷酸化多肽的检测.现有的2-2Zn( )Ⅱ探针对于不同位点磷酸化(i, i + n)的多肽都能检测,但选择性较差,而 1-2Zn()Ⅱ探针专门针对双磷酸化位点为(i, i+1)的多肽,因此与现有的双磷酸化多肽探针 2-2Zn()Ⅱ相比,性能更优越,选择性更好[22].2010年,Lim等人合成了一种选择性检测半胱氨酸或者含 N-端半胱氨酸残基多肽的荧光探针,该探针为不饱和醛基功能化的发色团,该物质与含巯基的半胱氨酸或者半胱氨酸残基反应后的生成物,可产生强烈的荧光,即产生与目标物相关的“turn-on”模式的信号响应[23].近些年,随着荧光共振能量转移(FRET)火热发展,FRET技术已经广泛应用到了各类生物和化学物质的分析检测之中[24-27],多肽的检测也不例外.2012年,Takahashi等人设计出了一种可检测淀粉体多肽Aβ1-42的蛋白,并将其命名为CPYAB4,由荧光供体蓝绿色荧光蛋白 CFP、荧光受体黄色荧光蛋白YFP以及连接序列GGS三部分构成.体系中不含目标物情况下,CPYAB4发生分子内的FRET效应,CFP荧光有效猝灭,荧光强度极弱;当体系中含有目标物淀粉体多肽Aβ1-42时,CPYAB4与其发生反应,结构发生变化,CFP与YFP之间距离发生变化,于是阻碍了CPYAB4分子内的FRET效应,CFP的荧光不能被有效猝灭,体系荧光大大增强,其增强程度与Aβ1-42的浓度密切相关[28].除了上述利用荧光方法检测多肽以外,其他的一些光谱技术也逐渐深入到多肽检测的领域中来.例如,在2005年Xie等人用拉曼光谱来表征氨基酸,通常磷酸化的氨基酸和多肽由于–OPO32-与–OPO3H-的存在随着体系pH的变化而变化,而拉曼光谱中,980 cm-1和 1080 cm-1处的磷酸丝氨酸带(–OPO3H-)和磷酸苏氨酸带(–OPO32-)容易受临近基团的影响,从而为磷酸化的氨基酸和多肽的表征带来了困难,于是 Xie等人利用 drop coating deposition Roman(DCDR)方法很好地解决了以上问题,顺利地对不同pH体系中的磷酸质子化的多肽和氨基酸进行了表征[29].另外,在 2010年,Mustafa等人利用椭圆偏振光谱测量的内部全反射模式(TIRE)检测β-淀粉样肽Aβ(1-16),在该法中,利用Aβ(1-16)以及其单克隆抗体DE2直接免疫反应而形成的复合物静电吸附于金表面,从而实现了β-淀粉样肽(1-16)在0.05 ng/ml ~ 5 ug/ml范围内的免标记检测[30].随后在2011年,Wang等人设计了一种共振光散射检测β-淀粉肽1-42的方法.基于纳米金聚集后产生更强的光散射信号,目标分子的出现会引起纳米金的聚集状态.当体系中没有Aβ1-42时,预先存在的Zn2+首先会引起生物素修饰的Aβ1-16聚集,亲和素修饰的纳米金也因表面的亲和素与生物素间较强的作用而产生聚集,因而产生很强的共振光散射信号;体系中含有Aβ1-42时,Zn2+与Aβ1-42 作用力更强而优先与之发生反应,使得之前的纳米金聚集反应无法顺利进行,共振光散射信号明显减弱,其信号减弱程度与目标物Aβ1-42的浓度密切相关[31].总之,利用光谱技术检测多肽,通常无需复杂的样品前处理分离技术,且光谱技术设计的多肽传感器灵活多变,适用于各种不同体系下的多肽检测.Hou等发展了一种简单、快速,超灵敏的检测生物素修饰的多肽的方法[32].该方法首先将生物素修饰的多肽固载于硝化纤维膜上,通过抗体与生物素之间的反应,抗体修饰的纳米金发生反应后形成红点,红点的强度通过Quantity One(一种定量分析软件)记录.检出限低至100 amol,检出范围是1pmoL~1μmol.随后用银进行信号放大,灵敏度低至100 zmol,检出范围100 zmoL~100 fmol.再如,Brambilla等人将毛细管电泳与激光诱导荧光结合(CE-LIF),有效地检测并监控了β-淀粉样多肽与聚合纳米颗粒的相互作用,为CE-LIF法的开发提供了一定的实验和理论基础,开辟了新的研究前景[33].Kawulka 等采用同位素标记技术,以13C、15N 标记化合物的核磁共振(NMR)新技术测定了一种分离自一种细菌Bacillus subtilis 中新的抗微生物多肽Subtilosin A的结构,最新出现的HPLC-MS-NMR联用集合了HPLC-MS 与HPLC-NMR 这两种联用技术的优点,使得在线获得更多的多肽产物样品的结构信息成为可能[34].Louden 等以D2O 为流动相在线联用HPLC-UV-IR,-HNMR-MS技术分离分析了Sileneotites,Silenenutans,Silenef rivaldiskyana的提取物中的20 种蜕皮激素和蜕皮类固醇[35].杨茜璐等建立了一种非探针标记型磷酸化多肽的电化学检测方法,该方法以N,N-二(羧甲基)–L-赖氨酸(Lys-NTA)和Fe3+修饰的金电极作为磷酸化多肽的捕获和传感界面,利用磷酸化多肽能够与之形成金属离子螯合物而发生特异性结合并引起电极表面修饰层通透性改变等特点,采用铁氰化钾作为电化学指示剂,用循环伏安法和交流阻抗法对磷酸化多肽的结合进行表征和检测.磷酸化多肽浓度在5~75 μmo l/L时,循环伏安图中峰电流随着磷酸化多肽浓度的增大而增大,而非磷酸化多肽不能引起峰电流变化[36].研究者已经开发出多种依赖不同的检测技术的多肽检测方法,并已经成功实现了多肽超高灵敏性,高选择性的检测,并为生物医药、临床病理论等方面的研究提供了强有力的支持.然而,很多多肽片段因其分子量小,结构普通,对它们的在复杂基质中(如尿液,血浆等)超痕量的检测仍然存在着巨大的挑战,多肽检测方法的开发仍然还有很大的探索空间.尤其是电化学方法作为新兴的多肽检测方法,具有所用仪器简单、灵敏、快速等特点,是一个很有发展潜力的分析技术.【相关文献】[1] 杜晓宁,宋明鸣.多肽类物质分析检测方法的研究进展[J].上海化工,2009,34(11):6-11.[2] Barroso O, Handelsman DJ, Strasburger C, et al. Analytical challenges in the detectionof peptide hormones for anti-doping purposes[J]. Bioanalysis, 2012,4(13):1577-1590.[3] Takahashi T, Mihara H. FRET detection of amyloid betapeptide oligomerization using a fluorescent protein probe presenting a pseudo-amyloid structure[J]. Chemical Communications, 2012,48(10):1568-1570.[4] Hardy J, Selkoe D J. The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics[J]. Science, 2002,297(5580):353-356.[5] Qiu W Q, Folstein M F. Insulin, insulin-degrading enzyme and amyloid-beta peptide in Alzheimer's disease: review and hypothesis[J]. Neurobiology of Aging, 2006,27(2):190-198.[6] LaFerla F M, Green K N, Oddo S. Intracellular amyloidbeta in Alzheimer's disease[J]. Nature Reviews Neuroscience, 2007,8(7):499-509.[7] Ahn S, Simpson R J. Body fluid proteomics: prospects for biomarker discovery[J]. Proteomics Clin Appl, 2007(1):1004-1015.[8] David W. Hoskin , Ayyalusamy Ramamoorthy. Studies on anticancer activities of antimicrobial peptides[J]. Biochimica et Biophysica Acta, 2008,1778:357-375.[9] Hale J E, Butler J P, Knierman M D, et al. Increased sensitivity of tryptic peptide detection by MALDITOF mass spectrometry is achieved by conversion of lysine to homoarginine[J]. Analytical Biochemistry, 2000,287(1):110-117.[10] Kailasa SK, Wu HF. Interference free detection for small molecules: probing theMn2+-doped effect and cysteine capped effect on the ZnS nanoparticles for coccidiostats and peptide analysis in SALDI-TOF MS[J]. The Analyst, 2010,135(5):1115-1123.[11] Liu CW, Chien MW, Chen GF, et al. Quantum dot enhancement of peptide detectionby matrix-assisted laser desorption/ionization mass spectrometry[J]. Analytical Chemistry, 2011,83(17):6593-6600.[12] Rodthongkum N, Ramireddy R, Thayumanavan S, Richard WV. Selective enrichment and sensitive detection of peptide and protein biomarkers in human serum using polymeric reverse micelles and MALDI-MS[J]. The Analyst, 2012,137(4):1024-1030.[13] Kaneko N, Yoshimori T, Yamamoto R, et al. Multi epitope-targeting immunoprecipitation using F(ab') fragments with high affinity and specificity for the enhanced detection of a peptide with matrix-assisted laser desorption ionization-time-of-flight mass spectrometry[J]. Analytical Chemistry, 2013,85(6):3152-3159.[14] Shimada T, Kuyama H, Sato TA, et al. Development of iodoacetic acid-based cysteine mass tags: detection enhancement for cysteine-containing peptide by matrix-assisted laser desorption/ionization time-offlight mass spectrometry[J]. Analytical Biochemistry,2012,421(2):785-787.[15] Bjellaas T, Holm A, Molander P, et al. Trace determination of peptides in water samples using packed capillary liquid chromatography with UV and MS detection and characterization of peptide oxidation products by MS[J]. Analytical and Bioanalytical Chemistry, 2004,378(4):1021-1030.[16] Venne K, Bonneil E, Eng K, et al. Improvement in peptide detection for proteomics analyses using NanoLC-MS and high-field asymmetry waveform ion mobility mass spectrometry[J]. Analytical Chemistry, 2005,77(7):2176-2186.[17] Thevis M, Bredehoft M, Geyer H, et al. Determination of Synacthen in human plasma using immunoaffinity purification and liquid chromatography/tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry: RCM, 2006,20(23):3551-3556.[18] Thomas A, Kohler M, Schanzer W, et al. Determination of Synacthen in urine for sports drug testing by means of nano-ultra-performance liquid chromatography/tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry: RCM, 2009,23(17):2669-74.[19] 刘丽红,陈子林.氨基酸组成相同序列不同的小分子多肽的液相色谱-质谱联用分析[J].中国科学 B辑:化学,2009,39(8):800-805.[20] 周国华,罗国安,周克玉,等.毛细管电泳质谱联用技术测定肽和蛋白质混合物[J].高等学校化学学报,1998,19(3):353-358.[21] Varesio E,Rudaz S, Krause K H, et al. Nanoscale liquid chromatography and capillary electrophoresis coupled to electrospray mass spectrometry for the detection of amyloid-βpeptide related to Alzheimer’s disease[J]. J Chromatorgr A, 2002,974:135-138.[22] Ishida Y, Inoue M A, Inoue T, Ojida A, Hamachi I. Sequence selective dual-emission detection of (i, i + 1) bis-phosphorylated peptide using diazastilbene-type Zn(II)-Dpa chemosensor[J]. Chemical Communications, 2009(20):2848-2850.[23] Lim S, Escobedo J O, Lowry M, et al. Selective fluorescence detection of cysteine and N-terminal cysteine peptide residues[J]. Chemical Communications, 2010,46(31):5707-5709.[24] Shaner N C, Patterson GH, Davidson MW. Advances in fluorescent protein technology[J]. Journal of Cell Science, 2007,120(Pt 24):4247-4260.[25] Tadross M R, Park S A, Veeramani B, et al. Robust approaches to quantitative ratiometric FRET imaging of CFP/YFP fluorophores under confocal microscopy [J]. Journal of Microscopy, 2009,233(1):192-204.[26] Kotera I, Iwasaki T, Imamura H, Noji H, Nagai T. Reversible dimerization of Aequorea victoria fluorescent proteins increases the dynamic range of FRET-basedindicators[J]. ACS Chemical Biology, 2010,5(2):215-222.[27] Miyawaki A, Llopis J, Heim R, et al. Fluorescent indicators for Ca2+based on green fluorescent proteins and calmodulin[J]. Nature, 1997,388(6645):882-887.[28] Takahashi T, Mihara H. FRET detection of amyloid beta-peptide oligomerization usinga fluorescent protein probe presenting a pseudo-amyloid structure [J]. Chemical Communications, 2012,48(10):1568-1570.[29] Xie Y, Jiang Y, Ben-Amotz D. Detection of amino acid and peptide phosphate protonation using Raman spectroscopy[J]. Analytical Biochemistry, 2005,343(2):223-230.[30] Mustafa MK, Nabok A, Parkinson D, Tothill IE, Salam F, Tsargorodskaya A. Detection of beta-amyloid peptide (1-16) and amyloid precursor protein (APP770) using spectroscopic ellipsometry and QCM techniques: a step forward towards Alzheimers disease diagnostics[J]. Biosensors & Bioelectronics, 2010,26(4):1332-1336.[31] Wang C, Liu D, Wang Z. Resonance light scattering as a powerful tool for sensitive detection of beta-amyloid peptide by gold nanoparticle probes[J]. Chemical Bommunications, 2011,47(33):9339-9341.[32] Hou SY, Chen HK, Cheng HC, et al. Development of zeptomole and attomolar detection sensitivity of biotin-peptide using a dot-blot gold nanoparticle immunoassay[J]. Analytical Chemistry, 2007,79(3):980-985.[33] Brambilla D, Verpillot R, Taverna M, De Kimpe L, Le Droumaguet B, Nicolas J, et al. New method based on capillary electrophoresis with laser-induced fluorescence detection (CE-LIF) to monitor interaction between nanoparticles and the amyloid-beta peptide[J]. Analytical Chemistry, 2010,82(24):10083-10089.[34] Kawulka K, Sprules T, McKay R T, et al.Structure of subtilosin A, an antimicrobial peptide from Bacillus subtilis with unusual posttranslational modificationslinking cysteine sulfurs to alpha-carbons of phenylalanine and threonine[J]. J Am Chem Soc, 2003,125(16):4726-4727.[35] Louden D, Handley A, Lafont R, et al. HPLC analysis of Ecdysteroids in plant extracts using superheated deuterium oxide with multiple on line spectroscopic analysis (UV, IR,H-1,NMR, and MS) [J]. Analytical Chemistry, 2002,74(1):288-294.[36] 杨茜璐,朱微,张冬梅,等.电化学检测磷酸化多肽的研究[J].分析试验室,2011,30(3):2011-2013.。
多肽药物HPLC纯度分析
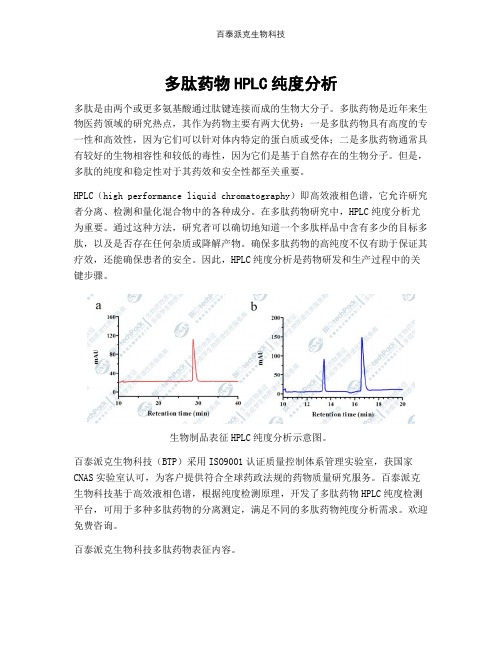
多肽药物HPLC纯度分析
多肽是由两个或更多氨基酸通过肽键连接而成的生物大分子。
多肽药物是近年来生物医药领域的研究热点,其作为药物主要有两大优势:一是多肽药物具有高度的专一性和高效性,因为它们可以针对体内特定的蛋白质或受体;二是多肽药物通常具有较好的生物相容性和较低的毒性,因为它们是基于自然存在的生物分子。
但是,多肽的纯度和稳定性对于其药效和安全性都至关重要。
HPLC(high performance liquid chromatography)即高效液相色谱,它允许研究者分离、检测和量化混合物中的各种成分。
在多肽药物研究中,HPLC纯度分析尤为重要。
通过这种方法,研究者可以确切地知道一个多肽样品中含有多少的目标多肽,以及是否存在任何杂质或降解产物。
确保多肽药物的高纯度不仅有助于保证其疗效,还能确保患者的安全。
因此,HPLC纯度分析是药物研发和生产过程中的关键步骤。
生物制品表征HPLC纯度分析示意图。
百泰派克生物科技(BTP)采用ISO9001认证质量控制体系管理实验室,获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务。
百泰派克生物科技基于高效液相色谱,根据纯度检测原理,开发了多肽药物HPLC纯度检测平台,可用于多种多肽药物的分离测定,满足不同的多肽药物纯度分析需求。
欢迎免费咨询。
百泰派克生物科技多肽药物表征内容。
多肽药物检测新技术:探索肽图分析流程

多肽药物检测新技术:探索肽图分析流程多肽药物是一类具有广泛应用前景的生物药物,其独特的结构和功能使其成为治疗多种疾病的有力工具。
然而,多肽药物的复杂性和多样性给其检测和分析带来了挑战。
为了更好地理解和应用多肽药物,科学家们不断探索新的检测技术。
本文将介绍一种新兴的技术——肽图分析流程,以帮助读者更好地了解多肽药物的检测方法和应用。
图1。
一、什么是肽图分析流程?肽图分析流程是一种基于质谱技术的多肽药物检测方法。
质谱技术是一种通过测量分子的质量和电荷比来确定其结构和组成的方法。
肽图分析流程利用质谱技术对多肽药物进行定性和定量分析,从而获得关于多肽药物的结构、序列、修饰和含量等信息。
二、肽图分析流程的步骤肽图分析流程主要包括样品制备、质谱分析和数据解析三个步骤。
1.样品制备。
样品制备是肽图分析流程的第一步。
在这一步骤中,科学家们需要从样品中提取多肽药物,并进行前处理步骤,如蛋白酶消化、样品纯化等。
样品制备的质量和效率对后续的质谱分析结果有重要影响。
2.质谱分析。
质谱分析是肽图分析流程的核心步骤。
在这一步骤中,科学家们使用质谱仪对样品中的多肽药物进行分析。
质谱仪可以将多肽药物分子离子化,并通过测量离子的质量和电荷比来确定其结构和组成。
常用的质谱技术包括质谱仪、液相色谱质谱联用技术等。
3.数据解析。
数据解析是肽图分析流程的最后一步。
在这一步骤中,科学家们对质谱分析得到的数据进行处理和解释。
通过比对实验数据和已知的多肽药物数据库,科学家们可以确定多肽药物的序列、修饰和含量等信息。
数据解析的准确性和可靠性对于多肽药物的研究和应用至关重要。
三、肽图分析流程的应用肽图分析流程在多肽药物研究和开发中具有广泛的应用前景。
1.多肽药物质量控制。
肽图分析流程可以用于多肽药物的质量控制。
通过对多肽药物样品进行质谱分析和数据解析,科学家们可以确定多肽药物的纯度、序列和修饰等信息,从而保证多肽药物的质量和安全性。
2.多肽药物代谢研究。
浅析多肽类药物常用的分析方法

l 0 2
北方药学 2 0 1 3年第 1 0卷第 7期
法探究 了力达霉素在小 鼠和犬 中的药 物代 谢动力学 ,结 合同 位素跟踪法反应了药物代谢 的过程 。 2 . 2同位素示踪技术 : 同位 素示踪 技术 包括稳定 同位 素示 踪技 术和放射性同位素示踪技术两种 。前者无放射性 , 但是其物理 和化学性质较 为稳定 , 因此 , 在药物合成过程 中引入稳 定同位 素, 通过气质 和液质方法进行定量测定。放射性 同位素示踪技 术 由于具有放 射性 , 其灵敏 度更高 , 操作起 来也更方 便快捷 ,
癌 细胞 的凋 亡过程。多肽类抗癌药物 由于其能够成 为肿瘤基 因表达时 的调控 因子 , 因而成为 了抗癌药物研究 的新 希望 。 抗病毒类多肽药 物 : 一般来说 , 病毒感染细胞 的过程包括 以下几 个主要 阶段 : 吸附 、 自我复 制 、 重新组合 、 释 放病毒等 。 因此 ,抗病毒类 药物多在阻止以上某一过程或者多个 过程发 生。 抗 病毒多肽通 常作用 于病毒吸附和病毒复制两个阶段 , 通 过与宿主细胞特异性结合或者病毒蛋 白酶结合来发挥作用 。 2多肽类药物的常用分析方法 2 . 1生物检定 法 : 不 同类 型的多肽具有 不 同的生 物活性 , 多肽 类药物 的一级结构 ,包括二三级结 构都 与其生物有着密 切的 关系。因此 , 生物检定法可以用来研究多肽类药物的药物动力 学及其生物活性 。 目前 , 生物检定法主要有两种方 式 : 活 体检 定法和体外检定法 。活体检定法检测 动物对某种多肽类 药物 的反应 , 提供 相应 的实验数据支持 。陈淑珍I l _ 等利用生物 检定
北方药学 2 0 1 3年第 1 0卷第 7期 特别注意 , 尽 量避免发生不 良反应 。
多肽 紫外 检测实验报告

多肽紫外检测实验报告一、实验目的本实验旨在通过紫外光谱技术对多肽进行检测,以确定其吸收光谱特征,分析其结构和浓度。
二、实验原理紫外检测是一种测量样品在紫外区域内吸收辐射的技术。
多肽是由许多氨基酸组成的生物大分子,其结构和成分决定了其在紫外区域的吸收特征。
在紫外光谱中,主要关注的是多肽的吸收峰和峰位,通过测量其光谱吸收值可以确定多肽的浓度。
三、实验步骤1. 准备样本:将多肽样品溶解于适当的溶液中,使其浓度在检测范围内。
2. 设置分光光度计:将分光光度计调节至紫外检测模式。
3. 调节样品池:将样品池对准光路,并清洁样品池表面。
4. 添加样品:取适量的多肽样品,滴入样品池中。
5. 测量吸收谱:设置波长扫描范围和扫描速率,开始测量紫外吸收谱。
6. 记录数据:记录吸光度和波长的数据,制作吸收曲线。
7. 分析数据:根据吸收峰的位置和强度,分析多肽的结构和浓度。
四、实验结果与分析通过测量我们得到了多肽的吸收曲线,如下图所示:从曲线中可以看出,在280nm附近存在一个明显的吸收峰。
根据文献报道,280nm处是由多肽中的芳香性氨基酸(如酪氨酸、酪氨酸、色氨酸等)引起的吸收峰。
该峰的强度与多肽的浓度成正比,因此可以通过测量该峰的吸收强度来确定多肽的浓度。
根据实验数据计算,我们得到样品的浓度为2mg/mL。
同时,根据吸收峰的形态和峰位可以初步确定多肽的结构。
五、实验总结本实验通过紫外光谱技术对多肽进行了检测,并成功得到了多肽的吸收曲线。
通过分析曲线,我们可以确定多肽的结构和浓度。
实验结果表明,在280nm附近存在一个明显的吸收峰,通过测量该峰的吸收强度可以确定多肽的浓度。
但是需要注意的是,紫外光谱检测只能提供多肽结构的初步信息,结合其他分析方法才能得到更准确的结果。
综上所述,紫外光谱是一种简便快速的多肽检测方法,在生物医药等领域具有重要的应用价值。
通过进一步研究和改进,可以提高其检测的精度和灵敏度,满足不同领域对多肽分析的需求。
酵母多肽制备实验报告

一、实验目的1. 掌握酵母多肽的制备方法。
2. 研究不同酶解条件对酵母多肽产率和质量的影响。
3. 分析酵母多肽的抗氧化活性。
二、实验原理酵母多肽是从酵母细胞中提取的一种具有生物活性的多肽,含有多种氨基酸和抗氧化物质。
通过酶解法可以将酵母细胞壁中的蛋白质分解为小分子多肽,提高其生物活性。
三、实验材料与仪器1. 材料:- 酵母菌株(如:ATCC 204508)- 酶制剂(如:木瓜蛋白酶、菠萝蛋白酶)- 无水乙醇、NaCl、ZnSO4等2. 仪器:- 研钵、移液器、恒温培养箱、酶标仪、离心机、紫外可见分光光度计等四、实验方法1. 酵母培养:将酵母菌株接种于含有ZnSO4的培养基中,在恒温培养箱中培养至对数生长期。
2. 酵母细胞破壁:将培养好的酵母细胞用超声波破碎机进行处理,使细胞壁破裂。
3. 酶解:将破壁后的酵母细胞与酶制剂混合,在适宜的温度和pH条件下进行酶解反应。
4. 酶解产物分离:酶解完成后,将混合液离心分离,收集上清液。
5. 酶解产物纯化:采用离子交换、凝胶过滤等方法对酶解产物进行纯化。
6. 抗氧化活性测定:采用DPPH自由基清除法测定酶解产物的抗氧化活性。
五、实验结果与分析1. 酶解条件对酵母多肽产率的影响通过正交实验,确定了最佳酶解条件为:酶解温度58℃,pH 7.05,酶用量3.03%。
在此条件下,酵母多肽产率达到52.13%。
2. 酶解产物纯化通过离子交换和凝胶过滤,将酶解产物纯化至纯度达到95%以上。
3. 酶解产物抗氧化活性采用DPPH自由基清除法测定酶解产物的抗氧化活性,结果显示,酶解产物的抗氧化活性与维生素C相当。
六、实验结论1. 成功制备了酵母多肽,并通过酶解法提高了其产率和纯度。
2. 确定了最佳酶解条件,为酵母多肽的工业化生产提供了理论依据。
3. 酶解产物具有良好的抗氧化活性,具有良好的应用前景。
七、实验注意事项1. 实验过程中,应注意无菌操作,避免污染。
2. 酶解过程中,应严格控制温度和pH,以确保酶解效果。
多肽类分析分离方法

多肽类化合物广泛存在于自然界中,其中对具有一定生物活性的多肽的研究,一直是药物开发的一个主要方向。
生物体内已知的活性多肽主要是从内分泌腺组织器官、分泌细胞和体液中产生或获得的,生命活动中的细胞分化、神经激素递质调节、肿瘤病变、免疫调节等均与活性多肽密切相关。
随着现代科技的飞速发展,从天然产物中获得肽类物质的手段也不断得到提高。
一些新方法、新思路的应用。
不断有新的肽类物质被发现应用于防病治病之中。
本文介绍了近几年肽类物质分离、分析的主要方法研究进展。
1 分离方法采取何种分离纯化方法要由所提取的组织材料、所要提取物质的性质决定。
对蛋白质、多肽提取分离常用的方法包括:盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法等。
这些方法常常组合到一起对特定的物质进行分离纯化,同时上述这些方法也是蛋白、多肽类物质分析中常用的手段,如层析、电泳等。
1.1 高效液相色谱(HPLC)HPLC的出现为肽类物质的分离提供了有利的方法手段,因为蛋白质、多肽的HPLC 应用与其它化合物相比,在适宜的色谱条件下不仅可以在短时间内完成分离目的,更重要的是HPLC能在制备规模上生产具有生物活性的多肽。
因此在寻找多肽类物质分离制备的最佳条件上,不少学者做了大量的工作。
如何保持多肽活性、如何选择固定相材料、洗脱液种类、如何分析测定都是目前研究的内容。
1.1.1 反相高效液相色谱(RP-HPLC)结果与保留值之间的关系:利用RP-HPLC分离多肽首先得确定不同结构的多肽在柱上的保留情况。
为了获得一系列的保留系数,Wilce等利用多线性回归方法对2106种肽的保留性质与结构进行分析,得出了不同氨基酸组成对保留系数影响的关系,其中极性氨基酸残基在2~20氨基酸组成的肽中,可减少在柱上的保留时间;在10~60氨基酸组成的肽中,非极性氨基酸较多也可减少在柱上的保留时间,而含5~25个氨基酸的小肽中,非极性氨基酸增加可延长在柱上的保留时间。
水溶性维生素的分析,多肽和蛋白质的分离

水溶性维生素的分析,多肽和蛋白质的分离1.办法原理水溶性维生素皆为强极性有机化合物,可用C18反相键合相色谱柱实现彻低分别。
用反相离子对色谱分别水溶性维生素9-72所示。
图9-72 反相离子对色谱分别水溶性维生素1-维生素C; 2-维生素B1;3-维生素B6;4-烟酸;5-维生素K3(亚硫酸氢钠甲基萘醌);6-烟酰胺;7-对羟基苯甲酸;8-维生素B12 ; 9-维生素B2 2.色谱分析条件 (1)色谱柱Biophase ODS(5um, φ4.6mm×250mm)。
(2)流淌相(A) 1%+0.5%溶液(pH= 4.5); (B)A+(50:50)。
梯度洗脱程序在0~10min内,流淌相B由0增至80%,再维持15min。
流量为1mL/min。
(3)检测器UVD (275nm)。
3.分析结果样品溶于流淌相A后进样,维生素K3样品中应加入Na2SO3,以避开2-甲基萘醌的生成;维生素B12和在一起时不稳定,应在测定时现用现配。
离子对试剂的浓度对维生素B1、维生素B6、烟酸和维生素K3的分别影响很大,应选用最佳浓度。
水溶性也可在反相键合相柱(C8)或氨基键合相柱(u-Bondapak-NH2)实现分别。
二、在C4烷基反相键合相上,和的分别 1.办法原理YMC-Pack Protein-RP是在硅胶上键合短的C4烷基链的反相固定相,特殊适用于长链多肽和的分析。
图9-73 为多肽和蛋白质的分别谱图。
图9-73 在C4烷基反相固定相上,多肽和蛋白质的分别1-甲硫氨酸-脑啡肽;2-亮氨酸-脑啡肽;3-催产素;4-血管舒缓激肽;5-血管紧急素I;6-核糖核酸酶A; 7-a-交配因子;8-胰岛素(牛);9-细胞色素c; 10-溶菌酶;11-牛血清白蛋白;12-β-乳球蛋白;13-卵清蛋白 2.色谙分析条件 (1)色谱柱:φ4.6mm×25cm, YMC-Pack Protein-RP(5um,30nm),室温。
蛋白质多肽分析技术的研究与应用

蛋白质多肽分析技术的研究与应用作为生命体的重要成分,蛋白质被广泛应用于医疗、农业、生化工程等领域。
其中,蛋白质中占比较大的多肽分子是研究蛋白质功能和性质的重要角色。
因此,研究和应用蛋白质多肽分析技术成为了当前热点和难点之一。
1. 多肽分析技术的分类目前,多肽分析技术主要分为三类:基于色谱法的多肽分析技术、基于光谱法的多肽分析技术和基于质谱法的多肽分析技术。
基于色谱法的多肽分析技术主要包括高效液相色谱(HPLC)、离子交换色谱(IEC)、凝胶过滤色谱(GFC)等。
其中,HPLC是一种高分辨率的分离技术,能够将蛋白质与多肽分子分离出来,并精确测定单个多肽成分的含量和结构。
IEC主要是根据多肽分子的电性差异来进行分离,将多肽分子按电荷大小逐步分离出来。
GFC 则是根据多肽分子的大小和形状差异来进行分离,将多肽分子从分子量大到小依次分离出来。
基于光谱法的多肽分析技术主要包括紫外吸收光谱(UV)、荧光光谱、圆二色性(CD)等。
其中,UV能够根据多肽分子的吸收波长和强度,对多肽分子进行定量和分析。
荧光光谱则可以根据多肽分子的荧光光谱图像,确定多肽分子的光谱特性和化学结构。
CD是一种比较新的多肽分析技术,可以通过对多肽分子的旋光度进行测量,来鉴定多肽分子的立体结构和构象变化。
基于质谱法的多肽分析技术是目前应用最广泛的分析技术之一。
包括基质辅助激光解吸电离过程(MALDI-TOF)、电喷雾质谱(ESI-MS)等。
其中,MALDI-TOF是一种高效的分析技术,能够通过对多肽分子的分子质量和荷质比进行检测,以确定多肽的含量和结构。
而ESI-MS则是一种基于电荷分离的质谱技术,可以检测多肽分子的电子和质量谱图,以及多肽分子的荷质比和荷量等信息。
2. 蛋白质多肽分析技术的应用领域蛋白质多肽分析技术是目前应用比较广泛的生物学分析技术之一,其主要应用领域包括医学、农业、生化工程等。
在医学领域,蛋白质多肽分析技术被广泛应用于药物研发和临床分析等方面。
蛋白质和多肽反相hplc分析和纯化指南

蛋白质和多肽反相hplc分析和纯化指南蛋白质和多肽反相HPLC分析和纯化指南1. 简介反相高效液相色谱(RP-HPLC)是一种常用的分析和纯化蛋白质和多肽的方法。
它利用疏水性相互作用将样品分离,可以有效地分离和纯化各种大小的蛋白质和多肽。
本指南旨在为您提供使用RP-HPLC分析和纯化蛋白质和多肽的基本原理和实践技巧。
2. 样品制备适当的样品制备对于成功的RP-HPLC分离至关重要。
样品应该溶解在与HPLC流动相相容的溶剂中,通常是水/醇混合物。
如果样品不溶于此类溶剂,可以考虑使用其他助溶剂,如尿素或盐酸胍。
样品浓度应适中,以避免过载和峰展宽。
3. 色谱条件- 色谱柱: C18反相柱是最常用的,但也可以尝试其他疏水性基团。
柱长和粒径的选择取决于分离需求。
- 流动相: 通常由水和有机溶剂(如乙腈或甲醇)组成的梯度洗脱。
添加小量三氟乙酸(TFA)或其他离子对调节pH和离子强度可能有助于改善分离。
- 检测器: 紫外/可见光检测器是最常用的,检测波长取决于蛋白质/多肽的吸收特性。
4. 方法开发开发RP-HPLC方法需要优化多个参数,包括梯度斜率、流速、温度和pH等。
可以尝试不同的梯度程序和流动相组成,以获得最佳分离。
5. 纯化利用RP-HPLC可以有效地纯化蛋白质和多肽。
根据初步分析结果,选择合适的梯度条件,收集目标峰。
必要时可进行多次重复注射和分馏,以提高纯度。
6. 样品回收纯化后的样品需要除去有机溶剂和其他添加剂。
常用的方法包括液体-液体萃取、离子交换、超滤和凝胶层析等。
回收的样品应进行浓缩和缓冲液交换,以适应后续用途。
7. 结语RP-HPLC是一种强大的分析和纯化蛋白质和多肽的工具。
掌握正确的技术和方法开发策略对于获得满意结果至关重要。
本指南概述了基本原理和关键步骤,为您成功应用RP-HPLC分析和纯化蛋白质和多肽提供参考。
离子交换层析法在多肽分离纯化过程中的应用

离子交换层析法在多肽分离纯化过程中的应用离子交换层析法是一种常用的分离纯化技术,广泛应用于多肽分析和制备工作中。
本文将介绍离子交换层析法在多肽分离纯化过程中的应用,并探讨其原理、优势以及相应的实验设计。
一、离子交换层析法概述离子交换层析法是基于样品中带电离子与固定相上的离子交换基团之间的静电相互作用来完成分离的一种技术。
它利用固定在层析固相上的离子交换基团与溶液中带电离子之间的吸附和解吸作用,将样品中的不同离子种类分离开来。
离子交换层析法的原理基于离子的荷电性质和在不同条件下其与固定相之间的相互作用。
离子交换基团通常以有机阴离子或阳离子形式存在于层析固相上。
在具有相同荷电性质的情况下,强吸附离子优先与固定相结合,较弱吸附离子则以解吸的方式从固定相上解离。
二、离子交换层析法的优势离子交换层析法在多肽分离纯化过程中具有以下几个优势:1. 高选择性:离子交换层析材料可以通过调节溶液的pH值和离子强度来实现对多肽的选择性分离。
通过调整这些条件,可以改变多肽与固定相之间的静电相互作用,从而实现对目标多肽的高效分离。
2. 较大容量:离子交换层析法具有较大的样品处理量和负荷容量。
多肽样品可以批量进样,从而提高分析和制备的效率。
3. 操作简便:离子交换层析法操作相对简单,不需要复杂的仪器设备。
只需将固定相装填到层析柱中,通入样品和洗脱缓冲液,即可完成分离纯化过程。
4. 分离效果好:离子交换层析法可以实现对多肽的高效纯化,去除杂质和不同极性的肽段,提供高纯度的目标多肽。
三、离子交换层析法在多肽分离纯化中的应用离子交换层析法在多肽分离纯化中的应用涉及到样品预处理、层析条件优化和纯化效果评估等方面。
1. 样品预处理:多肽样品通常包含有机溶剂、无关组分和杂质等。
在离子交换层析之前,需要将样品进行适当的预处理,去除杂质和不相关的成分。
预处理方法可以包括溶剂调整、蛋白酶降解、酸碱处理等。
2. 层析条件优化:离子交换层析的分离效果和纯化效率与层析条件密切相关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
・专题讲座・多肽物质分离与分析方法研究进展赵 锐 顾谦群 管华诗(青岛海洋大学海洋药物与食品研究所,青岛 266003)摘 要 综述了近几年来多肽类物质的提取分离与分析方法,主要包括高效液相色谱法、电泳、质谱及核磁共振等方法在肽类物质研究中的最新应用进展。
关键词 多肽,分离,分析,进展 多肽类化合物广泛存在于自然界中,其中对具有一定生物学活性的多肽的研究,一直是药物开发的一个主要方向。
生物体内已知的活性多肽主要是从内分泌腺组织器官、分泌细胞和体液中产生或获得的,生命活动中的细胞分化、神经激素递质调节、肿瘤病变、免疫调节等均与活性多肽密切相关。
随着现代科技的飞速发展,从天然产物中获得肽类物质的手段也不断得到提高。
一些新方法、新思路的应用,不断有新的肽类物质被发现应用于防病治病之中。
本文介绍了近几年肽类物质分离、分析的主要方法研究进展。
1 分离方法采取何种分离纯化方法要由所提取的组织材料、所要提取物质的性质决定。
对蛋白质、多肽提取分离常用的方法包括:盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法等[1]。
这些方法常常组合到一起对特定的物质进行分离纯化,同时上述这些方法也是蛋白、多肽类物质分析中常用的手段,如层析、电泳等。
111 高效液相色谱(H PL C)H PL C的出现为肽类物质的分离提供了有利的方法手段,因为蛋白质、多肽的H PL C 应用与其他化合物相比,在适宜的色谱条件下不仅可以在短时间内完成分离目的,更重要的是H PL C能在制备规模上生产具有生物活性的多肽。
因此在寻找多肽类物质分离制备的最佳条件上,不少学者做了大量的工作。
如何保持多肽活性、如何选择固定相材料、洗脱液种类、如何分析测定都是目前研究的内容。
11111 反相高效液相色谱(R P2H PL C)结果与保留值之间的关系:利用R P2 H PL C分离多肽首先得确定不同结构的多肽在柱上的保留情况。
为了获得一系列的保留系数,W ilce等[2]利用多线性回归方法对2106种肽的保留性质与结构进行分析,得出了不同氨基酸组成对保留系数影响的关系,其中极性氨基酸残基在2~20氨基酸组成的肽中,可减少在柱上的保留时间;在10~60氨基酸组成的肽中,非极性氨基酸较多也可减少在柱上的保留时间。
而含5~25个氨基酸的小肽中,非极性氨基酸增加可延长在柱上的保留时间。
同时有不少文献报道了肽链长度、氨基酸组成、温度等条件对保留情况的影响,并利用计算机处理分析得到每种多肽的分离提取的最佳条件[3]。
肽图分析(Pep tide M app ing):肽图分析是根据蛋白质、多肽的分子量大小以及氨基酸组成特点,使用专一性较强的蛋白水解酶[一般为肽链内切酶(endopep tidase)]作用于特殊的肽链位点将多肽裂解成小片断,通过一定的分离检测手段形成特征性指纹图谱。
肽图分析对多肽结构研究和特性鉴别具有重要意义。
利用胰蛋白酶能特意性作用于A rg 和L ys羧基端的肽链的性质,通过R P2H PL C 法采用C18柱检测了重组人生长激素(rhGH)的肽片断,成功获得了人生长激素特征性胰肽图谱[4]。
同时胰岛素的肽图经V8酶专一裂解也制得,并可鉴别仅相差一个氨基酸残疾的不同种属来源的胰岛素[5]。
人类肿瘤坏死因子的单克隆抗体结构也应用酶解法及在线分析技术确定了肽图,便于鉴定分析。
此项技术已经在新药开发中得到广泛应用。
11112 疏水作用色谱(H ydrophobic in teracti on ch rom atography,H I C)H I C是利用多肽中含有疏水基团,可与固定相之间产生疏水作用而达到分离分析的目的,其比R P2H PL C具有较少使多肽变性的特点。
利用H I C分离生产激素(GH)产品的结构与活性比R P2H PL C分离的要稳定,活性较稳定。
Geng等[6]利用H I C柱的低变性特点,将大肠杆菌表达出的经盐酸胍乙啶变性得到人重组干扰素2Χ,通过H I C柱纯化、折叠出高生物活性的产品。
不同人尿表皮生长因子(EGF)也利用H I C纯化到了,均具有良好的生物活性。
H I C可将未经离子交换柱的样品纯化。
而R P2H PL C则不能达到这一要求。
11113 分子排阻色谱(Size2Exclusi on ch rom atography,SEC)SEC是利用多肽分子大小、形状差异来分离纯化多肽物质,特别对一些较大的聚集态的分子更为方便。
如人重组生长激素(hGH)的分离,不同结构、构型的GH在SEC 柱上的分离行为完全不同,从而可分离不同构型或在氨基酸序列上有微小差异的变异体。
利用SEC研究修饰化的PEG的分离方法,此PEG具有半衰期长、作用强的特点[7]。
一些分子量较大的肽或蛋白均可利用此法分离分析。
11114 离子交换色谱(Iron2Exchange ch rom atography,IEXC)IEXC可在中性条件下,利用多肽的带电性不同分离纯化具有生物活性的多肽。
其可分为阳离子柱与阴离子柱两大类,还有一些新型树脂,如大孔型树脂、均孔型树脂、离子交换纤维素、葡聚糖凝胶、琼脂糖凝胶树脂等。
在多肽类物质的分离分析研究中,对多肽的性质、洗脱剂、洗脱条件的研究较多,不同的多肽分离条件有所不同,特别是洗脱剂的离子强度、盐浓度等对纯化影响较大。
W u 等[8]报道利用离子交换柱层析法,探讨分离牛碳酸酐酶异构体和牛血清白蛋白、鸡血清白蛋白酶的提取条件,获得了有价值的数据供今后此类物质分离研究。
11115 膜蛋白色谱(Ch rom atography of M e m brane P ro tein,C M P)C M P+分离强疏水性蛋白、多肽混合物的层析系统,一般有去垢剂(如SD S)溶解膜蛋白后形成SD S2融膜蛋白,并由羟基磷灰石为固定相的柱子分离纯化。
羟基磷灰石柱具有阴离子磷酸基团(P2端),又具有阳离子钙(C2端),与固定相结合主要决定于膜蛋白的大小、SD S结合量有关。
利用原子散射法研究c AM P的分离机制发现,样品与SD S结合后在离子交换柱上存在SD S分子、带电荷氨基酸与固定相中带电离子间的交换,从而达到分级分离的目的[9]。
11116 高效置换色谱(H igh-Perfo r m ance D is p lace m en t Ch rom atography,H PDC)H PDC是利用小分子的高效置换剂来交换色谱柱上的样品,从而达到分离目的。
它具有分离组分含量较少成分的特性。
利用H PDC鉴定分离了低于总量1%组分的活性人重组生长激素(rH G)[10]。
在研究非毒性交换剂时Jayara m a[11]发现硫酸化葡聚糖(D etran Sulfate,D S)是对Β2乳球蛋白A和B 的良好置换剂,一般D S的相对分子质量为1×104和4×104最宜。
研究表明置换剂的相对分子质量越低,越易于与固定相结合,因此在分离相对分子质量小的多肽时,需要更小的置换剂才能将其置换纯化出来。
11117 灌注层析(Perfusi on Ch rom atography,PC)PC是一种基于分子筛原理与高速流动的流动相的层析分离方法,固定相孔径大小及流动相速度直接影响分离效果。
试验证明其在生产、制备过程中具有低投入、高产出的特性[12]。
目前市场上可供应的PC固定相种类较多,适合于不同分子量的多肽分离使用。
112 亲和层析(A ffin ity Ch rom atography, A C)A C是利用连接在固定相基质上的配基与可以和其特异性产生作用的配体之间的特异亲合性而分离物质的层析方法。
自1968年Cuatrecasas提出亲和层析概念以来,在寻找特异亲和作用物质上发现了许多组合,如抗原2抗体、酶2催化底物、凝集素2多糖、寡核苷酸与其互补链等等。
对多肽类物质分离目前主要应用其单抗或生物模拟配基与其亲和,这些配基有天然的,也有根据其结构人工合成的。
Patel等[13]人利用一系列亲合柱分离纯化到了组织血浆纤维蛋白酶原激活剂蛋白多肽。
固定金属亲和层析(I m mobilized M etal A ffin ity Ch rom atography,I M A C)是近年来发展起来的一种亲和方法。
其固定相基质上鳌合了一些金属离子,如Cu2+、N i2+、Fe3+等,此柱可通过配为键鳌合侧链含有L ys、M et、A s p、A rg、T yr、Glu和H is的多肽,特别是肽序列中含有H is-X-X-X-H is的结构最易结合到金属离子亲和柱上,纯化效果较好[14]。
其中胰岛素样生长因子(In sulin-L ike Grow th Facto r,IGF)、二氢叶酸还原酶融合蛋白等均用此方法分离到纯度较高的产品。
Chaiken等[15]人报道了另一种亲和层析方法,利用反义多肽作为配基,这种多肽是由反义DNA表达产生,其与正链DNA表达产生的肽或蛋白具有一定的亲和性,如A rg加压素受体复合物,已用此法分离得到。
DNA 与蛋白、多肽复合物之间的作用也是生物亲和中常用的方法。
将人工合成的寡核苷酸结合在固定相基质上,将样品蛋白或多肽从柱中流过,与之结合可达到分离特定结构多肽的目的。
113 毛细管电泳(Cap illary electropho resis, CE)——分离分析方法CE是在传统的电泳技术基础上于本世纪60年代末由H jerten发明的,其利用小的毛细管代替传统的大电泳槽,使电泳效率提高了几十倍。
此技术从80年代以来发展迅速,是生物化学分析工作者与生化学家分离、定性多肽与蛋白类物质的有利工具。
CE根据应用原理不同可分为以下几种;毛细管区带电泳(Cap illary Zone electropho resis,CZE)、毛细管等电聚焦电泳(Cap illary Is oeletric Focusing,C IEF)、毛细管凝胶电泳(Cap illary Gel E lectropho resis,CGE)和胶束电动毛细管层析(M icellar E lectrok inetic E lectropho resisCh rom atography,M ECC)等。
11311 毛细管区带电泳(Cap illary Zone electropho resis,CZE)CZE分离多肽类物质主要是依据不同组分中的化合物所带电荷不同,且分离效果只由带电性决定,比传统凝胶电泳更准确。
目前存在于CZE分离分析多肽物质的主要问题是天然蛋白或肽易与毛吸管硅胶柱上的硅醇发生反应,影响峰形与电泳时间,针对这些问题不少学者做了大量实验进行改进,如调节电泳液的pH值,使与硅醇反应的极性基团减少;改进毛细管柱材料的组成,针对多肽性质的不同采取不同的CZE柱来分离。
