国家药品质量公告
国家药品质量公告

药品质量公告(总第67期)国家食品药品监督管理局发布 2006年10月根据2006年全国药品抽验计划,国家食品药品监督管理局组织有关单位在全国范围内对相关品种进行了药品质量抽查检验,在抽验中发现18个批次的药品为假冒药品,涉及1家医疗机构、17家药品经营企业(见附表),现予以公告。
对公告中的假冒药品立即停止销售和使用,涉及经营、使用假冒药品的经营企业和医疗机构所在地的药品监督管理部门要认真追查假药的来源,依法从严查处。
附表:假冒药品名单药品质量公告(总第68期)国家食品药品监督管理局发布 2007年3月根据2006年国家药品抽验计划,国家食品药品监督管理局组织有关单位在全国范围内进行了药品监督抽验,本期公告内容为在流通和使用单位对15个品种的不同剂型进行抽查检验的结果。
具体为:阿司匹林(肠溶片、胶囊、泡腾片、维生素C分散片):41家生产企业的200批次为合格药品,5家生产企业的9个批次为不合格药品;氨咖黄敏(胶囊、颗粒、片):44家生产企业的205批次为合格药品,1家生产企业的1个批次为不合格药品;布洛芬缓释胶囊:34家生产企业的182批次为合格药品,1家生产企业的1个批次为不合格药品;复方氨酚烷胺(片、分散片):149家生产企业的746批次为合格药品,5家生产企业的5个批次为不合格药品;复方对乙酰氨基酚片:52家生产企业的165批次为合格药品,4家生产企业的5个批次为不合格药品;交沙霉素片:13家生产企业的129批次为合格药品,1家生产企业的1个批次为不合格药品;青霉素V钾(片、分散片):36家生产企业的394批次为合格药品,5家生产企业的27个批次为不合格药品;维生素B12片:15家生产企业的314批次为合格药品,1家生产企业的1个批次为不合格药品;维生素E烟酸酯(胶囊、胶丸):19家生产企业的53批次为合格药品,1家生产企业的1个批次为不合格药品;盐酸利多卡因注射液、蚓激酶(胶囊、片)、甲硫氨酸片、胰激肽原酶肠溶片、左旋多巴注射液和对乙酰氨基酚颗粒6个品种抽验结果为符合规定。
国家药品质量公告

80mg
陕西省大正国药有限责任公司西郊分公司
《中国药典》2005年版二部
河南省食品药品检验所
不合格
检查(溶出度)
16
格列齐特片(Ⅱ)
北京海联制药有限公司
20090201
80mg
北京海联制药有限公司
《中国药典》2005年版二部
河南省食品药品检验所
不合格
检查(溶出度)
17
格列齐特片(Ⅱ)
江西省食品药品检验所
不合格
检查(溶出度)
2
盐酸异丙嗪片
北海阳光药业有限公司
080414
12.5mg
吉林省四平市盛泰医药药材有限公司
《中国药典》2005年版二部
江西省食品药品检验所
不合格
检查(溶出度)
3
硝酸甘油片
北京益民药业有限公司
0701010
0.5mg
云南省保山市第二人民医院
《中国药典》2005年版二部
山西省药品检验所
不合格
性状
检查(pH值)
21
强力枇杷露
成都天银制药有限公司
090103
每瓶装100ml
广东思明药业有限公司
国家食品药品监督管理局标准(试行)YBZ00582006
陕西省食品药品检验所
不合格
含量测定
22
强力枇杷露
成都天银制药有限公司
090101
每瓶装100ml
新疆克州万兴药业有限责任公司
0.25g(按C16H17N3O4S计)
北京太洋药业有限公司
《中国药典》2005年版二部
山东省药品检验所
不合格
检查(溶出度)
8
盐酸环丙沙星滴眼液
国家药监局关于发布《药品生产质量管理规范(2010年修订)》临床试验用药品附录的公告

国家药监局关于发布《药品生产质量管理规范(2010年修订)》临床试验用药品附录的公告文章属性•【制定机关】国家药品监督管理局•【公布日期】2022.05.27•【文号】国家药监局公告2022年第43号•【施行日期】2022.07.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药监局公告2022年第43号关于发布《药品生产质量管理规范(2010年修订)》临床试验用药品附录的公告根据《药品生产质量管理规范(2010年修订)》第三百一十条规定,现发布《临床试验用药品(试行)》附录,作为《药品生产质量管理规范(2010年修订)》配套文件,自2022年7月1日起施行。
特此公告。
附件:临床试验用药品(试行)国家药监局2022年5月27日附件临床试验用药品(试行)第一章范围第一条本附录适用于临床试验用药品(包括试验药物、安慰剂)的制备。
已上市药品作为对照药品或试验药物时,其更改包装、标签等也适用本附录。
第二章原则第二条临床试验用药品的制备和质量控制应当遵循《药品生产质量管理规范》的相关基本原则以及数据可靠性要求,最大限度降低制备环节污染、交叉污染、混淆和差错的风险,确保临床试验用药品质量,保障受试者安全。
第三条临床试验用药品的制备和质量控制具有以下特殊性:(一)在新药早期临床试验阶段,通常尚未形成成熟的制备工艺,尚不具备充分确认和验证的条件;(二)对新药的特性、潜在作用及毒性的了解不够充分,对试验药物关键质量属性的识别,对质量控制指标和方法的研究还需进一步深入;(三)临床试验用药品制备过程可能同时涉及试验药物制备、安慰剂制备、对照药品和试验药物更改包装标签等不同活动,随机和盲法的要求也增加了临床试验用药品制备过程混淆和差错的风险。
应当基于以上的特殊性,以及其不同研发阶段的特点和临床试验设计的要求等,对临床试验用药品进行相应的控制。
第四条在保证受试者安全且不影响临床试验质量的前提下,临床试验用药品的质量风险管理策略可根据研发规律进行相应调整。
药品质量公告

药品质量公告
2008年度第1期(总第73期)
国家食品药品监督管理局发布2008年4月
为加强药品监管,保障公众用药安全,国家食品药品监督管理局组织在全国范围内对流感疫苗进行了评价抽验,并对2006年至2007年度抽验的部分生物制品进行了跟踪抽验。
本期公告内容为对2006年至2007年度抽验的部分生物制品跟踪抽验和流感疫苗评价性抽验的药品质量情况。
一、部分生物制品跟踪抽验的质量情况
跟踪抽验涉及8家生物制品生产企业生产的17批制品,经检验,1家生产企业生产的1个品种3批次不合格(见附表1)。
二、流感疫苗评价性抽验的质量情况
被抽验的流感疫苗涉及12家生产企业的77批制品,经检验,均合格(见附表2)。
附表:1.2008年第1期国家药品质量公告部分生物制品跟踪抽验的质量情况
2.2008年第1期国家药品质量公告流感疫苗评价性抽验的质量情况
附表1:
2008年第1期国家药品质量公告部分生物制品跟踪抽验的质量情况
附表2:
2008年第1期国家药品质量公告流感疫苗评价性抽验的质量情况。
国家药品监督管理局关于发布 《化妆品生产质量管理规范》的公告

国家药品监督管理局关于发布《化妆品生产质量管理规范》的公告文章属性•【制定机关】国家药品监督管理局•【公布日期】2022.01.06•【文号】国家药品监督管理局公告2022年第1号•【施行日期】2022.07.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】美容业、化妆品管理正文国家药监局公告2022年第1号关于发布《化妆品生产质量管理规范》的公告为规范化妆品生产质量管理,根据《化妆品监督管理条例》《化妆品生产经营监督管理办法》等法规、规章,国家药监局组织制定了《化妆品生产质量管理规范》(以下简称《规范》),现予公布,自2022年7月1日起施行。
自2022年7月1日起,化妆品注册人、备案人、受托生产企业应当按照《规范》要求组织生产化妆品。
2022年7月1日前已取得化妆品生产许可的企业,其厂房设施与设备等硬件条件须升级改造的,应当自2023年7月1日前完成升级改造,使其厂房设施与设备等符合《规范》要求。
特此公告。
附件:化妆品生产质量管理规范国家药监局2022年1月6日化妆品生产质量管理规范第一章总则第一条为规范化妆品生产质量管理,根据《化妆品监督管理条例》《化妆品生产经营监督管理办法》等法规、规章,制定本规范。
第二条本规范是化妆品生产质量管理的基本要求,化妆品注册人、备案人、受托生产企业应当遵守本规范。
第三条化妆品注册人、备案人、受托生产企业应当诚信自律,按照本规范的要求建立生产质量管理体系,实现对化妆品物料采购、生产、检验、贮存、销售和召回等全过程的控制和追溯,确保持续稳定地生产出符合质量安全要求的化妆品。
第二章机构与人员第四条从事化妆品生产活动的化妆品注册人、备案人、受托生产企业(以下统称“企业”)应当建立与生产的化妆品品种、数量和生产许可项目等相适应的组织机构,明确质量管理、生产等部门的职责和权限,配备与生产的化妆品品种、数量和生产许可项目等相适应的技术人员和检验人员。
企业的质量管理部门应当独立设置,履行质量保证和控制职责,参与所有与质量管理有关的活动。
国家药监局、国家卫生健康委公告2020年第57号——关于发布药物临床试验质量管理规范的公告

国家药监局、国家卫生健康委公告2020年第57号——关于发布药物临床试验质量管理规范的公告文章属性•【制定机关】国家药品监督管理局,国家卫生健康委员会•【公布日期】2020.04.27•【文号】国家药监局、国家卫生健康委公告2020年第57号•【施行日期】2020.07.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药监局国家卫生健康委公告2020年第57号关于发布药物临床试验质量管理规范的公告为深化药品审评审批制度改革,鼓励创新,进一步推动我国药物临床试验规范研究和提升质量,国家药品监督管理局会同国家卫生健康委员会组织修订了《药物临床试验质量管理规范》,现予发布,自2020年7月1日起施行。
特此公告。
附件:药物临床试验质量管理规范国家药监局国家卫生健康委2020年4月27日附件药物临床试验质量管理规范第一章总则第一条为保证药物临床试验过程规范,数据和结果的科学、真实、可靠,保护受试者的权益和安全,根据《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》《中华人民共和国药品管理法实施条例》,制定本规范。
本规范适用于为申请药品注册而进行的药物临床试验。
药物临床试验的相关活动应当遵守本规范。
第二条药物临床试验质量管理规范是药物临床试验全过程的质量标准,包括方案设计、组织实施、监查、稽查、记录、分析、总结和报告。
第三条药物临床试验应当符合《世界医学大会赫尔辛基宣言》原则及相关伦理要求,受试者的权益和安全是考虑的首要因素,优先于对科学和社会的获益。
伦理审查与知情同意是保障受试者权益的重要措施。
第四条药物临床试验应当有充分的科学依据。
临床试验应当权衡受试者和社会的预期风险和获益,只有当预期的获益大于风险时,方可实施或者继续临床试验。
第五条试验方案应当清晰、详细、可操作。
试验方案在获得伦理委员会同意后方可执行。
第六条研究者在临床试验过程中应当遵守试验方案,凡涉及医学判断或临床决策应当由临床医生做出。
药品质量公告2015年

规格 100ml 饮片
检品来源
检验依据
不合格项目
浙江同亨协药品包装有限 公司
国家药品包装容器(材料)标准(试 行)
[溶出物试验](乙 醇浸液紫外吸收
度)
浙江华宇药业股份有限公 《中国药典》2010年版一部及《中
司
国药典》2010年版第二增补本
[含量测定]
检验机构 台州市食品药品检验所
温州市药品检验所
枳壳)
公司
《中国药典》2010年版一部
19 枳壳 安徽亿源中药饮片科技有限公司 20130401 饮片 浙江安泰医药有限公司 《中国药典》2010年版一部
20 枳壳
亳州市中信中药饮片厂
201404002 饮片
温州时代医药有限公司
《中国药典》2010年版一部及《中 国药典》2010年版第二增补本
假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产
364OO1
2O13O4O1 1402001 2O13O2O1 13O5O5 2O13O4O2
对乙酰氨 基酚
0.126g,阿 司匹林
0.23g,咖 啡因30mg
绍兴震欣医药有限公司
《卫生部药品标准》化学药品及制 [检查](游离水杨
剂第一册
酸,崩解时限)
复方
/
每片重 0.3g 每支装 10ml 每粒装 0.32g
130704
26
止嗽化痰胶 囊
牡丹江灵泰药业股份有限公司
130701
27 仲景胃灵丸 亚宝药业大同制药有限公司 20111002
28
壮阳春胶囊
吉林省通化博祥药业股份有限公 司
131101
每袋装6g
每粒装 0.3g 每粒装 0.4g 每袋装 1.2g 每粒装 0.3g
国家食品药品监督管理局公告2011年第36号――国家药品质量公告(2011

国家食品药品监督管理局公告2011年第36号――国家药品质量公告(2011年第1期,总第85号)【法规类别】药品管理【发文字号】国家食品药品监督管理局公告2011年第36号【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)【发布日期】2011.04.28【实施日期】2011.04.28【时效性】现行有效【效力级别】部门规范性文件国家食品药品监督管理局公告(2011年第36号)国家药品质量公告(2011年第1期,总第85号)为加强药品监管,保障公众用药安全,根据全国药品抽验工作计划,国家食品药品监督管理局在全国范围内组织对醋酸泼尼松片等18个国家基本药物品种,以及苦碟子注射液等5个其他制剂品种进行了质量抽验,并对流通流域抽验不符合标准规定的32个基本药物品种在其生产企业进行了跟踪抽验。
结果显示,本次抽验的55个品种4035批次产品中,有4016批次产品符合标准规定,19批次产品不符合标准规定,被抽验产品总体质量良好。
现将抽验结果公告如下:一、国家基本药物品种抽验结果本次共抽验醋酸泼尼松片、硫酸链霉素注射剂、盐酸美西律片、通心络胶囊、复方氢氧化铝片、盐酸布比卡因注射液、盐酸维拉帕米制剂、藿胆丸(片)、联苯双酯制剂、消炎利胆制剂、多潘立酮口服常释制剂、盐酸多巴胺注射液、利多卡因注射液、普鲁卡因注射液、注射用哌拉西林钠、复方泛影葡胺注射液、诺氟沙星口服常释制剂、逍遥丸(颗粒)18个国家基本药物品种3383批次,其中3376批次产品符合标准规定,7批次产品不符合标准规定。
具体抽验结果如下:(一)醋酸泼尼松片本次抽样245批次,涉及40家生产企业,经河北省药品检验所检验,全部符合标准规定。
(二)硫酸链霉素注射剂本次抽样158批次,涉及7家生产企业,经河北省药品检验所检验,全部符合标准规定。
(三)盐酸美西律片本次抽样177批次,涉及6家生产企业,经河北省药品检验所检验,全部符合标准规定。
(四)通心络胶囊本次抽样31批次,涉及1家生产企业,经河北省药品检验所检验,全部符合标准规定。
国家市场监管总局关于发布《特殊医学用途配方食品临床试验质量管理规范》的公告

国家市场监管总局关于发布《特殊医学用途配方食品临床试验质量管理规范》的公告文章属性•【制定机关】国家市场监督管理总局•【公布日期】2024.04.25•【文号】国家市场监督管理总局公告2024年第17号•【施行日期】2024.04.25•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】食品安全正文国家市场监督管理总局公告2024年第17号关于发布《特殊医学用途配方食品临床试验质量管理规范》的公告《特殊医学用途配方食品临床试验质量管理规范》已经2024年4月9日市场监管总局第12次局务会议通过,现予公告,自发布之日起施行。
原国家食品药品监督管理总局2016年10月13日发布的《特殊医学用途配方食品临床试验质量管理规范(试行)》同时废止。
市场监管总局2024年4月25日特殊医学用途配方食品临床试验质量管理规范第一章总则第一条为了规范特殊医学用途配方食品临床试验过程,保证数据及结果的科学、真实、可靠,保护受试者的安全和权益,根据《中华人民共和国食品安全法》及其实施条例、《特殊医学用途配方食品注册管理办法》,制定本规范。
第二条本规范适用于特殊医学用途配方食品临床试验全过程的质量管理,包括方案设计、组织实施、数据管理与统计分析、临床试验总结和报告。
第三条特殊医学用途配方食品临床试验应当符合《世界医学大会赫尔辛基宣言》原则及相关伦理要求,受试者的安全和权益是考虑的首要因素,优先于对科学和社会的获益。
伦理审查与知情同意是保障受试者权益的重要措施。
第四条承担特殊医学用途配方食品临床试验的医疗机构应当具有临床营养科以及与所研究的特殊医学用途配方食品相关的专业科室,具备开展临床试验相应的组织管理能力、专业技术能力、伦理审查能力等特殊医学用途配方食品临床试验研究条件,及药品注册临床试验经验,并在国家市场监督管理总局特殊食品验证评价技术机构备案信息系统备案。
第五条试验样品的质量要求应当符合相应食品安全国家标准和(或)相关规定,生产条件应当符合特殊医学用途配方食品良好生产规范。
为杜绝假劣药品,保障人民用药安全有效,现将国家食品药品监督管.

为杜绝假劣药品,保障人民用药安全有效,现将国家食品药品监督管理局2007年第1期《国家药品质量公告》(总第69期)、国家食品药品监督管理局2007年第1期《国家医疗器械质量公告》(总第33期)、山西省食品药品监督管理局2007年第1期《药品质量公告》(总第31期)以及晋中市食品药品监督管理局《案情通报》中通报查处的共计143种(批)《2007年度已确认不合格药品、医疗器械自查目录》公布如下,请广大消费者在购买药品医疗器械时注意鉴别,发现假劣药械请及时举报。
药品质量举报投诉电话:12346。
合格药品质量公告(46种批)
检验不合格进口药品(11种批)
“中成药非法添加化学药物”假药名单(41种批)
假冒企业生产的橡胶避孕套(25种批)
2007年第1期国家医疗器械质量公告不合格产品(7种批)
2007年度《案情通报》及质量公告假药(13种批)。
总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)

一、为便于企业选择参比制剂,国家食品药品监督管理总局将把《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性 评价的意见〉有关事项的公告》(2016年第106号)所附289个品种的原研企业药品列出清单并向社会公布,供企业选择参比制剂 时参考。清单分为已在中国境内上市和未在中国境内上市两类。建议企业按以下顺序选择其一作为参比制剂备案:
(三)在欧盟、美国或日本上市但未在中国境内上市的,经临床研究证实无种族差异的,可使用境外上市申报的生物等效性研 究、药学研究数据等技术资料向国家食品药品监督管理总局提出上市申请;可能存在种族差异的,应开展相应的临床试验。审评通 过的视同通过一致性评价。
(四)上述技术资料,应是用于向欧盟、美国或日本监管部门申请上市的完整研究数据,包括药学研究数据、生物等效性试验 资料等,应符合中国现行技术指导原则要求并需接受国家食品药品监督管理总局现场检查。对提供虚假的证明文件、资料、样品或 者以其他欺骗手段取得药品批准证明文件的,撤销批准证明文件。
总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)
国家食品药品监督管理局网站 2017-08-25 21:10
总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号) 2017年08月25日 发布
为做好仿制药质量和疗效一致性评价工作(以下简称一致性评价),现就有关事宜公告如下:
十七、对企业申报的一致性评价申请,审评结论均向社会公开。对通过一致性评价的品种,向社会公开其产品说明书、企业研 究报告及生物等效性试验数据,涉及企业生产工艺及其参数等技术秘密的,按照国家食品药品监督管理总局有关规定执行。具体标 准由国家食品药品监督管理总局药品审评中心另行规定。对未通过一致性评价的品种,将在公布不予通过决定的同时说明不予通过 的理由。
国家药监局、农业农村部、国家林草局、国家中医药局关于发布《中药材生产质量管理规范》的公告

国家药监局、农业农村部、国家林草局、国家中医药局关于发布《中药材生产质量管理规范》的公告文章属性•【制定机关】国家药品监督管理局,农业农村部,国家林业和草原局,国家中医药管理局•【公布日期】2022.03.01•【文号】国家药监局、农业农村部、国家林草局、国家中医药局公告2022年第22号•【施行日期】2022.03.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药监局农业农村部国家林草局国家中医药局公告2022年第22号关于发布《中药材生产质量管理规范》的公告为贯彻落实《中共中央国务院关于促进中医药传承创新发展的意见》,推进中药材规范化生产,加强中药材质量控制,促进中药高质量发展,依据《中华人民共和国药品管理法》《中华人民共和国中医药法》,国家药监局、农业农村部、国家林草局、国家中医药局研究制定了《中药材生产质量管理规范》(以下称本规范),现予发布实施,并将有关事项公告如下:一、本规范适用于中药材生产企业规范生产中药材的全过程管理,是中药材规范化生产和管理的基本要求。
本规范涉及的中药材是指来源于药用植物、药用动物等资源,经规范化的种植(含生态种植、野生抚育和仿野生栽培)、养殖、采收和产地加工后,用于生产中药饮片、中药制剂的药用原料。
本公告所指中药材生产企业包括具有企业性质的种植、养殖专业合作社或联合社。
二、鼓励中药饮片生产企业、中成药上市许可持有人等中药生产企业在中药材产地自建、共建符合本规范的中药材生产企业及生产基地,将药品质量管理体系延伸到中药材产地。
鼓励中药生产企业优先使用符合本规范要求的中药材。
药品批准证明文件等有明确要求的,中药生产企业应当按照规定使用符合本规范要求的中药材。
相关中药生产企业应当依法开展供应商审核,按照本规范要求进行审核检查,保证符合要求。
三、使用符合本规范要求的中药材,相关中药生产企业可以参照药品标签管理的相关规定,在药品标签中适当位置标示“药材符合GAP要求”,可以依法进行宣传。
国家药品监督管理局关于发布《药物警戒质量管理规范》的公告

国家药品监督管理局关于发布《药物警戒质量管理规范》的公告文章属性•【制定机关】国家药品监督管理局•【公布日期】2021.05.07•【文号】国家药品监督管理局公告2021年第65号•【施行日期】2021.12.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药品监督管理局公告2021年第65号国家药监局关于发布《药物警戒质量管理规范》的公告根据《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》,为规范和指导药品上市许可持有人和药品注册申请人的药物警戒活动,国家药监局组织制定了《药物警戒质量管理规范》,现予以公布,并就实施《药物警戒质量管理规范》有关事宜公告如下:一、《药物警戒质量管理规范》自2021年12月1日起正式施行。
二、药品上市许可持有人和药品注册申请人应当积极做好执行《药物警戒质量管理规范》的准备工作,按要求建立并持续完善药物警戒体系,规范开展药物警戒活动。
三、药品上市许可持有人应当自本公告发布之日起60日内,在国家药品不良反应监测系统中完成信息注册。
四、各省级药品监督管理部门应当督促本行政区域内的药品上市许可持有人积极做好相关准备工作,配合做好有关宣贯和解读,通过加强日常检查等工作监督和指导药品上市许可持有人按要求执行《药物警戒质量管理规范》,及时收集和反馈相关问题和意见。
五、国家药品不良反应监测中心统一组织和协调《药物警戒质量管理规范》的宣贯培训和技术指导工作,在官方网站开辟《药物警戒质量管理规范》专栏,及时解答相关问题和意见。
特此公告。
附件:药物警戒质量管理规范国家药监局2021年5月7日附件药物警戒质量管理规范第一章总则第一条为规范药品全生命周期药物警戒活动,根据《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》等有关规定,制定本规范。
第二条本规范适用于药品上市许可持有人(以下简称“持有人”)和获准开展药物临床试验的药品注册申请人(以下简称“申办者”)开展的药物警戒活动。
药品质量公告2014年2期

130324 121102 20120701
饮片(制) 每支10ml 每支装10ml
金华市医药有限公司 宁波新城医药有限公司 浙江维康医药零售有限公 司维康大药房城东路店 云和信安大药房
《中国药典》2010年版第一增补本 《中国药典》2010年版一部 《中国药典》2010年版一部 《卫生部药品标准》化学药品及制 剂第一册 《中国药典》2010年版二部 《中国药典》2010年版二部
每10丸重2.3 《卫生部药品标准》中药成方制剂 [检查](水分,重量 绍兴市越城加会平安药店 克 第十二册 差异) 宁波海曙镇明药房有限公 《卫生部药品标准》中药成方制剂 20120301 每10丸重2.3g [检查](重量差异) 司 第十二册 缙云县天天好药品零售有 国家食品药品监督管理局标准 110802 每粒装0.25g [检查](水分) 限公司便民分公司 YBZ08942008 20130105 1303191C 20120207 20120702 1ml:2mg / / 陶静莉西医诊所 奉化市民众平价大药房 奉化市兴福欣大药房 《中国药典》2010年版二部 《中国药典》2010年版一部 [检查](可见异物) [含量测定]
2 3 4 5 6 7
参茸鞭丸 参茸鞭丸
吉林省天光药业有限公 司 海外集团天光制药
胆香鼻炎胶 吉林吉春制药股份有限 囊 公司 地塞米松磷 郑州卓峰制药有限公司 酸钠注射液 吉林省精鑫药业集团有 复方丹参片 限公司 复方对乙酰 吉林制药股份有限公司 氨基酚片 复方对乙酰 黑龙江鼎恒升药业有限 氨基酚片 公司
[含量测定] [含量测定] [含量测定]
浙江省食品药品检验研究院 浙江省食品药品检验研究院 浙江省食品药品检验研究院
5
120705
国家食品药品监督管理总局关于施行医疗器械经营质量管理规范的公告

国家食品药品监督管理总局关于施行医疗器械经营质量管理规范的公告文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2014.12.12•【文号】国家食品药品监督管理总局公告2014年第58号•【施行日期】2014.12.12•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】医疗质量正文国家食品药品监督管理总局公告2014年第58号关于施行医疗器械经营质量管理规范的公告为加强医疗器械经营质量管理,规范医疗器械经营管理行为,保证公众用械安全,国家食品药品监督管理总局根据相关法规规章规定,制定了《医疗器械经营质量管理规范》,现予公布,自公布之日起施行。
特此公告。
附件:医疗器械经营质量管理规范国家食品药品监督管理总局2014年12月12日附件医疗器械经营质量管理规范第一章总则第一条为加强医疗器械经营质量管理,规范医疗器械经营管理行为,保证医疗器械安全、有效,根据《医疗器械监督管理条例》和《医疗器械经营监督管理办法》等法规规章规定,制定本规范。
第二条本规范是医疗器械经营质量管理的基本要求,适用于所有从事医疗器械经营活动的经营者。
医疗器械经营企业(以下简称企业)应当在医疗器械采购、验收、贮存、销售、运输、售后服务等环节采取有效的质量控制措施,保障经营过程中产品的质量安全。
第三条企业应当按照所经营医疗器械的风险类别实行风险管理,并采取相应的质量管理措施。
第四条企业应当诚实守信,依法经营。
禁止任何虚假、欺骗行为。
第二章职责与制度第五条企业法定代表人或者负责人是医疗器械经营质量的主要责任人,全面负责企业日常管理,应当提供必要的条件,保证质量管理机构或者质量管理人员有效履行职责,确保企业按照本规范要求经营医疗器械。
第六条企业质量负责人负责医疗器械质量管理工作,应当独立履行职责,在企业内部对医疗器械质量管理具有裁决权,承担相应的质量管理责任。
第七条企业质量管理机构或者质量管理人员应当履行以下职责:(一)组织制订质量管理制度,指导、监督制度的执行,并对质量管理制度的执行情况进行检查、纠正和持续改进;(二)负责收集与医疗器械经营相关的法律、法规等有关规定,实施动态管理;(三)督促相关部门和岗位人员执行医疗器械的法规规章及本规范;(四)负责对医疗器械供货者、产品、购货者资质的审核;(五)负责不合格医疗器械的确认,对不合格医疗器械的处理过程实施监督;(六)负责医疗器械质量投诉和质量事故的调查、处理及报告;(七)组织验证、校准相关设施设备;(八)组织医疗器械不良事件的收集与报告;(九)负责医疗器械召回的管理;(十)组织对受托运输的承运方运输条件和质量保障能力的审核;(十一)组织或者协助开展质量管理培训;(十二)其他应当由质量管理机构或者质量管理人员履行的职责。
2014药品质量公告第1期
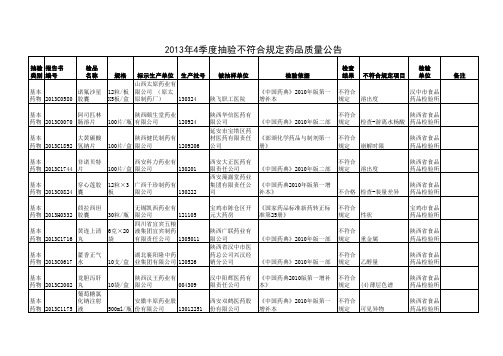
非标示生产 企业生产药 品
非基 本药 物 非基 本药 物 非基 本药 物 非基 本药 物 非基 本药 物 非基 本药 物
XAZCY20130 清火桅麦 387 片 XAZCY20130 934 荆防颗粒 XAZCY20132 消炎退热 460 颗粒 XAZCY20131 紫芝多糖 863 片 乳核内消 液
非标示生产 企业生产药 品
专项 抽验 2013C0657 醋没药 专项 抽验 2013C571
130504
专项 2013YPC053 抽验 5 沉香 专项 2013YPC053 抽验 7 法半夏 专项 抽验 2013C0660 白芍 专项 抽验 2013C0666 白术 白芍(生 专项 XAZCY20132 切未炮 抽验 366 制) 白芍(生 专项 XAZCY20132 切未炮 抽验 364 制)
/
20130701
/
20130702
/
/
121221
成都中医大惠 0.5kg/袋 康药业公司 陇南明月中药 饮片有限公司
120801
1kg/袋
120801
留坝县医院
不符合 【鉴别】-显微鉴 杨凌区药 规定 别 品检验所 汉中市食 不符合 性状、检查:总 品药品检 《中国药典2010年版一部 》 规定 灰分 验所 安康市食 不符合 品药品检 《中国药典》2010年版一部 规定 水分 验所 安康市食 不符合 性状,水分,含 品药品检 《中国药典》2010年版一部 规定 量测定 验所 安康市食 不符合 品药品检 《中国药典》2010年版一部 规定 含量测定 验所 宝鸡市食 《中国药典》2010年版第一 不符合 品药品检 增补本 规定 性状 验所 性状、鉴别、检 汉中市食 不符合 查:水分、含量 品药品检 《中国药典2010年版一部 》 规定 测定。 验所 汉中市食 不符合 性状、鉴别、检 品药品检 《中国药典》2010年版一部 规定 查、含量测定。 验所 《中国药典》2010年版一部
第3期药品质量公告中不合格药品明细药品名称标示

滋阴清肺丸
临汾市第三人民医院
131001
每丸重9g
临汾市第三人民医院
临YZ2010-011
不符合规定
微生物限度、含量测定
临汾市食品药品检验所
SxLf20150121
3%硫软膏
长治市第二人民医院
150508
20g
长治市第二人民医院
3%硫软膏所附质量标准,标准号:2013001
不符合规定
130601
9g/丸
吕梁中医结核骨病医院
LLZJBZ-GYZ-2010-10
不符合规定
含量测定
临汾市食品药品检验所
SxLf20150296
润肺解毒丸
吕梁中医结核骨病医院委托山西省吕梁中药厂生产
130601
9g/丸
吕梁中医结核骨病医院
LLZJBZ-GYZ-2010-12
不符合规定
含量测定
临汾市食品药品检验所
附件1
2015年第3期《药品质量公告》中不合格药品明细
药品名称
标示生产单位
批号
规格
被抽样单位
检验依据
检验
结果
不合格项目
检验机构
检验报告书编号
备注
脑立清丸
山西康威制药有限责任公司
3140405
每10丸重1.1克
山西亚宝医药物流配送有限公司
《中国药典》2010年
版一部
不符合规定
微生物限度
运城市食品药品检验所
非该公司生产
山药
安徽益生源中药饮片科技有限公司
141101
/
长子县人民医院
《中国药典》2010年版第二增补本
不符合规定
国家药品监督管理局关于实施《药品生产质量管理规范》有关规定的通知

国家药品监督管理局关于实施《药品生产质量管理规范》有关规定的通知文章属性•【制定机关】国家药品监督管理局•【公布日期】1999.08.24•【文号】国药管安[1999]261号•【施行日期】1999.08.24•【效力等级】部门规范性文件•【时效性】失效•【主题分类】正文*注:本篇法规已被《国家食品药品监督管理局关于清理规章和规范性文件的公告》(发布日期:2007年3月22日实施日期:2007年3月22日)宣布失效或废止(原因:适用期已过)国家药品监督管理局关于实施《药品生产质量管理规范》有关规定的通知(国药管安[1999]261号1999年8月24日)各省、自治区、直辖市药品监督管理局或卫生厅(局)、医药管理部门:为促进我国制药工业的发展,提高药品质量,保障人民用药安全有效,国家药品监督管理局总结了我国十几年来推行药品GMP的经验,借鉴其他国家和地区实施GMP的先进做法,对我国《药品生产质量管理规范》进行了修订,并就实施药品GMP提出了要求,作出了规定,现通知如下:一、依法实施GMP是药品监督管理工作的重要内容,是对药品生产全过程实施监督管理的法定制度,是保障药品质量和人民用药安全有效的可靠措施。
各级药品监督管理部门应提高对实施GMP重要性和必要性的认识,并将其作为新时期药品监督管理的一项重要任务抓紧抓好。
二、由我局组织修订的《药品生产质量管理规范》(1998年修订)已以国家药品监督管理局第9号令发布,并从1999年8月1日起施行。
请各省、自治区、直辖市药品监督管理部门认真组织本辖区药品监督管理部门和药品生产企业,学习、贯彻执行新修订的药品GMP。
三、请各省、自治区、直辖市药品监督管理部门遵照我局印发的《药品GMP认证管理办法》和《药品GMP认证工作程序》(国药管安(1999)105号),认真组织好本辖区药品生产企业的GMP认证工作。
四、为确保《药品生产质量管理规范》(1998年修订)的贯彻执行,我局将分剂型、分品种有步骤地组织实施GMP认证工作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
国家食品药品监督管理局
公告
2011年第59号
国家药品质量公告
(2011年第2期,总第86号)
为加强药品监管,保障公众用药安全,根据全国药品抽验工作计划,国家食品药品监督管理局在全国范围内组织对氟哌啶醇制剂等17个国家基本药物品种,以及苦参素注射液等4个其他制剂品种进行了质量抽验。
结果显示,本次抽验的21个品种2661批次产品中,有2652批次产品符合标准规定,9批次产品不符合标准规定,被抽验产品总体质量良好。
现将抽验结果公告如下:
一、国家基本药物品种抽验结果
本次共抽验氟哌啶醇制剂、盐酸多巴酚丁胺注射液、注射用苯唑西林钠、妇科千金制剂、去乙酰毛花苷制剂、鼻炎康片、地塞米松制剂、连翘败毒制剂、川芎茶调制剂、保和丸、右旋糖酐40制剂、盐酸肾上腺素注射液、胰岛素制剂、麻疹减毒活疫苗、醋酸甲羟孕酮制剂、开塞露、益母草制剂17个国家基本药物品种2075批次,其中2066批次产品符合标准规定,9批次产品不符合标准规定。
具体抽验结果如下:(一)氟哌啶醇制剂
本次抽样49批次,涉及5家生产企业,经北京市药品检验所检验,全部符合标准规定。
(二)盐酸多巴酚丁胺注射液
本次抽样155批次,涉及6家生产企业,经河南省食品药品检验所检验,全部符合标准规定。
(三)注射用苯唑西林钠
本次抽样114批次,涉及8家生产企业,经湖南省药品检验所检验,全部符合标准规定。
(四)妇科千金制剂
本次抽样33批次,涉及1家生产企业,经湖南省药品检验所检验,全部符合标准规定。
(五)去乙酰毛花苷制剂
本次抽样58批次,涉及1家生产企业,经江苏省食品药品检验所检验,全部符合标准规定。
(六)鼻炎康片
本次抽样29批次,涉及1家生产企业,经江苏省食品药品检验所检验,全部符合标准规定。
(七)地塞米松制剂
本次抽样142批次,涉及26家生产企业,经内蒙古自治区食品药品检验所检验,全部符合标准规定。
(八)连翘败毒制剂
本次抽样62批次,涉及17家生产企业,经内蒙古自治区食品药品检验所检验,全部符合标准规定。
(九)川芎茶调制剂
本次抽样129批次,涉及15家生产企业,经宁波市药品检验所检验,全部符合标准规定。
(十)保和丸
本次抽样283批次,涉及75家生产企业,经青海省药品检验所检验,全部符合标准规定。
(十一)右旋糖酐40制剂
本次抽样94批次,涉及31家生产企业,经陕西省食品药品检验所检验,全部符合标准规定。
(十二)盐酸肾上腺素注射液
本次抽样48批次,涉及9家生产企业,经上海市食品药品检验所检验,全部符合标准规定。
(十三)胰岛素制剂
本次抽样47批次,涉及3家生产企业,经中国食品药品检定研究院检验,全部符合标准规定。
(十四)麻疹减毒活疫苗
本次抽样99批次,涉及4家生产企业,经中国食品药品检定研究院检验,全部符合标准规定。
(十五)醋酸甲羟孕酮制剂
本次抽样183批次,涉及8家生产企业,经内蒙古自治区食品药品检验所检验,全部符合标准规定。
(十六)开塞露
本次抽样241批次,涉及44家生产企业,经西藏自治区食品药品检验所检验,有4批次产品不符合标准规定,分别为安庆市永生制药有限公司生产的批号为20100201的开塞露(含山梨醇)1批次,不合格
项目为性状、检查(微生物限度);锦州本天药业有限公司生产的批号为100604、100639的开塞露(含山梨醇)各1批次,不合格项目均为性状;鞍山九天制药有限公司生产的批号为20100109的开塞露(含山梨醇)1批次,不合格项目为含量测定。
(十七)益母草制剂
本次抽样309批次,涉及106家生产企业,经四川省食品药品检验所检验,有5批次产品不符合标准规定,分别为莱阳市江波制药有限责任公司生产的批号为1004041的益母草膏1批次,不合格项目为含量测定;广西灵峰药业有限公司生产的批号为1509105、1509117的益母草颗粒各1批次,不合格项目均为检查(细菌数);武汉鄂中药业有限公司生产的批号为090802的益母草膏1批次,不合格项目为含量测定;湖北康源药业有限公司生产的批号为1004141的益母草膏1批次,不合格项目为含量测定。
二、其他制剂品种抽验结果
本次共抽验苦参素注射液、细辛脑注射液、盐酸川芎嗪注射液、林可霉素注射液4个制剂品种586批次,经检验,全部符合标准规定。
具体抽验结果如下:
(一)苦参素注射液
本次抽样47批次,涉及14家生产企业,经福建省食品药品检验所检验,全部符合标准规定。
(二)细辛脑注射液
本次抽样164批次,涉及16家生产企业,经湖北省食品药品监督检验研究院检验,全部符合标准规定。
(三)盐酸川芎嗪注射液
本次抽样152批次,涉及18家生产企业,经海南省药品检验所检验,全部符合标准规定。
(四)林可霉素注射液
本次抽样223批次,涉及50家生产企业,经中国人民解放军总后勤部卫生部药品仪器检验所检验,全部符合标准规定。
对本次抽验结果为不符合标准规定的药品及相关单位(详见附件),各省(区、市)食品药品监督管理部门正在依法进行查处。
请各省(区、市)食品药品监督管理部门于2011年9月底前将查处结果报送国家食品药品监督管理局稽查局,同时抄送国家食品药品监督管理局药品市场监督办公室。
对本次抽验结果为符合标准规定的药品,请登录国家食品药品监督管理局网站公告通告栏目查阅。
附件:国家抽验不符合标准规定的药品名单
国家食品药品监督管理局
二○一一年七月二十五日
附件:
国家抽验不符合标准规定的药品名单。
