高三化学二轮复习专题突破
2023届高三化学二轮复习 考点突破--物质的分离、提纯和检验

2023届高三化学二轮复习考点突破--物质的分离、提纯和检验一、单选题1.用括号内试剂及操作方法除去下列各物质中的少量杂质,错误的是()A.苯中的甲苯(溴水、分液)B.溴乙烷中的乙醇(水、分液)C.乙醇中的水(CaO、蒸馏)D.溴苯中的溴(NaOH溶液、分液)2.宋代《开宝本草》中记载了KNO3的提纯方法“…所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,这里不涉及到的操作方法是()A.蒸馏B.蒸发C.结晶D.溶解3.下列家庭化学小实验不能达到预期目的是()A.用米汤检验食用加碘盐(含KIO3)中含有碘B.用醋、石灰水验证蛋壳中含有碳酸盐C.用碘酒检验汽油中是否含有不饱和烃D.用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验4.下列物质除杂的过程中,不能实现目的的是()A.A B.B C.C D.D5.下列物质分离操作错误的是()A.分离豆腐花和豆浆水:过滤B.提取白酒中的乙醇:分液C.除去NaCl溶液中少量KNO3:蒸发结晶,趁热过滤D.利用海水制取蒸馏水:蒸馏6.为达到相应实验目的,下列实验操作可行的是()]向溶液中滴入2滴溶液,产生白色沉淀后,再滴加2滴溶液,出现红褐色沉淀A.A B.B C.C D.D7.两瓶气体分别为NO2和Br2蒸气,外观均相同,某同学设计了各种鉴别法,①用湿润的淀粉KI试纸②加少量NaCl溶液③加少量AgNO3溶液④加少量水后再加适量苯⑤一定条件下改变温度()A.只能采用①③④B.只能采用②③④C.能采用②③④⑤D.都可以8.某白色固体混合物可能含有Ba(NO3)2、CaCl2、K2CO3,现进行如下实验:①将部分粉末加入水中,振荡,有白色沉淀;②向①的悬浊液中加入过量的稀硝酸,白色沉淀消失,并有气泡产生;③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。
下列判断正确的是()A.若做焰色反应,通过蓝色钴玻璃可观察到紫色B.②中现象对应的离子方程式为CO32−+2H+=CO2↑+H2OC.白色固体中一定含有Ba(NO3)2、K2CO3,可能含有CaCl2D.将步骤②中的稀硝酸改用稀盐酸,对整个实验结果没有影响9.实验室用铁泥(含Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)制备七水合硫酸亚铁(FeSO4⋅7H2O)和柠檬酸铁铁,过程如下图:下列说法错误的是()A.过程Ⅰ中杂质分离操作所用的主要玻璃仪器有漏斗、烧杯、玻璃棒B.过程Ⅱ中发生反应的离子方程式为:2Fe2++2H2O2=3Fe3++2H2O+O2↑C.过程Ⅲ中加氨水的作用是使铁元素转变为沉淀形式,可改用NaOH溶液D.可用KSCN溶液检验过程Ⅴ中Fe3+是否已完全还原为Fe2+10.在萃取﹣分液实验中,振荡分液漏斗的操作正确的是()A.B.C.D.11.采用高岭土(主要成分为Al2 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[Al2(OH)n Cl6﹣n]m (n<6,m为聚合度)}的过程如图.下列说法正确的是()A.试剂X为H2SO4B.滤渣主要成分为Fe(OH)3、H2 SiO3C.调pH过高或过低均会减少PAC生成D.滤液浓缩聚合过程发生了加聚反应12.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择正确的是()A.A B.B C.C D.D二、填空题13.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.供选择的化学试剂及实验方法A.加热升华B.加适量的食醋振荡C.用pH试纸测定溶液pHD.分别通入酸性高锰酸钾溶液.14.鉴别四种溶液:NH4Cl、(NH4)2SO4、NaCl、Na2SO4,若只用一种化学试剂,则该试剂可以是15.选择下列实验方法分离物质,将分离方法的序号填在横线上.A.萃取分液B.升华C.结晶D.分液E.蒸馏F.过滤(1)分离饱和食盐水与沙子的混合物.(2)从硝酸钾和氯化钠的混合液中获得硝酸钾.(3)分离水和汽油的混合物.(4)分离CCl4和苯(二者互溶)的混合物.16.食物的酸碱性是按分类的,请你列举两种酸性食物,.我国居民形成了摄入蔬菜和水果偏少的习惯,一般尿液呈性.三、综合题17.硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2):部分物质的物理性质如表:回答下列问题:(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为;H2Se的热稳定性比H2S的热稳定性(填“强”或“弱”).(2)乙醇浸取后过滤所得滤渣的主要成分是.蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是.(3)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式.(4)已知H2SeO3的电离常数K1=3.5×10﹣3、K2=5.0×10﹣8,回答下列问题:①Na2SeO3溶液呈性,原因是(用离子方程式表示);②在Na2SeO3溶液中,下列关系式正确的是:A.c(Na+)+c(H+)=c(SeO32﹣)+c(HSeO3﹣)+c(OH﹣)B.2c(Na+)=c(SeO32﹣)+c(HSeO3﹣)+c(H2SeO3)C.c(Na+)=2c(SeO32﹣)+2c(HSeO3﹣)+2c(H2SeO3)D.c(OH﹣)=c(H+)+c(HSeO3﹣)+c(H2SeO3)18.工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),工艺流程及相关物质溶解度曲线如图:(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为,通过冷却结晶析出大量K2Cr2O7的原因是.(2)向Na2Cr2O7母液中加碱液调pH的目的是.(3)固体A主要为(填化学式),固体B主要为(填化学式).(4)用热水洗涤固体A,回收的洗涤液转移到母液(填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低.19.某氯化铜晶体(CuCl2•2H2O)中含有少量氯化亚铁杂质,某同学设计如下工艺流程制备纯净的CuCl2•2H2O。
2023届高三化学高考备考二轮复习题型突破五 有机合成及合成路线课件

和H2O。
(7)已知
+CO2,则以 为原料合成
的条件下发生取代反应生成
,
再与CH3COCl发生取代反应生成
再与AlCl3反应可得到
再依次与NaOH熔融、HCl反应生成
,
。
时,可先将 与浓硫酸在加热
氧化可得到
,
,
4.[2022·广东化学]基于生物质资源开发常见的化工原料,是绿色化学的重要研究方
回答问题:
(1)A→B的反应类型为
。
答案:(1)取代反应或磺化反应
(2)已知B为一元强酸,室温下B与NaOH溶液反应的化学方程式为
。
答案:(2)
(3)C的化学名称为
,D的结构简式为
答案:(3)苯酚
(4)E和F可用
(写出试剂)鉴别。
答案:(4)FeCl3溶液(或其他合理答案)
。
(5)X是F的同分异构体,符合下列条件。X可能的结构简式为
得苯环上的取代基中含1个羟基;分子中苯环上只含有1个取代基,则该取代基的结
构为
、
、
、
(1、2、3、4均表示羟基的连接位置),即满足条
件的化合物I的同分异构体共有12种。其中,苯环侧链上有3种不同化学环境的氢原
子,且个数比为6∶2∶1的同分异构体应含有两个等效的甲基,则其结构简式为
或
。
2.[2022·湖北化学]化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:
合物a反应得到2 mol Ⅴ,则化合物a为
。
答案:(4)乙烯
解析:(4)化合物Ⅳ到化合物Ⅴ的反应是原子利用率100%的反应,且1 mol Ⅳ与1
2023届高考化学二轮复习专题突破练十一常见有机物及其应用含解析

高考化学二轮复习:专题突破练十一常见有机物及其应用一、选择题:本题共10小题,每小题3分,共30分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2021湖南永州三模)下列说法错误的是( )A.一定条件下,乙酸和乙醇都能与CuO反应B.丙烷和丁烷都没有同分异构体C.油脂和蛋白质都能发生水解反应D.乙烯和丙烯可通过石油裂解的方法大量获得2.(2021北京丰台区模拟)化学可使生活更美好。
下列说法不正确的是( )A.食盐可用作调味剂,也可作食品防腐剂B.包装用材料聚乙烯和聚氯乙烯都属于烃C.疫苗一般应冷藏存放,目的是避免蛋白质变性D.利用油脂的皂化反应可制得高级脂肪酸盐和甘油3.(2021上海杨浦区模拟)向苯、CCl4、无水乙醇、己烯中分别滴加少量溴水,振荡、静置后,描述错误的是( )A.苯:上层红棕色,下层无色B.无水乙醇:液体不分层C.己烯:上层无色,下层无色l4:上层无色,下层紫色4.(2021湖南永州模拟)下列关于有机物的说法正确的是( )A.棉花和蚕丝的主要成分都是纤维素B.煤的气化、液化都是物理变化C.石油裂化主要是为了得到更多的轻质油D.硫酸钠浓溶液或福尔马林都能使蛋白质变性5.(2021湖南长沙明德中学三模)中国工程院院士李兰娟团队发现,阿比朵尔对2019-nCoV具有一定的抑制作用,其结构简式如图所示,下面有关该化合物的说法不正确的是( )A.含氧官能团有2种B.能使酸性KMnO4溶液褪色C.能与碱溶液反应生成盐D.1 mol该分子最多与8 mol H2反应6.(2021湖南永州重点中学联考)薰衣草精油中一成分的结构简式为,下列关于该物质的说法不正确的是( )A.含有两种官能团B.分子式为C12H18O2C.所有碳原子处于同一平面D.能与酸性KMnO4溶液反应7.(2021湖南永州三模)关于有机化合物()的说法错误的是( )A.分子式为C8H12OB.有2种官能团C.能发生消去反应D.分子中所有原子可能共平面8.(2021河北张家口模拟)甲基丙烯酸()是一种重要的有机合成单体,下列关于甲基丙烯酸的说法错误的是( )A.分子式为C4H6O2B.与丙烯酸互为同系物C.分子中所有碳、氧原子可能处于同一平面D.1 mol甲基丙烯酸可与2 mol H2发生加成反应9.(2021湖南长郡模拟)已知有机物和的邻二氯代物均只有一种,则有机物的一氯代物有( )A.4种B.5种C.6种D.7种10.(2021湖南十校联考)药物异博定(盐酸维拉帕米)能有效控制血压升高、促进血液循环,其合成路线中有如下转化过程:(注:连有四个不同的原子或原子团的碳原子称为手性碳原子)则下列说法不正确的是( )A.Z分子中各元素的非金属性强弱为O>C>HB.X、Y、Z三种物质中都没有手性碳原子C.1 mol Y在一定条件下可以与2 mol NaOH发生反应D.X中最多有18个原子共平面二、选择题:本题共4小题,每小题4分,共16分。
2023年高三化学二轮专题复习++化学反应原理综合突破训练

考向2 反应机理循环图
5. (2022·山东卷)在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图
③在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一 定波长范围内,最大 A 对应的波长(λmax)取决于物质的结构特征;浓度越高,A 越大。 混合溶液在某一波长的 A 是各组分吸收程度之和。为研究 pH 对反应(ⅰ)和(ⅱ)平衡 的影响,配制浓度相同、pH 不同的 K2Cr2O7 稀溶液,测得其 A 随 λ 的变化曲线如图 3。 波长 λ1、λ2 和 λ3 中,与 CrO24-的 λmax 最接近的是____λ3____;溶液 pH 从 a 变到 b 的过 程中,cHc+C·cr22OC72r-O 24-的值 __增__大____(填“增大”“减小”或“不变”)。
BaS(s)+4H2O(g)在不同
2. (2022·广东卷)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X―→2Y的影响,各物
质浓度c随反应时间t的部分变化曲线如图,则( D ) A. 无催化剂时,反应不能进行 B. 与催化剂Ⅰ相比,Ⅱ使反应活化能更低 C. a曲线表示使用催化剂Ⅱ时X的浓度随t的变化 D. 使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 mol/(L·min)
10. (2022·全国乙卷)油气开采、石油化工、煤化工等行业废气普遍含有的硫化
氢,需要回收处理并加以利用。回答下列问题:
(1) 已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)===2SO2(g)+2H2O(g) ΔH1=-1036 kJ/mol
2023年高三化学二轮复习专题突破训练 有机化学综合题(含解析)

有机化学综合题真题研究1.(2022·广东,21)基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向。
以化合物Ⅰ为原料,可合成丙烯酸Ⅴ、丙醇Ⅶ等化工产品,进而可制备聚丙烯酸丙酯类高分子材料。
(1)化合物Ⅰ的分子式为__________,其环上的取代基是__________(写名称)。
(2)已知化合物Ⅱ也能以Ⅱ′的形式存在。
根据Ⅱ′的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。
(3)化合物Ⅳ能溶于水,其原因是____________________________________________________________________________________________________________________。
(4)化合物Ⅳ到化合物Ⅴ的反应是原子利用率100%的反应,且1 mol Ⅳ与1 mol化合物a反应得到2 mol Ⅴ,则化合物a为__________。
(5)化合物Ⅵ有多种同分异构体,其中含结构的有______种,核磁共振氢谱图上只有一组峰的结构简式为__________。
(6)选用含二个羧基的化合物作为唯一的含氧有机原料,参考上述信息,制备高分子化合物Ⅷ的单体。
Ⅷ写出Ⅷ的单体的合成路线__________(不用注明反应条件)。
2.(2021·福建,15)帕比司他是治疗某些恶性肿瘤的药物,其中间体(E)的合成路线如图所示:回答下列问题:(1)A 分子含有的官能团名称为________。
(2)反应Ⅱ分两步进行:B ―――――→CH 2(COOH )2PyC C 。
第一步反应为加成反应,则C 的结构简式为________________________________________________________________________; 第二步脱水的反应属于____________(填反应类型)。
(3)若反应Ⅲ加热温度太高,CH 3OH 自身反应生成的副产物为________(填名称)。
新教材适用2024版高考化学二轮总复习第2部分新高考五大题型突破题型突破2化学工艺流程综合题突破点2

突破点2 流程中分离提纯方法与方程式的书写1. (2022·北京选考)铵浸法由白云石[主要成分为CaMg(CO 3)2,含Fe 2O 3,SiO 2杂质]制备高纯度碳酸钙和氧化镁。
其流程如下:已知: 物质Ca(OH)2 Mg(OH)2 CaCO 3MgCO 3 K sp5.5×10-61.8×10-122.8×10-93.5×10-8(1)(命题角度:方程式书写)煅烧白云石的化学方程式为 CaMg(CO 3)2=====高温CaO +MgO +2CO 2↑ 。
(2)根据下表数据分析:n (NH 4Cl)∶ n (CaO)CaO 浸出率/%MgO 浸出率/%w (CaCO 3)理论值/% w (CaCO 3)实测值/% 2.1∶1 98.4 1.1 99.7 - 2.2∶1 98.8 1.5 99.2 99.5 2.3∶1 98.9 1.8 98.8 99.5 2.4∶199.16.095.697.6已知:ⅰ.MO 浸出率=煅烧得到的MO 质量×100%(M 代表Ca 或Mg);ⅱ.CaCO 3纯度计算值为滤液A 中钙、镁全部以碳酸盐形式沉淀时计算出的产品中CaCO 3纯度。
①(命题角度:方程式书写)“沉钙”反应的化学方程式为 CaCl 2+NH 3·H 2O +CO 2===CaCO 3↓+NH 4Cl +H 2O 。
②(命题角度:分离提纯)CaO 浸出率远高于MgO 浸出率的原因为_Ca(OH)2的溶度积大于Mg(OH)2,溶液中Ca(OH)2能与NH 4Cl 反应,而Mg(OH)2不能__。
③(命题角度:浸出率与投料关系)不宜选用的“n (NH 4)Cl ∶n (CaO)”数值为_2.4∶1__。
④(命题角度:误差原因分析)w (CaCO 3)实测值大于理论值的原因为_反应加入的CaO 也转化为CaCO 3__。
⑤(命题角度:浸出率与H +浓度关系)蒸馏时,随馏出液体积增大,MgO 浸出率可从68.7%增加至98.9%,结合化学反应原理解释MgO 浸出率提高的原因为 Mg(OH)2+(NH 4)2SO 4=====△MgSO 4+2NH 3↑+2H 2O ,蒸馏时,NH 3逸出促进NH +4水解,溶液中H +浓度增大,有利于Mg(OH)2完全转化为MgSO 4 。
2023届高三化学二轮复习+考点突破--常见气体的制备与收集
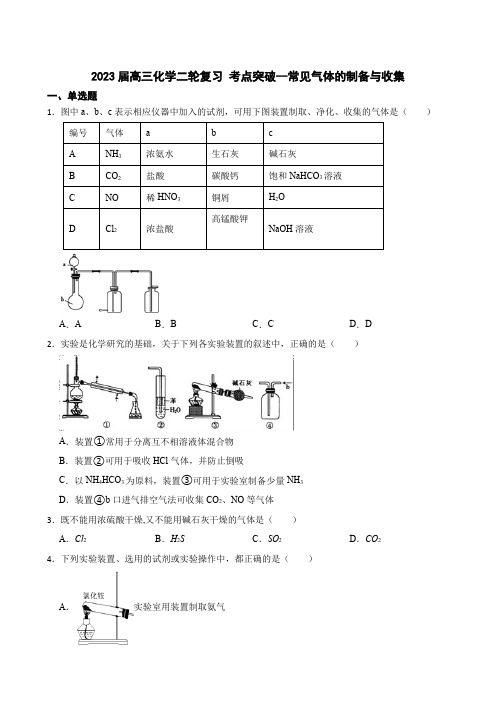
2023届高三化学二轮复习考点突破--常见气体的制备与收集一、单选题1.图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是()编号气体a b cA NH3浓氨水生石灰碱石灰B CO2盐酸碳酸钙饱和NaHCO3溶液C NO稀HNO3铜屑H2OD Cl2浓盐酸高锰酸钾NaOH溶液A.A B.B C.C D.D 2.实验是化学研究的基础,关于下列各实验装置的叙述中,正确的是()A.装置①常用于分离互不相溶液体混合物B.装置②可用于吸收HCl气体,并防止倒吸C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3D.装置④b口进气排空气法可收集CO2、NO等气体3.既不能用浓硫酸干燥,又不能用碱石灰干燥的气体是()A.Cl2B.H2S C.SO2D.CO2 4.下列实验装置、选用的试剂或实验操作中,都正确的是()A.实验室用装置制取氨气B.用装置吸收氨气,并防止倒吸C.用装置稀释浓硫酸D.用装置除去CO2中的HCl5.实验室用环戊醇(沸点160.8℃,密度0.96g/mL)与溴化氢反应制备溴代环戊烷(沸点138℃,密度1.37g/mL),其反应原理如下:OH+NaBr+H2SO4Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择()A.B.C.D.6.要设计一套实验室利用液体和液体加热反应制备气体的装置,现设计了五步操作,正确的程序是()①将蒸馏烧瓶固定在铁架台上②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集器中④检查装置的气密性(利用对固定装置微热的方法检查气密性)⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管A.②①⑤④③B.④①②⑤③C.①②⑤④③D.①⑤④②③7.下面关于图所示实验装置的使用方法中叙述正确的是()①用于排水集气:充满水,B进气,A排放水②用于收集密度比空气大的气体:A进气,B排放空气③用于收集密度比空气小的气体:B进气,A排放空气④用于洗气:装入洗液,A进气,B出气⑤用于测量气体的体积:充满水,B进气,A出水,计算溢出水的体积.A.全正确B.②③④⑤C.①③④⑤D.①②③④8.实验室用铁屑、液溴与苯制取溴苯,提纯粗溴苯需要过滤、水洗、碱洗、干燥、蒸馏等操作(上述操作可能多次,且不代表实验顺序),完成提纯实验不需要的实验装置有()A.B.C.D.9.下列有关实验的操作正确的是()实验操作A 除去NaHCO3固体中混有的NH4Cl直接将固体加热B 实验室收集Cu与稀硝酸反应成的NO向上排空气法收集C检验非金属性Cl>C在Na2SiO3溶液中加入足量HClD检验某溶液中是否有NH4+取该溶液于干净的试管中,加NaOH浓溶液加热,并用湿润的红色石蕊试纸检验A.A B.B C.C D.D10.以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下,下列说法正确的是()A.装置②的作用是干燥O2B.装置③中试剂可以是NaOH溶液C.制备反应的化学方程式为:Na2O3+CO2=Na2CO3+O2D.收集氧气应选择装置b11.下列装置正确且能达到对应实验目的的是()A.用图1装置进行银镜反应B.用图2装置检验溴乙烷消去后的产物是否含乙烯C.用图3装置制备乙酸乙酯D.用图4装置比较乙酸、碳酸、苯酚的酸性强弱12.下列气体制备实验设计中,药品和装置都合理的是()A.图1:碳酸钠与盐酸反应制备CO2B.图2:铜片与稀硝酸反应制备NOC.图3:消石灰与氯化铵固体反应制备NH3D.图4:二氧化锰与浓盐酸反应制备Cl2二、填空题13.如图1装置常用于实验室制备气体(1)写出实验室用该装置制备O2化学方程式(2)若利用该装置制备干燥NH3,试管中放置药品是(填化学式);仪器a中放置药品名称是(3)图2装置实验室可用于制备常见的有机气体是.仪器b名称是有学生利用图B装置用浓氨水和生石灰制备NH3,请说明该方法制取NH3的原因(4)学生甲按图3所示探究氨催化氧化,用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气,然后将红热的螺旋状铜丝插入锥形瓶中;片刻,锥形瓶中气体变为红棕色.下列叙述正确的是A.如图收集氨气是利用氨水的密度较小B.锥形瓶必须干燥C.收集氨气时间越长,红棕色现象越明显D.铜丝能保持红热(5)学生乙对学生甲的实验提出了异议,认为实验中产生的红棕色气体可能是空气中的氮气氧化后造成的,你认为学生乙的说法合理吗?请你设计一个简单实验证明学生乙的说法是否正确.14.如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是(填序号).a.洗气或干燥装置:瓶内放一定体积溶液,由a管口进气b.用于收集不溶于水的气体:瓶内充满水,由b管口进气c.提供少量CO:瓶内充满CO,b管口接自来水龙头d.H2S和SO2反应的装置:由a管口通入H2S,b管口通入SO2e.病人输氧时用于观察输氧速度:瓶内装适量水,b接病人鼻腔.15.如图为实验室制取自来水的装置示意图,根据图示回答下列问题.(1)图中有(填数值)处明显的错误.(2)A仪器的名称是,B仪器的名称是.(3)实验时A中除加入适量自来水外,还需加入少量,其作用是.(4)要检测锥形瓶中的蒸馏水是否含有Cl﹣,需要的两种化学试剂是(填化学式).16.如图为实验室制取蒸馏水的装置示意图,请根据图示回答下列问题.(1)图中有两处明显的错误分别是①②(2)图中A仪器的名称是(3)实验时A中除加入自来水外,还需加入少量,其作用是.(4)区别自来水和蒸馏水可用的试剂是.三、综合题17.氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390℃,沸点是430℃,溶于冷水,退热水则强烈水解。
2022届高三化学二轮总复习 专题突破 专题三 离子反应 氧化还原反应(76张)

不守恒,正确的离子方程式为3NO2 + H2 O === 2H+ + 2NO−
3 +NO,B项错误;
________________________________________________;
+H2O
(8)将H2S气体通入CuSO4溶液中:
H2S+Cu2+===2H++CuS↓
________________________________________________;
(9)将少量SO2气体通入Na2CO3溶液中:
(11)Al和NaOH溶液的反应:
+ − + = − +3H2↑
__________________________________________________;
(12)AlCl3和过量氨水的反应:
+ + · = ↓ ++
3
2H2O
C.硫酸铝溶液中滴加少量氢氧化钾溶液:Al3+ + 4OH − == AlO2− +
2H2O
D.氯化铜溶液中通入硫化氢:Cu2++S2-===CuS↓
答案:A
3.[2020·江苏卷]下列指定反应的离子方程式正确的是(
)
A.Cl2通入水中制氯水:Cl2+H2O⇌2H++Cl-+ClO-
B.NO2通入水中制硝酸:22 + 2 === 2 + + 3− +
与CO2−
、SO
,Ag
4
4
3
3
②因发生氧化还原反应不能大量共存:具有氧化性的离子与具有还
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 下图是某同学用500 mL 容量瓶配制0.10 mol·L -1 NaOH 溶液的过程:该同学的错误步骤有( )A .1处B .2处C .3处D .4处2. 若20 g 密度为ρ g·cm -3的Ca(NO 3)2溶液中含有2 g Ca(NO 3)2,则溶液中NO -3的物质的量浓度为( )A.ρ400mol·L -1 B.20ρ mol·L -1 C.50ρ41mol·L -1D.25ρ41 mol·L -1 3. 只给出下列甲和乙中对应的量,不能求出物质的量的是( )好使反应后的溶液呈中性,则下列叙述错误的是 ( )A .溶液中c (Na +)=2c (SO 2-4)B.a2mol >沉淀的物质的量>0 C .沉淀的物质的量=a2molD .原浓硫酸中H 2SO 4的物质的量>a2mol5. 3 g 镁铝合金与100 mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4 g ,则原硫酸的物质的量浓度为( )A.1 mol·L-1B.1.5 mol·L-1C.2 mol·L-1D.2.5 mol·L-16.等质量的CuO和MgO粉末分别溶于相同体积的硝酸中完全溶解,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol·L-1和b mol·L-1,则a与b的关系为()A.a=b B.a=2bC.2a=b D.a=5b7.300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1 Ba(OH)2溶液300 mL,反应后溶液中SO2-4的物质的量浓度为()A.0.4 mol·L-1B.0.3 mol·L-1C.0.2 mol·L-1D.0.1 mol·L-18.在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。
下列叙述中正确的是()①w=35a22.4Vρ×100%②c=1 000a22.4V③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w④若上述溶液中再加入0.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为c(NH+4)>c(Cl-)>c(OH-)>c(H+)A.①④B.②③C.①③D.②④9.右图是NaCl、MgSO4的溶解度曲线。
下列说法正确的是()A.只有在t1℃时,NaCl和MgSO4的溶解度才相等B.t1~t2℃,MgSO4的溶解度随温度升高而减小C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出10.36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为W,物质的量浓度为c mol·L-1,N A表示阿伏加德罗常数,则下列叙述中正确的是()A.所得溶液的物质的量浓度:c=1 mol·L-1B.所得溶液中含有N A个HCl分子C.36.5 g HCl气体占有的体积为22.4 LD.所得溶液的质量分数:W=36.5 c/(1 000ρ)11.试回答下列问题。
(1)已知24 g A和40 g B恰好完全反应生成0.4 mol C和32 g D,则C的摩尔质量为________。
(2)把1 mol Na和1 mol Mg分别投入到等量且过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为m a________m b。
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:盐酸分子式:HCl 相对分子质量:36.5 密度:1.19 g·cm -3HCl 的质量分数:36.5%①该浓盐酸中HCl 的物质的量浓度为______ mol·L -1。
②标准状况下,1.00 L 水(密度为1.00 g·cm -3)吸收________ L 的HCl 可制得上述浓盐酸。
12.奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。
然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH 3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?________________________________________________________________________ ________________________________________________________________________。
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( ) A .烧杯中溶液转移到容量瓶中时,未洗涤烧杯 B .定容时,俯视刻度线 C .定容时,仰视刻度线 D .移液时,有少量液体溅出(3)若称取样品的质量为1.5 g ,共配制100 mL 的溶液,取其中的20 mL ,经过一系列处理后,使N 转变为硼酸铵然后用0.1 mol·L -1盐酸滴定,其用去盐酸的体积为23.0 mL ,则该样品中N 的含量为________。
[已知:滴定过程中涉及到的反应方程式:(NH 4)2B 4O 7+2HCl +5H 2O===2NH 4Cl +4H 3BO 3] 13.盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。
实验室以盐泥为原料制取MgSO 4·7H 2O 的实验过程如下: 29.0 g 盐泥――→①水,调成泥浆②稀硫酸调pH 为1~2――→③煮沸④过滤滤液Ⅰ―→滤液Ⅱ―→产品已知:①室温下K sp [Mg(OH)2]=6.0×10-12。
②在溶液中,Fe 2+、Fe 3+、Al 3+从开始沉淀到沉淀完全的pH 范围依次为7.1~9.6、2.0~3.7、3.1~4.7。
③三种化合物的溶解度(S )随温度变化的曲线如图所示。
(1)在盐泥中加入稀硫酸调pH 为1~2以及煮沸的目的是_____________________。
(2)若室温下的溶液中Mg 2+的浓度为6.0 mol·L -1,则溶液pH ≥________才可能产生Mg(OH)2沉淀。
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO 调溶液pH 约为5,再趁热过滤,则趁热过滤的目的是__________________,滤渣的主要成分是______________________。
(4)从滤液Ⅱ中获得MgSO 4·7H 2O 晶体的实验步骤依次为①向滤液Ⅱ中加入______________;②过滤,得沉淀;③________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(5)若获得的MgSO 4·7H 2O 的质量为24.6 g ,则该盐泥中镁[以Mg(OH)2计]的百分含量约为________(MgSO 4·7H 2O 的相对分子质量为246)。
14.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:(1)表中硫酸的质量分数为________(不写单位,用含c 1、ρ1的代数式表示)。
(2)物质的量浓度为c 1 mol·L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________ mol·L -1。
(3)将物质的量浓度分别为c 2 mol·L-1和15c 2 mol·L -1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm -3,所得溶液的物质的量浓度________35c 2 mol·L -1(设混合后溶液的体积变化忽略不计)。
专题突破答案1. 答案 C解析 第①步不能把NaOH 放在称量纸上称量;第④步玻璃棒应接触容量瓶内壁刻度线以下的部分;第⑤步定容时应平视刻度线。
2. 答案 C 3. 答案 C 4. 答案 C解析 铜和浓硫酸反应后的溶液中含有CuSO 4和H 2SO 4,加入含a mol NaOH 的溶液后显中性,此时溶液中的溶质为Na 2SO 4,Cu 2+完全沉淀,A 项正确;n (CuSO 4)<a 2 mol ,故B 项正确,C 项错;由于有一部分浓硫酸被还原为SO 2,故n (H 2SO 4)>a2 mol ,D项正确。
5. 答案 B解析 由镁铝合金到无水硫酸盐,固体增重的质量为SO 2-4的质量,则n (H 2SO 4)=n (SO 2-4)=(17.4-3) g 96 g·mol -1=0.15 mol ,故c (H 2SO 4)=0.15 mol 0.1 L =1.5 mol·L -1,B 对。
6. 答案 C解析 该溶液中,n (CuO)∶n (MgO)=m M (CuO )∶m M (MgO )=m 80∶m 40=1∶2,体积相同时,物质的量的比等于物质的量浓度的比,所以a b =n (CuO )n (MgO )=12,即2a =b ,故选C 。
7. 答案 D解析 n (Al 3+)= 1.62 g 27 g·mol -1=0.06 mol ,则n (SO 2-4)=0.09 mol ,加入的Ba(OH)2溶液中含Ba 2+0.03 mol ,反应后剩余SO 2-4 0.06 mol ,此时溶液的体积为600 mL ,因此c (SO 2-4)=0.1 mol·L -1。
8. 答案 D解析 ①w =a 22.4×17Vρ×100%=17a22.4Vρ×100%;②c =a 22.4V 1 000=1 000a 22.4V;③因为V mL水的质量大于V mL 氨水的质量,所以溶液的质量分数小于0.5w ;④所得溶液为NH 4Cl 和NH 3·H 2O 等物质的量的混合液,所以c (NH +4)>c (Cl -)>c (OH -)>c (H +)。
