-常见晶体结构举例
§1-3 常见晶体结构举例 固体物理 教学课件

2. 体心立方(bcc)----- w
3.金刚石结构 (GT016a) 两个fcc子格子沿对角线相对位移1/4体 对角线长度套构而成。 B格子是fcc 惯用原胞包含格点数=4 基元内原子数=2 (同种元素) 惯用原胞包含原子数=2x4=8 配位数=4
注意
不同晶体结构的Cu.NaCl,金刚石结构, 闪锌矿结构等,它们的B格子均为fcc,
所以,B格子的种类数大大少于晶体结 构的种类数。
7. 六方密排结构(h c p)---Mg
(模型)(GT003)
惯用原胞是以正六边形为底的直角棱柱。 晶格常数是正六边形的边长a和柱高c.
密堆积:如果晶体由全同的一种粒子组成, 而粒子被看成是小圆球,这些小圆球最紧 密的堆积状态。此时它有最大的配位数- --12。
§1-3 常见晶体结构举例
1. 面心立方(fcc) ------ Cu
2. (GT002)
3. 致密度η(又称空间利用率):晶体中 原子所占体积与晶体总体积之比。
4. 配位数:晶体中一个原子最近邻的原子 数。
5.
(注意:不是格点数)
6. 例如:Cu
7. 配位数=12,惯用原胞包含格点数=4
8.
最近邻原子间距=?
有最大配位数12的排列方式称为密堆积。
基元内原子数=2
惯用原胞体积是初基原胞体积的3倍
hcp的排列方式为AB,AB,……密排面垂直于棱柱高c轴。
fcc的排列方式为ABC,ABC,……
密排面垂直于体对角线。
(GT003,
模型)
hcp和fcc均为配位数为12的密堆积,
可能给我们什么启示?
8. 纤维锌矿结构(六角硫化锌结构) 两个hcp套构而成。 例如,ZnO, ZnS。 (模型)
第二章45节晶体结构与常见晶体类型-文档资料

ABC ABC... .
8
面面心心立立方方最最紧紧密密堆堆积积
A
B
C
9
面心立方最紧BCABC……, 即每三层重复一次
10
面面心心立立方方最最紧紧密密堆堆积积
12
6
3
54
11
晶体结构
面心立方 晶胞
在这种堆积方式中可以找出面心立方晶 胞,其中的相当点按面心立方格子分布, 所以称为面心立方最紧密堆积。 其最紧密排列层平行于{111}面网。
①被极化—— 一个离子在其他离子所产生的外电场作用下产生极化(变形)。 变形程度大小用极化率α表示。
F
F——离子所在位置的电场强度;u——诱导偶极矩。 u=e·L e——电荷;L——极化后正、负电荷的中心距。
②主极化——一个离子其本身的电场作用于周围离子使其他离子极化变形。主极 化能力的大小用极化力β表示。
4
六方最紧密堆积
A B A B A
ABABAB…… 每两层重复一次
5
六方晶胞——六方密堆积
A
B
A
密 排
B面
A
A
6
※ 六方最紧密堆积的排列层序是:AB AB AB... ... 将这些球的球心联结起来,便形成六方原始格子,即在这
种堆积中可找出六方晶胞,故称为六方最紧密堆积。其 最紧密排列层平行于{0001}面网。
w r2
w——离子的电价;r——离子半径。
33
在离子晶体中,一般正离子半径较小,当电价较高时, 极化力较明显,而极化率较小,不易变形。负离子半径较大 ,易于变形而被极化,而极化力较小。如Br-、I-等。
通常只考虑正离子对负离子的极化作用。但当正离子外层 为18电子构型时,如Cu+、Ag+、Zn2+等,极化率也比较大, 需考虑负离子对它们的极化作用。
第一章晶体结构(离子晶体课件4-2)

结构中O2-离子作变形的六方最紧密堆积,正离子占据一半的八
面体空隙位,并且交替占据,有一半是空的。八面体单元TiO6共边连接
成平行于C轴的链。 这种结构属于四方晶系,简单四方点阵。就一个晶胞而言,Ti4+ 占
据简单四方点阵的顶点和体心位置,O2-则处于上、下底面一组相互平行
对角线上和通过体心并平行于上下底截面上另外方向的一条对角线上, 这三条面对角线上各有两个O2-,它们距离所在面对角线端点的距离同为对
3、A2B3型化合物结构:
其中O 离子近似作六方最紧密堆积(HCP),Al
2-
2-
3+
离子填充在6个O 离子形成有八面体空隙中。 由于 3+ Al/O=2/3,所以Al 占据八面体空隙的2/3,其余1/3的空 隙均匀分布,这样13层构成一个完整周期。刚玉结构 中 正负离子的配位数分别为6和4。
依照Pauling第一规则,钛、氧离子半径比r /r 3+ =0.43>0.414, Al 的C.N.=6,处于八面体空隙位置;依照 3+ 2Pauling第二规则, Al -O 静电强度Si=3/6=1/2。氧离子 为负二价,因此它的配位数为4.
尖晶石的单位细胞
[反尖晶石结构]
在面心立方体点阵中,占T位和O位的正离子必须满足:A离子 (占T位)的半径必须小于B离子(占O位)的半径。如果A离子半径 大于B离子,则A离子占据O位,B离子占据T位。这种结构称作反尖 晶石结构。正离子占据孔隙的情况如下: 32个O2-离子 64个四面体空隙 32个八面体空隙 16个A3+离子 8个A3+离子 8个A3+离子
晶体结构.01

1.1 几种常见的晶体结构
一、晶体的定义
晶 体: 组成固体的原子(或离子)在微观上的 排列具有长程周期性结构
非晶体:组成固体的粒子只有短程序(在近邻或 次近邻原子间的键合:如配位数、键长 和键角等具有一定的规律性),无长程 周期性 准 晶: 有长程的取向序,沿取向序的对称轴方向 有准周期性,但无长程周期性
第一章 晶体结构(crystal structure)
1-1 几种常见的晶体结构 1-2 晶格的周期性 1-3 晶向、晶面和它们的标志 1-4 对称性和Brawais点阵
1-5 倒点阵及其基本性质
1-6 晶体衍射物理基础
1
1-1几种常见的晶体结构
主要内容
1.1简立方晶格结构(cubic)
1) NaCl晶体的结构 氯化钠由Na+和Cl-结合而成 —— 一种典型的离子晶体 Na+构成面心立方格子;Cl-也构成面心立方格子
20
2) CsCl晶体的结构 CsCl结构 —— 由两个简单立方子晶格彼此沿立方体空间对 角线位移1/2 的长度套构而成
21
CsCl晶体
22
3) ZnS晶体的结构 —— 闪锌矿结构 立方系的硫化锌 —— 具有金刚石类似的结构 化合物半导体 —— 锑化铟、砷化镓、磷化铟
六角密排晶格的原胞基矢选取 —— 一个原胞中包含A层 和B层原子各一个 —— 共两个原子 k
定义:
i
j
原胞基矢为:
a1 , a2 , a3
a1 a2 a3
(四)晶格周期性的描述 —— 布拉伐格子
Bravais lattices
由于组成晶体的组分和 组分的原子排列方式的 多样性,使得实际的晶 体结构非常复杂。
Chap2-2晶体结构(PDF9)

晶体结构
晶体和非晶体
晶体:固体材料中原子在三维空间呈周期性规则
雪
排列,有规则外形,有一定熔点,各向异性。
花 六
举例:食盐、蔗糖
种
非晶体:原子不规则排列,无规则外形,无一定
形 貌
熔点,各向同性。
举例:萘
实 际 晶 体
照 片
SEM
金属晶体结构
大多数固态金属內部的原子都在三微空间整齐规律地排列(晶体)。 因此其原子位置可以画成三微空间立体格子形式,称为晶格 (crystal lattice); 构成晶格的最小立体格子单位称晶胞(unit cell)。 金属的主要晶体结格有三种: 面心立方(Face-centered cubic, FCC) 体心立方(Body-centered cubic, BCC) 密排六方(Hexagonal close-packed, HCP)
HCP晶面、晶向指数
三坐标系a1, a2, c: 晶面指数——(h k l); 晶向指数——[U V W]; 确定方法同立方晶系。 四坐标系a1, a2, a3, c: 晶面指数——(h k i l),i=-(h+k); 晶向指数——[u v t w]; u=1/3(2U-V),v=1/3(2V-U) t=-(u+v), w=W,转化后取最小公倍数。
BCC结构
晶胞原子数: 1+8×1/8 =2 晶胞常数:
a = 4R / πR3 ) 2× ( 4 πR3 )
3 a3
=3 (4R /
3)3
= 0.68
HCP结构
举例:Cd、Ti、Be、Mg、Zn
HCP结构
晶胞原子数: 3+12×1/6+2 ×1/2 =6 晶胞常数:
晶体与非晶体的例子

晶体与非晶体的例子晶体与非晶体是固体材料中两种常见的结构类型,它们在原子或分子排列上存在着显著的不同。
下面将分别从晶体和非晶体的角度举例说明它们的特点和应用。
晶体是具有长程有序结构的固体材料,其原子或分子呈周期性排列,形成具有特定几何形状和面向的晶体结构。
晶体的结构稳定、有序,具有明确的晶体学方向性。
以下是几种常见的晶体材料:1. 钻石:钻石是一种由碳原子构成的晶体材料,具有极高的硬度和光泽。
它的晶体结构是由碳原子以sp3杂化形式排列而成的,使得钻石成为非常耐磨的材料,被广泛用于珠宝和工业领域。
2. 盐类晶体:如氯化钠(NaCl)、碳酸钙(CaCO3)等,这类晶体由正负离子以离子键结合形成。
氯化钠是一种典型的离子晶体,其晶体结构呈立方对称,被广泛应用于食品加工和化工生产中。
3. 金属晶体:金属材料的晶体结构多为紧密堆积结构,如面心立方、体心立方等。
金属晶体具有良好的导电性和导热性,被广泛应用于电子、汽车等领域。
4. 半导体晶体:如硅(Si)、锗(Ge)等,这类晶体结构介于金属和非金属之间,具有一定的导电性和带隙能量。
半导体晶体在电子器件制造中发挥着关键作用。
非晶体是没有规则周期结构的固体材料,其原子或分子呈无序排列状态,缺乏明显的晶体学方向性。
以下是几种常见的非晶体材料:5. 玻璃:玻璃是一种非晶体材料,其原子排列呈无序状态。
玻璃具有透明、硬度高、不导电等特点,被广泛用于建筑、容器、光学器件等领域。
6. 塑料:塑料是一种由高分子化合物构成的非晶体材料,其分子链呈无序排列。
塑料具有轻质、耐腐蚀、易加工等特点,广泛应用于包装、建材等领域。
7. 液晶:液晶是一种介于液体和固体之间的非晶体材料,其分子呈液态有序排列。
液晶具有电光响应性,被广泛应用于液晶显示器、电子书等领域。
8. 胶体:胶体是一种由固体颗粒悬浮在液体中形成的非晶体材料,具有粒径小、表面活性大等特点。
胶体在生物医药、食品加工等领域有着重要应用。
晶体结构2

第二讲—化合物晶体结构
主讲:王宇斌
2010-2011学年第Ⅰ学期
• 原子晶体、分子晶体和金属晶体结构
• 典型无机化合物晶体结构
– NaCl型、闪锌矿型、萤石型
– 钙钛矿型、纤锌矿型、金红石型
– 金刚石和石墨、CsCl型 • 硅酸盐晶体结构质是晶体内部结构的反应 • 晶体结构概述 • 1.原子晶体结构 • 代表:惰性气体 结构特点:以单原子分子 形式存在,满电子层结构,不形成化学键, 且具有球形对称结构;惰气通过范德华力 凝聚成晶体,原子配置近似“钢球”密堆 积:FCC or HCP
3
2013-7-10
• 2.分子晶体结构 • 代表:白磷 • 结构特点:构成晶体 的结构单元为分子, 分子内原子靠共价键 结合,分子之间靠范 德华力结合
结构决定性质:范德华很弱,分子晶体在较低 温度下即能熔融或升华,分解为分子单位;分 子内共价键为强键,分子自身离解需很高温度
2013-7-10
• 3.金属晶体结构 • 如上章所讲,金属原子看作刚性球体,作 紧密堆积 • 堆积方式:面心立方,体心立方和六方紧 密堆积
[ZnS4]四面体以反向“一坐三”的方式在空间中堆积
25
+++++++
------+ + + + + + +
+
+ -
+++++++
----------
26
• 二. AX型结构 • 1). 萤石结构CaF2 – 立方晶系:a=0.545nm – r +/r-=0.975 – CN(Ca2+)=8 – 面心立方格子Ca2+一套,F -两套穿插而成 – 可看成:Ca2+按面心立方密 堆积,F-填充全部四面体空隙 – 立方体晶胞共棱连接 – 一半立方体空隙未填充
无机材料科学基础第二章-晶体结构-第6节(3)

CaO静电键强度与MgO相同,但晶体结构疏松,不稳定,易水 化。因为Ca2+离子半径大,使O2-离子的立方密堆积紧密程度变 松。 CaO 的晶格能为3469KJ/mol ,熔点2560 ℃。
6
2、CsCl型
r+/r- = 0.93(大于0.732)
CsCl晶体为Pm3m空间群(立方原始格子); a0=0.411nm; Cl-按简立方形式堆积,位于立方体的8个角顶上;Cs+填充在立方体 中心。 Cl-、Cs+的配位数均为8;单位晶胞中的分子数Z=1;
r+/r- = 0.102/0.181=0.56 (0.414~0.732)
3
②球体紧密堆积方法:Cl-按面心立方紧密堆积,Na+填入 全部八面体空隙(Na︰Cl=1︰1); ③配位多面体及其连接方式:[NaCl6]八面体以共棱方式 连接,该描述方法适宜于复杂晶体结构。
NaCl中的正八面体结构
4
属于NaCl型结构的晶体很多,表2-7所示。
按离子堆积分析, O2-按变 形的六方密堆积, Ti4+只填 充了O2-所形成的八面体空隙 的一半(Ti︰O=1 ︰2)。
16
晶胞中质点的坐标为:Ti4+(000),(1/2 1/2 1/2);
O2-(uu0),((1-u) (1-u) 0),((1/2+u)(1/2-u)1/2),
1号点 2号点 4号点 3号点
单位晶胞中质点的坐标如图所示。 属于CsCl结构的晶体有CsBr、CsI、NH4Cl 等。
7
3、闪锌矿(立方ZnS)型结构(共价晶体)
闪锌矿为Fm3m 空间群, a0=0.540nm。面心立方格子,S=按立方 紧密堆积,Zn2+交错处于八分之一小立方体中心,占据四面体空 隙的一半; 质点坐标及投影图如图所示。
大学材料科学基础第二章材料中的晶体结构

4.晶面间距(Interplanar crystal spacing)
两相邻近平行晶面间的垂直距离—晶面间 距,用dhkl表示,面间距计算公式见(1-6)。 通常,低指数的面间 距较大,而高指数的 晶面间距则较小 晶面间距愈大,该晶 面上的原子排列愈密 集;晶面间距愈小, 该晶面上的原子排列 愈稀疏。
晶体结构 = 空间点阵 + 结构单元
如:Cu, NaCl, CaF2有不同的晶体结构, 但都属于面心立方点阵。 思考题:空间点阵与布拉菲点阵。
三、 晶向指数与晶面指数
(Miller Indices of Crystallographic Directions and Planes) 在晶体中,由一系列原子所组成的平面称 为晶面,原子在空间排列的方向称为晶向。 晶体的许多性能都与晶体中的特定晶面和晶 向有密切关系。为区分不同的晶面和晶向, 采用晶面和晶向指数来标定。
5.晶带 (Crystal zone) 所有平行或相交于同一直线的晶面构 成一个晶带,此直线称为晶带轴。
晶带轴[u v w]与该晶带的晶面(h k l) 之间存在以下关系: hu + kv + lw = 0 凡满足此关系的晶面都属于以[u v w]为 晶带轴的晶带,律应用举例
1 晶胞中原子数 (Number of Atoms in Unit Cell)
一个晶胞内所包含的原子数目。 体心立方晶胞:2个。 面心立方晶胞:4个。 密排六方晶胞:6个。
2 原子半径 r 与点阵常数 a 的关系
严格的说,原子半径并不是一个常数,它 随外界条件(温度)、原子结合键、配位数而 变,在理论上还不能精确地计算原子半径。 定义为晶胞中原子密排方向上相邻两原子 之间平衡距离的一半,用点阵常数表示。
固体物理:1-晶体结构-1

1 4
a1
1 4
a2
1 4
a3
晶列、晶向、晶面、及其指数标记
在布拉伐格子中作一簇平行的直线,这些平行直线 可以将所有的格点包括无遗。
—— 在一个平面里,相邻晶列之间的距离相等 —— 每一簇晶列定义了一个方向 —— 晶向
沿晶向到最短的一个格点的位矢
l1a1 l2a2 l3a3
晶向指数 [l1, l2 , l3 ]
Graphene, 石墨烯(2010 Nobel Prize)
布拉维格子(Bravais lattice)
晶体可以看作是在布拉维点阵(Bravais Lattice)的 每一个格点上放上一组基元(Basis )
原胞(元胞,初基元胞) primitive cell
和一个给定格点的最近邻格点的数量为配位数 z
原子球排列为:AB AB AB ……
Be、Mg、Zn、Cd
各种晶格的堆积比
金刚石晶格结构(diamond)
碳原子构成的一个面心立方原胞内还有四个 原子,分别位于四个空间对角线的 1/4处
NaCl晶体的结构 (sodium chloride)
CsCl晶体的结构(cesium chloride)
CsCl结构 —— 由两个简单立方子晶格彼此沿立方体空间对角线位移1/2 的 长度套构而成
闪锌矿结构 (zinc blende) ZnS
立方系的硫化锌 —— 具有金刚石类似的结构 化合物半导体 —— 锑化铟、砷化镓、磷化铟
钙钛矿结构 (perovskite)
钙钛矿型的化学式可写为ABO3 —— A代表二价或一价的金属 —— B代表四价或五价的金属 —— BO3称为氧八面体基团, 是钙钛矿型晶体结构的特点
晶体结构1
举例说明单晶体多晶体和非晶体的结构

举例说明单晶体多晶体和非晶体的结构下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!单晶体、多晶体与非晶体的结构比较1. 单晶体的结构单晶体是指由同一种化学物质构成的晶体,其原子或分子排列呈现高度有序的结构。
晶体结构-晶体的结构举例(奥赛4)
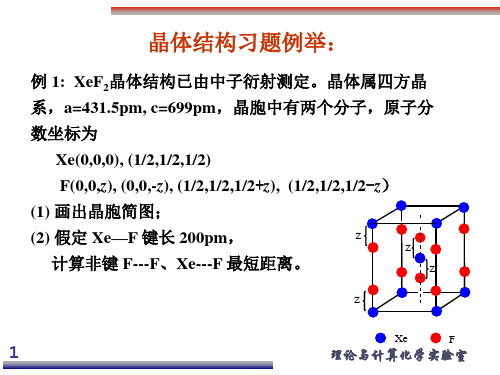
21
理论与计算化学实验室
解: (1) (88.1g/MM): (134.4L/22.4L.mol-1) = 1 : 4
MM = 58.7g.mol-1; 可推出:M应是金属Ni; (2) (a)主要原因是混乱度(熵)增加了(从表面 化学键角度讨论焓变,熵变和自由能变化也可)。
(b)氧离子在氧化铝表面作单层排列,镍离子 有规律地填充三角形空隙中。
12
理论与计算化学实验室
(b) 首先,由晶体结构参数求出C60分子的半径R。由hcp结 构的晶胞参数a求得:R=0.5a=0.5×1002pm=501pm 也可由ccp结构的晶胞参数求R,结果稍有差别。
由C60分子堆积成的两种最密堆积结构中,空隙类型及 数目都是相同的。
四面体空隙所能容纳的小球的最大半径为: rT=0.225R=0.225×501pm=112.7pm
3a 8
3 648.9 pm 140.5 pm 8
16
理论与计算化学实验室
(c) 设锡的摩尔质量为M,灰锡的密度为DSn(灰)晶胞中的 原子数为Z,则:
M DSn(灰)a3N / Z 5.75g cm-3 (648.9 1010 cm)3 6.022 1023 mol1
8 118.3g mol1
=16.4o
(
h
2
a2
k
2
)
(
l c
)2
显然,对此四方结构(001)衍射的θ值最小。
9
理论与计算化学实验室
例5:由于生成条件不同,C60分子可堆积成不同的晶体结 构,如立方最密堆积和六方最密堆积结构。前者的晶胞参 数a=1420pm;后者的晶胞参a=b=1002pm,c=1639pm。 (a) 画出C60的ccp结构沿四重轴方向的投影图;并用分数 坐标示出分子间多面体空隙中心的位置(每类多面体空隙 中心只写一组坐标即可)。 (b) 在C60的ccp和hcp结构中,各种多面体空隙理论上所能 容纳的“小球”的最大半径是多少?
典型的晶体结构范文

典型的晶体结构范文晶体是由原子、分子或离子按照一定的规律排列而组成的固体物质。
晶体结构是指晶体中原子、分子或离子的空间排列方式。
不同的晶体结构决定了晶体的物理性质和化学性质。
下面将介绍几种典型的晶体结构。
1.离子晶体结构:离子晶体是由带正电荷的阳离子和带负电荷的阴离子构成的晶体。
它们之间通过离子键相互结合。
典型的离子晶体如氯化钠(NaCl)。
在氯化钠晶体中,钠离子和氯离子按照八面体配位的方式排列。
每个钠离子被六个氯离子包围,每个氯离子被六个钠离子包围。
2.共价晶体结构:共价晶体是由原子通过共用电子而形成的晶体。
原子之间的共价键保持着晶体的稳定性。
典型的共价晶体如金刚石(C),其中每个碳原子通过共价键与周围四个碳原子相连。
金刚石晶体的结构是由不同的碳原子和碳原子之间的关系构成的。
3.金属晶体结构:金属晶体是由金属原子构成的晶体,金属原子之间通过金属键相互结合。
金属晶体的典型例子是铁(Fe)和铜(Cu)。
在金属晶体中,金属原子形成密堆积结构,具有非常高的导电性和热导性。
4.分子晶体结构:分子晶体是由分子构成的晶体,分子之间通过范德华力相互结合。
分子晶体的典型例子是冰(H2O)。
在冰晶体中,水分子通过氢键连接在一起,形成六角形密堆积结构。
5.网络共价晶体结构:网络共价晶体是由原子通过共价键形成复杂的网状结构的晶体。
典型的例子是二硫化碳(CS2)。
在二硫化碳晶体中,碳原子通过共价键和硫原子形成复杂的网状结构。
以上是一些典型的晶体结构,每种晶体结构都有其独特的特点和性质。
了解晶体的结构对于研究晶体的物理性质和化学性质具有重要意义。
晶体结构

《金属晶体》
一、金属共同的物理性质
容易导电、导热、有延展性、有金属光泽等。
金属为什么具有这些共同性质呢?
二、金属的结构
问题:构成金属晶体的粒子有哪些?
组成粒子:金属阳离子和自由电子
1.“电子气理论”(自由电子理论) 金属原子脱落来的价电子形成遍布整
个晶体的“电子气”,被所有原子所共用, 从而把所有的原子维系在一起。
1、什么是晶体?什么是非晶体?
定义:晶体——具有规则几何外形的固体
非晶体——没有规则几何外形的固体
2、晶体有什么特点和性质?
特点和性质: (1) 晶体有自范性(几何外形和内部质点排
列的高度有序性,非晶体没有) (2)晶体具有各向异性(非晶体不具有各向异
性) (3)晶体具有固定的熔点(非晶体不具有固定
《分子晶体与原子晶体》
交流·讨论
雪花、冰糖、食盐、水晶 和电木(酚醛树脂)这些固体 是否属于晶体?若不是晶体, 请说明理由。
观察与思考: 下列两种晶体有什么共同点?
干冰晶体结构
碘晶体结构
一、分子晶体
1、概念
构成晶体的粒子是分子,粒子 间以分子间作用力(范德华力, 氢键)相互作用的晶体叫分子晶 体。
故其熔点金刚石高。
金刚石 3550
沸点 (℃)
4827 4827
(3)石墨属于哪类晶体?为什么?
石墨为混合键型晶体。
4. 只认识到冰中含有共价键(即氢元素和 氧元素之间的共价键),而没有认识冰晶 体中水分子与其他水分子之间的作用力是 范德华力和氢键,不是化学键,所以误认 为冰是原子晶体。
5.属于分子晶体的有:干冰、冰、硫磺、 C60、碘、白磷、苯甲酸、稀有气体的晶体 、氧的晶体、氮的晶体; 属于原子晶体的有:金刚石、石英、金刚砂
晶体结构

晶体结构3-1-1 晶体的宏观特征通常人们说的“固体”可分为晶态和非晶态两大类。
晶态物质, 即晶体,是真正意义的固体。
在宏观上,晶体有别于橡胶、玻璃、琥珀、树脂等非晶态的最普遍的本质特征是它的“自范性”,即:晶体能够自发地呈现封闭的规则凸多面体的外形。
非晶态物质则没有自范性1。
单一的晶体多面体叫做单晶。
有时两个体积大致相当的单晶按一定规则生长在一起,叫做双晶;许多单晶以不同取向连在一起,叫做晶簇。
有的晶态物质(例如用于雕塑的大块“汉白玉”),看不到规则外形,是多晶,是许多肉眼看不到的微小晶体的集合体。
有的多晶压成粉末,放到光学显微镜或电子显微镜下观察,仍可看到整齐规则的晶体外形(图3-1)。
a.水晶单晶b。
石膏双晶和晶簇c。
水晶晶簇d。
蛋白质显微照片图3-1 晶体自发呈现规则凸多面体外形举例2配制明矾饱和溶液,在容器中央挂一条线,浸入溶液的线端悬一小块明矾晶体(晶种),尽量保持恒温令溶液慢慢挥发,数天后,你会发现线端的晶种长大了,呈现八面体外形。
你再把得到的明矾晶体放进饱和铬钾矾溶液,不久,会发现呈八面体外形的铬钾矾晶体在明矾晶体上生长。
这个实验不仅说明晶体会自发呈现规则凸多面体外形,还告诉我们,明矾和铬钾矾是类质同晶的——KAl(SO4)2·12H2O和KCr(SO4)2·12H2O组成和结构类同, 有相同的外形。
早在1669年,丹麦科学家斯丹诺(N. Steno)就发现,晶体,例如水晶(SiO2),在自然条件下形成的单晶的形状丰富多样, 然而,借助几何学知识,却可找到相同的晶面(如图3-2中用R、r、m…标记的晶面),而且,确定的晶面之间的二面角——“晶面夹角”是不变的。
这叫做晶面夹角不变定律。
图3-2 自然生长的水晶晶体1固体物质除晶体和称为玻璃态的非晶态外,还有液晶、类晶等介乎晶态与非晶态之间的状态。
液晶和类晶也有某种整齐排列的特性,但在宏观外形和微观结构上却与理想晶体不完全相同。
晶体结构

有效半径:是指离子或原子在晶体结构中处于相接触时的半径。在这 种状态下,离子或原子间的静电吸引或排斥作用达到平衡。 1、离子晶体:在离子晶体中,一对相邻接触的阴、阳离子的中心距,
即为该阴、阳离子的离子半径之和。
2、共价晶体:在共价化合物晶体中,两个相邻键合原子的中心距, 即为这两个原子的共价半径之和。
规则四:在一个含有不同阳离子的晶体中,电价高而配位 数小的阳离子,不趋向于相互共有配位多面体的要素。 规则五(节约规则):即在一个晶体结构中,本质不同的 结构组元的种类,趋向于为数最少。本质不同的结构组 元,是指在性质上有明显差别的结构方式。
举例:
① Mg2[SiO4](镁橄榄石结构)
② 石榴石(Ca3Al2Si3O12)结构分析:
A
C
B
1 6
5
2
A
3
4
C B
A
配位数 12 。 ( 同层 6, 上下层各 3 ) 面心立方紧密堆积的前视图
ABC ABC 形式的堆积,
为什么是面心立方堆积?
我们来加以说明。
C B A
这两种堆积都是最紧密堆积,空间利用率为 74.05%。以面心立方紧密堆积为例:
设圆球的半径为r,在(111)面为密排面,如图所示。所以单位晶胞立方 体的边长 a 2 2r 在面心立方的晶胞中包含有四个这样的圆球,所以:
Z S + CN
+ Z Z - Si ( ) + i CN i i
+
因此,静电价规则写成数学表达式为:
作用:分析离子晶体结构的稳定性,通过计算每个阴离子 所得到的静电键强度的总和,如果与其电价相等,则表 明电价平衡,结构稳定。
举例:① CaF2属于萤石型结构,Ca2+的配位数为8,故CaF键的静电键强度为S=2/8=1/4,每个F-与四个Ca2+形成
十二晶体结构

十二晶体结构
是一种特殊的结晶形态,也被称作十二面体晶胞。
这种结构的
晶胞由十二个六角形构成,看起来非常美丽。
但是除了其美观,
对于材料科学和化学领域来说也是非常重要的。
最早发现的实例是铝石墨烯(Al13C4)的分子团簇。
这种分子
团簇的晶胞由13个铝原子和4个碳原子构成,形状类似于一个球。
这种结构是一种几何立体的体系,具有极高的强度和超弹性。
这
些特性使得其在纳米材料和生物医学领域有着广泛的应用。
除了铝石墨烯,还在其他材料中被广泛应用。
比如氢化物、卤
素化合物和碱金属化合物等。
在这些材料中,的特性主要体现在
其高度对称性和其调节热导率的能力。
这在材料的制造和应用过
程中都有着非常重要的意义。
举例来说,氢化镧(LaH10)和氢化铈(CeH10)这两种化合
物都具有。
这种结构中的La和Ce原子占据了中心位置,而氢原
子则填充在晶胞的角落处。
这种结构的特性使得氢化镧成为了一
种具有潜力的超导材料,并能够用于制造高温超导电缆和超导磁体。
而氢化铈则可以用于制造高强度的磁体,因为能够调节热传导,从而使得其在高温下仍能保持磁场的稳定性。
总的来说,是一种具有非常特殊性质的结晶形态。
除了在材料
科学和化学领域的应用之外,在生物医学领域也有着潜在的应用。
拥有这种结构之后,材料可以具有极高的强度,超弹性和优异的
传热性能。
可以预见,在以后的发展中,将会在各种领域发挥着
更加重要的作用。
固体物理第2课常见晶格结构-

6a y
(326)
晶面间距的计算
低指数的晶面晶面间距较大,高指数的则较小。晶 面间距越大,该面上原子排列愈密集,否则越疏。
注意点:
本节的晶向、晶面及其指数主要针对布喇 菲格子而言。
如以原胞基矢为坐标轴建立坐标系,则晶 向指数和晶面指数的通式一般为[l1 l2 l3]、 (h1 h2 h3)。
cos a b
ab
氯化钠型结构
氯化钠型结构
复式面心立方结构:KCl、LiH、PbS
返回
氯化铯型结构
氯化铯型结构
晶胞和原胞
复式简立方结构:TlBr溴化铊、TlI(碘化钛)、 CuPd(钯铜)、AgMg、AlNi
返回
金钢石结构 1Biblioteka 金刚石 3返回金钢石结构 2
返回
金刚石和闪锌矿结构(1)
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa
U
Np
Pu Am
C m
Bk
Cf
Es Fm Md No
Lr
金刚石结构
闪锌矿结构
闪锌矿结构又称为立方硫化锌
金刚石和闪锌矿结构(2)
复式面心立方结构:两个面心立方的布喇菲晶格沿对 角线平移1/4长度套构而成,但原子价键取向不同。 Si、Ge、GaAs、InP、InSb(用途?)
InSb 探测器阵列 320×240制冷 目前11所和211所已做 出来。
金刚石和闪锌矿结构(2)
晶体管的发明
1947年12月23日 第一个点接触式 NPN Ge晶体管
发明者: W. Schokley J. Bardeen W. Brattain
获得1956年 Nobel物理奖
晶体和非晶体的例子

晶体和非晶体的例子
晶体和非晶体是固体物质中的两种不同类型。
晶体拥有有序的结构和对称性,而非晶体则缺乏这些特征。
下面将介绍一些晶体和非晶体的例子。
晶体:钻石。
钻石是一种矿物,是碳元素的一种纯净形式。
它的晶体结构是立方晶系,具有对称性。
钻石是一种非常坚硬的材料,具有闪闪发光的外观,因此被广泛地用于珠宝和装饰领域。
晶体:盐。
盐是一种晶体固体,其晶体结构是立方晶系。
盐晶体的分子结构非常紧密,因此是一种很稳定的化合物。
盐在生活中被广泛用于烹饪食品、消毒、润滑等领域。
非晶体:玻璃。
玻璃是一种非晶体物质,没有长程的结构和对称性,其分子结构是杂乱无序的。
玻璃可以表现出粘滞性和塑性,而不像晶体一样具有硬度和脆性。
玻璃可以用于制造窗户、饮料瓶、太阳能电池板等。
非晶体:塑料。
塑料是一种由合成材料制成的非晶体物质。
塑料通常是由有机化学物质制成,具有高度的可塑性和耐火性。
塑料被广泛用于制造日用品,如塑料袋、塑料瓶、塑料家具等。
总的来说,晶体和非晶体都是我们周围的常见物质。
它们在不同的应用领域中发挥着重要的作用。
理解晶体和非晶体的结构和性质对我们更好地使用和创新这些材料非常重要。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(GT017,GT018)
hcp的排列方式为AB,AB,…… 密排面垂直于棱柱高c轴。 fcc的排列方式为ABC,ABC,…… 密排面垂直于体对角线。 (GT003,模型) hcp和fcc均为配位数为12的密堆积, 可能给我们什么启示?
8. 纤维锌矿结构(六角硫化锌结构) 两个hcp套构而成。 例如,ZnO, ZnS。 (模型)
§1-3 常见晶体结构举例
1. 面心立方(fcc) ------ Cu (GT002)
致密度η(又称空间利用率):晶体中 原子所占体积与晶体总体积之比。
配位数CN:晶体中一个原子最近邻的 原子数。(注意:不是格点数)
例如:Cu 配位数=12,惯用元胞包含格点数=4 最近邻原子间距=?
2. 体心立方(bcc)----- w
3.金刚石结构 (GT016)
两个fcc子格子沿对角线相对位移1/4体 对角线长度套构而成。 B格子与子格子相同---fcc 惯用元胞包含格点数=4 基元内原子数=2 (同种元素) 惯用元胞包含原子数=2x4=8 配位数=4
4. 闪锌矿结构(立方硫化锌结构)
套构形式与金刚石结构相同,区别是基 元内含2个原子为不同的元素。 B格子是-------惯用元胞包含格点数=? 惯用元胞包含原子数=? 配位数=?
5. 氯化铯(CsCl)结构 Cs+,Cl-离子分别为简立方(SC)子 格子,二子格子体心套构。
B格子=SC 配位数=?
6. NaCl结构 Na+,Cl-分别为fcc子格子,沿立方边位 移a/2套构而成。
(Hale Waihona Puke T016)注意不同晶体结构的Cu.NaCl,金刚石 结构,闪锌矿结构等,它们的B格子 均为fcc。
所以,B格子的种类数大大少于 晶体结构的种类数。
7. 六方密排结构(h c p)-------Mg (模型)
惯用元胞是以正六边形为底的直角棱柱。 晶格常数是正六边形的边长a和柱高c. 密堆积:如果晶体由全同的一种粒子组 成,而粒子被看成是小圆球,这些小圆 球最紧密的堆积状态。此时它有最大的 配位数---12。 有最大配位数12的排列方式称为密堆积。 hcp基元内原子数=2 惯用元胞体积是初基元胞体积的3倍。
