喜树碱合成
羟基喜树碱结构

羟基喜树碱结构一、引言羟基喜树碱是一种重要的天然生物碱,具有广泛的药理活性和医学应用价值。
本文将从羟基喜树碱的结构、合成方法、药理作用以及应用领域等方面进行全面介绍。
二、羟基喜树碱结构1. 分子式和分子量羟基喜树碱的分子式为C20H24N2O2,分子量为324.42。
2. 结构特点羟基喜树碱是一种含有吡啶环和吗啉环的杂环化合物。
其主要结构特点包括:(1)含有两个手性中心,存在四个立体异构体;(2)吡啶环上连接有两个苯乙烯侧链;(3)吗啉环上连接有一个氢原子和一个氧原子。
三、羟基喜树碱合成方法1. 自然来源提取法羟基喜树碱最初是从植物亚洲鹅掌柴中提取得到的。
目前已经发现多种植物中含有羟基喜树碱,如印度马钱科植物等。
2. 化学合成法化学合成法主要包括以下几种:(1)巴克曼重排法:以苯乙烯和吗啉为原料,通过巴克曼重排反应制备羟基喜树碱。
(2)Mannich反应法:以苯乙烯、吗啉和甲醛为原料,在碱催化下进行Mannich反应得到羟基喜树碱。
(3)环氧化合物开环法:以苯乙烯和吗啉为原料,经过环氧化合物开环反应得到羟基喜树碱。
四、羟基喜树碱药理作用1. 抗肿瘤作用羟基喜树碱具有抗肿瘤活性,可以通过多种途径抑制肿瘤细胞的增殖和转移。
2. 抗炎作用羟基喜树碱可以抑制多种炎性因子的产生,具有显著的抗炎作用。
3. 免疫调节作用羟基喜树碱可以调节机体免疫系统的功能,增强机体免疫力。
五、羟基喜树碱应用领域1. 肿瘤治疗领域羟基喜树碱被广泛应用于肿瘤治疗领域,可以单独使用或与其他化疗药物联合使用。
2. 抗炎治疗领域羟基喜树碱可以作为抗炎药物应用于多种炎性疾病的治疗中。
3. 免疫调节治疗领域羟基喜树碱可以作为免疫调节剂应用于多种免疫性疾病的治疗中,如自身免疫性甲亢等。
六、结论羟基喜树碱是一种具有广泛药理活性和医学应用价值的天然生物碱。
其结构特点、合成方法、药理作用以及应用领域等方面均已得到深入探究。
未来,随着科技的不断进步和人们对健康需求的不断提高,羟基喜树碱必将在医学领域发挥更加重要的作用。
7-乙基-10-羟基喜树碱合成

7-乙基-10-羟基喜树碱合成7-乙基-10-羟基喜树碱(7-ethyl-10-hydroxycamptothecin,简称SN-38)是一种重要的抗肿瘤药物。
它是由喜树碱(camptothecin)经过合成反应得到的衍生物。
SN-38的合成方法多种多样,下面将介绍一种常用的合成方法。
合成SN-38的第一步是合成7-乙基-10-氯喜树碱。
喜树碱是一种天然存在的植物生物碱,具有抗癌活性。
合成7-乙基-10-氯喜树碱的方法是将乙酸乙酯和喜树碱经过反应生成7-乙酸乙酯喜树碱,然后再用硼氢化钠将其还原为7-乙基-10-氯喜树碱。
第二步是合成7-乙基-10-羟基喜树碱。
将7-乙基-10-氯喜树碱与氢氧化钠和过氧化氢反应,生成7-乙基-10-羟基喜树碱。
这个反应是一个亲核取代反应,氢氧化钠起到亲核试剂的作用,过氧化氢是氧化剂。
合成SN-38的第三步是将7-乙基-10-羟基喜树碱与醋酸乙酯反应,生成醋酸盐衍生物。
这个反应是酯化反应,醋酸乙酯起到酯化试剂的作用。
最后一步是将醋酸盐衍生物与碘化亚铜反应,生成7-乙基-10-羟基喜树碱。
这个反应是一个亲电取代反应,碘化亚铜起到亲电试剂的作用。
以上就是一种常用的合成SN-38的方法。
通过这个方法,可以高效地合成出SN-38这种抗肿瘤药物。
SN-38具有很强的抗癌活性,对多种肿瘤细胞具有杀伤作用。
它可以通过抑制DNA拓扑异构酶Ⅰ(DNA topoisomerase I)的活性,阻断DNA的复制和转录,从而抑制肿瘤细胞的生长和分裂。
SN-38在临床上已经用于多种癌症的治疗,特别是结直肠癌的治疗。
它可以通过静脉注射或者口服的方式给药。
然而,SN-38也具有一定的毒副作用,如骨髓抑制、胃肠道反应等。
因此,在使用SN-38治疗患者时,需要根据患者的具体情况进行剂量的调整和监测。
7-乙基-10-羟基喜树碱是一种重要的抗肿瘤药物,通过合成方法可以高效地合成出来。
它具有很强的抗癌活性,已经在临床上得到广泛应用。
喜树碱衍生物的合成及其抗肿瘤活性的研究共3篇

喜树碱衍生物的合成及其抗肿瘤活性的研究共3篇喜树碱衍生物的合成及其抗肿瘤活性的研究1喜树碱衍生物的合成及其抗肿瘤活性的研究随着近年来对天然产物的深入研究,许多草本植物中的化合物被证明具有抗肿瘤活性。
在其中,喜树碱被认为是一种具有潜在抗肿瘤活性的天然产物,它由喜树属植物中提取,具有强烈的生物活性和丰富的药理活性成分。
而喜树碱衍生物则是一系列新的合成化合物,具有解决天然产物使用难的问题和进一步拓展喜树碱的生物活性领域的潜力。
元素分析、1H NMR、13C NMR、MS等现代分析方法的应用已成功合成了一系列的喜树碱衍生物。
其中一种化合物,永立康喜树碱(YLLL),是一种新的喜树碱类化合物,具有较高的抗肿瘤活性。
它的临床前药效研究表明,YLLL具有抗肿瘤的多种药理学特征,如细胞增殖的抑制、细胞周期的阻滞和凋亡的诱导等。
实验结果表明,在体外实验中,YLLL可迅速抑制肿瘤细胞的生长和扩张;而在动物实验中,YLLL可降低肿瘤负荷并延长小鼠的生存时间。
这为以后开发抗肿瘤药物提供了极大的帮助。
深入研究表明,YLLL的抗肿瘤机制主要是通过抑制多种蛋白酶而产生作用,如蛋白酶PFKFB3。
通过对亚甲蓝染色的实验发现,YLLL对肿瘤细胞的DNA含量和核形态也产生了改变。
这种机制使其在肿瘤治疗中具有更广阔的应用前景。
总体而言,喜树碱衍生物的合成研究和抗肿瘤活性研究为抗肿瘤药物发展提供了新的方向和活力,同时也充分验证了天然产物的生物活性与药理活性的潜力。
未来,我们将进一步挖掘喜树碱衍生物的潜力,进一步发掘新的药物治疗方式,为人类健康事业作出更大贡献综上所述,喜树碱及其衍生物在抗肿瘤活性领域具有广泛应用前景。
通过现代化学合成与分析方法,以及深入的生物学研究,我们可以不断探索喜树碱在肿瘤治疗方面的潜力。
未来,我们有理由相信,在喜树碱衍生物的基础上,继续研究和创新,将会有更多的突破和发现,为人类健康事业作出更大的贡献喜树碱衍生物的合成及其抗肿瘤活性的研究2喜树碱是一种在自然界中广泛存在的植物生物碱,具有很多的生物活性,其中包括抗肿瘤作用。
喜树碱构效关系-概述说明以及解释

喜树碱构效关系-概述说明以及解释1.引言1.1 概述概述部分的内容可以介绍喜树碱的背景和相关研究的重要性。
可以参考以下内容:喜树碱是一种具有丰富植物化学活性的天然产物,广泛存在于喜树科植物中。
它们以其独特的化学结构和广泛的生物活性受到了科学家们的广泛关注。
喜树碱被发现具有多方面的药理活性,包括抗炎、抗菌、抗氧化、抗肿瘤、抗HIV等。
这些活性使得喜树碱成为了药物研发领域的重要研究对象。
随着现代科学技术的发展,人们对喜树碱的研究也取得了显著的进展。
通过对喜树碱进行结构活性关系研究,可以揭示其生物活性的结构基础,并为药物设计和优化提供理论指导。
喜树碱构效关系的研究对于挖掘更多有潜力的药物候选物、改进现有药物的性能以及阐明喜树科植物的药用价值具有重要意义。
本篇文章将综述喜树碱的构效关系研究,旨在全面地总结和分析已有的研究成果,并对未来的研究方向和可能的应用进行展望。
通过深入研究喜树碱的定义、特性、生物活性以及结构与活性的关系,我们可以更好地理解这一类天然产物的潜力和应用前景,为药物研发和临床治疗提供有力支持。
1.2 文章结构本文将围绕喜树碱的构效关系展开讨论。
文章分为引言、正文和结论三个主要部分。
引言部分将对本文的内容进行概述,首先介绍喜树碱的定义和特性,然后阐述文章结构和目的。
正文部分将详细讨论喜树碱的构效关系。
其中,2.1小节将介绍喜树碱的定义和特性,包括其化学结构、分子量、理化性质等。
2.2小节将探讨喜树碱的生物活性,包括其抗肿瘤、抗炎症等生物活性表现。
2.3小节将重点研究喜树碱的结构与活性关系,探讨不同结构因素对喜树碱生物活性的影响。
结论部分将总结喜树碱构效关系的重要性,并展望未来研究的方向。
3.1小节将对本文中探讨的喜树碱构效关系进行总结,并分析其在药物研发领域中的应用前景。
3.2小节将给出未来研究的展望,指出需要进一步深入研究喜树碱的构效关系,并提出值得关注的研究方向。
最后,3.3小节将进行总结,重申文章的主要观点和结论。
喜树碱天然提取方法

CT超临界CO2提取流程图
上述工艺的优点如下:
(1)提取阶段用超临界二氧化碳萃取法萃取能够节省大量时间传统方法一般需要浸泡几十小时而超临界二氧化碳萃取法萃取只需几小时适用于大规模生产。
(2)传统方法的渗漉过程耗费大量有机污染。
(3)采用超临界二氧化碳萃取法萃取可减少耗时、耗力的溶剂减压浓缩环节。(4)大孔吸附树脂纯化工艺可以大量减少氯仿消耗量简化产品精制环节。
3.超临界二氧化碳萃取法
研究用现代技术提取喜树中的抗癌活性成分探索喜树多种抗癌活性成分的综合提取方法将是今后发展的方向。对喜树有效化学成分的深入了解及其对喜树碱等有效成分的高效提取分离是目前喜树研究的热点在这方面人们进行了大量的研究。其中超临界二氧化碳萃取技术是一种快速、廉价、无毒、无污染、低温、高效的方法。刘展眉等用超临界二氧化碳流体萃取方法及大孔吸附树脂从喜树果中提取喜树碱的同时还得到了亚麻酸、油酸、棕榈酸、亚油酸等脂肪酸组分。亚麻酸、油酸、棕榈酸也被证实具有抗癌作用能明显地延长长肿瘤的小白鼠的寿命。他们将喜树果原料投人萃取槽首先进行棕榈酸和亚油酸的提取从分离釜取出棕榈酸、亚油酸等的混合液后又继续进行喜树碱的提取采用协同萃取可以减少操作环节不但可以减少原料的损失还可以节省大量工作时间大大地提高了工作效率喜树碱得率为0.025%纯度为97.8%脂肪酸收率为1.8%其工艺流程见下图。
喜树碱(Camtothecin下面简写为CT)的天然提取天然提取法提的CT必须为s构型才有活性。但由于含CT的天然植物资源有限、CT含量少且易受季节、产地等因素的影响从而限制了该法的广泛应用。根据近2年的研究成果喜树碱的天然提取法目前较为可取的主要有树脂吸附法、碱法、超临界二氧化碳萃取等方法。
1.树脂吸附法
赵东亮等探讨并确立了用大孔吸附树脂从喜树果中提取、纯化喜树碱的优化工艺:喜树果粉末一70%的乙醇浸泡一浓缩一浓缩液加饱和石灰水搅拌30rain过滤一滤液调H值8~9一上AB一8树脂柱_90%h值2—3的乙醇洗脱一浓缩至悬浊状_乙酸乙酯萃取_浓缩避光结晶-+粗品一乙酸乙酯一石油醚(2:3)溶解重结晶得纯品。所得喜树碱纯度可达98%得率为0.41%o。该法的优势在于:①乙醇提取液浓缩后用饱和石灰水处理可大大提高喜树碱的得率得率可达0.41%o同时也使杂质大为减少;②树脂经H值2~3、90%的乙醇洗脱后用自来水洗掉乙醇可以再利用处理方便简单;③乙酸乙酯:石油醚(2:3)萃取后剩下的不溶物中含有大量的羟基喜树碱而羟基喜树碱的是喜树碱的10倍左右所以可进一步对其进行纯化。
从喜树中提取喜树碱的工艺研究进展

从喜树中提取喜树碱的工艺研究进展[摘要] 近几年来,喜树碱及其衍生物的药理作用已经普遍受到各国医学专家的极度重视,本文简单介绍了喜树碱及其衍生物的基本特性以及药理作用。
总结了当前从喜树中提取喜树碱的几种工艺过程并对比分析了每种工艺的优缺点。
结果表明匀浆提取法是较快速、有效的提取方法。
[关键词] 喜树碱药理作用提取喜树碱及其衍生物具有比较明显的抗癌作用,最近几年在临床上有比较多的应用,而且疗效相对其他的抗癌药物更为明显,因此其提取工艺被各国医学专家不断地进行研究,并进行各种药理作用的临床实验。
结果证明喜树碱及其衍生物具有抗肿瘤,抗癌,免疫抑制,抗病毒,抗早孕,改变皮肤表皮的角化过程等作用;对胃癌、肝癌、膀胱癌及白血病等恶性肿瘤都有显著的疗效,是一种有较高药用价值的植物资源。
因此,不断地探索和改进其提取方法就成为了化学工作者的首要工作。
1.喜树碱的简介喜树碱(Camptothecin)是从珙桐科喜树(Camptotheca acuminata Decne)的木部、果实、根皮、种子和叶子中提取出来的一种生物碱,分子式为C20H16N2O4,分子量348.34,为淡黄色针状晶体,熔点264~267℃;该分子为五环结构,含有一个毗咯喹啉环,一个共轭的吡啶酮环和一个六元α—羟基内酯环[1];喜树碱的化学性质不同于普通的生物碱,其没有明显的碱性,属于中性的喜树碱,与一般的生物碱试剂无反应,避光十分稳定,加热可使喜树碱分解;不溶于水,不溶于一般的有机溶剂,除吡啶、氯仿和甲醇的混合溶液、二甲基亚砜等少数有机溶剂外,不溶于酸,与酸不易成盐,所以不能用常规的方法提取、分离喜树碱。
通过大量的实验证明,喜树碱具有抗肿瘤,抗癌,免疫抑制,抗病毒,抗早孕,改变皮肤表皮的角化过程等作用,目前已经临床应用:用于恶性肿瘤,银屑病,治疣,急慢性白血病以及血吸虫病引起的肝脾肿大等。
喜树碱具有的抗癌活性是1966年美国国立癌症治疗服务中心(CCNSC)Monroe E. Wall博士最初发现[2]。
喜树碱自总结

喜树碱是一种植物抗癌药物,从中国中南、西南分布的喜树中提取得到。1976年中国化学家高怡生等合成消旋喜树碱成功。喜树碱对肠胃道和头颈部癌等有较好的疗效,但对少数病人有尿血的副作用。10-羟基喜树碱的抗癌活性超过喜树碱,对肝癌和头颈部癌也有明显疗效,而且副作用较少。喜树碱是继紫杉醇之后的第二个木本植物来源的抗癌药物。1985年美国学者发现喜树碱是迄今为止唯一的通过抑制拓扑异构酶Ⅰ(topoisomeraseⅠ,TopoⅠ)发挥细胞毒性的天然植物活性成分。TopoⅠ是一种与细胞分裂相关的酶,阻断该酶的产生即可阻止癌细胞的生长。
理化性质:浅黄色针状结晶(甲醇-乙腈),分解点:264℃~267℃,[α]25D +31.3。(氯仿-甲醇)。在紫外光下表现强烈的蓝色荧光,和酸不能生成稳定的盐。
喜树碱难溶于水及一般有机溶剂,微溶于氯仿、乙醇、乙酸、乙酸乙酯,可溶于碱、吡啶、二甲基亚砜、醋酸和三氯甲烷和甲醇的混合液等少数溶剂,在浓硫酸中酸解呈黄绿色溶液。
作用机理: DNA拓扑异构酶I
•Topo I与DNA结合形成可裂解复合物,在DNA磷酸二酯上形成一个单链缺口,让未受损的单链从缺口中回转,使DNA松弛,以利于复制核转录,随后将缺口连接。
•CPT-Topo I-DNA三元复合物的形成,使其可裂解复合物稳定化,导致DNA单链断裂,不能再度连接。
•不同种癌细胞拓扑酶过度表达
构效关系
•内酯环是其抗癌活性的关键部位。其环上的羰基氧与20-OH共同影响其活性。
•ABCD四个环的平面结构有利于其嵌入。
•20-C的S构型对其活性有一定贡献。
•衍生物脂溶性的大小。
•分子内氢键。活化内酯,削弱羟基与酶的相互作用。
图1
衍生物合成思路
临床应用:用于抗病毒,抗早孕,恶性肿瘤,银屑病,治疣,急慢性白血病以及血吸虫病引起的肝脾肿大等。
喜树碱全合成的研究进展1

喜树碱全合成的研究进展喜树碱全合成的研究进展喜树碱是一种植物抗癌药物,最初由美国科学家Wall等人从中国中南、西南分布的喜树中提取得到。
20世纪70年代的研究发现喜树碱对胃癌、结肠癌、慢性粒细胞性血友病等多重恶性肿瘤均有一定疗效,从而引起人们的广泛关注。
通过历来学者的研究,喜树碱的合成方法已经有了很大的突破,但是,喜树碱的天然资源分布极其有限,加上现在大多数合成方法制备为消旋产物异构体才有生物活性,无法适应大批量生产而用于临床。
因此,喜树碱的合成方法很值得探讨。
1966年美国的Monroe E. Wall 首次从喜树茎的提出物中分离出喜树碱(Camptothecine CPT)。
尤其具抗癌活性被证实后, 引起了一些合成化学家的兴趣, 并对其合成进行了研究且近两年日趋活跃. 近几年,喜树碱在合成上面已经取得了很大的进展,但是仍然存在合成路线长、收率低等不足,还有很大改进余地。
课题研究的目的对我来说就是初步了解和掌握喜树碱及其相关衍生物的合成路线,就现阶段关于喜树碱的研究成果进行整合,然后对这些合成路线的优缺点有一定的了解,对每种喜树碱类药物对治疗疾病的效果有初步的认识。
只有这样,才能不断地进行合成路线改进,提高收率,降低成本,从而使喜树碱类的药物更好的发挥作用,因此,喜树碱的合成的改良,对于抗肿瘤药物的研发起到重要作用。
最早报道 CP T 手性合成的是 Corey 等 [ 8 ] 。
尽管该方法产率很低 ,但极有创意 ,通过手性的假酸氯代物 ( 环 E) 与三环二胺 ( 环 A ,B ,C) 反应 ,经中间体 r2醛2t2胺环化形成环 D 。
环 E 中 3 ,42二取代呋喃α2羟酸 ( 6) 的拆分经非对映异构体喹啉盐和内酯中季羟基的保护形成有光学活性的 7 ,光照氧化 ,DM F 中经 SOCl2 处理得 8 ,再经三环胺 ( 9) 缩合即可到到 ( S) 2CP T 。
Ejima 等[ 10 ] 则通过一个新的非对映异构体乙基化反应过程合成( S) 2CP T 。
9_烯丙基_10_羟基喜树碱的合成
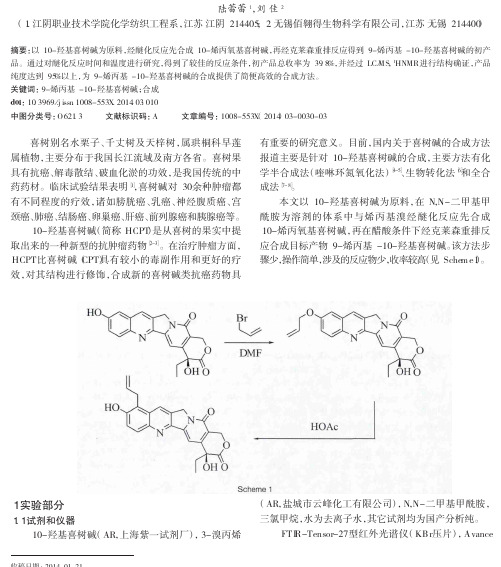
喜树别名水栗子、千丈树及天梓树,属珙桐科早莲属植物,主要分布于我国长江流域及南方各省。
喜树果具有抗癌、解毒散结、破血化淤的功效,是我国传统的中药药材。
临床试验结果表明[1],喜树碱对30余种肿瘤都有不同程度的疗效,诸如膀胱癌、乳癌、神经腹质癌、宫颈癌、肺癌、结肠癌、卵巢癌、肝癌、前列腺癌和胰腺癌等。
10-羟基喜树碱(简称HCPT)是从喜树的果实中提取出来的一种新型的抗肿瘤药物[2-3]。
在治疗肿瘤方面,HCPT比喜树碱(CPT)具有较小的毒副作用和更好的疗效,对其结构进行修饰,合成新的喜树碱类抗癌药物具有重要的研究意义。
目前,国内关于喜树碱的合成方法报道主要是针对10-羟基喜树碱的合成,主要方法有化学半合成法(喹啉环氮氧化法)[4-5]、生物转化法[6]和全合成法[7-8]。
本文以10-羟基喜树碱为原料,在N,N-二甲基甲酰胺为溶剂的体系中与烯丙基溴经醚化反应先合成10-烯丙氧基喜树碱,再在醋酸条件下经克莱森重排反应合成目标产物9-烯丙基-10-羟基喜树碱。
该方法步骤少,操作简单,涉及的反应物少,收率较高(见Scheme1)。
陆蕾蕾1,刘佳2(1.江阴职业技术学院化学纺织工程系,江苏江阴214405;2.无锡佰翱得生物科学有限公司,江苏无锡214400)摘要:以10-羟基喜树碱为原料,经醚化反应先合成10-烯丙氧基喜树碱,再经克莱森重排反应得到9-烯丙基-10-羟基喜树碱的初产品。
通过对醚化反应时间和温度进行研究,得到了较佳的反应条件,初产品总收率为39.8%,并经过LC/MS,1HNMR进行结构确证,产品纯度达到95%以上,为9-烯丙基-10-羟基喜树碱的合成提供了简便高效的合成方法。
关键词:9-烯丙基-10-羟基喜树碱;合成doi:10.3969/j.issn.1008-553X.2014.03.010中图分类号:O621.3文献标识码:A文章编号:1008-553X(2014)03-0030-03Scheme11实验部分1.1试剂和仪器10-羟基喜树碱(AR,上海紫一试剂厂),3-溴丙烯(AR,盐城市云峰化工有限公司),N,N-二甲基甲酰胺,三氯甲烷,水为去离子水,其它试剂均为国产分析纯。
喜树碱的全合成研究进展

最早报道 CP T 手性合成的是 Corey 等[ 8] 。尽管该方法产率很低 , 但极有创意 , 通过手性的假酸 氯代物 ( 环 E) 与三环二胺 ( 环 A, B, C) 反应 , 经中间体 r 醛 t 胺环化形成环 D。环 E 中 3, 4 二取代呋 喃 羟酸 ( 6) 的拆分经非对映异构体喹啉盐和内酯中季羟基的保护形成有光学活性的 7 , 光照氧化, DMF 中经 SOCl2 处理得 8 , 再经三环胺( 9) 缩合即可到到 ( S) CPT 。
[ 1] [ 2] [ 3] [ 4] [ 5] [ 6] [ 7] [ 8] [ 9] [ 10] [ 11] [ 12] [ 13] [ 14] [ 15] [ 16] Wall, M . E. ; Wani, M . C. ; Cook, C. E. , et al. : J. Am. Chem. Soc. , 1966, 88, 3888. Schultz, A. G. : Chem, Rev. , 1973, 73, 385. 上海药物研究所 : 中华医学杂志 , 1975, 55, 274. Hsiang , Y . H. ; Hertzber g, R . ; Hecht, S. , et al. : J. Biol. Chem. , 1985, 260, 14873. K ingsbur y, W . D. ; Bochm, J. C. ; Jakas, D. R . , et al. : J. M ed. Chem. , 1991, 34, 98. Saw ada, S. : Chem. Pham. Bull. , 1991, 39, 1446. Wall, M . E. : J. M ed. Chem. , 1987, 30( 12) , 2317. Cor ey , E. J. ; Crouse, D. N. ; Anderson, J. E. , et al. : J. Or g. Chem. , 1975, 40, 2140. T agawa, H. : JP. App. No. JP 85 296 127. Ejima, A . ; T er asaw a, H. ; Gima, A. , et al. : T etrahedro n L ett. , 1989, 30( 20) , 2639. Comins, D. L. ; Baevsky, M . F . ; Hong, H. , et al. : T etrahedron Lett. , 1993, 34, 801. F ortunak, J. M . D. ; K itter ing ham, J. ; M astrocola, A. R. , et al. : T etrahedron Lett. , 1996, 37( 32) , 5683. F ang, F. G. ; Xie, S. P . ; Lowery , M . W. : J. Org. Cehm. , 1994, 59, 6142. Shar pless, K. B. : Cataly tic Asynmetr ic Sythesis; VCH P ublishers, N Y, 1993. Ciufolini, M . A . : T etrahedron, 1997, 53( 32) , 11049. M urata, N . : Syn. L ett. , 1997, ( 3) , 298.
喜树碱

谢谢观看
Байду номын сангаас
3 喜树碱的合成
O
OH O
O
NH 2
+
CHO
N O O
酸性
N
N
O
O
1975年,Cory等人以呋喃衍生物为原料,经过17步以0.03%的总产率得到了( S ) —Camptothecin 。该步骤产率低,但创新之处在于二元环结构的化合物 4 是 经过光学拆分得到的,并且内酯呋喃化合物4具有光活性,可以在氧气、光照的 作用下发生氧化,接着在氯化亚砜、DMF的作用下形成氯代化合物5,进而合成 了喜树碱7
O
O Na
2.2 10-羟基喜树碱
O N N O
HO
O N N
HOAc,H2/PtO2 Pb(OAc)4,HOAc
O
O
O
喜树碱经氧化可得10-羟基喜树碱,淡黄色结晶性粉末, 不溶于水,溶于稀碱溶液,微溶于乙醇、氯仿等有机溶剂; 微有引湿性,在氯仿8份与甲醇2份的溶液中有右旋性;遇光 易变质。其抗肿瘤活性高于喜树碱
O N N O
O
1.1喜树碱的性质
理化性质: 浅黄色针状结晶(甲醇-乙腈) ,分解点: 264℃~267℃,[α]25D +31.3。(氯仿-甲醇) 。在紫外 光下表现强烈的蓝色荧光,和酸不能生成稳定的盐。 药理作用: 抗肿瘤,免疫抑制,抗病毒,抗早孕, 改变皮肤表皮的角化过程。喜树碱 camptothecin 临床应用: 用于恶性肿瘤,银屑病,治疣,急慢性 白血病以及血吸虫病引起的肝脾肿大等。 抗癌机理:喜树碱的抗癌活性是由于对拓扑异构酶1 的抑制。通过与DNA与与拓扑异构酶1形成的复合物 结合,从而抑制蛋白合成和细胞分化
目录
喜树碱的制备方法

V = IRI OH, 2= R3 OH; R H, = l = i RI OH, 2= R = t f R H, 3 OCH3
喜树碱 的化学 性 质不 同 于普 通 的生物碱 , 其没 有
明显 的碱性 , 于中性 的喜 树碱 。喜树 碱 与一般 的 生 属 物碱 试 剂无 反 应 , 常用 的检 测 试 剂 : 化 铋 钾 和苯 如 碘 酚试 剂 , 阴性 ; 哚 分 析 , 反 应 ; 呈 吲 负 与各 种 酸 不形 成
般 认 为果 实 中喜 树 碱 的含 量 最 高 , 次 为 根皮 、 其 树根
和树皮 , 而树 枝 含 量较 低 。近 年来 的研 究结 果 表 明组 织 越幼 嫩 , 树 碱 的含 量 越 高 ; ( ) 喜 枝 叶 龄越小 , 含量越 高 :皮质 较 木 质 含 量 高 。 嫩 叶 中喜树 碱 的含 量 高达 0 %, 种子 中含 量 的 1 . 是 4 . 。 由于喜 树 植 株有 简单 5倍 易 得 、 树 碱 含 量 高等 优 点 , 喜 因此 是 目前 获 得 喜 树碱
从植 株 中提 取 喜 树 碱 研 究 最 早 ,条 件 也 比较成 熟。
16 9 6年 美 国 的 Mo reEWa 等 首 次从 喜 树 茎 no . l l
的提 取物 中分 离 出喜 树 碱 , 们 首先 将植 物 原料 通过 他
热 庚 烷 去 除无 效 成 分 , 乙醇 提 取 、 缩 、 经 氯仿 一 浓 后 乙
V RI H , 2= = R OH , = ; R3 H
是 目前最 有效 、 速 的办 法 , 其 生 产 受 到 喜树 生 长 迅 但 发 育和环境 因素 的影 响 , 量 开采 还会 造 成 资源 匮乏 过 和生态学 问题 , 是 限制 喜 树碱 生 产 的主 要 因素 。合 这
喜树碱的全合成研究进展

2020年12月Dec. 2020第6期Issue 6江西科技师范大学学报Journal of Jiangxi Science & Technology Normal University喜树碱的全合成研究进展王建新桂琳琳2,王晓季"卢,胡 冲2卢(1.江西科技师范大学药学院,江西 南昌330013;2.江西科技师范大学生命科学学院,江西 南昌330013;3.东莞理工学院化学工程与能源技术学院,广东东莞523830)摘要:自喜树碱被提取分离并发现其具有良好的抗肿瘤活性后,喜树碱的全合成研究引起了广泛关注0而近十 年来,喜树碱的全合成研究又有了突破性的进展0本文总结了近十年来关于喜树碱的合成路线和方法,为后续喜树碱及其衍生物的结构修饰和新药研发提供借鉴"关键词:喜树碱;抗肿瘤;全合成中图分类号:0625.6文献标识码:A 文章编号:2096-854X (2020)06-0104-05Progress in Total Synthesis of CamptothecinWang Jianxin 1, Gui Linlin 2, Wang Xiaoji 2,3,L , Hu Chong 2卢$ 1 .School of Pharmacy, Jiangxi Science & Technology Normal University, Nanchang 330013,Jiangxi, P.R. China; 2.School of Life Science, Jiangxi Science & Technology Normal University,Nanchang 330013, Jiangxi, P.R. China; 3.College of Chemical Engineering and Engergy Technology,Dongguan University of Technology, Dongguan 523830, Guangdong, P.R. China )Abstract : Since the extraction of camptothecin and the discovery of its anti-tumor activity, the total synthesis ofcamptothecin has attracted extensive attention by researchers. In the past decade, it has witnessed significant advances in the total synthesis of camptothecin. Herein, we summarize various synthetic routes and methods for synthesizingcamptothecin during the past decade, which is expected to provide a significant reference for the following research onstructural modification of camptothecin and its derivatives, as well as the development research of new drugs.Key words : Camptothecin; anti-tumor; total synthesis—、前言喜树是我国特有的一种高大落叶乔木,广泛分 布于长江流域及南方各省区。
7-乙基-10-羟基喜树碱合成

7-乙基-10-羟基喜树碱合成7-乙基-10-羟基喜树碱(7-ethyl-10-hydroxycamptothecin),也被称为7-乙基喜树碱(7-ethylcamptothecin),是一种具有抗癌活性的天然产物。
它是来自于喜树科植物喜树(Camptotheca acuminata)的根皮中提取得到的。
7-乙基-10-羟基喜树碱是一种重要的抗癌药物,具有广泛的应用前景。
合成7-乙基-10-羟基喜树碱的方法有多种,其中一种常用的方法是通过合成喜树碱的衍生物,再进行化学修饰得到目标产物。
以下是一种常用的合成方法的简要描述:以喜树碱为出发物,通过酸碱萃取等方法从喜树的根皮中提取得到。
然后,通过化学反应将喜树碱转化为7-乙基-10-羟基喜树碱。
将喜树碱与乙酰氯反应,得到7-乙酰氧基喜树碱。
然后,通过氧化反应将7-乙酰氧基喜树碱氧化为7-羟基喜树碱。
接下来,将7-羟基喜树碱与乙基溴化物反应,得到7-乙基-10-羟基喜树碱。
这个合成过程中的关键步骤是氧化反应和取代反应。
氧化反应可以使用氧化剂如过氧化氢或过氧化苯甲酰来进行。
取代反应可以使用亲核试剂如乙基溴化物来实现。
合成7-乙基-10-羟基喜树碱的方法还有其他的变种,如通过合成喜树碱的前体化合物,再进行化学修饰得到目标产物。
这些方法在反应条件、反应物选择等方面可能有所差异,但基本的反应原理是相似的。
总结起来,合成7-乙基-10-羟基喜树碱的方法主要包括喜树碱的提取和化学修饰两个步骤。
合成的关键步骤是氧化反应和取代反应。
这种合成方法为制备7-乙基-10-羟基喜树碱提供了一种有效的途径,有助于满足临床上的需求,并促进相关药物的研究和开发。
7-乙基-10-羟基喜树碱是一种具有抗癌活性的天然产物,合成方法包括喜树碱的提取和化学修饰两个步骤。
通过合成喜树碱的衍生物,再进行化学修饰可以得到目标产物。
这种合成方法为制备7-乙基-10-羟基喜树碱提供了一种有效的途径,有助于满足临床上的需求,并促进相关药物的研究和开发。
喜树碱合成

1975年,Cory等人以呋喃衍生物为原料,经过17步以0.03%的总产率得到了(S)—Camptothecin。
该步骤产率低,但创新之处在于二元环结构的化合物4是经过光学拆分得到的,并且内酯呋喃化合物4具有光活性,可以在氧气、光照的作用下发生氧化,接着在氯化亚砜、DMF的作用下形成氯代化合物5,进而合成了喜树碱7。
Corey E J, Crouse D N, Anderson J E. A total synthesis of natural 20 (S)-camptothecin [J]. J. Org. Chem, 1975, 40:2140~2141.2001年,Comins小组[3]以吡啶衍生物8为原料,经过6步完成了喜树碱的不对称全合成。
该路线比较短,但其中的某些关键步骤产率不高。
[3]Comins D L, Nolan J M. A Practical Six-Step Synthesis of (S)-Camptothecin [J]. Org. Lett,2001, 3: 4255~4257.Comins等人以2-氯-6-乙氧甲氧基吡啶为原料合成7位或9位CPT衍生物[8]研究表明, 喜树碱7 位、9 位取代基团对其活性、水溶性和脂溶性有重要影响。
在7 - 位引入小分子烷基可以提高它的活性,其中以乙基最好。
在9 - 氨基喜树碱葡萄糖酸苷( 9 -ACG) 是新合成的一种水溶性衍生物。
它与CPT 相比,9-ACG 水溶性更好,通常多数CPT 药物包括9 -AC 都能被人体内的人血清白蛋白作用而导致内酯环活性降低, 药效持续时间变短。
但是, 9 -ACG 可以改变与体内的血清白蛋白的作用方式而达到稳定内酯环, 提高抗癌活性的效果。
Comins DL,Nol an JM. A pr ac t i ca lsix-step synthesis of (S)-camptothecin [J].Org Lett,2001,3(26):4255~4257.Bennasar等人用对吡啶季铵盐的对位进行芳香亲核,引入所需的手性中心后,再经过脱氢,还原酯基,氧化等步骤得到CPT[9]将其制成前药, 以期降低母体化合物毒副作用, 改善其药物动力学特征, 提高溶解性、肿瘤作用靶向性和E 内酯环的稳定性, 可扩大临床应用范围。
喜树碱全合成方法的研究进展
过 6步 完 成 了喜 树 碱 的 不 对 称 全 合 成 。该 路 线 比较 短 ,
但 其 中 的某 些 关 键 步 骤 产 率 不 高 。 2 0 0 1年 , Ya b u小 组 I 4 使用 化 合物 1 4作 为 手 性 配
2 1 的产率得 到硝 酮 2 1 , 接 着 与 消 旋 的 邻 羟 基 酰 胺 发
2 0 0 4年 , Yu小 组 _ 6 从 季酮酸 2 O出 发 , 经 过 三 步 以
亚砜 、 D MF的作 用 下形 成 氯 代 化 合 物 5 , 进 而 合 成 了 喜 树碱 7 。
2 0 0 1年 , C o mi n s小 组 以 吡 啶衍 生 物 8为 原 料 , 经
捕要 : 指 出 了喜 树 碱 与 1 O 一羟 基 喜 树 碱 是 一 类 具 有 抗 癌 作 用 的 生 物碱 , 此 类 生物 碱 的 不 对 称 全 合 成 方 法 成 为 国 内 外研 究 热 点 。概 述 了近 几 年 有 关 喜 树 碱 与 1 O 一羟基喜树碱 提 纯与不对 称全合成 的方 法, 旨在 为 有
2 0 1 3 年1 2 月
J o u r n a 1 Байду номын сангаас o f Gr e e n S c i e n c e a n d T e c h n o l o g y
缘 色科 技
第 1 2期
喜树碱全合成方法 的研究进展
阮 树堂
( 江西 环境 工程 职业 学院 , 江西 赣州 3 4 1 0 0 0 )
Kn o e v e n a g e l c o n d e n s a t i o n反 应 得 到 三 元 环 片 段 2 4 , 后
体, 诱 导 合 成 了喜 树 碱 的关 键 环 结 构 1 5 。 作 者 首 先 筛 选 了不 同 金 属 与 上 述 配 体 组 成 混 合 物 的催 化 效 果 , 确 定 了最 终 的镧 系 金 属 S m 作为 L e w i s 酸 与配体 1 4 a 组成混合催化剂 , 从 哌 啶酮 衍 生 物 1 6出发 ,
7-乙基-10-羟基喜树碱的合成

7-乙基-10-羟基喜树碱的合成7-乙基-10-羟基喜树碱是一种具有潜在药物活性的天然产物。
它可以从天然产物喜树碱通过化学合成得到。
在本文中,将详细介绍7-乙基-10-羟基喜树碱的合成方法。
喜树碱(vincamine)是从喜树(Vinca minor)中提取得到的一种主要成分。
它具有抗缺血、抗肿瘤、抗骨质疏松等药理活性。
然而,喜树碱存在一些不足之处,如溶解度低、生物利用度差等。
为了改善这些不足,研究人员开始合成衍生的喜树碱化合物。
在此文中,将详细介绍7-乙基-10-羟基喜树碱的合成方法。
首先,合成7-乙基-10-羟基喜树碱的关键步骤是在喜树碱的7位引入乙基基团和在10位引入羟基。
引入乙基基团的方法可以采用烷基化反应。
通常使用碘代烷烃和碱作为反应物,在碱催化下发生亲核取代反应,将乙基引入到喜树碱的7位。
引入羟基的方法可以采用羟基化反应。
通常使用醇和酸催化剂作为反应物,在酸催化下发生亲核加成反应,将羟基引入到喜树碱的10位。
实际合成中,可以将上述两个步骤结合起来进行。
首先,在碱的存在下,将乙醇和碘代烷烃加入到喜树碱的反应体系中,发生亲核取代反应,将乙基引入到喜树碱的7位。
然后,将醇和酸催化剂加入到反应体系中,发生亲核加成反应,将羟基引入到喜树碱的10位。
在实际操作中,需要控制反应条件,以确保产率和纯度。
反应温度、反应时间、催化剂、反应物比例等因素都会对反应结果产生影响。
此外,还需要对合成产物进行合适的结构表征和分析,以确保合成产物的结构符合预期。
总之,7-乙基-10-羟基喜树碱是通过在喜树碱的7位引入乙基基团和在10位引入羟基来合成的。
这个合成方法结合了烷基化反应和羟基化反应,需要合适的反应条件和结构表征方法来实现。
通过这种合成方法,可以获得7-乙基-10-羟基喜树碱,从而拓宽了喜树碱的结构多样性和药物活性。
植物喜树碱生物合成代谢途径研究

植物喜树碱生物合成代谢途径研究植物喜树碱是一类广泛存在于植物中的次生代谢产物,其结构多样,具有重要的生理活性和药用价值。
近年来,随着对植物喜树碱生物合成代谢途径的研究不断深入,人们对于它的生理作用和开发利用的认识也日益加深。
一、喜树碱的概述喜树碱是一类氮杂环化合物,结构复杂,存在于广泛的植物中,如番茄、菠菜、柑橘等。
喜树碱具有广泛的生理活性和药用价值,如兴奋中枢神经、抗氧化、抗肿瘤、抗菌、抗病毒等作用。
对于喜树碱的生物合成代谢途径的深入研究,不仅可以揭示植物次生代谢调控原理,还可能为开发新型抗癌药物、农药、食品保鲜剂等提供理论依据和技术支持。
二、喜树碱的生物合成代谢途径喜树碱的生物合成代谢途径至今仍存在争议,但大致可以分为两种:甲基丙酮酸通路和型上式色氨酸途径。
其中,型上式色氨酸途径被认为是主要的喜树碱生物合成途径。
型上式色氨酸途径中,色氨酸在脱氨酶的催化下转化为吲哚丙酮酸,随后与丙酮酸经过包括四氢喜树碱•甲醇、美洲链霉菌素E、菌酸、理光碱、帕卢碱、紫锥菊碱等关键酶催化的一系列反应,合成最终产品。
其中,四氢喜树碱•甲醇催化吲哚丙酮酸与丙酮酸的首要缩合反应,其次是美洲链霉菌素E催化的两个羟基化步骤,以及最后的环醇化反应。
不同种类的植物中,喜树碱的结构和含量都存在差别,这与不同植物细胞内喜树碱代谢酶的多样性和特异性有关。
三、喜树碱生物合成途径的研究进展近年来,关于喜树碱生物合成途径的研究不断深入,涉及的领域越来越广泛,如遗传、生化、分子进化、生理学等。
其中,最新的研究成果得出,植物中可能存在多条喜树碱生物合成途径,具体途径的选择受到不同的生态环境、生长发育状态、个体差异等因素的影响。
同时,研究人员正在努力探索喜树碱生物合成调控机制、分子交互作用、多样性演化等问题。
四、喜树碱的开发利用喜树碱具有多种生理活性和药用价值,因此,开发利用其代谢途径也广泛的应用于农业和医学领域。
如在农业领域,喜树碱可以作为天然的重要农药成分,防治植物病虫害。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1975年,Cory等人以呋喃衍生物为原料,经过17步以0.03%的总产率得到了(S)—Camptothecin。
该步骤产率低,但创新之处在于二元环结构的化合物4是经过光学拆分得到的,并且内酯呋喃化合物4具有光活性,可以在氧气、光照的作用下发生氧化,接着在氯化亚砜、DMF的作用下形成氯代化合物5,进而合成了喜树碱7。
Corey E J, Crouse D N, Anderson J E. A total synthesis of natural 20 (S)-camptothecin [J]. J. Org. Chem, 1975, 40:2140~2141.
2001年,Comins小组[3]以吡啶衍生物8为原料,经过6步完成了喜树碱的不对称全合成。
该路线比较短,但其中的某些关键步骤产率不高。
[3]Comins D L, Nolan J M. A Practical Six-Step Synthesis of (S)-Camptothecin [J]. Org. Lett,2001, 3: 4255~4257.
Comins等人以2-氯-6-乙氧甲氧基吡啶为原料合成7位或9位CPT衍生物[8]
研究表明, 喜树碱7 位、9 位取代基团对其活性、水溶性和脂溶性有重要影响。
在7 - 位引入小分子烷基可以提高它的活性,其中以乙基最好。
在9 - 氨基喜树碱葡萄糖酸苷( 9 -ACG) 是新合成的一种水溶性衍生物。
它与CPT 相比,9-ACG 水溶性更好,通常多数CPT 药物包括9 -AC 都能被人体内的人血清白蛋白作用而导致内酯环活性降低, 药效持续时间变短。
但是, 9 -ACG 可以改变与体内的血清白蛋白的作用方式而达到稳定内酯环, 提高抗癌活性的效
果。
Comins DL,Nol an JM. A pr ac t i ca lsix-step synthesis of (S)-camptothecin [J].Org Lett,2001,3(26):4255~4257.
Bennasar等人用对吡啶季铵盐的对位进行芳香亲核,引入所需的手性中心后,再经过脱氢,还原酯基,氧化等步骤得到CPT[9]将其制成前药, 以期降低母体化合物毒副作用, 改善其药物动力学特征, 提高溶解性、肿瘤作用靶向性和E 内酯环的稳定性, 可扩大临床应用范围。
Bennasar ML,Zulaica E,Juan C,et al.Addition of ester enolates to N-alkyl-2-fluoropyridinium salts:total synthesisof (±) - 20- de oxy c ampto the c i n a nd(+)-camptothecin[J]. Org Chem,2002,67(21):7465~7474.
2004年,Yu小组[6]从季酮酸20出发,经过三步以21%的产率得到硝酮21,接着与消旋的邻羟基酰胺发生[3+2]环加成反应以60%的产率得到一对非对映异构体22和23,比例是1∶1。
不用纯化,在锌试剂的作用下选择性地切断N-O键,接着Swern氧化、分子间的 Knoevenagel condensation反应得到三元环片段24,后者再经过溴化、还原、缩酮水解得到关键中间体——三元环酮25,进而完成喜树碱的全合成。
[6]Yu J, DePue J, Kronenthal D. Synthesis of (±)-camptothecin using
a [3+2] nitrone cycloaddition to construct the CDE ring moiety [J]. Tetrahedron Lett,2004, 45:7247~7250.
Subhash P. Chavan和Rasapalli Sivappa以2-碘代-3-甲酰基喹啉为原料经8步
反应得到CPT[6]研究表明在喜树碱20 位引入羟基、烷氧基、胺基等, 既可以改善水溶性或
脂溶性, 也可以控制在体内的释放, 从而提高抗癌性能。
Subhash P.Chavan,Rasapalli Sivappa.A synthesis of camptothecin[J]. Tetrahedron Letters.2004,45:3113~3115.
Subhash P. Chavan和Ashok B. Pathak等人以酮酯12为原料经10步反应得到CPT[7]研究表明它的半衰性明显增加通过与Me t h A 癌组织中不同的酶作用, 分解出甘氨酸共轭化合物, 目前该项研究进行1 期临床试验。
Subhash P.Chavan,Ashok B.Pathak,Uttam R.Kalkote. A practical formal synthesis of camptothecin[J ]. Tet rahedron Letter s.2007,48:6561~6563.
\
生物合成途径如图1TSB: 色氨酸合酶B亚单位; TDC: 色氨酸脱羧酶;DXS: 脱氧木酮糖252磷酸合酶;DXR: 脱氧木酮糖252磷酸氧化还原酶;M ECS: 22C2甲基2D 2赤藓糖22, 42环焦磷酸合酶; G10H: 香叶醇2102羟化酶; SCS: 裂环马钱子苷合酶; SSS: 直夹竹桃啶合酶; 102HGO: 102羟基香叶醇氧化还原酶
V愈伤组织培养: 在植物次生代谢产物生产中, 利用细胞悬浮培养技术生产次生代谢产物是一种有效的途径, 目前已有利用植物细胞培养的方法生产喜树碱的报道。
Sakato、M is2ava、V an Hengel、W iedenfied 以及张冬艳等[9 ]已经对喜树愈伤组织报道作过大量的研究, 但是由于喜树碱的量太低而无法用于生产。
刘文哲[25 ]以含喜树碱最高的幼叶为外植体, 进行了愈伤组织的诱导和培养, 通过优良细胞系的筛选, 使愈伤组织中喜树碱的量提高到0. 02% , 达到了原植物的33. 3%到50%。
Helmut 等[26 ]则首次报道了在喜树苗和愈伤组织中含有102羟基喜树碱。
毛状根培养: 由于生物碱的生物合成和积累受到细胞发育和环境因子的严格调控[27 ] , 建立适合生物合成和积累的细胞类型是离体生产喜树碱所必需的。
利用毛状根培养技术生产植物次生代谢产物是一种非常有效的方法, 因为毛状根具有非常强大的次生代谢产物积累能力。
毛状根培养是利用发根农杆菌A g robacterium rh iz og enes 将R i 质粒的T 2DNA 转入植物组织中, 使得植物体不需要生长激素诱导, 就能产生根,可避免植物体长期培养于生长激素中, 导致生物碱合成能力下降。
毛状根培养可避免植物来源短缺及环境限制, 利用发根农杆菌转化产喜树碱的植物, 建立毛状根培养生产喜树碱及其衍生物, 是缓解喜树碱原料不足的有效途径。
目前, 产喜树碱的短小蛇根草和喜树的毛状根培养系统都已经建立。
