2020届二轮复习 元素周期表 元素周期律 专题卷(全国通用) (1)
2020届人教版高考化学第二轮复习专题5《物质结构 元素周期律》测试卷

绝密★启用前2020届人教版高考化学第二轮复习专题5《物质结构元素周期律》测试卷本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分分卷I一、单选题(共10小题,每小题2.0分,共20分)1.下列根据元素周期表和元素周期律得出的推断中正确的是()A.金属元素原子最外层电子数越少,该金属失电子能力越强B.若存在简单阴离子R2-,则R一定位于ⅥA族C.a A2+、b B+、c C3-三种离子具有相同的电子层结构,则原子序数c>a>bD.铅位于周期表中金属和非金属的交界处,可作半导体材料2.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
下列说法正确的是()A.常温常压下X的单质为气态B. Z的氢化物为离子化合物C. Y和Z形成的化合物的水溶液呈碱性D. W与Y具有相同的最高化合价3.下列说法中正确的是()A.34S原子核内的中子数为16B.1H和2H的化学性质基本相同C. H O与H O互为同素异形体D. Na和Na+属于同种元素,且性质相同4.下列关于分类的说法正确的是()A.活性炭,C60,金刚砂都是碳的同素异形体B. Fe2O3、Na2O2、K2O都是碱性氧化物C.淀粉、蛋白质、油脂都属于有机高分子化合物D.纯碱、氯化铵、明矾都是盐且都属于强电解质5.若新发现的118号元素的某种原子记作X,则有关该核素说法正确的是()A.质子数为118,电子数为179,中子数为179B.原子序数为179,质量数为297C.与C的相对原子质量之比为118∶6D.X经过一次α衰变得到的116号元素原子可表示为Y6.已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是()A.若为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)B.若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱C.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸D.若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应7.几种短周期元素的原子半径及主要化合价如下表,下列叙述正确的是( )A. X,Y元素的金属性X<YB.一定条件下,Z单质与W的常见单质直接生成ZW2C. Y的最高价氧化物对应的水化物能溶于稀氨水D.一定条件下,W单质可以将Z单质从其氢化物中置换出来8.现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。
2020届高三化学二轮冲刺新题专练——元素周期表、周期律的考查(含解析)

2020届高三化学二轮冲刺新题专练——元素周期表、周期律的考查(含解析)1.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A,B,C,D,E为上述四种元素中的两种或三种所组成的化合物。
已知A的相对分子质量为28,B分子中含有18个电子,五种化合物间的转化关系如图所示。
下列说法错误的是A. X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低B. Y的最高价氧化物的水化物为弱酸C. Y、Z组成的分子可能为非极性分子D. W是所在周期中原子半径最小的元素2.短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为下列关系正确的是A. 氢化物沸点:B. 氧化物对应水化物的酸性:C. 化合物熔点:D. 简单离子的半径:3.2019年是元素周期表诞生的第150周年,联合国大会宣布2019年是“国际化学元素周期表年”。
W、X、Y和Z为原子序数依次增大的四种短周期主族元素。
W的一种核素可用于文物年代的测定,X与W同周期相邻,四种元素中只有Y为金属元素,Z的单质为黄绿色气体。
下列叙述正确的是A. W的氢化物中只存在极性共价键B. Z的氧化物对应的水化物均为强酸C. X与Y组成的化合物可发生水解反应D. Y与Z组成的化合物熔融电解一定得金属单质4.非整比化合物是各种原子的相对数目不能用简单整数比表示的化合物,能呈现特殊的颜色,有不同的化学反应活性,有金属性或半导体性,还有特殊的光学性质。
下面关于非整比化合物的说法不正确的是A. 将ZnO晶体放在锌蒸气中加热,制成红色氧化锌,导电性会增强B. 在中煅烧制得,用作光照条件下水分解的催化剂C. 氙气会进入液态水的笼形分子团中,形成,增大氙气的溶解量D. 层状石墨间隙吸附制成的可做锂离子电池正极材料5.短周期元素A,B,C,D,E的原子序数依次增大,A的一种核素在考古时常用来鉴定一些文物的年代,B的一种氢化物的水溶液呈碱性;C,D为金属元素,且D 原子最外层电子数等于其K层电子数;若往E单质的水溶液中滴加少量紫色石蕊试液,可观察到溶液先变红后褪色。
2020-2021高考化学二轮 元素周期律 专项培优含详细答案

2020-2021高考化学二轮元素周期律专项培优含详细答案一、元素周期律练习题(含详细答案解析)1.元素周期表是打开物质世界奧秘之门的一把金钥匙,1869年,门捷列夫发现了元素周期律并发表了元素周期表。
下图为元素周期表的一部分,回答下列问题。
(1).上述元素中化学性质最稳定的是________(填元素符号,下同) ,非金属性最强的是_____。
(2)c的最高价氧化物对应水化物的化学式为__________。
(3)h元素的原子结构示意图为__________,写出h单质的一种用途:__________。
(4)b、d、f三种元素原子半径由大到小的顺序是__________(用元素符号表示)。
(5)a、g、j的氢氧化物中碱性最强的是__________(填化学式),写出其溶液与g的氧化物反应的离子方程式:___________________________________。
【答案】Ar F HNO3制光电池 Mg>C>O KOH Al2O3 +2OH-=2AlO2- +H2O【解析】【分析】由元素周期表可知,a为Li、b为C、c为N、d为O、e为F、f为Mg、g为Al、h为Si、i 为Ar、j为K。
【详解】(1)0族元素的化学性质最稳定,故上述元素中化学性质最稳定的是Ar;F元素的非金属性最强;(2)c为N,其最高价氧化物对应的水化物为HNO3;(3)h为Si,核电荷数为14,原子的核外电子数也是14,Si的原子结构示意图为;Si单质的一种用途是可以制光电池;(4)b为C、d为O、f为Mg,当电子层数相同时,核电荷数越大原子半径越小;电子层数越多原子半径越大,故b、d、f三种元素原子半径由大到小的顺序是Mg>C>O;(5)a为Li、g为Al、j为K,K的金属性最强,金属性越强,最高价氧化物对应的水化物的碱性越强,故a、g、j的氢氧化物中碱性最强的是KOH;g的氧化物为Al2O3,Al2O3与KOH溶液反应的离子方程式为Al2O3 +2OH-=2AlO2- +H2O 。
高考化学二轮复习讲练测(新高考专用)专题07元素周期律与元素周期表(测)原卷版+解析

专题七能力提升检测卷(本卷共19小题,满分100分,考试用时75分钟)可能用到的相对原子质量:H 1 Li 7 B 11 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5第I卷(选择题共100分)一、选择题:本题共10个小题,每小题4分,共40分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学用语是学习化学知识的基本工具。
下列化学用语表示正确的是H O的电子式:A.22SB.含17个中子的硫元素的原子符号:3316CH CHC.乙烯的结构式:22D.甲烷的比例模型:2.运用元素周期律分析下面的推断,其中正确的是A.HF、HCl、HBr、HI的热稳定性依次减弱,酸性依次减弱Li OB.锂(Li)在氧气中剧烈燃烧,产物是22SrSO)是难溶于水的白色固体C.硫酸锶(4D.氯单质与水的反应比氟单质与水的反应更剧烈3.今年是门捷列夫发现元素周期律150周年。
下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。
下列说法错误的是()A.原子半径:W<XB.常温常压下,Y单质为固态C.气态氢化物热稳定性:Z<WD.X的最高价氧化物的水化物是强碱4.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Z最外层电子数之和为10;W 与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
下列说法正确的是(B)A.常温常压下X的单质为气态B.Z的氢化物为离子化合物C.Y和Z形成的化合物的水溶液呈碱性D.W与Y具有相同的最高化合价5.现有部分元素的原子结构特点如表,下列叙述中正确的是()X L层电子数是K层电子数的3倍Y核外电子层数等于原子序数Z L层电子数是K层和M层电子数之和W共用三对电子形成双原子分子,常温下为气体单质A.W原子结构示意图为B.元素X和Y只能形成原子个数比为12的化合物C.元素X比元素Z的非金属性强D.X、Y、Z、W四种元素不能形成离子化合物6.用N A表示阿伏加德罗常数的值,35Cl和37Cl是Cl元素的两种核素,下列说法正确的是()A.71 g 35Cl2和71 g 37Cl2均含2N A个Cl原子B.35Cl和37Cl间的相互转化是化学变化C.35Cl和37Cl核外电子排布方式相同D.35Cl2、H2形成的燃料电池,35Cl2在负极放电7.下列说法正确的是()A.IUPAC公布了118号元素Og,其中核素297118Og中中子数与质子数之差为179B.18 g H2O与20 g D2O中质子数与中子数均为10N AC.a g A Z X2-中核外电子数为aA(Z+2)N AD.金刚石与石墨互为同位素8.全氮类物质具有高密度、超高能量及爆轰、产物无污染等优点。
元素周期律与元素周期表(高三化学二轮专题复习)
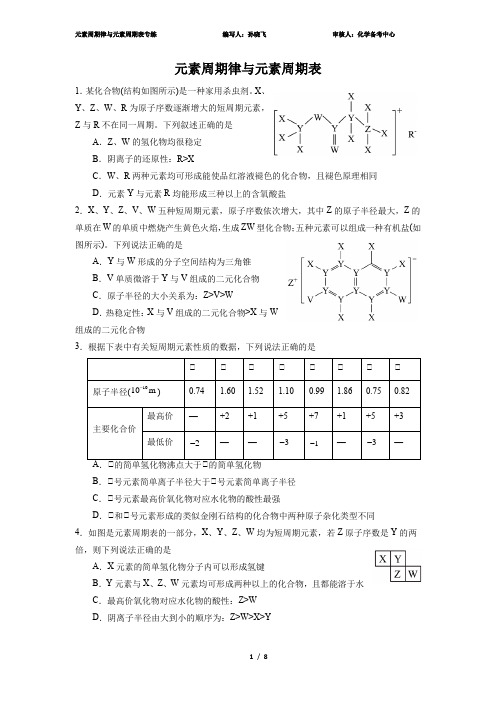
元素周期律与元素周期表1.某化合物(结构如图所示)是一种家用杀虫剂。
X 、Y 、Z 、W 、R 为原子序数逐渐增大的短周期元素,Z 与R 不在同一周期。
下列叙述正确的是A .Z 、W 的氢化物均很稳定B .阴离子的还原性:R>XC .W 、R 两种元素均可形成能使品红溶液褪色的化合物,且褪色原理相同D .元素Y 与元素R 均能形成三种以上的含氧酸盐2.X 、Y 、Z 、V 、W 五种短周期元素,原子序数依次增大,其中Z 的原子半径最大,Z 的单质在W 的单质中燃烧产生黄色火焰,生成ZW 型化合物;五种元素可以组成一种有机盐(如图所示)。
下列说法正确的是A .Y 与W 形成的分子空间结构为三角锥B .V 单质微溶于Y 与V 组成的二元化合物C .原子半径的大小关系为:Z>V>WD .热稳定性:X 与V 组成的二元化合物>X 与W 组成的二元化合物3.根据下表中有关短周期元素性质的数据,下列说法正确的是 ① ① ① ① ① ① ① ① 原子半径(1010m -) 0.74 1.601.52 1.10 0.99 1.86 0.75 0.82 主要化合价 最高价 — +2+1 +5 +7 +1 +5 +3 最低价 2- — — 3- 1- — 3-— A .①的简单氢化物沸点大于①的简单氢化物B .①号元素简单离子半径大于①号元素简单离子半径C .①号元素最高价氧化物对应水化物的酸性最强D .①和①号元素形成的类似金刚石结构的化合物中两种原子杂化类型不同4.如图是元素周期表的一部分,X 、Y 、Z 、W 均为短周期元素,若Z 原子序数是Y 的两倍,则下列说法正确的是A .X 元素的简单氢化物分子内可以形成氢键B .Y 元素与X 、Z 、W 元素均可形成两种以上的化合物,且都能溶于水C .最高价氧化物对应水化物的酸性:Z>WD .阴离子半径由大到小的顺序为:Z>W>X>Y5.R、X、Y、Z为原子序数依次增大的前20号元素。
2020-2021高考化学二轮 元素周期律 专项培优
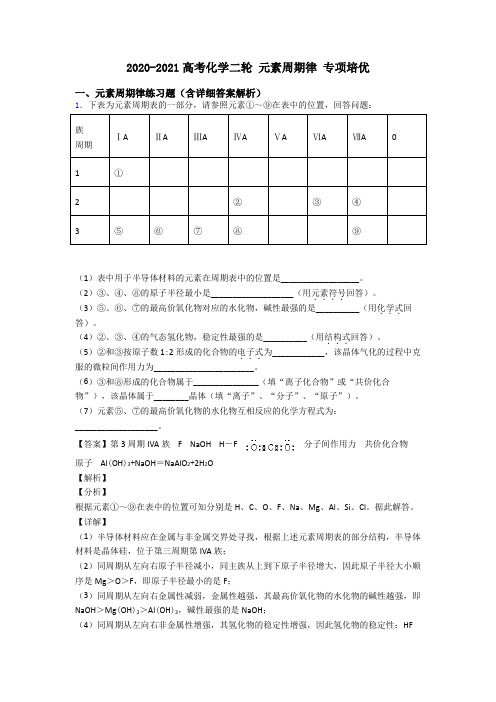
2020-2021高考化学二轮元素周期律专项培优一、元素周期律练习题(含详细答案解析)1.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:族ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期1①2②③④3⑤⑥⑦⑧⑨(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号....回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式...回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式...回答)。
(5)②和③按原子数1:2形成的化合物的电子式...为____________,该晶体气化的过程中克服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
【答案】第3周期IVA族 F NaOH H-F 分子间作用力共价化合物原子 Al(OH)3+NaOH=NaAlO2+2H2O【解析】【分析】根据元素①~⑨在表中的位置可知分别是H、C、O、F、Na、Mg、Al、Si、Cl。
据此解答。
【详解】(1)半导体材料应在金属与非金属交界处寻找,根据上述元素周期表的部分结构,半导体材料是晶体硅,位于第三周期第IVA族;(2)同周期从左向右原子半径减小,同主族从上到下原子半径增大,因此原子半径大小顺序是Mg>O>F,即原子半径最小的是F;(3)同周期从左向右金属性减弱,金属性越强,其最高价氧化物的水化物的碱性越强,即NaOH>Mg(OH)2>Al(OH)3,碱性最强的是NaOH;(4)同周期从左向右非金属性增强,其氢化物的稳定性增强,因此氢化物的稳定性:HF>H2O>CH4,最稳定的氢化物是HF,其结构式为H-F;(5)②和③按原子数1:2形成的化合物是CO2,其电子式为:,CO2属于分子晶体,熔化时克服分子间作用力;(6)③和⑧构成的化合物是SiO2,属于共价化合物,其晶体为原子晶体;(7)⑤是钠元素,其最高价氧化物的水化物是NaOH,⑦是Al,其最高价氧化物的水化物是Al(OH)3,Al(OH)3表现两性,与碱反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。
高三化学高考备考二轮复习:《元素周期表和周期律》专题质量评估试题(Word版,含解析)

(人教版)高考化学二轮复习《元素周期表和周期律》专题质量评估试题(原卷版)考试时间:45分钟满分:100分一、单项选择题:本题包括12小题,每小题5分,共60分。
1.1869年俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上重要里程碑之一。
下列有关元素周期表的说法正确的是() A.元素周期表有7个横行、18个纵列,即有7个周期、18个族B.在过渡元素中寻找半导体材料C.俄罗斯专家首次合成了178116X原子,116号元素位于元素周期表中第七周期第ⅥA族D.ⅠA族的元素全部是金属元素2.2020年12月17日“嫦娥五号”返回器携带月球样品成功着陆地球。
月球上的土壤中吸附着数百万吨的32He。
在地球上,氦元素主要以42He的形式存在。
下列说法正确的是( )A.42He原子核内含有4个质子B.42He和32He互为同位素C.32He原子核内含有2个中子D.42He的最外层电子数为2,所以42He具有较强的还原性3.部分元素在周期表中的分布如图所示(虚线为金属元素与非金属元素的分界线),下列说法不正确的是()A.B只能得电子,不能失电子B.原子半径:Ge>SiC.As可作半导体材料D.Po处于第六周期第ⅥA族4.下列说法不正确的是A.HCl属于共价化合物,溶于水能电离出H+和Cl-B.NaOH是离子化合物,该物质中含共价键C.碘在升华过程中,只需克服分子间作用力D.氢键是一种特殊的化学键5.下列性质的递变规律错误的是A.NaOH、KOH、CsOH碱性依次增强B.Li、Na、K、Rb、Cs的失电子能力逐渐增强C.Al3+、Mg2+、Na+的离子半径依次减小D.F2、Cl2、Br2、I2的熔沸点依次升高下列叙述正确的是()A.K、L、M三种元素的金属性逐渐增强B.在RCl2分子空间结构为直线形,且分子中各原子均满足8电子稳定结构C.Q元素的最高价氧化物为电解质,其水溶液能够导电D.K在T单质中燃烧所生成的化合物是淡黄色的Na2O2固体7.短周期主族元素W、M、X、Y、Z原子序数依次增大。
2020届高考化学二轮复习专项测试:专题七元素周期律和元素周期表(1)Word版含答案

2020届高考化学二轮复习专项测试专题七元素周期律和元素周期表(1)1、人们对发现的第114号元素很感兴趣,并预测它具有良好的力学、光学和电学性质,被命名为“类铅”。
下列对“类铅”的叙述中正确的是( )A.最外层有6个电子B.位于元素周期表的第七周期C.主要化合价为-4、+ 4D.电解硝酸铜与硝酸“类铅”的混合溶液时,首先会析出“类铅”2、W、X、Y、Z是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
下列叙述不正确的是()A.W与Z形成的化合物在常温下为气体B.Y的最高价氧化物对应的水化物不与NaOH溶液反应C.X和Z形成的常见化合物能形成酸雨D.简单氢化物的稳定性:X>Z3、X、Y、Z、W、M五种短周期主族元素,原子序数依次增大,已知X为原子半径最小的元素,Y的最高正化合价和最低负化合价的代数和为0,Z可以与X形成原子个数比为1∶1和1∶2的两种液态化合物,W是地壳中含量最高的金属元素,M的单质是一种黄绿色气体,则下列叙述正确的是( )A. 原子半径的大小关系W>M>Z>Y>XB. Y和M的含氧酸的酸性,前者一定比后者弱C.YX与M的单质在光照条件下的反应产物最多有4种物质4D. X、Y、W的单质均可用于冶炼金属的还原剂4、钛号称“崛起的第三金属”,因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域。
已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )A.上述钛原子中,中子数不可能为22B.钛元素在周期表中处于第四周期ⅡB族C.钛原子的外围电子排布为3d24s2D.钛元素位于元素周期表的d区,是过渡元素5、短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,W的简单氢化物与Z的单质混合在光照下反应,气体颜色不断变浅,瓶壁上有油状液滴,X的简单氢化物与Z的氢化物相遇会产生白烟。
2020届 高考化学二轮复习物质结构 元素周期律专题卷

物质结构元素周期律(一)元素周期表与元素周期律(必修)1.主族元素X、Y、Z、W的原子序数依次增大,且均不大于20。
其中X、Y处于同一周期,Y的单质与水反应可生成X的单质,X、Y、W的最外层电子数之和是Z的最外层电子数的3倍。
下列说法正确的是( )A.简单离子的半径:Z>Y>XB. WX2中含有非极性共价键C.简单氢化物的热稳定性:X>YD. 常温常压下Z的单质为气态2.短周期主族元素X、Y、Z、W、Q的原子序数依次增加。
已知,离子化合物甲是由X、Y、Z、W四种元素组成的,其中,阴阳离子个数比为1∶1,阳离子是一种5核10电子微粒;Q元素原子半径是短周期主族元素中最大的;乙为上述某种元素的最高价氧化物对应的水化物;甲与乙的浓溶液反应生成丙、丁、戊三种物质,其中丁在常温下为气体。
下列说法正确的是( )A.甲中既含离子键,又含共价键B.丙和戊的混合物一定显酸性C.丁一定能使湿润的红色石蕊试纸变蓝D.原子半径:X<Y<Z<W3.短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。
X 与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。
下列说法中正确的是( )A.原子半径:W>Z>Y>XB.气态氢化物热稳定性:Z>WC.元素Z和W均存在两种以上的含氧酸D.元素Z和W在自然界中均只能以化合态存在4.短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20。
则下列说法不正确的是( )X YW ZA.B.原子半径大小:Y<WC.X元素和氢元素所形成的化合物的沸点一定比Y的氢化物的沸点低D.ZY2是一种高效广谱型消毒剂5.短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,W与Y同族且W原子的质子数是Y原子的一半。
2020届高考化学专题练习元素周期表和周期律(包含答案)

D.元素的金属性: Mg>Al
【答案】 B 20. BeCl 2熔点较低,易升华,溶于醇和醚,其化学性质与
AlCl 3 相似。由此可
推测
BeCl 2 (
)
A .熔融态不导电
B.水溶液呈中性
C.熔点比 BeBr 2 高 【答案】 A
D.不与 NaOH 溶液反应
21. X 、 Y 、 Z、 W 是短周期元素, X 元素原子的最外层未达到 8 电子稳定结构, 工 业 上
2020届高考专题练习 元素周期表和周期律(含答案)
1. 根据中学化学教材所附元素周期表判断,下列叙述正确的是
(
)
A . M 电子层电子数为奇数的所有元素都是金属
B.第三、四、五、六周期元素的数目分别是
8、 18、 32、 32
C.由左至右第 2 到 12 列,共十一列元素中没有非金属元素
D.只有第 ⅡA族元素的原子最外层有 【答案】 C
D.同周期元素中 Y 的最高价含氧酸的酸
性最强
【答案】 B
5. 短周期元素 X 原子核外的电子处于 n 个电子层上,最外层电子数为
数为 (2n2- 1)。有关 X 的说法中不正确的是
(
)
(2n+ 1),核内质子
A . X 元素气态氢化物的水溶液呈酸性
B.X 能形成化学式为 NaXO 3 的含氧酸钠盐
D .B 的氧化物的熔点比 A 的氧化物熔点高
【答案】 C
4. 元素 X 、 Y 、 Z 原子序数之和为 36, X 、 Y 在同一周期, X +与 Z2-具有相同的核外电子
层结构。下列推测不正确的是
(
)
A .同周期元素中 X 的金属性最强
B.原子半径 X > Y ,离子半径 X +> Z2-
2020届高三化学二轮总复习题型强化——常考题型元素周期表(律)选择专练

1.2020届届届届届届届届届届届届届届——届届届届届届届届届届届届届届届届根据下列实验现象,所得结论正确的是( )序ABCD号实验现 白色固体变象 为淡黄色生成白色胶状沉淀左边棉球变为橙色,右边棉球变为蓝色锥形瓶中有气体产生, 烧杯中液体变浑浊结溶度积:同浓度溶液的 pH :氧化性:非金属性:论AgBr > AgCl NaAlO > NaHCO23Cl > Br > I222Cl > C > SiA.AB.BC.CD.D2.设NA为阿伏加德罗常数的值。
下列说法不正确的是 ( )A.用铅蓄电池电解氯化钠溶液得到标准状况下22.4 L 氢气时理论上铅蓄电池中消耗氢离子数目为4N AB.32 g S (分子结构:)中的共价键数目为N AC.2 g 由HO 和 2 H O 组成的混合物中含有的质子数为N 2A D.90 g 草酸(乙二酸)中含有的羧基数为NA3.LDFCB 是锂离子电池的一种电解质,该电解质阴离子由同周期元素 W 、X 、Y 、Z 构成(如图),Y 的最外层电子数等于 X 的核外电子总数,四种元素最外层电子数之 和为 20。
下列说法正确的是( )8 18 2A. B. C. D.四种元素的单质中,Z的沸点最高原子半径:W > X > Y > ZW、Z形成的分子中各原子均满足8电子稳定结构Y分别与另外三种元素形成的二元化合物中,Y的价态相同4.四种主族元素a、b、c、d分布在三个短周期中,其原子序数依次增大,b、d的简单离子具有相同电子层结构,d的简单离子半径是同周期主族元素中最小的,四种元素原子的最外层电子数之和为15,下列叙述正确的是( )A. B. C. D.b元素最高价氧化物对应的水化物为强酸最简单气态氢化物的热稳定性:b > c c为第二周期第VIIA族元素原子半径:d > c > b > a5.短周期主族元素W、X、Y、Z位于三个不同的周期,W与Y同主族,X与Z的核外电子数之和是Y的核外电子数的2倍。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素周期表元素周期律1.(2019·朝阳区摸底)短周期主族元素a、b、c、d、e的原子序数依次增大,a元素的简单氢化物与最高价氧化物的水化物反应生成的盐溶液显酸性;b原子的最外层电子数是其次外层电子数的0.125倍;c的单质有“国防金属”之称;《抱朴子内篇》中记载“丹砂烧之成水银,积变又还成丹砂”,丹砂中含有d元素。
下列叙述正确的是(C)A.简单离子半径:d>e>b>c>aB.b、d不能形成含有非极性键的离子化合物C.a、c形成的化合物与水剧烈反应,化合物结构中都形成8电子稳定结构D.d2e2与水反应,作氧化剂解析:a元素的简单氢化物与最高价氧化物的水化物反应生成的盐溶液显酸性,a为N,b原子的最外层电子数是其次外层电子数的0.125倍,b为Na,c的单质有“国防金属”之称,c为Mg, “丹砂烧之成水银,积变又还成丹砂”,丹砂中含有d元素,d为S,则e为Cl。
简单离子半径:S2->Cl->N3->Na+>Mg2+,A错误;Na2S2为含有非极性键的离子化合物,B错误;Mg3N2与水剧烈反应,并且Mg3N2中N3-、Mg2+形成8电子稳定结构,C正确;S2Cl2与水反应方程式为2S2Cl2+2H2O===4HCl+SO2↑+3S↓,S元素的化合价由+1价变成+4价和0价,S2Cl2既作氧化剂又作还原剂,D错误。
2.(2019·湖南怀化联考)X、Y、Z、W是4种短周期主族元素,在周期表中的相对位置如下,已知Z的单质可用作半导体材料,则以下说法中正确的是(C)A.X的气态氢化物的水溶液呈酸性B.X原子的半径小于Y原子的半径C.Z的氧化物是生产玻璃的原料之一D.W单质的水溶液久置不会变质解析:Z的单质可用作半导体材料,则Z是Si,根据在周期表中各元素的相对位置可知X是N,Y是O,W是Cl。
N的气态氢化物的水溶液是氨水,呈碱性,A项错误;氮原子的半径大于氧原子的半径,B项错误;Z的氧化物二氧化硅是生产玻璃的原料之一,C项正确;W单质的水溶液氯水久置后由于次氯酸分解,最终变为盐酸,会变质,D项错误。
3.(2019·广东五校协作体第一次联考)如图是部分短周期元素原子半径与原子序数的关系图,下列说法中正确的是(A)A.M的最高价氧化物对应水化物能分别与Z、R的最高价氧化物对应的水化物反应B.Y的单质能从含R简单离子的水溶液中置换出R单质C.X、N两种元素组成的化合物熔点很低D.简单离子的半径:Z<X<M解析:题图为第二周期和第三周期元素的原子半径的变化,根据原子序数关系可知X为O,Y为F,Z为Na,M为Al,N为Si,R 为Cl。
M的最高价氧化物对应水化物Al(OH)3能分别与Z、R的最高价氧化物对应水化物NaOH、HClO4反应,A项正确;Y的单质F2的非金属性很强,直接与水反应,不能从含Cl-的水溶液中置换出Cl2,B项错误;X、N两种元素组成的化合物SiO2是原子晶体,熔点很高,C项错误;O2-、Na+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+>Al3+,D项错误。
4.(2019·山东枣庄一模)A、B、C、D、E为原子序数依次增大的短周期非金属元素,A和B同周期,B和E同主族,C和D原子最外层电子数之和为A原子最外层电子数的2倍。
下列说法中不正确的是(C)A.元素的非金属性强弱为:B>A>CB.元素A、E的气态氢化物相遇会产生白烟C.元素C的单质是制造光导纤维的材料D.形成的简单离子半径从大到小的顺序为:D>E>B解析:根据原子序数依次增大、元素在周期表中的位置关系可知,这五种元素关系图如下:由于都是非金属元素,则A、B、C、D、E为N、F、Si、S、Cl。
二氧化硅是光导纤维的主要材料,C项错误。
5.(2019·河南八市第二次测评)短周期主族元素X、Y、Z、W的原子序数依次增大,Y与X形成的某气态化合物可以使湿润的红色石蕊试纸变蓝,Z的质子数比Y多1,非金属元素W的氧化物熔点高于其他短周期非金属元素。
下列说法中不正确的是(A) A.四种元素任意组合形成的化合物均为共价化合物B.原子半径大小:W>Y>Z>XC.Y、Z均可与X形成含有非极性共价键的化合物D.简单氢化物的稳定性:Z>Y>W解析:短周期主族元素X、Y、Z、W的原子序数依次增大,Y 与X形成的某气态化合物可以使湿润的红色石蕊试纸变蓝,X为H,Y为N,Z的质子数比Y多1,Z为O,非金属元素W的氧化物熔点高于其他短周期非金属元素,W为Si。
四种元素任意组合形成的化合物不一定为共价化合物,如NH4NO3是离子化合物,A项错误。
6.(2019·浙江“七彩阳光”联盟联考)X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。
下列说法正确的是(D)A.Y、Z、X三种元素的原子半径依次增大B.X、Z都是第二周期第ⅥA族元素,单质的氧化性:X>ZC.Y的气态氢化物的热稳定性比Z的强D.R元素与W同族且处于相邻周期,则R元素最高价氧化物对应的水化物的酸性比Z的强解析:根据元素周期表中位置关系可知X为氧元素,W为氟元素,Y为硅元素,Z为硫元素。
由于同周期元素原子半径从左到右依次减小,同主族元素原子半径从上而下依次增大,故Y、Z、X三种元素的原子半径依次减小,A错误;X、Z分别是第二周期第ⅥA族元素和第三周期第ⅥA族元素,单质的氧化性:X>Z,B错误;SiH4的热稳定性比H2S的弱,C错误;R元素与W同族且位于相邻周期,则R为氯元素,其最高价氧化物对应的水化物HClO4的酸性比H2SO4强,D正确。
7.(2019·保定摸底)短周期主族元素R、X、Y、Z的原子序数依次增大,X是短周期元素中金属性最强的元素;常温下将pH>7的X2YR3溶液久置于空气中,最终溶液中1g c(H+)c(OH-)=0。
下列推断正确的是(A)A.简单离子半径:Y>Z>R>XB.最高价氧化物对应的水化物的酸性:Y>ZC.由X、Y、R三种元素组成的化合物一定能破坏水的电离平衡D.X分别与R、Y、Z组成的二元化合物中均含有一种化学键解析:由题意可知,R、X、Y、Z分别为O、Na、S、Cl。
则简单离子半径S2->Cl->O2->Na+,A正确;最高价氧化物对应的水化物的酸性H2SO4<HClO4,B错误;Na2SO4不影响水的电离平衡,C错误;Na2O2中含有离子键、共价键,D错误。
8.(2019·皖江名校联盟联考)X、Y、Z、W、R是原子序数依次增大的五种短周期元素。
X原子的最外层电子数为最内层电子数的2倍。
Y与X是同周期元素,XY2可用于灭火。
简单阳离子Z+、W2+具有相同的电子层结构。
R是同周期原子半径最小的主族元素。
下列有关说法正确的是(A)A.XY2中各原子都达到8电子稳定结构B.Z、W分别与Y形成的常见化合物均为碱性氧化物C.Y、Z、R三种元素形成的化合物一定能发生水解反应D.离子半径的大小顺序为Z>W>Y解析:X、Y、Z、W、R是原子序数依次增大的五种短周期元素,X原子的最外层电子数为最内层电子数的2倍,X是C元素,Y与X是同周期元素,XY2可用于灭火,则XY2是CO2,Y是O元素;简单阳离子Z+、W2+具有相同的电子层结构,根据原子序数关系,Z 是Na元素,W是Mg元素;R是同周期原子半径最小的主族元素,且R的原子序数大于W,则R是Cl元素。
XY2为CO2,各原子都达到8电子稳定结构,A正确;Na,Mg分别与O形成的常见化合物有氧化钠、过氧化钠、氧化镁,其中过氧化钠不是碱性氧化物,B 错误;Na、O、Cl三种元素可以形成的化合物有NaClO、NaClO2、NaClO3、NaClO4,其中NaClO3、NaClO4是强酸强碱盐,不能发生水解反应,C错误;电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Mg2+,D错误。
9.(2019·河北邯郸质检)a、b、c、d为短周期元素,原子序数依次增大。
a原子最外层电子数等于电子层数的3倍,a和b能组成两种离子化合物,其中一种含两种化学键,d的最高价氧化物对应的水化物和气态氢化物都是强酸。
向d的氢化物的水溶液中逐滴加入bca2溶液,开始没有沉淀;随着bca2溶液的不断滴加,逐渐产生白色沉淀。
下列推断正确的是(C)A.简单离子半径:b>c>d>aB.最高价氧化物对应水化物的碱性:b<cC.工业上电解bd的饱和溶液可得到d的单质D.向b2a2中加入cd3溶液一定不产生沉淀解析:a、b、c、d为短周期元素,原子序数依次增大,a原子最外层电子数等于电子层数的3倍,则a为O元素;a和b能组成两种离子化合物,其中一种含两种化学键,则b为Na元素(过氧化钠中既含有离子键又含有共价键);d的最高价氧化物对应的水化物和气态氢化物都是强酸,则d为Cl元素;向d的氢化物的水溶液中逐滴加入bca2溶液,开始没有沉淀,随着bca2溶液的不断滴加,逐渐产生白色沉淀,则c为Al元素。
简单离子半径:Cl->O2->Na+>Al3+,A不正确;最高价氧化物对应水化物的碱性:NaOH>Al(OH)3,B 不正确;工业上电解NaCl的饱和溶液可得到氯气,C正确;向过氧化钠中加入足量的氯化铝溶液一定能产生氢氧化铝沉淀,D不正确。
10.(2019·山西六校联考)甲、乙、丙、丁分别为A、B、C、D 四种短周期元素的最高价氧化物对应的水化物,已知0.1 mol·L-1甲、丙、丁溶液的pH与A、C、D的原子序数关系如图所示(lg 2=0.3),且常温下甲、丙、丁均可与乙反应。
下列说法正确的是(C)A.原子半径:A<B<C<DB.A、B分别与D形成的化合物均为离子化合物C.B、C的简单离子都会影响水的电离平衡D.乙在浓氨水中能溶解解析:由题图可知,0.1 mol·L-1甲溶液的pH=13,说明甲是一元强碱,则甲为NaOH、A为Na元素;0.1 mol·L-1丁溶液的pH=1,说明丁为一元强酸,又因D原子序数大于A,则丁为HClO4、D为Cl元素;0.1 mol·L-1丙溶液的pH=0.7,说明丙为二元强酸,则丙为H2SO4、C为S元素;常温下甲、丙、丁均可与乙反应,说明乙具有两性,则乙为Al(OH)3、B为Al元素。
同一周期元素从左至右原子半径逐渐减小,所以原子半径:A>B>C>D,A错误;Na与Cl形成的NaCl是离子化合物,Al与Cl形成的AlCl3是共价化合物,B 错误;Al3+、S2-在水中都会发生水解促进水的电离,C正确;NH3·H2O 是弱碱,不能溶解Al(OH)3,D错误。
