元素周期律元素周期表-
初中化学元素周期表带拼音

初中化学元素周期表带拼音化学元素是学习化学的最基本前提,科学家们对化学元素的规律进行总结,制成了化学元素周期表,为了帮助大家学习,今天小编在这整理了初中化学元素周期表,接下来随着小编一起来看看吧!元素周期表(注音版)qīng氢hài氦lǐ锂pí铍péng硼tàn碳dàn氮yǎng氧fú氟nǎi氖nà钠měi镁lǚ铝guī硅lín磷liú硫lǜ氯yà氩jiǎ钾gài钙kàng钪tài钛fán钒gè铬měng锰tiě铁gǔ钴niè镍tóng铜xīn锌jiā镓zhě锗shēn砷xī硒xiù溴kè氪rú铷sī锶yǐ钇gào锆ní铌mù钼dé锝liǎo钌lǎo铑pá钯yín银gé镉yīn铟xī锡tī锑dì碲diǎn碘xiān氙sè铯bèi钡lán镧shì铈cuò错nǚ钕pǒ钷shān钐yǒu铕gá钆tè铽dí镝huǒ钬ěr铒diū铥yì镱 lǔ镥hā铪tǎn钽wū钨lái铼é锇yī铱bó铂jīn金gǒng汞tā铊qiān铅bì铋pō钋ài砹dōng氡fāng钫léi镭ā锕tǔ钍pú镤yóu铀ná镎bù钚méi镅jū锔péi锫kāi锎āi锿fèi镄mén钔nuò锘láo 铹巧记化学元素周期表口诀先用2分钟时间看一个不伦不类的小故事:侵害:从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
元素周期律及周期

He:2
Ne:10
Ar:18
Kr:36
Xe:54
Rn:86
预备知识2:熟悉元素周期表的结构
第1、2纵行为ⅠA、ⅡA;第13-17纵行为ⅢA-ⅦA;第18纵 行为零族
若序数小于56,则序数减去比它小而相近的稀有气体的原子 序数,既得该元素所在的纵行数。 若序数大于56,则序数减去比它小而相近的稀有气体的原子序 数后,再减去14,既得该元素所在的纵行数。 注周期数:相近的稀有原子所在周期数加1。
(8) 12Mg:其单质能在CO2气体中燃烧,也能在氮气中燃烧。
(9) 13Al:是地壳中含量最高的金属元素;该金属单质在冷浓 H2SO4或冷浓HNO3中钝化;该元素具有两性。
(10) 14Si: 电子层结构跟同族碳相似。该元素在地壳中含量居第二
位,其单质是良好的半导体材料。该单质又能与强碱作用放出 H2 (11) 15P:该元素的一种单质白磷,有剧毒,不溶于水,易溶于CS2 能自燃,它的分子具有正四面体结构;另一种单质红磷不溶于
例. “北大富硒康”中含有微量元素硒(Se),对人体有保 健作用。已知硒为第四周期第ⅥA族元素,根据它在周 期表中的位置推测,硒不可能具有的性质为( AC )。 A.硒化氢很稳定
B.硒化氢的水溶液显弱酸性
C.非金属性强于硫
D.其最高价氧化物的水化物酸性强于砷弱于溴
例:现代隐形飞机表面涂有钋,可以吸收和屏蔽雷达
水,也不溶于CS2,是制造安全火柴的原料;在一定条件下,两
种单质可以相互转化。
(12) 16S:该元素的氢化物与它的最高价氧化物对应的水化物的浓
溶液作用。
(13) 17Cl:同周期元素中成对电子数最多的元素之一,其单质有剧
毒,最高价氧化物对应的水化物的酸性最强。
元素周期表

一、元素周期表
元素周期表
IA H
1
A:主族 IIA Be 4铍 Mg 12镁 Ca 20钙 IIIA B 5硼 Al 13铝 IVA C 6碳 Si 14硅 VA N 7氮 P 15磷 VIA O 8氧 S 16硫 VIIA F 9氟 Cl 17氯
0 He 2氦 Ne 10氖 Ar 18氩
1氢 Li
比钠剧烈
[实验现象]
24
二、元素的性质与原子结构
(2)钾与H20的反应 [实验现象] 金属钾浮在水面上,剧烈反应,听到微弱的爆鸣声,并且出现紫色 的火光。 比钠剧烈 均能与O2、H2O反应,表现出金属性(还原性) △
2.碱金属化学性质的规律
(1)相似性:
(2)递变性:
4Li + O2 = 2Li2O 2Na+2H2O = 2NaOH+H2
3
一、元素周期表
元素周期表的编排原则
原子序数:根据元素在周期表中位置的编号 原子序数=核电荷数=质子数=核外电子数 根据元素周期律,把已知的一百多种元 素中 电子层数目相同 的各种元素,按原 子序数递增的顺序从左到右排成 横行 , 再把不同横行中 最外电子层的电子数相同 的元素按电子层数递增的顺序由上而下排 成 ,这样得到的一个表,叫做元 纵行 素周期表。
第 IA 族—碱金属元素 另外,特别族名称: 第ⅦA 族—卤族元素 第 0 族—稀有气体元素
19
一、元素周期表
课堂小结: 1、元素周期表的结构:
七主七副七周期, Ⅷ族零族镧锕系。
2、元素原子结构与其在周期表中位置的关系:
a.电子层数 b.最外层电子数
决定
周期序数
决定
主族序数
原子序数 核外电子排布 周期表中位置
元素周期律知识点总结(精华版)
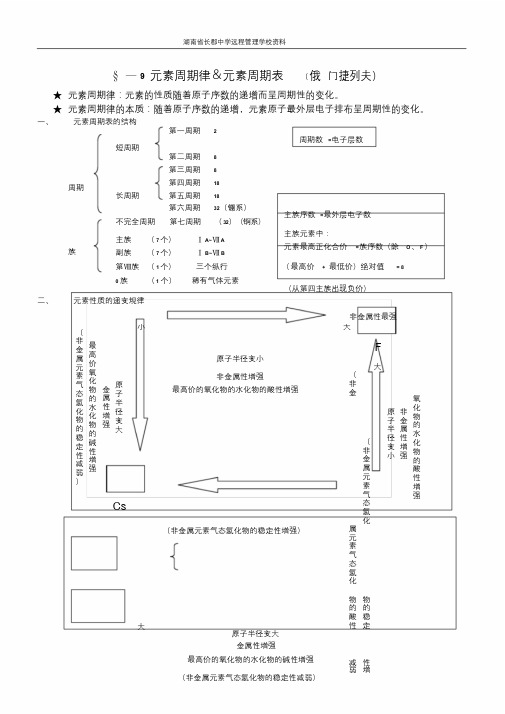
湖南省长郡中学远程管理学校资料§—9 元素周期律&元素周期表(俄门捷列夫)★元素周期律:元素的性质随着原子序数的递增而呈周期性的变化。
★元素周期律的本质:随着原子序数的递增,元素原子最外层电子排布呈周期性的变化。
一、元素周期表的结构第一周期 2周期数=电子层数短周期第二周期8第三周期8周期长周期第四周期18第五周期18第六周期32(镧系)不完全周期第七周期(32)(锕系)主族序数=最外层电子数族主族(7 个)ⅠA~ⅦA副族(7 个)ⅠB~ⅦB主族元素中:元素最高正化合价=族序数(除O、F)第Ⅷ族(1 个)三个纵行(最高价+ 最低价)绝对值= 80 族(1 个)稀有气体元素(从第四主族出现负价)二、元素性质的递变规律非金属性最强(非金属元素气态氢化物的稳定性减弱)最高价氧化物的水化物的碱性增强金属性增强原子半径变大Cs小大F原子半径变小大非金属性增强最高价的氧化物的水化物的酸性增强(非金(非金属元素气态氢化(非金属元素气态氢化物的稳定性增强)属元素气态氢化大物物的的酸稳性定原子半径变大金属性增强最高价的氧化物的水化物的碱性增强减性弱增(非金属元素气态氢化物的稳定性减弱)原子半径变小非金属性增强氧化物的水化物的酸性增强)强大小)最高价金属性最强元素的最高价氧化物的水化物主族元素R →R2O xR金属R(OH) xR 非金属H8-x RO 4元素气态氢化物H6-x RO 3非金属元素R →H x R ( RH x ) X 代表元素最低价的绝对值怀化市长郡湖天中学、怀化市第一中学、怀化市第五中学。
元素周期表(全面版)
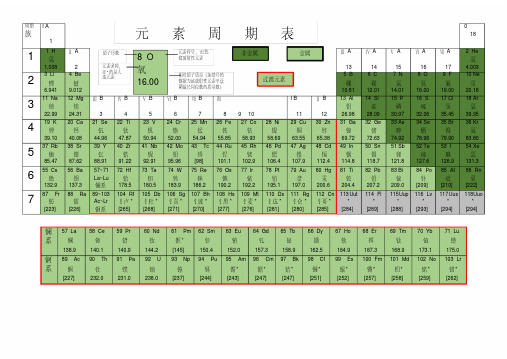
周期族I A1 0181 1 H 氢1.008 Ⅱ A2Ⅲ A13Ⅳ A14Ⅴ A15Ⅵ A16Ⅶ A172 He氦4.0032 3 Li 锂6.941 4 Be铍9.0125 B硼10.816 C碳12.017 N氮14.018 O氧16.009 F氟19.0010 Ne氖20.183 11 Na 钠22.99 12 Mg镁24.31Ⅲ B3Ⅳ B4Ⅴ B5Ⅵ B6Ⅶ B7Ⅷ8 9 10I B11Ⅱ B1213 Al铝26.9814 Si硅28.0915 P磷30.9716 S硫32.0617 Cl氯35.4518 Ar氩39.954 19 K钾39.10 20 Ca钙40.0821 Se钪44.9622 Ti钛47.8723 V钒50.9424 Cr铬52.0025 Mn锰54.9426 Fe铁55.8527 Co钴58.9328 Ni镍58.6929 Cu铜63.5530 Zn锌65.3831 Ga镓69.7232 Ge锗72.6333 As砷74.9234 Se硒78.9635 Br溴79.9036 Kr氪83.805 37 Rb 铷85.47 38 Sr锶87.6239 Y钇88.9140 Zr锆91.2241 Nb铌92.9142 Mo钼95.9643 Tc锝[98]44 Ru钌101.145 Rh铑102.946 Pd钯106.447 Ag银107.948 Cd镉112.449 In铟114.850 Sn锡118.751 Sb锑121.852 Te碲127.653 I碘126.954 Xe氙131.36 55 Cs 铯132.9 56 Ba钡137.357~71La~Lu镧系72 Hf铪178.573 Ta钽180.574 W钨183.975 Re铼186.276 Os锇190.277 Ir铱192.278 Pt铂195.179 Au金197.080 Hg汞200.681 Ti铊204.482 Pb铅207.283 Bi铋209.084 Po钋[209]85 At砹[210]86 Rn氡[222]7 87 Fr钫[223] 88 Ra镭[226]89~103Ac~Lr锕系104 Rf钅卢*[265]105 Db钅杜*[268]106 Sg钅喜*[271]107 Bh钅波*[270]108 Hs钅黑*[277]109 Mt钅麦*[276]110 Ds钅达*[281]111 Rg钅仑*[280]112 Cn钅哥*[285]113Uut*[284]114 Fl*[289]115Uup*[288]116 Lv*[293]117Uus*[294]118Uuo*[294]镧系57 La镧138.958 Ce铈140.159 Pr镨140.960 Nd钕144.261 Pm钷*[145]62 Sm钐150.463 Eu铕152.064 Gd钆157.365 Tb铋158.966 Dy镝162.567 Ho钬164.968 Er铒167.369 Tm铥168.970 Yb镱173.171 Lu镥175.0锕系89 Ac锕[227]90 Th钍232.091 Pa镤231.092 U铀238.093 Np镎[237]94 Pu钚[244]95 Am镅*[243]96 Cm锯*[247]97 Bk锫*[247]98 Cf锎*[251]99 Es锿*[252]100 Fm镄*[257]101 Md钔*[258]102 No锘*[259]103 Lr铹*[262]金属非金属过渡元素8 O氧16.00原子序数元素符号,红色指放射性元素元素名称,注*的是人造元素相对原子质量(加括号的数据为该放射性元素半衰期最长同位数的质量数)元素周期表元素周期表有关知识一、部分酸、碱和盐的溶解性表(室温)说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“-”表示那种物质不存在或遇水就分解了。
元素周期律及表

元素周期律、元素周期表(一)[重点内容讲解]一、元素周期律:元素的性质随着原子序数的递增而呈周期性的变化(即随着原子核电荷数的递增,核外电子排布呈现周期性的变化)表现在1.随着原子序数的递增,元素原子的最外层电子数重复着由1到8(K层除外)的周期性变化。
2.随着原子序数的递增,元素(除稀有气体外)的原子半径重复着由大到小的周期性变化。
3.随着原子序数的递增,元素的主要化合价(除H、He外)重复着正价由+1到+7,负价由-4到-1的规律性变化。
元素周期律的实质是由于原子序数的递增,核外电子排布呈周期性变化的结果。
由此导致元素化学性质,如金属性、非金属性、气态氢化物稳定性、高价氧化物对应水化物的酸碱性等呈现周期性的变化规律,这就是元素周期律,但应注意这种变化不是简单的重复。
二、元素周期表:元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
1.元素周期表的结构:七横行——周期,包括三个短周期,三个长周期和一个不完全周期;十八个纵列——族,包括七主族,七副族,一个Ⅷ族和一个零族。
注意:(1)主族和副族的区分:主族是由长周期元素和短周期元素共同构成的族,但由长周期和短周期构成的族也不一定是主族元素,如0族元素。
只由长周期元素构成的族为副族。
(2)镧系和锕系及超铀元素所包含的元素。
2.与原子结构的关系:同周期:电子层数相同,周期数即电子层数,最外层电子从1个递增到8个(除第1周期外)同主族:电子层数不同,最外层电子数相同,族序数即最外层电子数。
注意:(1)最外层只有1个电子的元素,不一定是IA族元素,可能是副族元素,如Cu,也不一定是金属元素,如H。
最外层电子数有2个电子的元素不一定是主族元素,如He、Fe等。
最外层电子是3~7个电子的元素一定是主族元素。
(2)每一周期元素种类:2,8,8,18,18,32,(7周期预计32);(3)同一周期主族序数之差即原子序数之差或最外层电子数之差。
元素周期表及元素周期律

R2O3 RO2
R(OH)3 H2RO3
RO3
H2RO4
R2O7
HRO4
族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
元素
单质化学活 泼性
最高价氧化物
最高价氧化物对 应水化物
Na Mg Al
?
Si
P
S
?
Cl
酸、碱性
气态氢化物
热稳定性比较
族
ⅠA
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
元素
单质化学活 泼性
最高价氧化物
ⅣA
ⅤA
ⅥA ⅦA
Na
Mg
逐渐减弱
Al
Si
P
S
Cl
逐渐增强
Al2O3
Al(OH)3
Na2O
MgO
Mg(OH)2
SiO2
H2SiO3
P2O5 H3PO4
最高价氧化物对 NaOH 应水化物
酸、碱性 气态氢化物
热稳定性比较
强碱 中强碱 两性
弱酸 中强 SiH4
很不稳 定 P纵行:18个纵行 主族:由短周期元素和长周期元素共同构成的元素。 七个主族: 族的序数: ⅠA 、ⅡA 、 ⅢA 、ⅣA 、ⅤA 、 ⅥA 、ⅦA 结构:
相同点:最外层电子排布相同。(最外层电子数相同)
最外层电子数=族的序数 不同点:电子层数不同,从上到下随着原子序数的增加,依次增加 一层
副族:完全由长周期元素构成的族。 七个族的序数: ⅠB 、ⅡB 、 ⅢB 、ⅣB 、ⅤB 、 ⅥB 、ⅦB
F
金 属 性 增 强
金属性增强
逐非 渐金 增属 强性
族 周期 1 2 3 4 5 6 7
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 非金属性增强
高三化学元素周期律与元素周期表

1、元素周期表的结构
短周期:3个(第1、2、3周期)
周期
7个
长周期:4个(第4、5、6、周期,
周期表 (七个横行) 其中第7周期为不完全周期)
主族7个:ⅠA-ⅦA
族
16个 (共18个纵行)
副族7个:IB-ⅦB 第Ⅷ族1个(3个纵行) 零族(1个)稀有气体元素
A. 原子序数=核电核数=质子数=核外电子数 B. 周期序数=原子核外电子层数 C. 主族序数=原子的最外层电子数=元素最高价数
⑤ (d)
元素性质的递变规律
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
族
半径由大变小
1半
2径
3
由 小
4
变 大
5
6
7
非金属性逐渐增强
非
金
B
金
属
属
性
Al Si
性
逐
渐
Ge As
逐 渐
增 强
Sb Te
增 强
金属性逐渐增强
Po At
再见
网上订花 买花 订花 网上订花 买花 订花
A、非金属性强弱为:X>Y>Z
B、气态氢化物的稳定性由强到弱为X、Y、Z
C、原子半径大小是:X<Y<Z
D、对应阴离子的还原性按X、Y、Z顺序减弱
3.指出原子序数为5、17、20、35的元素的 位置在哪里?(用周期和族表示)
4.下列各组原子序数表示的两种元素,能形 成AB2型离子化合物的是( A )
7、 X、Y、Z为短周期三种元素,已知
X和Y同周期,Y和Z同主族,又知三种元 素原子最外层电子数总和为14,而质子数 总和为28,则三种元素为(D) (A)N、P、O (B)N、C、Si (C)B、Mg、Al (D)C、N、P
元素周期律

元素周期表
1.周期
元素周期表有7个横行,也就是7个周期。具有相 同的电子层数,而又按照原子序数递增的顺序排 列的一系列元素,称为一个周期。 周期的序数就是该周期原子具有的电子层数。 各周期里元素的数目不同,第一周期只有2个元 素,第二、第三周期各有8个元素。第四、五、 六、七周期元素都比8个元素多。第一、二、三 称为短周期,其余称长周期。
微粒半径大小比较的一般规律 1.先看电子层,电子层数越多,半径越大 2. 电子层数相同,看核电荷数,核电荷数越 大,半径越小。 3. 电子层数相同,核电荷数也相同,看最外 层电子数,电子数越多,半径越大。
四.元素主要化合价的周期变化
原子序数
元素名称
1
氢
2
氦
3
锂
4
铍
5
硼
6
碳
7
氮
第16号元素是硫也是非金属。它的最高价氧化物是 SO3,SO3对应的水化物是H2SO4。硫酸是一种强酸。在 加热时硫可以与氢气化合,生成气态氢化物硫化氢。
第17号元素氯也是非金属。它的最高价氧化物是Cl2O7, 对应的水化物是HClO4,它是已知酸中最强的酸。氯气与 氢气在光照或点燃时会发生爆炸而化合,生成气态氢化 物氯化氢。
一.核外电子 排布的周期性
部分元素原子 的电子层排布
通过上表可以发现,每隔一定数目的元素,会重复出 现原子最外层电子数从1个递增到8个的情况。也就是 说,随着原子序数的递增,元素原子的最外层电子呈 周期性的变化。
原子半径的周期性变化 同一周期内,从ⅠA到ⅦA(卤族)随着原子序数的递 增,原子半径由大变小。如Na原子的半径为: 1.86×10 -10米递减到0.99×10 -10米。 同一主族内,从上到下,随着元素电子层的增加,原 子半径增大。
元素周期表

6 C
元素符号 元素名称 非金属元素
碳
相对原子质量
12.01
小结:
元素周期表的结构 元 素 周 期 表
7个横行 18个纵行
周期 7个(三短四长)周期序数=电子层数
主族(A):7个 主族序数=最外层电子数
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
族
(16个)
副族(B):7个
ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB
C.元素周期表中有十八个纵行,分为十六个族。
D.元素周期表中有十八个纵行,分为十八个族。
2、同周期元素,其原子结构相同之处是( C ) A、最外层电子数 B、核电荷数 C、电子层数 D、核外电子数
3、在短周期元素中,原子最外电子层只有1个或2个 电子的元素是 ( D ) A.金属元素 B.稀有气体元素 C.非金属元素 D.无法确定为哪一类元素 4、已知某离子的结构示意图 是( C )
第Ⅷ族:
第8、9、10三个纵行 稀有气体元素
0族:
1.周期表中有多少个纵行?
18个
是不是就有18个族呢? 2.有多少个主族?多少个副族? 3.主族元素族序数与主族元素的最外 层电子数有什么样的关系?
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
①
主族(A) : 7个
七主七副一Ⅷ0
ⅠA ⅡA (副族) ⅢA ⅣA ⅤA ⅥA ⅦA
族
18个纵行 16个族
副族(B) :7个
ⅢB ⅣB ⅤB ⅥB ⅦB (第Ⅷ族)ⅠB ⅡB
第Ⅷ族:
第8、9、10三个纵行
①
主族(A) : 7个
七主七副一Ⅷ0
ⅠA ⅡA (副族) ⅢA ⅣA ⅤA ⅥA ⅦA
元素周期律、元素周期表-PPT课件

如88号元素,88-86=2,则应在第7周期第ⅡA。
②若比相应的稀有气体元素的原子序数少1~5时,则应在第ⅦA~ⅢA,如84号元素 在第6周期第ⅣA。 ③若预测新元素,可与未发现的稀有气体元素118号相比按上面的方法推算。如 116号元素应在第7周期ⅥA。 (2)同族的上下周期元素原子序数之间的关系 ①第ⅠA、ⅡA的元素上下周期元素原子序数的差值等于上一种元素所在周期所能
【例2】短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电
子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素 原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个,则这三种 元素所组成的化合物的分子式不可能是( A.X2YZ4 B.XYZ3 C.X3YZ4 ) D.X4Y2Z7
考点1一原子结构 一、构成原子或离子微粒间的数量关系: (1)质子数=核电荷数=核外电子数=原子序数; (2)质量数=质子数+中子数;
(3)质子数=阳离子的核外电子数+阳离子所带电荷数;
(4)质子数=阴离子的核外电子数-阴离子所带电荷数; (5)原子的质量数≈该同位素原子的相对原子量; (6)元素的质量数≈该元素的平均相对原子量。 二、核外电子排布特点归纳 (1)前18号元素排布的特点 ①原子核中无中子的原子为1 1H;
够排列的元素种类数。因此第ⅠA、ⅡA族的元素的原子序数等于上一种元素的原子
序数+上一周期所上一种元素Rb的原 子序数)+18(Rb所在的周期能够排列的元素种类数)=55。
②第ⅢA~0族的元素上下周期元素原子序数的差值等于下一种元素所在周期所能够 排列的元素种类数。因此第ⅢA~0族的元素的原子序数等于上一种元素的原子序数 +下一周期所能排列的元素种类数。如:Se的原子序数=16(上一种元素S的原子序
第一节元素周期表

归纳:碱金属的主要物理性质
相似性: 1) 银白色有金属光泽(铯略带金色) 2) 较柔软,有延展性 3) 密度小 4) 熔点低(均小于200℃) 5) 导电、导热
递变性: 随着核电荷数的增加:
• 密度增大 (但K 反常) • 熔、沸点逐渐降低
2、卤族元素
(1)物理性质
物理性质
随原子序数的递增: 1.颜 色: 颜色逐渐加深 2.状 态: 气态~液态~固态 3.熔沸点: 逐渐升高 4.密 度: 逐渐增大
(2)原子结构
(3)化学性质
①卤素单质与氢气反应
卤素单质与氢气反应 剧烈程度:F2>Cl2>Br2>I2 生成氢化物稳定性:
HF>HCl>HBr>HI
②卤素单质间的置换反应
颜色
溶于水
溶于CCl4
Cl2
黄绿色
黄绿色
黄绿色
Br2
深红棕色 橙黄色
橙红色
I2
紫黑色
褐色
紫红色
实验1—1
实验
现象
化学方程式
57
6 55 56 - 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
71
7 87 88 89103
104
105
106
107
108
109
110
111
112
过渡元素
镧 系 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
碳有两个电子层,位于第二周期,镁有三个电子层, 位于第三周期;溴有四个电子层,位于第四周期。
(2)族(16个) 七个主族 七个副族 一个第Ⅷ族(3个纵行) 一个0族
