体内药物分析方法的建立与验证
体内药物分析

体内药物分析体内药物分析:药物分析的的重要分支,是研究生物体中药物及其代谢物和内源性物质的质与量变化规律的分析方法学。
体内药物分析的特点◆生物样品基质复杂◆被测物浓度低◆分析方法要求高◆实验室仪器设备要求高◆测定目标与数据处理复杂体内药物分析方法的要求◆高灵敏度检测方法的应用◆建立高选择性、高专属性的分离方法◆建立的分析方法满足于分析目的相适应的精密度和准确度要求成分复杂、干扰众多——要求方法选择性高采样量小,浓度很低——要求方法灵敏度高原料药:容量分析为主制剂:仪器分析为主体内药物:高灵敏度;高选择性的方法第二章生物样品指含待测物质的生物基质最常见的生物基质为血液,最常用的生物样品是血浆或血清血样采集的时间、方式:血样的应用:血样包括全血、血浆、血清全血不能作为作用部位药物浓度的可靠指标,通常指测定血浆或血清中的药物的浓度。
当血浆中含有的抗凝剂对药物浓度有干扰时,使用血清样品血样制备的差异:尿液:尿液中必须加入防腐剂,非损伤性采样方法唾液:组织:头发:微量元素的测定生物样品的贮存:◆血浆和血清:采血后及时分离(2h),短期4℃,长期-20℃◆冷冻是最常用的生物保存方法◆生物样品总的原则:临时解冻,解冻的样品一次测完,不能反复冷冻→解冻→冷冻分析样品制备的目的:◆使药物从缀合物或结合物中释放,测定总浓度◆使样品纯化与药物组分富集◆满足测定方法对分析样品的要求◆保护仪器性能及改善分析条件有机破坏法主要应用于头发样品中金属元素的测定去除蛋白质法去除蛋白质目的:溶剂解法:◆常用溶剂——甲醇、丙醇◆原理——◆操作——盐析法:中性盐(置换蛋白结合的水,使蛋白脱水而沉淀)强酸沉淀法:10%三氯醋酸、6%高氯酸超滤法:不需加热,不需添加化学试剂、操作条件温和,没有相态变化,破坏性小,能耗少,工艺流程短。
酶水解法:避免酸碱、高温降解,改善回收率,无乳化,减少净化操作纯化与浓集应用范围:液-液提取法(LLE)大多数药物都是脂溶性,内源性物质基本上都是水溶性,当用有机溶剂萃取时,药物被萃取出来而内源性物质被除去,因此采用有机溶剂萃取法能够达到纯化目的优点:选择性;药物能与多数内源性物质分离缺点:乳化、有毒、不环保、不自动,对极性大的化合物的萃取效率低固相萃取(SPE)◆原理:根据液相萃取的原理,利用液相中溶质与吸附剂间的选择性吸附与洗脱原理。
体内药物分析方法和方法的设计和评价

为:毛细管区带电泳、胶束电动毛细管色谱、
毛细管凝胶电泳、毛细管等电聚焦、毛细管等
速电泳和毛细管电色谱法。上述这些方法近几
年来在体内药品分析中均得到不一样程度应
用。 体内药物分析方法和方法的设计和评价
第14页
体内药物分析方法和方法的设计和评价
第15页
• 选取何种方法进行体内药品分析为好呢?普通 要依据药品理化性质、结构持征、药品浓度大 小、干扰成份多少、预处理方法、试验目标以 及试验室条件等原因综合起来进行考虑。
体内药物分析方法和方法的设计和评价
第9页
1、HPLC法
• HPLC法在体内药品分析中应用已大大超出其 它分析方法,成为体内药品分析中应用最广泛 技术之一。与GC法相比,它含有以下优点:
• (1)适用范围广,可在室温下进行检测。对于 挥发性低,热稳定性差,分子量大以及离子型和评价
(一)以纯品进行测定
• 取药品或其代谢物纯品适量,按确定方法测 定,求得浓度与测定响应值之间关系,进行线 性范围、最适测定浓度、检测灵敏度、测定最 适 条 件 ( 如 pH 值 、 温 度 、 反 应 时 间 等 ) 等 选 择。
体内药物分析方法和方法的设计和评价
第21页
(二)空白样品测定
• 取空白生物样品,按确定方法进行处理,测定 空白值(或色谱图)。空白值高低或色谱图情况 将影响到方法灵敏度和专属性,应力争将空白 值降低。在色谱分析中应力争降低体内样品中 内源性杂质峰,对无法消除内源性杂质峰应设 法使其从待测物色谱区域内移开。能否取得良 好样品空白试验结果,是决定测定方法实际可 行性主要步骤,必须设法处理。
• 另外,还有一些含抗生素类药品生物样品,它 们可用微生物方法测定,利用抗生素在琼脂培 养基内扩散作用,比较样品与药品标准品二者 对接种试验菌产生抑菌圈大小,借以测定样品 内抗生素药品浓度。
体内药物分析概述
体内药物分析的任务:内源性物质检测
体内内源性物质如氨基酸、激素、儿茶酚胺、肌 酐、草酸、尿酸等。
喹诺酮类药物对致病菌的杀菌作用取决于药物血药浓 度的峰浓度,即药物浓度越高,杀菌作用越强。—— 浓度依赖性
时间依赖性——杀菌活性与药物浓度维持在MIC以上时 间的长短有关。β-内酰胺类、林可霉素类等抗生素。
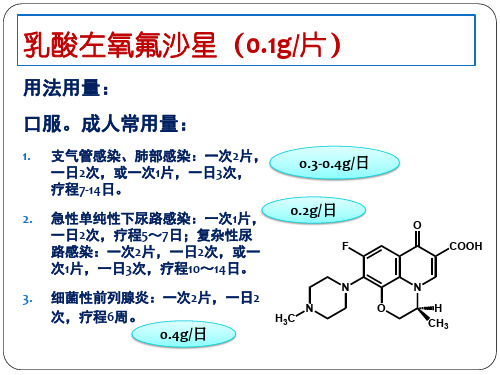
乳酸左氧氟沙星(0.1g/片)
用法用量:
口服。成人常用量:
1. 支气管感染、肺部感染: 药物随着血液到各个组织
2.体内样品的种类、采集与贮存
2.1体内样品的种类与采集
血液(血浆、血清、全血)、尿液、唾液、胆汁、乳 汁、脑脊液等均匀生物样品
心、肝、脾、肺、肾、脑等非均匀生物样品 样品选取原则 (1)必须是能够反映出浓度与药物效应之间关系; (2)易于获得; (3)便于处理,适合于分析; (4)根据不同目的与要求进行选取。
0.3-0.4g/日
2. 急性单纯性下尿路感染: 0.2g/日 药物通过尿液排泄在下尿路发挥治疗作用
3. 细菌性前列腺炎: 0.4g/日 药物随着血液到前列腺组织
测定血液、尿液甚至
组织中的药物浓度
1.概述
1.1体内药物分析的定义
体内样品(生物体液、器官或组织)中药物 及其代谢产物或内源性生物活性物质的定性、 定量分析。
CuSO4-Na2WO4
ZnSO4-NaOH
每1容积血浆加入沉淀剂容积
0.2
体内药物研究分析的方法和重要性

体内药物分析的方法和重要性————————————————————————————————作者:————————————————————————————————日期:2浙江大学远程教育学院本科生毕业论文(设计)开题报告题目体内药物分析的方法和重要性专业药学学习中心衢州姓名袁奕艺学号710013222002指导教师周新高2012 年03月24日一、文献综述体内药物分析是指通过分析手段了解药物在体内的数量和质量的变化,获得药物动力学的各种参数,以及药物在体内转变、代谢的方式、途径等信息。
从而为药物的生产、医疗临床、实验研究等方面对所研究的药物做出估计与评价,对药物改进和发展做出贡献。
随着体内药物分析的深入,必将对药物和人的内在关系作出更准确的表达和描述。
体内药物分析的首要任务是为临床药学和临床实际工作提供分析数据,这就决定了其独特的分析方法。
1样品必须净化。
供分析的样品来自不同生物体,组成复杂,干扰物质多。
如体液和组织中的内源性物质的成分可以与药物结合,且干扰测定。
因此测定前需进行不同程度分离、纯化,方可进行测定。
2样品浓缩。
一般而言,能供分析的样品量较少,其中所含药物及其衍生物的量更少,实际进行的是微量分析,另外,样品不易重新获得,所以经进化后的样品还应进行必要浓缩。
3方法简便、快速和准确。
样品若是临床药物浓度监测的分析,由于工作量大,故分析方法越简单越好;若为有关科研提供数据,则要准确性高;若与中毒解救有关,则要求越迅速越佳。
4还需有一定为检测服务的仪器设备。
总之体内药物分析的首要是适合体内样品中药物的灵敏性高、选择性好、准确可靠地分析方法。
生物样品经过适当的前处理后,选择合适的方法进行定性定量分析。
常用的体内药物分析方法包括:色谱法、各种联用技术、免疫分析法、光谱分析法、放射性核素标记法和微生物法等,其中色谱法和色—质联用技术是体内药物分析的最常用方法。
1色谱法包括高效液相色谱法、气相色谱法、毛细管电泳法、薄层色谱法等,是分析混合组分最有效的方法,尤其是当色谱与质谱、色谱与核磁共振波谱联用时,更显示出其强大的分离分析、定性定量的功能。
体内药物分析

数据分析和解释
通过统计学和模型建立等方 法,对分析结果进行解释和 评估。
体内药物分析的未来发展趋势
随着技术的不断进步,体内药物分析将更加精准和高效。人工智能和大数据分析将在药物研发和个体化 用药中起到重要作用。
结论和总结
体内药物分析是现代药物研发和临床实践中不可或缺的一部分。通过准确评 估药物的代谢和药代动力学,可以实现个体化治疗和提高治疗效果。
常用的体内药物分析方法
液相色谱法
通过分离和测定药物成分,快速和准确地分析 药物浓度。
质谱法
通过分析药物的质谱图谱,检测药物的代谢产物。
免疫分析法
利用抗体和抗原的特异性反应,检测药物的含 量和浓度。
药动学分析
通过建立数学模型,研究药物在体内的吸收、 分布、代谢和排泄。
体内药物分析的应用领域
1
药物研发
体内药物分析
体内药物分析是研究药物在人体内的分布、代谢和排泄的过程。它在制药行 业和临床实践中起着至关重要的作用。
药物分析的定义
分析药物成分
通过分离和定量测量药物的化学成分,确定 药物的纯度和质量。
检测药物浓度
测定血浆或尿液中的药物浓度,评估药物的 吸收、分布和排泄。
研究药物代谢
追踪和测量药物在体内的转化和代谢途径, 了解药物的药代动力学。
监测治疗效果
评估药物治疗效果和安全性,为个体化用药 提供依据。
体内药物分析的重要性
1 个体差异
不同个体对药物的代谢和反应有所不同,体内药物分析可以实现个性化治疗。
2 疗效优化
通过监测药物浓度,调整剂量和给药方案,最大限度地发挥药物疗效。
3 安全性评估
体内药物定量分析方法的评价与认证

体内药物定量分析方法的评价与认证中国医院药学杂志1999年第3期第19卷综述作者:刘会臣单位:白求恩国际和平医院石家庄050082体内药物分析涉及的生物样品种类很多,有血清、血浆、尿液、粪便、淋巴液、唾液、胆汁、脑脊液、各种组织等。
目前,常用的各类药物有千余种,不同药物的使用剂量及体内处置过程等方面都有一定的差异,这就导致了不同药物即使在同一个体的同一组织中浓度的不同,如血药浓度从mg水平到pg水平都有;即使在同一个体内,同一种药物也会因分布不均一而使各种组织中的药物浓度不同,相差几倍到数百倍。
为了进行药物代谢动力学及生物利用度方面的试验研究,首先要建立一个合格的体内药物分析定量方法。
建立方法,应尽量了解和掌握药物理化性质及体内处置过程,主要应考虑分析测定方法灵敏度与样品中药物浓度水平相适应,参考相关文献资料并结合本实验室的实际情况,选择测定方法。
常见的体内药物定量分析方法及其特性见表1[1]。
测定方法在用于实际工作之前,须经过下列内容的评价(evaluation)和认证(validation)。
表1常用体内药物分析方法及其特性方法最低检测限(ng) 选择性UV 100 -FLU 1 +TLC-UV 10 ++TLC-FLU 1 ++GC-FID 1 ++GC-NPD 0.1 +++GC-ECD 0.01 +++GC-MS 0.001 ++++HPLC-UV 1 ++HPLC-FLU 0.1 +++HPLC-ECD 0.01 +++RIA 0.001 ++EIMT 0.001 ++FPIA 0.001 ++1选择性(selectivity)选择性表示在其它干扰组分共存的复杂样品中,准确和专一地测定待分析物的能力。
生物样品中内源性物质(蛋白质、多肽、激素、递质、类脂、色素、无机盐等)和外源性物质(合用药物、药物代谢产物、从食物中摄取的物质等),都有可能干扰待测药物的定量。
此外,生物样品在提取、浓缩、衍生化等过程中,所用试剂纯度不高,亦会影响分析方法的选择性。
体内药物分析方法的建立和验证

2)标准系列模拟生物样品高低浓度比1/10-1/20 3)同时配制空白样C=0 4)防止生物基质中加入过多溶剂,干扰测定,可将标准液和 内标液先加到试管中,蒸干后加生物基质 4.标准曲线的绘制 1)以待测物的响应值(A;h)或与内标物的响应值的比(A1/A2;h1/h2)为(y)对浓度(x),回归得y=a+bx及r。绘 制标准曲线。 2)回归分析时在至少7个浓度构成的标准曲线中,至多2个浓度点数据因确切原因“离群”,可剔出,余至少5点数据线性良好。
5.限度要求 1)标准曲线5-8浓度,最高和最低浓度比1/10-1/20 2)回归方程a应近于零,斜率b接近1或大于1,系数R接近1, HPLC R>0.99;生物学法R>0.98。 3)需分区制备标准曲线(最高和最低浓度比>100) 三)准确度 指用该法测得的生物样;样品中待测药物的浓度与其真实浓 度的接近程度。 1.测定法 取空白生物基质数份,照“标准曲线下”配制,至少选标准 曲线的高、中、低3个浓度样品。每个浓度5个平行样,每个 样测定一次。与随行的标准曲线同测定
A:比较待测物的对照品、空白生物基质、模拟生物样品的检测 信号,确证内源性物质对分析物有无干扰 B:比较的内容 Tr;n;TБайду номын сангаасR 2.代谢产物干扰 比较模拟生物样品和实际生物样品的检测信号(Tr;n;T; R),确证代谢产物对分析物有无干扰 3.配伍用药的干扰 A:比较待测药物、同时服用的药物、空白生物样本、待测药物模拟生物样品、待测药物+同时服用的药物模拟生物样品的检测信号
体内药物分析方法

甲醇 乙腈 甲醇1:2 乙腈1:1.5
(NH4)2SO4 NaCl 2.加入酸性沉淀剂
三氯醋酸 高氯酸 苦味酸等 使蛋白质分子的阳离子形成 不溶性盐而↓,pH低于等电点
3.组织酶消化法
加入酶使蛋白质水解 优点:①平衡条件下进行,可避免反应和降解
②可改善对蛋白结合率强的药物的回收率
③不产生乳化
4.其他 加热 超滤
代谢情况
3.明确测定目的、要求
目的
药浓监测 药代动力学研究
母体药物和代谢物 4.结合实验室条件 设备条件 预处理方法
三、分析方法的建立
1.纯品进行测定
确定线性范围、灵敏度、反应条件(pH、t、T) 2.空白样品测定
确定空白样品是否有干扰
3.以水代替空白样品,加标准液后测定 了解提取率、检测浓度 确定萃取条件、pH、挥发浓缩等
体内药物分析ppt课件

UV
FL
非对映衍生化
生物样品含有大量可影响测定的内源性杂质,加上服用的药物、代谢物、同时服用的其他药物,组成一个极其复杂的混合物。
如何将微量的药物从如此复杂的混合物中分离出来?
有差别才有可能分离!
(五)分离、纯化与浓集
01
02
原理:多数药物是亲脂性的,在适当的有机溶剂中的溶解度大于在水相中的溶解度,而生物样品中的大多数内源性杂质是强极性的水溶性物质(差别)。因而用有机溶剂萃取一次即可除去大部分杂质,从大量的样品中提取药物经浓集后测定。
加入酸性沉淀剂
三氯醋酸 高氯酸 苦味酸等 使蛋白质分子的阳离子形成不溶性盐而↓,pH低于等电点
02
组织酶消化法 加入酶使蛋白质水解 优点:①平衡条件下进行,可避免反应和降解 可改善对蛋白结合率强的药物的回收率 不产生乳化
其他 加热 超滤
1
2
01
02
03
酸水解 : 0.1mol/L HCl,100℃,30min, 条件较剧烈,易致药物分解,空白值也高。
对有些患者(昏迷)不能采集唾液样品。
缺点:
(二)样品的贮藏
1.血样(血浆、血清)及时分离→冷藏, -70℃加入稳定 剂NaF 2.尿样 ①尿中水、无机盐、尿素等细菌的生长, 4℃保存 ②加入防腐剂 a.1%甲苯 b.饱和氯仿 c.pH改变 3.唾液:同血样
第二节 生物样品的预处理与制备
03
缺点: 与血药浓度不相关,难以反映药物作用过程;受肾功能、pH影响;难以定时定量取样,易污染;所含成分复杂,已知其中有紫外吸收的化合物就达数十种。
04
2.尿样
01
02
唾液是无损伤性采样,易采集。 一些药物的唾液药浓(S)与血浆游离药浓(P)密切相关,因此,在TDM中可利用测定S代替P监测;唾液样品也可用于药代动力学研究。
体内药物分析方法的建立和验证

气相色谱-质谱联用法(GC-MS)
GC-MS结合气相色谱和质谱技术,可用于药物 的定性和定量分析。
毛细管电泳法(CE)
CE方法基于电解质溶液中的荧光物质的运移差 异,对药物进行定量分析。
液相色谱-质谱联用法(LC-MS)
体内药物分析方法的建立 和验证
在本次演讲中,我将介绍体内药物分析方法的重要性以及建立与验证这些方 法的步骤。我们还将探讨常见的分析方法,并分享一些实际样品分析的案例 研究。
研究目的和背景
我们的研究旨在提高体内药物分析的准确性和可靠性。了解药物在体内的代谢和排泄过程对药物疗效评估至关 重要。
建立药物分析方法的重要性
1 提高药物治疗效果
通过建立准确和可重复的药物分析方法,我们可以优化药物的剂量和给药方式,以提高 治疗效果。
2 保证药物安全性
合适的药物分析方法可以帮助我们检测潜在的药物代谢产物和有害副作用,确保药物的 安全性。
3 促进新药开发
通过建立高效的药物分析方法,我们可以更好地评估新药的代谢特性和药代动力学特征, 从而推动新药的研发。
质量控制和质量保证
我们使用建立和验证的分析方法, 在血浆样品中测定药物的浓度, 以评估药物的相应效应和剂量控 制。
通过分析代谢产物,我们可以进 一步了解药物的代谢途径和体内 转化过程,为合理用药提供支持。
使用建立和验证的分析方法,我 们能够监控药物制剂的质量并确 保合格产品的生产。
总结和展望
通过建立和验证准确可靠的药物分析方法,我们能够更好地理解药物在体内 的代谢和作用机制,并为药物治疗提供科学依据。
建立与验证方法的步骤
1
体内药物分析方法的选择与建立

体内药物分析方法的选择与建立c1、根据待测药物的理化性质选择的分析方法不合适的是()A、具有亲脂性应在适当的pH值下用溶剂萃取B、具有强极性或亲水性可进行沉淀蛋白、固相萃取、离子对萃取或衍生化后萃取等C、具有光谱或电化学特性应选择GC测定法D、对酸碱不稳定应避免使用强酸或强碱性溶剂E、对热不稳定应避免高温蒸发溶剂b2、进行极低浓度样品限度检测,要求高特异性和高灵敏度的样品分析时可选择()进行检测A、紫外分光光度计B、质量碎片选择离子检测器C、薄层扫描法D、荧光分光光度计E、氢火焰离子化检测器a3、中毒患者的临床抢救体内药物分析方法的要求是()A、药物浓度极高,不强调方法的灵敏度,要强调方法的特异性和分析速度B、不必强调方法的简便、快速C、大多采用色谱及其脱线或在线联用技术,如HPLC、LC-MSD、需同时测定原形药物和代谢产物E、应尽量简便、易行,可用于长期、批量样品的测定c4、GC与HPLC相比,在检测条件筛选时可无需考虑()A、检测器类型B、色谱柱型号、牌号、填料性状与粒经、柱长度C、流动相组分及其配比D、柱温与进样量E、内标物质的浓度及其加入量d5、下列关于分离条件的筛选叙述错误的是()A、在进行分离条件筛选时,应考察生物基质中的内源性物质及代谢产物对分离与检测的干扰B、筛选步骤:空白溶剂试验—空白生物基质试验—模拟生物样品试验—实际生物样品测试C、空白生物基质在待测药物(或特定的活性代谢物、内标物质等)的“信号窗”(信号附近的有限范围)内不应出现内源性物质信号D、模拟生物样品试验需经化学反应的预处理过程,应不干扰药物的测定E、确立分析方法后,可进行实际生物样品的测试,进一步验证方法的可行性。
体内药物分析方法的建立和验证护理课件

多组分同时检测
未来体内药物分析将更加注重多 组分同时检测,以全面了解药物
在体内的代谢和分布情况。
体内药物分析方法面临的挑战与机遇
挑战
随着药物种类和数量的增加,体内药物分析的复杂性也在增加,对分析方法的要求也越来越高。同时, 由于人体内环境的复杂性和动态变化,准确测定药物及其代谢物在体内的浓度和行为仍具有很大挑战 性。
机遇
随着新技术的不断涌现,如质谱技术、核磁共振技术等,为体内药物分析提供了更多的手段和工具, 使得更深入地了解药物在体内的行为成为可能。同时,随着临床对个体化治疗的需求增加,体内药物 分析在指导临床用药、评估治疗效果等方面的应用也将更加广泛。
体内药物分析方法未来的发展方向
跨学科融合
体内药物分析将与生物学、 医学、化学等多个学科进 行交叉融合,形成更全面、 系统的研究体系。
体内药物分析方法的 建立和验证护理课件
• 药物分析方法概述 • 体内药物分析方法建立 • 体内药物分析方法验证 • 体内药物分析方法的应用和案例
分析 • 体内药物分析方法的未来发展与
展望
01
药物分析方法概述
药物分析的定义和重要性
药物分析的定义
药物分析是对药物进行全面分析 的过程,旨在了解药物在体内的 性质、行为和作用。
个体化与精准医疗
随着个体化医疗的发展, 体内药物分析将更加注重 个体差异,为精准医疗提 供有力支持。
新技术应用
新技术如人工智能、大数 据等将在体内药物分析中 发挥重要作用,提高分析 的智能化和精准度。
感谢观看
药物分析方法的建立和验证过程
建立药物分析方法
根据研究目的和实验要求,选择合适的分析方法,建立可靠的检测方法和技术。
体内药物分析方法(精)

1. 标准曲线的建立 (1) 系列标准溶液: n≥6(不包括0点); 等比系列(2~3);
通常为100~1000倍
(2) 内标溶液: 浓度相当于系列标准溶液的几何平均浓度 (二 ) (3) 系列标准样品 : 空白生物介质, 加入系列标准溶液 (4) 标准曲线的绘制: 药物浓度, 以单位体积(如血浆)或
①辅助试剂的使用 乙醚(1.2%水): 氯化钠 ②混合溶剂的使用
溶剂 正己烷 环己烷
紫外截止波长 (nm) 210 210
沸点(℃) 69 81
甲苯
↓ 极 性 增 加 ↓ 异丙醚* 乙醚* 醋酸戊酯
285
220 220 285
111
68 35 149
三氯甲烷
甲基异丁基酮 醋酸乙酯 正丁醇
245
230 260 215
(4) 自动化固相萃取法
对于单个样品处理, SPE操作省时 对于大量样品的处理 半自动SPE: 萃取过程机械化
全自动化仪器: 通过柱切换技术
实现固相萃取与HPLC联用
(5) 自动化固相萃取法 柱切换: 固相萃取-LC/MS/MS
3. 超滤法 ultrafiltration是一种膜分离技术
体液
血液; 唾液
脑脊液;胃液; 胆汁;乳汁;精 液;泪液
排泄物
尿液
粪便; 汗液
组织
胃;肠;肝;肾;肺, 脑;肌肉;头发
二、体内样品的采集与制备
1. 血样的采集
静脉, 1-5ml ≤1/10 TDM测定S代替P 进行临床监测
50-60% 2. 血浆的制备
抗凝剂, 1000g离心 5-10min 淡黄色上清液
提取1次
若提取回收率较低(低于50%), 提取2~3次 脂溶性干扰物, 可进行小体积水溶液反提取
体内药物分析实验教学方法实践初探_杨燕云

197第15卷 第7期 2013 年 7 月辽宁中医药大学学报JOURNAL OF LIAONING UNIVERSITY OF TCMVol. 15 No. 7 Jul .,20134.2 类比要简单明了,形象生动,通俗易懂发掘教材中的类比因素,掌握丰富的类比资料。
教材、教参上的类比例子不多,教师在备课时有意识地发掘类比因素,把平时积累的类比资料选入教案,有的放矢。
否则,只凭课堂上的灵感,随便举例,打比方,不会有好的教学效果[8-10]。
类比过程中不可选取复杂的事物去比拟抽象的知识,也尽量不要选用难于理解或者很多人都不知道的现象去进行类比。
因此,类比法应用过程中避免将问题反而复杂化、模糊化。
简单明了是为了突出相比点,形象生动是为了让同学们在比较轻松的氛围中理解难懂的知识,这样的类比使学生茅塞顿开,收到很好教学效果。
4.3 把握好应用尺度类比教学是手段不是目的,只能起到过渡启发认知作用。
在使用时,不应在类比的对象本身上作过多的描述和渲染,以免喧宾夺主。
如果类比运用不恰当,则不但无助于问题的解决,反而会增加问题的抽象和难懂,使学生对概念、知识点造成更大的误解。
这就要求教师必须注意各种不同事物之间的同一性与差异性,只有这样,才能使学生更好地加深对所学内容的理解。
另外,对于本身就比较直观的知识,如果运用类比,反而显得啰嗦,使教学重点得不到突出,所以还要避免机械类比的错误。
总之,只要教师在生理学教学过程中把握好类比教学法的应用尺度,巧设类比,并结合其它教学方法,创设类比教学情境,可以改善生理学教学中课堂枯燥、难懂、难记的情况,增加课堂教学的趣味性和可听性,能更好的激发学生的学习兴趣,引导学生积极探究、自主学习,使其更好的掌握和理解生理学这门专业基础课程,同时又能培养了学生分析问题、解决问题和应用知识的能力。
◆参考文献[ 1 ] 袁希娟,龚耘.浅谈类比法[ J ] .河北理工学院学报:社会科学版,2003,3 ( 1 ):84-88.[ 2 ] 曹瑞.类比教学法初探[ J ] .宁波大学学报:教育科学版,2011,33 ( 6 ):5-8.[ 3 ] 曹瑞.类比教学法的研究与应用[ J ] .教学与管理,2011 ( 9 ):128-129.[ 4 ] 钱会南.案例式教学法在《内经》教学中运用的必要性[ J ] .中华中医药学刊,2012,29 ( 10 ):2169.[ 5 ] 李洪文,黄玉焕.类比法在解剖学教学中的应用 [ J ] .基层医学论坛,2009,14 ( 2 ):178-179.[ 6 ] 宋琳,谢宁,刘华生,等.PBL 教学方法在《中医基础理论》教学应用中的几点体会[ J ] .中华中医药学刊,2012,29 ( 4 ):835.[ 7 ] 郑旭锐,李长秦,董正华,等.案例式教学法在2010级中医创新实验班《温病学》教学中的应用[ J ] .河北中医,2012,34:155.[ 8 ] 潘丽红.类比教学法在医学免疫学理论教学中的应用[ J ] .井冈山学院学报:自然科学版,2009,30 ( 10 ):159-160.[ 9 ] 张慧卿,杨延龙,辛海量,等.《中药学》系统化教学模式的探索[ J ] .中华中医药学刊,2012,29 ( 5 ):1119.[ 10 ] 王华楠,毛兵,李宁.以案例引子为基础的中医学共享探究性建构学习的课堂教学模式探讨[ J ] .河北中医,2012,34:639.体内药物分析(Biopharmaceutical analysis)是药物分析学的重要分支,是一门研究生物机体中药体内药物分析实验教学方法实践初探杨燕云,许亮,张振秋,何凡,王静,英锡相(辽宁中医药大学药学院,辽宁 大连 116600)摘 要:论述了实验教学内容的选择应该与应用相联系,强调了实验规范操作的重要性,突出实验思路培养以及方法学研究是为实验课核心,初步探讨了体内药物分析实验教学的教学思路。
药物定量分析与分析方法验证

方法验证的内容与步骤
准确度
通过对比已知浓度的样品测量值 与真实值,评估方法的准确度。
精密度
通过多次测量同一样品,评估方 法的重复性和再现性。
专属性
验证方法是否能够区分目标成分 与其他物质的干扰。
耐用性
验证方法在不同条件下的稳定性 及变化程度。
范围
验证方法适用的浓度范围。
线性
验证方法在一定浓度范围内的响 应是否呈线性关系。
响应值应无明显交叉干扰,能够准确区分目标物质与杂质。
专属性验证结果
根据响应值判断分析方法的专属性是否符合要求。
检测限与定量限验证
检测限与定量限验证方法
逐渐降低样品浓度,观察信号响应值的变化。
检测限与定量限验证要求
检测限和定量限应满足预设的灵敏度要求。
检测限与定量限验证结果
根据信号响应值判断分析方法的检测限与定 量限是否符合要求。
分析方法验证的意义
分析方法验证是确保药物定量分析结果准确可靠的重要手段。通过验证,可以证明所选用 的分析方法适用于该药物的分析,并确保其在各种条件下的稳定性和可靠性。
当前发展状况
随着科学技术的发展,药物定量分析的方法和技术也在不断进步。目前,高效液相色谱法 、气相色谱法和质谱法等先进技术已被广泛应用于药物定量分析中,大大提高了准物质进行多次测定,计算相对标准偏 差(RSD)。
精密度验证要求
RSD应符合预设的接受范围,通常不超过±5%。
精密度验证结果
根据RSD大小判断分析方法的精密度是否符 合要求。
专属性验证
专属性验证方法
采用具有相似结构或相同成分的物质进行测定,比较其响应值。
专属性验证要求
中药有效成分的定量分析
中药是我国传统医学的重要组成部分, 中药有效成分的定量分析对于确保中 药质量和临床疗效具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•2020/5/26
•24
•第四章 分析方法的建立与验证 •第三节 分析方法的验证与要求
验证的效能指标与基本要求
1.特异性——避免干扰 2.标准曲线与线性范围——覆盖所有浓度范围 3.准确度——与实际状况相符 4.精密度——结果可重现 5.定量限——达到峰浓度的1/10~1/20 6.稳定性——确保所有样品准确测定 7.提取回收率——确保准确度
•2020/5/26
•6
•第四章 分析方法的建立与验证 •第一节 分析方法的设计依据
二、分析测定的目的与要求
体内药物分析的目的——影响分析方法的应用
药代动力学——研究药物在体内吸收、分布、代谢和排泄过程 ——血浆浓度随时间的变化过程;代谢途径及代谢产物
要求 ——同时测定原形药物和代谢产物 检测 ——宽线性范围(Cmax~Cmax的1/20)、高灵敏度(10-9g/ml)和高专属
——需经化学反应的预处理过程,若预处理过程仅为生物样品 的提取分离,则可不进行该步骤,直接进行空白生物基质试验
•2020/5/26
•18
2. 空白生物基质试验
•第四章 分析方法的建立与验证 •第二节 分析方法的建立步骤
空白生物基质 (blank biological matrix) ——如空白血浆 ——照 “1. 空白溶剂试验” 项下方法操作
分析方法的建立和验证过程——是不可截然划分的 ——为便于讨论而分别叙述
分析方法的建立步骤 ➢ 第一步:检测条件的筛选 ➢ 第二步:分离条件的筛选
•2020/5/26
•14
(一)检测条件的筛选
•第四章 分析方法的建立与验证 •第二节 分析方法的建立步骤
标准物质 —— 照拟定的分析方法(不包括生物基质的预处理)测定
以血浆或血清为分析样品 采用蛋白沉淀-溶剂萃取预处理技术 ——分析样品较为“干净”,可用HPLC检测
用RIA分析 ——样品的预处理方法可较为粗放 ——经过简单的蛋白沉淀或不经任何预处理直接测定
•2020/5/26
•9
四、实验室条件
•第四章 分析方法的建立与验证 •第一节 分析方法的设计依据
在设计体内药物分析方法时,还应充分考虑 到实验室现有的或有可能在其它实验室使用的仪 器装备,合理选择可行的分析方法。
生物样品中的药物浓度——决定分析方法的首要因素 生物样品中药物或其特定代谢产物的浓度低、样品量少
——难以通过增加取样量提高方法灵敏度 ——通过选择适当的分析方法适应样品分析需求 体内药物分析中常用分析方法——特点见表4-1
•2020/5/26
•12
二、分析方法的建立
•第四章 分析方法的建立与验证 •第二节 分析方法的建立步骤
•2020/5/26
•25
•第四章 分析方法的建立与验证 •第三节 分析方法的验证与要求
一、方法特异性(专属性或选择性)
方法的特异性(specificity)
——又称专属性或专一性,通常与选择性(selectivity)互用
——系指当有内源性物质存在时,方法准确测定待测物质的能力
专属性——表示所检测的信号(响应)系属于待测药物所特有的
结构已知的特定活性代谢物的测定
——必要时通过HPLC-DAD和LC-MS确证色谱峰的单纯性和同一性
对于结构未知的代谢产物的测定
——可采用LC-LC-NMR进行结构的初步推测后,考察其干扰情况
•2020/5/26
•28
3. 伍用药物的干扰
•第四章 分析方法的建立与验证 •第三节 分析方法的验证与要求
—— 确定最佳分析检测条件(如色谱条件)和检测灵敏度
HPLC —— 调整检测器(类型、条件)
色谱柱(型号、牌号、填料性状与粒经、柱长度)
流动相(组分及其配比)及其流速
柱温、进样量、内标物质的浓度及其加入量等
—— 使各物质具有足够的方法灵敏度(LOQ)
良好的色谱参数(n、R、T)
适当的保留时间(tR)
•2020/5/26
•3
•第四章 分析方法的建立与验证 •第一节 分析方法的设计依据
一、待测药物的理化性质及体内存在状况
准确测定生物样品中的药物或其特定代谢物 ——预处理——待测物从结合物或缀合物中释
放 选择样品预处理方法——首先应考虑
——待测药物的理化性质 ——药物在生物体内的存在状况 ——药物在生物体内的生物转化(代谢)途径
确证——内源性物质对分析方法有无干扰
•2020/5/26
•27
2. 代谢产物的干扰
•第四章 分析方法的建立与验证 •第三节 分析方法的验证与要求
比较——模拟生物样品和用药后的实际生物样品的检测信号
与代谢产物(在实际样品中 tR 随时间延长而增加)的 R 如HPLC色谱峰的 tR、n 和 T 〔或改变色谱条件(色谱柱)再比较〕 确证——其它代谢产物对分析方法有无干扰
实际生物样品——确立分析方法后,尚需进行实际生物样品的测试 考察目标 ——代谢产物对药物、内标物质的干扰情况
——进一步验证方法的可行性
•2020/5/26
•22
•第四章 分析方法的建立与验证
第三节 分析方法 验证的内容与要求
用于实际生物样品分析之前
——验证 (validation) 分析方法的可行性与可靠性
选择性——系指将待测物质与其代谢物及同服的其它药物加以区
分(分离)的能力
特异性——函盖二者,以验证所测定的物质与待测药物的同一性
考察一个分析方法是否具有特异性,应着重考虑以下几点:
•2020/5/26
•26
1. 内源性物质的干扰
•第四章 分析方法的建立与验证 •第三节 分析方法的验证与要求
比较——待测药物或其活性代谢产物检测信号 对照品(或标准品) 空白生物基质 模拟生物样品(空白生物基质中添加对照品) ——如HPLC色谱峰的 tR、n 和 T 是否一致 及与内源性物质色谱峰的 R
TDM 时 ——还要考虑患者可能同时服用药物(通常为数有限)的干扰
比较——待测药物及可能同时服用药物的模拟生物样品的检测信号 ——如HPLC色谱峰的 tR、n 和 T 是否一致
➢ 分析方法建立之前
查阅文献资料——充分了解药物在体内的动力学过程,使所 拟定的分析方法
——避免受到代谢产物的干扰适用于实际生物样品测定
•2020/5/26
•13
二、分析方法的建立
•第四章 分析方法的建立与验证 •第二节 分析方法的建立步骤
➢ 初步拟定分析方法后 进行一系列试验工作——选择最佳分析条件 同时验证分析方法的可行性——确认是否适用于实际生物样品
考察目标 ——方法的线性范围、精密度与准确度、灵敏度 药物的萃取回收率等各项技术指标 ——同时进一步检验生物基质中内源性物质以及可能共同使用的
其他药物对测定的干扰程度,即方法特异性
•2020/5/26
•20
色谱分析法
•第四章 分析方法的建立与验证 •第二节 分析方法的建立步骤
——进一步考察待测药物(或内标物)与内源性物质(或其它药物)的 分离情况
考察目标 ——生物基质中内源性物质对测定的干扰(方法特异性) ——在待测药物(或特定的活性代谢物、内标物质等)的“信号窗
”(信号附近的有限范围)内不应出现内源性物质信号
•2020/5/26
•19
3. 模拟生物样品试验
•第四章 分析方法的建立与验证 •第二节 分析方法的建立步骤
模拟生物样品(质量控制,QC样品)——空白生物基质中加入待测药物 ——照 “1. 空白溶剂试验” 项下方法操作
中毒患者的临床抢救 药物浓度极高
方法——不必强调方法的灵敏度,强调方法的特异性和分析速度 ——大多采用色谱及其联用技术GC、GC-MS、RIA或EIA
•2020/5/26
•8
•第四章 分析方法的建立与验证 •第一节 分析方法的设计依据
三、生物样品的类型与预处理方法
生物样品的类型与预处理方法——决定分析方法的应用
•2020/5/26
•16
1.空白溶剂试验
•第四章 分析方法的建立与验证 •第二节 分析方法的建立步骤
待测药物的非生物基质溶液(通常为水溶液) ——采用拟定的分析方法进行衍生化反应、萃取分离等 样品预处理(反应试剂、衍生化试剂、萃取溶剂等) ——测定响应信号(如HPLC峰面积或峰高)
考察目标 ——方法的特异性 ——空白值应尽可能小,并能有效校正
•2020/5/26
•15
(二)分离条件的筛选
•第四章 分析方法的建立与验证 •第二节 分析方法的建立步骤
在进行分离条件筛选时,应考察生物基质中的内源性物质及代谢 产物对分离与检测的干扰,步骤如下:
1.空白溶剂试验 ——溶剂(方法特异性) 2.空白生物基质试验 —— endogenous compounds(方法特异性) 3.模拟生物样品试验 —— 方法效能指标 4.实际生物样品测试 —— 代谢产物(方法特异性)
体内药物分析方法的建 立与验证
2020年5月26日星期二
本章内容提要
•第四章 分析方法的建立与验 证
分析方法的设计依据 分析方法建立的一般步骤 分析方法验证的内容与要求 体内药物分析应用示例
•2020/5/26
•2
•第四章 分析方法的建立与验证
第一节 分析方法的设计依据
建立分析检测方法的主要依据 ➢ 待测药物的理化性质及在生物体内的存在状况 ➢ 分析测定的目的与要求 ➢ 生物样品的类型与预处理方法 ➢ 实验室条件
•2020/5/26
•5
•第四章 分析方法的建立与验证 •第一节 分析方法的设计依据
(二)待测药物的体内存在状态
与血浆蛋白结合的强弱及结合率的高低 ——分离萃取方法 蛋白结合较强——不宜直接采用溶剂萃取
