BD FACSCalibur流式细胞仪简易操作步骤_corr_ZYH_20140520
BDFACSCalibur流式细胞仪简明操作规程

BD FACSCalibur流式细胞仪简明操作规程一.开机程序1.把稳压器电源开关设到ON。
2.打开储液箱,把黑色开关开到TANK CHANGE位置,鞘液桶加满鞘液,倒空废液桶,把黑色开关开到Pressurize位置。
3.将FACSCalibur右侧下面的绿色按钮按开。
4.打开电脑。
二.仪器条件设定1.点击“苹果”菜单项下的CELLQuest,建立一个新视窗。
2.点击“Acquire”菜单下的“Parameter description”建立自己的文件夹,保留在屏幕上。
3.点击“Acquire”菜单下的“Connect to Cytometer”联机,这时出现“Acquisiton Control”对话框,保留在屏幕上。
4.点击“Cytometer”菜单下的“Detectors/Amps”、“Threshold”、“Compensation”三个对话框,保留在屏幕上。
5.点击“Cytometer”菜单下的“Instrument settings”,出现对话框,点击对话框中“open”,选择自己的实验条件后,点击“set”,然后点击“Done”6.加上对照样本,样品支撑架置于中位,用LO 流速RUN,点击AcqusiotionControl 对话框的Acquire,观察样品的散射光和荧光参数是否合适,调节“Detectors/Amps”对话框的相关参数,直到各个参数都合适为止。
7.点击”Acqusiotion Control”对话框的“Setup”,开始测试样品。
当所有样品分析完毕,即换上双蒸水,并将流式细胞仪置于“STANDBY”状态,以保护激光管。
三.关机程序1.测试完毕样品后,从File中选择Quit, 退出软件,点击“Special”菜单项下的“Shutdown”关机。
2.试管中加入3 ml Clean液,将样品支撑架置于旁位清洗外管,以外管吸入1ml Clean液,将样品支撑架置于中位,用HI流速RUN5分钟清洗内管,。
BD-FACSCalibur流式细胞仪操作手册

BD FACSCalibur流式细胞仪FACS101 Handbook本课程介绍「表面抗原流式分析」有关之基础工作原理。
如希望进一步了解流式细胞技术应用,请至本公司网站订阅FACSinformation电子报www.bdtwn。
com.tw/bdb/index.html。
如需要本课程手册,欢迎至本公司网站下载。
tw/bdb/10-5—3-1。
html . 如需要免疫荧光染色方法,请至本公司网站下载www。
bdtwn。
com。
tw/bdb/10—5-4—1.html。
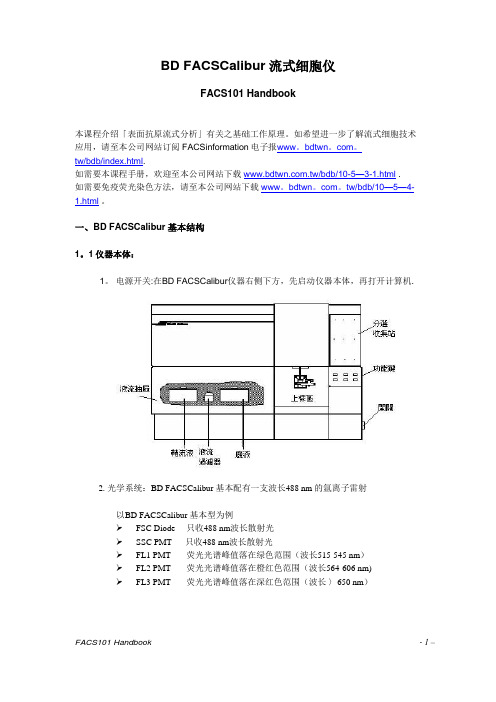
一、BD FACSCalibur基本结构1.1仪器本体:1. 电源开关:在BD FACSCalibur仪器右侧下方,先启动仪器本体,再打开计算机。
2。
光学系统:BD FACSCalibur 基本配有一支波长488 nm 的氩离子雷射以BD FACSCalibur 基本型为例➢FSC Diode 只收488 nm波长散射光➢SSC PMT 只收488 nm波长散射光➢FL1 PMT 荧光光谱峰值落在绿色范围(波长515-545 nm)➢FL2 PMT 荧光光谱峰值落在橙红色范围(波长564—606 nm)➢FL3 PMT 荧光光谱峰值落在深红色范围(波长 >650 nm)3。
仪器面板:仪器前方面板的右下方有三个流速控制键、及三个功能控制键。
流速控制:LO:样品流速:12 μl /minMED:样品流速:35 μl /minHI: 样品流速:60 μl /min功能控制:•RUN:此时上样管加压,使细胞悬液从进样针进入流动室.(正常显示绿色;黄色时表示仪器不正常,请检查是否失压。
)•STANDBY:无样品或暖机时之正常位置,此时鞘液停止流动,雷射功率自动降低。
•PRIME:去除流动室中的气泡,流动室施以反向压力,将液流从流动室冲入样品管,持续一定时间后,以鞘液回注满流动室。
PRIME 结束,仪器恢复STANDBY状态.4. 储液箱抽屉:在主机左下方之储液箱抽屉。
BD-FACSCalibur 流式细胞仪-细胞周期-操作步骤

BD/FACSCalibur流式细胞仪检测细胞周期操作步骤1、先给鞘液桶接超纯水。
2、把鞘液桶装上,拧紧。
3、开左边开关,从右向左依次打开,即总电源插头-交流稳定电压-插板-稳定输出电源。
(关机时从左向右关)。
4、按流式细胞仪开关。
换上新的已装超纯水的流式管。
5、将减压阀调至“run”(水缸旁边的黑色按钮)。
6、排气:将白色的手动排气阀从小头向大头移动,排气,2-3次,至无气泡。
最后停至小头。
自动排气:开始时是“低速”“standby”,调至“低速”“prime”,待排气完成会自动跳到“standby”,如此循环,到流式管内无气泡为止。
7、插电脑白色插头,打开电脑。
8、到无气泡时候调到“hign”“run”。
9、输入开机密码,打开电脑桌面上的“CELLQuest”(第四个图标)启动软件。
File→open Document→date→先找到打开自己之前的文件(cell dw 2018LSD)→Acquire→Connect to Cytometer→Acquisition面板中点击“change”修改文件名和日期,count改成1,即从第一个开始。
10、Acquire→counters→点击下面Acquisition control面板中的Acquire,看是否正常。
11、上样。
使仪器处于low run状态,样品管支架左移,上样品管后支架回位。
确认Acquisition control 窗口中Setup前需打勾(即不收集数据,用于仪器设置),点击Acquire。
仪器设置完成后,取消Setup前的“√”,点击Acquire 正式开始收集数据。
调界面操作:Cytometer → Detectors/Amps出现 Detectors/Amps 界面后,调FSC和SSC和FL2和FL2-W。
FSC调节的是门内(R1)细胞位置的左右,FSC的“Voltage”调到“E-1”,“E-1”是指个体很大细胞;“Amo Gain”的值调节门内(R1)细胞位置的宽度。
BD FACSCalibur流式细胞术标准操作规程

BD FACSCalibur流式细胞仪操作与维护程序目的:规范BD FACSCalibur流式细胞仪操作与维护程序,正确使用设备,保证实验顺利进行、操作人员人身安全和设备安全。
适用范围:本规程适用于BD FACSCalibur流式细胞仪的使用操作。
责任者:操作人员:负责按照本规程操作仪器设备,对仪器进行日常维护,并作使用记录。
保管人员:负责监管仪器操作是否符合规程,并对仪器进行定期维护、保养。
科室负责人:负责对仪器设备的综合管理。
内容:1. 每日开机程序1.1 在气压阀减压的状态下检查鞘液桶,确认:1.1.1鞘液充满状态,约3L1.1.2盖紧盖子1.1.3安上金属挡板1.1.4管路畅通,无扭曲1.2. 检查废液桶,确认:1.2.1废液桶充满400ml漂白剂1.2.2管路畅通,无扭曲1.3打开流式细胞仪。
1.4打开电脑。
1.5气压阀置于加压位置,并排除管路中气泡。
1.6做Prime。
1.7等待机器预热5~10分钟后可开始试验。
2. 每日关机程序2.1 用3mlFACSClean洗液加入样品管中上样,将样品支撑架置于旁位,以外套管吸入1ml。
2.2 将样品支撑架置于中位,以HI RUN运行10分钟,使内管吸入约1ml。
2.3 将样品管换成蒸馏水重复1-2步。
2.4 放置盛有1ml蒸馏水的试管于样品支撑架上。
2.5 选择Standby模式10分钟,将激光冷却后可关掉主机。
2.6 退出所有应用软件,关闭电脑。
2.7 将流式细胞仪的压力阀置于减压状态。
3. 每月维护程序3.1 将FACSClean洗液1~2L装入鞘液桶。
3.2 旁路鞘液过滤器(过滤器上的快速接口从SANLINE FILTER端断开,将鞘液白色管路液路取下联到SANLINE FILTER端口),以防伤害。
3.3 将盛有3ml FACSClean洗液的试管置于样品支架上,以HI RUN 30分钟。
3.4 将鞘液和样品换成蒸馏水重复步骤3,以 HI RUN 60分钟。
BD_FACSCalibur流式细胞仪操作手册
BD FACSCalibur流式细胞仪FACS101 Handbook本课程介绍「表面抗原流式分析」有关之基础工作原理。
如希望进一步了解流式细胞技术应用,请至本公司网站订阅FACSinformation电子报www。
bdtwn。
com。
tw/bdb/index.html.如需要本课程手册,欢迎至本公司网站下载/bdb/10-5—3-1.html .如需要免疫荧光染色方法,请至本公司网站下载www。
bdtwn。
com。
tw/bdb/10—5—4-1.html。
一、BD FACSCalibur基本结构1。
1仪器本体:1。
电源开关:在BD FACSCalibur仪器右侧下方,先启动仪器本体,再打开计算机.2. 光学系统:BD FACSCalibur 基本配有一支波长488 nm 的氩离子雷射以BD FACSCalibur 基本型为例➢FSC Diode 只收488 nm波长散射光➢SSC PMT 只收488 nm波长散射光➢FL1 PMT 荧光光谱峰值落在绿色范围(波长515-545 nm)➢FL2 PMT 荧光光谱峰值落在橙红色范围(波长564-606 nm)➢FL3 PMT 荧光光谱峰值落在深红色范围(波长〉650 nm)3。
仪器面板:仪器前方面板的右下方有三个流速控制键、及三个功能控制键。
流速控制:LO:样品流速:12 μl /minMED:样品流速:35 μl /minHI:样品流速:60 μl /min功能控制:•RUN:此时上样管加压,使细胞悬液从进样针进入流动室.(正常显示绿色;黄色时表示仪器不正常,请检查是否失压。
)•STANDBY:无样品或暖机时之正常位置,此时鞘液停止流动,雷射功率自动降低。
•PRIME:去除流动室中的气泡,流动室施以反向压力,将液流从流动室冲入样品管,持续一定时间后,以鞘液回注满流动室。
PRIME 结束,仪器恢复STANDBY状态。
4。
储液箱抽屉:在主机左下方之储液箱抽屉。
流式细胞仪操作步骤(FACSCalibur)

一、开机程序:1.检查鞘液桶和废液桶。
确认鞘液充满状态(鞘液为鞘液桶体积的3/4位置,可以连续工作3个小时左右)、盖紧黑盖、管道畅通、废液桶有足够空间容纳本批标本排弃的废液。
如果要添加鞘液,要先释放鞘液桶中气压。
2.依次打开流式细胞仪FACSCalibur稳压器、主机开关、电脑开关,打印机。
3.气压阀置于加压位置,待流式细胞仪处于STANDBY状态,做Prime,以排除管路中气泡。
二、运行FACSComp软件、检查仪器状况1.制备三色标准微球样本。
一般情况向1ml鞘液(或过滤PBS)中加入1滴质控小微球,也可以根据实际情况调节浓度。
2.机器预热5 min,打开FACSComp软件,选择保持路径。
选择所需校正内容,如果使用的微球是新一批产品要输入微球的批号。
3.在软件界面左侧Assay Selection选项中选择质控类型,即实验过程中是否需要清洗样品。
4.上样品,微球溶液上样之前要充分混匀。
功能键设置在“RUN”。
5.仪器自动检查,并做电压、补偿等设置。
6.FACSComp软件运行完毕,显示结果通过测试。
7.做Set up。
8.打印校正结果,退出FACSComp程序。
备注:在质控过程中,如果提示收集细胞速度慢可以提高细胞收集速度,但是在调节灵敏度(Sens)时,一定要用“Low”的状态上样,保证仪器灵敏度的准确。
在使用仪器过程中要养成好的习惯,在上样品过程中,仪器保持在“Low”“Standby”状态。
三、样品分析软件:CellQuest Pro软件,选择“联机”。
1.(2)对实验样本进行命名;(3)对实验通道进行预设(FSC,SSC,FL1-FL4)。
备注:如果界面被关闭,重新调出步骤:2.调出质控模板。
3.画图选择画图工具(一般选择散点图),Inspect界面会自动弹出,对几选中图形),将更改横纵坐备注:第一个散点图横坐标为FSC,纵坐标为SSC。
(1一般获取10000个细胞。
(2(3)将所有补偿调为0(4)将非52(5)FSC和SSC(64.上阴性对照将阴性对照管混匀,上机,功能键设置在“RUN”,散点图出现细胞信号,第一个图:让细胞信号出现在自己看上去舒服的区域;其他三个散点图,要将细胞信号调整到阴性区域,即左下角区域。
流式细胞仪操作步骤(FACSCalibur)

流式细胞仪操作步骤(FACSCalibur)一、开机程序:1.检查鞘液桶和废液桶。
确认鞘液充满状态(鞘液为鞘液桶体积的3/4位置,可以连续工作3个小时左右)、盖紧黑盖、管道畅通、废液桶有足够空间容纳本批标本排弃的废液。
如果要添加鞘液,要先释放鞘液桶中气压。
2.依次打开流式细胞仪FACSCalibur稳压器、主机开关、电脑开关,打印机。
3.气压阀置于加压位置,待流式细胞仪处于STANDBY状态,做Prime,以排除管路中气泡。
二、运行FACSComp软件、检查仪器状况1.制备三色标准微球样本。
一般情况向1ml鞘液(或过滤PBS)中加入1滴质控小微球,也可以根据实际情况调节浓度。
2.机器预热5 min,打开FACSComp软件,选择保持路径。
选择所需校正内容,如果使用的微球是新一批产品要输入微球的批号。
3.在软件界面左侧Assay Selection选项中选择质控类型,即实验过程中是否需要清洗样品。
4.上样品,微球溶液上样之前要充分混匀。
功能键设置在“RUN”。
5.仪器自动检查,并做电压、补偿等设置。
6.FACSComp软件运行完毕,显示结果通过测试。
7.做Set up。
8.打印校正结果,退出FACSComp程序。
备注:在质控过程中,如果提示收集细胞速度慢可以提高细胞收集速度,但是在调节灵敏度(Sens)时,一定要用“Low”的状态上样,保证仪器灵敏度的准确。
在使用仪器过程中要养成好的习惯,在上样品过程中,仪器保持在“Low”“Standby”状态。
三、样品分析软件:CellQuest Pro1.软件,选择“联机”。
Acq Connect(1)在弹出的界面中的选择数据存储路径(Directory 菜单);(2) 对实验样本进行命名;(3) 对实验通道进行预设(FSC,SSC,FL1-FL4)。
备注:如果界面被关闭,重新调出步骤:2.调出质控模板。
3. 画图 选择画图工具(一般选择散点图),Inspect 界面会自动弹出,对几够选中图形),将 改为 ,更改横纵备注:第一个散点图横坐标为FSC ,纵坐标为SSC 。
BD_FACSCalibur流式细胞仪操作手册

一、BD FACSCalibur 基本结构
1.1 仪器本体: 1. 电源开关:在BD FACSCalibur仪器右侧下方,先启动仪器本体,再打开计算机。
2. 光学系统:BD FACSCalibur 基本配有一支波长488 nm 的氩离子雷射 以BD FACSCalibur 基本型为例 FSC Diode SSC PMT FL1 PMT FL2 PMT FL3 PMT 只收488 nm波长散射光 只收488 nm波长散射光 荧光光谱峰值落在绿色范围(波长515-545 nm) 荧光光谱峰值落在橙红色范围(波长564-606 nm) 荧光光谱峰值落在深红色范围(波长 >650 nm)
9. 在工具板中选择四象限工具,在 FL1/FL2 散点图上拖动 Quadrant 的中心将它设 定在(x,y)=(101,101)处,这些象限将指定阴性/阳性区域。
建立仪器和计算机之间通讯 10. 从 Acquire 菜单中选择 Connect to Cytometer,此时会出现 Acquisition Control 对话方框。如果无法选择 Connect to Cytometer,参考秘技 #1。如果没见到 Acquisition Control 对话,可到屏幕上方 Windows 菜单中选择 Show Acquisition Control。
功能控制:
RUN:此时上样管加压,使细胞悬液从进样针进入流动室。(正常显示绿 色;黄色时表示仪器不正常,请检查是否失压。) STANDBY:无样品或暖机时之正常位置,此时鞘液停止流动,雷射功率 自动降低。 PRIME:去除流动室中的气泡,流动室施以反向压力,将液流从流动室冲 入样品管,持续一定时间后,以鞘液回注满流动室。PRIME 结束,仪器 恢复 STANDBY 状态。
BD_FACSCalibur流式细胞仪操作手册

BD FACSCalibur流式细胞仪FACS101 Handbook本课程介绍「表面抗原流式分析」有关之基础工作原理。
如希望进一步了解流式细胞技术应用,请至本公司网站订阅FACSinformation电子报www.bdtwn。
com。
tw/bdb/index.html。
如需要本课程手册,欢迎至本公司网站下载。
tw/bdb/10—5-3—1。
html . 如需要免疫荧光染色方法,请至本公司网站下载www。
bdtwn。
com.tw/bdb/10-5—4—1.html .一、BD FACSCalibur基本结构1.1仪器本体:1。
电源开关:在BD FACSCalibur仪器右侧下方,先启动仪器本体,再打开计算机。
2。
光学系统:BD FACSCalibur 基本配有一支波长488 nm 的氩离子雷射以BD FACSCalibur 基本型为例➢FSC Diode 只收488 nm波长散射光➢SSC PMT 只收488 nm波长散射光➢FL1 PMT 荧光光谱峰值落在绿色范围(波长515-545 nm)➢FL2 PMT 荧光光谱峰值落在橙红色范围(波长564—606 nm)➢FL3 PMT 荧光光谱峰值落在深红色范围(波长 >650 nm)3。
仪器面板:仪器前方面板的右下方有三个流速控制键、及三个功能控制键.流速控制:LO:样品流速:12 μl /minMED:样品流速:35 μl /minHI: 样品流速:60 μl /min功能控制:•RUN:此时上样管加压,使细胞悬液从进样针进入流动室.(正常显示绿色;黄色时表示仪器不正常,请检查是否失压。
)•STANDBY:无样品或暖机时之正常位置,此时鞘液停止流动,雷射功率自动降低。
•PRIME:去除流动室中的气泡,流动室施以反向压力,将液流从流动室冲入样品管,持续一定时间后,以鞘液回注满流动室。
PRIME 结束,仪器恢复STANDBY状态.4。
储液箱抽屉:在主机左下方之储液箱抽屉。
FACScalibur检测前后操作步骤

流式细胞仪检测开始前操作步骤1.检查鞘液桶, 若鞘液少于1/3, 请补充鞘液(双蒸水). 注意鞘液桶不可加满, 须至少保留1/5空间;2.将压力阀移到加压位Pressurize;3.取一流式管, 加入1/2体积双蒸水, 置于进样器上;4.依次打开稳压器, 流式细胞仪, 电脑;5.用水高速冲洗管路10分钟: HIGH+RUN; 在此等待期间可进行程序设置.流式细胞仪检测结束后操作步骤1.取一流式管, 加入1/2体积清洗液(双蒸水稀释的84消毒液, 9:1稀释), 置于进样器上;2.仪器设定为HIGH+RUN;3.将样品支持架置于侧位10-20秒, 以清洗进样针; 然后将样品支持架置于正位3-5分钟, 以清洗管路;4.取一流式管, 加入1/2体积双蒸水, 替换下清洗液. 重复步骤3;5.按亮STANDBY, 使仪器进入待机状态5-10分钟, 以冷却激光器;6.依次关闭软件, 电脑, 流式细胞仪, 稳压器;7.将压力阀移到泄压位Vent.8.清空废液桶.检测过程中相关操作1.检测过程中注意观察样品管,勿让样品被全部吸干, 以免气体进入管路; 若样品不慎被吸干, 请取一流式管, 加入1/2体积双蒸水, HIGH+RUN用水高速冲洗管路10分钟以排出气体, 方可继续正常检测.2.若鞘液耗尽需补充鞘液:1)按亮STANDBY使仪器进入待机状态;2)将压力阀移到泄压位Vent以消除管路高压;3)补充鞘液;4)将压力阀移到加压位Pressurize;5)取一流式管, 加入1/2体积双蒸水, HIGH+RUN用水高速冲洗管路10分钟以排出气体, 方可继续正常检测.3.若废液桶满需及时清空:1) 按亮STANDBY使仪器进入待机状态;2) 将压力阀移到泄压位Vent以消除管路高压;3) 清空废液桶;4) 将压力阀移到加压位Pressurize;5) 取一流式管, 加入1/2体积双蒸水, HIGH+RUN用水高速冲洗管路10分钟以排出气体, 方可继续正常检测.。
BD流式细胞仪操作说明
生 物 秀
本课程介绍「表面抗原流式分析」有关之基础工作原理。
一、BD FACSCalibur 基本结构
1.1 仪器本体:
1. 电源开关:在BD FACSCalibur仪器右侧下方,先启动仪器本体,再打开计算机。
物秀 2. 光学系统:BD FACSCalibur 基本配有一支波长488 nm 的氩离子雷射
.com 9. 在工具板中选择四象限工具,在 FL1/FL2 散点图上拖动 Quadrant 的中心将它设 o 定在(x,y)=(101,101)处,这些象限将指定阴性/阳性区域。 .bbio 建立仪器和计算机之间通讯 w 10. 从 Acquire 菜单中选择 Connect to Cytometer,此时会出现 Acquisition Control ww 对话方框。如果无法选择 Connect to Cytometer,参考秘技 #1。如果没见到 秀 Acquisition Control 对话,可到屏幕上方 Windows 菜单中选择 Show
4. 储液箱抽屉: 在主机左下方之储液箱抽屉。可向前拉开,内含鞘流液筒、废液筒、鞘液过滤 器Sheath Filter,及空气滤网 Air filter。请注意气路减压阀VENT TOGGLE之位 置。
FACS101 Handbook
易生物-领先的生物医药商务平台
-2–
生物秀-专心做生物!
秀 物 生
FACS101 Handbook
易生物-领先的生物医药商务平台
-6–
生物秀-专心做生物!
5. 从工具板中点击散点图图示。在实验文件的空白区点击,拖曳对角线至适当大 小,然后放开鼠标。出现散点图对话方框。
FACSCalibur流式细胞仪中文操作手册
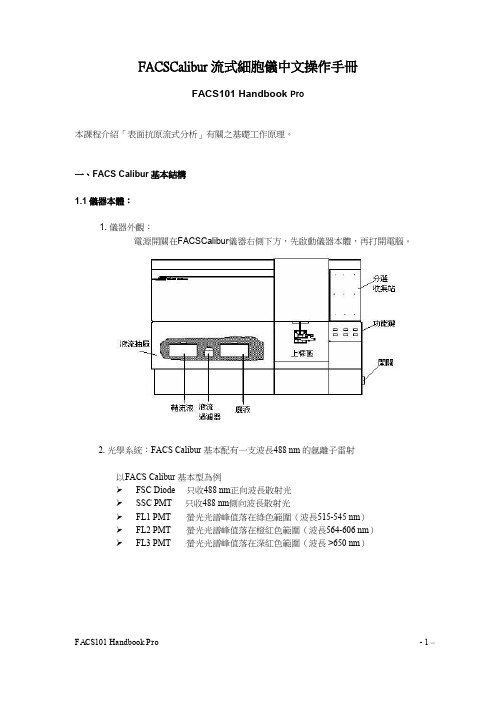
5. 上樣區: 上樣區是樣本管的上樣位置。它包括三個部 分,一個是進樣針 Sample Injection Tube,將 樣本輸入流動室,還有就是支撐架 Tube Support Arm、和液滴存留系統 Droplet Containment System。 進樣針:是一根不鏽鋼管,將細胞從樣本針中吸入流動室。進樣管外有一套管, 是液滴保留系統的一部分。 支撐架:用於支撐樣本管、並負責啟動液滴存留系統。支撐架有三個位置:位於 樣本管之下的中位,樣本管左側或右側。 液滴存留系統:系統由支撐架、真空幫浦和外套 管組成。當支撐架位於左側或右側位置時,真空 幫浦就會啟動,將液體從外管吸入廢液桶內。上 樣時,須注意將支撐架位於中位,以避免過多樣 品被抽吸到廢液筒內(當支撐架位於中位,真空 幫浦停止工作)。更換樣品時,讓儀器保持 RUN 的模式,使得進樣針可以反沖;切換到 STANDBY 模式前,確保液路已沖洗徹底以免碎片沈積到流 動室中。
FACS101 Handbook Pro
-7–
4. 從 Acquire 功能表中選擇 Connect to Cytometer,建立儀器和電腦之間通訊。此時 會出現 Browser 方框。將之移至適當位置。
5. 從工具板中點擊散點圖圖示。在實驗文件的空白區點擊,拖曳對角線至適當大小, 然後放開滑鼠。此時應可以在右方看到 Inspector:Dot Plot 對話框。
FACS101 Handbook Pro
-8–
6. 從螢幕上方 Edit 功能表中選擇 Duplicate 功能,可複製一個同樣大小的散點圖,完 成後可將重製圖移至原圖右方。
7. 從螢幕上方 Edit 功能表中選擇 Select All 功能,文件中所有圖譜的四角會出現黑色 方塊,表示被選取。可在出現之 Inspector:2 Objects 方框中將 Plot Type 改成 Acquisition。 8. 因應實驗需求來修改所有圖譜中顯示之參數。第一圖 X 和 Y 軸參數分別設為 FSC-H 1024、SSC-H 1024;第二圖 X 和 Y 軸參數分別設為 FL1-H 1024、FL2-H 1024。 修改動作為輕擊圖譜,並在出現之 Inspector 方框依需要選擇。 FSC:細胞大小 SSC:細胞顆粒性 FL1:FITC 綠色螢光 FL2:PE 橙色螢光 FL3:PerCP 紅色螢光 儀器設定 注意:實驗數據品質,取決於最適化儀器設定。儀器設定文件不能在數據收取後再更 改,研究人員必須在第一次就使用正確的儀器設定。 儀器設定(Instrument settings),含偵測器電壓(Detector/ Amps),閾值 (Threshold),螢光補償(Compensation)等儀器條件的組合。一般而言,儀器設 定的順序為 Detector/Amps -- Threshold -- Compensation。
BDFACSCalibur流式细胞仪简易操作步骤corr_ZYH_
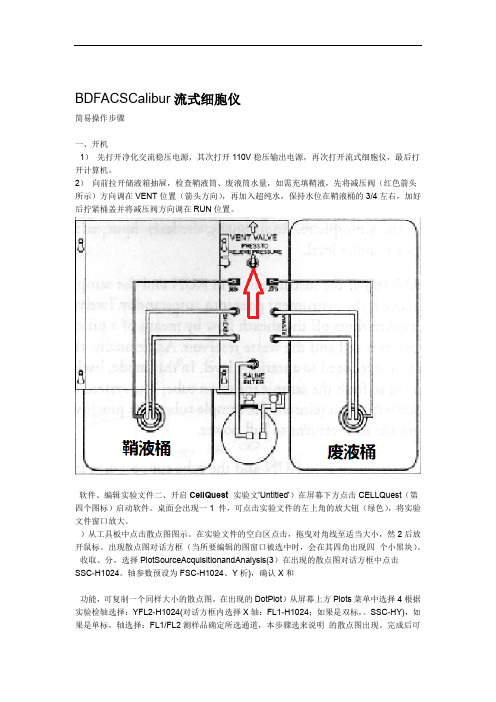
BDFACSCalibur流式细胞仪简易操作步骤一、开机1)先打开净化交流稳压电源,其次打开110V稳压输出电源,再次打开流式细胞仪,最后打开计算机。
2)向前拉开储液箱抽屉,检查鞘液筒、废液筒水量,如需充填鞘液,先将减压阀(红色箭头所示)方向调在VENT位置(箭头方向),再加入超纯水,保持水位在鞘液桶的3/4左右,加好后拧紧桶盖并将减压阀方向调在RUN位置。
软件、编辑实验文件二、开启CellQuest实验文'Untitled')在屏幕下方点击CELLQuest(第四个图标)启动软件。
桌面会出现一1 件,可点击实验文件的左上角的放大钮(绿色),将实验文件窗口放大。
)从工具板中点击散点图图示。
在实验文件的空白区点击,拖曳对角线至适当大小,然2后放开鼠标。
出现散点图对话方框(当所要编辑的图窗口被选中时,会在其四角出现四个小黑块)。
收取、分,选择PlotSourceAcquisitionandAnalysis(3)在出现的散点图对话方框中点击SSC-H1024。
轴参数预设为FSC-H1024、Y析),确认X和功能,可复制一个同样大小的散点图,在出现的DotPlot)从屏幕上方Plots菜单中选择4根据实验检轴选择:YFL2-H1024(对话方框内选择X轴:FL1-H1024;如果是双标,。
SSC-HY),如果是单标,轴选择:FL1/FL2测样品确定所选通道,本步骤选来说明的散点图出现。
完成后可将重制图移至原图右方。
,FL1/FL2点击OK),又称二维散点图是流式分析最常用图谱,它可以显示两个独立Dotplot说明:散点图(SSC-、FSC-H1024轴参数分别设为Y轴和纵坐标X参数的相互关系。
在图中,横坐标.H1024;双荧光标记时,第二图X和Y轴参数分别设为FL1-H1024、FL2-H1024,X轴为为荧光1强度的相对值,单位是道数,Y轴则通常表示荧光2或光散射强度的相对值。
仪器使用者可因实验需求来修改所有图谱中显示之参数。
BD-FACSCalibur流式细胞仪操作手册

BD FACSCalibur流式细胞仪一、BD FACSCalibur基本结构1.1仪器本体:1. 电源开关:在BD FACSCalibur仪器右侧下方,先启动仪器本体,再打开计算机。
2. 光学系统:BD FACSCalibur 基本配有一支波长488 nm 的氩离子雷射以BD FACSCalibur 基本型为例➢FSC Diode 只收488 nm波长散射光➢SSC PMT 只收488 nm波长散射光➢FL1 PMT 荧光光谱峰值落在绿色范围(波长515-545 nm)➢FL2 PMT 荧光光谱峰值落在橙红色范围(波长564-606 nm)➢FL3 PMT 荧光光谱峰值落在深红色范围(波长 >650 nm)3. 仪器面板:仪器前方面板的右下方有三个流速控制键、及三个功能控制键。
流速控制:LO:样品流速:12 l /minMED:样品流速:35 l /minHI: 样品流速:60 l /min功能控制:•RUN:此时上样管加压,使细胞悬液从进样针进入流动室。
(正常显示绿色;黄色时表示仪器不正常,请检查是否失压。
)•STANDBY:无样品或暖机时之正常位置,此时鞘液停止流动,雷射功率自动降低。
•PRIME:去除流动室中的气泡,流动室施以反向压力,将液流从流动室冲入样品管,持续一定时间后,以鞘液回注满流动室。
PRIME 结束,仪器恢复STANDBY状态。
4. 储液箱抽屉:在主机左下方之储液箱抽屉。
可向前拉开,内含鞘流液筒、废液筒、鞘液过滤器Sheath Filter,及空气滤网 Air filter。
请注意气路减压阀VENT TOGGLE之位置。
•鞘液筒:位于抽屉左侧,容积4升。
装八分满鞘液筒,仪器可以运行大约 3小时。
筒上装有液面感应器,鞘液用完时,仪器软件上会有显示。
鞘液筒盖上有金属环扣,保证鞘液筒密闭。
•废液筒:位于抽屉右侧,容积4升。
筒上装有液面感应器,废液盛满时,仪器软件上会有显示。
BD FACSCalibur操作规程

BD FACSCalibur 操作规程(一)开机1、打开主机后侧接线板开关,然后依次打开交流稳压电源、110V输出电源、主机、电脑电源。
(分析数据时,不需打开流式细胞仪)2、执行Prime功能2次。
(二)流式检测1、点击打开CellQuest软件,在Acquire菜单中选择Connect to Cytometer进行电脑和仪器联机,在弹出的Acquisition Control对话框中选择文件保存路径、检测信号及样品的相关参数信息。
2、绘图工具栏中,依需要选择所需图形(Dot Plots:散点图;Histogram:直方图),调整X轴、Y轴参数,在对话框中选择Acquire→Acquisition作为图形资料来源。
3、点击Cytometer菜单下Detectors/Amps (调各检测通道的电压和模式)、Compensation(调不同荧光信号间的补偿)、Status (由Not Ready变为Standby即可上样检测,一般10~15min左右)。
4、上样。
流式细胞仪设定为RUN,点击Acquisition Control的Acquire(调条件时前面打√,收样本时√去掉),上阴性管,调电压;上单染管,调补偿;上样品管,收集数据。
5、设门。
从绘图工具栏中选择合适的图形设门,门之间的逻辑关系在Gates>Gate List设定,在Dot Plots / Histogram对话框中Gate进行赋值。
6、数据。
点中要分析的图片,选择Stats菜单下相应统计选项;若需要编辑统计内容,从Stats菜单中选择Edit…进行编辑。
7、样品分析间隙,换上ddH2O,并将流式细胞仪置于STANDBY状态,以保护激光管。
(三)HTS 96/384孔板上样1、移开HTS保护盖,将模式转到HTS模式,按右图接好管路,打开HTS右侧电源开关;2、点击打开HTS软件,进入Layout界面:Mode选择High Throughput(2-10ul)或Standard(2-200ul),Plate选择板类型;点中阴性孔、单染孔或样品孔,选择Setup Standard或Sample,对Acquisition Document、Analysis Document、Instrument Settings及其他一些参数进行定义(注:HTS软件会自动调用CellQuest,Acquisition Document需提前绘制);3、Set Up界面:进行阴性管、单染管检测,对预设的Instrument Settings进行微调;4、Acquire界面:点击Acquire获取数据;5、Analyze界面:数据的整理和分析。
BD FACSCalibur 流式细胞仪 操作规程

FACSCalibur流式细胞仪简明操作规程1.开机程序开启稳压电源、变压器,打开流式细胞仪电源;开启计算机,桌面不显示跳动的提示,认为细胞仪和电脑连接成功;确认鞘液筒有2/3满,废液桶近似空的,桶盖是旋紧的(所有管线及管路装置连接通畅,无扭曲、折叠);将气压阀方向调在加压位置,用手感觉鞘液桶在慢慢鼓起;PRIME排除液流过滤器中的气泡;HIGH RUN 鞘液或超纯水两分钟;开始分析样品。
2.上机操作确保流式细胞仪处于“Run,Hi”状态;上样前,确认样本细胞是否已过滤,去除检品中的细胞团块,以防止管路堵塞;将样本的试剂管在旋涡器上正立混匀5秒;支持架置于旁位,上样,支持架置于正位;点击软件右下方“Acquire”;分析完成后,换样,重复操作。
3.关机程序清洁加样针的外管和内管,防止加样针堵塞或有染料残留;取3ml浓度为0.5%-1%的次氯酸钠(洗液)上样,将样品支持架置于旁位,以外管吸去约1ml,将样品支持架置于中位,再HIGH RUN 10分钟(内管吸去1-2ml);取 3ml ddH2O 于上样针,将样品支持架置于旁位,用外管吸取1-2ml液体将样品支持架置于正位,按RUN HI,时间需长于5分钟,如8-10分钟;最后留约 1ml ddH2O 在试管中,置于上样位;按Standby以冷却激光,五分钟后关闭细胞仪(务必等五分钟后再FACSCalibur 电源,以延长激光光源寿命。
);倒掉废液,将气压阀放在减压位置,将鞘流液筒充填至2/3满;确认退出计算机中所有BD应用软件,所有数据已储存备份,关程序,关闭苹果计算机;填写使用记录。
4.日常维护方法标本检测结束后都应清洗机器。
关闭仪器之前,必须清洁进样针,及进样针与套管间的区域。
做好月保养工作,进行系统管道清洗,每月至少一次。
每月至少一次质控,通过标准微球来监测仪器的工作状态定期对设备的各种功能进行检查。
将清洗以及检查、维护记录在案。
使用注意事项该仪器仅限仪器管理人员和通过仪器操作培训的人员操作;样品务必过滤后上机;使用完毕后及时清洗管路。
BDFACSCalibur流式细胞术标准操作规程

BD FACSCalibur流式细胞仪操作与维护程序目的:规范BDFACSCalibur流式细胞仪操作与维护程序,正确使用设备,保证实验顺利进行、操作人员人身安全和设备安全。
适用范围:本规程适用于BD FACSCalibur流式细胞仪的使用操作。
责任者:操作人员:负责按照本规程操作仪器设备,对仪器进行日常维护,并作使用记录。
保管人员:负责监管仪器操作是否符合规程,并对仪器进行定期维护、保养。
科室负责人:负责对仪器设备的综合管理。
内容:1.每日开机程序1.1在气压阀减压的状态下检查鞘液桶,确认:1.1.1鞘液充满状态,约3L1.1.2盖紧盖子1.1.3安上金属挡板1.1.4管路畅通,无扭曲1.2.检查废液桶,确认:1.2.1废液桶充满400ml漂白剂1.2.2管路畅通,无扭曲1.3打开流式细胞仪。
1.4打开电脑。
1.5气压阀置于加压位置,并排除管路中气泡。
1.6做Prime。
1.7等待机器预热5~10分钟后可开始试验。
2.每日关机程序2.1用3mlFACSCIean洗液加入样品管中上样,将样品支撑架置于旁位,以外套管吸入1ml。
2.2将样品支撑架置于中位,以HI RUN运行10分钟,使内管吸入约1ml。
2.3将样品管换成蒸馏水重复1-2步。
2.4放置盛有1ml蒸馏水的试管于样品支撑架上。
2.5选择Standby模式10分钟,将激光冷却后可关掉主机。
2.6退出所有应用软件,关闭电脑。
2.7将流式细胞仪的压力阀置于减压状态。
3.每月维护程序3.1将FACSClean洗液1~2L装入鞘液桶。
3.2旁路鞘液过滤器(过滤器上的快速接口从SANLINEFILTER端断开,将鞘液白色管路液路取下联到SANLINE FILTER 端口),以防伤害。
3.3将盛有3ml FACSClean 洗液的试管置于样品支架上,以HI RUN 30 分钟。
3.4将鞘液和样品换成蒸馏水重复步骤3,以HI RUN 60 分钟。
3.5将鞘液桶装满鞘液,恢复过滤器。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
BD FACSCalibur流式细胞仪简易操作步骤一、开机1)先打开净化交流稳压电源,其次打开110V稳压输出电源,再次打开流式细胞仪,最后打开计算机。
2)向前拉开储液箱抽屉,检查鞘液筒、废液筒水量,如需充填鞘液,先将减压阀(红色箭头所示)方向调在VENT位置(箭头方向),再加入超纯水,保持水位在鞘液桶的3/4左右,加好后拧紧桶盖并将减压阀方向调在RUN位置。
二、开启CellQuest 软件、编辑实验文件1)在屏幕下方点击CELLQuest(第四个图标)启动软件。
桌面会出现一’Untitled’ 实验文件,可点击实验文件的左上角的放大钮(绿色),将实验文件窗口放大。
电子版本:\\NOVOPUBLIC\NovoBio\流式细胞仪\BD FACSCalibur流式细胞仪简易操作步骤_corr_ZYH_20140520- 1 -2)从工具板中点击散点图图示。
在实验文件的空白区点击,拖曳对角线至适当大小,然后放开鼠标。
出现散点图对话方框(当所要编辑的图窗口被选中时,会在其四角出现四个小黑块)。
3)在出现的散点图对话方框中点击Plot Source,选择Acquisition and Analysis (收取、分析) ,确认X和Y轴参数预设为FSC-H 1024、SSC-H 1024。
4)从屏幕上方Plots菜单中选择Dot Plot功能,可复制一个同样大小的散点图,在出现的对话方框内选择X轴:FL1-H 1024;如果是双标,Y轴选择:FL2-H 1024(根据实验检测样品确定所选通道,本步骤选FL1/FL2来说明),如果是单标,Y轴选择:SSC-H。
点击OK,FL1/FL2的散点图出现。
完成后可将重制图移至原图右方。
说明:散点图(Dotplot),又称二维散点图是流式分析最常用图谱,它可以显示两个独立参数的相互关系。
在图中,横坐标X轴和纵坐标Y轴参数分别设为FSC-H 1024、SSC-H 1024;双荧光标记时,第二图X和Y轴参数分别设为FL1-H 1024、FL2-H 1024,X轴为为荧光1强度的相对值,单位是道数, Y轴则通常表示荧光2或光散射强度的相对值。
仪器使用者可因实验需求来修改所有图谱中显示之参数。
修改动作为轻击图谱上X和Y轴参数,并依需要选择之(FSC:细胞大小,SSC:细胞折射率,FL1:FITC绿色荧光,FL2:PE橙色荧光,FL3:PerCP红色荧光)。
5)在工具板中选择四象限工具,在FL1/FL2散点图上拖动Quadrant的中心将它设定在(x,y)=(101,101)处,这些象限将指定阴性/阳性区域。
6)从工具板中点击直方图图示,在实验文件的空白区点击,拖曳对角线至适当大小,然后放开鼠标。
单色荧光只需一个直方图,和第二个散点图一样,横坐标选择FL-1,纵坐标默认为Counts;若是双色荧光,需画2个直方图,一个横坐标选择FL-1-1024,另一个横坐标选择FL-2-1024;7)在上面直方图中画出M1和M2,其中M1代表隐性数目(一般标示是101),M2代表阳性数目(除M1以外所有的部分)。
8)从Stats菜单中选择Quadrant Stats(象限统计),5)步骤中的点图将分为四个象限。
三、建立仪器和计算机之间通讯从Acquire菜单中选择Connect to Cytometer (快捷键Win+b),此时会出现Acquisition Control 对话方框。
四、仪器设置文件注意:实验数据质量,取决于最适化仪器设定文件。
仪器设定文件不能在数据收取后再更改,研究人员必须在第一次就使用正确的仪器设定文件。
仪器设定文件(Instrument settings),含信号器高压(Detector/ Amps),阈值(Threshold),荧光补偿(Compensation)等仪器条件的组合。
一般而言,仪器设定的顺序为Detector/Amps -- Threshold -- Compensation。
1)检查现有仪器条件,从Cytometer菜单中选择Detectors/Amps。
出现 Detectors/Amps窗口。
在Detectors/Amps窗口确认FSC与SSC(根据实验样品确定,一般细胞选择LIN,细菌选择LOG),其它FL1-3为LOG(对数放大),将其拖至空白区。
2)从Cytometer菜单中选择Threshold,出现 Threshold 窗口在Threshold 窗口:确认FSC为设阈参数,初步确认预设阈值52。
将其拖至空白区。
3)从Cytometer菜单中选择Compensation,确认所有预设数值皆为零。
将其拖至空白区。
五、上样品、设置仪器使仪器处于High RUN,样品管支撑架左移,上阴性对照管样品,支撑架回位。
确认Acquisition Control 窗口中 Setup前需打叉或打勾 (即不储存数据,用于仪器设置),点击Acquire。
1、调节FSC/SSC探测器(电压)观察FSC/SSC图的变化。
FSC电压(Voltage)预设为E00,可调节 Amp Gain 从1.00—9.99 使主要细胞群得以清楚显示(如细胞较大,将FSC电压设置于E-1;较小细胞,将FSC电压设置于E01)。
调节SSC电压使主要细胞群得以清楚呈现。
调节FSC/SSC图的原则,在于能得到一独立离散的细胞族群,该细胞群不与其它族群、细胞碎片有重迭现象。
调整定位后,点击Acquisition Control 窗口中的Pause。
2、Gating 圈选细胞检品中,常含有大小不同、性质相异的细胞群体。
我们常用前方散射(FSC)与侧方散射(SSC)的二维位图,即散射光图谱(Scatter Plot),来圈选出不同细胞群的范围,选择性显示出有意义的细胞群体,如下图圈选白血球之淋巴细胞族群。
1)在工具板中选择多边形的Region,在FSC/SSC散点图上划定淋巴细胞R1 区域(如下图)。
分析样品时,区域内细胞应会呈现成红色,可移动或改变形状来圈选有意义的细胞。
如果要删除R1区域,您可以在工具列中点选Gates → Region list,以鼠标点选R1,再按Delete键删除R1区域。
删除R1区域后,可用绘图工具板,重画R1。
2)选取希望Gate的FL1/FL2散点图,从Plots菜单中选择Format dot plot。
在出现的对话方框内,将No Gate 改选 G1=R1。
点击OK。
3、调节FL1、FL2的探测器(电压)1)点击Acquisition Control 窗口中的Restart。
在Detector/Amps 窗口中调节FL1、FL2的电压,使Negative Control细胞群着落在所选直方图或散点图之100--101处。
2)在Threshold 窗口,适当地提高FSC阈值>52,以去除碎片或低阶噪音。
唯需注意不要切掉主要细胞族群。
3)点击Acquisition Control 窗口中的Pause、Abort。
移去阴性对照管,我们已设定好有意义细胞群之自体荧光,不要再改动Detector/Amps、Threshold等数值。
4、调节荧光补偿说明:最适化的最后一步是调节光谱重迭。
(如是单色荧光实验可跳过此步骤)如是2色样本,必要时需调节FL2-%FL1,FL1-%FL2(若3色样本,必要时需调节FL2-%FL1、FL1-%FL2、FL3-%FL2、FL2-%FL3的补偿)。
1) High RUN,换上单染CD3-FITC管。
点击AcquisitionControl窗口中的Acquire。
调节FL2-%FL1使FITC阳性细胞在FL1/FL2散点图的右下象限。
补偿调节可通过点击 来选择或直接拖动滑标上下移动。
调节完毕,点击AcquisitionControl窗口中的Pause。
2)移去单染CD3,换上单染CD19-PE管。
点击AcquisitionControl窗口中的Restart。
调节FL1-%FL2使PE+细胞在FL1/FL2散点图的左上象限。
调节完毕,点击AcquisitionControl窗口中的Pause。
3.)最后以CD3-FITC/CD19-PE双染样本上机,点击Acquisition Control窗口中的Restart,确定三群细胞工整垂直。
当您已完成2色荧光之光谱重迭时,点击Acquisition Control窗口中的Pause、Abort。
4)移去样本管,换上dH2O管,让仪器暂且处于Standby状态。
关闭Compensation窗口。
您已完成2色荧光之最适化。
六、收集实验数据1)决定储存细胞总数:预设之「储存细胞总数」为10000。
如需修改,从Acquire菜单中选择Acquisition & Storage,并在出现的窗口功,确认「Collection Criteria」从10000 of All,再点击OK。
2)找个档案匣准备储存数据,本机所有数据都贮存在D盘data盘中,按实验日期编排。
从Acquire 菜单中选择Parameter Description,出现Parameter Description对话方框。
点击Folder,并在随后出现之对话方框,选择「Your Folder」或新建活页夹,点击此对话方框的Select ’Your Folder’(一般用实验日期来命名Folder)。
3)命名即将储存之文件名:点击Parameter Description对话方框的File,出现文件名编辑窗口,输入文件名(根据实验来决定),点击此对话方框的OK。
4) Optional:如有需要,可选择或在P1-P5后的空格中输入相关参数名。
如P1:Size, P2:Granularity, P3:CD3 FITC。
输入参数名会存入实验档案中,显示在图谱上。
5)计数器Counters:从Acquire 菜单中选择Counters. 窗口会显示样品分析速率、与总数进度6)开始收集实验数据。
LOW RUN(根据Counters来调节速度,一般保持在700-800/Second),将第一管样品放到检测区,在Acquisition Control窗口中,将☒Setup 改成☐ Setup,此时CellQuest会自动显示 Your Folder文件名为资料文件名。
点击“Acquire” 便可启动样品之分析测定与数据储存。
当计算机成功地收取足够数据,会自动储存数据文件文件名.001,并会以“嘟”声告知,CellQuest会自动升幂附加档名成文件名.002。
等待下一指示。
7)换上超纯水,清洗管路,直到Counters持续显示0/Second 30s (约为10-20s),换上下一管样品,点击“Acquire” 启动样品之分析测定与数据储存。
