CNAS-CL39:2012《医学实验室质量和能力认可准则在临床免疫学检验领域的应用说明》 [2012-09-26]
ISO15189现场评审不符合项经验分享(松中心2014.9)

对应条款:
CNAS-CL42: 5.5.1.1 检验过程
ISO15189医学实验室认可
现场评审不符合项经验分享
松江区中心医院 检验科 侯彦强
2014-9-30
医学实验室认可25个要素
4.1 组织和管理责任 4.2 质量管理体系 4.3 文件控制 4.4 服务协议 4.5 受委托实验室的检验
5.1 人员 5.2 设施和环境条件 5.3 检验科设备、试剂和耗材 5.4 检验前过程
不符合事实描述:
无对人员进行监督指导的记录、无人员培训效果定期评估记录。
不符合对应条款:
CNAS-CL02: 5.1.5 人员
ISO15189现场评审不符合项之四
不符合事实描述:
现场评审时发现所购置的一次性定量接种环未进行抽样验证。
不符合对应条款:
CNAS-CL42 :5.3.2.3 g) 检验科设备、试剂和耗材
现场评审不符合项专业组分布统计
现场评审不符合项在专业组分布 7 6 5
数量
4 3 2 1 0 综合组 门急诊组 生化组 专业组 免疫组 微生物组
ISO15189现场评审不符合项之一
不符合事实描述:
查质量手册、程序文件于2014年9月10日换第二版,无第一版回收记录。
《实验室安全风险评估报告》、《实验室检验结果风险评估报告》无 唯一性编号。
ISO15189现场评审不符合项之十五
不符合事实描述:
微生物室只固定了两位做分枝杆菌的染色操作,当两人休息的时候,
不能满足收到样品24小时内报告分枝杆菌的染色结果。
不符合对应条款:
CNAS-CL42 :5.8.2 c) 结果报告
ISO15189现场评审之观察项
观察项事实描述:
定性免疫学检验的性能验证与质量控制

25
辽宁中医药大学附属医院临床检验中心
ISO15189实验室认可系列培训讲座
临床特异性和临床敏感性
临床敏感性:在患有明确临床疾病的患者中,其检 测结果呈阳性或者超过正常值范围的比率 (即出现 阳性结果和确定患者患病)。
临床特异性:在没有特定临床疾病的患者中,其检 测结果呈阴性或者在正常值范围内的比率。
ISO15189实验室认可系列培训讲座
二、检验结果质量的保证-----室内质控 质控品的来源
第三方质控品 检测系统配套质控品 自制质控品
32
辽宁中医药大学附属医院临床检验中心
ISO15189实验室认可系列培训讲座
质控物的选择
基质:应尽量选择人血清基质,动物源性的基质由 于人体内有大量的异嗜性抗体的存在引起假失控。稀 释液也应用人血清,冻干品复溶可以使用生理盐水。
阳性符合率和阴性符合率的计算
待评价试剂与已验证方法相比较进行阳性符合率和阴性符合率的计算
待评价试剂的检测结果 +
已验证方法
+
-
a
b
共计
c
d
a+c
b+d
阳性符合率= a/(a+c) ×100%。 阴性符合率= d/(b+d) ×100%。 总符合率=(a+d)/(a+b+c+d)×100%。
31
辽宁中医药大学附属医院临床检验中心
22
辽宁中医药大学附属医院临床检验中心
ISO15189实验室认可系列培训讲座
(二)检出限的验证
检测限(limit of detection)是指检测方法可检 测 出 的 最 低 被 测 量 浓 度 , 也 称 检 测 低 限 ( lower limit of detection ) 或 最 小 检 出 浓 度 ( minimum detectable concentration),有时也称为分析灵敏 度(analytical sensitivity)。 如前所述,分析物浓度位于C5-C95区间之外(小于 C5或大于C95)时,候选方法对同一样本的重复性检 测将得到相同结果。因此,C95代表了某一试剂可以 测出的最低被测量浓度。
(仅供参考)医学实验室质量和能力认可准则

注1:测量结果高于临界值判断为阳性而低于临界值判断为阴性。 注2:测量结果接近临界值判断为非确定性。 注3:临界值的选择决定检验的诊断特异性和诊断灵敏度。 [ISO 18113-1, 定义A.3.13]
3.5 校准物 calibrator 用于体外诊断仪器或系统校准的测量标准。[ISO 18113-1, 定义 3.11]
3.6 诊断灵敏度 diagnostic sensitivity 体外诊断检验程序可以识别与特定疾病或状态相关的目标标志物存在的能力。
注1:在目标标志物已知存在的样品中也定义为阳性百分数。 注2:诊断灵敏度以百分数表达(数值分数乘以 100)。以 100×真阳性值数(TP)除以真阳性值数(TP)加上
本文件与CNAS-CL02:2008《医学实验室质量和能力认可准则》同时使用。 在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL02:2008中章、 节条款号和名称,对CNAS-CL02:2008解释和说明的具体内容在对应条款后给出。 本文件的附录A为规范性附录。附录的序号及内容与CNAS-CL02:2008不对应。 本文件为第一次发布。
认可的授权签字人应至少具有中级以上专业技术职务任职资格,从事申请认可授权 签字领域专业技术工作至少 3 年以上。 5.1.10 应实施安全培训和应急预案的演练,并记录。
2012 年 09 月 13 日发布
2013 年 04 月 01 日实施
5.1.11 实验室应制定员工能力评审的要求和方法,每年评审员工的工作能力;对新进员 工在最初 2 个月内应至少进行 2 次能力评审(间隔为 30 天),保存评审记录。当职责变 更时,或离岗 6 个月以上再上岗时,或政策、程序、技术有变更时,应对员工进行再培 训和再评审。没有通过评审的人员应经再培训和再评审,合格后才可继续上岗,并记录。 5.1.13 应提供工作人员对患者隐私及结果保密的声明及签字。 5.2 设施及环境条件 5.2.1 实验室应有充分工作空间,包括:
CNAS-CL42:2012《医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明[2012-09-26]
![CNAS-CL42:2012《医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明[2012-09-26]](https://img.taocdn.com/s3/m/4e9e3f4ae518964bcf847c86.png)
CNAS-CL42医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明Guidance on the Application of AccreditationCriteria for the MedicalLaboratory Quality and Competence in the Field ofClinical Microbiology中国合格评定国家认可委员会前言本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS根据临床微生物学检验的特性而对CNAS-CL02:2008《医学实验室质量和能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
本文件与CNAS-CL02:2008《医学实验室质量和能力认可准则》同时使用。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL02:2008中章、节条款号和名称,对CNAS-CL02:2008应用说明的具体内容在对应条款后给出。
本文件的附录A为规范性附录。
附录的序号及内容与CNAS-CL02:2008不对应。
本文件为第一次发布。
医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明1 范围本文件规定了CNAS对医学实验室临床微生物学检验领域的认可要求。
临床微生物学检验领域中涉及的病毒血清学检验、基因扩增检验、寄生虫检验等应符合相关专业领域应用说明的要求。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。
CNAS-RL02 能力验证规则3 术语和定义4 管理要求4.1 组织和管理4.1.1 实验室为独立法人单位的,应有医疗机构执业许可;实验室为非独立法人单位的,其所属医疗机构执业证书的诊疗科目中应有医学实验室,自获准执业之日起,开展医学检验工作至少2年。
4.1.5 h) 应至少有1名具有副高以上专业技术职称,从事医学检验工作至少5年以上的人员负责技术管理工作。
CNAS-CL38:2012《医学实验室质量和能力认可准则在临床化学检验领域的应用说明》(2015年第三次修订清稿)

CNAS-CL38医学实验室质量和能力认可准则在临床化学检验领域的应用说明Guidance on the Application of Accreditation Criteria for the Medical Laboratory Quality and Competence in the Field of Clinical Chemistry中国合格评定国家认可委员会前言本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS根据临床化学检验的特点,对CNAS-CL02:2012《医学实验室质量和能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
本文件与CNAS-CL02:2012《医学实验室质量和能力认可准则》同时使用。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL02:2012中章、节条款号和名称,对CNAS-CL02:2012应用说明的具体内容在对应条款后给出。
本文件的附录A、B为规范性附录。
附录的序号及内容与CNAS-CL02:2012不对应。
本文件于2012年制定,本次为第3次修订。
医学实验室质量和能力认可准则在临床化学检验领域的应用说明1 范围本文件规定了CNAS对医学实验室临床化学检验领域的认可要求。
适用时,医学实验室临床免疫学定量检验领域的认可,应符合本文件要求。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。
GB/T 20468-2006 临床实验室定量测定室内质量控制指南WS/T 407-2012 医疗机构内定量检验结果的可比性验证指南CNAS-RL02 能力验证规则CNAS-CL31 内部校准要求3 术语和定义4 管理要求4.1 组织和管理责任4.1.1.2医学实验室为独立法人单位的,应有医疗机构执业许可证;实验室为非独立法人单位的,其所属医疗机构的执业许可证书的诊疗科目中应有医学实验室;自获准执业之日起,实验室开展医学检验工作至少2年。
HCV抗体阴阳性符合率
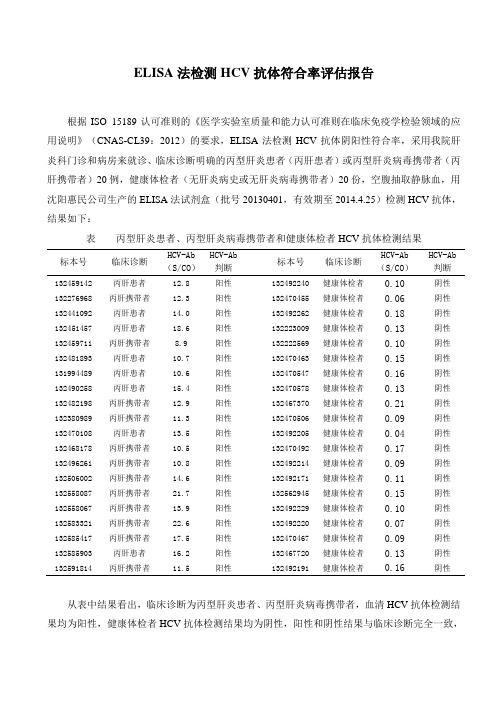
ELISA法检测HCV抗体符合率评估报告根据ISO 15189认可准则的《医学实验室质量和能力认可准则在临床免疫学检验领域的应用说明》(CNAS-CL39:2012)的要求,ELISA法检测HCV抗体阴阳性符合率,采用我院肝炎科门诊和病房来就诊、临床诊断明确的丙型肝炎患者(丙肝患者)或丙型肝炎病毒携带者(丙肝携带者)20例,健康体检者(无肝炎病史或无肝炎病毒携带者)20份,空腹抽取静脉血,用沈阳惠民公司生产的ELISA法试剂盒(批号20130401,有效期至2014.4.25)检测HCV抗体,结果如下:表丙型肝炎患者、丙型肝炎病毒携带者和健康体检者HCV抗体检测结果标本号临床诊断HCV-Ab(S/CO)HCV-Ab判断标本号临床诊断HCV-Ab(S/CO)HCV-Ab判断132459142 丙肝患者12.8 阳性132492240 健康体检者0.10 阴性132276968 丙肝携带者12.3 阳性132470455 健康体检者0.06 阴性132441092 丙肝患者14.0 阳性132492262 健康体检者0.18 阴性132451457 丙肝患者18.6 阳性132223009 健康体检者0.13 阴性132459711 丙肝携带者8.9 阳性132222569 健康体检者0.10 阴性132481893 丙肝患者10.7 阳性132470463 健康体检者0.15 阴性131994489 丙肝患者10.6 阳性132470547 健康体检者0.16 阴性132490258 丙肝患者15.4 阳性132470578 健康体检者0.13 阴性132482198 丙肝携带者12.9 阳性132467370 健康体检者0.21 阴性132380989 丙肝携带者11.3 阳性132470506 健康体检者0.09 阴性132470108 丙肝患者13.5 阳性132492205 健康体检者0.04 阴性132468178 丙肝携带者10.5 阳性132470492 健康体检者0.17 阴性132496261 丙肝携带者10.8 阳性132492214 健康体检者0.09 阴性132506002 丙肝携带者14.6 阳性132492171 健康体检者0.11 阴性132558087 丙肝携带者21.7 阳性132562945 健康体检者0.15 阴性132558067 丙肝携带者13.9 阳性132492229 健康体检者0.10 阴性132583321 丙肝携带者22.6 阳性132492220 健康体检者0.07 阴性132585417 丙肝携带者17.5 阳性132470467 健康体检者0.09 阴性132585903 丙肝患者16.2 阳性132467720 健康体检者0.13 阴性132591814 丙肝携带者11.5 阳性132492191 健康体检者0.16 阴性从表中结果看出,临床诊断为丙型肝炎患者、丙型肝炎病毒携带者,血清HCV抗体检测结果均为阳性,健康体检者HCV抗体检测结果均为阴性,阳性和阴性结果与临床诊断完全一致,说明该试剂盒检测结果的阴阳性符合率达到100%,质量完全满足实验室和临床医生及病人等客户的要求。
CNAS实验室认可规件清单
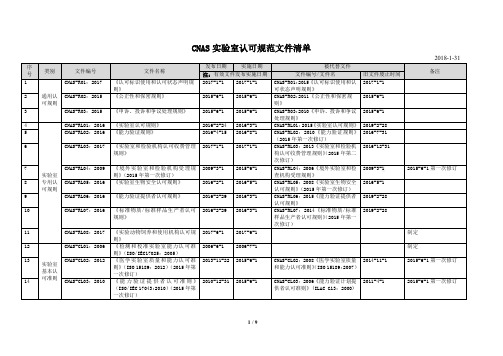
2018-1-31
序 号
类别
文件编号
文件名称
发布日期
实施日期
注:有效文件发布实施日期
被代替文件 文件编号/文件名
旧文件废止时间
备注
1
CNAS-R01:2017 《认可标识使用和认可状态声明规 2017-1-1 2017-1-1
CNAS-R01:2015《认可标识使用和认 2017-1-1
31
CNAS-CL19:2010 《检测和校准实验室能力认可准则 2010-12-30 2015-6-1
CNAS-CL19:2006《实验室能力认可 2011-4-1
2015-6-1 第一次修订
在金属材料检测领域的应用说明》
准则在金属材料检测领域的应用说
(2015 年第一次修订)
明》
32
CNAS-CL20:2014 《检测和校准实验室能力认可准则 2014-9-1 2015-9-1
年第一次修订)
应用说明》
39
CNAS-CL27:2014 《司法鉴定/法庭科学机构能力认 2014-4-1 2015-6-1
CNAS-CL27:2010《检测和校准实验
可准则在电子物证鉴定领域的应用
室能力认可准则在电子物证检验领
说明》(2015 年第一次修订)
域的应用说明》
2015-6-1 第一次修订
2015-6-1 第一次修订
在微生物检测领域的应用说明》
室能力认可准则在微生物检测领域
(2015 年第一次修订)
的应用说明》(2007 年第 1 次修订)
22
CNAS-CL10:2012 《检测和校准实验室能力认可准则 2012-6-11 2015-6-1
医学实验室质量和能力认可准则在临床微生物学检验领域的

CNAS-CL02-A005医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明Guidance on the Application of Accreditation Criteria for the Medical Laboratory Quality and Competence in the Field of Clinical Microbiology中国合格评定国家认可委员会前言本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS根据临床微生物学检验的特性而对CNAS-CL02:2012《医学实验室质量和能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
本文件与CNAS-CL02:2012《医学实验室质量和能力认可准则》同时使用。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL02:2012中章、节条款号和名称,对CNAS-CL02:2012应用说明的具体内容在对应条款后给出。
本文件的附录A为规范性附录。
附录的序号及内容与CNAS-CL02:2012不对应。
本文件代替:CNAS-CL42:2012。
本次为换版修订,相对于CNAS-CL42:2012,本次换版仅涉及文件编号改变。
医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明1 范围本文件规定了CNAS对医学实验室临床微生物学检验领域的认可要求。
临床微生物学检验领域中涉及的病毒血清学检验、基因扩增检验、寄生虫检验等应符合相关专业领域应用说明的要求。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。
CNAS-RL02 能力验证规则3 术语和定义4 管理要求4.1 组织和管理责任4.1.1.2 实验室为独立法人单位的,应有医疗机构执业许可;实验室为非独立法人单位的,其所属医疗机构执业证书的诊疗科目中应有医学实验室;自获准执业之日起,开展医学检验工作至少2年。
HIV初筛实验室SOP

HIV初筛实验室管理制度1.目的为加强本实验室艾滋病初筛检测工作的规范化管理,提高检测工作,根据《全国艾滋病检测工作管理办法》(2020年修订版),特制定本实验室的管理制度。
2.范围适用于艾滋病初筛实验室。
3.人员组成本实验室人员均参加过省疾病控制中心HIV初筛检测技术培训,并获得培训证书,实验室负责人为副主任检验师及以上,且有2年以上临床免疫工作经验:认可的授权签字人为主管检验师,且从事申请认可授权签字领域专业技术工作3年以上,符合相关要求。
4.安全等级HIV初筛实验室为二级生物安全实验室。
5. 管理制度5.1 热爱本职工作,遵守医务人员服务守则与工作原则;5.2 坚持不歧视原则,与服务对象建立良好关系,关心他人;5.3 做好合格和规范的预防艾滋病传播的宣传工作;5.4 严格执行《全国艾滋病检测工作管理办法》(2020年修订版),遵照本实验室的相关SOP文件工作;5.5 严格执行实验室生物安全通用要求,工作人员要熟悉生物安全操作知识和消毒技术;5.6 不得在实验室内喝饮料,抽烟,吃食物和化妆等,不得在实验室会客;5.7 实验室用品(包括工作服)不得用作其他用途,不可将私人用品和无关用品带入实验室;5.8 工作时,要戴手套,穿工作服,操作时手套破损应立即丢弃,洗手并戴上新手套;5.9 不要用戴手套的手触摸暴露皮肤、口唇、眼睛、耳朵和头发等;5.10 尽量避免使用尖锐物品和器具,宜用不易破碎材料制品;禁止用口吸任何物品;5.11 工作认真负责。
严格执行本实验室的质量管理控制程序规则;做好室间质评和室内质控工作;保证检测结果准确无误,杜绝差错事故的发生;5.12 工作结束后,要对工作台面消毒,如用消毒液清洁后要干燥20分钟以上;操作时要有标本,检测试剂外溅时,应及时消毒;平时要保持环境整洁;5.13 工作完毕,脱去手套后洗手,再脱去工作服,用消毒洗手液和流动水洗手;5.14 遇到意外事故,应立即处理并报告上级,妥善处理。
医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明

医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明如下:
1. 标准化操作流程:医学实验室应根据质量认可准则建立标准化的操作流程,包括样品采集、处理、培养和鉴定等步骤,以确保结果的准确性和可重复性。
2. 质量控制体系:医学实验室应建立完善的质量控制体系,包括内部质量控制和外部质量评估。
内部质量控制包括定期进行质控样品的检测和记录,以评估实验室的准确性和稳定性。
外部质量评估则通过参与外部质量评估方案,与其他实验室进行比对,以评估实验室的能力和水平。
3. 人员培训和继续教育:医学实验室应确保实验人员具备必要的专业知识和技能,并定期进行培训和继续教育,以跟踪最新的技术和方法,提高实验人员的能力和水平。
4. 设备和设施:医学实验室应配备适当的设备和设施,以支持临床微生物学检验的进行。
设备应符合相关的质量标准,并定期进行维护和校准,以确保其准确性和可靠性。
5. 数据管理和报告:医学实验室应建立完善的数据管理系统,包括样
品信息、检测结果和质量控制记录等。
检测结果应准确、及时地向临床医生报告,以支持临床决策和治疗。
6. 不断改进:医学实验室应不断改进质量管理体系,包括定期进行内部审核和管理评审,以发现和纠正问题,并持续改进实验室的质量和能力。
总之,医学实验室质量和能力认可准则在临床微生物学检验领域的应用,旨在确保实验室的操作流程标准化、质量控制有效、人员能力高、设备可靠、数据管理完善,并持续改进实验室的质量和能力,以提供准确、可靠的检验结果,支持临床诊断和治疗。
CNAS-CL36:2012《医学实验室质量和能力认可准则在分子诊断领域的应用说明》(2014年第1次修订)(发布稿)

CNAS-CL36:2012《医学实验室质量和能力认可准则在分子诊断领域的应用说明》(2014年第1次修订)(发布稿)医学实验室质量和能力认可准则在分子诊断领域的应用说明1 范围本文件规定了CNAS对分子诊断领域的认可要求,包括:病原体核酸和人体基因等领域涉及的核酸扩增试验、杂交试验(包括原位杂交试验)、核酸电泳分析等。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。
GB/T 20468-2006 临床实验室定量测定室内质量控制指南CNAS-RL02 能力验证规则CNSA-CL31 内部校准要求临床技术操作规范·病理学分册,人民军医出版社,2004医疗机构临床基因扩增检验实验室工作导则病理科建设与管理指南(试行),卫办医政发〔2009〕31号3 术语和定义4 管理要求4.1 组织和管理责任4.1.1.2 实验室为独立法人单位的,应有医疗机构执业许可;实验室为非独立法人单位的,其所属医疗机构执业证书的诊疗科目中应有医学实验室,自获准执业之日起,开展分子诊断工作至少2年。
4.1.2.5应至少有1名具有副高及以上专业技术职务任职资格,从事分子诊断工作至少5年。
4.2 质量管理体系4.3 文件控制4.4 服务协议4.5 受委托实验室的检验4.6 外部服务和供应4.7 咨询服务4.8 投诉的解决4.9 不符合的识别和控制4.10 纠正措施4.11 预防措施4.12 持续改进4.13 记录控制4.14 评估和审核4.15 管理评审5 技术要求5.1 人员5.1.2 分子诊断实验室(以下简称实验室)负责人应至少具有中级专业技术职称、从事分子诊断工作至少3年。
分子诊断实验室操作人员应经过有资质的培训机构培训合格取得上岗证后方可上岗。
签发分子病理报告的医师应至少具有中级病理学专业技术职务任职资格,并有从事分子病理工作的经历。
CNAS-CL39:2012《医学实验室质量和能力认可准则在临床免疫学检验领域的应用说明》 [2012-09-26]
![CNAS-CL39:2012《医学实验室质量和能力认可准则在临床免疫学检验领域的应用说明》 [2012-09-26]](https://img.taocdn.com/s3/m/29490aeb102de2bd96058886.png)
3.3 分析灵敏度 analytical sensitivity 测量示值变化除以相应的被测量值变化所得的商。
注1:测量程序的灵敏度有可能依赖于被测量值。
2012 年 09 月 13 日发布
2013 年 04 月 01 日实施
CNAS-CL39:2012
第 3 页 共 10 页
注2:要考察的被测量值改变必须大于分辨率。 注3:一个测量系统的分析灵敏度是校准曲线的斜率。 注4:分析灵敏度不应用于表示检出限或定量限,并且不应与诊断灵敏度混淆。 [ISO/IEC 指南 99:2007,定义4.12]
3.2 临界值 cut-off value 鉴别样品,作为判断特定疾病、状态或被测量存在或不存在的界限的量值。
注1:测量结果高于临界值判断为阳性而低于临界值判断为阴性。 注2:测量结果接近临界值判断为非确定性。 注3:临界值的选择决定检验的诊断特异性和诊断灵敏度。 [ISO 18113-1, 定义A.3.13]
2012 年 09 月 13 日发布
2013 年 04 月 01 日实施
CNAS-CL39:2012
第 6 页 共 10 页
5.1.11 实验室应制定员工能力评审的要求和方法,每年评审员工的工作能力;对新进员 工在最初 2 个月内应至少进行 2 次能力评审(间隔为 30 天) ,保存评审记录。当职责变 更时,或离岗 6 个月以上再上岗时,或政策、程序、技术有变更时,应对员工进行再培 训和再评审。没有通过评审的人员应经再培训和再评审,合格后才可继续上岗,并记录。 5.1.13 应提供工作人员对患者隐私及结果保密的声明及签字。 5.2 设施及环境条件 5.2.1 实验室应有充分工作空间,包括: (a) 实验台和设备的放置; (b) 试剂、样品和记录的贮存; (c) 危险物品储存与处理; (d) 废弃物的处理; (e) 实验操作; (f) 合理独立的办公区域; (g) 员工便利设施(洗涤间、茶水间、个人物品存放处等) 。 。 5.2.2 应实施安全风险评估, 如果设置了不同的控制区域, 应制定针对性的防护措施及合 适的警告。 5.2.5 应依据所用分析设备和实验过程对环境温湿度的要求,制定温湿度控制要求并记 录。应依据用途(如:试剂用水、生化仪用水)制定适宜的水质标准(如:电导率、微 生物含量等) ,并定期检测。应对稳压电源等电力系统的设施设备定期维护,并记录。 5.2.9 应有足够的、温度适宜的储存空间(如冰箱) ,用以保存临床样品和试剂,设置目 标温度和允许范围,并记录。应有温度失控时的处理措施,并记录。 5.2.10 应有指定内务管理人员(如:保洁人员) ,应有地面、台面的维护、清洁和消毒计 划及相关的记录。 5.3 实验室设备 5.3.2 实验室仪器设备的相关管理应符合如下要求: (a) 建议进行; (b) 性能标准及校准程序至少应按制造商规定, 对分析设备校准的基本项目至少 应包括加样系统、检测系统和温控系统; (c) 实验室应保存维护保养手册及相关记录。 实验室试剂的相关管理应符合如下要求: 实验室应提供仪器校准清单、计划、校准状态;设备新安装时应按法规或制 造商建议进行校准,并保留性能测试记录;投入使用之后的校准周期应按法规或制造商
定性免疫学检验的性能验证与质量控制

检出限的验证方法
样本选择:评估试剂分析灵敏度所使用的样本,如 检测项目有国家参考品,则可使用国家参考品或经国 家参考品标化的参考品进行检测,如没有国家参考品 ,则使用可以溯源或量化的样本,如国际标准物质, 或与国际标准物质溯源的样本。 验证方法:处于测定下限浓度( C95 )的样本,重 复检测20次,应至少有18次以上为阳性反应。
精密度评估的基本原则(2)
评估精密度时,应至少评估两个浓度水平样本的精 密度。 所选样本浓度应在测量范围内有医学意义,即至少 有一个浓度在医学决定水平左右,在定性测定,即为 接近临界水平的浓度。
批内精密度的评估
评估方法:三个不同浓度的样本,在一个测试批内 重复进行至少20次检测,计算所得S/CO值的均值和SD ,计算批内CV%。 质量控制:检验时应同时至少测一个质控品。 判断结论:应≤试剂说明书所标明的批内变异。 ELISA的批内变异CV%应≤10%。
(三)准确度验证
验证方法及指标: 以与临床诊断、金标准方法和标准血清盘的检 测比较来评价,常以敏感性(包括临床敏感性)/ 特异性(包括临床特异性)和阳性符合率/阴性符 合率来表示。
临床特异性和临床敏感性
临床敏感性:在患有明确临床疾病的患者中,其检 测结果呈阳性或者超过正常值范围的比率 (即出现 阳性结果和确定患者患病)。 临床特异性:在没有特定临床疾病的患者中,其检 测结果呈阴性或者在正常值范围内的比率。
(一)不精密度的验证
纯定性试验:采用浓度接近临界值的分析物作为检 测材料,不宜采用阴性低值或强阳性样本来评价定性 检测方法的不精密度。 量值化定性试验:以COI(cut-off Index)或S/CO 比值作为分析方法的精密度评价指标。
纯定性测定不精密度的评估方法
CNAS-CL40:2012《医学实验室质量和能力认可准则在

CNAS-CL40:2012《医学实验室质量和能力认可准则在什么是CNAS-CL40准则?CNAS-CL40准则是指《医学实验室质量和能力认可准则》,它是由国家认可委员会(CNAS)制定的,旨在确保医学实验室的质量和能力达到国际标准。
它被认为是一项全面评估实验室质量管理和技术能力的规范性要求。
CNAS-CL40准则的主要内容CNAS-CL40准则包含了以下内容:管理要求医学实验室要建立质量管理体系,并按照其要求进行管理。
质量管理体系包括实验室设施的管理、人员的管理、设备的管理、试剂的管理、数据的管理以及文件的管理等。
技术要求医学实验室要能够进行各种常见和特殊的检验项目,并确保其结果准确可靠。
实验室需要有资质的技术人员、适当的设备和试剂。
报告要求医学实验室的报告必须符合相关法律法规和规范性文件的要求。
实验室需要建立标准的报告模板和流程,并保证报告的准确性、及时性和可追溯性。
审核和认证要求CNAS-CL40准则规定了医学实验室审核和认证的程序和要求。
医学实验室需要通过证书和标识来证明其质量和能力达到国际标准。
CNAS-CL40准则的作用CNAS-CL40准则的实施可以:提高医学实验室的质量和能力CNAS-CL40准则规范了医学实验室的管理、技术和报告等方面的要求,可以有效提高医学实验室的质量和能力。
提高医疗服务的水平医学实验室作为医疗服务的重要组成部分,其准确可靠的检验结果直接关系到医疗服务的质量和安全。
CNAS-CL40准则的实施可以提高医疗服务的水平,为病患提供优质服务。
促进国际贸易CNAS-CL40准则制定了国际标准的要求,医学实验室通过认证可以获得国际承认。
这可以促进医学实验室与国外供应商和客户的贸易往来,提高医学实验室在国际市场上的竞争力。
CNAS-CL40准则的应用医学实验室需要在满足CNAS-CL40准则的基础上,结合自身实际情况进行实施。
医学实验室可以按照CNAS-CL40准则的标准进行自评,也可以邀请第三方认证机构进行外部认证。
新通知|CNAS发布《医学实验室质量和能力认可准则在实验室信息系统的应用说明》等10份专业应用说明

新通知|CNAS发布《医学实验室质量和能⼒认可准则在实验室信息系统的应⽤说明》等10份专业应⽤说明各有关医学实验室、评审员:根据亚太实验室认可合作组织(APLAC)国际同⾏评审要求,中国合格评定国家认可委员会(CNAS)对CNAS-CL35:2012《医学实验室质量和能⼒认可准则在实验室信息系统的应⽤说明》等10份应⽤说明进⾏了修订,于2015年11⽉11⽇发布, 2016年1⽉1⽇实施。
主要变化为增加了对5.2.3的说明,同时进⾏了⼀些编辑性修改。
⽂件清单如下:AS-CL35:2012《医学实验室质量和能⼒认可准则在实验室信息系统的应⽤说明》(第3次修订)AS-CL36:2012《医学实验室质量和能⼒认可准则在分⼦诊断检验领域的应⽤说明》(第3次修订)AS-CL37:2012《医学实验室质量和能⼒认可准则在组织病理学检查领域的应⽤说明》(第3次修订)AS-CL38:2012《医学实验室质量和能⼒认可准则在临床化学检验领域的应⽤说明》(第3次修订)AS-CL39:2012《医学实验室质量和能⼒认可准则在临床免疫学定性检验领域的应⽤说明》(第3次修订)AS-CL40:2012《医学实验室质量和能⼒认可准则在输⾎医学领域的应⽤说明》(第3次修订)AS-CL41:2012《医学实验室质量和能⼒认可准则在体液学检验领域的应⽤说明》(第3次修订)AS-CL42:2012《医学实验室质量和能⼒认可准则在临床微⽣物学检验领域的应⽤说明》(第3次修订)AS-CL43:2012《医学实验室质量和能⼒认可准则在临床⾎液学检验领域的应⽤说明》(第3次修订)10. CNAS-CL51:2014《医学实验室质量和能⼒认可准则在细胞病理学检查领域的应⽤说明》(第2次修订)上述⽂件可以从CNAS⽹站()“实验室认可”栏⽬下载。
如有疑问,可垂询CNAS认可四处。
认可四处联系⼈:胡冬梅电话:************,邮箱:*************.cn。
(完整版)医学实验室质量和能力认可准则在临床生物化学检验领域的应用说明.pdf

CNAS-CL29医学实验室质量和能力认可准则在临床生物化学检验领域的应用说明Guidance on the Application ofMedical Laboratory Quality and Competence Accreditation Criteria in the Field of Clinical Biochemistry中国合格评定国家认可委员会CNAS-CL29:2007第1页共7页医学实验室质量和能力认可准则在临床生物化学检验领域的应用说明一引言临床生物化学检验是中国合格评定国家认可委员会(英文缩写:CNAS)对医学实验室的认可领域之一。
本文件是CNAS根据临床生物化学检验的特性而对CNAS—CL02:2006《医学实验室质量和能力认可准则》所作的进一步说明,并未增加或减少该准则的要求。
本文件的条款编号同CNAS—CL02:2006《医学实验室质量和能力认可准则》的相应条款编号。
由于仅对需说明的条款进行了说明,故章节号是不连续的。
本文件应与CNAS—CL02:2006《医学实验室质量和能力认可准则》同时使用。
适用时,还应符合CNAS—RL05:2006《实验室生物安全认可规则》、CNAS—CL05:2006《实验室生物安全认可准则》以及国家法规和标准(如 GB19781:2005 医学实验室-安全要求)的要求。
二应用说明5 技术要求5.1 人员5.1.1 实验室应提供明确的组织结构图和所有人员的岗位描述。
5.1.3 实验室负责人至少应具有以下资格:a) 执业医师,医学实验室工作经历或培训2年以上;或b) 医学实验室相关专业高级技术职称;或c) 检验、生物化学、化学、生物科学等主修专业博士,医学实验室工作经历或培训2年以上;或d) 检验、生物化学、化学、生物科学等主修专业硕士,医学实验室工作经历或培训4年以上;或检验、生物化学、化学、生物科学等主修专业学士,医学实验室工作经历或培训8年以上。
CNAS-CL02:2012《医学实验室质量和能力认可准则》(2019-2-20第二次修订)

CNAS-CL02医学实验室质量和能力认可准则Accreditation Criteria for the Quality and Competence of Medical Laboratories中国合格评定国家认可委员会CNAS-CL02:2012 第1 页共1 页前言本准则规定了中国合格评定国家认可委员会(英文缩写:CNAS)对医学实验室质量和能力进行认可的专用要求,包含了医学实验室为证明其按质量管理体系运行、具有相应技术能力并能提供正确的技术结果所必须满足的要求。
此外,我国对医学实验室的相关法律法规要求,医学实验室也须同时遵守。
医学实验室的服务对于患者的医疗很重要,因而应满足患者及负责患者医疗的临床人员的需求。
这些服务包括检验申请的安排,患者准备,患者识别,样品采集、运送和保存,临床样品的处理和检验以及后续的解释、报告及建议,此外,还包括医学实验室工作的安全和伦理方面的相关事项。
只要我国法律法规允许,鼓励医学实验室的服务能包含为咨询病例的患者进行检验,以及积极参与除诊断和患者服务之外的疾病预防,同时,也鼓励实验室为其专业工作人员提供适宜的教育和科研机会。
尽管本准则旨在用于目前公认的医学实验室服务所涉及的各类学科,但在临床生理学、医学影像学和医学物理学等其它服务和学科领域工作的人员,会发现本准则也是有用且适当的。
CNAS欢迎对医学实验室能力进行承认的各机构将本准则作为其工作的基础。
尽管本准则用于实验室认可(accreditation)而不意图用作认证(certification)目的,然而医学实验室符合本准则的要求即意味着满足持续发布技术上有效结果所必需的技术能力和管理体系要求。
本准则内容及条款号与国际标准ISO 15189:2012《医学实验室—质量和能力的要求》内容及条款号完全一致。
CNAS鼓励申请认可的机构购买和使用正版ISO标准及正版国家标准。
ISO 15189:2012及本准则均受到版权保护,未经恰当的授权禁止复制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CNAS-CL39:2012
第 5 页 共 10 页
3.14 确认试验 Confirmatory Test 用于验证筛查试验或者诊断试验结果的试验。
4
管理要求
4.1 组织与管理 4.1.1 实验室为独立法人单位的,应有医疗机构执业许可;实验室为非独立法人单位的, 其所属医疗机构执业证书的诊疗科目中应有医学实验室,自获准执业之日起,开展医学 检验工作至少 2 年。 4.1.5 h) 应至少有 1 名具有副高以上专业技术职务任职资格,从事医学检验工作至少 5 年的人员负责技术管理工作。 4.2 质量管理体系 4.3 文件控制 4.4 合同的评审 4.5 委托实验室的检验 4.6 外部服务和供应 4.7 咨询服务 4.8 投诉的解决 4.9 不符合项的识别和控制 4.10 纠正措施 4.11 预防措施 4.12 持续改进 4.13 质量和技术记录 4.14 内部审核 4.15 管理评审
注1:应在实际程度规定改变和未改变的条件,特别是如校准物、试剂批号、设备系统、操作者和环境条件等 变量。 注2:在体外诊断医疗器械评价中,一般选择的中间精密度条件代表体外诊断医疗器械在一长时间段内的实际 使用条件。 注3:相关统计学术语在 GB/T 6379.3/ISO 5725-3 中给出。 注4:中间精密度可用结果的分散性特征术语定量表达。如标准差、方差和变异系数。 注5:改写自 ISO/IEC 指南 99:2007,定义 2.22 和 2.23。
3.10 测量再现性 measurement reproducibility 再现性 reproducibility 在包括了不同地点、不同操作者、不同测量系统的测量条件下对同一或相似被测对 象重复测量的测量精密度。
注1:在临床化学上,术语室间精密度有时用于指此概念。 注2:在评估体外诊断医疗器械时,通常选择再现性条件来代表最大改变的条件(被称为再现性条件),此条 件产生独立实验室间比较结果时遇到的测量结果变异,如发生在室间比对计划中(例如,能力比对、外 部质量保证或实验室标准化试验)。 注3:再现性可以用结果分散性特征术语定量表达,如再现性标准差、再现性方差和再现性变异系数。相关统 计术语在 GB/T 6379.2/ISO 5725-2 中给出。 注4:不同测量系统可使用不同测量程序。 注5:应在实际程度上给出改变或不改变条件的说明。 注6:改写自 ISO/IEC 指南 99:2007,定ement precision 精密度 precision 在规定条件下,对同一或相似被测对象重复测量得到测量示值或测得量值间的一致 程度。
注1:测量精密度通常由不精密度的量度以数字表达,如规定测量条件下的标准差、方差和变异系数。 注2:规定的条件可以是,例如,测量的重复性条件、测量的中间精密度条件、或测量的再现性条件(见 GB/T 6379.5/ISO 5725-5)。 注3:测量精密度用于定义测量重复性、中间测量精密度和测量再现性。 注4:重复测量指在同一或相似样品上以不受以前结果影响的方式得到的结果。 [ISO/IEC 指南 99:2007,定义 2.15]
2012 年 09 月 13 日发布
2013 年 04 月 01 日实施
CNAS-CL39:2012
第 2 页 共 10 页
医学实验室质量和能力认可准则在 临床免疫学检验领域的应用说明
1 范围
本文件规定了CNAS对医学实验室临床免疫学定性检验领域认可的要求。 临床免疫学定性检验是指基于物质的化学或物理特性将其识别或分类的一组操作。 免疫学检验包括:(1)任何利用抗体与某物质作用而检测该物质的实验室方法。(2) 利用特异性抗原或抗体能够绑定到分析物的配体-绑定实验。 定性检验指只提供两种反应 结果的检测方法(即阳性/阴性或者是/否)。阳性结果只说明分析信号超过了分析阈值 (检出限)或临界值(临界值的设定给出简要的敏感性和特异性组合)。
3.11 中间测量精密度 intermediate measurement precision 中间精密度 intermediate precision 在一组测量条件下的测量精密度,这些条件包括相同的测量程序、相同地点并且对 相同或相似的被测对象在一长时间段内重复测量,但可包含其它相关条件的改变。
3.2 临界值 cut-off value 鉴别样品,作为判断特定疾病、状态或被测量存在或不存在的界限的量值。
注1:测量结果高于临界值判断为阳性而低于临界值判断为阴性。 注2:测量结果接近临界值判断为非确定性。 注3:临界值的选择决定检验的诊断特异性和诊断灵敏度。 [ISO 18113-1, 定义A.3.13]
3.7 诊断特异性 diagnostic specificity 体外诊断检验程序可以识别特定疾病或状态相关的目标标志物不存在的能力。
注1:在目标标志物已知不存在的样品中也定义为阴性百分数。 注2:诊断特异性以百分分数表达(数值分数乘以 100)。以 100×真阴性值数(TN)除以真阴性值数(TN) 加上假阳性值数(FP)的和来计算,或 100×TN/(TN+FP)。此计算基于从每个对象中只取出一个样品 的研究设计。 注3:目标状况由独立于被考察检查程序的标准定义。 [ISO 18113-1,定义 A.3.16]
3
术语和定义
由给定测量程序得到的测得量值,对于此值,在给定声称物质中存在某成分的误判
3.1 检出限 detection limit/limit of detection 概率为α时,声称不存在该成分的误判概率为β。
注1:IUPAC 建议 α 和 β 默认值等于 0.05。 注2:术语“分析灵敏度”有时用于代表检出限,但这样的用法现在不鼓励。 [ISO/IEC 指南 99:2007,定义 4.18]
3.12 筛查试验 Screening Test 用于检测整个人群(或者人群中的特定的一部分)中特定待测物或因子的存在情况 的试验。 3.13 诊断试验 Diagnostic Test 用于临床怀疑某种特定疾病或状况是否存在的诊断的试验。
2012 年 09 月 13 日发布 2013 年 04 月 01 日实施
2012 年 09 月 13 日发布
2013 年 04 月 01 日实施
CNAS-CL39:2012
第 6 页 共 10 页
5.1.11 实验室应制定员工能力评审的要求和方法,每年评审员工的工作能力;对新进员 工在最初 2 个月内应至少进行 2 次能力评审(间隔为 30 天) ,保存评审记录。当职责变 更时,或离岗 6 个月以上再上岗时,或政策、程序、技术有变更时,应对员工进行再培 训和再评审。没有通过评审的人员应经再培训和再评审,合格后才可继续上岗,并记录。 5.1.13 应提供工作人员对患者隐私及结果保密的声明及签字。 5.2 设施及环境条件 5.2.1 实验室应有充分工作空间,包括: (a) 实验台和设备的放置; (b) 试剂、样品和记录的贮存; (c) 危险物品储存与处理; (d) 废弃物的处理; (e) 实验操作; (f) 合理独立的办公区域; (g) 员工便利设施(洗涤间、茶水间、个人物品存放处等) 。 。 5.2.2 应实施安全风险评估, 如果设置了不同的控制区域, 应制定针对性的防护措施及合 适的警告。 5.2.5 应依据所用分析设备和实验过程对环境温湿度的要求,制定温湿度控制要求并记 录。应依据用途(如:试剂用水、生化仪用水)制定适宜的水质标准(如:电导率、微 生物含量等) ,并定期检测。应对稳压电源等电力系统的设施设备定期维护,并记录。 5.2.9 应有足够的、温度适宜的储存空间(如冰箱) ,用以保存临床样品和试剂,设置目 标温度和允许范围,并记录。应有温度失控时的处理措施,并记录。 5.2.10 应有指定内务管理人员(如:保洁人员) ,应有地面、台面的维护、清洁和消毒计 划及相关的记录。 5.3 实验室设备 5.3.2 实验室仪器设备的相关管理应符合如下要求: (a) 建议进行; (b) 性能标准及校准程序至少应按制造商规定, 对分析设备校准的基本项目至少 应包括加样系统、检测系统和温控系统; (c) 实验室应保存维护保养手册及相关记录。 实验室试剂的相关管理应符合如下要求: 实验室应提供仪器校准清单、计划、校准状态;设备新安装时应按法规或制 造商建议进行校准,并保留性能测试记录;投入使用之后的校准周期应按法规或制造商
注1:在临床化学上,术语批内或序列内精密度有时用于表示此概念。 注2:在评估体外诊断医疗器械时,通常选择重复性条件来代表基本不变的测量条件(被称为重复性条件), 此条件产生测量结果的最小变异。重复性信息可对故障排除目的有用处。 注3:重复性可以用结果分散性特征术语定量表达,如重复性标准差、重复性方差和重复性变异系数。相关统 计术语在 GB/T 6379.2/ISO 5725-2 中给出。 注4:改写自 ISO/IEC 指南 99:2007,定义 2.20 和 2.21。
5
技术要求
5.1 人员 5.1.2 临床免疫学实验室(以下简称实验室)特殊岗位(如抗 HIV 初筛、产前筛查、新 生儿疾病筛查等)工作人员应取得相应上岗证。 5.1.4 实验室负责人至少应具有以下资格:中级技术职称,医学检验专业背景,或相关专 业背景经过医学检验培训,2 年临床免疫工作经验。从事特殊检验项目的实验室还应符 合相关规范的要求。 认可的授权签字人应至少具有中级以上专业技术职务任职资格,从事申请认可授权 签字领域专业技术工作至少 3 年以上。 5.1.10 应实施安全培训和应急预案的演练,并记录。
3.3 分析灵敏度 analytical sensitivity 测量示值变化除以相应的被测量值变化所得的商。
注1:测量程序的灵敏度有可能依赖于被测量值。
2012 年 09 月 13 日发布
2013 年 04 月 01 日实施
CNAS-CL39:2012
第 3 页 共 10 页
注2:要考察的被测量值改变必须大于分辨率。 注3:一个测量系统的分析灵敏度是校准曲线的斜率。 注4:分析灵敏度不应用于表示检出限或定量限,并且不应与诊断灵敏度混淆。 [ISO/IEC 指南 99:2007,定义4.12]
