电化学方法第七章
第7章 熔盐电解

7.1 概述
二、熔盐电化学的特点
(1)虽然熔盐也属于第二类导体,但其形成条件和 状态、结构都和水溶液大不相同。
(2)熔盐电解过程一般都在高温下进行,因此导致 熔盐电极过程在热力学及动力学方面都具有特点。 熔盐中,电极过程的分步骤都具有很高的速度,因 此电解可以采用很高的电流密度,达到105A/m2。 (3)同样是因为高温,产生了熔盐中金属与熔盐的 相互作用,导致金属的溶解,高温还会对电化学反 应器的材料和结构提出更高的要求。
粘度与密度一样,是熔盐的一种特性。粘度与熔盐及其混 合熔体的组成和结构有一定关系。粘度大而流动性差的熔盐 电解质不适合于金属的熔盐电解,这是因为在这种熔体当中, 金属液体将与熔盐搅和而难于从盐相中分离出来。此外,粘 滞的熔盐电解质的电导往往比较小。因此,在熔盐电解中, 需选择熔盐成份,使其粘度小流动性好,可保证熔盐电解质 导电良好并能保证金属、气体和熔盐的良好分离。
7.2 熔盐电解电化学基础 一、熔盐的结构
熔盐即盐类的熔体,主要由阳离子和阴离子构成,
由于热作用,由电解质熔融形成。
熔盐的“准晶格模型” 熔盐的结构介于固态与气态之间,并更接近于 固态,具有“近程有序,远程无序”的特点。 关于熔盐的结构模型有“空穴模型”、“细胞模 型”、“自由体积模型”等,但都不完整。
7.2 熔盐电解电化学基础 三、熔盐电化学热力学的特点
2、由于熔盐温度高,温度变化的区间大,电极电 位变化范围大,甚至可能导致相互位置的变化。 3、电极电位测量比较困难,缺少通用的参比电 极,因而不易确定共同的电极电位标度,所得的 数据也较难比较。
7.2 熔盐电解电化学基础 四、熔盐电极反应的特点
第七章 熔盐电解
7.1 概述 7.2 熔盐电解电化学基础 7.3 铝电解 7.4 镁的熔盐电解 7.5 碱金属的熔盐电解
电化学理论与方法 第七章 电子转移动力学

j 0 越大,净反应速度也越大,电极反应越 当极化值相等时,
容易进行。
以同一净反应速度进行,则 j 0 越大,其可逆性越大 。
0 越大,所需要的极化值越小。 j
通过交换电流密度的大小,有助于判断电极反应的可逆性。
电极反应的可逆性:电极反应这种力图恢复平衡态的能力,或 者说去极化作用的能力称之为~。
交换电流密度值与电极体系动力学性质之间的关系
§6.2.3电极反应速度常数K
1、定义 电极电位为标准电极电位和反应粒子浓度为单位浓度时电 极反应的绝对速度,单位为cm/s,它本身排除了浓度变化的 影响。 K的表达式: F 0 F 0 F Kc R exp F KcO exp RT RT 已知
第6章 电子转移步骤动力学
内容
电极电位对电子转移步骤反应速度的影响 电子转移步骤的基本动力学参数 稳态电化学极化规律 多电子的电极反应 双电层结构对电化学反应速度的影响 电子转移步骤量子理论简介
§6.1.1电极电位对电子转移步骤活化能的影响
电极电位对电子转移步骤的直接影响是通过对该 步骤活化能的影响实现的。 反应活化能:反应物越过反应能垒而活化所需的 能量。
(6.8)
式中 即
K 和 K 分别表示电位 0 处的反应速度常数,
用 j 和 j 分别表示电位 0 处的还原反应速度和氧 化反应速度,则
0
0
j F Kc O j F KcR
代入式(6.8)、式(6.9)得
0
0
(6.12)
(6.13)
F j j exp RT
F 平 F 平 F Kc R exp j F KcO exp RT RT
南京工业大学物理化学课件第七章电化学

§7—3 溶液的电导率和摩尔电导率
弱电解质 : 电导率虽也随着浓度的增加而稍有增大,之后减小,但并不显著。
因为浓度增大时,单位体积溶液中的分子数目虽然增加,但电离度 却随之减小,以致离子数目的增加量并不显著而造成的。
摩尔电导率随浓度的变化与电导率的变化不同 当浓度降低时,由于粒子之间的相互作用力 减弱,正、负离子的运动速度加快,故摩尔 电导率增加;当浓度降低到一定程度之后, 强电解质的摩尔电导率几乎保持不变。
弱电解质溶液在稀释过程中,摩尔电导率 增加甚多随着浓度的下降,该 溶液中的电解质数量未变,但电离度随之 增大稀释到一定程度后,电离度迅 速增加, 致使离子数目增加很多,因而摩尔电导率 显著增大
§7—3 溶液的电导率和摩尔电导率
科尔劳施(德国化学家)根据实验结果发现:如以 C 的值为横坐 标,以 m 的值为纵坐标作图。强电解质的 m 与 C 之间有如下 关系:
z
• 上式又可写成: Q nF
• 因此 F 的物理意义:就是1克当量物质发生放电时通过溶液 的电量:此值也就是电极上有1mol电子转移时所带的电量。
F Le 6.0221023 m ol1 1.60221019 C 96484.6C • m ol1
96500C • m ol1
§7-2 离子的迁移数 1、离子的电迁移现象:
相连的电极是发生失去电子的反应是阳极。
§7-1 电化学的基本概念和法拉第定律
• 原电池:若电池能自发地在两极上发生化学反应并产生电流, 此时化学能转化为电能,则该电池就称为原电池
• 示意图如下:
§7-1 电化学的基本概念和法拉第定律
无论是在原电池还是电解池中,人们总是把电势较低的电极称为 负极,在电势较高的极称为正极,在电解池中阳极是正极,阴极 是负极。
第七章 电化学(4)

l g Ksp = −9.7566
K sp = 1 . 75 × 10 − 10
例7.9.3 将下列扩散过程设计成电池,并写出其电动势的能斯 特方程。
(1) H 2 (g, p1 ) → H 2 (g, p2 )
( p1>p2 )
(2) Ag + (a1 ) → Ag + (a2 )
解: (1) 阳极: 阴极:
Pt | O 2 (g, p ) | OH − H + | O 2 (g, p ) | Pt
同样,这两个电极中O2压力也必须相等。
例 7.9.2
利用表7.7.1的数据,求25℃ AgCl(s)在水中的溶度积Ksp。 解:溶解过程表示为
AgCl(s) = Ag + + Cl −
阳极 阴极
Ag = Ag + + e −
{
}
2.第二类电极
(1)金属—难溶盐电极 这类电极是在金属上覆盖一层该金属的难溶盐,然后 将它浸入含有与该难溶盐具有相同阴离子的溶液中而 构成的。 银-氯化银电极和甘汞电极。 甘汞电极
Cl − Hg 2 Cl 2 (s) Hg
电极反应为:
Hg 2 Cl 2 (s) + 2e − 2Hg + 2Cl −
当外加电压等于分解电压时,两极的电极电势分别称为氢和氧 的析出电势。 表7.10.1 几种电解质溶液的分解电压(室温,铂电极) 电解质 HCl HNO3 H2SO4 NaOH CdSO4 NiCl2 浓度c/mol·dm−3 1 1 0.5 1 0.5 0.5 电解产物 H2和Cl2 H2和O2 H2和O2 H2和O2 Cd和O2 Ni和Cl2 E分解/V 1.31 1.69 1.67 1.69 2.03 1.85 E理论/V 1.37 1.23 1.23 1.23 1.26 1.64
电化学理论与方法第七章电子转移动力学

电化学理论与方法第七章电子转移动力学电化学理论与方法是研究电化学现象的原理和方法的科学,涵盖了从电化学基础理论到应用实践的各个方面。
电子转移动力学是电化学领域的重要内容之一,研究电子在电极和电解质溶液界面上的传输过程以及相关的动力学行为。
电子转移动力学的研究内容主要包括电子转移速率、电子转移距离以及电子转移反应的机理等。
电子转移速率是指电子从电极表面传播到电解质溶液中的速度,是电子转移反应速率的重要指标。
电子转移速率受到多种因素的影响,包括电极表面的性质、电解质溶液中的浓度和温度等。
电子转移速率的研究可以通过实验方法来测量,如伏安法、电化学阻抗谱等。
电子转移距离是指电子从电极表面传输到电解质溶液中的平均距离,与电极表面的性质以及电解质溶液中的浓度相关。
电子转移距离的研究可以通过实验方法来测量,如扩散限电流法等。
电子转移反应的机理研究是电子转移动力学的核心内容,通过研究电子转移反应的机理可以揭示电子传输过程中的基本规律。
电子转移反应的机理研究包括电子转移的反应动力学、过渡态的结构和能量等。
电子转移反应的机理研究可以通过实验方法和理论方法相结合来进行,如电极动态电位法、电化学等温平衡法以及量子力学计算等。
电子转移动力学的研究对于理解和控制电化学反应过程具有重要意义。
通过对电子转移动力学的深入研究,可以揭示电极界面的复杂反应机理,优化电化学反应条件,提高电化学反应的效率和选择性。
此外,电子转移动力学的研究还可以为电催化剂的设计和开发提供理论依据。
综上所述,电子转移动力学是电化学理论与方法的重要研究内容,通过研究电子的传输过程和相关的动力学行为,可以揭示电极界面的复杂反应机理,优化电化学反应条件,提高电化学反应的效率和选择性。
电子转移动力学的研究对于电化学领域的发展和应用具有重要的意义。
第七章 电位分析法

离子敏感场效应晶体管(ISFET)
16-4 离子选择性电极性能参数
一、检测限与响应斜率 离子选择性电极能够检测到被测离子的最低浓 度。如图16-10中的CD与FG两延长线交叉点A 所对应的离子活度。 依能斯特方程直线的理论斜率为:
2.303 RT 理论斜率 zF
实际测定时斜率与理论值不一定相同。
(二)氟电极
氟电极的敏感膜由LaF3单晶片制成,为提高导电性, 在其中参杂少量Eu2+,Ca2+ ,二价离子的引入,使晶 格点阵中La3+被Eu2+,Ca2+取代,形成较多空的F-点 阵,增强了晶体的导电性,导电由F-完成。 氟离子选择性电极是目前最成功的单晶膜电极。
RT EF k ln a F F
能斯特方 程比较
EM
RT k ln a Ag F
二、电位选择性系数
电极选择性是指:电极对被测离子 和干扰离子响应的差异。 这种差异可用电极选择性系数Ki,j表 示。
RT z/m EM k ln( ai K iPot a ) ,j j zF
Ki,j表征了干扰离子对被测离子干扰的程度
玻璃电极的电位与溶液PH关系
玻璃电极的电位与溶液的PH有如下关系 RT E玻 k玻 ln aH F 2.303 RT E玻 k玻 pH 试 F
E玻 k玻 0.0592pH试
(三)阳离子玻璃电极
二、晶体电极
(一)电极结构 晶体电极的基本结构图16-5,其敏感膜 材料系难溶盐加压或拉制成的。能满足 室温下导电的难溶盐晶体只有少数几种, 氟化镧、硫化银、卤化银等。这类晶体 晶格能比较小,离子半径最小电荷最少 的离子F ,Ag+等参与导电。
第7章-电化学基础
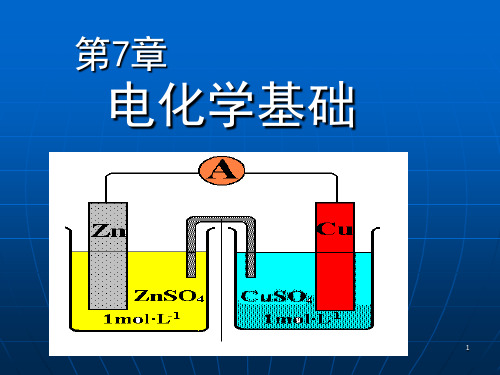
标准电极电势的测定
例5 简述测定Pt | Fe3+(1.0), Fe2+(1.0)的标准电极电势的方法及结果。 解 将Pt | Fe3+(1.0), Fe2+(1.0)与标准氢电极组成电池。从实验电流的方向确定此待测电极为正极,标准氢电极为负极。 测得电动势为0.771V,则 EΘ= E+Θ - E- Θ = EΘFe3+ /Fe2+ - EΘH+/H2
2.电极反应
任何氧化还原反应都可拆分为两个氧化还原电对的半反应(半电池反应,电极反应): Fe3+ + e → Fe2+ Sn2+ → Sn4+ + 2e 氧化-还原反应的实质: 两个共轭电对之间的电子转移反应。
3.电对拆分:
2MnO4-+5H2C2O4 + 6H+ → 2Mn2+ + 10CO2 + 8H2O MnO4- + 8H+ + 5e → Mn2+ + 4H2O ① H2C2O4 → 2CO2 + 2H+ + 2e ② MnO4- / Mn2+; CO2 /H2C2O4
例1 用离子-电子法配平下列氧化还原反应: K2Cr2O7 + KI + H2SO4 →K2SO4 + Cr2(SO4)3+I2+H2O 解:先写成离子反应式: Cr2O72- + I- + H+→ Cr3+ + I2 + H2O 将离子反应式分成两个半反应: I- → I2(电对:I2 /I- ) Cr2O72- + H+ → Cr3+ + H2O(电对:Cr2O72- /Cr3+) 分别配平两个半反应: 2I- = I2 + 2e Cr2O72- + 14 H+ + 6e = 2Cr3+ +7 H2O
电化学

负离子传输的电荷量 Q t 总电荷量Q
t t 1
由于正、负离子迁移的速率不同,所带的电荷不 等,因此它们在迁移电量时所分担的分数也不同。
溶液中离子的浓度为c+, c-,离子迁移速率u+, u单位时间内通过溶液某一截面的电量为Q=Q++Q-
③类型:
银电量计、铜电量计、气体电量计等。
以电极上析出(固体或气体)或溶解的物质的量测 定电量。如:铜电量计,银电量计和气体电量计。 例:阴极上析出0.4025g银,则通过的电量为: Q=nF=(0.4025/109) ×96500=356.3C 阴极上析出0.2016g铜,则通过的电量为: Q=nF=(0.2016/63.5) ×2 96500=612.7C
现在离子都是一价的,则离子运输电荷的 数量只取决于离子迁移的速度。
r r ,则导电任 1)设正、负离子迁移的速率相等, 务各分担2 mol,在假想的AA,BB平面上各有2 mol正、 负离子逆向通过。
当通电结 束,阴、阳两 极部溶液浓度 相同,但比原 溶液各少了 2 mol 而中部溶液浓度不变。
= 96485.309 C . mol-1 ≈ 96485 C . mol-1 ≈ 96500 C.mol-1
(2)例:
1 摩尔电子通过 AgNO3 1 mol Ag+ → Ag 107.868 g Ag↓
1 摩尔电子通过 CuSO4
1 / 2 mol Cu2+ → Cu 63.546 / 2 = 31.773 g Cu↓
AgNO3 KNO3
NaAc
0.465 0.508
0.544
0.465 0.509
0.555
物理化学第七章电化学

第七章电化学7.1电极过程、电解质溶液及法拉第定律原电池:化学能转化为电能(当与外部导体接通时,电极上的反应会自发进行,化学能转化为电能,又称化学电源)电解池:电能转化为化学能(外电势大于分解电压,非自发反应强制进行)共同特点:(1)溶液内部:离子定向移动导电(2)电极与电解质界面进行的得失电子的反应----电极反应(两个电极反应之和为总的化学反应,原电池称为电池反应,电解池称为电解反应)不同点:(1)原电池中电子在外电路中流动的方向是从阳极到阴极,而电流的方向则是从阴极到阳极,所以阴极的电势高,阳极的电势低,阴极是正极,阳极是负极;(2)在电解池中,电子从外电源的负极流向电解池的阴极,而电流则从外电源的正极流向电解池的阳极,再通过溶液流到阴极,所以电解池中,阳极的电势高,阴极的电势低,故阳极为正极,阴极为负极。
不过在溶液内部阳离子总是向阴极移动,而阴离子则向阳极移动。
两种导体:第一类导体(又称金属导体,如金属,石墨);第二类导体(又称离子导体,如电解质溶液,熔融电解质)法拉第定律:描述通过电极的电量与发生电极反应的物质的量之间的关系=Fn=FzQξ电F -- 法拉第常数; F = Le =96485.309 C/mol = 96500C/molQ --通过电极的电量;z -- 电极反应的电荷数(即转移电子数),取正值;ξ--电极反应的反应进度;结论: 通过电极的电量,正比于电极反应的反应进度与电极反应电荷数的乘积,比例系数为法拉第常数。
依据法拉第定律,人们可以通过测定电极反应的反应物或产物的物质的量的变化来计算电路中通过的电量。
相应的测量装置称为电量计或库仑计coulometer,通常有银库仑计和铜库仑计 。
7.2 离子的迁移数1. 离子迁移数:电解质溶液中每一种离子所传输的电量在通过的总电量中所占的百分数,用 tB 表示1=∑±=-++t 或显然有1:t t离子的迁移数主要取决于溶液中离子的运动速度,与离子的价数无关,但离子的运动速度会受到温度、浓度等因素影响。
应用电化学 课件 第七章 电化学研究方法介绍.ppt

单电势阶跃是指在暂态实验开始以前,电极 电势处于开路电位,实验开始时,施加于工作 电极上的电极电势突跃至某一指定值,同时记 录电流—时间曲线(计时电流法)或电量—时间 曲线(计时电量法).直到实验结束为止。图 1.15为单电位阶跃实验的电势—时间曲线和得 到的相应的电流—时间响应曲线。
刚开始时电流迅速增加达到最大值,此 时暂态电流可能由于双电层充电引起,达到 最大值后电流又随时间延长而下降,说明电 极反应可能是扩散控制或电化学步骤和扩散 联合控制。通过分析实验得到的电流—时间 曲线同样可以确定电极反应的机理和测定动 力学参数等,本部分只介绍扩散控制下的电 位阶跃法处理结果。
计时电量法是指在电势阶跃实验中将通过电极/ 溶液界面的总电量作为时间的函数进行记录,得 到了相应的电量Q-t的响应。对于扩散控制的电 极 反 应 , 电 量 — 时 间 关 系 式 可 由 Cottrell 方 程 (1.74)积分得到:
扩散系数D的值同样可以从Q-t1/2直线斜率求得。
需要指出的是:对于扩散控制的电极反应,由于 溶液电阻和双电层的存在及仪器的限制,单电势 阶跃实验有效的时间范围在几十微秒到200s之间。 同时,与计时电流法相比,计时电量法的优点是: 由于电量是电流的积分,在很短的时间内电量受 双电层的影响,但在长时间范围内充电电流等对 总电量的影响很快就可以忽略,这样得到的结果 就会更真实;而且双电层充电和吸附物质对总电 量的贡献可以与反应物的扩散区别开来:对于双 电层充电和吸附物质存在时的单电位阶跃实 验.公式(1.75);T表达为:
在暂态阶段,电极电势、电极表面的吸附状态以 及电极/溶液界面扩散层内的浓度分布等都可能与时间 有关,处于变化中。稳态的电流全部是由于电极反应 所产生的,它代表着电极反应进行的净速度,而流过 电极/溶液界面的暂态电流则包括了法拉第电流和非法 拉第电流。暂态法拉第电流是由电极/溶液界面的电荷 传递反应所产生,通过暂态法拉第电流可以计算电极 反应的量,暂态非法拉第电流是由于双电层的结构改 变引起的,通过非法拉第电流可以研究电极表面的吸 附和脱附行为,测定电极的实际表面积。
第7章 电化学交流阻抗

第7章 电化学交流阻抗交流阻抗方法是一种暂态电化学技术,具有测量速度快,对研究对象表面状态干扰小的特点。
交流阻抗技术作为一种重要的电化学测试方法不仅在电化学研究[例如,电池、电镀、电解、腐蚀科学(金属的腐蚀行为和腐蚀机理、涂层防护机理、缓蚀剂、金属的阳极钝化和孔蚀行为,等等)]与测试领域应用,而且也在材料、电子、环境、生物等多个领域也获得了广泛的应用和发展。
传统EIS 反映的是电极上整个测试面积的平均信息,然而,很多时候需要对电极的局部进行测试,例如金属主要发生局部的劣化,运用EIS 方法并不能很清晰地反映金属腐蚀的发生发展过程,因此交流阻抗方法将向以下方向发展:(1) 测量电极微局部阻抗信息;(2) 交流阻抗测试仪器进一步提高微弱信号的检测能力和抗环境干扰能力;(3) 计算机控制测量仪器和数据处理的能力进一步增强,简化阻抗测量操作程序,提高实验效率。
7.1 阻抗之电工学基础 (1) 正弦量设正弦交流电流为:i(t)=I m sin(ωt +φ) (图7-1)。
其中,I m 为幅值;ωt +φ为相位角,初相角为φ;角频率ω:每秒内变化的弧度数,单位为弧度/秒(rad/s)或1/s 。
周期T 表示正弦量变化一周所需的时间,单位为秒(s);频率f :每秒内的变化次数,单位为赫兹(Hz);周期T 和频率互成倒数,即Tf1=,πf Tπω22==。
正弦量可用相量来表示。
相量用上面带点的大写字母表示,正弦量的有效值用复数的模表示,正弦量的初相用复数的幅角来表示。
表示为:i t j I Iei I ϕϕω∠==+•)(.,正弦量与相量一一对应。
一个正弦量的瞬时值可以用一个旋转的有向线段在纵轴上的投影值来表示(图7-2)。
图7-2 正弦量的旋转矢量表示()m sin u U t ωϕ=+ϕϕmU tωω+1+j初始矢量tj j m e e U ωϕ旋转因子图7-1 正弦量的波形三要素:振幅、频率、初相位矢量长度=振幅;矢量与横轴夹角=初相位;矢量以角速度ω按逆时针方向旋转(2) 阻抗和导纳的定义对于一个含线性电阻、电感和电容等元件,但不含有独立源的一端口网络N ,当它在角频率为ω的正弦电压(或正弦电流)激励下处于稳定状态时,端口的电流(或电压)将是同频率的正弦量。
第七章环境有机污染物的电化学分析

2020/2/22
5.滴汞电极的特点
(1) 电极毛细管口处的汞滴很小, 易形成浓差极化; (2) 汞滴不断滴落,使电极表面不断 更新,重复性好。(受汞滴周期性滴落 的影响,汞滴面积的变化使电流呈快速 锯齿性变化); (3) 氢在汞上的超电位较大; (4) 金属与汞生成汞齐,降低其析出 电位,使碱金属和碱土金属也可分析。 (5)汞容易提纯。
0.1mol/L 甘汞电极 0.1 mol / L +0.3365
标准甘汞电极(NCE) 1.0 mol / L +0.2828
饱和甘汞电极(SCE) 饱和溶液 +0.2438
温度校正,对于SCE,t ℃时的电极电位为: Et= 0.2438- 7.6×10-4(t-25) (V)
2020/2/22
2020/2/22
4. 根据电解过程中所消耗的电量来进行分析 的方法,称为库仑分析; 5. 根据电解过程中,电流与电压曲线而建 立起来的分析方法,称为伏安法,伏安法中 使用滴汞电极的,称为极谱分析。在环境有 机污染物中,极谱分析及溶出伏安法应用较 为广泛。
2020/2/22
第二节 化学电池
电极:将金属放入对应的溶液后所组成 的系统。
2020/2/22
一、与普通电解的区别(特点)
1. 极谱分析中电解池的工作电极为滴汞电极, 参比电极为甘汞电极或其它大面积的电极; 滴汞电极一般作为负极,特点是表面积很小。 2. 极谱分析所用试液的浓度较低,一般为 1μg/L~mg/L。
2020/2/22
(完整版)第七章电化学答案

第七章 电化学第七章 电化学7.1 用铂电极电解CuCl 2溶液。
通过的电流为20A ,经过15min 后,问:⑴在阴极上能析出多少质量的Cu ?⑵在阳极上能析出多少体积的27℃、100kPa 下的Cl 2(g) ?解:⑴ 阴极反应:Cu 2++2e -=Cu阳极反应:2Cl -=Cl 2+2e -电解反应:Cu 2++2Cl -= Cu + Cl 2溶液中通过的电量为: Q=I·t = 20A×15×60s=18000C由法拉第定律和反应进度知:(Cu)(Cu)/(Cu)(Cu)(Cu)Q n m M zF ξνν∆=== (Cu)(Cu)1800064g/mol (Cu) 5.969g 296485.309C/molQ M C m zF ν⋅⋅⨯∴===⨯⑵22(Cl )(Cl )n ξν∆=222(Cl )(Cl )0(Cl )0.0933mol n n νξ∆=-=⋅=30.09338.314300.15dm 100nRT V p ⨯⨯∴== = 2.328dm 37.3用银电极电解AgNO 3水溶液。
通电一段时间后,阴极上有0.078g 的Ag(s)析出,阳极区溶液质量23.376g ,其中含AgNO 3 0.236g 。
已知通电前溶液浓度为1kg 水中溶有7.39g 的AgNO 3。
求t(Ag +)和t(NO 3-)。
解:方法一:t +=阳离子迁出阳极区的物质的量发生电极反应的物质的量电解后阳极区溶液质量23.376g ,其中含AgNO 3 0.236g ,设电解前后水量不变,则电解前阳极区AgNO 3的量为:37.39(23.3760.236)(AgNO )1000m g ⨯-==0.1710g 电解过程阳极反应为:Ag = Ag ++e -产生的Ag +溶入阳极区。
因此迁出阳极区的Ag +的物质的量为:n n n n =-迁出电电应+解前解后反第七章 电化学3Ag (M(AgNO )(Ag )1/M(Ag)n n n m m t n m +--==+电电应电电应+)/解前解后反解前解后反(0.1710.236)/169.9410.4710.078/107.9-=+= 3(NO )0.529t -=方法二:t -==阴离子迁出阴极区的物质的量阴离子迁入阳极区的物质的量发生电极反应的物质的量发生电极反应的物质的量3[M(AgNO )(((NO )()()/M(Ag)m m n n t n m -3--==电解后电解前]/电解后)电解前)反应反应(0.2360.171)/169.940.5290.078/107.9-== (Ag )0.471t +=7.5已知25℃时0.02mol/dm 3KCl 溶液的电导率为0.2768 S/m 。
电化学原理-第七章-气体电极过程

则: H 平
常数
RT F
ln
c OH
1
RT
F
ln
jc
减小59mV
pH值增大 一个单位
不变时
(7.21)
与实验结果吻合
2、迟缓放电机理的实验依据
当酸浓度很低时,由于 1效应,使酸的浓度 变化时, 不H 随之改变。(图7.2现象)
H
常数 1
RT F
ln
c H
1
1
RT
F
ln
jc
两项影响抵消
低过电位金属:
c 0.001mol / L
(3)溶液组成的影响
在浓的纯酸溶液中, 析氢过电位随氢离子 浓度升高而降低。
高过电位金属:
c 0.5 ~ 1.0mol / L
低过电位金属:
c 0.001mol / L
(3)溶液组成的影响
同一过电位下,高浓 度对应的电流密度 (反应速度)比低浓 度高很多。
析氢过电位 a b log j (7.1)
0.1~ 0.14V 电流密度
j 1A / cm2时的析氢过电位 与金属材料的性质、表面状态、 溶液组成、温度有关
二、析氢过电位及其影响因素
在很低的电流密度下有:
析氢过电位
j (7.2)
电流密度
j 1A / cm2时的析氢过电位 与金属材料的性质、表面状态、 溶液组成、温度有关
1
常数
2RT F
ln( a)
RT F
ln
cH
(3.50)
2、迟缓放电机理的实验依据
当酸浓度较高时,可忽略 效1 应,使 随H cH 升高而降低。(图7.2现象)
H
常数 1
物理化学 第七章电化学总结

如果正、负离子荷电量不等,如果电极本身也发生反 应,情况就要复杂一些。
29
(2)迁移数 transfer number 某种离子运载的电流与通过溶液的总电流之比 称为该离子的迁移数, 以t 表示。
即每有1mol Ag+被还原或1molAg沉积下来,通过的 电量一定为96500C
21
2+ + 2e对于电极反应:Cu = Cu
z=2, Q=96500C 时:
Q 96500 C 0.5mol zF 2 96500 mol 1 C
n(Cu ) (Cu )
n(Cu) (Cu) 0.5mol
49
3.摩尔电导率与浓度的关系
例1例2例3例4例5
0.04 HCl 0.03 0.02 NaOH
0.01
0 0
AgNO3 CH3COOH 0.5 1.0 1.5
•随着电解质浓度c降低, 离子间引力减小, 离子 运动速度增加,故摩尔 电导率m增大。
m/(S m2 mol-1)
c , F , v , m 。
F=L· e
=6.0221367×1023 mol-1×1.6022×10-19 C =96485.309 C· -1 mol
≈96500 C· -1 mol
19
对各种电解质溶液, 每通过96485.309C的电量,
在任一电极上发生得失1mol电子的反应, 同时相
对应的电极反应的物质的量亦为1mol(所选取的 基本粒子荷一价电).
第7章 电化学习题答案

第7章 电化学7.1 用铂电极电解CuCl 2溶液。
通过的电流为20 A ,经过15 min 后,问:(1)在阴极上能析出多少质量的Cu? (2) 在27 °C ,100 kPa 下阳极上能析出多少体积的Cl 2(g )? 解: Pt 电极电解CuCl 2溶液时的电极反应,为电极反应的反应进度为因此:7.2 用Pb(s)电极电解Pb (NO 3)2溶液,已知溶液浓度为1 g 水中含有Pb (NO 3)2 1.66 × 10-2 g 。
通电一定时间后,测得与电解池串联的银库仑计中有0.1658g 的银沉积。
阳极区的溶液质量为62.50 g ,其中含有Pb (NO 3)2 1.151g ,计算Pb 2+的迁移数。
解:1231229.331])(NO [9.107)(--∙=∙=mol g Pb M molg Ag M用Pb (s )电极电解Pb (NO 3)2溶液时的阳极反应为-++→e Pb Pb 22设电解过程中水量保持不变,电解前阳极区Pb (NO 3)2的物质的量为molmol mol g Pb Pb n 312232310075.322.3310184.122.331)]151.150.62(11066.1[])(NO M[])(NO m[---⨯==∙-⨯⨯==电解前电解后阳极区Pb (NO 3)2的物质的量为mol 10475.3mol 22.331151.1])(NO M[])(NO m[3-2323⨯===)(电解后Pb Pb n电解过程中因电极反应溶解下来的Pb 2+的物质的量为mol mol Ag n n 3107683.0)9.1071658.0(21)(21-⨯=⨯==反应 Pb 2+迁移的物质的量molmol 4310683.310475.3-7683.0075.3n -n n n --⨯=⨯+=+=)(电解后反应电解前迁移于是,479.0107683.010683.3n n )(342=⨯⨯==--+molmol Pb t 反应迁移 7.3 用银电极电解AgNO 3溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)工作电极—研究的对象
合理选择处理工作电极方法
消除材料组织结构与内应力的影响
电极表面抛光:光洁度,磨料的种类影响重现性。
氧化性抛光料会使金属表面发生钝化。
要选择逐级加工的方法,每次都达到同一光洁度。
电极表面清洗:除去表面污物以及抛光时的夹杂物。
几种常用的鲁金毛细管的形式和位置
同相放大电路
很大,所以,运放两输入端之间的同相放大电路
无电压跟随器时
负载上得到的电压
R 电压跟随器时
i
p
≈0,v p=v s
反相放大电路反相放大电路
利用理想运放的虚短路特性,写出图示电路中结点①的KCL 方程
3
o
2S211S R u R u R u −=+用外加电源法求出a 、b 两端的VCR 关系, 从而求得输入电阻R ab 。
利用理想运放的虚短路特性,再用观察法列出
o
2
12
2u R R R u u +=
=电化学测试中的电子电路原理
R1100k ΩA1
Vin
D0D1D2
D3恒电位原理
Working
Counter
R m
i
-+
-+
-+
Ref.
Differential Electrometer
Power Amp。
