高中物理竞赛-热学部分
高中物理竞赛——热学部分

热学部分—自主招生考试一.分子动理论分自动理论的基本内容:物质是由大量分子组成的,分子永不停息地做无规则热运动,分子间存在着相互作用的引力和斥力。
1. 1231002.6N -⨯=mol A 是联系微观世界和宏观世界的桥梁,具体表现在:(1)固体、液体分子微观量的计算(估算) ①分子数:A A A N V v N M m nN 00N === ②每个分子的质量为:A01N M =m ③每个分子体积(分子所占空间):A A N M N V v ρ001==,其中ρ为固体或液体的密度 ④分子直径的估算:把固体、液体分子看成球形,则分子直径3031/6/6A N V v d ππ==;把固体、液体分子看成立方体,则3031/A N V v d ==.(2)气体分子微观量的估算方法(油膜法估测分子的直径,分子直径的数量级约为10-10m ) ①物质的量4.22n V =,V 为气体在标况下的体积. ②分子间距的估算:设想气体分子的分布均匀,每个分子平均占有一定的体积,假设为立方体,则分子间距30V d =,而每个分子所占体积A mol N V V =0,则分子间距为3Amol N V d =. 2.分子在做永不停歇的无规则的热运动。
扩散现象是分子的运动,布朗运动是悬浮微粒的无规则运动,是液体分子的无规则运动引起的.布朗运动的剧烈程度不仅跟颗粒的大小有关,还跟液体或气体的温度有关,颗粒越小、温度越高布朗运动越剧烈。
3.分子间存在相互作用力:引力与斥力,都随距离增加减小,但是斥力对距离更敏感,所以分子力很近的时候体现出斥力,在平衡位置体合力等于零,平衡位置外体现出引力。
二.物体的内能物体内所有分子的动能和势能的总叫物体的内能.1.温度是分子平均动能的标志,理想气体的内能正比于温度与气体的物质的量.2.分子势能的大小与物体的体积有关.3.做功和热传递是改变物体内能的两种方式.三.热力学定律热力学第零定律:如果两个系统分别和第三个系统处于热平衡,那么这两个系统也处于热平衡状态。
高中物理竞赛十年预赛真题热学纯手打word版含答案

十年真题-热学(预赛)1.(34届预赛2)系统1和系统2质量相等,比热容分别为C 1和C 2,两系统接触后达到够达到共同的温度T ,整个过程中与外界(两系统之外)无热交换.两系统初始温度T 1和T 2的关系为A .T 1=C 2C 1(T -T 2)-TB .T 1=C 1C 2(T -T 2)-T C .T 1=C 1C 2(T -T 2)+T D .T 1=C 2C 1(T -T 2)+T 2.(31届预赛1)一线膨胀系数为α的正立方体物块,当膨胀量较小时,其体膨胀系数等于A .αB .α1/3C .α3D .3α3.(29届预赛1)下列说法中正确的是A .水在0℃时密度最大B .一个绝热容器中盛有气体,假设把气体中分子速率很大的如大于v A 的分子全部取走,则气体的温度会下降,此后气体中不再存在速率大于v A 的分子C .杜瓦瓶的器壁是由两层玻璃制成的,两层玻璃之间抽成真空,抽成真空的主要作用是既可降低热传导,又可降低热辐射D .图示为一绝热容器,中间有一隔板,隔板左边盛有温度为T 的理想气体,右边为真空.现抽掉隔板,则气体的最终温度仍为T4.(28届预赛2)下面列出的一些说法中正确的是A .在温度为20ºC 和压强为1个大气压时,一定量的水蒸发为同温度的水蒸气,在此过程中,它所吸收的热量等于其内能的增量.B .有人用水银和酒精制成两种温度计,他都把水的冰点定为0度,水的沸点定为100度,并都把0刻度与100刻度之间均匀等分成同数量的刻度,若用这两种温度计去测量同一环境的温度(大于0度小于100度)时,两者测得的温度数值必定相同.C .一定量的理想气体分别经过不同的过程后,压强都减小了,体积都增大了,则从每个过程中气体与外界交换的总热量看,在有的过程中气体可能是吸收了热量,在有的过程中气体可能是放出了热量,在有的过程中气体与外界交换的热量为零.D .地球表面一平方米所受的大气的压力,其大小等于这一平方米表面单位时间内受上方作热运动的空气分子对它碰撞的冲量,加上这一平方米以上的大气的重量.5.(27届预赛2)烧杯内盛有0℃的水,一块0℃的冰浮在水面上,水面正好在杯口处.最后冰全部融化成0℃的水.在这过程中A .无水溢出杯口,但最后水面下降了B .有水溢出杯口,但最后水面仍在杯口处C .无水溢出杯口,水面始终在杯口处D .有水溢出杯口,但最后水面低于杯口6.(27届预赛3)如图所示,a和b是绝热气缸中的两个活塞,它们把气缸分成甲和乙两部分,两部分中都封有等量的理想气体.a是导热的,其热容量可不计,与气缸壁固连.b 是绝热的,可在气缸内无摩擦滑动,但不漏气,其右方为大气.图中k为加热用的电炉丝.开始时,系统处于平衡状态,两部分中气体的温度和压强皆相同.现接通电源,缓慢加热一段时间后停止加热,系统又达到新的平衡,则A.甲、乙中气体的温度有可能不变B.甲、乙中气体的压强都增加了C.甲、乙中气体的内能的增加量相等D.电炉丝放出的总热量等于甲、乙中气体增加内能的总和7.(27届预赛4)一杯水放在炉上加热烧开后,水面上方有“白色气”;夏天一块冰放在桌面上,冰的上方也有“白色气”.A.前者主要是由杯中水变来的“水的气态物质”B.前者主要是由杯中水变来的“水的液态物质”C.后者主要是由冰变来的“水的气态物质”D.后者主要是由冰变来的“水的液态物质”8.(26届预赛3)一根内径均匀、两端开中的细长玻璃管,竖直插在水中,管的一部分在水面上.现用手指封住管的上端,把一定量的空气密封在玻璃管中,以V0表示其体积;然后把玻璃管沿竖直方向提出水面,设此时封在玻璃管中的气体体积为V1;最后把玻璃管在竖直平面内转过900,让玻璃管处于水平位置,设此时封在玻璃管中的气体体积为V2.则有A.V1>V0≥V2B.V1>V0>V2C.V1=V2>V0D.V1>V0,V2>V09.(25届预赛4)如图所示,放置在升降机地板上的盛有水的容器中,插有两根相对容器的位置是固定的玻璃管a和b,管的上端都是封闭的,下端都是开口的.管内被水各封有一定质量的气体.平衡时,a管内的水面比管外低,b管内的水面比管外高.现令升降机从静止开始加速下降,已知在此过程中管内气体仍被封闭在管内,且经历的过程可视为绝热过程,则在此过程中A.a中气体内能将增加,b中气体内能将减少B.a中气体内能将减少,b中气体内能将增加C.a、b中气体内能都将增加D.a、b中气体内能都将减少10.(25届预赛5)图示为由粗细均匀的细玻璃管弯曲成的“双U形管”,a、b、c、d 为其四段竖直的部分,其中a、d上端是开口的,处在大气中.管中的水银把一段气体柱密封在b、c内,达到平衡时,管内水银面的位置如图所示.现缓慢地降低气柱中气体的温度,若c中的水银面上升了一小段高度Δh,则A.b中的水银面也上升ΔhB.b中的水银面也上升,但上升的高度小于ΔhC .气柱中气体压强的减少量等于高为Δh 的水银柱所产生的压强D .气柱中气体压强的减少量等于高为2Δh 的水银柱所产生的压强11.(31届预赛9)图中所示的气缸壁是绝热的.缸内隔板A 是导热的,它固定在缸壁上.活塞B 是绝热的,它与缸壁的接触是光滑的,但不漏气.B 的上方为大气.A 与B 之间以及A 与缸底之间都盛有n mol 的同种理想气体.系统在开始时处于平衡状态,现通过电炉丝E 对气体缓慢加热.在加热过程中,A 、B 之间的气体经历_________过程,A 以下气体经历________过程;气体温度每上升1K ,A 、B 之间的气体吸收的热量与A 以下气体净吸收的热量之差等于_____________.已知普适气体常量为R .答案:等压、等容、nR解析:在加热过程中,AB 之间的气体的压强始终等于大气压强与B 活塞的重力产生的压强之和,故进行的是等压变化,由于隔板A 是固定在气缸内的,所以,A 以下的气体进行的是等容变化,当气体温度升高1K 时,AB 之间的气体吸收的热量为Q 1=P ΔV +ΔU ,A以下的气体吸收的热量为Q 2=ΔU ,又根据克拉伯龙方程p ΔV =nR ΔT ,所以Q 1-Q 2=p ΔV=nR .12.(28届预赛6)在大气中,将一容积为0.50m 3的一端封闭一端开口的圆筒筒底朝上筒口朝下竖直插人水池中,然后放手,平衡时,筒内空气的体积为0.40m 3.设大气的压强与10.0m 高的水柱产生的压强相同,则筒内外水面的高度差为 .答案:2.5m13.(34届预赛13)横截面积为S 和2S 的两圆柱形容器按图示方式连接成一气缸,每隔圆筒中各置有一活塞,两活塞间的距离为l ,用硬杆相连,形成“工”字形活塞,它把整个气缸分隔成三个气室,其中Ⅰ、Ⅲ室密闭摩尔数分别为ν和2ν的同种理想气体,两个气室内都有电加热器;Ⅱ室的缸壁上开有一个小孔,与大气相通;1mol 该种气体内能为CT(C 是气体摩尔热容量,T 是气体的绝对温度).当三个气室中气体的温度均为T 1时,“工”字形活塞在气缸中恰好在图所示的位置处于平衡状态,这时Ⅰ室内空气柱长亦为l ,Ⅱ室内空气的摩尔数为32ν.已知大气压不变,气缸壁和活塞都是绝热的,不计活塞与气缸之间的摩擦.现通过电热器对Ⅰ、Ⅲ两室中的气体缓慢加热,直至Ⅰ室内气体的温度升为其初始状态温度的2倍,活塞左移距离d .已知理想气体常量为R ,求:(1)Ⅲ室内气体初态气柱的长度;(2)Ⅲ室内气体末态的温度;(3)此过程中ⅠⅢ室密闭气体吸收的总热量.解析:(1)设大气压强为p 0.初态:Ⅰ室内气体压强为p 1;Ⅲ室内气体压强为p 1′,气柱的长度为l ′.末态:Ⅰ室内气体压强为p 2;Ⅲ室内气体压强为p 2′.由初态到末态:活塞左移距离为d .对初态应用气体状态方程,对Ⅰ室气体有:p 1lS =νRT 1 ①对Ⅱ室内气体有:p 0(l 2×S +l 2×2S )=32ν0RT 1②对Ⅲ室内气体有:p1′l′(2S)=(2ν)RT1③由力学平衡条件有:p1′(2S)=p1S+p0(2S-S) ④由题给条件和①②③④式得:l′=ν2ν1+ν0l=2νν+ν0l⑤(2)对末态应用气体状态方程,对Ⅰ室内气体有:p2(l-d)S=νRT2=νR·2T1⑥对Ⅲ室内气体有:p2′(l′+d)(2S)=(2ν)RT2′⑦由力学平衡条件有:p2′(2S)=p2S+p0(2S-S) ⑧联立②⑤⑥⑦⑧和题给条件得:T2′=2νl+(ν+ν0)d(l-d)(ν+ν0)⎝⎛⎭⎫1+ν02νl-dl T1⑨(3)大气对密闭气体系统做的功为W=p0(2S-S)(-d)=-p0Sd=-dlν0RT1⑩已利用②式.系统密闭气体内能增加量为:ΔU=νC(T2-T1)+(2ν)C(T2′-T1)=νC(2T2′-T1) ⑪由⑨⑩式得:ΔU=2νl+(ν+ν0)d(l-d)(ν+ν0)⎝⎛⎭⎫2ν+l-dlν0CT1-νCT1⑫系统吸收的热量为:Q=ΔU-W=2νl+(ν+ν0)d(l-d)(ν+ν0)⎝⎛⎭⎫2ν+l-dlν0CT1-νCT1+dlν0RT1⑬参考评分:第(1)问9分,①②③④式各2分,⑤式1分.第(2)问4分,⑥⑦⑧⑨式各1分.第(3)问7分,⑩⑪式各2分,⑫式1分,⑬式2分.14.(33届预赛16)充有水的连通软管常常用来检验建筑物的水平度.但软管中气泡会使得该软管两边管口水面不在同一水平面上.为了说明这一现象的物理原理,考虑如图所示的连通水管(由三段内径相同的U形管密接而成),其中封有一段空气(可视为理想气体),与空气接触的四段水管均在竖直方向;且两个有水的U形管两边水面分别等高.此时被封闭的空气柱的长度为L a .已知大气压强P 0、水的密度ρ、重力加速度大小为g ,L 0≡P 0/(ρg).现由左管口添加体积为ΔV =xS 的水,S 为水管的横截面积,在稳定后:(1)求两个有水的U 形管两边水面的高度的变化和左管添水后封闭的空气柱的长度;(2)当x <<L 0、L a<<L 0时,求两个有水的U 形管两边水面的高度的变化(用x 表出)以及空气柱的长度.已知1+z ≈1+12z ,当z <<1. 解析:解法(一)(1)设在左管添加水之前左右两个U 形管两边水面的高度分贝为h 1和h 2,添加水之后左右两个U 形管两边水面的高度分别为h 1L 和h 1R 、h 2L 和h 2R .如图所示,设被封闭的空气的压强为p ,空气柱的长度为L b .水在常温常压下可视为不可被压缩的流体,故:2h 1+x =h 1L +h 1R ①2h 2=h 2L +h 2R ②由力学平衡条件有:p 0+ρgh 1L =p +ρgh 1R ③p 0+ρgh 2R =p +ρgh 2L④由于连通管中间高度不变,有:h 1+h 2+L a =h 1R +h 2L +L b ⑤由玻意耳定律得:p 0L a =pL b ⑥联立①②③④⑤⑥式得p 满足的方程:L 0p 0p 2+⎝⎛⎭⎫L a -L 0-x 2p -p 0L a =0 解得:p =p 02L 0⎣⎡⎦⎤L 0-L a +x 2+⎝⎛⎭⎫L a -L 0-x 22+4L a L 0 ⑦ 将⑦式带入⑥式得:L b =12⎣⎡⎦⎤L a -L 0-x 2+⎝⎛⎭⎫L a -L 0-x 22+4L a L 0 ⑧ 由①②③④⑦式得:Δh 1L ≡h 1L -h 1=x -Δh 1R=x -L 02+14[L 0-L a +x 2+⎝⎛⎭⎫L a -L 0-x 22+4L a L 0] ⑨ =5x -2L a -2L 08+14⎝⎛⎭⎫L a -L 0-x 22+4L a L 0 Δh 1R ≡h 1R -h 1=L 0+x 2-p 2ρg=L 0+x 2-14⎣⎡⎦⎤L 0-L a +x 2+⎝⎛⎭⎫L a -L 0-x 22+4L a L 0 ⑩=3x +2L a +2L 08-14⎝⎛⎭⎫L a -L 0-x 22+4L a L 0 Δh 2L ≡h 2L -h 2=L 02-p 2ρg =L 02-14⎣⎡⎦⎤L 0-L a +x 2+⎝⎛⎭⎫L a -L 0-x 22+4L a L 0 ⑪ =2L a +2L 0-x 8-14⎝⎛⎭⎫L a -L 0-x 22+4L a L 0 Δh 2R ≡h 2R -h 2=-Δh 2L=x -2L a -2L 08+14⎝⎛⎭⎫L a -L 0-x 22+4L a L 0 ⑫ (2)在x <<L 0和L a <<L 0的情形下,由⑧式得:L b ≈L a ⑬⑦式成为:p ≈p 0(1+x 2L 0) ⑭ 由⑨⑩⑪⑫⑬⑭式得:Δh 1L ≈34x ⑮ Δh 1R ≈-Δh 2L =Δh 2R ≈14x ⑯ 参考评分:第(1)问14分,①②③④⑤⑥⑦⑧式各1分,⑨⑩式各2分,⑪⑫式各1分;第(2)问6分,⑬⑭式各1分,⑮⑯式各2分.解法(二)(1)设U 形管1左侧末态水面比初态上升x 2+y ,右侧末态水面比初态上升x 2-y ,U 形管2左侧末态水面比初态下降y ,右侧末态水面比初态上升y .由玻意耳定律得: L a L 0=L b (L 0+2y ) ①由几何关系有:L a -x 2+2y =L b ②将②式带入①式得:L a L 0=(L a -x 2+2y ) (L 0+2y ) ③解得: y =x 8-L 04-L a 4+14⎝⎛⎭⎫L 0+L a -x 22+2xL 0 ④ 此即U 形管2左侧末态比初态水面下降值,也是右侧末态比初态水面上升值(负根y=x 8-L 04-L a 4-14⎝⎛⎭⎫L 0+L a -x 22+2xL 0不符合题意,已舍去).U 形管1左侧末态比初态水面上升:x 2+y =5x -2L a -2L 08+14⎝⎛⎭⎫L a +L 0-x 22+2xL 0 ⑤ 右侧末态比初态水面上升:x 2-y =3x +2L a +2L 08-14⎝⎛⎭⎫L a +L 0-x 2 2+2xL 0 ⑥ 将④式带入②式得:L b =L a -x 2+2y =2L a -2L 0-x 4+12⎝⎛⎭⎫L a +L 0-x 22+2xL 0 ⑦ (2)在x <<L 0和L a <<L 0的情形下,④⑤⑥⑦式中的根号部分⎝⎛⎭⎫L a +L 0-x 22+2xL 0=L a 2+L 02+x 24+2L 0L a -xL 0-xL a +2xL 0 =L 01+L a 2L 02+x 24L 02+2L a L 0-xL a 2L 02+x L 0≈L 0⎣⎡⎦⎤1+12(L a 2L 02+x 24L 02+2L a L 0-xL a L 02+x L 0 =L 0+12⎣⎡⎦⎤L a 2L 0+x 24L 0+2L a -xL a L 0+x ⑧ ≈L 0+12(2L a +x ) =L a +L 0+x 2⑧式在推导过程中用到了1+z ≈1+12z ,当z <<1. 将⑧式带入④⑤⑥⑦式中分别得到:y ≈x 8-L 04-L a 4+14⎝⎛⎭⎫L 0+L a +x 2=x 4⑨ x 2+y ≈x 2+x 4=3x 4⑩ x 2-y ≈x 2-x 4=x 4⑪ L b ≈L a 2-L 02-x 4+12⎝⎛⎭⎫L 0+L a +x 2=L a ⑫参考评分:第(1)问14分,①式4分,②③式各1分,④式3分,⑤式2分,⑥式1分.第(2)问6分,⑨⑩式各2分,⑪⑫式各1分.15.(32届预赛15)如图,导热性能良好的气缸A 和B 高度均为h (已除开活塞的厚度),横截面积不同,竖直浸没在温度为T 0的恒温槽内,它们的底部由一细管连通(细管容积可忽略).两气缸内各有一个活塞,质量分别为m A =2m 和m B =m ,活塞与气缸之间无摩擦,两活塞的下方为理想气体,上方为真空.当两活塞下方气体处于平衡状态时,两活塞底面相对于气缸底的高度均为h /2.现保持恒温槽温度不变,在两活塞上面同时各缓慢加上同样大小的压力,让压力从零缓慢增加,直至其大小等于2m g (g 为重力加速度)为止,并一直保持两活塞上的压力不变;系统再次达到平衡后,缓慢升高恒温槽的温度,对气体加热,直至气缸B 中活塞底面恰好回到高度为h /2处.求:(1)两个活塞的横截面积之比S A ∶S B .(2)气缸内气体的最后的温度.(3)在加热气体的过程中,气体对活塞所做的总功.解析:(1)平衡时气缸A 、B 内气体的压强相等,故:m A g S A =m B g S B① 由①式和题给条件得: S A ∶S B =2∶1 ②(2)两活塞上各放一质量为2m 的质点前,气体的压强p 1和体积V 1分别为:p 1=2mg S A =mg S B③ V 1=32S B h ④ 两活塞上各放一质量为2m 的质点后,B 中活塞所受到的气体压力小于它和质点所受重力之和,B 中活塞将一直下降至气缸底部为之,B 中气体全部进入气缸A .假设此时气缸A 中活塞并未上升到气缸顶部,气体的压强p 2=4mg S A =2mg S B⑤ 设平衡时气体体积为V 2,由于初态末态都是平衡态,由理想气体状态方程有:p 1V 1T 0=p 2V 2T 0⑥ 由③④⑤⑥式得: V 2=34S 0h =38S A h ⑦ 这时气体的体积小于气缸A 的体积,与活塞未上升到气缸顶部的假设一致.缓慢加热时,气体先等压膨胀,B 中活塞不动,A 中活塞上升;A 中活塞上升至顶部后,气体等容升压;压强升至3mg S B时,B 中活塞开始上升,气体等压膨胀.设当温度升至T 时,该活塞恰好位于h 2处.此时气体的体积变为V 3=52S B h ⑧ 气体压强 p 3=3mg S B⑨ 设此时气缸内气体的温度为T ,由状态方程有:p 2V 2T 0=p 3V 3T⑩ 由⑤⑦⑧⑨⑩式得: T =5T 0 ⑪(3)升高恒温槽的温度后,加热过程中,A 活塞上升量为h -38h =58h ⑫ 气体对活塞所做的总功为W =4mg ·58h +3mg ·h 2=4mgh ⑬ 参考评分:第(1)问3分,①式2分,②式1分;第(2)问13分,③④⑤⑥式各2分,⑦⑧⑨⑩⑪式各1分;第(3)问4分,⑫⑬式各2分.16.(31届预赛14)1mol 的理想气体经历一循环过程1-2-3-1,如p -T 图示所示,过程1-2是等压过程,过程3-1是通过p -T 图原点的直线上的一段,描述过程2-3的方程为c 1p 2+c 2p =T ,式中c 1和c 2都是待定的常量,p 和T 分别是气体的压强和绝对温度.已知,气体在状态1的压强、绝对温度分别为P 1和T 1,气体在状态2的绝对温度以及在状态3的压强和绝对温度分别为T 2以及p 3和T 3.气体常量R 也是已知的.(1)求常量c 1和c 2的值;(2)将过程1-2 -3 -1在p -v 图示上表示出来;(3)求该气体在一次循环过程中对外做的总功.解析:(1)设气体在状态i (i =1、2、3)下的压强、体积和温度分别为p i 、V i 和T i ,由题设条件有:c 1p 22+c 2p 2=T 2 ①c 1p 32+c 2p 3=T 3 ②由此解得:c 1=T 2p 3-T 3p 2p 22p 3-p 32p 2=T 2p 3-T 3p 1p 12p 3-p 32p 1③ c 2=T 2p 32-T 3p 22p 2p 32-p 22p 3=T 2p 32-T 3p 12p 1p 32-p 12p 3④ (2)利用气体状态方程pV =RT 以及V 1=R T 1p 1、V 2=R T 2p 2、V 3=R T 3p 3⑤ 可将过程2—3的方程写为p V 2-V 3p 2-p 3=V +V 2p 3-V 3p 2p 2-p 3⑥ 可见,在p -V 图上过程2-3是以(p 2,V 2)和(p 3,V 3)为状态端点的直线,过程3-1是通过原点直线上的一段,因而描述其过程的方程为:p T =c 3 ⑦ 式中c 3是一常量,利用气体状态方程pV =RT ,可将过程3-1的方程改写为:V =R c 3=V 3=V 1 ⑧ 这是以(p 3,V 1)和(p 1,V 1)为状态端点的等容降压过程.综上所述,过程1-2-3-1在p -V 图上是一直角三角形,如图所示.(3)气体在一次循环过程中对外做的总功为:W =-12(p 3-p 1)(V 2-V 1) ⑨ 利用气体状态方程pV =RT 和⑤式,上式即:W =-12R (T 2-T 1)⎝⎛⎭⎫p 3p 1-1 ⑩ 参考评分:第(1)问8分,①②③④式各2分;第(2)问10分,⑤⑥式各2分,过程1-2-3-1在p -V 上的图示正确得6分;第(3)问2分,⑩式2分.17.(30届预赛14)如图所示,1摩尔理想气体,由压强与体积关系的p-V 图中的状态A 出发,经过一缓慢的直线过程到达状态B ,已知状态B 的压强与状态A 的压强之比为12,若要使整个过程的最终结果是气体从外界吸收了热量,则状态B 与状态A 的体积之比应满足什么条件?已知此理想气体每摩尔的内能为32RT ,R 为普适气体常量,T 为热力学温度.解析:令ΔU 表示系统内能的增量,Q 和W 分别表示系统吸收的热量和外界对系统所做的功,由热力学第一定律有:ΔU =Q +W ①令T 1和T 2分别表示状态A 和状态B 的温度,有:ΔU =32R (T 2-T 1) ②令p 1、p 2和V 1、V 2分别表示状态A 、B 的压强和体积,由②式和状态方程可得: ΔU=32(p 2V 2-p 1V 1) ③由状态图可知,做功等于图线下所围面积,即:W =-12(p 1+p 2)(V 2-V 1) ④要系统吸热,即Q >0,由以上格式可得:32(p 2V 2-p 1V 1)+12(p 1+p 2)(V 2-V 1)>0⑤按题意,p 2p 1=12,带入上式,可得:V 2V 1>32 ⑥参考评分:①②③式各3分,④式4分,⑤式3分,⑥式2分.18.(29届预赛14)由双原子分子构成的气体,当温度升高时,一部分双原子分子会分解成两个单原子分子,温度越高,被分解的双原子分子的比例越大,于是整个气体可视为由单原子分子构成的气体与由双原子分子构成的气体的混合气体.这种混合气体的每一种成分气体都可视作理想气体.在体积V =0.045m 3的坚固的容器中,盛有一定质量的碘蒸气,现于不同温度下测得容器中蒸气的压强如下:试求温度分别为1073K 和1473K 时该碘蒸气中单原子分子碘蒸气的质量与碘的总质量之比值.已知碘蒸气的总质量与一个摩尔的双原子碘分子的质量相同,普适气体常量R =8.31J·mol -1·K -1解析:以m 表示碘蒸气的总之,m 1表示蒸气的温度为T 时单原子分子的碘蒸气的质量,μ1、μ2分别表示单原子分子碘蒸气和双原子分子碘蒸气的摩尔质量,p 1、p 2分别表示容器中单原子分子碘蒸气和双原子分子碘蒸气的分压强,则由理想气体的状态方程有:p 1V =m 1μ1RT ① p 2V=m -m 1μ2RT②其中,R 为理想气体常量. 根据道尔顿分压定律,容器中碘蒸气的总压强p 满足:p =p 1+p 2 ③设α=m 1m 为单原子分子碘蒸气的质量与碘蒸气的总质量的比值,注意到μ1=12μ2 ④ 由以上各式解得:α=μ2V mR ·p T-1 ⑤ 带入有关数据可得,当温度为1073K 时,α=0.06 ⑥ 当温度为1473K 时,α=0051 ⑦ 参考评分:①②③⑤式各4分,⑥⑦式各2分.19.(26届预赛15)图中M 1和M 2是绝热气缸中的两个活塞,用轻质刚性细杆连结,活塞与气缸壁的接触是光滑的、不漏气的,M 1是导热的,M 2是绝热的,且M 2的横截面积是M 1的2倍.M 1把一定质量的气体封闭在气缸为L 1部分,M 1和M 2把一定质量的气体封闭在气缸的L 2部分,M 2的右侧为大气,大气的压强p 0是恒定的.K 是加热L 2中气体用的电热丝.初始时,两个活塞和气体都处在平衡状态,分别以V 10和V 20表示L 1和L 2中气体的体积.现通过K 对气体缓慢加热一段时间后停止加热,让气体重新达到平衡太,这时,活塞未被气缸壁挡住.加热后与加热前比,L 1和L 2中气体的压强是增大了、减小还是未变?要求进行定量论证.解析:解法(一)用n 1和n 2分别表示L 1和L 2中气体的摩尔数,p 1、p 2和V 1、V 2分别表示L 1和L 2中气体处在平衡状态时的压强和体积,T 表示气体的温度(因为M 1是导热的,两部分气体的温度相等),由理想气体状态方程有:p 1V 1=n 1RT ①p 2V 2=n 2RT ②式中R 为普适气体常量.若以两个活塞和轻杆构成的系统为研究对象,处在平衡状态时有:p 1S 1-p 2S 1+p 2S 2-p 0S 2=0 ③已知S 2=2S 1 ④有③④式得:p 1+p 2=2p 0 ⑤由①②⑤三式得:p 1=2n 1n 2p 0V 2V 1+n 1n 2V 2 ⑥若⑥式中的V 1、V 2是加热后L 1和L 2中气体的体积,则p 1就是加热后L 1中气体的压强.加热前L 1中气体的压强则为p 10=2n 1n 2p 0V 20V 10+n 1n 2V 2 ⑦ 设加热后L 1中气体体积的增加量为ΔV 1,L 2中气体体积的增加量为ΔV 2,因连接两活塞的杆是刚性的,活塞M 2的横截面积是M 1的2倍,故有:ΔV 1=ΔV 2=ΔV ⑧加热后L 1和L 2中气体的体积都是增大的,即ΔV >0.(若ΔV <0,即加热后活塞是向左移动的,则大气将对封闭在气缸中的气体做功,电热丝又对气体加热,根据热力学第一定律,气体的内能增加,温度将上升,而体积是减小的,故L 1和L 2中气体的压强p 1和p 2都将增大,这违反力学平衡条件⑤式)于是有V 1=V 10+ΔV ⑨V 2=V 20+ΔV ⑩由⑥⑦⑨⑩四式得:p 1-p 10=2n 1n 2p 0(V 10-V 20)ΔV ⎣⎡⎦⎤V 10+ΔV +n 1n 2(V 20+ΔV )⎝⎛⎭⎫V 10+n 1n 2V 20 ⑪由⑪式可知:若加热前V 10=V 20,则p 1=p 10,即加热后p 1不变,由⑤式知p 2亦不变;若加热前V 10<V 20,则p 1<p 10,即加热后p 1必减小,由⑤式知p 2必增大;若加热前V 10>V 20,则p 1>p 10,即加热后p 1必增大,由⑤式知p 2必减小.参考评分:得到⑤式3分,得到⑧式3分,得到⑪式8分,最后结论6分. 解法(二)设加热前L 1和L 2中气体的压强和体积分别为p 10、p 20和V 10、V 20,以p 1、p 2和V 1、V 2分别表示加热后L 1和L 2中气体的压强和体积,由于M 1是导热的,加热前L 1和L 2中气体的温度是相等的,设为T 0,加热后L 1和L 2中气体的温度也相等,设为T .因为加热前、后两个活塞和轻杆构成的系统都处在力学平衡状态,注意到S 2=2S 1,力学平衡条件分别为:p 10+p 20=2p 0 ①p 1+p 2=2p 0 ②由①②两式得:p 1-p 10=-(p 2-p 20) ③根据理想气体状态方程,对L 1中的气体有:p 1V 1p 10V 10=T T 0④ 对L 2中气体有:p 2V 2p 20V 20=T T 0⑤ 由④⑤两式得:p 1V 1p 10V 10=p 2V 2p 20V 20⑥ ⑥式可改写成:⎝⎛⎭⎫1+p 1-p 10p 10⎝⎛⎭⎫1+V 1-V 10V 10=⎝⎛⎭⎫1+p 2-p 20p 20⎝⎛⎭⎫1+V 2-V 20V 20 ⑦ 因连接两活塞的杆是刚性的,活塞M 2的横截面积是M 1的2倍,故有:V 1-V 10=V 2-V 20 ⑧把③⑧式带入⑦式得:⎝⎛⎭⎫1+p 1-p 10p 10⎝⎛⎭⎫1+V 1-V 10V 10=⎝⎛⎭⎫1-p 1-p 10p 20⎝⎛⎭⎫1+V 1-V 10V 20 ⑨ 若V 10=V 20,则由⑨式得p 1=p 10,若加热前L 1中气体的体积等于L 2中气体的体积,则加热后L 1中气体的压强不变,由②式可知加热后L 2中气体的压强亦不变;若V 10<V 20,则由⑨式得p 1<p 10,若加热前L 1中气体的体积小于L 2中气体的体积,则加热后L 1中气体的压强必减小,由②式可知加热后L 2中气体的压强必增大;若V 10>V 20,则由⑨式得p 1>p 10,若加热前L 1中气体的体积大于L 2中气体的体积,则加热后L 1中气体的压强必增大,由②式可知加热后L 2中气体的压强必减小;参考评分:得到①式和②式或得到③式得3分,得到⑧式得3分,得到⑨式得8分,最后结论得6分.。
物理竞赛-热学部分

例题
温度为0oC的1kg的水与温度为100oC的恒 温热源接触后,水的温度达到100oC,试分别 计算水和热源及整个系统的熵的改变.(设水 的比热容为cp=4.18J/gK)
例题
将质量相同、温度分别为T1、T2 的两杯水在等压下绝热地 混合,试问:(1)此系统达到最后状态,计算此过程的熵 变。(2)分析判断熵是增加、减少、还是未变?要有推算 过程并对结论说明理由。(设水的摩尔等压热容量为Cp, 每杯水的量为ν摩尔)
p0
S l2 l1 Q
l1=1m 处.今从底部极缓慢地加热气缸中的气
体,使活塞上升了l2 = 0.5 m的一段距离如图所 示.试过计算:气缸中的气体在整个过程中吸 了多少热量?
解:可分析出起初气缸中的气体的压强由于小于P2 (P2=外界压强+活塞重力产生的压强),所以体积不 会变,是一个等容升温的过程,当压强达到P时,它 将继续做一个等压膨胀的过程,则气缸中的气体的过 程为:等容升温+等压膨胀。
a2 T RV
a2 1 1 T2 T1 ( ) R V1 V2
例题
0.02kg的氦气(视为理想气体),温度由17 oC 升为27 oC,若在升温过程中: (1)体积保持不变; (2)压强保持不变; (3)不与外界交换能量。 分别求出气体内能的改变、吸收的热量、外界对气体 做功。 解:(1)等体过程 由热力学第一定律得Q=ΔE 吸热 Q=ΔE=CV(T2-T1)=(i/2)R(T2-T1) Q=ΔE=5×(3/2)×8.31×(300-290)=623 J 对外作功 A=0
做功与内能的变化均为 A=ΔE= CV(T2-T1)
= (i/2)R(T2-T1) A=ΔE=5×(3/2)×8.31×(300-290)=623 J
高中物理竞赛热学篇

13、课程:液体表面现象
1、表面张力
2、球形液面内外压强差
3、任意弯曲液面内外压强差
4、液体、固体交界面现象
5、毛细现象
6、知识精炼(一)
7、知识精炼(二)
8、知识精炼(三)
14、课程:真题回顾
1、知识精炼(一)
2、知识精炼(二)
3、知识精炼(三)
4、奥托循环
5、狄塞尔循环
6、知识精炼
7、吸放热转换
8、振动自由度解锁
9、课程:热力学第二定律
1、热力学第二定律
2、克劳修斯表述
3、两种表述等价性
4、可逆与不可逆
5、卡诺定理
6、热力学温标
10、课程:熵
1、熵
2、克劳修斯等式
3、态函数熵
4、小结
5、知识精炼(一)
6、知识精炼(二)
7、温熵图
8、一些不可逆过程中熵计算
1、自由度
2、能量按自由度均分定理
3、知识精炼
4、理想气体内能及比热
7、课程:热力学第一定律
1、热力学过程
2、功与热量
3、热力学第一定律
4、等容、等压、等温过程
5、绝热过程
6、多方过程
7、知识精炼(一)
8、混合气体绝热过程
9、知识精炼(二)
8、课程:循环过程
1、循环过程及其效率
2、卡诺循环
3、卡诺循环效率
1、气体分子速率分布
2、最可几与平均速率
3、高斯微积分
4、平方速率平均值
5、气体速度分布函数
6、知识精炼(一)
7、知识精炼(二)
8、知识精炼(三)
5、课程:玻尔兹曼分布律
1、玻尔兹曼分布
高中物理竞赛热学
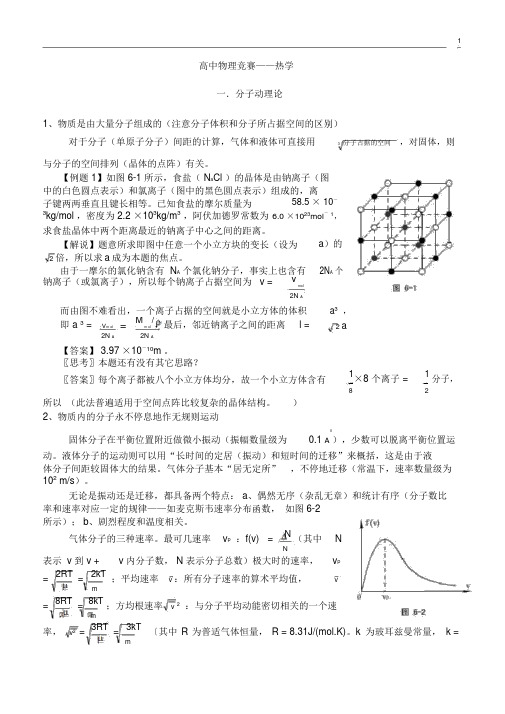
1高中物理竞赛——热学一.分子动理论1、物质是由大量分子组成的(注意分子体积和分子所占据空间的区别)对于分子(单原子分子)间距的计算,气体和液体可直接用3分子占据的空间,对固体,则与分子的空间排列(晶体的点阵)有关。
【例题 1】如图 6-1 所示,食盐( N a Cl )的晶体是由钠离子(图中的白色圆点表示)和氯离子(图中的黑色圆点表示)组成的,离 子键两两垂直且键长相等。
已知食盐的摩尔质量为 3kg/mol ,密度为 2.2 ×103kg/m 3 ,阿伏加德罗常数为求食盐晶体中两个距离最近的钠离子中心之间的距离。
【解说】题意所求即图中任意一个小立方块的变长(设为a )的 2 倍,所以求 a 成为本题的焦点。
由于一摩尔的氯化钠含有 N A 个氯化钠分子,事实上也含有 2N A 个钠离子(或氯离子),所以每个钠离子占据空间为 v = V mol2N A而由图不难看出,一个离子占据的空间就是小立方体的体积a 3 ,即 a 3= V m ol=M m ol/,最后,邻近钠离子之间的距离 l = 2 a2N A 2N A 【答案】 3.97 ×10-10m 。
〖思考〗本题还有没有其它思路?〖答案〗每个离子都被八个小立方体均分,故一个小立方体含有1×8 个离子 =1分子,82所以 (此法普遍适用于空间点阵比较复杂的晶体结构。
)2、物质内的分子永不停息地作无规则运动固体分子在平衡位置附近做微小振动(振幅数量级为0.1 A ),少数可以脱离平衡位置运动。
液体分子的运动则可以用“长时间的定居(振动)和短时间的迁移”来概括,这是由于液体分子间距较固体大的结果。
气体分子基本“居无定所” ,不停地迁移(常温下,速率数量级为 102m/s )。
无论是振动还是迁移,都具备两个特点: a 、偶然无序(杂乱无章)和统计有序(分子数比率和速率对应一定的规律——如麦克斯韦速率分布函数, 如图 6-2 所示); b 、剧烈程度和温度相关。
重点高中物理竞赛热学

重点高中物理竞赛热学高中物理竞赛——热学一.分子动理论1、物质是由大量分子组成的(注意分子体积和分子所占据空间的区别)对于分子(单原子分子)间距的计算,气体和液体可直接用3分子占据的空间,对固体,则与分子的空间排列(晶体的点阵)有关。
【例题1】如图6-1所示,食盐(N a Cl )的晶体是由钠离子(图中的白色圆点表示)和氯离子(图中的黑色圆点表示)组成的,离子键两两垂直且键长相等。
已知食盐的摩尔质量为58.5×10-3 kg/mol ,密度为 2.2×103kg/m 3,阿伏加德罗常数为6.0×1023mol -1,求食盐晶体中两个距离最近的钠离子中心之间的距离。
【解说】题意所求即图中任意一个小立方块的变长(设为a )的2倍,所以求a 成为本题的焦点。
由于一摩尔的氯化钠含有N A 个氯化钠分子,事实上也含有2N A 个钠离子(或氯离子),所以每个钠离子占据空间为v=Am olN 2V而由图不难看出,一个离子占据的空间就是小立方体的体积a 3,即a 3=Am ol N 2V =Am ol N 2/M ρ,最后,邻近钠离子之间的距离l=2a【答案】3.97×10-10m 。
〖思考〗本题还有没有其它思路?〖答案〗每个离子都被八个小立方体均分,故一个小立方体含有8 1×8个离子=21分子,所以…(此法普遍适用于空间点阵比较复杂的晶体结构。
) 2、物质内的分子永不停息地作无规则运动固体分子在平衡位置附近做微小振动(振幅数量级为0.1A 0),少数可以脱离平衡位置运动。
液体分子的运动则可以用“长时间的定居(振动)和短时间的迁移”来概括,这是由于液体分子间距较固体大的结果。
气体分子基本“居无定所”,不停地迁移(常温下,速率数量级为102m/s )。
无论是振动还是迁移,都具备两个特点:a 、偶然无序(杂乱无章)和统计有序(分子数比率和速率对应一定的规律——如麦克斯韦速率分布函数,如图6-2气体分子的三种速率。
高中物理竞赛热学部分优题选

高中物理竞赛——热学题选1.一个老式的电保险丝,由连接在两个端纽之间的一根细而均匀的导线构成。
导线按斯特藩定律从其表面散热。
斯特藩定律指出:辐射功率P 跟辐射体表面积S 以及一个与温度有关的函数成正比,即(),44外辐T T S P -∞试说明为什么用保险丝时并不需要准确的长度。
2.有两根长度均为50cm 的金属丝A 和B 牢固地焊在一起,另两端固定在牢固的支架上(如图21-3)。
其线胀系数分别为αA =1.1×10-5/℃,αB =1.9×10-5/℃,倔强系数分别为K A =2×106N/m ,K B =1×106N/m ;金属丝A 受到450N 的拉力时就会被拉断,金属丝B 受到520N 的拉力时才断,假定支架的间距不随温度改变。
问:温度由+30°C 下降至-20°C 时,会出现什么情况?(A 、B 丝都不断呢,还是A 断或者B 断呢,还是两丝都断呢?)不计金属丝的重量,在温度为30°C 时它们被拉直但张力为零。
3.长江大桥的钢梁是一端固定,另一端自由的。
这是为什么?如果在-10℃时把两端都固定起来,当温度升高到40℃时,钢梁所承担的胁强(压强)是多少?(钢的线胀系数为12×10-6/℃,弹性模量为2.0×105N/mm 2,g=10m/s 2)4.厚度均为a=0.2毫米的钢片和青铜片,在T 1=293开时,将它们的端点焊接起来,成为等长的平面双金属片,若钢和青铜的线膨胀系数分别为10-5/度和2×10-5/度,当把它们的温度升高到T 2=293开时,它们将弯成圆弧形,试求这圆弧的半径,在加热时忽略厚度的变化。
5.在负载功率P 1=1kW ,室温t 0=20℃时,电网中保险丝的温度达到t 1=120℃,保险丝的材料的电阻温u C 图21-13度系数α=4×10-3K-1,保险丝的熔断温度t2=320℃,其所释放的热量与温度差成正比地增加,请估计电路中保险丝熔断时负载的功率。
高中物理竞赛--热力学专题

dW = −pdV → W = − � pdV
V1
这就是外界对流体在无限小的准静态膨胀或压缩中所做的功 非准静态过程(包括不可逆过程):外界对物体所作的功仍然等于作用力与位移的乘积,但是由于在过程进行
中,物体的各部分都在变化,作用在物体上的力不再需要力平衡条件,一般情况下功的表达式会非常复杂。 特殊情形下的功:
C V +R
的关系为pV CV = 恒量。 解答:关键点—注意与节流过程的区别 分析打开K1的热力学过程:开始时,气室a中有ν摩尔气体,打开K1,外界气体有一部分空气ν′摩尔等压p0进
入气室,热力学过程:绝热、非准静态、不可逆,注意:与常规的节流过程有区别 初态:
外界气体:�ν′ , p0, V�, T0�,其能量 Ui1 = ν′ CV T0,且p0V� = ν′ RT0
体达到热平衡时,测得气体的压强为p1 2) 仍从初始状态出发,让活塞处在自由状态,在电热丝中通以弱电流,也持续一段时间,然后停止通电,最
后测得气体的体积为V2
解答:关键点—热力学状态的描述 初始热力学状态(ν, p0, V0, T0)的内能
Ui = CxνT0,且 p0V0 = νRT0
→
Ui
=
Cx R
p0V0
末态热力学状态: 等容过程末态(ν, p1, V0, T1)的内能
Uf = CxνT1,且 p1V0 = νRT1
→
Uf
=
Cx R
p1V0
热力学第一定律给出电热丝传给气体的热量
Q1
=
Uf
−
Ui
=
Cx R
(p1
−
p0)V0
等压过程末态(ν, p0, V2, T2)的内能
高中物理竞赛辅导教程(新大纲版)

高中物理竞赛辅导教程(新大纲版)一、力学部分1. 运动学- 基本概念:位移、速度、加速度。
位移是矢量,表示位置的变化;速度是描述物体运动快慢和方向的物理量,加速度则反映速度变化的快慢。
- 匀变速直线运动公式:v = v_0+at,x=v_0t+(1)/(2)at^2,v^2-v_{0}^2 = 2ax。
这些公式在解决直线运动问题时非常关键,要注意各物理量的正负取值。
- 相对运动:要理解相对速度的概念,例如v_{AB}=v_{A}-v_{B},在处理多个物体相对运动的问题时很有用。
- 曲线运动:重点掌握平抛运动和圆周运动。
平抛运动可分解为水平方向的匀速直线运动和竖直方向的自由落体运动;圆周运动中要理解向心加速度a =frac{v^2}{r}=ω^2r,向心力F = ma的来源和计算。
2. 牛顿运动定律- 牛顿第二定律F = ma是核心。
要学会对物体进行受力分析,正确画出受力图。
- 整体法和隔离法:在处理多个物体组成的系统时,整体法可以简化问题,求出系统的加速度;隔离法用于分析系统内单个物体的受力情况。
- 超重和失重:当物体具有向上的加速度时超重,具有向下的加速度时失重,加速度为g时完全失重。
3. 动量与能量- 动量定理I=Δ p,其中I是合外力的冲量,Δ p是动量的变化量。
- 动量守恒定律:对于一个系统,如果合外力为零,则系统的总动量守恒。
在碰撞、爆炸等问题中经常用到。
- 动能定理W=Δ E_{k},要明确功是能量转化的量度。
- 机械能守恒定律:在只有重力或弹力做功的系统内,机械能守恒。
要熟练掌握机械能守恒定律的表达式E_{k1}+E_{p1}=E_{k2}+E_{p2}。
二、电磁学部分1. 电场- 库仑定律F = kfrac{q_{1}q_{2}}{r^2},描述真空中两个静止点电荷之间的相互作用力。
- 电场强度E=(F)/(q),电场线可以形象地描述电场的分布情况。
- 电势、电势差:U_{AB}=φ_{A}-φ_{B},电场力做功与电势差的关系W = qU。
高二物理竞赛热学绪论课件(共14张PPT)

力学规律, 统计平均方法
热学
物理学中专门研究热现象的一门分支学科
绪论
§1.1 宏观描述方法与微观描述方法
热 学 研究物质热运动与热相联系的各种规律的理论
热力学
统计物理学
宏观理论(热力学)
微观理论(统计物理学)
观察和实验
力学规律, 统计平均方法
热力学验证统计物理学,统计物理学揭示热力学本质
§1.1.1 热学的研究对象及其特点 一 、热物理学(thermal physics)
宏观与微观的两种不同描述方法。
一、热力学(thermodynamics)
热力学是热物理学的宏观理论,它从对热现象的大量的直接观 察和实验测量所总结出来的普适的基本定律出发,应用数学方法,通过 逻辑推理及演绎,得出有关物质各种宏观性质之 间的关系、宏观物理过
程进行的方向和限度等结论。
特征
1. 热力学基本定律是自然界中的普适规律,结论具有可靠性与普遍性 。
微观理论(统计物理学)
02×1023个分子。
力学规律, 统计平均方法
宏观理论
热力学
二、统计物理学(Statistical physics)
微观描述方法的局限性在于它在数学上常遇到很大的困难,由此而作出简化假设(微观模型)后所得到的理论结果常与实验不能完全符合。
微观理论
统计物理学
§1.1.2 宏观描述方法与微观描述方法
高中物理竞赛十年复赛真题热学纯手打word版含答案

十年真题-热学复赛1.34届复赛7如气体压强-体积图所示,摩尔数为ν的双原子理想气体构成的系统经历一正循环过程正循环指沿图中箭头所示的循环,其中自A到B为直线过程,自B到A为等温过程.双原子理想气体的定容摩尔热容为R,R为气体常量.1求直线AB过程中的最高温度;2求直线AB过程中气体的摩尔热容量随气体体积变化的关系式,说明气体在直线AB过程各段体积范围内是吸热过程还是放热过程,确定吸热和放热过程发生转变时的温度T c;3求整个直线AB过程中所吸收的净热量和一个正循环过程中气体对外所作的净功.解析:1直线AB过程中任一平衡态气体的压强p和体积V满足方程=此即p=p0-V①根据理想气体状态方程有:pV=νRT②由①②式得:T==+③由③式知,当V=V0时,④气体达到直线AB过程中的最高温度为:T max=⑤2由直线AB过程的摩尔热容C m的定义有:dQ=νC m dT⑥由热力学第一定律有:dU=dQ-pdV⑦由理想气体内能公式和题给数据有:dU=νC V dT=νRdT⑧由①⑥⑦⑧式得:C m=C V+=R+⑨由③式两边微分得:=⑩由⑩式带入⑨式得:C m=由⑥⑩ 式得,直线AB过程中,在V从增大到的过程中,C m>0,>0,故>0,吸热在V从增大到的过程中,C m<0,<0,故>0,吸热在V从增大到V0的过程中,C m>0,<0,故<0,放热由式可知,系统从吸热到放热转折点发生在V=V c=处由③式和上式得:T c==3对于直线AB过程,由⑥⑩式得:dQ=νCm dV=pdV=pdV将上式两边对直线过程积分得,整个直线AB过程中所吸收的净热量为:Q直线==p0=p0V0直线AB过程中气体对外所做的功为:W直线==p0V0等温过程中气体对外所做的功为:W等温===-ln2一个正循环过程中气体对外所做的净功为:W=W直线+W等温=p0V0参考评分:第1问10分,①②式各3分,④⑤式各2分;第2问20分,⑥⑦⑧⑨⑩ 式各2分;第3问10分,式各2分.2.33届复赛2秋天清晨,气温为℃,一加水员到实验园区给一内径为、高为的圆柱形不锈钢蒸馏水罐加水.罐体导热良好.罐外有一内径为的透明圆柱形观察柱,底部与罐相连连接处很短,与大气相通,如图所示.加完水后,加水员在水面上覆盖一层轻质防蒸发膜不溶于水,与罐壁无摩擦,闭了罐顶的加水口.此时加水员通过观察柱上的刻度看到罐内水高为.1从清晨到中午,气温缓慢升至℃,问此时观察柱内水位为多少假设中间无人用水,水的蒸发及罐和观察柱体积随温度的变化可忽略.2从密闭水罐后至中午,罐内空气对外做的功和吸收的热量分别为多少求这个过程中罐内空气的热容量.已知罐外气压始终为标准大气压p0=×105pa,水在℃时的密度为ρ0=×103kg·m-3,水在温度变化过程中的平均体积膨胀系数为×10-4K-1,重力加速度大小为g=s2,绝对零度为-℃.解析:1清晨加完水封闭后,罐内空气的状态方程为p0V0=nRT0①至中午时由于气温升高,罐内空气压强增大,设此时罐内空气的压强、体积和温度分别为p、V1、T1,相应的状态方程为:p1V1=nRT1②1此时观察柱和罐内水位之差为:Δh=++③式中右端第三项是由原罐内和观察柱内水的膨胀引起的贡献,l0=为早上加水后观察柱内水面的高度,S1=πm2,S2=4π×10-4m2分别为罐、观察柱的横截面积.由力平衡条件有:p1=p0+ρ1gΔh1④式中ρ1=是水在温度为T1时的密度.⑤联立①②③④⑤式得:ρ1gS′Δh2+p0S1+λρ1gV0-p0V0=0⑥式中S′=,λ=1-κT1-T0⑦解⑥得:Δh==⑧另一解不合题意,舍去.由③⑤⑦⑧式和题给数据得:V1-V0=S′Δh-κT1-T0S1l0=-由上式和题给数据得,中午观察柱内水位为:l1=Δh-+l0=⑨2先求罐内空气从清晨至中午对外所做的功.解法一早上罐内空气压强p0=×105pa,中午观察柱内水位相对于此时罐内水位升高Δh,罐内空气压强升高了Δp=ρ1gΔh=×103pa⑩因Δp<<p0,认为在准静态升温过程中罐内平均压强=p0+Δp=×105pa罐内空气体积缩小了ΔV=可见<<1,这说明式是合理的.罐内空气对外做功W=ΔV=-×103J解法二缓慢升温是一个准静态过程,在封闭水罐后至中午之间的任意时刻,设罐内空气都处于热平衡状态,设其体积、温度和压强分别为V、T和p.水温为T时水的密度为ρ=⑩将②③④式中的V1、T1和p1换为V、T和p,利用⑩式得罐内空气在温度为T时的状态方程为:p=p0+V1-V0+κT1-T0S1l0=p0+由题设数据和前门计算结果可知,κT-T0<κT1-T0=<=这说式右端分子中与T有关的项不可略去,而右端分母中与T有关的项可略去.于是式:p=p0+V1-V0+κT1-T0S1l0=p0+利用状态方程,上式可改写成p=-从封闭水罐后至中午,罐内空气对外界做的功为W===-=-×103J解法三缓慢升温是一个准静态过程,在封闭水罐后至中午的任意时刻,罐内空气都处于热平衡状态,设其体积、温度和压强分别为V、T和p.水在温度为T时的密度为ρ=⑩将②③④式中的V1、T1和p1换为V、T和p,利用⑩式得罐内空气在温度为T时的状态方程为p=p0+V-V0+κT1-T0S1l0=p0+=p0+S1l0+≈p0++V-V0-S1l01-κT-T0=p0++≈p0++V-V0-S1l01+κT0+PV=p0++V-2V01+κT0+PV=p0++V-2V01+κT0+PV式中应用了κT-T0<κT1-T0=,<=式可改写成p==-+从封闭水罐后至中午,罐内空气对外界做的功为W===-=-×103J现计算罐内空气的内能变化.由能量均分定理知,罐内空气中午相对于清晨的内能改变为:ΔU=nRT1-T0=T1-T0=×104J式中5是常温下空气分子的自由度.由热力学第一定律得罐内空气的吸热为:ΔQ=W+ΔU=×104J从封闭水罐后至中午,罐内空气在这个过程中的热容量为:C==×103J/K参考评分:第1问10分,①②③④⑤⑥⑦⑧式各1分,⑨式2分;第2问10分,⑩ 式各1分,式各2分,式1分.3.32届复赛7如图,1mol单原子理想气体构成的系统分别经历循环过程abcda和abc′a.已知理想气体在任一缓慢变化过程中,压强p和体积V满足函数关系p=fV.1试证明:理想气体在任一缓慢变化过程的摩尔热容可表示为Cπ=C V+,式中,C V和R分别为定容摩尔热容和理想气体常数;2计算系统经bc′直线变化过程中的摩尔热容;3分别计算系统经bc′直线过程中升降温的转折点在p-V图中的坐标A和吸放热的转折点在p-V图中的坐标B;4定量比较系统在两种循环过程的循环效率.解析:1根据热力学第一定律有:dU=δQ+δW①这里对于1mol理想气体经历的任一缓慢变化过程中,δQ、δW和dU可分别表示为δQ=CπdT、δW=-pdV、dU=CVdT②将理想气体状态方程pV=RT两边求导得p+V=R③式中利用了=,根据③式有:=④联立①②③④式得:Cπ=C V+⑤2设bc′过程方程为p=α-βV⑥根据Cπ=C V+可得该直线过程的摩尔热容为:Cπ=C V+⑦式中C V=R是单原子理想气体的定容摩尔热容.对bc′过程的初态3p1,V1和终态p1,5V1有:3p1=α-βV1、p1=α-5βV1⑧由⑧式得:α=p1、β=⑨由⑥⑦⑧⑨式得:Cπ=⑩3根据过程热容的定义有:Cπ=式中,ΔQ是气体在此直线过程中,温度升高ΔT时从外界吸收的热量.由⑩ 式得:ΔT=RΔQΔQ=由式可知,bc′过程中的升降温的转折点A在p-V图上的坐标为AV1,p1由⑩式可知,bc′过程中的吸放热的转折点B在p-V图上的坐标为BV1,p14对于abcda循环过程,ab和bc过程吸热,cd和da过程放热Qab=nC V T b-T a=RT b-RT a=3p1V1Qbc=nC p T c-T b=RT c-RT b=15p1V1式中已知n=1mol,单原子理想气体定容摩尔热容C V=R,定压摩尔热容C V=R气体在abcda循环过程中的效率可表示为循环过程中对外做的功处以总吸热,即ηabcda===对于abc′a循环过程,ab和bB过程吸热,Bc′和c′a过程放热.由热力学第一定律可得bB过程吸热为:Q bc′=ΔU bB-W bB=nC V T B-T b+p B+3p1V B-V1=所以循环过程abc′a的效率为ηabc′a===由式可知,ηabc′a>ηabcda参考评分:第1问5分,①②③④⑤式各1分;第2问5分,⑥⑦⑧⑨⑩式各1分;第3问7分,式1分,式各2分,式各1分;第4问5分,式各1分.4.31届复赛2一种测量理想气体的摩尔热容比γ=C p/C V的方法Clement-Desormes方法如图所示:大瓶G内装满某种理想气体,瓶盖上通有一个灌气放气开关H,另接出一根U形管作为压强计M.瓶内外的压强差通过U形管右、左两管液面的高度差来确定.初始时,瓶内外的温度相等,瓶内气体的压强比外面的大气压强稍高,记录此时U形管液面的高度差h i.然后打开H,放出少量气体,当瓶内外压强相等时,即刻关闭H.等待瓶内外温度又相等时,记录此时U形管液面的高度差hf.试由这两次记录的实验数据h i和h f,导出瓶内气体的摩尔热容比γ的表达式.提示:放气过程时间很短,可视为无热量交换;且U形管很细,可忽略由高差变化引起的瓶内气体在状态变化前后的体积变化→解析:解法一瓶内理想气体经历如下两个气体过程:pi,V0,T0,N i p0,V0,T,N f p f,V0,T0,N f其中,p i,V0,T0,N i、p0,V0,T,N f、p f,V0,T0,N f分别是瓶内气体在初态、中间态与末态的压强、体积、温度和摩尔数.根据理想气体方程pV=NkT,考虑到由于气体初、末态的体积和温度相等,有=①另一方面,设V′是初态气体在保持其摩尔数不变的条件下绝热膨胀到压强为p0时的体积,即:p i,V0,T,N i p0,V′,T0,N i此绝热过程满足=②由状态方程有p0V′=N i kT和p0V0=N f kT,所以=③联立①②③式得=④此即γ=⑤由力学平衡条件有p i=p0+ρgh i⑥pf=p0+ρgh f⑦式中,p0+ρgh0为瓶外的大气压强,ρ是U形管中液体的密度,g是重力加速度的大小.由⑤⑥⑦式得γ=⑧利用近似关系式:当x<<1,ln1+x≈x,以及<<1,<<1有γ==⑨参考评分:本题16分.①②③⑤⑥⑦⑧⑨式各2分.解法二若仅考虑留在容器内的气体:它首先经历了一个绝热膨胀过程ab,再通过等容升温过程bc达到末态p i,V1,T0p0,V0,Tp f,V0,T0其中,p i,V1,T0、p0,V0,T、和p f,V0,T0分别是留在瓶内的气体在初态、中间态和末态的压强、体积与温度.留在瓶内的气体先后满足绝热方程和等容过程方程ab:p1γ-1Tγ=pγ-1Tγ①bc:=②由①②式得:=③此即γ=④由力学平衡条件有p i=p0+ρgh i⑤pf=p0+ρgh f⑥式中,p0+ρgh0为瓶外的大气压强,ρ是U形管中液体的密度,g是重力加速度的大小.由④⑤⑥式得⑦利用近似关系式:当x <<1,ln1+x ≈x ,以及<<1,<<1有γ==⑧参考评分:本题16分.①②式各3分,④⑤⑥⑦⑧式各2分. 5.30届复赛6温度开关用厚度均为的钢片和青铜片作感温元件;在温度为20℃时,将它们紧贴,两端焊接在一起,成为等长的平直双金属片.若钢和青铜的线膨胀系数分别为×10-5/度和×10-5/度.当温度升高到120℃时,双金属片将自动弯成圆弧形,如图所示.试求双金属片弯曲的曲率半径.忽略加热时金属片厚度的变化.解析:设弯成的圆弧半径为r ,金属片原长为l ,圆弧所对的圆心角为φ,钢和青铜的线膨胀系数分别为α1和α2,钢片和青铜片温度由T 1=20℃升高到T 2=120℃时的伸长量分别为Δl 1和Δl 2.对于钢片r -φ=l +Δl 1①Δl 1=lα1T 2-T 1②式中,d =.对于青铜片r +φ=l +Δl 2③Δl 2=lα2T 2-T 1④联立以上各式得r =d =×102mm⑤参考评分:本题15分.①式3分,②式3分,③式3分,④式3分,⑤式3分.6.29届复赛6如图所示,刚性绝热容器A 和B 水平放置,一根带有绝热阀门和多孔塞的绝热刚性细短管把容器A 、B 相互连通.初始时阀门是关闭的,A 内装有某种理想气体,温度为T 1;B 内为真空.现将阀门打开,气体缓慢通过多孔塞后进入容器B 中.当容器A 中气体的压强降到与初始时A 中气体压强之比为α时,重新关闭阀门.设最后留在容器A 内的那部分气体与进入容器B 中的气体之间始终无热量交换,求容器B 中气体质量与气体总质量之比.已知:1mol 理想气体的内能为u =CT ,其中C 是已知常量,T 为绝对温度;一定质量的理想气体经历缓慢的绝热过程时,其压强p 与体积V 满足过程方程常量=+CR C pV ,其中R 为普适气体常量.重力影响和连接管体积均忽略不计.解析:设重新关闭阀门后容器A 中气体的摩尔数为n 1,B 中气体的摩尔数为n 2,则气体总摩尔数为n =n 1+n 2①把两容器中的气体作为整体考虑,设重新关闭阀门后容器A 中气体温度为T 1′,B 中气体温度为T 2,重新关闭阀门之后与打开阀门之前气体内能的变化可表示为ΔU =n 1CT 1′-T 1+n 2CT 2-T 1②由于容器是刚性绝热的,按热力学第一定律有ΔU =0③令V 1表示容器A 的体积,初始时A 中气体的压强为p 1,关闭阀门后A 中气体压强为αp 1,由理想气体状态方程可知n =④ n 1=⑤由以上各式可解得:T 2=由于进入容器B 中的气体与仍留在容器A 中的气体之间没有热量交换,因而在阀门打开到重新关闭的过程中留在容器A 中的那部分气体经历了一个绝热过程,设这部分气体初始时体积为V 10压强为p 1时,则有p 1=αp 1⑥ 利用状态方程可得=⑦由①②③④⑤⑥⑦式得,阀门重新关闭后容器B 中气体质量与气体总质量之比=⑧参考评分:本题15分.①式1分,②式3分,③式2分,④⑤式各1分,⑥式3分,⑦式1分,⑧式3分.7.28届复赛6如图所示为圆柱形气缸,气缸壁绝热,气缸的右端有一小孔与大气相通,大气的压强为P0.用一热容量可忽略的导热隔板N和一绝热活塞M将气缸分为A、B、C三室,隔板与气缸固连,活塞相对气缸可以无摩擦地移动但不漏气.气缸的左端A室中有一电加热器Ω.已知在ArrayA、B室中均盛有1摩尔同种理想气体,电加热器加热前,系统处于平衡状态,A、B两室中气体的温度均为T0,A、B、C三室的体积均为V.现通过电加热器对A室中气体缓慢加热,若提供的总热量为Q0,试求B室中气体的末态体积和A室中气体的末态温度.设A、B两室中气体1摩尔的内能为U=RT,式中R为普适气体常量,T为绝对温度在电加热器对A室中气体加热的过程中,由于隔板N是导热的,B室中气体的温度要升高,活塞M将向右移动.当加热停止时,活塞M有可能刚移到气缸最右端,亦可能尚未移到气缸最右端.当然亦可能活塞已移到气缸最右端但加热过程尚未停止.解析:1设加热恰好能使活塞M移到气缸的最右端,则B室气体末态的体积V=2V0①B根据题意,活塞M向右移动过程中,B中气体压强不变,用T B表示B室中气体末态的温度,有=②由①②式得T B=2T0③由于隔板N是导热的,故A室中气体末态的温度T A=2T0④下面计算此过程中的热量Q m.在加热过程中,A室中气体经历的是等容过程,根据热力学第一定律,气体吸收的热量等于其内能的增加量,即Q A=RT A-T0⑤由④⑤两式得Q A=RT0⑥B室中气体经历的是等压过程,在过程中B室气体对外做功为W=p0V B-V0⑦B由①⑦式及理想气体状态方程得W B=RT0⑧内能改变为ΔU B=RT B-T0⑨由④⑨两式得ΔU B=RT0⑩根据热力学第一定律和⑧⑩两式,B室气体吸收的热量为Q B=ΔU B+W B=RT0由⑥ 两式可知电加热器提供的热量为Q m=Q A+Q B=6RT0若Q0=Q m,B室中气体末态体积为2V0,A室中气体的末态温度2T0.2若Q0>Q m,则当加热器供应的热量达到Q m时,活塞刚好到达气缸最右端,但这时加热尚未停止,只是在以后的加热过程中气体的体积保持不变,故热量Q0-Q m是A、B中气体在等容升温过程中吸收的热量.由于等容过程中气体不做功,根据热力学第一定律,若A室中气体末态的温度为T A′,有Q-Q m=RT A′-2T0+RT A′-2T0由两式可求得T A′=+T0B中气体的末态的体积V′=2V0B3若Q0<Q m,则隔板尚未移到气缸最右端,加热停止,故B室中气体末态的体积V B″<2V0.设A、B两室中气体末态的温度为T A″,根据热力学第一定律,注意到A室中气体经历的是等容过程,其吸收的热量Q A=RT A″-T0B室中气体经历的是等压过程,吸收热量Q=RT A″-T0+p0V B″-V0B利用理想气体状态方程,上式变为Q B=RT A″-T0由上可知Q0=Q A+Q B=6RT A″-T0T0所以A室中气体的末态温度T A″=+T0B室中气体的末态体积V″=T A″=V0B参考评分:本题20分.得到Q0=Q m的条件下①④式各1分;式6分,得到Q0>Q m的条件下的式4分,式2分;得到Q0<Q m的条件下的式4分,式2分.8.27届复赛7地球上的能量从源头上说来自太阳辐射到达地面的太阳辐射假定不计大气对太阳辐射的吸收一部分被地球表面反射到太空,其余部分被地球吸收.被吸收的部分最终转换成为地球热辐射红外波段的电磁波.热辐射在向外传播过程中,其中一部分会被温室气体反射回地面,地球以此方式保持了总能量平衡.作为一个简单的理想模型,假定地球表面的温度处处相同,且太阳和地球的辐射都遵从斯忒蕃一玻尔兹曼定律:单位面积的辐射功率J与表面的热力学温度T的四次方成正比,即J=σT4,其中σ是一个常量.已知太阳表面温度T s=×103K,太阳半径R s=×105km,地球到太阳的平均距离d=×108km.假设温室气体在大气层中集中形成一个均匀的薄层,并设它对热辐射能量的反射率为ρ=.1如果地球表面对太阳辐射的平均反射率α=,试问考虑了温室气体对热辐射的反射作用后,地球表面的温度是多少2如果地球表面一部分被冰雪覆盖,覆盖部分对太阳辐射的反射率为α1=,其余部分的反射率处α2=.间冰雪被盖面占总面积多少时地球表面温度为273K.解析:1根据题意,太阳辐射的总功率P S=4πRσT,太阳辐射各向同性的向外传播.设地球半径为r E,可以认为地球所在处的太阳辐射是均匀的,故地球接收太阳辐射的总功率为:P I=σTπr①地球表面反射太阳辐射的总功率为αP I.设地球表面的温度为T E,则地球的热辐射总功率为:P E=4πrσT②考虑到温室气体向地球表面释放的热辐射,则输入地球表面的总功率为P I+βP E.当达到热平衡时,输入的能量与输出的能量相等,有:P I+βP E=αP I+P E③由以上各式得:T E=T S错误未定义书签;④带入数值有:T E=287K⑤2当地球表面一部分被冰雪覆盖后,以α′表示地球表面对太阳辐射的平均反射率,根据题意这时地区表面的平均温度为T E=273K.利用④式可求得:α′=⑥设冰雪覆盖的地表面积与总面积之比为x,则:α′=α1x+α21-x⑦由⑥⑦两式并带入数据得:x=30%⑧参考评分:本题15分.第1问11分,①式3分,②式1分,③式4分,④式2分,⑤式1分;第2问4分,⑥式2分,⑧式3分.9.26届复赛4火箭通过高速喷射燃气产生推力.设温度T1、压强p1的炽热高压气体在燃烧室内源源不断生成,并通过管道由狭窄的喷气口排入气压p2的环境.假设燃气可视为理想气体,其摩尔质量为μ,每摩尔燃气的内能为u=C V TC V是常量,T为燃气的绝对温度.在快速流动过程中,对管道内任意处的两个非常靠近的横截面间的气体,可以认为它与周围没有热交换,但其内部则达到平衡状态,且有均匀的压强p、温度T和密度ρ,它们的数值随着流动而不断变化,并满足绝热方程p=C恒量,式中R为普适气体常量,求喷气口处气体的温度与相对火箭的喷射速率.解析:于火箭燃烧室出口处与喷气口各取截面A1和A2,它们的面积分别为S1和S2,由题意,S1>>S2,以其管道内的气体为研究对象,如图所示.设经过很短时间Δt,这部分气体流至截面B1与B2之间,A1B1间、A2B2间的微小体积分别为ΔV1、ΔV2,两处气体密度为ρ1、ρ2,流速为v1、v2.气流达到稳定时,内部一切物理量分布只依赖于位置,与时间无关.由此可知,尽管B1A2间气体更换,但总的质量与能量不变.先按绝热近似求喷气口的气体温度T2.质量守恒给出:ρ1ΔV1=ρ2ΔV2①即A2B2气体可视为由A1B1气体绝热移动所得.事实上,因气流稳恒,A1B1气体流出喷口时将再现A 2B2气体状态.对质量Δm=ρ1ΔV1=ρ2ΔV2的气体,利用理想气体的状态方程:pV=RT②和绝热过程方程p1=p2③可得:T2=T1④再通过能量守恒求气体的喷射速率v2.由①式及ΔV=SΔvt可得:ρ1S1V1=ρ2S2V2⑤再利用①③式知,v1=v2=v2,因S2<<S1,p2<<p1,v2<<v1⑥整个系统经Δt时间的总能量包括宏观流动机械能与微观热运动内能增量ΔE为A2B2部分与A1B1部分的能量差.由于重力势能变化可忽略,在理想气体近似下比高考虑到⑥式有:ΔE=Δmv+C V T2-T1⑦体系移动过程中,外界做的总功为W=p1ΔV1-p2ΔV2⑧根据能量守恒定理,绝热过程满足ΔE=W⑨得:v2=⑩其中利用了②④式.参考评分:本题20分.②式1分,③式2分,④式3分,⑥式1分,⑦式6分,⑧式4分,⑨式1分,⑩式2分.10.25届复赛4图示为低温工程中常用的一种气体、蒸气压联合温度计的原理示意图,M为指针压力表,以V M表示其中可以容纳气体的容积;B为测温泡,处在待测温度的环境中,以V B 表示其体积;E为贮气容器,以V E表示其体积;F为阀门.M、E、B由体积可忽略的毛细血管连接.在M、E、B均处在室温T0=300K时充以压强p0=×105Pa的氢气.假设氢的饱和蒸气仍遵从理想气体状态方程.现考察以下各问题:1关闭阀门F,使E与温度计的其他部分隔断,于是M、B构成一简易的气体温度计,用它可测量25K以上的温度,这时B中的氢气始终处在气态,M处在室温中.试导出B处的温度T和压力表显示的压强p的关系.除题中给出的室温T0时B中氢气的压强P0外,理论上至少还需要测量几个已知温度下的压强才能定量确定T与p之间的关系2开启阀门F,使M、E、B连通,构成一用于测量20~25K温度区间的低温的蒸气压温度计,此时压力表M测出的是液态氢的饱和蒸气压.由于饱和蒸气压与温度有灵敏的依赖关系,知道了氢的饱和蒸气压与温度的关系,通过测量氢的饱和蒸气压,就可相当准确地确定这一温区的温度.在设计温度计时,要保证当B处于温度低于T V=25K 时,B中一定要有液态氢存在,而当温度高于T V=25K时,B中无液态氢.要达到这一目的,V M+V E与V B间应满足怎样的关系已知T V=25K时,液态氢的饱和蒸气压p V=×105Pa.3已知室温下压强p1=×105Pa的氢气体积是同质量的液态氢体积的800倍,试论证蒸气压温度计中的液态气不会溢出测温泡B.解析:1当阀门F关闭时,设封闭在M和B中的氢气的摩尔数为n1,当B处的温度为T时,压力表显示的压强为p,由理想气体状态方程,可知B和M中氢气的摩尔数分别为n1B=①n1M=②式中R为普适气体常量.因n1B+n1M=n1③解①②③式得:=-④或T=⑤④式表明,与成线性关系,式中的系数与仪器结构有关.在理论上至少要测得两个已知温度下的压强,作对的图线,就可求出系数.由于题中已给出室温T0时的压强p0,故至少还要测定另一已知温度下的压强,才能定量确定T与p之间的关系式.2若蒸气压温度计测量上限温度T V时有氢气液化,则当B处的温度T≤T V时,B、M和E中气态氢的总摩尔数应小于充入氢气的摩尔数.由理想气体状态方程可知充入氢气的总摩尔数n=⑥2假定液态氢上方的气态氢仍可视为理想气体,则B中气态氢的摩尔数为n2B=⑦在⑦式中,已忽略了B中液态氢所占的微小体积.由于蒸气压温度计的其它部分仍处在室温中,其中氢气的摩尔数为n2M+n2E=⑧根据要求有:n2B+n2M+n2E≤n2⑨解⑥⑦⑧⑨各式得:V M+V E≥V B⑩带入相关数据得:V M+V E≥18V B11.25届复赛7在地面上方垂直于太阳光的入射方向,放置一半径R=、焦距f=的薄凸透镜,在薄透镜下方的焦面上放置一黑色薄圆盘圆盘中心与透镜焦点重合,于是可以在黑色圆盘上形成太阳的像.已知黑色圆盘的半径是太阳像的半径的两倍.圆盘的导热性极好,圆盘与地面之间的距离较大.设太阳向外辐射的能量遵从斯特藩—玻尔兹曼定律:在单位时间内在其单位表面积上向外辐射的能量为W=σT4,式中σ为斯特藩—玻尔兹曼常量,T为辐射体表面的的绝对温度.对太而言,取其温度t s=×103℃.大气对太阳能的吸收率为α=.又设黑色圆盘对射到其上的太阳能全部吸收,同时圆盘也按斯特藩—玻尔兹曼定律向外辐射能量.如果不考虑空气的对流,也不考虑杂散光的影响,试问薄圆盘到达稳定状态时可能达到的最高温度为多少摄氏度解析:按照斯特藩-波尔兹曼定律,在单位时间内太阳表面单位面积向外发射的能量为W=σT①S其中σ为斯特藩-波尔兹曼常量,T S为太阳表面的绝对温度.若太阳的半径为R S,则单位时间内整个太阳表面向外辐射的能量为P S=4πR W S②单位时间内通过以太阳为中心的任意一个球面的能量都是P S.设太阳到地球的距离为r SE,考虑到地球周围大气的吸收,地面附近半径为R的透镜接收到的太阳辐射的能量为P=πR21-α③凸透镜将把这些能量会聚到置于其后焦面上的薄圆盘上并被薄圆盘全部吸收.另一方面,因为薄圆盘也向外辐射能量.设圆盘的半径为R D,温度为T D,注意到薄圆盘有两个表面,故圆盘在单位时间内辐射的能量为P D=2πRσT④显然,当P D=P⑤即圆盘单位时间内接收到的能量与单位时间内辐射的能量相等时,圆盘达到稳定状态,其温度达到最高.由①②③④⑤各式得:T D=T S⑥依题意,薄圆盘半径为太阳的像的半径R的2倍,即R D=R2.由透镜成像公式知:=⑦于是有:R D=2f⑧把⑧式带入⑥式得:T D=T S⑨带入已知数据,注意到T S=+t S K,T D=×103K⑩即有:t D=T D-=×103℃。
高中物理竞赛(热学)课件

v2 3kT m
v 8kT
m
vp
2kT m
2kT1 3kT2
m
m
T1 / T2 3 / 2
v 2 3kT 3nkT 3 p
m
nm
7.已知氮气分子的麦克斯韦速率分布曲线如图,试在该图上 定性画出相同温度下氢气分子的速率分布曲线。
r R2时, T T2
T1
Q
2k
ln
R1
C
T2
Q
2k
ln
R2
C
解得:
Q
2k(T1
T2
)
/
ln
R2 R1
C
T1
(T2
T2
)
ln ln
R1 R2
R1
所以r处的温度为:
ln R1
T
T1
(T1
T2 ) ln
r R2
R1
热力学第一定律
基本公式:
参见《大学物理》上册第170页
该过程为绝热自由膨胀,Q=0,
A=0,由热一律E 0,所以内 A
B
能应保持不变。
C
2.摩尔数相同的两种理想气体,第一种由单原子分子组成, 第二种由双原子分子组成,现两种气体从同一初态出发,经 历一准静态等压过程,体积膨胀到原来的两倍(假定气体的温 度在室温附近)。在两种气体经历的过程中,外界对气体作的
(a)大;(b)小;(c)一样。
可用范德瓦尔斯气体代表真实气体来粗略讨论分子体积及分子 间引力的影响。1mol范氏气体在Tl温度下等温膨胀,作功为:
物理竞赛热学部分习题

物理竞赛热学部分习题能⼒训练A组1、夏天,在密闭的绝热的房间⾥,⼀直打开冰箱门让冰箱运转起来,房间内的温度将_______(填“升⾼”或“降低”或“不变”)。
2、最近我国⼀些城市出现了环保汽车,该车型采⽤“清洁燃料”加“汽油”双燃料系统,使尾⽓中有害⽓体的成份降低了80%。
这种燃料是⽓态碳氢化合物,在微微加压的情况下即变为液体⽽储存于钢瓶中,加装到汽车供油系统。
当向发动机供“油”时,该燃料在钢瓶中逐渐汽化,然后进⼊⽓缸被点燃,从⽽产⽣动⼒。
3、在⽓温是20℃的房间⾥,⽤⽔银温度计测沸⽔的温度,当⽔银⾯经过“20”到“100”之间的某⼀刻度时,温度计的⽰数表⽰()A、房间⾥空⽓的温度B、沸⽔的温度C、温度计中⽔银的温度D、什么也不表⽰4、在沿海或⼤湖附近的⽓温变化⽐远离⽔域的地区缓慢。
这主要是因为()A、⽔在⼀般情况下⽐⼟壤温度⾼B、在⼀般情况下⽔⽐⼟壤温度低C、⽔⽐⼟壤更缓慢地变暖或变冷D、⽔⽐⼟壤更迅速地变暖或变冷5、两个相同的容器,内盛放相同体积、相同温度的热⽔,⼀个容器的表⾯是⽩⾊的,另⼀个表⾯是⿊⾊的,把它们放在同⼀个房间内,让它们⾃然冷却,则()A、⽩⾊容器⾥的⽔冷却得快B、⿊⾊容器⾥的⽔冷却得快C、两个容器⾥的⽔冷却得⼀样快D、以上情况都有可能6、我国发射的神州四号飞船返回舱的表⾯有⼀层叫做“烧蚀层”的物质,它可以在返回⼤⽓层时保护返回舱不因⾼温⽽烧毁。
烧蚀层能起这种作⽤,除了它的隔热性能外,还由于()A、它的硬度⼤,⾼温下不会损坏B、它的表⾯⾮常光滑,能减少舱体与空⽓的摩擦C、它在汽化时能吸收⼤量的热D、它能把热辐射到宇宙空间7、下列说法正确的是()A、质量相同的两种物质吸收热量时,⽐热⼤的温度变化⼀定⼩B、1焦⽿的热量可以使1克⽔温度升⾼4.2℃C、物体的机械能增加时,热能也会增加D、⼀根锯条的温度升⾼,热能增加时,我们⽆法判断其增加热能的⽅法8、家中烧⽔的⽔壶,壶盖上常有⼀个⼩孔。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
由热力学第一定律,内能改变为 ΔE Q A 3.74 105 J
四. 循环、卡诺循环
1)特点: E 0
2)效率: W Q1 Q2
Q1
Q1
3)制冷系数:e Q2 Q2 W Q1 Q2
4)卡诺循环:
热机效率: W 1 T2
Q1
T1
制冷系数:e Q2 T2 W T1 T2
i RT 2
m M
CVmT
W
p(V2
V1)
m M
RT
Qp
m M
CpmT
W
E
(3)等温过程
E
m M
i RT 2
m M
CVmT
0
W Q m RT ln V2 m RT ln p1
M
V1 M
p2
(4)绝热过程
Q 0 m
W E M CVmT
pV C
TV 1 C'
T p 1 C ''
(2)等压过程 Q=Cp(T2-T1)=[(i+2)/2]R(T2-T1) 吸热 Q=5×(5/2)×8.31×(300-290)=1038.5 J ΔE= CV(T2-T1) 内能增加 ΔE=5×(3/2)×8.31×(300-290)=623 J 对外作功 A=Q-ΔE=1038.5-623=415.5 J (3)绝热过程 由热力学第一定律得A=ΔE 做功与内能的变化均为 A=ΔE= CV(T2-T1)
水的体积为
V水
0.18 103
0.18103 (m3 )
将水蒸气视作理想气体,由 pV νRT
1.013105V气 108.31373.15 V气 0.306m3
水变为水蒸气,对外作功为
A
V气 pdV
V水
p(V气 V水 ) 1.013 10 5 (0.306 - 0.18 10 3) 0.31 10 5 (J )
时的密度为 ,此时它的分子方均根速率 v2 __________ 。
v 2 3kT v 8kT
m
m
vp
2kT m
2kT1 3kT2
m
m
T1 / T2 3 / 2
v 2 3kT 3nkT 3 p
m
nm
3kT
3RT
0
m0
M
最概然速率:
vp
2kT m0
2RT M
七.平均碰撞频率和平均自由程 (1)平均碰撞频率
Z 2 d 2 vn
(2)平均自由程
v 1 Z 2 d 2n
1.一定量的理想气体盛于容器中,则该气体分子热运动的平均 自由程仅决定于
(A)压强p
(B)体积V
(C)温度T
(D)分子的平均碰撞频率
不可能把热量从低温物体传到高温 物体而不产生其他影响。
2、熵
(1)卡诺定理
工作于两个一定温度热源之间的所有的热机, 以可逆机的效率最高.
1 Q2 1 T2
Q1
T1
特别注意:
克劳修斯熵公式
dS dQ T
(可逆过程)
S2 S1
2 dQ 1T
(可逆过程)
例题
将质量相同、温度分别为T1、T2的两杯 水在等压下绝热的混合,试问: (1)此系统达到最后状态,计算此过程的熵 变。 (2)分析判断熵是增加、减少、还是未变? 要有推算过程并对结论说明理由。(设水的 等压摩尔热容量为cpm,每杯水摩尔质量n)
六.麦克斯韦速率分布率
f (v) dN 4 (
m
) e v 3 2
mv2 2 kT
2
Ndv
2 kT
物理意义:速率在v附近单位速率区 间内的分子数占总分子数的百分比。
气体分子的三个统计速率 平均速率:
v vf (v)dv
8kT
8RT
0
m0 M
方均根速率:ຫໍສະໝຸດ v2 v2 f (v)dv
卡诺机的制冷系数:
( Q2
t ) P2
T2
W t P T1 T2
求得卡诺机的工作功率:
P
T1 T2 T2
P2
172 34.4 48.2千瓦 122
五.热力学第二定律、熵
1、热力学第二定律的两种表述
1)开尔文表述: 不可能从单一热源吸收热量,使之
完全变成有用功,而不产生其他影响。 2)克劳休斯表述:
v
z
1
2d
2n
1
2d 2N
/V
V
2d 2N
N不变
2. 在下面四种情况中,何种将一定能使理想气体分子平均碰撞 频率增大?
(a)增大压强,提高温度 (c)降低压强,提高温度 (b)增大压强,降低温度 (d)降低压强,保持温度不变
z 2d 2nv 2d 2 p 8kT p kT M T
3.某气体在温度T1时的分子最可几速率与在温度T2时的分子 方均根速率相等,则T1 / T2 =_______。这种气体在压强为p
例题
月球上白天最高温度116oC,夜间的最低温度-151oC。 人们要在月球上居住,若起居室温度保持21oC,起居室 墙 壁 透 热 的 功 率 为 每 度 温 差 0.2 千 瓦 ( 随 墙 壁 材 料 而 变)。试求昼间与夜间在温度最大和最小值情况下,卡 诺热机的功率各为多少?
解:温度:昼间为389K,夜间122K,居室294K。 1.昼间室内外温差95K,
p0
S
l2
l1
Q
解:可分析出起初气缸中的气体的压强由于小于P2 (P2=外界压强+活塞重力产生的压强),所以体积不 会变,是一个等容升温的过程,当压强达到P时,它 将继续做一个等压膨胀的过程,则气缸中的气体的过 程为:等容升温+等压膨胀。
p1
RT V
1
8.31 273 0.021
1.13105
p2
例题
一充满氢气的气球,球囊的质量是氢气质量的5.0倍, 球内外的温度相同,而球内的压力为球外的1.8倍,在忽 略球囊本身体积、空气阻力情况下,静止释放此气球,求 开始上升时的加速度是多少?
例题
一侧面绝热的气缸内盛有1 mol的单原子 分子理想气体.气体的温度T1=273K,活塞外 气压p0=1.01×105Pa,活塞面积S=0.02m2,活塞 质量m =102kg.活塞起初停在距气缸底部为 l1=1m处.今从底部极缓慢地加热气缸中的气 体,使活塞上升了l2 = 0.5 m的一段距离如图所 示.试过计算:气缸中的气体在整个过程中吸 了多少热量?
p0
mg s
1.01105
10210 0.02
1.52 105
等容升温:
QV
i 2
R(T2
T1)
i pV 2
3 2
(
p2
p1)V
等压膨胀:
Qp
5 2
R(T2
T1)
5 2
R( p2V2
p1V1 )
Q QV Qp 4.9103 J
例题
摩尔的某种理想气体,状态按 V a / p
a 的规律变化(式中 为正常量),当气体体积从
例题
温度为0oC的1kg的水与温度为100oC的恒 温热源接触后,水的温度达到100oC,试分别 计算水和热源及整个系统的熵的改变.(设水 的比热容为cp=4.18J/gK)
例题
将质量相同、温度分别为T1、T2 的两杯水在等压下绝热地 混合,试问:(1)此系统达到最后状态,计算此过程的熵 变。(2)分析判断熵是增加、减少、还是未变?要有推算 过程并对结论说明理由。(设水的摩尔等压热容量为Cp, 每杯水的量为ν摩尔)
室外向居室透热功率:P2 0.2 95 19.0千瓦 卡诺机的制冷系数: (Q2 t ) P2 T2
W t P T1 T2
求得卡诺机的工作功率:
P
T1 T2 T2
P2
95 19.0 6.1千瓦 294
2 夜间室内外温差172K,居室T1 294 K,室外T2 122 K
居室流出热功率:P1 172 0.2 34.4千瓦
热学
内容提要
1 平衡态、状态参量、热力学第零定律 2 理想气体状态方程 3 准静态过程、热量和内能 4 热力学第一定律、典型的热力学过程 5 循环过程、卡诺循环、热机效率、致冷系数 6 热力学第二定律、熵和熵增加原理、玻耳兹曼熵关系式 7 统计规律、理想气体的压强和温度 8 理想气体的内能、能量按自由度均分定理 9 麦克斯韦速率分布律、三种统计速率 10 气体分子的平均碰撞频率和平均自由程
例题
通常说混合气体中各组分的体积百分
比,是指每种组分单独处在和混合气体相 同的压强及温度的状态下其体积占混合气 体体积V的百分比。已知空气中的几种主 要氧准组(状O分态2的()1体2a1t积m﹪百,、分0氩℃比()是A下:r)空氮1气(﹪中N,各2)求组7在8分﹪标的、 分压强和密度以及空气的密度。已知氮的 相对分子量是28.0,氧的是32.0,氩的是 40.0,平均为29.0。
= (i/2)R(T2-T1) A=ΔE=5×(3/2)×8.31×(300-290)=623 J 吸热 Q=0
例题
在一个大气压下,180克水在沸点汽化为100 0C的水蒸汽。问它的内能改变了多少?(水 的沸点汽化热为2.25x106焦耳/千克)
解:汽化吸热为 Q 0.18 2.25 10 6 4.05 10 5 (J )
每个分子的平均动能 i kT
2
系统共有N个分子 E N N i kT
2 系统摩尔数为m/M E m i RT
M2 系统压强p体积V E i pV
2
三. 热力学第一定律及其应用
Q E W dE dQ pdV
(1)等容过程
mi
m
QV
E
