配位化学基础
配位化学基础及解题
Co(H2O)62+,粉红色;Co(H2O)63+,红色
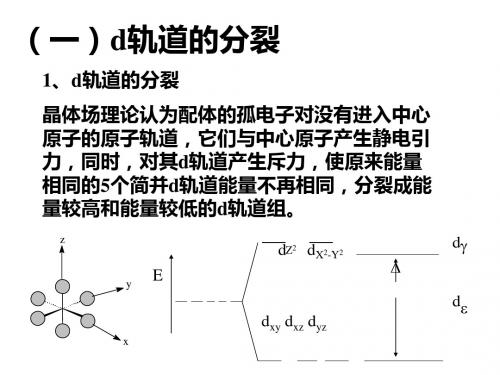
4、中心原子d电子组态
八面体配合物的中心原子d电子组态
弱场
强场
t2g
Eg
t2g
Eg
d1
1
1
d2
2
2
d3
3
3
d4
3
1
4
d5
3
2
5
d6
4
2
6
d7
5
2
6
1
d8
6
2
6
2
d9
6
3
6
3
d10
6
4
6
4
x
平面正方形场
z
37.5O
y
x
7.5O
22.5O
三角双锥场
表1 在各对称场中d轨道的能级(Dq)
结构
d(Z2)
四面体 -2.67 八面体 6.00 平面正方 -4.28 四方锥 0.86 五角双锥 4.93
d(x2-y2) d(xy) d(xz)
-2.67 6.00 12.28 9.14 2.82
成对能P<分裂能时,电子尽可能配对而不进入能 量较高的d轨道。此时,配合物未成对电子数少, 这种配合物称为内轨型配合物或低自旋配合物。
成对能P>分裂能时,电子不配对而是优先进入能 量较高的d轨道。此时,配合物未成对电子数多, 这种配合物称为外轨型配合物或高自旋配合物。
低自旋与高自旋由磁矩来判断
= U n(n+2) UB
该公式适用于第一过渡系金属离子
7、高、低自旋的经验判据
配位化学基础

1.配位数为6的配合物的几何异构体结构式的书写
(1) [MA4B2 ]型: 以[CoCl2(NH3)4]+ 为例
Cl Cl
n( n 2) B . M
(6-1)
n 表示分子中未成对的电子数。 n μ / B.M 0 0 1 1.73 2 2.83 3 4 5 5.92
3.87 4.90
3、 配合物的空间构型与杂化轨道类型
4、配合物的形成
(1) 配位数为4的配位单元
配位数为4的配位单元的空间构型有两种: 四面体 sp3 ; 平面四方形 dsp2,取决于形成体的价电子结构和配体的性质。
中心原子 (形成体) 配位体
[Ni(CO)4 ]
中心原子 (形成体) 配位体
内界 (配离子)
外界
外界
内界 (配离子)
内界
配合物
配合物
配合物
由配离子形成的配合物是由内界和 外界构成的。配合物的内界称配离子 用[ ]括起来。内界是配合物的特征部分。
配合物的外界是与内界保持电荷平衡的简单离子或离子团。内界与外界 之间以离子键结合。
如写出[M a2 b c d e]的几何异构体, 处在相对位置的配体可列出如下
组合, 再删除相同的组合, 剩余的部分画出结构式。
再如写出[M a3 b c d]的几何异构体, 处在相对位置的配体可列出如
下组合, 再删除相同的组合, 剩余的部分画出结构式。
A B D A A C
B C
A A D A
B C
2-1配合物的立体化学

[Co(en)3]3+
2、旋光异构
四配位 Td点群: MABCD
乳酸
OH
COOH C H CH3
六配位Oh点群: M(L-L)3, cis-M(L-L)2A2, MA2B2C2, MABCDEF eg. [Co(en)3]3+
N N Co N N N N
N N Co N N N N
D (+) Co(en)33+
配合物的异构类型
1、几何异构(geometric isomerism) 2、旋光异构(chiral isomerism)
异构类型
3、键合异构(linkage isomerism) 4、电离异构(ionization isomerism) 5、溶剂合异构(solvate isomerism)
6、配位异构(coordination isomerism)
空间斥力:配体间静电排斥, 与配体大小有关。
立方体场
Oh
四面体场
Td
球形场
八面体场 四方畸变
Oh D4h
平面四方场
D4h
中心离子的电子组态为:d0
d5
d10 d1
d6
通常与弱场配体形成 Td构型配合物。 例如: TiBr4 (d0),
FeCl4- (d5),
ZnCl42- (d10),
VCl4 (d1),
③ 同类配体(同为阴离子或同为中性分子)以配 位原子元素符号英文字母的先后排序。
配位化合物的命名原则:
① 阴离子名称在前,阳离子名称在后,阴、阳离子名称 之间用“化”字或“酸”字相连。此时,配阴离子一 律当含氧酸根看待; ② 配位个体中:配体名称在前,中心原子名称在后;
不同配体名称的顺序同书写顺序,相互之间以中圆点 “”分开,最后一种配体名称之后缀以“合”字;
第11章 配位化学基础

N P
O S
F Cl
Ne Ar Kr Xe Rn
Sr Y 配位原子 Ba Lu
Tc Re Bh
Fr Ra Lr Rf Db Sg 配体中与中心金属直接 结合的原子。
Cu Zn Ga Ge As Se Br •Ni 排列在中心金属周围 Ag Cd In Sn Sb Te I •Pd分子或者阴离子 Pt Au Hg Tl Pb Bi Po At • 分为单齿配体与多齿配体
2018/5/31
21
配合物的分类
特殊配合物
1)夹心配合物:
金属原子 M 被夹在两个平行的碳环之间,形成夹心配合物。
2)羰基配合物
以 CO 为配体的配合物称为羰基配合物。
3)原子簇状化合物
有两个或两个以上金属原子以金属 –金属键( M–M)直接结合而 形成的化合物。
4)多核配合物
含两个或两个以上中心金属离子的配合物。
单齿 配体
特点 多齿 配体 举例
有两个或两个以上的配位原子同时与中心金属
结合。可分为二齿、三齿、多齿配体等。
O :O
N N
O H 2C :N CH2 CH 2 N: CH2 C O O: H 2C CH2 C O:
C C O
:O
邻二氮菲 (phen)
乙二胺四乙酸根 (EDTA4-)
配位数
配合物的组成
2018/5/31
11
[Fe(SCN)(H2O)5]2+, [Co(SCN)4(H2O)2]2-, [Cu(NH3)4(H2O)2]2+, [CuBr4]22018/5/31
12
2018/5/31
无机化学-配位化学基础-配合物的定义和组成

W. C. Zeise salt K[Pt(C2H4)Cl3] Pt2+ C2H[Cu(NH3)4]SO4
中心离子 配位体 外 界
[内
界]
[Co (NH3)6]Cl3 vs [CoCl(NH3)5]Cl2
第十五章、配位化学基础
➢ 配合物的基本概念 ➢ 配合物的同分异构现象 ➢ 配合物的化学键理论 ➢ 配位平衡
9.1 配合物的基本概念
➢ 配合物的定义 ➢ 配合物的组成 ➢ 配位数与配位结构 ➢ 配合物的分类 ➢ 配合物的命名
9.1.1 配合物的形成
[Cu (H2O)4]2+
[Cu (NH3)4]2+
Fe(C5H5)2 或 Fe(cp)2 二茂铁(Ferrocene) Fe2+ C5H5- 配位键
环戊二烯基阴离子 (C5H5- 或 cp- )
配位键
由配体单方面提供电子对给中心原子(离子)而形 成的共价键
[Cu (NH3)4]2+ Cu2+ NH3 配位键 (dsp2 , 空)
中心原子(离子)是酸, 配体是碱 , 配合物是 酸碱加合物。
NH3(aq)
NH3(aq)
CuSO4 (aq)
蓝色 深蓝色溶液(1)
NH3(aq)
NH3(aq)
CuSO4 (aq)
蓝色 深蓝色溶液(1)
(1) + NaOH (aq) 无 Qi < Ksp [Cu(OH)2] (1) + BaCl2 (aq) 白色 (BaSO4) (1) 浓缩、冷却 深蓝色晶体
配位化学基础

氢氧化二氨合银(Ⅰ) 氢氧化二氨合银 (Ⅰ) 四氯合铂(Ⅱ)酸 四吡啶合铂( 四氯合铂(Ⅱ)酸 四吡啶合铂(Ⅱ) (Ⅱ) 四羰基合镍(0) 四羰基合镍(0) 三氯化二氨 乙二胺)合钴(Ⅲ) 三氯化二氨 ·二(乙二胺)合钴(Ⅲ) 六氯合铂(Ⅳ)酸 六氯合铂 (Ⅳ)酸 (Ⅳ)
[Co(ONO)(NH3)5]SO4 硫酸 一亚硝酸根 · 五氨合钴(Ⅲ) 合钴(Ⅲ) [Pt(NO2)(NH3)(NH2OH)(Py)]Cl Ⅱ 氯化 一硝基 · 一氨 · 一羟氨基 · 一吡啶合铂 (Ⅱ)
n(n + 2)
- 2 + 4 + 4µ 2 n= 2
- 2 + 4 + 4 × 4.52 n = 3.61≈ 4 [CoF6]3-(4.5): = : 2
Co3+ :3d6 sp3d2 正八面体 [CoF6]3-: 外轨型
- 2 + 4 + 4 × 3.2 2 = 2.35≈ 2 n [Ni(NH3)4]2+(3.2): = : 2
配合物的组成: 二. 配合物的组成: [Cu ( NH3 ) 4 ]2+ SO4
内界 中 心 离 子
配 位 键 离子键
K 2 [Hg I4 ]
外 界 配 位 数 内 界
外界
配 位 体
配 位 体 数
配 离 子 的 电 荷
内界
配离子
[Cu ( NH3 ) 4 ] SO4
是体现配合物性质的核心部分 用方括号标明 1. 中心离子 ( 形成体 ) 位于配离子的中心 是配离子的核心部分 金属离子 某些金属原子 高氧化值的非金属元素 过渡金属离子
NH4[Cr(NCS)4(NH3)2] 四异硫氰酸根 ·二氨合铬(Ⅲ)酸铵 合铬(Ⅲ) (Ⅲ)酸铵 NH4[Cr(SCN)4(NH3)2] 四硫氰酸根 ·二氨合铬(Ⅲ)酸铵 合铬(Ⅲ) (Ⅲ)酸铵
配位化学的基础知识

配体的加质子常数的关系
如同配合物稳定常数的关系一样 KH 所表示的称为逐级加质子常数, 相应的有积累加质子常数, 积累加质子常数与逐级加质子常数的关系有:
n H [[ H H ]n n [ L L ]] K 1 H K 2 H K 3 H .K .n H . i n 1K iH
第三节 配位数与配合物的立体结构
所说的配位数系指最高配位数。
金属离子和种类,氧化数
配位数取决于
决定性的
配体的种类
其它因素有:
1 空间因素
1)中心离子一定时,配体的体积增大,则配 位数下降
如Al(III)与F-可形成AlF63-, 而与Cl- , Br-, I-, 等只能形成AlX4-.
2) 配体一定时,中心离子体积增大,配位数 增大
2 电荷的影响
1)中心离子电荷大,利于形成配位数高 的配合物
2)配体为阴离子时,其电荷越低,越容 易形成高配位数的配合物
中心离子的配位数
有2,3,4,5,6,7,8,9,10,11,12, 最高有为14的报道, 在水溶液中常见的是2,4,6
Cu(NH3 )42+,Ni(NH3 )62+ 等形式存在
交换的两种途径
交换阴离子,选用阴离子交换树脂 交换阳离子,选用阳离子交换树脂
色层分离,利用淋洗时各配合物的稳定性差别进 行分离
用EDTA来淋洗负载稀土的树脂,其反应如下: (R)RE + (NH4)3HY =(R)(NH4)3
+REY- + H+
2 溶剂萃取
溶剂萃取的发展先从核工业开始
然后是稀有金属、贵金属
配位化学第2章-基础

硫酸铜和水都是独立存在的稳定化合物, 它们仍然可以相互作 用, 形成更复杂的化合物五水硫酸铜. 由于人们在相当长的一段 时间内并不能了解式3−1中两个反应物的作用机理, 尽管得到的 产物组成易于确定, 但其结构并不清楚, 因此, 早期将这类化合 物统称为复杂化合物, 汉语译为络合物. 1798年, 法国化学家塔舍特(Tassert)将蓝色的二氯化钴与氨 作用, 得到了玫瑰红色的化合物, 其组成为CoCl2∙6NH3, 该物质 在有氨和氯化铵存在下, 于水溶液中慢慢转变为桔黄色, 分析产 物的组成为CoCl3∙6NH3, 很明显, 它是由CoCl2∙6NH3氧化而产 生的, 见式3−2.
早在上世纪五十年代就已成立的国际性配位化学 学会, 至今已举办数十次国际配位化学会议(ICCC), 其中第25届就是于1987年7月在中国南京举行, 由 南京大学配位化学研究所承办, 我国化学界前辈戴 安邦院士担任大会主席, 著名无机化学家游效曾院 士担任大会秘书长.
据统计目前有关配位化学研究的原始论文占无 机化学专业论文总数的75%以上。 随着现代物质结构理论以及现代物理技术的推 动, 配位化学的研究成果已远远超出了无机化学 的范畴, 已经渗透到化学的所有分支领域, 包括 分析化学、有机化学、物理化学、高分子化学、 结构化学、环境化学、催化机理、生物化学、 以及能源、原子能、激光、半导体、空间科学 等众多科技领域.
CoCl2 (蓝色) + 6NH3 → CoCl2∙6NH3 (玫瑰红色) → CoCl3∙6NH3 (桔黄色) 3−2
上述研究可认为是配位化学的起点, 这是因为塔舍特的报道 在当时便引起轰动, 很多无机化学家对这类奇异的化学反应 性产生了浓厚兴趣. 从那时起, 经过一百五十年的发展, 到上 世纪中叶, 配位化学已发展成为化学学科中一门及其重要的 分支学科.
3配位化学基础

§3-4 配位化合物的稳定性与 化学键理论
真正稳定的体系(热力学稳定):在一定条 件下体系的各种可能变化都不能自发进行, 体系处于平衡状态
表观稳定的体系(动力学稳定):至少有一 种可能变化会自发进行,但变化的速度很缓 慢以致不可测量
配合物的稳定性影响因素:
1. 中心离子的电荷、半径、电子构型 2. 配位体的种类和配位键的类型 3. 配位体的数目多少及其空间配臵 σ-配体: 配位体用配位原子的孤对电子与中心 离子形成σ键 π-配体:配位体用其π电子形成配位键 π-酸配体:既有σ键也有反馈π键的形成
配合物的化学键理论
价键理论(VBT)
晶体场理论和配位场理论(CFT, LFT)
分子轨道理论(MOT)
• 1931 年, Pauling建立和发展了配合物的价 键理论, Pauling 的轨道杂化概念,可以解 释大多情况下配合物的空间构型和磁性。但 对吸收光谱、配合物的稳定性和畸变等问题 解释不好 • 五十年代后,配合物的化学键理论由于引入 了1929 年物理学家 Bethe和van-Vleck 提出 的晶体场理论CFT得到了进一步发展。改进 的晶体场理论称为配位场理论LFT • 新近又发展了分子轨道理论MOT
反应在大约 70 oC温度下才能迅速进行,反应经过 一个中间体[Co(en)(NO2)4]-, 如果将溶剂全部除去, 得到的固体仍含有相当量的中间体,因为它是一个 惰性配离子
3. 非水溶剂中的合成
许多取代反应可以在有机溶剂中进行,常用的有 机溶剂有乙醇、丙酮、苯、乙腈、硝基甲烷等。 例如:制备[Fe(Bipy)3]Cl2配合物可在丙酮中或在 水-乙醇混合溶剂中进行 [Fe(H2O)6]2+ + 3bipy = [Fe(bipy)3]2++ 6H2O 若希望制备无水配合物,最好是直接采用无水盐
宋天佑版无机化学 第11章配位化学基础

一个环上有几个原子称 为几原子环。 五或六元环最稳定。
螯合剂:能与中心离子形成螯合物的配体叫 螯合剂。
一般常见螯合剂是含有N、O、S、P等配位原 子的有机化合物。en,EDTA,C2O42-,NH2CH2COO-. 螯合剂必须具备的条件:
(1) 含2个或2个以上的配位原子;
(2) 任两个配位原子间最好间隔2-3个其它原子.
§11-1 配合物的空间构型、命名和磁性
§11-2 配位化合物的化学键理论 §11-3 配位化合物的稳定性
前 言
实验: 1.CuSO4+NaOH→Cu(OH)2→ CuSO4+BaCl2→BaSO4→
2.CuSO4
NH3H2O
C u 2( OH ) 2S O 4
NH 3H 2O
深蓝色溶液
深蓝 溶液
外界为其它阳离子 K4[Fe(CN)6]
2.配离子的命名
“某酸某”
配体数→配体名称→合→中心离子(氧化数)
汉字大写
罗马数字
⑴先阴离子(先无机后有机,先简后繁)后中性 分子(先无机后有机)。 ⑵同类配体,按配位原子元素符号的英文字母顺 序排列。NH3、H2O。
⑶同类配体中,若配位原子相同,含原子数少的 配体在前。NH3、NH2OH。
2.配位化合物的组成
配位键 离子键
[Cu( NH3 )4 ] SO4
中心 离子 配位 原子
配 位 体
配 体 数
外 界
内界(配阳离子)
K3[Fe(CN)6]
配(阴) 离子 中心 原子
Ni(CO)
4
中性配合物 (无外界)
一般配合物图示如下:
[中心离子(配位体)配体数]外界离子
内界(配离子)
配位化学知识点总结

配位化学知识点总结配位化学是化学的一个重要分支,它探讨的是化学中的配位作用,即两个或多个分子相互作用形成复合物。
在高分子材料、医药、冶金、土木工程和环境科学等领域应用广泛。
配位化学的基础知识和技能是化学专业学生和研究人员必备的求生技能之一。
本文将介绍配位化学的基本概念、重要原则以及主要应用。
一、配位化学的基本概念1. 配位体在化学中,配位体是指通过给体原子与金属中心之间的化学键与金属形成配合物的分子或离子。
著名的例子有氨、水、五硝基吡啶、乙二胺等。
2. 配位作用配位作用是指配位体的给体原子利用孤对电子与金属中心形成协同共振化学键的过程。
配位能力取决于给体原子的化学性质。
一般来说,仅具有孤对电子的原子或离子能够作为配位体。
在配位作用中,给体原子发生了电子的向金属中心的迁移,原子中的孤对电子与金属中心的未配对电子形成共价键。
3. 配位数配位数是一个复合物中与离子或分子互相作用的中心原子数量。
通常,金属离子具有高配位数,而范德瓦尔斯复合物和氢键配合物具有较低的配位数。
二、配位化学的重要原则1. 八面体配位八面体配位是指配合物中金属中心周围八个空间位置上配位体的均匀分布,也是最常见的配位几何形态之一。
一些典型的八面体配位化合物包括六氟合铁酸钾和硫脲铜硫脲。
2. 方阵配位方阵配位是一种由四个配位体组成的四面体形态的配位体,常见的方阵配位化合物包括四氟合镍和四氯合钴。
3. 配体场理论配体场理论是解释元素化学、配位化学和配位化合物性质的一种理论。
该理论通过将配位体组合成简单的场点,进而表征复合物的化学键结构和物理性质。
三、配位化学的主要应用1. 工业催化工业化学中的催化剂往往是由配位化合物构成,钯的催化反应、铂的催化脱氢和钨的催化氧化反应都是利用了配位体的协同作用完成的。
例如,五氯甲基钌配合物和卟啉钴配合物在氧气氧化和n 桥苯甲基乙烯二醇转移反应中均被用作催化剂。
2. 生物学知识生物配合物(例如血红蛋白和维生素B12)中的重要化学反应是由于配位体与活性中心原子之间的化学反应所形成的。
配位化学基础知识

如: NH3 中的 N 原子 H2O中的 O 原子
配位化学基础知识
(2)能提供 电子的分子.
如: H
C H
H C
H
配位化学基础知识
3. 配体的类型 (1)单齿配位体: 只有 1 个配位原子的配体.
例 : NH3 H2O F -
配位化学基础知识
1. 中心原子(或形成体)
具有接受孤对电子或多个不定域电子的 原子或离子.
特点: 具有空轨道. 常见的中心原子:
(1)金属原子或离子,过渡金属居多. (2) 具有高氧化态的P区非金属元素.
如:[SiF6]2-、[PF6]-、[BF4]-
配位化学基础知识
2. 配位体(配体) (1)具有孤对电子的分子或离子.
Ir
CO
O C Ir
Ir CO
OC
Ir
CO
O C CO CO
Ir4(CO)12的结构 配位化学基础知识
特点?
5. 螯合物
由中心离子与多齿配体形成具有环状 结构的配合物 。五元、六元环最稳定。
NH2
H2N
2+
H2C H2C
CH2 Cu
CH2
NH2
H2N
[Cu(配e位n化)学2基]2础+知的识 结构
H3C CO
配位化学基础知识
第二节 配合物的类型
1. 单一配体配合物
配合物中只含一种配体,[MLn]
例如: [Cu(H2O)4]2+ [Co(py)4]2+
[Cu(NH3)4]2+ [Cu(en)2]2+
配位化学基础知识
第五章 配位化学基础

o 同类配体的名称,按配位原子元素符号的英文字母顺序排列 同类配体的名称, [Co(NH3)5(H2O)]3+ 五氨·一水合钴 五氨 一水合钴(III)离子 一水合钴 离子
配合物的命名 服从一般无机物的命名原则。 服从一般无机物的命名原则。 若与配位阳离子结合的负离子是简单酸根, 若与配位阳离子结合的负离子是简单酸根,则该配合物 叫做“某化某” [Ag(NH3)2]Cl 叫做“某化某”;
配合物命名示例
H[AuCl4] K[PtCl3(C2H4)] [CoCl(NH3)3(H2O)2]Cl2 Fe(CO)5 [Ag(NH3)2](OH) [Co(NO2)3(NH3)3] 四氯合金(III)酸 酸 四氯合金 三氯•乙烯合铂 酸钾 三氯 乙烯合铂(II)酸钾 乙烯合铂 二氯化一氯•三氨 二水合钴 二氯化一氯 三氨•二水合钴 三氨 二水合钴(III) 五羰基合铁 氢氧化二氨合银( ) 氢氧化二氨合银(I) 三硝基•三氨合钴( ) 三硝基 三氨合钴(III) 三氨合钴
Cu2++4NH3 + HCl → Cl- + H+ = NH4+
5.2.3 稳定常数的应用
(1)配离子溶液中的离子浓度计算 ) 例5-1:计算含有 ×10-3mol·L-1[Zn(NH3)4]2+和0.1mol·L-1 :计算含有1.0× NH3的混合溶液中 2+的浓度。(已知 i=3.48×10-10) 的混合溶液中Zn 的浓度。 已知K × [Zn2+]=3.48×10-9mol·L-1 × (2)判断配离子与沉淀之间的相互转化 ) 溶液与10mL 6.0mol·L-1 例5-2:10mL 0.1mol·L-1 CuSO4溶液与 : NH3·H2O混合并达到平衡,计算溶液中 2+、NH3及 混合并达到平衡, 混合并达到平衡 计算溶液中Cu [Cu(NH3)4]2+的浓度各为多少?若向此溶液中加入 的浓度各为多少? 0.010molNaOH固体,问是否有Cu(OH)2沉淀生成?(已知 固体,问是否有 沉淀生成? 固体 K稳([Cu(NH3)4]2+)=2.09×1013,Ksp [Cu(OH)2]=5.6×10-20) × ×
配位化学基础

1.定义
配 位 化 学 旧 称 络 合 物 化 学 , 配 位 化 合 物 (Coordination compounds),简称配合物,旧称络合物(Complex compounds) 。 考虑到结构和性质上的特点,将其称为配合物更确切些。目前 国际上多采用配合物一词。 CCS(中国化学会)1980年定义:(狭义) 配位化合物(简称配合物)是由可以给出孤电子对或多个不
3.配位数(Coordination Number,C.N.)
配位数 —— 配合物中与中心原子直接成键的配位原子的总 数 。配位数是中心原子的重要性质之一。 定义(IUPAC):(1)与中心原子直接键合的原子数 (2)中心原子与配体间的键数(不包括键) 单齿配体:配位数 = 配位原子数 = 配体总数 多齿配体:配位数 = 配体i的数目齿数 注意:配位数≠配体数, 但 配位原子数 = 配位数
18 / 258
▴ INTERMEDIATE INORGANIC CHEMISTRY
DMF DMSO THF trien tu ur pn
N,N’-二甲基甲酰胺 二甲基亚砜 四氢呋喃 二乙三胺 硫脲 尿素 丙二胺
关于配体缩写符号的使用规则和常用的缩写符号 C.f.《无机化学命名原则》
▴ INTERMEDIATE INORGANIC CHEMISTRY
▴ INTERMEDIATE INORGANIC CHEMISTRY
14 / 258
加括号表示的配体有:
所有的有机配体; 如: PPh3 三苯基膦
所有的用缩写符号表示的配体; 如:en N2(双氮)和O2(双氧)配体;
用bis,tris,tetrkis,pentakis……为数字前缀的配体;
带数字前缀的无机含氧酸阴离子配体; 如:三磷酸根 含有一个以上直接相连的成酸原子的配体。如:硫代硫酸根
配位化学的基础知识

配位原子在周期表中的位置:
C
N O P S As Se Te
F Cl Br I
配位数:
配合物中,与中心离子直接结合的配位原 子的总数, 多齿配体:一个配体中能与金属离子配位 的位原子的数目
第二节 配合物的稳定常数
[Cu(NH3)4]SO4溶于水时,内外界之间完全离解 [Cu(NH3)4]SO4=[Cu(NH3)4]2+ + SO42- [Cu(NH3)4]2+ 进一步离解成 [Cu(NH3)3]2+ [Cu(NH3)2]2+ [Cu(NH3)]2+ Cu2+ 氨的浓度高时可能形成[Cu(NH3)6]2+
中心离子的配位数
有2,3,4,5,6,7,8,9,10,11,12, 最高有为14的报道, 在水溶液中常见的是2,4,6
常见金属离子的配位数一览表
配位数 2 4 中心离子 Cu(I), Ag(I), Au(I), Hg(I), Hg(II) Cu(I), Ag(I), Zn(II), Cd(II), Hg(II), Al(III), Ga(III), In(III), Sn(IV), Pb(II), Cu(II), Au(III), Ni(II), Pd(II), Pt(II) Al(III), Co(III), Co(II), Fe(III), Fe(II), Rh(III), Ru(III), Pd(IV), Os(III), Ir(III), Pt(IV), Pb(II), La(III)系, Ni(II), Zn(II), Cd(II), Sn(II), Sn(IV) 实例 Au(CN)2-, Ag(CN)-2
配位化学的基础知识
《无机化学》第3版 宋天佑 第11章 配位化学基础

黄褐色的硝基配位化合物 [ Co(NO2)(NH3)5 ] Cl2 红褐色的亚硝酸根配位化合物 [ Co(ONO)(NH3)5 ] Cl2
互为键合异构
(4) 配体异构
如果两个配位体互为异构体, 那么由它们分别形成的相应的配位 化合物互为配体异构。
1,2 — 二氨基丙烷
NH2CH2CHNH2CH3 和 1,3 — 二氨基丙烷
几种不同的配体之间加 “ • ” 隔开。
[ Co(NH3)5 H2O ] Cl3 三氯化五氨•水合钴(III)
Cu2 [ SiF6 ] 六氟合硅(IV)酸亚铜
中心后面加( ),内写罗 马数字表示中心的化合价。
3. 配体的先后顺序
在配位单元中,可能涉及多种 配体,所以要明确规定命名时配体 的次序。
[ Co(NH3)5 H2O ] Cl3 三氯化五氨•水合钴(III)
④ 配位原子相同,配体 中原子个数少的在前。
[ Pt(py)(NH3)(NO2)(NH2OH)] Cl 氯化硝基•氨•羟氨• 吡啶合铂(II)
⑤ 配体中原子个数相同, 则按和配位原子直接相连的配体 中的其他原子的元素符号的英文 字母表次序。
互为配位异构。
(3) 键合异构
配体中有两个配位原子,但 这两个原子并不同时配位,这样 的配体称两可配体。
两可配体可产生键合异构。
例如若 NO2- 以 N 为配位原子 时,则形成硝基配位化合物。
其中的配体硝基表示为 -NO2
例如若 NO2- 以 O 为配位原子 时,则形成亚硝酸根配位化合物。
其中的配体亚硝酸根表示为 - ONO
含有多个配位原子的配体称 多基配体(或多齿配体),
例如乙二胺四乙酸(EDTA)。
它的两个 N,4 个 -OH 中的 O 均 可以配位。
配位化学基础

配位化学基础配位化学基础配位化学就是在⽆机化学基础上发展起来的⼀门具有很强交叉性的学科,配位化学旧称络合物化学,其研究对象就是配合物的合成、结构、性质与应⽤。
配位化学的研究范围,除最初的简单⽆机加与物外,已包括含有⾦属-碳键的有机⾦属配位化合物,含有⾦属-⾦属键的多核蔟状配位化合物即⾦属簇合物,还包括有机配体与⾦属形成的⼤环配位化合物,以及⽣物体内的⾦属酶等⽣物⼤分⼦配位化合物。
⼀、配合物的基本概念1、配合物的定义及构成依据1980年中国化学会⽆机化学命名原则,配合物可以定义为:由可以给出孤对电⼦或多个不定域电⼦的⼀定数⽬的离⼦或分⼦(统称为配体)与具有接受孤对电⼦或多个不定域电⼦的空位的原⼦或离⼦(统称为中⼼原⼦),按⼀定的组成与空间构型所形成的化合物。
结合以上规定,可以将定义简化为:由中⼼原⼦或离⼦与⼏个配体分⼦或离⼦以配位键相结合⽽形成的复杂分⼦或离⼦,统称为配体单元。
含配体单元(⼜称配位个体)的化合物称为配位化合物。
配体单元可以就是配阳离⼦,配阴离⼦与中性配分⼦,配位阳离⼦与阴离⼦统称配离⼦。
配离⼦与与之平衡电荷的抗衡阳离⼦或阴离⼦结合形成配位化合物,⽽中性的配位单元即时配位化合物。
但⽔分⼦做配体的⽔合离⼦也经常不瞧成配离⼦。
配位化合物⼀般分为内界与外界两部分,配体单元为内界,抗衡阳离⼦或阴离⼦为外界,⽽含中性配位单元的配位化合物则⽆外界。
配合物的内界由中⼼与配体构成,中⼼⼜称为配位化合物的形成体,多为⾦属,也可以就是原⼦或离⼦,配体可以就是分⼦、阴离⼦、阳离⼦。
2、配位原⼦与配位数配位原⼦:配体中给出孤对电⼦与中⼼直接形成配位键的原⼦配位数:配位单元中与中⼼直接成键的配位原⼦的个数配位数⼀般为偶数,以4、6居多,奇数较少配位数的多少与中⼼的电荷、半径及配体的电荷、半径有关:⼀般来说,中⼼的电荷⾼、半径⼤有利于形成⾼配位数的配位单元,如氧化数为+1的中⼼易形成2配位,氧化数为+2的中⼼易形成4配位或6配位,氧化数为+3的易形成6配位。
中科院-1-配位化学基础知识

(2)多齿配位体: 有 2个配位原子的配体.
例 : en H2N .. CH2 CH2 NH .. 2
双齿配体
(3)桥联配体 ( bridge ligand ) : 联结 2个中心原子的配体.
如:
OH- , Cl- , O2-, NH2NH2
NH2 Ni NH2 NH2 NH2 Ni
常见配体
如:(OC)3Co(CO)2Co(CO)3
二( – 羰基) • 二(三羰基合钴)(Co-Co)
(2) 中心原子之间仅有金属键连接, 结构对 称,应用倍数词头命名。 [(CO)5Mn-Mn(CO)5] 二(五羰基合锰)(Mn-Mn) 或 十羰基合二锰(Mn-Mn)
OC OC OC Ir OC OC
单 齿 配 体
双 齿 配 体
N ..
(C6H5)3P : 三苯基膦 (ph3(Pph P) 3) 三苯基膦
O:
吡啶(py)
四氢呋喃(THF)
H2NCH .. 2CH2NH .. 2 乙二胺(en)
H3C
N .. N ..
H C C O C OH
CH3
联吡啶(bpy)
乙酰丙酮(acac)
常见配体 三 齿 配 体 六 齿 配 体
[Cu(NH3)4]2+
[Cu(en)2]2+
2. 混配配合物
配合物中含两种以上配体, [MLx By]
例如: [AgBrI]– [Cu(py)2(SCN)2] [Co(NH3)4Cl2]+
3. 多核配合物
含有2个或2个以上中心原子的配合物。
Cl Fe Cl Cl Cl Fe Cl
OH2 H O O H OH2 OH2 Fe OH2 OH2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配位化学基础配位化学是在无机化学基础上发展起来的一门具有很强交叉性的学科,配位化学旧称络合物化学,其研究对象是配合物的合成、结构、性质和应用。
配位化学的研究范围,除最初的简单无机加和物外,已包括含有金属-碳键的有机金属配位化合物,含有金属-金属键的多核蔟状配位化合物即金属簇合物,还包括有机配体与金属形成的大环配位化合物,以及生物体内的金属酶等生物大分子配位化合物。
一、配合物的基本概念1.配合物的定义及构成依据1980年中国化学会无机化学命名原则,配合物可以定义为:由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(统称为配体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称为中心原子),按一定的组成和空间构型所形成的化合物。
结合以上规定,可以将定义简化为:由中心原子或离子和几个配体分子或离子以配位键相结合而形成的复杂分子或离子,统称为配体单元。
含配体单元(又称配位个体)的化合物称为配位化合物。
配体单元可以是配阳离子,配阴离子和中性配分子,配位阳离子和阴离子统称配离子。
配离子与与之平衡电荷的抗衡阳离子或阴离子结合形成配位化合物,而中性的配位单元即时配位化合物。
但水分子做配体的水合离子也经常不看成配离子。
配位化合物一般分为内界和外界两部分,配体单元为内界,抗衡阳离子或阴离子为外界,而含中性配位单元的配位化合物则无外界。
配合物的内界由中心和配体构成,中心又称为配位化合物的形成体,多为金属,也可以是原子或离子,配体可以是分子、阴离子、阳离子。
2.配位原子和配位数配位原子:配体中给出孤对电子与中心直接形成配位键的原子配位数:配位单元中与中心直接成键的配位原子的个数配位数一般为偶数,以4、6居多,奇数较少配位数的多少和中心的电荷、半径及配体的电荷、半径有关:一般来说,中心的电荷高、半径大有利于形成高配位数的配位单元,如氧化数为+1的中心易形成2配位,氧化数为+2的中心易形成4配位或6配位,氧化数为+3的易形成6配位。
配体的半径大,负电荷高,易形成低配位的配位单元。
配位数的大小与温度、配体浓度等因素有关:温度升高,由于热震动的原因,使配位数减少;配体浓度增大,利于形成高配位。
配位数的大小与中心原子价电子层结构有关:价电子层空轨道越多一般配位数较高配位数的大小与配体位阻和刚性有关:配体的位阻一般都会使中心原子的配位数降低,位阻越大、离中心原子越近,配位数的降低程度也就越大。
配体的刚性不利于配体在空间中的取向,长回事中心原子的配位数降低。
3.配体的类型⑴.经典配体与非经典配体经典配体:维尔纳型配合物中的配体即配体原子只能单纯地提供孤对电子与中心原子形成σ配键非经典配体:不同于只提供孤对电子的经典配体,它往往即能给出电子又接受电子,能用π电子或者反馈π键与中心原子配位(包括π配体和π酸配体) π配体:往往以不饱和有机分子上的π电子与中心原子键合π酸配体:配体不仅能给中心原子提供孤对电子形成σ配键,同时还用自身空的π轨道接受中心原子的反馈电子,形成反馈π键⑵.单基配体、多基配体以及螯合物单基配体(即单齿配体):只有一个配位原子的配体多基配体(即多齿配体):含两个或两个以上配位原子的配体螯合物(即内配位化合物):由多基配体形成的环状结构的配位化合物内盐:阴离子多基配体与阳离子中心形成的中性配位单元⑶.金属配体金属配体:将具有孤对电子的配合物作为配体4.配合物类型按成键方式分类: {经典配合物非经典配合物(特殊配合物)非经典配合物:金属羰基配合物、分子氮配合物、烯和炔类配合物、 金属簇状配合物和王冠类化合物 按中心原子个数分类: {单核配合物多核配合物配位聚合物5.配合物的命名⑴首先根据盐类命名习惯,依次命名阴、阳离子,注意区分某酸某和某化某;非离子型的中性分子配合物则作为中性化合物命名⑵内界的命名原则①配体名称列在中心原子之前,两者以“合”字连接,如H[AuCl 4] 四氯合金(II )酸 ②带倍数词头的无机含氧酸阴离子命名时需用括号括起,有机配体要用括号括起来,如[Cu(en)2]SO 4 硫酸二(乙二胺)合铜(II )③配体数目用倍数词头二、三、四等表示,如H[AuCl 4] 四氯合金(II )酸④中心离子的氧化数在其名称后用带括号的罗马数字表示,(负氧化数需带负号,为零时省略)⑶配体命名原则若配体不止一种,不同配体间以中圆点分开①无机配体先于有机配体②无机配体中,先阴离子,其次为中性配体,最后是阳离子配体③同类配体若不止一种,名称按配原子元素符号的英文字母顺序排列④若同类配体配原子相同,则含较少原子数的配体在前,含较多原子数的配体在后⑤同类配体配原子相同,配体中原子数也相同,则在配体的结构式中与配体相连的原子的元素符号的顺序依次排列⑥注意区分配体化学式相同配原子不同的两个配体的命名,如硫氰根(以S配位)和异硫氰根(以N配位)⑦羟基配体与金属相连时,一般表现为阴离子,但在命名时将其称为“基”。
如K[B(C6H5)4] 四笨基合硼(III)酸钾⑷多核配合物的命名①多核配合物中若中心原子间有金属键连接且结构对称,则应该在前面加倍数词头。
如[(CO)5Mn-Mn(CO)5] 二(五羟基合锰)②若结构不对称,则将其中一个元素符号中的英文字母在前的中心原子及相连配体作为另一个中心原子的配体(词尾用“基”)来命名。
如[(C6H5)3AsAuMn(CO)5] 五羟基·[(三笨基胂)金基]合锰③对于配位聚合物,命名前在重复单元的名称前加“聚”,若为链状配位聚合物,则往往在名称前加“链”取代“聚”④桥联配体前加词头“μ-”,π电子配体前加词头“η-”⑤原子簇和物中还应该表明中心原子的几何形状,如三角形,正方形,四面形等⑸几何异构体的命名用“顺-”(或cis-)表示顺式异构体,用“反-”(trans-)表示反式异构体用“面-”(或fac-)表示面式异构体,“经-”(mer-)表示经式异构体当配合物中存在多种配体时,用小写英文字母作为位标表示配体具体的空间位置⑹含不饱和配体配合物的命名对于有机金属配合物,在以π键配位的不饱和配体的名称前加词头η,若配体与中心原子以σ键键合,则在配体前加词头σ二、配合物的合成、分离与晶体培养1.配合物的合成根据配位数和氧化数的变化,可以将合成方法分:加成反应:中心原子的配位数增加,氧化数不变取代反应:中心原子的配位数、氧化数均不变解离反应:中心原子的配位数减小,氧化数不变氧化或还原反应:中心原子的氧化数不变氧化加成反应:中心原子的氧化数和配位数均不变按实验方法分类:直接法:通过配体与中心原子直接进行配位反应,包括溶液中的直接配位反应、金属蒸汽法、基底分离法等组分交换合成法:包括金属交换反应和配体取代反应氧化还原反应:包含电化学合成法水热、溶剂热法微波辐射合成法热分解合成法分层扩散法固相反应法模板法2.配合物的分离⑴对于经典配合物(通常具有盐的性质,易溶于水,常采用结晶的方法)①蒸发浓缩除去溶剂:用冰盐冷却较浓的反应混合物使产品析出。
加入所需化合物的晶种,并在液面下摩擦器壁常有利于晶体析出注意:当配体是挥发性的(如NH3),或对热不稳定(如多聚磷酸盐),或只能增大溶液的浓度而不结晶时,则不宜采用浓缩的方法②缓慢加入能与溶剂互相混溶但又不能溶解所需配合物的溶剂,使产品析出例如:【Cu(NH3)4】SO4,在水中溶解度大不易析出,若在其溶液中加入乙醇(在乙醇中的溶解度小)则结晶析出③利用同离子效应使产品析出④加入沉淀剂⑵对于非经典配合物(通常是共价性化合物,一般溶于非极性溶剂,具有较低的沸点和熔点)也可以用上列方法,但更常用蒸馏、升华和色层分离的方法注意:若配合物在水中溶解度不大,可采用在沸水中进行重结晶。
也可以选用适当有机溶剂,在有机相中重结晶3.配合物制备的注意事项⑴、溶剂选择:依次顺序[1]水;[2]乙醇;[3]甲醇;[4]水-乙醇[5]水-甲醇;[6]乙腈;[7]DMF(N,N-二甲基甲酰胺)或DMSO(二甲亚砜);[8]或其他混合溶剂;[9]四氢呋喃水或醇的用量合计20mL左右,可以适当增加,取决于溶解性DMF的用量要小,一般合计10mL,配体和金属盐各用5mL溶解DMF可直接用于配合物的合成,也可在后续用于重结晶⑵操作①混合操作:容器采用50或100mL烧杯或100mL圆底烧瓶方法一:金属盐与配体分别溶解于溶剂后混和;方法二:第一配体与第二配体溶于有机溶剂,然后滴入金属盐的水溶液,混和方法三:第一配体和金属盐溶于水或醇/水混和溶剂,调节pH,然后滴入第二配体的醇溶液②酸碱度控制:采用广泛和精密pH试纸测量混和溶液pH值,然后根据需要搅拌下调节pH6-7(过渡金属)或5.5-6.5(稀土金属)③温度控制:加热设备采用加热磁力搅拌器或恒温磁力电热套方法一:常温下以烧杯做容器,平板磁力搅拌器或不加热的电热套方法二:60-70℃恒温水浴控制,圆底烧为容器置于500mL烧杯中水浴加热2-3h;或置于恒温槽中加热保温3h或更长时间方法三:回流控温⑶影响配合物生成因素内因:中心原子(离子)和配体的性质以及他们之间的成键情况外因:溶液的酸碱度、浓度、温度,共存离子的影响等4.晶体的培养测定晶体结构的关键问题是培养出合格的单晶,合格的单晶体(晶粒)粒径≈0.3mm三个方向基本匀称表面光滑,无棱片状或细绒毛状内因:分子间色散力、偶极性及氢键外因:溶剂极性|挥发或扩散速度、温度⑴晶体生长的共同条件:①结晶物质要纯净②过饱和浓度要低要培养晶体,基本条件:溶液要达到过饱和(但若过饱合度太大,一次形成的晶核多,晶体颗粒小)晶粒长大的三种方法:①小晶粒做晶种,放在刚达到饱和的溶液中,通过自然挥发等方法慢慢除去溶剂,增加过饱合度,使小晶粒长大。
②长时间放置,使相对较小的晶粒因界面能大而溶解度较大,逐渐溶解;相对较大的晶粒过饱和度大,溶质逐渐地结晶沉积到这些较大的晶粒上。
③利用蒸气扩散法,缓慢地改变溶液的组成,增加过饱和度,向结晶过程发展。
③溶液的组成和温度合适:溶液的组成合适:溶质一定,溶剂需要选择。
选择合适的溶剂,考虑两方面因素:溶解度和溶剂不同对晶体外形生长的影响温度合适:温度影响溶液的溶解度,也就是说影响溶液的组成(影响溶液的相图),有些晶体在夏天易生长,有些晶体在冬天易生长⑵培养单晶的方法:方法一:对于溶液体系,直接置于小烧杯中,用保鲜膜包裹并扎数十个孔或用纸包裹,室温静置。
方法二:对于有少量沉淀的体系,冷却至室温后,过滤,滤液置于小烧杯中,用保鲜膜包裹并扎数十个孔或用纸包裹,室温静置。
方法三:对于有大量沉淀物的体系,冷却,过滤,滤液置于小烧杯中,用保鲜膜包裹并扎数十个孔或用纸包裹,室温静置。
此处沉淀需要再用水、乙醇分别洗涤(注意:不要将洗涤后的溶液与前面的溶液混和),然后真空干燥备用。
