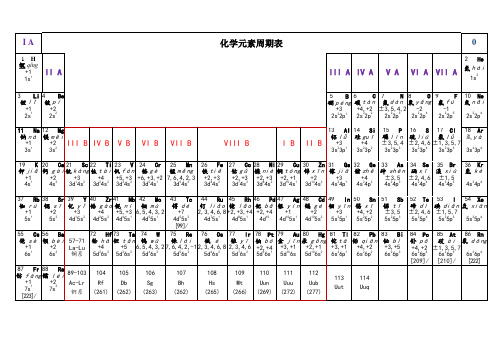
1~112号元素电子排布图及电负性
1-36核外电子排布式

[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1 [4]Be铍1s2 2s2 [5]B硼1s2 2s2 2p1 [6]C碳1s2 2s2 2p2 [7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5 [10]Ne氖1s2 2s2 2p6 [11]Na钠1s2 2s2 2p6 3s1 [12]Mg镁1s2 2s2 2p6 3s2 [13]Al铝1s2 2s2 2p6 3s2 3p1 [14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3 [16]S硫1s2 2s2 2p6 3s2 3p4 [17]Cl氯1s2 2s2 2p6 3s2 3p5 [18]Ar氩1s2 2s2 2p6 3s2 3p6 [19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s21s2 2s2 2p6 3s2 3p6 3d2 4s2 [23]V 钒1s2 2s2 2p6 3s2 3p6 3d3 4s2 *[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s21s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 [34]Se硒1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 [35]Br溴1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5[36]Kr氪1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。
价电子排布式(原子序数顺序)
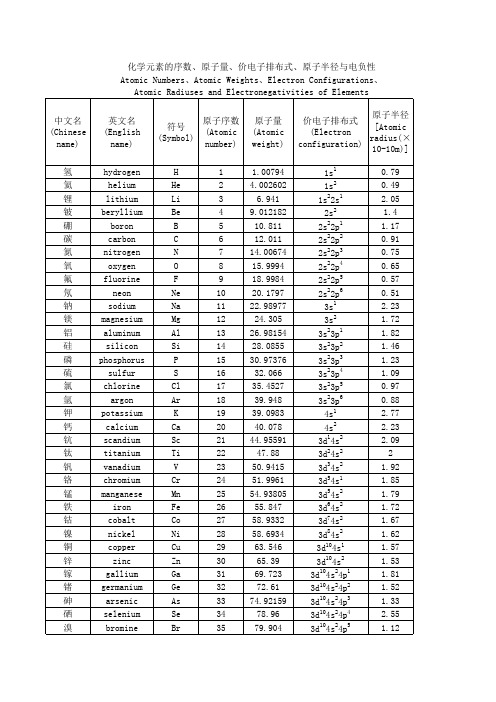
3d104s24p6 5s1 5s2 1 2 4d 5s 2 2 4d 5s 4d45s1 4d55s1 4d55s2 4d75s1 4d85s1 10 4d 4d105s1 4d105s2 4d105s25p1 4d105s25p2 4d105s25p3 4d105s25p4 4d105s25p5 2 6 5s 5p 6s1 6s2 1 2 5d 6s 4f15d16s2 4f36s2 4 2 4f 6s 4f56s2 4f66s2 7 2 4f 6s 4f75d16s2 4f96s2 10 2 4f 5s 4f116s2 12 2 4f 6s 13 2 4f 6s 4f146s2 4f145d16s2 4f145d26s2 4f145d36s2 4 2 5d 6s 14 5 2 5f 5d 6s 4f145d66s2 14 7 2 4f 5d 6s 14 9 1 4f 5d 6s
氪 铷 锶 钇 锆 铌 钼 锝 钌 铑 钯 银 镉 铟 锡 锑 碲 碘 氙 铯 钡 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 铪 钽 钨 铼 锇 铱 铂
krypton rubidium strontium yttrium zirconium niobium molybdenum technetium ruthenium rhodium palladium silver cadmium indium tin antimony tellurium iodine xenon cesium barium lanthanum cerium praseodymium neodymium promethium samarium europium gadolinium terbium dysprosium holmium erbium thulium ytterbium lutetium hafnium tantalum tungsten rhenium osmium iridium platinum
原子的电子组态与元素周期表

能级组与周期的关系、族与原子的电子组态、元素在周期表中的分区、镧系元素、锕系元素、过渡元素、内过渡元素、有效核电荷、原子半径、元素电负性、电离能、电子亲和能、电负性、s区元素,p区元素,d区元素,ds区元素世界上有多少元素,自从门捷列夫发明元素周期表,人们发现新元素的步伐加快。
现在的元素周期表元素的数量已经排到了118号。
其中中国人修订了周期表中的十个元素(1991年以来十年)。
这些元素按原子量从小到大排列,呈现明显的周期性的规律。
元素性质决定于原子的内部结构,周期系中元素性质呈周期性的变化规律,就是原子结构周期性变化的体现。
元素周期表有7行,即7个周期。
从各元素原子的电子层结构可知,当主量子数n依次增加时,n每增加1个数值就增加一个新的电子层,周期表上就增加一个周期。
因此,元素在周期表中所处的周期数(用阿拉伯数字表示)就等于它的最外电子层数n。
而每一个周期所含原子数目与对应能级组最多能容纳的电子数目一致。
能级组和周期性的关系可参见表9-4。
在第4周期中,从21号钪(S c)到30号锌(Z n),它们新增的电子都是填充到3d轨道上,这10种元素称为第4周期过渡元素。
从39号元素钇(Y)到48号元素镉(Cd),新增的电子都是填充到4d轨道上,这10种元素称为第5周期过渡元素。
在第6周期中,从57号元素镧(La)到70号元素镱(Yb),新增的电子都是依次填充在4f轨道上,这14种元素习惯上称为镧系元素。
从71号元素镥(Lu)到80号元素汞(Hg),新增加的电子则依次填充到5 d轨道上,这也是过渡元素。
第7周期,从87号元素钫(Fr)到112号元素(未有中文名)U ub,共25种元素是不完全周期,可以预计这一周期也应有32种元素,其中从89号元素锕(Ac)到102号元素锘(No),称为锕系元素。
化学元素周期表详解

起源简介现代化学的元素周期律是1869年的德米特里·伊万诺维奇·门捷列夫首创的。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序数越大,X射线的频率就越高,因此他认为原子核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序数)排列,经过多年修订后才成为当代的周期表。
常见的元素周期表为长式元素周期表。
在长式元素周期表中,元素是以元素的原子序数排列,最小的排行最先。
表中一横行称为一个周期,一纵列称为一个族,最后有两个系。
除长式元素周期表外,常见的还有短式元素周期表,螺旋元素周期表,三角元素周期表等。
道尔顿提出科学原子论后,随着各种元素的相对原子质量的数据日益精确和原子价(化合价)概念的提出,就使元素相对原子质量与性质(包括化合价)之间的联系显露出来。
德国化学家德贝莱纳就提出了“三元素组”观点。
他把当时已知的54种元素中的15种,分成5组,每组的三种元素性质相似,而且中间元素的相对原子质量等于较轻和较重的两个元素相对原子质量之和的一半。
例如钙、锶、钡,性质相似,锶的相对原子质量大约是钙和钡的相对原子质量之和的一半。
法国矿物学家尚古多提出了一个“螺旋图”的分类方法。
他将已知的62种元素按相对原子质量的大小顺序,标记在绕着圆柱体上升的螺旋线上,这样某些性质相近的元素恰好出现在同一母线上。
这种排列方法很有趣,但要达到井然有序的程度还有困难。
另外尚古多的文字也比较暧昧,不易理解,虽然是煞费苦心的大作,但长期未能让人理解。
英国化学家纽兰兹把当时已知的元素按相对原子质量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一一个元素的性质相近。
这很像音乐上的八度音循环,因此,他干脆把元素的这种周期性叫做“八音律”,并据此画出了标示元素关系的“八音律”表。
显然,纽兰兹已经下意识地摸到了“真理女神"的裙角,差点就揭示元素周期律了。
不过,条件限制了他做进一步的探索,因为当时相对原子质量的测定值有错误,而且他也没有考虑到还有尚未发现的元素,只是机械地按当时的相对原子质量大小将元素排列起来,所以他没能揭示出元素之间的内在规律。
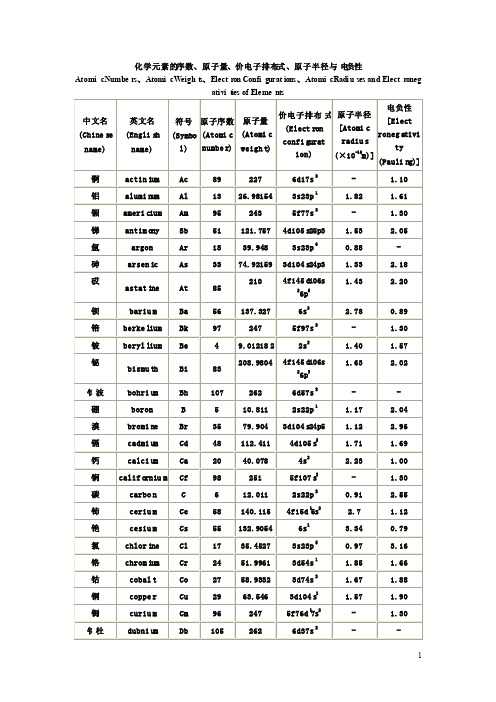
化学元素的序数、原子量、价电子排布式、原子半径与电负性
2
1.22 1.30 1.24 1.20 1.30 3.98 0.70 1.20 1.81 2.01 2.54 1.30
1.23 2.20 1.78 2.66 2.20 1.83 1.10 2.33
0.98 1.27 1.31 1.55
1.30 2.00 2.16 1.14
中 文名 (Chine se
name)
英 文名 (Engli sh
name)
符号 原子序数 (Symbo (Atomi c
l) numbe r)
原 子量 (Atomi c weigh t)
电 负性
价电子排布 式 原子半径
[Elect
(Elect ron [Atomi c
roneg ativi
氯
chlor ine Cl
17 35.4527
3s23p 5
0.97
铬
chrom ium Cr
24 51.9961
3d54s 1
1.85
钴
cobal t
Co
27 58.9332
3d74s 2
1.67
铜
coppe r
Cu
29
63.546
3d104 s1
1.57
锔
curiu m
Cm
96
confi gurat radiu s
ty
ion)
(×10-10m)]
(Pauli ng)]
锕
actin ium Ac
89
227
6d17s 2
铝
alumi num Al
13 26.98154
核外电子排布与元素周期表

P S 110 104
K 227
Rb 248 Cs 265
Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As 197 161 145 132 125 124 124 125 125 128 133 122 122 121
Se 117
Br 114Байду номын сангаас
Kr 198
Xe 217
Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I 215 181 160 143 136 136 133 135 138 144 149 163 141 141 137 133 Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po 217 188 159 143 137 137 134 136 136 144 160 170 175 155 153
Au
Hg Tl
[Xe]4f145d106s1
[Xe]4f145d106s2 [Xe]4f145d106s26p1
82
83 84
Pb
Bi Po
[Xe]4f145d106s26p2
[Xe]4f145d106s26p3 [Xe]4f145d106s26p4
85
86
At
Rn
[Xe]4f145d106s26p5
(四)
31
32 33 34 35 36
Ga
Ce As Se Br Kr
[Ar]3d104s24p1
[Ar]3d104s24p2 [Ar]3d104s24p3 [Ar]3d104s24p4 [Ar]3dl04s24p5 [Ar]3d104s24p6
37 38 39 40
化学元素周期表112个速记高中必备

化学元素周期表速读速记(本图可放大)中文谐音第一周期:氢H 氦He ---- 侵害第二周期:锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne ---- 鲤皮捧碳蛋养福奶第三周期:钠Na 镁Mg 铝Al 硅Si 磷S 硫P 氯Cl 氩Ar ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾K 钙Ca 钪钛钒铬锰---- 嫁改康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老把银哥印西堤碲碘氙---- 地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬(天)第七周期:钫镭锕---- 很简单了~就是---- 防雷啊!汉语拼音第一周期元素:1 氢(qīng) 2 氦(hài) 元素周期表正确金属汉字写法第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳tàn(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(nǎi)第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà)第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè) 29 铜(tóng) 30 锌(xīn)31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè)第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44 钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān)第六周期元素:55 铯(sè) 56 钡(bèi) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒng) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng)第七周期元素:87 钫(fāng) 88 镭(léi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yóu) 93 镎(ná) 94 钚(bù) 95 镅(méi) 96 锔(jú) 97 锫(péi) 98 锎(kāi) 99 锿(āi) 100 镄(fèi) 101 钔(mén) 102 锘(nuò) 103 铹(láo) 104 鑪(lú) 105 ??(dù) 106 ??(xǐ) 107 ??(bō) 108 ??(hēi) 109 ?(mài) 110 钽(dá) 111 錀(lún) 112 (仍未有中文名)元素周期表表格说明周期表的编排显示出不同元素的化学性质的周期性,在周期表中,元素按原子序(即原子核内的质子数目递增次序排列,并分为若干列和栏,在同一行中的称为同一周期,根据量子力学,周期对应着元素原子的电子排布,显示出该原子的已装填电子层数目。
高中化学电子排布、第一电离能和电负性知识归纳

高中化学电子排布、第一电离能和电负性知识归纳一、原子结构1. 原子的组成: 原子核、核外电子2. 原子的特点:原子不显电性,体积小,质量小,质量主要集中在原子核上,原子核的密度非常大3. 核外电子排布规律(1 )能量最低原理(2 )每一层最多容纳电子数:2n 2 个(3 )最外层电子数不超过8 个(K 层为最外层时不超过2 个)(4 )次外层电子数不超过18 个,倒数第三层不超过32 个二、能层与能级能量最低原理: 原子的电子排布遵循能使整个原子的能量处于最低状态基态原子: 处于最低能量的原子1. 能层: 核外电子的能量是不同的, 按电子能量差异,可以将核外电子分成不同的能层——电子层同一能层的电子,能量也可能不同,还可以分成不同能级能级数2. 能级:s 、p 、d 、f····以s 、p 、d 、f···· 排序的各能级可容纳的最多电子数依次为1 、3 、5 、7 、······ 的二倍。
能级数= 能层序数(n)三、构造原理1. 电子排布式Na :1s 2 2s 2 2p 6 3s 1试书写N 、Cl 、K 、26 Fe 原子的核外电子排布式注意:24 Cr :1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 129 Cu :1s 2 2s 2 2p 6 3s 2 3p 26 3d 10 4s 1离子电子排布式书写——先失去最外层电子与能量最低原则无关1) 、能量最低原理2 )、每个原子轨道上最多能容纳__2__ 个电子,且自旋方向__ 相反____ (泡利不相容原理)3 )、当电子排布在同一能级时,总是__ 首先单独占一个轨道__ ,而且自旋方向_ 相同__。
(洪特规则)4) 、补充规则:全充满(p 6 ,d 10 ,f 14 )和半充满(p 3 ,d 5 ,f 7 )更稳定2. 简化电子排布式15P:[Ne]3s 2 3p 3 (表示内层电子与Ne 相同。
3 原子结构第四次课
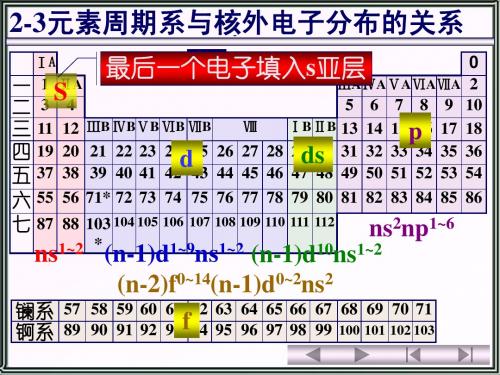
元素在周期表的位置(周期、区、族) 取决于该元素原子核外电子的分布 例 20 Ca 6元素周期表 5-3写出电子排布式 1s22s22p63s23p64s2 周期数=电子层数 第四周期 最后一个电子填入s亚层 s区元素 族数=最外层电子数=2 ⅡA Ca 为第四周期、ⅡA族元素
元素在周期表的位置(周期、区、族) 取决于该元素原子核外电子的分布 例 24Cr
*
0 ⅢA ⅣA ⅤA ⅥA ⅦA 2 5 6 7 8 9 10 ⅠB ⅡB 13 14 15 16 17 18 28 29 30 31 32 33 34 35 36 46 47 48 49 50 51 52 53 54 78 79 80 81 82 83 84 85 86
镧系 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 锕系 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103
区
0 ⅢA ⅣA ⅤA ⅥA ⅦA 2 5 6 7 8 9 10 ⅠB ⅡB 13 14 15 16 17 18 p 28 29 30 31 32 33 34 35 36 ds 46 47 48 49 50 51 52 53 54 78 79 80 81 82 83 84 85 86
*
(n-1)d1~9ns1~2
ⅠA
六 七 87 88 103 104 105 106 107 108 109 110 111 112
*
(n-1)d10ns1~2
镧系 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 锕系 89 90 91 92 93f94 95 96 97 98 99 100 101 102 103
元素的电负性及其变化规律
减 小
的 趋 电负性最小 势
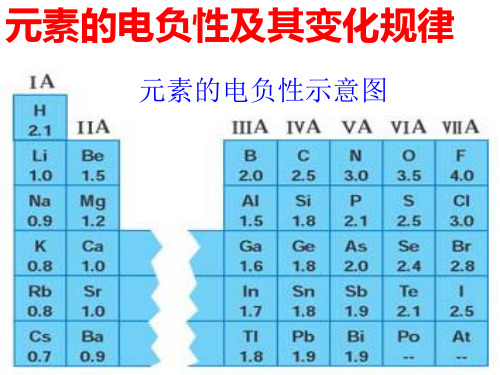
2、电负性的递变规律: 同一周期从左到右,主族元素电负性逐 渐 增 大,表明其吸引电子的能力逐 渐 增 大。同一主族从上到下,元素电负性 呈现 减 小 趋势,表明其吸引电子的能力 逐渐 减 小 。
3、电负性的意义
反映了原子间的成键能力和成键 类型。 一般认为,电负性 大于 1.8的元 素为非金属元素,电负性 小于 1.8的 元素为金属元素。
规律与总结
一般认为,如果两个成键元素间 的电负性差值大于1.7,他们之间通常 形成 离 子 键;如果两个成键元素间 的电负性差值小于1.7,他们之间通常 形成 共 价 键。
概念应用
请查阅下列化合物中元素的电负 性值,判断他们哪些是离子化合物, 哪些是共价化合物
NaF HCl NO MgO KCl CH4
巩固练习
7、A、B、C、D四种元素,已知A元素是自然界中 含量最多的元素;B元素为金属元素,已知它的 原子核外K、L层上电子数之和等于M、N层电子数 之和;C元素是第3周期第一电离能最小的元素, D元素在第3周期中电负性最大。 (1)试推断A、B、C、D四种元素的名称和符号。 O Ca Na Cl (2)写出上述元素两两化合生成的离子化合物的 化学式。
CaO
Na2O
Na2O2 CaCl2
NaCl
元素的电负性及其变化规律
元素的电负性示意图
1、电负性的概念:
1932年鲍林引入电负性的概念,用来 表示当两个不同原子在形成化学键时 吸引电子能力的相对强弱。
电负性是元素的原子在化合物中 的 吸引电子能力的标度。元素的电负 性越大,表示其原子在化合物中吸引 电子的能力越强。
电负性逐渐 增 大 。 电负性最大 电 负 性 有
周期律周期表(竞赛辅导用)

5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe
铷锶 钇 锆铌 钼 锝 钌 铑钯银 镉 铟 锡 锑 碲 碘 氙
变化规律: 主族元素:从左到右 r 减小;
从上到下 r 增大。 过渡元素:从左到右r 缓慢减小;
从上到下r略有增大。
2、 电离能
基态气体原子失去电子成为带一 个正电荷的气态正离子所需要的能量 称为第一电离能,用 I 1表示。
由+1价气态正离子失去电子成为 带+2价气态正离子所需要的能量称为 第二电离能,用 I 2表示。
1
1
主族:族数=ns+np电子数。 例:16号S:最外层结构为3s23p4 ⅥA
17号Cl:最外层结构为3s23p5 ⅦA 副族:ⅢB---ⅦB 族数=(n-1)d+ns电子数。 例:25号Mn: 1s22s22p63s23p63d5 4s2 ⅦB ⅠB、ⅡB族:族数=(n-1)d10后ns的电子数 例:29号Cu: 1s22s22p63s23p63d10 4s1 ⅠB
超铀元素:在锕系元素中92号元素铀U以后各种元素, 多数是人工制得的元素,称之为“超铀元素”
区: 长式周期表的主表从左到右可分
为s区,d区,ds区,p区4个区,有 的教科书把ds区归入d区;副表(镧 系和锕系)是f区元素。
s
p
d
ds
f
周期表中区的划分: 最后一个电子填充在什么类型的轨
道上,就是该元素所在的区。 ⅠA、ⅡA:s区; ⅢA---ⅦA:p区; ⅢB---Ⅶ B 、Ⅷ:d区; ⅠB、ⅡB:ds区; 镧系、锕系(超长周期):f区。
化学元素周期表112个速记(注音、谐音口诀法)高中必备

化学元素周期表速读速记(本图可放大)中文谐音第一周期:氢H 氦He ---- 侵害第二周期:锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne ---- 鲤皮捧碳蛋养福奶第三周期:钠Na 镁Mg 铝Al 硅Si 磷S 硫P 氯Cl 氩Ar ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾K 钙Ca 钪钛钒铬锰---- 嫁改康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老把银哥印西堤碲碘氙---- 地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬(天)第七周期:钫镭锕---- 很简单了~就是---- 防雷啊!汉语拼音第一周期元素:1 氢(qīng) 2 氦(hài) 元素周期表正确金属汉字写法第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳tàn(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(nǎi)第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà)第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè)29 铜(tóng) 30 锌(xīn) 31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè)第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44 钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān)第六周期元素:55 铯(sè) 56 钡(bèi) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒng) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng)第七周期元素:87 钫(fāng) 88 镭(léi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yóu) 93 镎(ná) 94 钚(bù) 95 镅(méi) 96 锔(jú) 97 锫(péi) 98 锎(kāi) 99 锿(āi) 100 镄(fèi) 101 钔(mén) 102 锘(nuò) 103 铹(láo) 104 鑪(lú) 105 (dù) 106 (xǐ) 107 (bō) 108 (hēi) 109 䥑(mài) 110 鐽(dá) 111 錀(lún) 112 (仍未有中文名)元素周期表表格说明周期表的编排显示出不同元素的化学性质的周期性,在周期表中,元素按原子序(即原子核内的质子数目递增次序排列,并分为若干列和栏,在同一行中的称为同一周期,根据量子力学,周期对应着元素原子的电子排布,显示出该原子的已装填电子层数目。
课件 元素的电负性及其变化规律

电负性
同周期(从左→右) 从1递增到7(第一周期除外)
逐渐减弱 逐渐增强 最高正价从+1→+7(O、F除外), 非金属元素最低负价=-(8-族序 数)(H等除外) 逐渐减小
逐渐增强
同主族(从上→下) 相同
逐渐增强 逐渐减弱 最高正价=族序数(O、F除外) ,非金属元素最低负价=-(8- 族序数)(H等除外) 逐渐增大
第2课时 元素的电负性及其变化规律
学习目标 1.认识元素的电负性的周期性变化。 2.知道原子核外电子排布呈现周期性变化 是导致电负性周期性变化的原因。 3.了解元素周期律的应用价值。
核心素养培养 证据推理与模型认知
宏观辨识与微观探析
知识体系
阅读学习
阅读课本第24~26页,了解元素的电负性的概念,电负性的标准和意义,元素 电负性变化规律,电负性的应用。
本节内容结束
知识梳理
二、元素周期律的实质
1.实质:元素性质的周期性变化取决于元素原子核外电子排布的周期性变化。 2.具体表现
(2)主族元素是金属元素还是非金属元素取决于原子中价电子的多少。
3.元素周期律 ⑴同周期、同主族元素的结构与性质递变规律
最外层电子数 金属性 非金属性
主要化合价
原子半径 气态氢化物的稳定性 最高价氧化物对应水
2.电负性的变化规律 (1)对主族元素,同一周期从左到右,电子层数相同,核电荷数逐渐增大,原子半径逐 渐减小,原子核对外层电子的吸引力逐渐增强,元素电负性逐渐增大。
(2)同一主族从上到下,核电荷数逐渐增大,随电子层数的增多,原子半径逐渐增大, 原子核对外层电子的吸引力逐渐减弱,元素的电负性逐渐减小。
逐渐减弱
碱性逐渐减弱,酸性逐渐增强 碱性逐渐增强,酸性逐渐减弱
电离能与电负性PPT课件

ⅠA
0
ⅡA
ⅢA …ⅦA
ⅢB…ⅦB Ⅷ ⅠB ⅡB
s区
d区
ds区
p区
ns1 ns2 (n-1)d1-8ns2
镧 (有例外) 锕
(n-1)d10 ns1-2
ns2np1-6
f 区镧系、锕系 (n-2)f1-14ns2(有例外)
第28页/共85页
3.按电子排布,可把周期表里的元素 划分为5个区,(除ds区外区的名称来 自按构造原理最后填入电子的能级符 号)仔细观察周期表,你能划分开吗? 这些区分别有几个纵列?
第29页/共85页
为什么s区、d 区和ds区都是金属?
第30页/共85页
3.原子的电子构型和元素的分区
S 区元素:最外层构型是ns1和ns2。IA和 IIA族元 素。除H外,其余为活泼金属。
p区元素:最外层电子构型从ns2np1~ns2np6 的元素。即IIIA~VIIA族、零族元素。除H 外,所有非金属元素都在p区。
第26页/共85页
原子的电子构型和元素的分区
d区元素:包含第IIIB族到VIII族元素。 最外层电子数皆为1~2个,均为金属元素, 性质相似。
ds区元素:包括IB族和IIB族元素,最外 层电子数皆为1~2个,均为金属元素。
f区元素:包括镧系和锕系元素。最外 层电子数基本相同,化学性质相似。
第27页/共85页
科学探究1 (p 15)
(1)元素周期表共有几个周期? (2)每个周期各有多少种元素? (3)写出每个周期开头第一个元素和结 尾元素的最外层电子的排布式的通式。 (4)为什么第一周期结尾元素的电子排
布跟其他周期不同?
第9页/共85页
1.原子的电子排布与周期的划分
元素性质的递变规律

f区元素
最后1个电子填充在f轨道上,价电子构 型是:(n-2)f 0~14ns2,或(n – 2)f 0~14 (n-1)d 0~2ns2,它包括镧系和锕系元素 (各有14种元素)。
小结
各区元素特点
包括元素 价电子排布 化学性质 s区 ⅠA、ⅡA族 ns1、ns2 活泼金属 ns2np1~6 p区 ⅢA~ⅦA族 大多为非金属 d区 ⅢB~Ⅷ族 (n-1)d1~9ns1~2 过渡元素 ds区 ⅠB、ⅡB族 (n-1)d10ns1~2 过渡元素 ( f区 镧系和锕系 n-2)f 0~14ns2
2、已知钠元素的I1=496KJ/mol。则Na(g) -e-→Na+(g)时所需的最小能量为 496KJ
元素第一电离能大小与原子失电 子能力有何关系?
第一电离能越小,原子越 容易 失去 电子,金属性越 强 ;第一电离能越大, 难 原子越 失去电子,金属性越 弱 。
探 究 学 习
课堂练习
1、下列叙述中正确的是 (C ) A、同周期元素中,VIIA 族元素的原子半 径最大 B、VIA族元素的原子,其半径越大,越容 易得到电子 C、室温时,零族元素的单质都是气体 D、同一周期中,碱金属元素的第一电离能 最大
Li>Na> K N>C>Be>B
He>Ne>Ar
P>S>Al>Na
课堂练习
根据第一电离能的定义, 你能说出什么是第二电离能、 第三电离能......吗?讨论后 回答
气态电中性基态原子失去一个电子转化 为气态基态正离子所需要的最低能量叫做第 一电离能(用I1表示),从一价气态基态正离 子中再失去一个电子所需消耗的最低能量叫 做第二电离能(用I2表示),依次类推,可得 到I3、I4、I5…… 同一种元素的逐级电离能的大小关系
带读音、化合价、电负性的化学元素周期表
4s1
20 Ca
钙gài
+2
4s2
21 Sc
钪kàng
+3
3d14s2
22 Ti
钛tài
+4
3d24s2
23 V
钒fán
+5,+3
3d34s2
24 Cr
铬gè
+6,+3,+2
3d54s1
25 Mn
锰měng
7,6,4,2,3
3d54s2
26 Fe
铁tiě
+2,+3
3d64s2
27 Co
钴gǔ
+2,+3
3d74s2
28 Ni
镍niè
+2,+3
3d84s2
29 Cu
铜tóng
+2,+1
3d104s1
30 Zn
锌xīn
+2
3d104s2
31 Ga
镓jiā
+3
4s24p1
32 Ge
锗zhě
+4
4s24p2
33 As
砷shēn
±3,5
4s24p3
34 Se
硒xī
±2,4,6
4s24p4
35 Br
溴xiù
±1,5
3s23p5
18Ar
氩yà
3s23p6
19K
钾jiǎ
+1
4s1
20Ca
钙gài
+2
4s2
21Sc
钪kàng
+3
3d14s2
22Ti
最全元素周期表

P 16 S 磷 liu 硫 3s23p4 6,4,2,-2 2.58 32.06 As 34 砷 xi 4s24p4 6,4,-2 2.55 78.96
17 Cl lv 氯 3s23p5 7,5,3,1,-1 3.16 34.45
18 Ar ya 氩 3s23p6 3.24 39.95 36 Kr ke 氪 4s24p6 2 3.00 83.80
镧系
锕系
59 Pr pu 镨 4f36s2 4,3 1.13 140.9 91 Th Pa 钍 pu 镤 5f26d17s2 5,4 1.54 231.0
Nd 61 钕 po 4f56s2 3 1.13 146.9 93 na 5f46d17s2 6,5,4,3 1.36 237.0
Eu 铕
92 U you 铀 5f36d17s2 6,5,4,3 1.38 238.0
IA 1
1 H qing 氢 1s1 1,-1 2.20 1.008
元素周期表
s区 IIA 元 2 素 d区 元 素 III B 3 IVB 4
22 tai 3d24s2 4,3 1.54 47.87 40 gao 4d25s2 4 1.33 91.22 72 ha 5d26s2 4 1.32 178.5 所有已知生 物物种的必 须元素
原子序数 元素读音 外层电子排 列 化合物中的 氧化态:重 要,最重要 电负性
3 Li 4 Be li 锂 pi 铍 2s1 2s2 1 2 0.98 1.57 6.941 9.012 11 Na 12 Mg na 钠 mei 镁 3s1 3s2 1 2 0.93 1.31 22.99 24.31
至少是一种 生物物种的 必须元素
84 Po 元素符号 po 钋 中文书写 6s26p4 6,4,2 相对原子质量 (原子量),对放 射性元素,给出 1.99 的是最重要同位 209.0* 素的核素质量 放射性元素
